Revisar los principales hallazgos radiológicos de la anisakiasis en las diferentes pruebas de imagen que se pueden utilizar en su diagnóstico, basándonos en estudios realizados en nuestro centro.
ConclusiónLa contaminación alimentaria por Anisakis muestra una tendencia creciente en países occidentales. Habitualmente se presenta como un cuadro de patología abdominal aguda, sin datos clínicos o analíticos característicos. Una anamnesis cuidadosa es clave para descubrir el antecedente de exposición, pero se ve dificultada al ser un proceso poco conocido o sospechado y con un periodo de latencia variable. Al tratarse de cuadros poco específicos, a estos pacientes con frecuencia se les realizan pruebas radiológicas para descartar otros procesos. Por ello, es recomendable familiarizarse con los posibles hallazgos en imagen que permitan incluir la anisakiasis en el diagnóstico diferencial, lo que podría guiar al clínico hacia una anamnesis dirigida y pruebas específicas.
To review the main findings for anisakiasis in the different imaging tests that can be used to diagnose it, based on studies done at our center.
ConclusionThe presence of Anisakis species in food consumed in Western countries is becoming more common. Patients with anisakiasis present with acute abdomen; there are no specific clinical signs or laboratory findings. Careful history taking is key to discovering exposure to Anisakis-contaminated food, but this task is hindered by unfamiliarity with the condition and lack of suspicion and is also confounded by the variable latency period after ingestion of Anisakis-contaminated food. Give the nonspecific presentation, patients with anisakiasis often undergo imaging tests to rule out other processes. Thus, radiologists need to be familiar with the spectrum of imaging findings that should lead to the inclusion of anisakiasis in the differential diagnosis, so they can guide clinicians toward directed history taking and specific tests.
La anisakiasis es una enfermedad parasitaria del tracto gastrointestinal, habitualmente asociada a la ingesta de pescado o marisco crudo o poco cocinado que contiene larvas vivas1. Fue descrita por primera vez en Holanda en 1960 por van Thiel et al.2. Anualmente se diagnostica una media de 20.000 casos, con una elevada incidencia en países asiáticos (aproximadamente el 90% en Japón), posiblemente asociada a los hábitos dietéticos; sin embargo, existe una tendencia ascendente en Europa y los Estados Unidos3–5. Teniendo en cuenta su sintomatología inespecífica y la escasa sospecha habitual, probablemente la incidencia real sea mayor1.
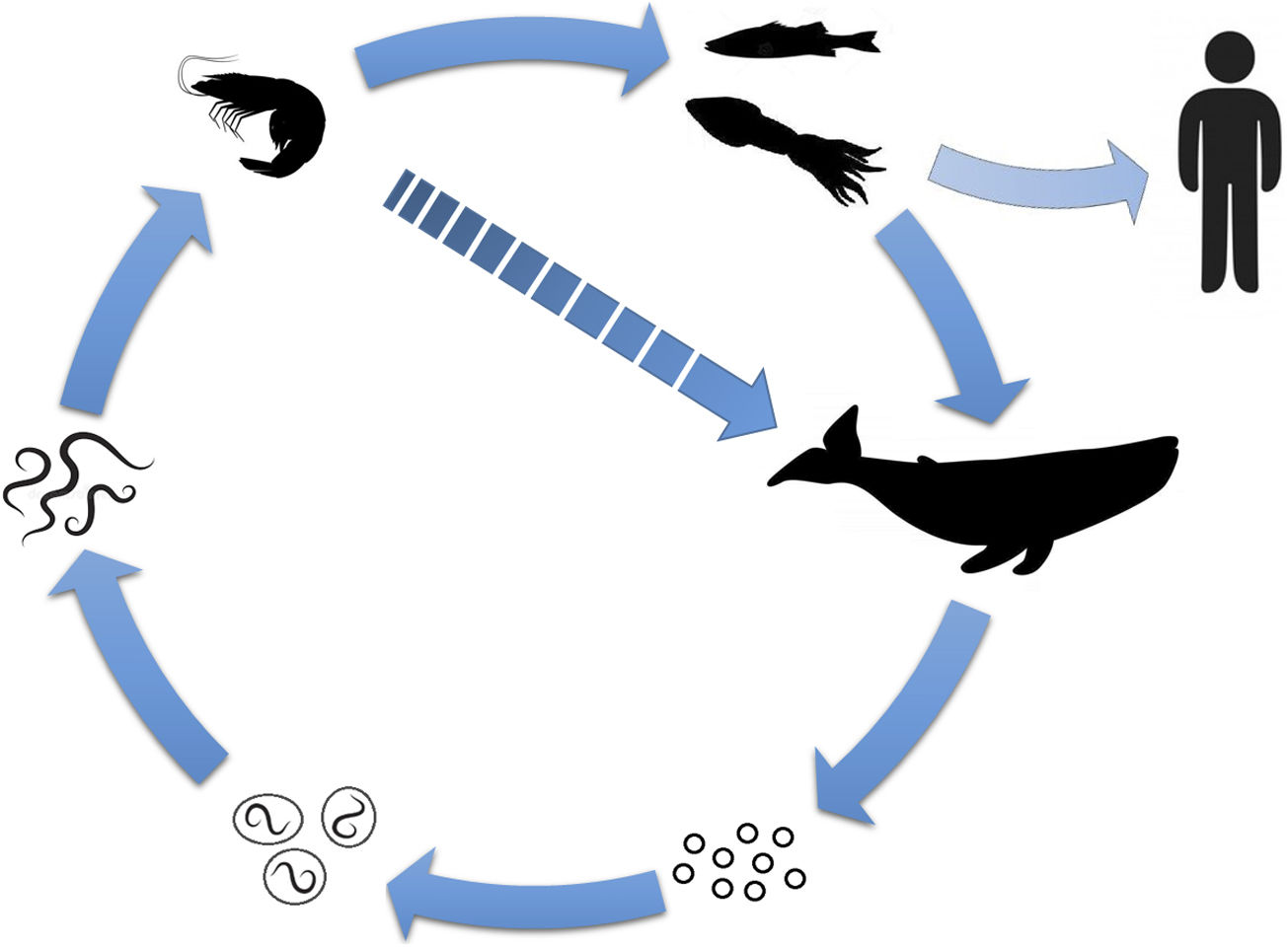
La causa es la ingesta de larvas de nematodos de la familia Anisakidae (habitualmente Anisakis simplex, con menor frecuencia Pseudoterranova decipiens o Anisakis pegreffi)4,5. Algunos peces, cefalópodos y pequeños crustáceos son hospedadores intermediarios del parásito, siendo el ser humano un hospedador accidental a través de la alimentación con especímenes contaminados (fig. 1)1,4. Se ha asociado a especies como merluza, anchoas o boquerones, bonito, caballa, salmón o calamares4,6.
Esquema del ciclo vital del Anisakis. Los hospedadores definitivos del parásito adulto son cetáceos y mamíferos marinos. Al alojarse en su mucosa gástrica, expulsan huevos junto con las heces. En el agua se producen el proceso embrionario y un primer estadio, tras lo cual los huevos eclosionan liberando las larvas. En este segundo estadio son ingeridas por pequeños crustáceos (primer hospedador intermediario), donde maduran a un tercer estadio. Posteriormente, estos son consumidos por peces o cefalópodos (segundo hospedador intermediario), en los que migran a vísceras, cavidad peritoneal y musculatura. Su consumo por mamíferos marinos (u ocasionalmente del primer hospedador) permite a la larva pasar a un cuarto estadio y a la madurez. En el ser humano, el consumo del segundo hospedador intermediario es el que produce la contaminación por el parásito, lo que lo convierte en un hospedador accidental.
La muerte del parásito puede asegurarse con el calentamiento de la pieza hasta alcanzar una temperatura mínima interna de 60° C durante al menos 1min, con la congelación a –20°C durante 1 a 7 días o con la ultracongelación a –35°C más de 15 h4,7,8. Las semiconservas, como por ejemplo la preparación en vinagre o salazón, no aseguran la muerte del parásito salvo en altas concentraciones durante al menos 6 semanas, en caso de no existir congelación previa9. Actualmente, la normativa nacional y comunitaria recomienda el tratamiento térmico previo a la comercialización y en determinados casos antes de la preparación en semiconserva, así como la retirada de especímenes con parásitos visibles8.
ClínicaAl ser ingeridas, las larvas se adhieren a la mucosa digestiva. Los síntomas suelen comenzar entre 4 y 72h tras la ingesta del alimento contaminado, aunque se han descrito periodos de latencia diferentes para la afectación gástrica (entre 1 y 24h) y la intestinal (desde horas hasta varios días)4,5,7. Clásicamente se considera que existe un franco predominio de la afectación gástrica (hasta el 96%), si bien series posteriores han demostrado que podría ser menor1,5,7,10. Por un lado, se ha descrito un mayor número de casos intestinales en Europa, lo que podría deberse a diferencias tanto epidemiológicas como en los métodos diagnósticos10–12. Por otra parte, los resultados de las series radiológicas publicadas no muestran un predominio gástrico tan evidente, aunque ello puede relacionarse con una diferente necesidad de pruebas radiológicas y de tiempo transcurrido desde la exposición en función del segmento afectado12–14. Las zonas más habitualmente afectadas en las pruebas de imagen son el estómago y el íleon (con predominio en el íleon distal) en rango variable13,15. La afectación colónica es infrecuente (0,1-0,9%), con el 50% de los casos localizados en el ciego y el colon derecho16,17.
La presentación clínica puede asociar náuseas, vómitos, diarrea, fiebre y dolor abdominal de localización variable en función del segmento afectado (p. ej., epigastralgia intensa en los casos gástricos o dolor en la fosa ilíaca derecha en los ileales)1,5,18. Los síntomas suelen persistir varios días12,13. La localización del dolor, asociada a la clínica inespecífica, hace que sea frecuente orientar el cuadro como un posible abdomen agudo (apendicitis, diverticulitis, cólico biliar, ulcus, gastritis, etc.)12,14,18.
Además de la localización, el tipo de infestación puede condicionar marcadas variaciones en la sintomatología4:
- 1.
Forma luminal. Adhesión de las larvas a la superficie de la mucosa, generalmente de localización gástrica. Suele ser asintomática, aunque puede ocasionar gastritis19.
- 2.
Forma invasiva. Las larvas penetran en la mucosa y la submucosa gastrointestinal. Condiciona daño tisular directo con un cuadro inflamatorio local que asocia dolor abdominal severo de instauración súbita (difuso o cólico, de localización variable en función del segmento afecto), náuseas, vómitos y diarrea13,19.
- 3.
Reacción alérgica o anisakiasis gastroalérgica. La infestación puede desencadenar una reacción alérgica sistémica severa mediada por IgE en personas ya sensibilizadas; parece que para condicionar dicha sensibilización, el parásito debe haber penetrado anteriormente la mucosa digestiva1,20. Al tratarse de una respuesta inmunitaria a un antígeno (a veces termoestable) presente en el nematodo, no es necesario que el parásito sea viable; por ello la reacción alérgica puede darse tanto con la ingestión de pescado crudo como correctamente cocinado o conservado11. La prevalencia es muy variable entre las diferentes series disponibles7. Suele manifestarse como urticaria, angioedema o shock anafiláctico, aunque el cuadro puede superponerse a otras formas de presentación de anisakiasis1,11.
- 4.
Forma ectópica. Se han descrito en la literatura casos excepcionales de afectación extraintestinal (pleuropulmonar, hepática o ganglionar) por migración de larvas a través de la pared digestiva, así como casos de anisakiasis crónica que condiciona la formación de granulomas y adherencias en órganos intraperitoneales, el mesenterio y la cavidad peritoneal14,18,20–22. Estos últimos se producen a consecuencia de una inflamación local crónica, ya que la larva suele morir en un plazo máximo de 14 días, con clínica inespecífica de dolor abdominal leve e intermitente14,18. A veces constituyen un hallazgo accidental en cirugías por otra causa o estudios de extensión tumoral14,18,20.
Ocasionalmente pueden aparecer síntomas atípicos como síncope, disnea, mareo, fiebre o distensión abdominal, en cualquier caso, con menor frecuencia, y raramente sangrado digestivo alto o signos de peritonismo1.
En general, el cuadro suele ser autolimitado, con eliminación espontánea del parásito por vía digestiva al cabo de varios días o mediante la propia respuesta inmunitaria en el caso de infiltración tisular7. Las complicaciones secundarias a la anisakiasis son poco frecuentes. La más habitual es la obstrucción, secundaria a la disminución de la luz intestinal por el edema parietal19,22,23. Ocasionalmente aparecen invaginaciones intestinales, sin causa conocida; se ha planteado su relación con el edema, así como con la alteración del peristaltismo por la irritación de la pared16,17,24. También se han observado casos aislados de isquemia intestinal (por inflamación directa o vasoconstricción secundaria a la reacción alérgica), perforación y abscesos19,23–25.
Debe recordarse que la presentación clínica es inespecífica, con un cuadro abdominal agudo y dolor de localización variable que depende del segmento afectado. Pueden aparecer síntomas de reacción alérgica severa, tanto aislados como en asociación con la clínica digestiva.
DiagnósticoEs necesaria una anamnesis cuidadosa ante una sintomatología compatible, enfocada a valorar una posible exposición reciente a alimentos contaminados5,13. No es excepcional que la anamnesis dirigida la inicie el radiólogo al observar hallazgos de sospecha. Las alteraciones en pruebas de laboratorio son inespecíficas. Puede asociar elevación de reactantes de fase aguda, habitualmente con leucocitosis discreta o ausente; en presencia de reacción alérgica puede observarse eosinofilia periférica, pero es variable en el resto de los casos1,7,26. También se ha descrito la presencia de eosinofilia en el líquido ascítico3.
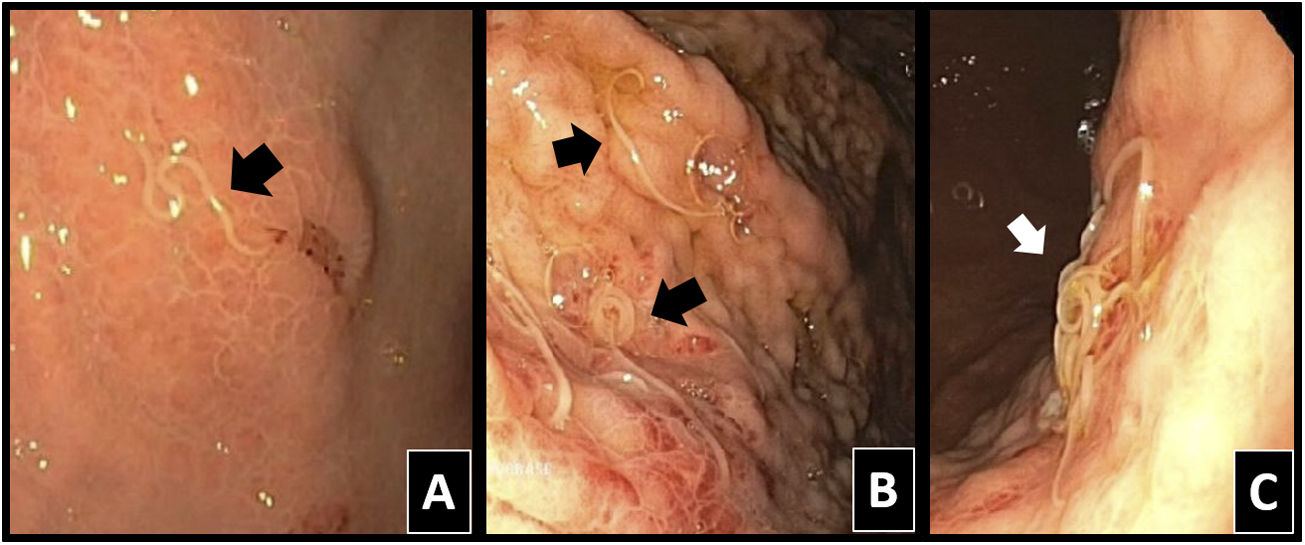
Clásicamente, el diagnóstico de certeza lo daría la observación directa de los parásitos en pruebas endoscópicas o en la cirugía (fig. 2)1,4,6,7. Pueden objetivarse eritema local, edema mucoso-submucoso y cambios flemonosos locales, así como eosinofilia en las muestras de tejido, todo ello en relación con una intensa reacción alérgica local por la penetración del parásito4,7,13.
Es posible detectar la exposición mediante test serológicos con determinación de anticuerpos IgE específicos, reacción en cadena de la polimerasa para detección de ADN del nematodo o test cutáneos con antígeno específico, aunque solo se realizan en caso de alta sospecha y la especificidad no siempre es óptima4,7,13,26. La presencia de anticuerpos específicos puede ser detectable en sangre tras el primer día de infestación, persistiendo entre 6 y 12 meses, pero el tiempo necesario para obtener el resultado hace que su utilidad en casos urgentes sea escasa5,27,28.
Hallazgos en la imagenLa sintomatología inespecífica en un contexto clínico de abdomen agudo hace frecuente que en estos casos se recurra a las pruebas diagnósticas por imagen. Su primer objetivo es, por tanto, descartar otras posibilidades diagnósticas14. Sin embargo, el planteamiento de una posible anisakiasis por los hallazgos en imagen puede ser clave para guiar al clínico en casos no sospechados, principalmente en casos intestinales dado el mayor periodo de latencia con respecto a la ingesta que dificulta su asociación6,13,14,19.
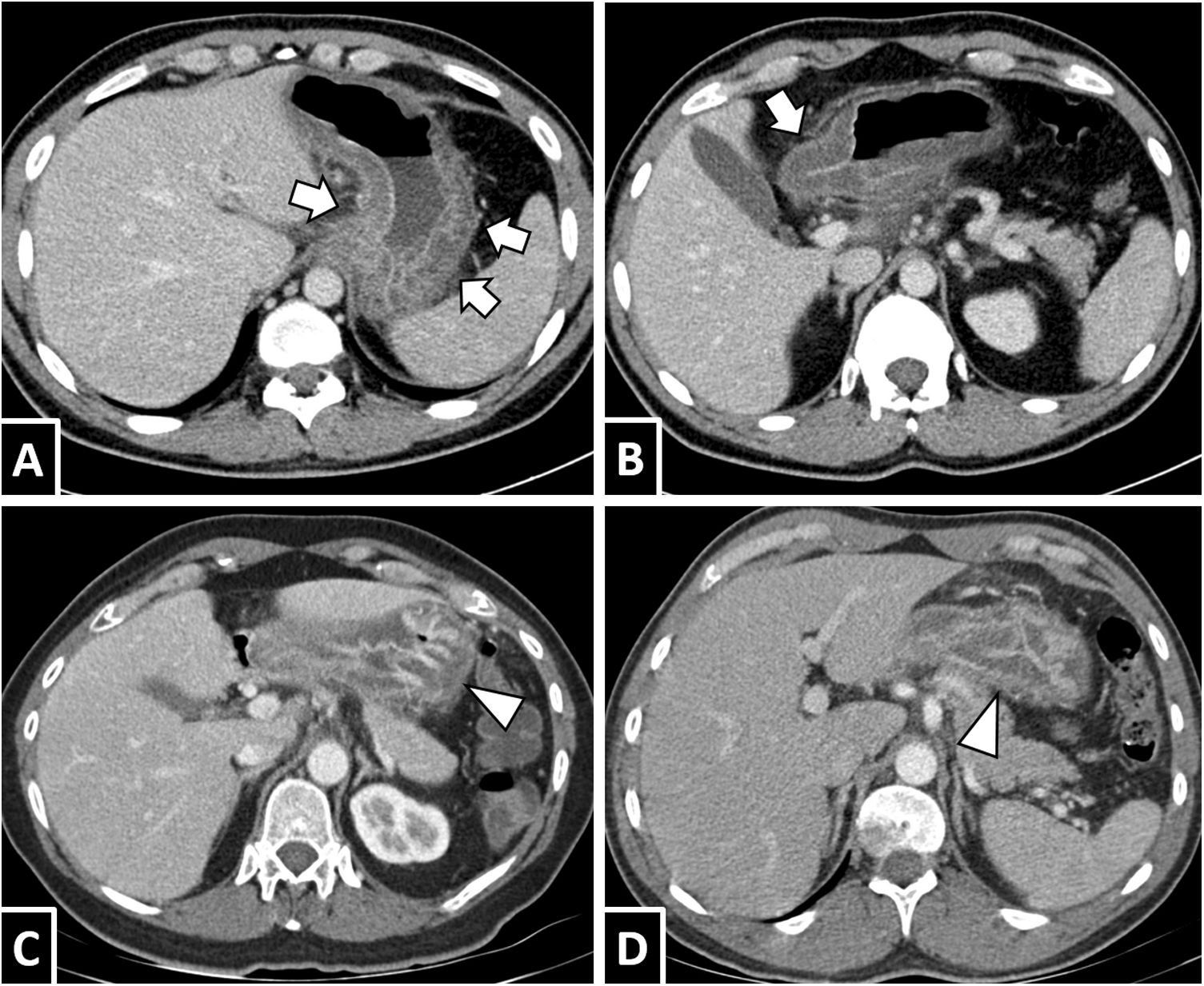
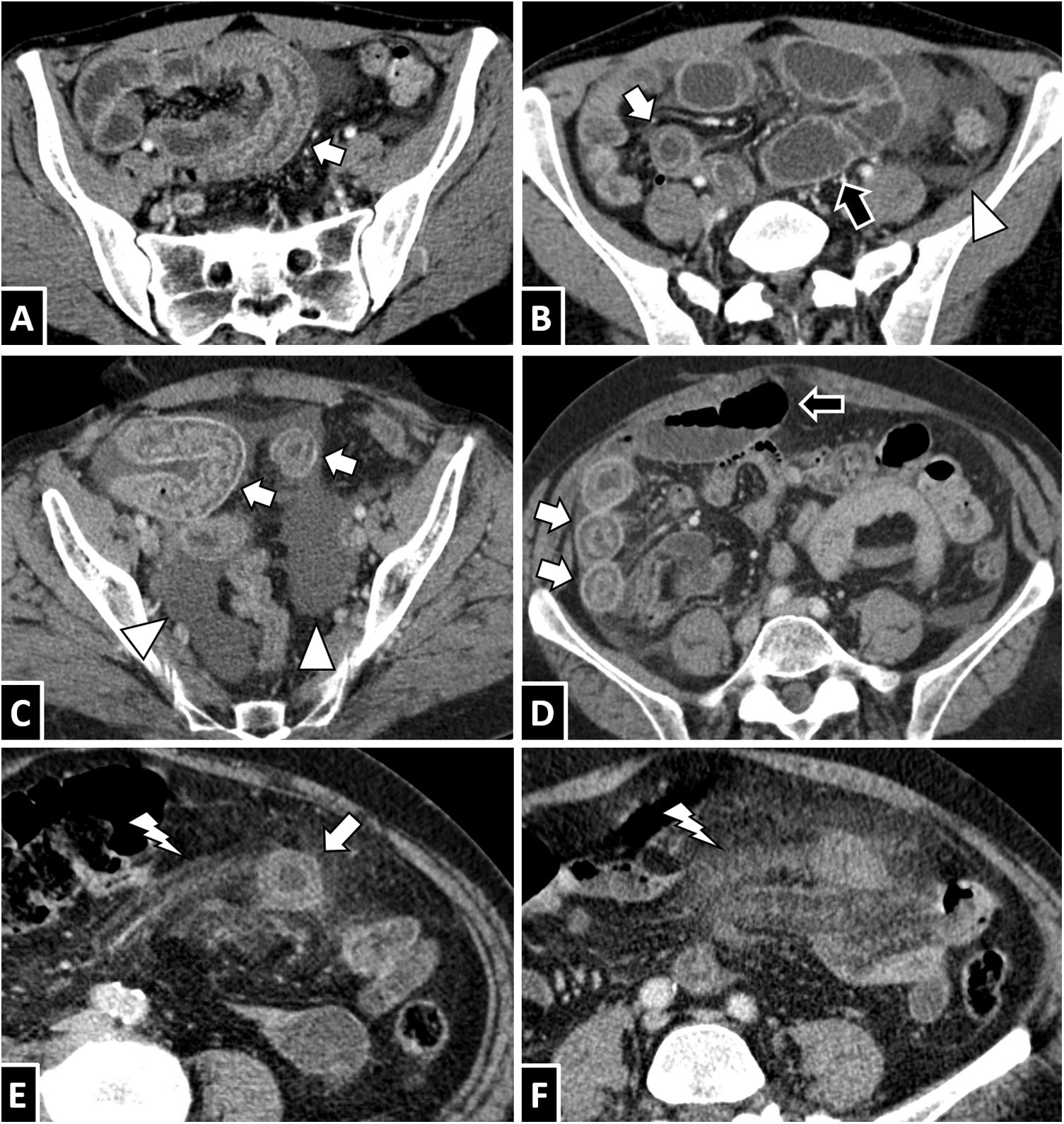
En la tomografía computarizada (TC) el protocolo más habitual sería una fase portal con contraste por vía intravenosa; es poco probable que la administración de contraste por vía oral aporte datos útiles para el diagnóstico. Se ha descrito una alta prevalencia de casos que muestran engrosamiento parietal y marcado edema submucoso de los segmentos afectados, conformando una imagen de «doble halo» o «en diana»; este puede ser llamativo en el estómago, con engrosamiento asociado de pliegues gástricos (figs. 3 y 4)5,6,14,19. Otros hallazgos frecuentes son edema de la grasa mesentérica adyacente, ascitis (desde mínimo líquido adyacente a ascitis generalizada) y dilatación proximal de asas con contenido líquido (figs. 4 a 8) (figs. 5, 6, 7 and 8)14,15,28. La presencia de adenopatías varía entre publicaciones y raramente pueden aparecer invaginaciones intestinales (fig. 9)14,16,24.
Anisakiasis gástrica. A y B) Varón de 31 años con sospecha de enfermedad biliar. En cortes axiales de TC con contraste por vía intravenosa se observa un marcado engrosamiento mural gástrico con edema submucoso (flechas blancas) y leve borrosidad de la grasa adyacente. C) Varón de 50 años con dolor abdominal severo. D) varón de 63 años con epigastralgia y vómitos. Ambos casos presentan engrosamiento mural gástrico con importante engrosamiento de pliegues (puntas de flecha blancas) y edema submucoso.
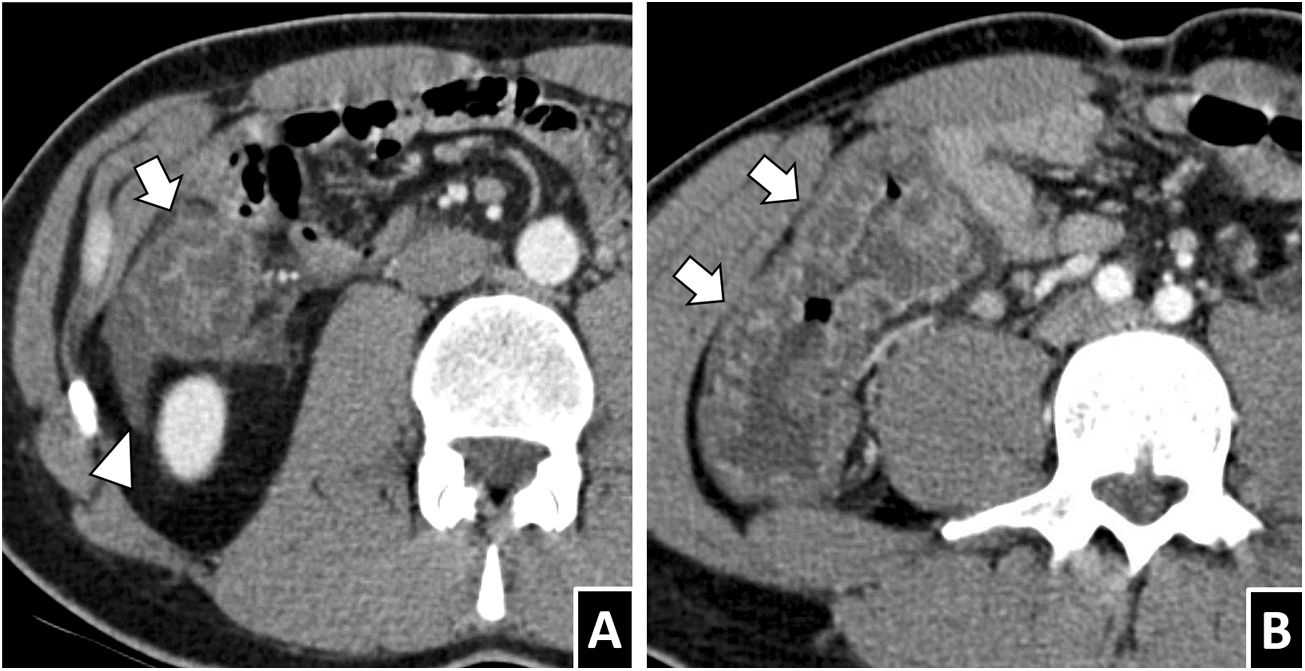
Anisakis en intestino delgado. A y B) Mujer de 35 años con sospecha de diverticulitis. C y D) Mujer de 58 años con sospecha de apendicitis. E y F) Mujer de 68 años con sospecha de diverticulitis. En la TC abdominal con contraste por vía intravenosa de los 3 casos puede apreciarse engrosamiento mural circunferencial de un segmento largo de íleon con edema submucoso (flechas blancas). Además, se observa, en diferente medida, ascitis (B y C, puntas de flecha blancas), disminución del calibre de la luz en los segmentos afectados con dilatación de la luz proximal asociada a contenido líquido (B y D, flechas negras) y edema de la grasa mesentérica adyacente (E y F, relámpagos blancos). Todos los casos se resolvieron mediante tratamiento conservador.
Anisakiasis en colon. Varón de 37 años con sospecha de apendicitis (A) y varón de 30 años con dolor abdominal severo (B). Ambos presentan importante engrosamiento mural circunferencial en el colon derecho con edema submucoso (flechas blancas) y líquido libre adyacente (punta de flecha blanca).
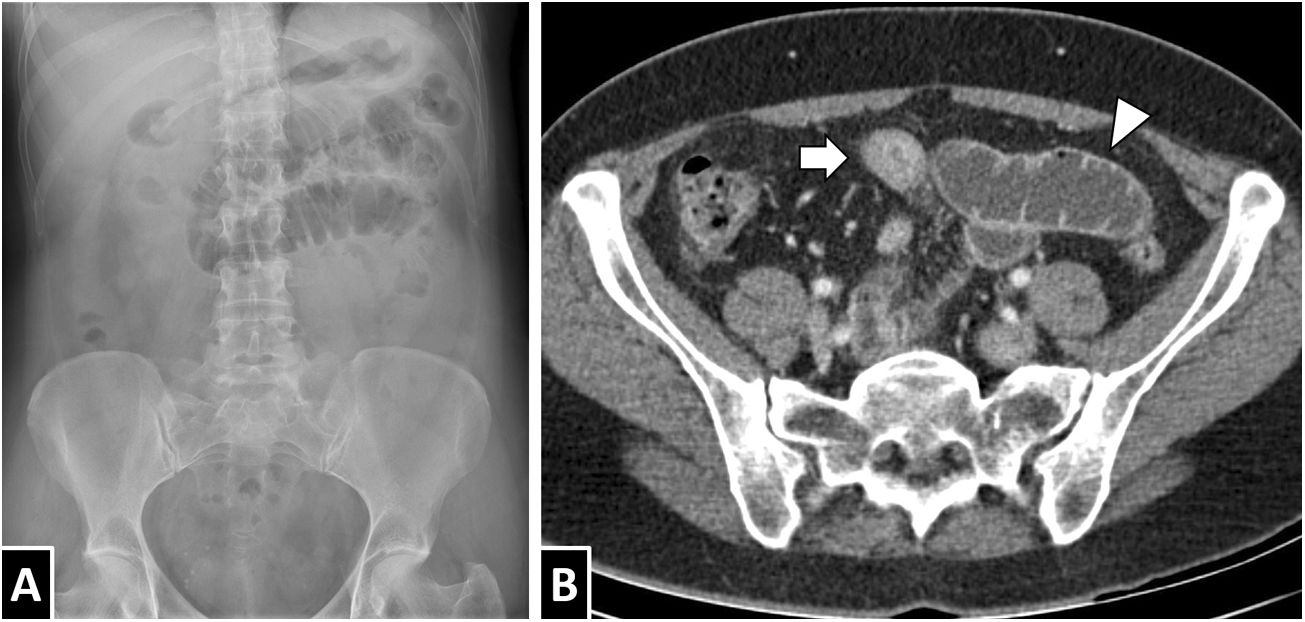
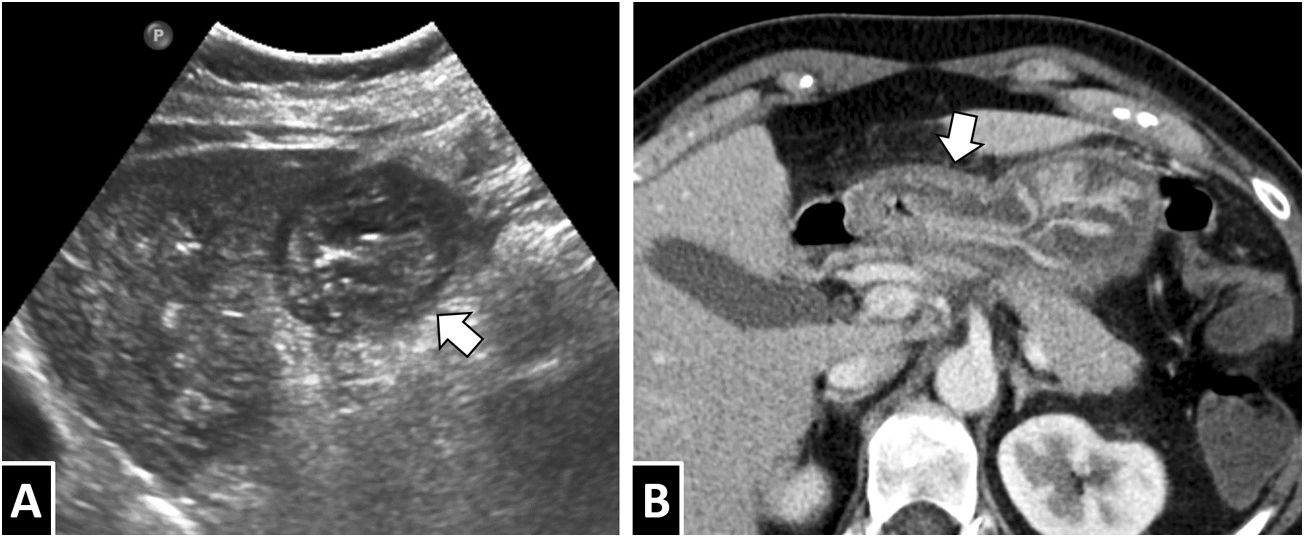
Mujer de 55 años con dolor abdominal y diagnóstico final de anisakiasis intestinal. En la radiografía convencional de abdomen (A) se aprecia una dilatación focal de asas en el hipocondrio izquierdo. En la TC abdominal con contraste por vía intravenosa (B) se objetiva un engrosamiento circunferencial de un segmento corto de íleon con hiperdensidad mural homogénea de mínimo predominio mucoso (flecha blanca) y dilatación intestinal proximal con contenido líquido (punta de flecha blanca). Si bien el edema submucoso es un hallazgo frecuente en la anisakiasis, como puede observarse en este caso, no es constante.
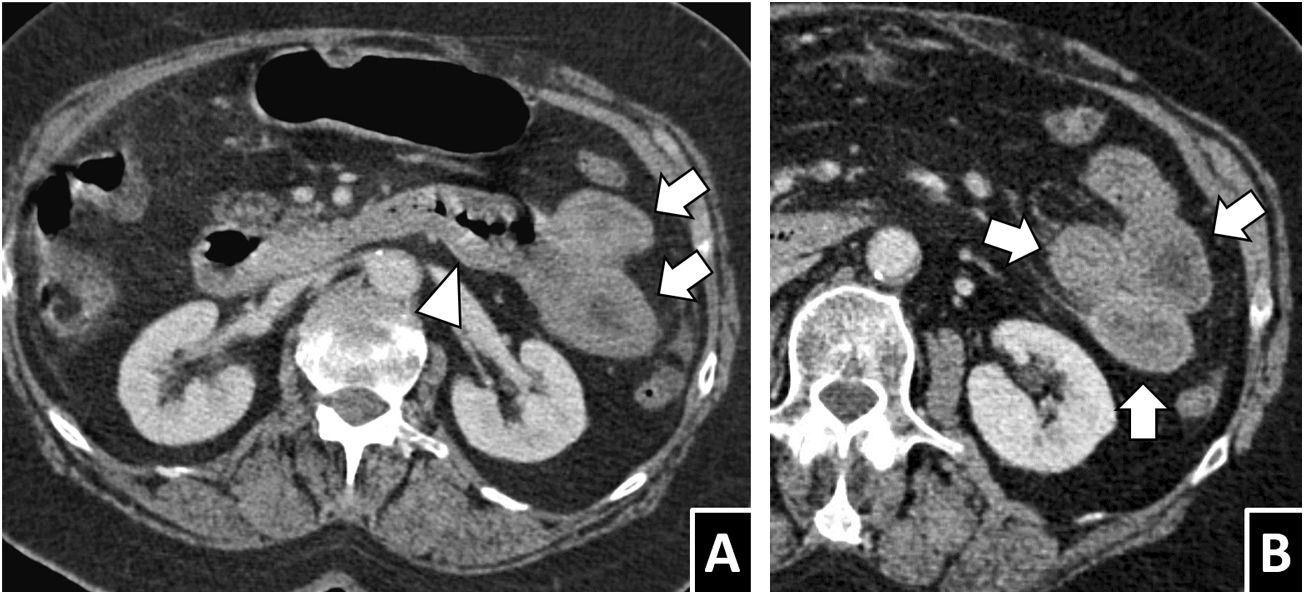
Mujer de 76 años con dolor abdominal, con diagnóstico final de anisakiasis. En la TC con contraste por vía intravenoso se objetiva un engrosamiento parietal circunferencial en la 4.ª porción duodenal (A, cabeza de flecha) y yeyuno (flechas). Puede apreciarse un patrón de realce mixto, con predominio de la hiperdensidad transmural en la zona más proximal (A) y un leve edema submucoso en la más distal (B).
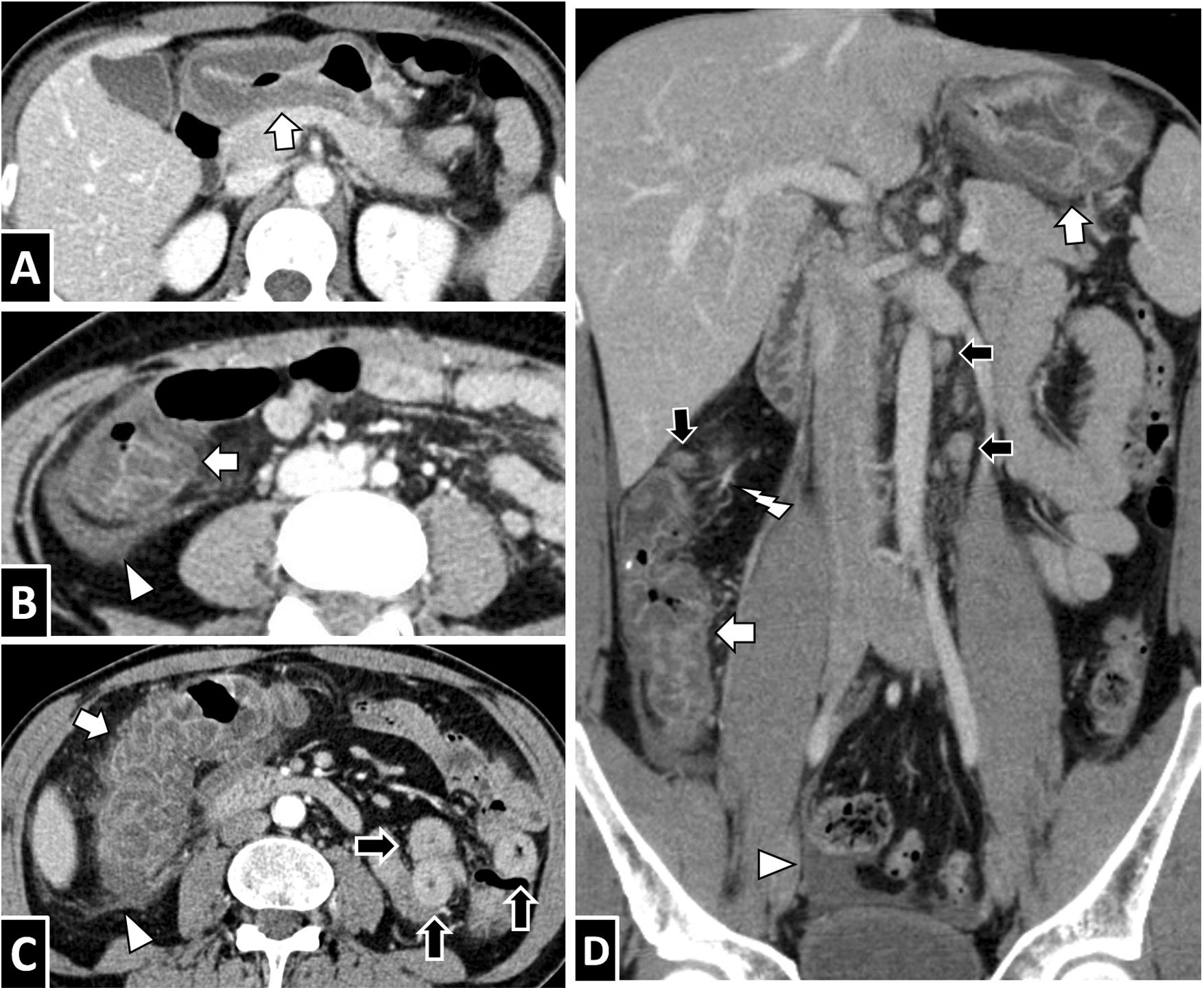
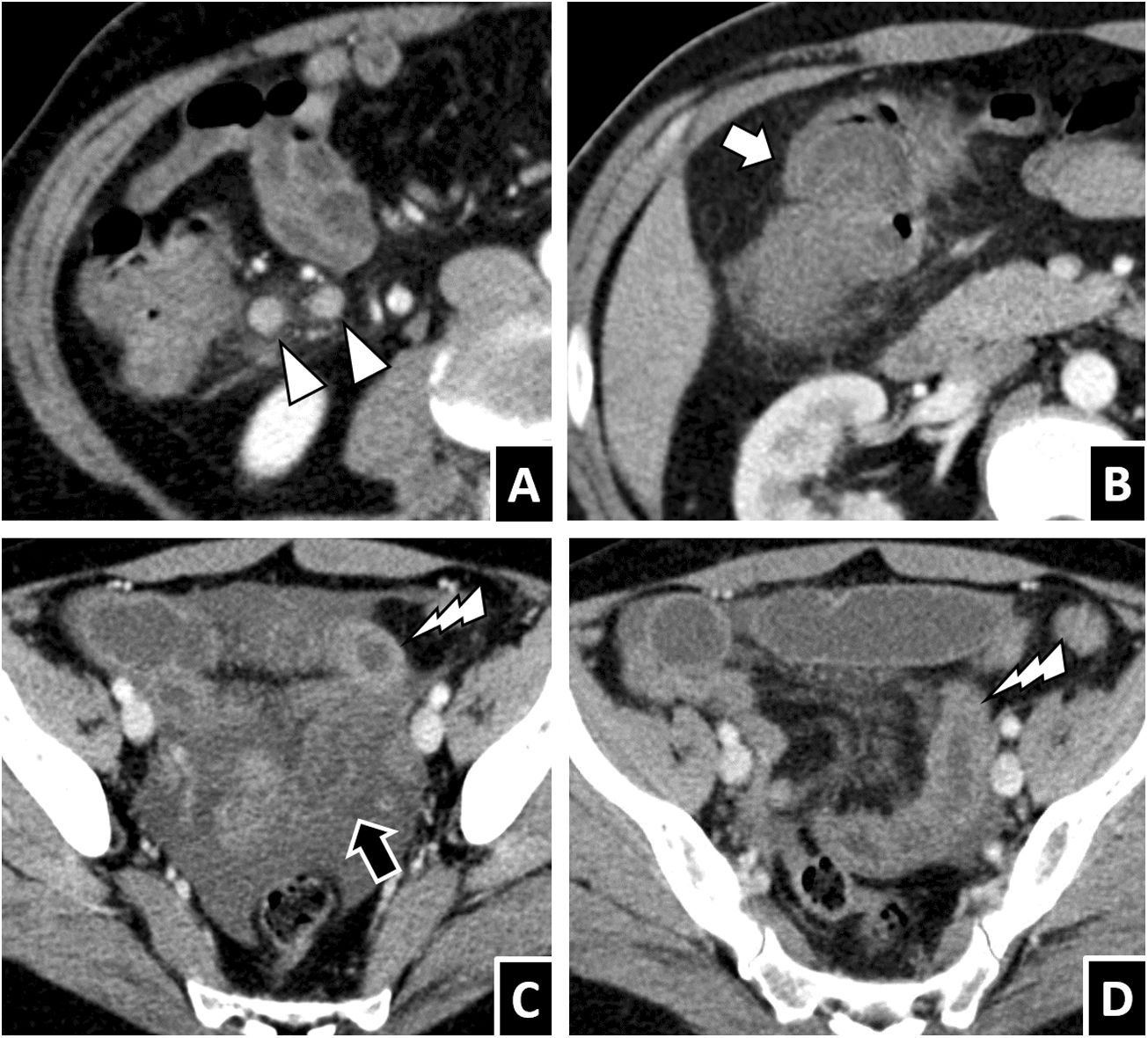
Anisakiasis con afectación multisegmentaria. A y B) Mujer de 52 años con manifestaciones cutáneas de reacción alérgica, dolor abdominal severo y antecedente de ingesta de pescado crudo, con elevada sospecha de anisakiasis. En la TC con contraste por vía intravenosa se observan un marcado engrosamiento mural y un edema submucoso, tanto en el antro gástrico como en el colon derecho (flechas blancas), así como una mínima cantidad de líquido libre (punta de flecha blanca). C) Varón de 54 años con sospecha de apendicitis. Se aprecian un importante engrosamiento y edema submucoso en el colon derecho (flecha blanca) asociado a un engrosamiento circunferencial segmentario en el íleon, con hiperdensidad transmural (flechas negras). D) Varón de 43 años con anisakiasis gástrica e ileocecal; reconstrucción coronal de TC con contraste por vía intravenosa. Muestra engrosamiento mural y edema submucoso de los segmentos afectados (flechas blancas), discreta cantidad de ascitis (punta de flecha), adenopatías (flechas negras) e hiperemia vascular (relámpago blanco). Como ilustran estos casos, no es rara la afectación de varios segmentos discontinuos del tubo digestivo, a veces con diferentes características.
Hallazgos menos frecuentes. A) Mujer de 66 años con ileítis terminal por Anisakis, con adenopatías regionales visibles en la TC (puntas de flecha blancas); la presencia de ganglios en la anisakiasis varía entre las series publicadas. B) Varón de 46 años con anisakiasis en el colon derecho que presenta una invaginación intestinal en la TC (flecha blanca), una de las posibles complicaciones secundarias. C y D) Varón de 55 años con dolor abdominal severo y diagnóstico final de anisakiasis intestinal. En la TC con contraste pueden observarse tanto segmentos de engrosamiento mural con hiperdensidad transmural (relámpagos blancos) como con importante edema submucoso, además de ascitis, edema de la grasa y dilatación proximal, todo ello compatible con anisakiasis. Uno de los segmentos de edema submucoso muestra escasa definición de la serosa (flecha negra), en contraste con los segmentos hiperdensos, lo que podría plantear la posibilidad de isquemia intestinal (no confirmada en este caso).
El uso habitual de la ecografía en casos de dolor abdominal agudo debe hacernos tener en cuenta el diagnóstico de anisakiasis ante la presencia de signos compatibles6. Se han descrito hallazgos similares a la TC (figs. 10 y 11): engrosamiento mural circunferencial segmentario, así como, en menor medida, dilatación intestinal proximal a las zonas afectadas, edema mucoso-submucoso y de válvulas conniventes, ascitis, hipomotilidad de las asas afectadas e hiperemia parietal en Doppler3,7,12,28,29. La pared suele mantener la estructura ecográfica en capas, con engrosamiento principalmente a expensas de edema de los pliegues de Kerckring; ello se muestra como un aumento y una ondulación de la capa hipoecogénica dependiente de la muscularis mucosae, correspondiente a la segunda capa desde la luz intestinal (fig. 11)12,29.
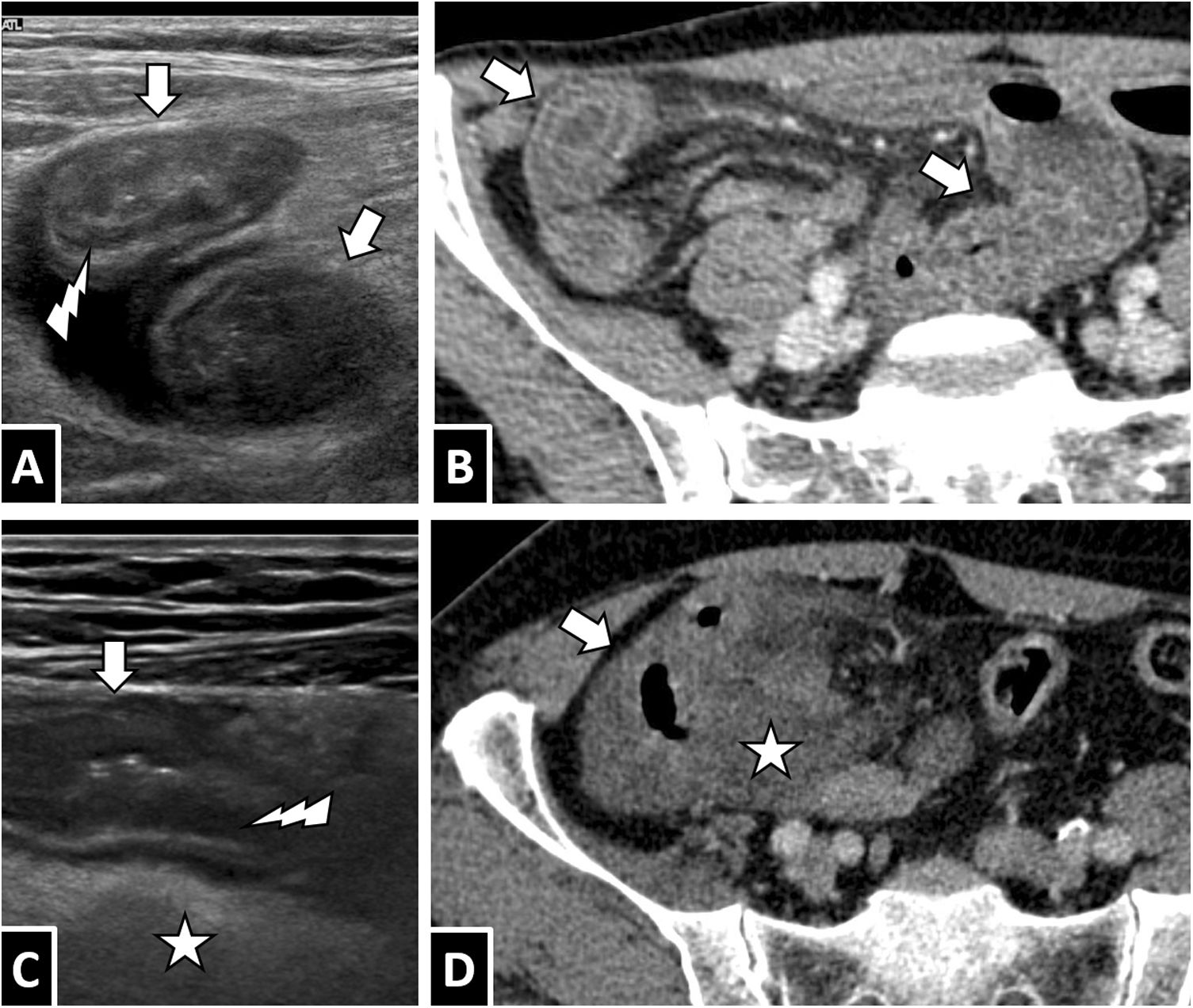
Varón de 50 años con dolor abdominal severo y diagnóstico de gastritis por anisakis (mostrado previamente en la Figura 2C). Correlación entre los hallazgos ecográficos (A, corte sagital en la región epigástrica) y en la TC con contraste (B). Ambas técnicas muestran un marcado engrosamiento mural en la región antral con edema mucoso-submucoso (flechas).
A y B) Varón de 43 años con dolor abdominal e ileítis extensa. C y D) Varón de 62 años con ileítis terminal y colitis derecha. En ambos casos se llegó al diagnóstico final de anisakiasis intestinal. Correlación entre imágenes de ecografía con sonda lineal de alta frecuencia (A y C) y las imágenes de TC con contraste intravenoso (B y D): se objetivan segmentos de engrosamiento mural intestinal (flechas blancas) con estructura en capas conservada y edema principalmente a expensas de los pliegues de Kerckring (A y C, relámpagos blancos), además de líquido libre adyacente (puntas de flecha) y marcado edema de la grasa mesentérica (estrella blanca).
El hallazgo de un marcado edema submucoso con engrosamiento parietal gástrico difuso plantearía el diagnóstico diferencial con varias entidades14,30. La gastritis aguda y la hipertrófica pueden causar una imagen similar con predominio en el antro, pero la ascitis y los cambios inflamatorios adyacentes son menos frecuentes (fig. 12A). La enfermedad de Ménétrier produce importante engrosamiento de pliegues, habitualmente en cuerpo y el fundus, pero igualmente no suele afectar a los tejidos perigástricos y el cuadro clínico es más crónico. La ingestión de cáusticos también condiciona un edema mural masivo con engrosamiento de pliegues. Por otra parte, el carcinoma escirro se asocia a engrosamiento mural difuso que a veces muestra hiperdensidad mucosa, pero con disminución del patrón de pliegues e hipomotilidad (fig. 12B).
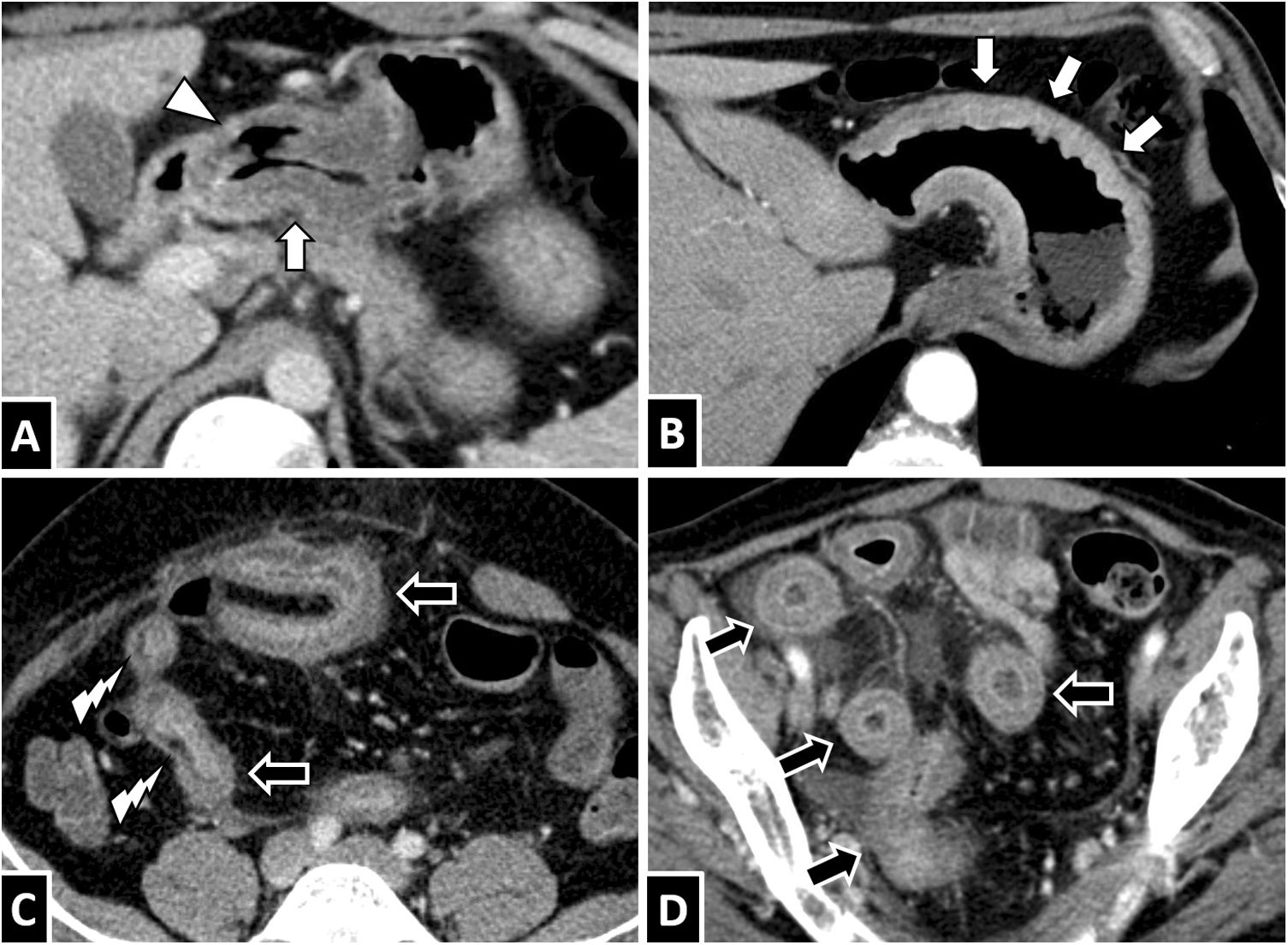
Ejemplos de diagnóstico diferencial. A) Varón de 31 años con gastritis y un ulcus penetrante en el antro (punta de flecha). Puede observarse un marcado engrosamiento mural con edema submucoso (flecha blanca). B) Varón de 70 años con carcinoma gástrico tipo células en anillo de sello y linitis plástica. Existe engrosamiento mural difuso (flechas blancas), pero con pliegues adelgazados, sin edema submucoso ni alteraciones de tejidos perigástricos. C) Varón de 45 años con reactivación de enfermedad de Crohn ileal. Además del engrosamiento mural con edema submucoso (flechas negras), se aprecia leve edema de la grasa adyacente sin ascitis apreciable. Puede apreciarse la presencia de depósitos milimétricos de grasa intramural (relámpagos blancos) que sugieren cronicidad. D) Mujer de 75 años con enteritis rádica secundaria a tratamiento radioterápico de cáncer de recto. Se observan varios segmentos de engrosamiento mural circunferencial localizados en pelvis con «signo del halo» (flechas negras), así como hiperemia vascular y discreta cuantía de líquido adyacente.
Dentro del diagnóstico diferencial de la afectación intestinal4,14, la enfermedad de Crohn en fase aguda puede presentar hallazgos y localización similares a la anisakiasis, aunque la aparición de ascitis es infrecuente; la presencia de alteraciones asociadas a fases crónicas, como depósitos y proliferación fibrograsa o signos de afectación transmural, facilitan su diferenciación (fig. 12C). Las enteritis infecciosas e inflamatorias también condicionan ocasionalmente el «signo de la diana», pero con segmentos engrosados habitualmente más largos y menor frecuencia de ascitis (fig. 12D). La isquemia intestinal se asocia a engrosamiento mural con densidad variable (puede existir hiperdensidad de la mucosa o hemorragia submucosa), además de edema de la grasa mesentérica y ascitis; sin embargo, la afectación suele ser más extensa y con dilatación del segmento, pudiendo observarse ausencia de repleción por contraste de estructuras vasculares y neumatosis en casos avanzados25. En la gastroenteritis eosinofílica suele aparecer engrosamiento segmentario con edema submucoso, pero con estenosis concéntrica de la luz, dismotilidad y una clínica más crónica. El linfoma de células B, tanto gástrico como intestinal, suele mostrar engrosamiento de pliegues y engrosamiento mural, pero con densidad de partes blandas; habitualmente asocia adenopatías y a veces dilatación aneurismática del segmento, siendo rara la ascitis. El engrosamiento asociado al adenocarcinoma suele ser más asimétrico e irregular, afectando a un segmento corto con una transición abrupta19. La peritonitis aguda o tuberculosa serían posibilidades a considerar en casos de afectación extraintestinal4.
Debe recordarse que la clínica y las alteraciones analíticas inespecíficas hacen frecuente que estos pacientes no se presenten con una sospecha previa de anisakiasis.
Debe recordarse que podría sospecharse anisakiasis ante la presencia de engrosamiento mural circunferencial segmentario con edema submucoso, líquido libre, edema de la grasa mesentérica y dilatación proximal de asas, sobre todo de existir un antecedente de exposición a alimentos de riesgo.
TratamientoEn la mayor parte de los casos se opta por un tratamiento conservador: con frecuencia es suficiente el control sintomático del dolor, la dieta absoluta y la fluidoterapia, con cierta controversia en cuanto a la indicación de inhibidores de la bomba de protones4,5,7,13. Sin embargo, se recomienda un seguimiento cuidadoso en la afectación intestinal, ya que se han documentado casos de fallo del tratamiento conservador con aparición de isquemia o perforación intestinal13.
La extracción de las larvas mejora de forma importante la sintomatología, por lo que en ocasiones se intenta la extracción endoscópica si el segmento es accesible4,5,13. En tal caso es recomendable no diferir la intervención: si bien las larvas pueden ser visibles hasta 6 días tras la ingesta, con el paso del tiempo aumenta la posibilidad de que degeneren, se eliminen o atraviesen la pared, condicionando una forma ectópica4,7.
En general, el tratamiento quirúrgico solo es necesario en casos que asocien complicaciones secundarias, como obstrucción con mala evolución, perforación o deterioro clínico importante19,23,24,26. Aunque se ha documentado el uso de antihelmínticos como el albendazol en algún caso, no tienen un papel definido en la actualidad4,5.
ConclusionesLa anisakiasis presenta una incidencia ascendente en países occidentales. Dada la baja sospecha clínica inicial en un número significativo de casos, el periodo de latencia variable de la sintomatología y el uso habitual de pruebas de imagen en el abdomen agudo, estas pueden tener un papel en su valoración. Ante la presencia de hallazgos radiológicos compatibles, como engrosamiento mural segmentario con edema submucoso, ascitis y cambios inflamatorios de la grasa, debería valorarse dicha posibilidad en el diagnóstico diferencial.
Autoría- 1.
Responsable de la integridad del estudio: RFP.
- 2.
Concepción del estudio: RFP, MUG y MPB.
- 3.
Diseño del estudio: RFP, MUG y MPB.
- 4.
Análisis e interpretación de los datos: no aplica.
- 5.
Tratamiento estadístico: no aplica.
- 6.
Búsqueda bibliográfica: RFP, MUG y MPB.
- 7.
Redacción del trabajo: RFP.
- 8.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MUG y MPB.
- 9.
Aprobación de la versión final: RFP, MUG y MPB.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.