Si hubiera que resumir en pocas palabras lo más sobresaliente de los últimos avances en técnicas de imagen neurorradiológica, seguramente entre ellas estarían los términos cuantificación y automatismo. La imagen diagnóstica se ha basado clásicamente en el análisis cualitativo de imágenes radiológicas, pero la llegada de la TC ya introdujo en su día la cuantificación de unidades de densidad (HU) y posteriormente la RM la cuantificación de los tiempos de relajación T1 y T2. A pesar de ello, el diagnóstico se ha basado en el análisis cualitativo de la morfología y las características del contraste propios de cada técnica, si bien a medida que se han incorporado avances que permiten identificar alteraciones más sutiles, la cuantificación se ha ido haciendo más necesaria. Por otro lado, es fundamental que el proceso de cuantificación sea fácil y rápido para que sea eficiente y la automatización de procesos es un factor determinante. Las llamadas técnicas avanzadas, se han ido incorporando a la rutina gracias a la automatización del posproceso: en los estudios morfológicos, la consolidación de la adquisición en 3D con vóxel isotrópico (con secuencias T1 y más recientemente con secuencias T2 y FLAIR), junto con la segmentación automática, permiten realizar cálculos volumétricos precisos, tanto del volumen cerebral global como de estructuras específicas (hipocampo, ventrículos) o de lesiones (volumen tumoral, volumen lesional). También en los estudios «funcionales» (difusión, perfusión, espectroscopia, RM funcional) la cuantificación y el posproceso automático (o semiautomático) se han hecho imprescindibles. De esta forma es frecuente en la práctica clínica el utilizar medidas cuantitativas tales como: coeficiente aparente de difusión, volumen y flujo sanguíneo cerebral, relación NAA/Cr o índice de dominancia hemisférica para el lenguaje.
Los avances en imagen diagnóstica están protagonizados por la introducción de nuevos parámetros tanto estructurales como funcionales que añaden valor a los estudios «convencionales», pero otro de los factores que están contribuyendo al avance de la neurorradiología es la introducción en el entorno clínico de equipos de RM de alto campo (3,0T). La ganancia en la relación señal/ruido y los cambios en los tiempos T1 y T2 que aportan estos equipos de alto campo posibilitan por un lado la rapidez necesaria para poder implementar nuevas secuencias sobre el estudio básico sin aumentar el tiempo del estudio de forma exagerada, y por otro aumentan la fiabilidad de las medidas y permiten utilizar dosis de contraste menores. Todo ello sin olvidar la mejoría general en la calidad de la imagen que de por sí aumenta la información en los estudios estructurales de alta resolución, especialmente con secuencias T2.
Otro de los avances más relevantes ha sido la aplicación de forma masiva de la TC multicorte que hace posible la adquisición en tiempo ultrarrápido de imágenes volumétricas que han permitido introducir en los exámenes rutinarios estudios vasculares y de perfusión cerebral. Los estudios de perfusión con TC compiten con los obtenidos con la RM, si bien en la práctica son mucho menos utilizados. Por el contrario los estudios vasculares obtenidos mediante TC, que en algunos aspectos son superiores a los realizados con RM, se realizan de forma habitual gracias especialmente a la facilidad y rapidez con que se obtienen, para el estudio de diferentes procesos que afectan las arterias y venas cerebrales y cervicales. No deben olvidarse, sin embargo, los riesgos que conlleva todo estudio que utiliza radiaciones ionizantes y contrastes yodados.
Por último no se podría pasar por alto la progresiva utilización de la PET dentro de la ámbito de la neurorradiología. Esto puede considerarse como un avance técnico (ya que se ha producido con la llegada de la PET-TC y de la fusión PET-RM) pero además está poniendo de manifiesto la necesidad de un abordaje integral del diagnóstico por imagen. La radiología y la medicina nuclear están abocadas a trabajar conjuntamente para aumentar su eficiencia. Si la llegada de la PET-TC fue un detonante para acelerar el acercamiento entre especialidades, en neurorradiología la llegada de la PET-RM, que hará posible obtener estudios funcionales simultáneamente con RM y PET, puede contribuir a consolidar el abordaje por sistemas y procesos (y no por tecnologías) del diagnóstico por imagen.
RM estructuralLa RM estructural ha evolucionado de forma continua con dos objetivos fundamentales: aumentar la relación señal/ruido (RSR) y mejorar o encontrar nuevas variaciones en el contraste. Un ejemplo de ello ha sido el desarrollo de secuencias FLAIR (fluid-attenuated inversion recovery), que hoy son de las más utilizadas en los estudios cerebrales, y han demostrado aportar un valor añadido significativo en diferentes procesos que afectan el sistema nervioso central, especialmente en la patología vascular, la epilepsia y la esclerosis múltiple. También la mayor rapidez en la adquisición de las secuencias ha sido un avance fundamental en RM. Ello ha sido posible al aprovechar aumentos de la RSR combinados con el diseño de nuevas secuencias de pulsos. Uno de los avances más significativos ha sido el desarrollo de la imagen paralela (PI)1 que, combinando la capacidad de nuevas antenas receptoras con múltiples componentes con secuencias diseñadas específicamente para este tipo de bobina (ASSET, SENSE)2, aumentan la rapidez de la adquisición al tiempo que aumentan la RSR (fig. 1). Por ejemplo, la ganancia en RSR de una antena cerebral que utilice 8 canales comparada con una antena volumétrica de un solo canal es del 200–300%. Si a ello le combinamos una adquisición PI, con la que es posible disminuir por un factor de 2 el tiempo de adquisición con una pérdida de señal de solamente el 30% el resultado final es un aumento de la RSR hasta 2 veces en la mitad o menos del tiempo requerido con secuencias clásicas. El próximo paso en esta línea será la incorporación de antenas multicanal emisoras/receptoras3, lo que aumentará aún más la RSR y se reducirá el depósito calórico inducido por la radiofrecuencia, lo cual es especialmente relevante en campos de 3T o superiores.
El aumento de la RSR junto al desarrollo de secuencias rápidas ha propiciado el uso de adquisiciones 3D, que ya eran ampliamente utilizadas con secuencias de eco de gradiente, sobre todo en T1 - y que se han perfeccionado con la aplicación de pulsos de preparación IR que aumentan el contraste en T1- y gracias a esta nueva tecnología actualmente pueden usarse con secuencias T2 y FLAIR4. Con los llamados estudios 3D isotrópicos (vóxel de 1×1×1mm) se mejora la información diagnóstica (mayor resolución espacial, menores artefactos de volumen parcial, reconstrucciones multiplanares de idéntica calidad a la imagen original) y se pueden utilizar los estudios de RM en la planificación de la radioterapia, neurocirugía y radiocirugía, con el uso de neuronavegadores. Aunque las secuencias 3D ponderadas en T1 siguen siendo las más utilizadas, en la actualidad también se utilizan secuencias 3D-FLAIR, que mejoran la calidad de las secuencias FLAIR obtenidas en 2D al minimizar los artefactos de flujo que degradan las imágenes5 y que incrementan su sensibilidad diagnóstica al ser capaces de detectar lesiones de pequeño tamaño en situación cortical como es el caso de alteraciones del desarrollo cortical6 o de la esclerosis múltiple7.
Por otro lado, el desarrollo de programas de segmentación automática está haciendo posible el uso de datos volumétricos en la práctica clínica8. El principal impacto de estas técnicas se centra en el análisis de cambios estructurales difíciles de detectar visualmente, como el volumen del hipocampo, bien para conocer la asimetría en el caso de la epilepsia temporal o para valorar la evolución de la atrofia en enfermedades neurodegenerativas9. Así por ejemplo, el índice anual de atrofia (porcentaje de pérdida anual de volumen cerebral respecto al volumen intracraneal) ha sido validado como un signo de probable enfermedad de Alzheimer10. También es posible calcular de forma automática el volumen de lesiones tumorales no sólo en áreas que realzan con el contraste, sino también en áreas sin realce, muy frecuentes en gliomas. Las medidas volumétricas en los gliomas se está planteando como una evolución de los criterios RECIST (Response Evaluation Criteria In Solid Tumors), basados en diámetros máximos de áreas medibles de realce post-contraste, que presentan serias limitaciones11, agravadas por los efectos sobre la barrera hemato-encefálica que provocan los fármacos anti-angiogénicos, que cada vez se usan con mayor frecuencia. La segmentación automática también facilita la valoración y seguimiento del volumen lesional en la esclerosis múltiple, ya que es posible obtener una medida global de las lesiones de la sustancia blanca y además obtener automáticamente medidas de la atrofia.
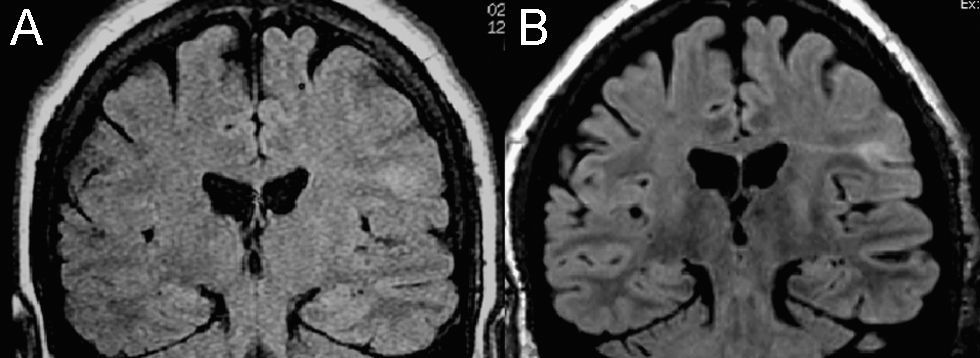
Probablemente el mayor avance en estudios estructurales ha sido la combinación de la imagen paralela con imanes de 3T. Al aumento global de la RSR que produce el aumento del campo (en torno al 80–100% dependiendo de las secuencias), que es mayor en profundidad debido al efecto dieléctrico, se une el aumento de señal de las bobinas multicanal, que es cercano al 180% en la periferia pero menor en profundidad (en los imanes de 1,5T produce imágenes con menor señal en profundidad) lo cual en 3,0T equilibra la señal en toda la imagen. Al aumento en la RSR hay que añadir los cambios que se producen en los tiempos de relajación y el aumento del desplazamiento químico. En cuanto al aumento del T1, la disminución del contraste que produce sobre secuencias SE ha sido compensada con secuencias con radiofrecuencia variable y sobre todo con secuencias de eco de gradiente con pulsos de preparación IR y en cambio se aprovecha la ventaja de la mayor sensibilidad a los contrastes paramagnéticos, que permite disminuir la dosis de contraste o aumentar la sensibilidad diagnóstica. El ligero acortamiento de T2 y sobre todo de T2* ha mejorado sensiblemente las aplicaciones en estudios funcionales. En estudios estructurales, junto con la ganancia en RSR, el mayor contraste en T2 aumenta la capacidad de detección de diferentes lesiones de pequeño tamaño (fig. 2) como las desmielinizantes12 y sobre todo las displasias corticales focales13, detectando hasta un 40% más lesiones que la RM de 1,5T14. Por otro lado, la mayor rapidez de adquisición no sólo contribuye a aumentar la productividad sino que es muy útil en pacientes con dificultades de colaboración y permite adquirir estudios en 3D de alta calidad en tiempos inferiores a los 7min.
El mayor avance que se ha producido en los estudios vasculares es la aplicación de secuencias 3D-T1 con TR ultracorto durante la inyección de un bolo de contraste (CE-MRA)15. Los principales inconvenientes de la técnica clásica en tiempo de vuelo (TOF) son los artefactos por flujo lento o turbulento y la saturación en cortes gruesos. Las secuencias CE-MRA no sólo minimizan la sobreestimación de las estenosis por flujo turbulento, sino que eliminan la limitación de cobertura que provoca la saturación de la señal en la sangre debida a los pulsos de radiofrecuencia. Además, la gran rapidez de adquisición que se consigue trabajando con los datos del espacio K (Time Resolved MRA) permite separar las fases venosa y arterial de forma efectiva16. Todos estos factores muestran su mayor utilidad en el estudio de los troncos supra-aórticos (TSA)17 donde la ARM con contraste no es ya una alternativa diagnóstica sino la principal indicación, en competencia con la Angio-TC. En estudios vasculares cerebrales, la CE-MRA es la primera indicación en el estudio de senos venosos y es de gran utilidad en el diagnóstico de malformaciones vasculares, especialmente en las fístulas, (fig. 3) donde la detección de venas en fases precoces puede ser el único signo diagnóstico. Los imanes de 3T también han supuesto un importante avance en las secuencias TOF (fig. 4) ya que el aumento de T1 disminuye la saturación de la sangre lo cual permite ver vasos más pequeños y distales18. En el caso de los aneurismas, la resolución espacial es una limitación en los imanes de 1.5T lo cual ha situado a la angio-TC como primera indicación por encima de la angio-RM. Sin embargo con 3T es posible adquirir estudios 3D-TOF con matrices de 1.024×1.024 píxel en tiempos razonables19,20 por lo que probablemente con la generalización de los imanes de 3T, el estudio de los aneurismas se realizará principalmente con angio-RM.
Las técnicas de difusión isotrópica son las que más claramente se han incorporado al uso clínico, por su facilidad de adquisición e interpretación. La aplicación que lanzó la difusión al entorno clínico fue el estudio de las lesiones isquémicas, pero hoy la difusión tiene un papel relevante en otras aplicaciones, como el diagnóstico diferencial entre absceso y tumor21, la detección precoz de la enfermedad de Creutzfeldt-Jakob22 y en la caracterización de tumores cerebrales23. En el seguimiento de los gliomas la difusión va a tener un papel relevante ante los nuevos tratamientos con fármacos antiangiogénicos24 ya que tienen un efecto directo sobre la barrera hemato encefálica y la vascularización tumoral, por lo que el efecto antitumoral probablemente será mejor analizado mediante cambios en difusión y espectroscopia. Uno de los inconvenientes de la difusión isotrópica con valor b «convencional» (1.000s/mm2) es el artefacto producido por el efecto T2 (T2-shine-through), que provoca un aumento de señal en las imágenes isotrópicas no relacionado con la reducción de la difusión, lo que hace necesario el uso de mapas de CAD (coeficiente aparente de difusión). Sin embargo, el CAD de las lesiones con reducción moderada de la difusión, como muchos gliomas, es similar al de la sustancia blanca normal, lo que dificulta su análisis, por lo que se recomienda en estos casos añadir secuencias de difusión con valores b más altos (3.000s/mm2)25. Los estudios con valor de b alto, que produce un mayor contraste entre tejido normal y patológico, han probado ser más eficaces para detectar lesiones pequeñas o con baja reducción del CAD, tal como ocurre con algunas lesiones isquémicas o en fases precoces de la enfermedad de Creutzfeldt-Jakob26,27. Aunque es factible obtener estudios con alto valor b en imanes de 1,5T, la incorporación de imanes de 3T con mayor RSR facilita su uso de forma habitual.
La imagen mediante tensor de difusión (DTI) ha supuesto un avance importante ya que ha permitido analizar cambios en las características de la difusión no visibles en los mapas de CAD y en las imágenes isotrópicas (salvo en estudios con valor b muy alto). El estudio de las variaciones en la anisotropía fraccional (FA) de la sustancia blanca permite detectar lesiones en «sustancia blanca aparentemente normal», término acuñado a partir del hallazgo de alteraciones en la FA no visibles con otras secuencias. Los mapas de FA han sido motivo de publicación prácticamente en todos los ámbitos de la neurorradiología, desde las lesiones de sustancia blanca o los tumores cerebrales hasta alteraciones del desarrollo o enfermedades degenerativas, pero en general se trata de estudios de grupos, que aunque muestran resultados interesantes permanecen en su mayoría en el ámbito de la investigación. Los estudios con DTI permiten realizar reconstrucciones tridimensionales del vector principal del tensor, lo que ha dado lugar a la tractografía, una técnica en clara expansión que se utiliza cada vez de forma más habitual en la planificación quirúrgica. La tractografía del tracto córtico-espinal ha sido validada en diferentes trabajos comparativos con estimulación eléctrica profunda28,29 y se han desarrollado programas de fácil manejo que permiten añadir la tractografía a los neuronavegadores, y por tanto ofrecer información útil que permita una neurocirugía lo más funcional y menos lesiva posible. La utilización conjunta de mapas de activación cortical y tractografía (fig. 5) no sólo aporta una información más global sino que potencia la eficacia de ambas técnicas30. Otros tractos que se estudian frecuentemente son el fascículo longitudinal superior, con gran importancia en el lenguaje, y las radiaciones ópticas, pero es necesaria mayor experiencia en estos aspectos ya que la validación es más compleja que en el caso del tracto córtico espinal. Hay que tener en cuenta algunas limitaciones que dificultan el uso generalizado de la tractografía: el posproceso es muy dependiente del operador y además, cuando hay edema -que provoca disminución de la anisotropía- el análisis se vuelve más complejo. Otra limitación de la tractografía es la presencia de cruces de fibras que con las técnicas actuales no pueden ser resueltos y que dan lugar a falsas disminuciones de la anisotropía. Con el objeto de minimizar este problema se están desarrollando programas de postproceso (Q-ball) que descomponen los tensores principales de cada píxel y son capaces de analizar correctamente estas zonas31. La tractografía es un buen ejemplo de la importancia del posproceso (más eficiente y automatizado) en la aplicación clínica de técnicas de imagen avanzadas.
PerfusiónEl estudio de la perfusión cerebral mediante RM es una técnica ya establecida y ampliamente validada, con aplicaciones en el estudio de tumores cerebrales y en patología cerebrovascular, aunque no exenta de limitaciones. Con la tecnología actual que utiliza la inyección de un bolo de contraste (Dinamic Susceptibility Contrast o DSC), es posible obtener en la mayoría de los casos mapas de flujo sanguíneo cerebral relativo (FSCr), volumen sanguíneo cerebral relativo (VSCr) y de tiempo medio de tránsito (TMT) mediante la deconvolución de la función de entrada arterial. Los mapas de VSCr muestran una clara correlación con el metabolismo de los gliomas y su grado de agresividad con valor predictivo de su supervivencia, independientemente de los hallazgos histológicos32. En el caso del infarto hiperagudo, la combinación de mapas de CAD, TMT y VSCr ha permitido aumentar la ventana terapéutica33 aunque el concepto de discordancia (mistmatch) difusión/perfusión continúa siendo objeto de debate y en general se considera que el riesgo de infarto es heterogéneo y el área de penumbra no se corresponde exactamente con el tamaño final del infarto34. La obtención de nuevos parámetros, como la oxigenación local estimada con técnica BOLD35 y la aplicación de modelos predictivos basados en múltiples parámetros (Estimated Voxel-based Risk) va a contribuir a una mejor selección de pacientes con infartos hiperagudos candidatos a terapias recanalizadoras.
La utilización de imanes de 3T mejora significativamente los estudios de perfusión36, no sólo por emplear menos dosis de contraste (es posible obtener estudios de buena calidad con 3–4ml de gadolinio 1M), sino porque la inyección más corta mejora la calidad de las curvas y disminuye el efecto de la permeabilidad. Además, la mejor RSR hace posible estudios de alta resolución, muy útiles en lesiones pequeñas o heterogéneas, o localizadas en la fosa posterior.
Un importante avance en los estudios de perfusión ha sido la incorporación de técnicas de etiquetado de spines (Arterial Spin Labeling o ASL)37, que no necesitan de la inyección de un bolo de contraste ya que utilizan la propia sangre circulante, etiquetada mediante pulsos de radiofrecuencia, como marcador. La ventaja más evidente de esta técnica es que al no emplear contraste es posible utilizarla en niños38 y en pacientes con mala función renal, y además no se producen artefactos debidos a recirculación o a permeabilidad de la barrera hemato-encefálica, lo cual es muy importante en el estudio de tumores cerebrales (fig. 6), ya que permite una estimación más exacta de la perfusión tumoral. En este sentido, también hay que mencionar el avance que representa la introducción de nuevos contrastes de distribución intravascular, que no están influenciados por la permeabilidad de la barrera hemato encefálica. Por otro lado, con la técnica ASL se obtiene una cuantificación absoluta del flujo sanguíneo cerebral, lo cual es fundamental cuando se trata de estudiar alteraciones que producen alteraciones hemodinámicas difusas (tal como ocurre en las enfermedades neurodegenerativas), en las que no es posible obtener valores de referencia normales. La principal limitación de ASL es la escasa RSR, ya que se basa en la substracción de una imagen con sangre sin etiquetar y otra con sangre etiquetada, con diferencias en señal de únicamente un 2% cuando se utilizan equipos de 1,5T. Para compensar esta baja señal es necesario obtener múltiples adquisiciones, pero a medida que aumenta el tiempo total de adquisición los pequeños movimientos provocan errores en la substracción y deterioran el resultado. El empleo de equipos de 3T aporta una ventaja importante ya que al aumentar el T1 de la sangre, la diferencia entre la sangre marcada y sin marcar se incrementa, lo que mejora sensiblemente la calidad de estos estudios39. Las secuencias actuales obtienen únicamente valores de flujo sanguíneo y esto representa una limitación, pero se están desarrollando secuencias con múltiples tiempos de etiquetado que permiten de forma automática obtener valores de TMT y volumen sanguíneo40.
Glioma de alto grado con afectación del esplenio del cuerpo calloso. El estudio de perfusión con «Dinamic Susceptibility Contrast» (A) muestra una pequeña zona de aumento del volumen sanguíneo cerebral regional, que es más evidente en el estudio de perfusión con «Arterial Spin Labeling» (B), que coincide con el área hipermetabólica en la misma localización de la imagen corregistrada con PET-RM (C).
La espectroscopia por resonancia magnética de protón (1H-ERM) es una técnica que permite determinar in vivo la concentración de diferentes metabolitos en regiones determinadas de un tejido. En el tejido cerebral normal, la 1H-ERM muestra resonancias atribuidas principalmente al N-acetilaspartato (NAA), creatina y fosfocreatina (Cr), y a compuestos que contienen colina (Cho). Los cambios en la concentración relativa de estos metabolitos, así como la aparición de otros, que en condiciones normales no son identificables, son un reflejo de los cambios patológicos que se producen en una zona determinada del parénquima cerebral.
El comienzo del uso clínico de la 1H-ERM estuvo marcado por la automatización, tanto en la obtención del espectro (proceso complejo y laborioso) como en la cuantificación de los metabolitos. La 1H-ERM de vóxel simple (VS) es la más utilizada ya que produce espectros más robustos y con mejor resolución de picos, y probablemente el avance en su utilización no ha sido tanto técnico como estratégico: comenzar a utilizar la espectroscopia como un dato más en el seno de una exploración con RM en vez de hacerlo de forma independiente. De esta manera, aunque la sensibilidad y especificidad en tumores no es alta de forma aislada, la asociación con otras secuencias de RM aumenta la eficacia global en el diagnóstico.
La 1H-ERM multivóxel (MV) ha sido uno de los grandes avances de la técnica, ya que hace posible obtener una gran cantidad de espectros de pequeño tamaño, lo que junto a la posible adquisición en 3D, permite estudiar la mayor parte del cerebro en una sola adquisición. Por otro lado, es posible, mediante programas automáticos, obtener mapas de metabolitos (Chemical Shift Imaging o CSI) que pueden incluirse dentro de las técnicas de imagen molecular. Las lesiones focales, especialmente las pequeñas o heterogéneas representan un serio problema cuando se usan los volúmenes habituales en la 1H-ERM de VS (8ml). Por otro lado en el estudio de tumores puede ser necesario estudiar múltiples áreas. La 1H-ERM MV permite superar estos inconvenientes41 aunque el volumen de cada vóxel no suele ser inferior a los 4ml. La escasa resolución espacial, junto con el largo tiempo de adquisición, especialmente cuando se utilizan técnicas 3D, siguen siendo importantes limitaciones de la 1H-ERM.
La incorporación de imanes de 3T ha supuesto un gran avance en la 1H-ERM42, ya que tanto la capacidad de resolución de picos como la RSR son directamente proporcionales al campo magnético. Además el empleo de equipos de 3T disminuye al 50% el tiempo de adquisición (dependiendo del TE empleado) y permite disminuir significativamente el tamaño del vóxel43. La principal aplicación de la 1H-ERM MV es el estudio inicial de tumores cerebrales, aún de pequeño tamaño44 o en la evaluación de los cambios post-tratamiento (fig. 7). Por otro lado, la mayor resolución de picos en 3T permite analizar metabolitos como la taurina, glutamato o GABA que no es posible analizar con equipos de 1,5T lo cual puede abrir nuevas posibilidades diagnósticas.
RM cerebral que muestra un resto de un oligodendroglioma intervenido (A). La espectroscopia de vóxel simple con volumen de adquisición de 8ml (D) muestra un patrón poco significativo, con relativa conservación de NAA y escaso aumento de Cho, debido al volumen parcial con el tejido cerebral normal. El estudio multivóxel con vóxels de 4ml (B y E) muestra un patrón similar, pero el estudio multivóxel con vóxel de 1ml (C,F) muestra en la zona del resto tumoral una marcada disminución de NAA y aumento de Cho, además de un pico más llamativo en la frecuencia del lactato.
La RM funcional es una técnica de imagen cuyo contraste se fundamenta en los cambios que se producen en el lecho capilar en la concentración relativa de oxihemoglobina y desoxihemoglobina, inducidos por un incremento de la actividad cerebral. La RM funcional se define, por tanto, de forma más adecuada como RM BOLD (Blood Oxygenation Level Dependent o nivel de oxigenación de la sangre), lo que permite diferenciarla de otras técnicas funcionales de RM.
Cuando existe un incremento de la actividad cerebral se produce un incremento de la actividad sináptica local, que provoca un aumento del flujo sanguíneo local (vasodilatación) y del consumo de glucosa. Este aumento en el flujo sanguíneo no se acompaña, sin embargo, de un aumento en el consumo tisular de oxígeno, lo cual induce un aumento proporcional en la concentración relativa de oxihemoglobina con relación a la de deoxihemogobina. Como consecuencia de estos cambios se produce una reducción del efecto paramagnético sobre los protones vecinos que experimentan, por tanto, una menor pérdida de magnetización transversal, detectable en secuencias ponderadas en T2 o de forma más sensible con secuencias T2*, con el consiguiente aumento de la señal de resonancia en las áreas corticales activadas.
La RM BOLD se encuentra en los primeros puestos en cuanto a número de publicaciones sobre técnicas en RM desde poco después de sus inicios a principios de los años 90 y continúa manteniendo un alto interés, tanto desde el punto de vista del desarrollo técnico como por sus aplicaciones, que poco a poco se incorporan a la clínica, sobre todo en el estudio del sistema motor y del lenguaje. La señal BOLD combina varios factores (flujo sanguíneo regional, volumen sanguíneo regional y extracción de oxígeno) y es una medida indirecta de la actividad cortical, (no siempre coincidente con los cambios eléctricos, cuya relación con el fenómeno BOLD todavía no es bien conocida)45. Para aplicar la RM BOLD en la planificación quirúrgica hay que disponer de datos robustos, cuantificables y fácilmente interpretables, lo que requiere un sistema de RM de altas prestaciones y programas de posproceso sofisticados.
El uso clínico más habitual de esta técnica es la identificación prequirúrgica de zonas funcionalmente críticas (motoras, sensitivas, lenguaje) con relación a lesiones quirúrgicamente tratables (tumores cerebrales, malformaciones cerebrales, epilepsia del lóbulo temporal), con el objeto de facilitar la práctica de una cirugía lo más funcional y menos lesiva posible. Pero, además del campo neuroquirúrgico la RM BOLD se está utilizando en la actualidad en dos campos como son: a) el estudio de la anatomía funcional normal con el objeto de incrementar el conocimiento de los circuitos neuronales implicados en el procesos motores, sensitivos, cognitivos y emocionales y cómo éstos se modifican con la experiencia, práctica o aprendizaje (neuroplasticidad en sujetos normales), y b) investigar diferencias entre pacientes con procesos neurológicos o psiquiátricos y sujetos sanos con el objeto de comprender los cambios funcionales inducidos por la enfermedad y los mecanismos a través de los cuales el cerebro se adapta o reorganiza (neuroplasticidad en pacientes) frente a lesiones que afectan los circuitos neuronales (traumatismos craneoencefálicos, infartos cerebrales, enfermedades neurodegenerativas y desmielinizantes y procesos neuropsiquiátricos).
Los estudios que han sido validados en el entorno clínico son los de área motora primaria, y han demostrado muy buena correlación con la electrocorticografía46,47. El empleo de imanes de 3T mejora la RSR de la RM BOLD en más del 100%, lo que aumenta la sensibilidad para detectar áreas de activación, sobre todo en regiones cercanas a la lesión o en áreas de edema vasogénico (fig. 8). Los estudios de dominancia hemisférica para el lenguaje han demostrado muy buena correlación con el test de Wada en pacientes epilépticos48, pero la correlación es más variable cuando se trata de tumores, ya que la existencia de edema o infiltración tumoral puede alterar el efecto BOLD («pseudorreorganización»)49 por lo que en estos casos la ausencia de cambios en la secuencia BOLD no descarta la ausencia de actividad cortical. Una posible alternativa a las secuencias BOLD son las secuencias ASL. Los mapas de flujo sanguíneo obtenidos con esta técnica son más robustos y menos sensibles a artefactos que las secuencias EPI (son las utilizadas rutinariamente en los estudios de RM BOLD), pero su introducción en la clínica requiere mejorar la sensibilidad (probablemente con la ayuda del aumento del campo magnético) y definir protocolos clínicos validados.
Estudio de activación motora en un tumor precentral izquierdo con técnica BOLD realizada con los mismos parámetros pero con baja resolución (A) y alta resolución (B). Los mapas de activación sobre las imágenes obtenidas con secuencia eco-planar demuestran áreas de activación adyacentes al tumor, visibles en el estudio de alta resolución que no se observan en el estudio de baja resolución.
La aparición de la tecnología de multidetectores ha permitido desarrollar nuevas aplicaciones en el estudio del sistema nervioso central con TC50. Una de las grandes ventajas de esta técnica es la rapidez en la adquisición y la capacidad de reconstrucción multiplanar, lo que ha facilitado el estudio de la patología aguda cráneo-encefálica o espinal. La capacidad de reconstrucción multiplanar también es muy útil en estudios de cuello y columna, pero probablemente el avance más significativo de la TC multidetector en neurorradiología ha sido la posibilidad de realizar estudios vasculares de alta resolución (angio-TC).
La angio-TC es una exploración de ejecución relativamente sencilla, con pocos artefactos, muy robusta y con una resolución espacial muy superior a la angio-RM obtenida con imanes de 1,5T51. La angio-TC de troncos supraaórticos en el estudio patología cerebro-vascular y la angio-TC cerebral en el caso de aneurismas y malformaciones vasculares se han ganado un merecido sitio entre las herramientas neurorradiológicas; incluso existe polémica acerca de la primera indicación (angio-RM o angio-TC), aunque la dosis de radiación y los riesgos del contraste yodado han de tenerse siempre presentes. En la práctica, la mayor parte de los estudios vasculares intracraneales se realizan con RM, salvo el caso de los aneurismas, donde además de la gran importancia de la resolución espacial, que es mejor en la angio-TC, la rapidez de adquisición (especialmente en pacientes con hemorragia subaracnoidea en malas condiciones) es un factor fundamental. Las RM de 3T, con excepcional sensibilidad para detectar áreas de hemorragia y la mayor rapidez y resolución espacial, favorecen el estudio de estos pacientes con angio-RM.
Una de las indicaciones en las que la angio-TC demuestra todo su valor es en el estudio de las malformaciones vasculares espinales52. La gran cobertura anatómica de la TC multidetector, que puede superar ampliamente los 45cm (importante en los estudios espinales donde es recomendable estudiar al menos desde C5 hasta S2), y la gran resolución espacial necesaria para estudiar la vasculatura medular (fig. 9), así como la rapidez de adquisición han motivado que en muchos centros de referencia sea la angio-TC el examen de primera indicación ante la sospecha diagnóstica de una malformación vascular espinal. La angio-RM con contraste, sobre todo con las técnicas de alta resolución temporal, tiene la ventaja de poder separar la fase arterial y venosa, lo cual es muy interesante en las fístulas durales (las malformaciones vasculares más frecuentes en adultos). No obstante los estudios vasculares medulares, por su complejidad, probablemente se beneficien de la combinación de angio-TC y angio-RM53, con el propósito fundamental de confirmar la existencia de una malformación y sugerir su tipo y origen, lo cual facilita la realización de la arteriografía y disminuye al 50% la dosis de contraste y también de radiación.
Fístula dural perimedular dependiente de la arteria hipogástrica izquierda. En la secuencia T2 (A) se observa un extenso edema medular asociado a un dudoso engrosamiento de venas perimedulares posteriores que se confunde por la presencia de artefactos de flujo del líquido cefalorraquídeo. En la angio-RM con técnica TRICKS (B) se observa tortuosidad en la vena medular anterior, de forma similar al estudio vascular obtenido mediante angio-TC (C), aunque gracias a la mayor cobertura de ésta, que permite alcanzar niveles sacros (D,E) se puede observar la relación con la arteria hipogástrica izquierda, que se confirma en el examen angiográfico realizado por vía intrararterial (F).
Los estudios de perfusión con TC se han utilizado sobre todo en el estudio de la isquemia aguda, como una alternativa a la perfusión con RM, aprovechando la mayor rapidez y facilidad de ejecución así como su mayor accesibilidad. Si bien inicialmente los estudios de perfusión por TC presentaban grandes limitaciones en cuanto a la cobertura anatómica, con la tecnología actual es posible estudiar todo el parénquima cerebral54. Con los programas de procesamiento actuales es posible obtener y analizar diferentes mapas hemodinámicos, como son los de VSC, TMT y FSC. En tumores cerebrales los estudios de perfusión por TC pueden ofrecer información complementaria a las técnicas de RM, sobre todo en áreas cercanas al hueso o cuando existen artefactos por sangrado o calcificaciones.
Imagen multimodal (PET-TC, PET-RM)La tomografía por emisión de positrones (PET) puede obtener imágenes moleculares (MI) con una sensibilidad muy por encima de las mejores técnicas de la RM, aunque con una resolución espacial relativamente baja y sin información fiable sobre la localización anatómica. La integración con la TC ha supuesto un gran avance ya que además de optimizar la medición del depósito del radiofármaco (mejora del cálculo de atenuación en profundidad), permite localizar con mucha mayor precisión las alteraciones que se observen en la MI55. Numerosas publicaciones han demostrado la enorme ventaja que supone obtener simultáneamente imágenes metabólicas y estructurales mediante equipos de PET-TC. Este tipo de exploraciones ha puesto de manifiesto la urgente necesidad de formación integral por parte de los especialistas en radiología y en medicina nuclear y ha dado lugar a un plan de acción europeo para poder abordar este tipo de exploraciones que probablemente supondrá un paso más hacia la unión de estas dos especialidades.
Si la integración estructural y molecular en la PET-TC ha demostrado una mejora en la eficiencia diagnóstica, la posibilidad de integrar PET y RM podría aún aportar más ventajas56. La RM en sí misma constituye una verdadera imagen multimodalidad, ya que integra diferentes imágenes estructurales (cada una con diferente contraste) con imágenes «fisiológicas o funcionales» (perfusión, difusión, RM BOLD) y metabólicas (imagen por espectroscopia). La integración de imágenes de PET en la RM es relativamente sencilla en el caso del cerebro, ya que basta con fusionar las imágenes de RM con TC (que ya está corregistrado con PET) y automáticamente se obtiene la fusión PET-RM (fig. 10). La fusión automática o semiautomática de RM y TC es hoy muy fácil y exacta, tanto si se utilizan puntos fiduciales externos como utilizando puntos de referencia internos visibles en las dos modalidades57. Recientes publicaciones han demostrado el valor añadido de las imágenes PET-RM para analizar lesiones pequeñas o sutiles como en alteraciones del desarrollo cortical58,59.
Displasia cortical tipo I en el lóbulo occipital derecho. En la secuencia FLAIR (A) se observa una leve disminución de la diferenciación córtico-subcortical, que en otras secuencias no presentaba alteraciones evidentes. La imagen de PET con glucosa (B) muestra discreto hipometabolismo occipital derecho. En la imagen corregistrada PET-RM se puede observar la coincidencia de ambas alteraciones, que conjuntamente ofrecen un diagnóstico más fiable.
Existen intensas investigaciones para desarrollar aparatos con PET y RM integrados60,61, aunque técnicamente es complejo. El desarrollo de este tipo de sistemas presenta algunas ventajas importantes. Una de ellas es evitar la radiación que supone realizar una TC, sobre todo en el caso de los estudios de cuerpo entero. En el caso de estudios cerebrales la dosis con TC es baja y la fusión con RM es fácil, por lo que la ventaja principal es la posibilidad de obtener estudios funcionales adquiridos simultáneamente con RM BOLD y PET, lo cual es muy interesante en investigación, aunque por el momento la utilidad clínica de esta aplicación no está demostrada. No obstante, es posible que en el futuro si las dificultades técnicas se superan y el coste no es muy elevado, los estudios PET-RM se incorporen al entorno clínico ya que además supondrían un aumento en la productividad y comodidad para el paciente al poder realizarse las dos exploraciones en el mismo tiempo.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.