El cáncer esofágico tiene un comportamiento agresivo con alta mortalidad. La ausencia de serosa y su peculiar drenaje linfático hacen que se diagnostique en estadios avanzados. La 8.ª edición TNM (2017) armoniza la atención del cáncer esofágico en todo el mundo e incluye no solo pacientes tratados con esofagectomía aislada, sino aquellos que han recibido tratamiento neoadyuvante con quimioterapia y/o radioterapia. Como novedad establece clasificaciones separadas y relacionadas temporalmente con el cáncer: un estadio clínico previo al tratamiento (cTNM), patológico tras esofagectomía (pTNM) y patológico posneoadyuvante (ypTNM). La combinación de la ecoendoscopia, tomografía computarizada (TC), tomografía por emisión de positrones asociada a TC y resonancia magnética proporciona la mayor precisión posible en la determinación del estadio clínico, y son esenciales para la planificación del tratamiento y evaluación posneoadyuvancia. El tratamiento principal sigue siendo la esofagectomía, que es la cirugía gastrointestinal electiva con mayor mortalidad y acarrea múltiples complicaciones: fugas anastomóticas, complicaciones pulmonares, técnicas y funcionales.
Cancer of the esophagus is an aggressive cancer with high mortality. Because of the esophagus's lack of serosa and its peculiar lymphatic drainage, esophageal cancer is diagnosed in advanced stages. The eighth edition of the TNM (2017) aims to standardize care for esophageal cancer throughout the world; it includes not only patients treated with esophagectomy alone, but also those receiving neoadjuvant chemotherapy and/or radiotherapy. One new development in the eighth edition is that it establishes separate classifications for different time periods, with pathologic stage groups for prior to treatment (cTNM), after esophagectomy (pTNM), and after neoadjuvant therapy (ypTNM). The combined use of endoscopic ultrasound, CT, PET-CT, and MRI provides the greatest accuracy in determining the clinical stage, and these techniques are essential for planning treatment and for evaluating the response to neoadjuvant treatment. Esophagectomy continues to be the main treatment; it is also the elective gastrointestinal surgery that has the highest mortality, and it carries the risk of multiple complications, including anastomotic leaks, pulmonary complications, technical complications, and functional complications.
El cáncer de esófago (CE) es el octavo más frecuente en todo el mundo y el tercero entre los de origen gastrointestinal1. Se observa principalmente en hombres de edad avanzada2. Existen dos tipos principales, dependiendo de las células histopatológicas1. El carcinoma de células escamosas (CCE) es más frecuente globalmente (90%), si bien en los últimos tiempos se ha visto una disminución significativa en los países occidentales. Este cáncer se asocia al consumo de alcohol y tabaco, y es más frecuente en el tercio superior y medio esofágicos3. El adenocarcinoma (ADC) es en la actualidad el CE más común en países occidentales. Se asocia a la enfermedad por reflujo gastroesofágico y a la obesidad, y asienta en el esófago distal en el 75% de los casos1. El CE tiene un comportamiento agresivo con alta mortalidad. Suele diagnosticarse en estadios avanzados, en parte por ciertas peculiaridades de este órgano, como la ausencia en su pared de capa serosa o la complejidad de sus vías de drenaje linfático1,2.
La 8.ª edición del manual de estadificación del cáncer del American Joint Committee on Cancer (AJCC) representa los mejores datos de estadificación del CE y unión esofagogástrica (UEG) disponibles actualmente en todo el mundo4. El sistema TNM (T: tumor; N: ganglios; M: metástasis) que utiliza la AJCC es el sistema estándar internacionalmente aceptado para la estadificación del cáncer y es un factor importante que influye en el pronóstico y las decisiones de tratamiento. La 8.ª edición TNM armoniza la atención del CE en todo el mundo e incluye no solo pacientes tratados con esofagectomía aislada, sino aquellos que han recibido terapia neoadyuvante con quimio y/o radioterapia4.
El objetivo de este trabajo es realizar una revisión actualizada del CE utilizando la última clasificación TNM, la octava (2017). Además, se revisarán las complicaciones que pueden surgir del propio tumor primario esofágico y las complicaciones posquirúrgicas de la esofagectomía, que sigue siendo el tratamiento principal para la enfermedad local o localmente avanzada, y en las que el radiólogo tiene un papel fundamental.
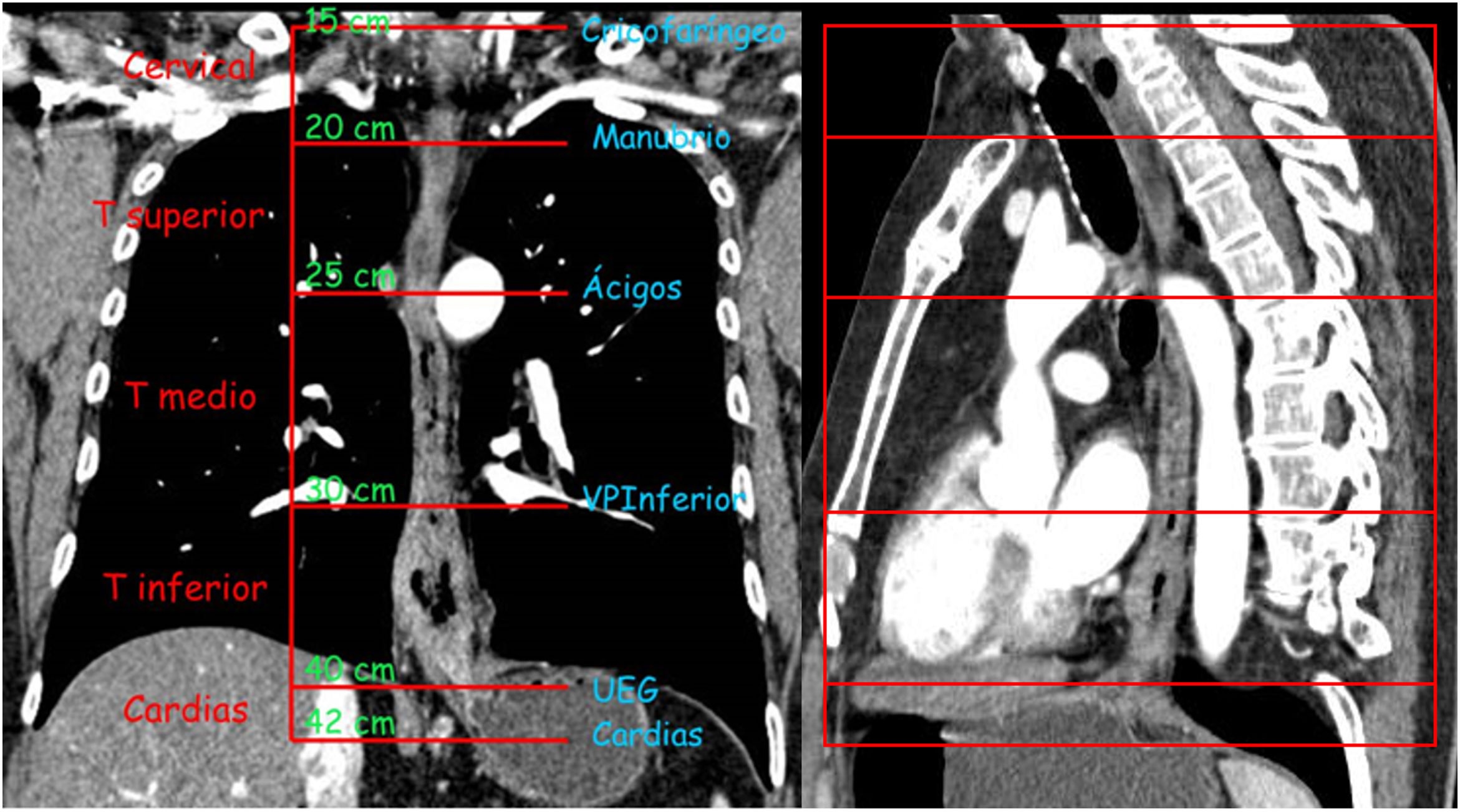
Recuerdo anatómicoEl esófago se divide en tres compartimentos anatómicos: cervical, torácico y abdominal. El esófago torácico se divide además en superior, medio e inferior (fig. 1). Sin embargo, la importancia clínica del CE radica en su relación anatómica con las estructuras adyacentes más que con su localización en el esófago4 (tabla 1).
Relaciones anatómicas de los compartimentos esofágicos
| Esófago cervical | TráqueaTiroidesArterias carótidasVértebras |
| Esófago torácico superior | TráqueaArco aórtico y grandes vasosVena ácigosVértebras |
| Esófago torácico medio | Hilios pulmonaresAurícula izquierdaAorta torácica descendenteVena ácigosVértebras |
| Esófago torácico inferior/Unión esofagogástrica | Aurícula izquierdaAorta torácica descendenteVena ácigosVértebras |
Esófago cervical: anatómicamente se localiza en el cuello, limitado superiormente por la hipofaringe e inferiormente por la escotadura esternal. Aunque existe cierta variabilidad, la longitud típica del esófago cervical medida endoscópicamente desde los incisivos es de 15 a 20cm4.
Esófago torácico superior: está limitado superiormente por la escotadura esternal e inferiormente por el borde inferior de la vena ácigos. La medida endoscópica típica es de 20 a 25cm4.
Esófago torácico medio: está limitado superiormente por el borde inferior de la vena ácigos e inferiormente por el borde inferior de la vena pulmonar inferior. La medida endoscópica es de 25 a 30cm4.
Esófago torácico inferior/Unión esofagogástrica: está limitado superiormente por el borde inferior de la vena pulmonar inferior e inferiormente por el estómago. El esófago torácico inferior normalmente cruza el diafragma hasta llegar al estómago, pero suele haber una porción esofágica intrabdominal variable. La parte del esófago abdominal se incluye en la del esófago torácico inferior. La medida endoscópica es de 30 a 40cm4.
La pared esofágica cuenta con cuatro capas: mucosa, submucosa, muscular propia y adventicia. La mucosa se compone de epitelio, lámina propia y la muscularis mucosae (formada por una capa longitudinal de músculo liso). La capa submucosa es una capa de tejido conectivo fibroelástico que contiene vasos sanguíneos y linfáticos. La muscular propia consta de una capa interna de fibras musculares circulares y una capa externa de fibras longitudinales. Rodeando la capa muscular no hay capa serosa; la adventicia, que es una capa de tejido conectivo, se apoya directamente en la muscular propia5.
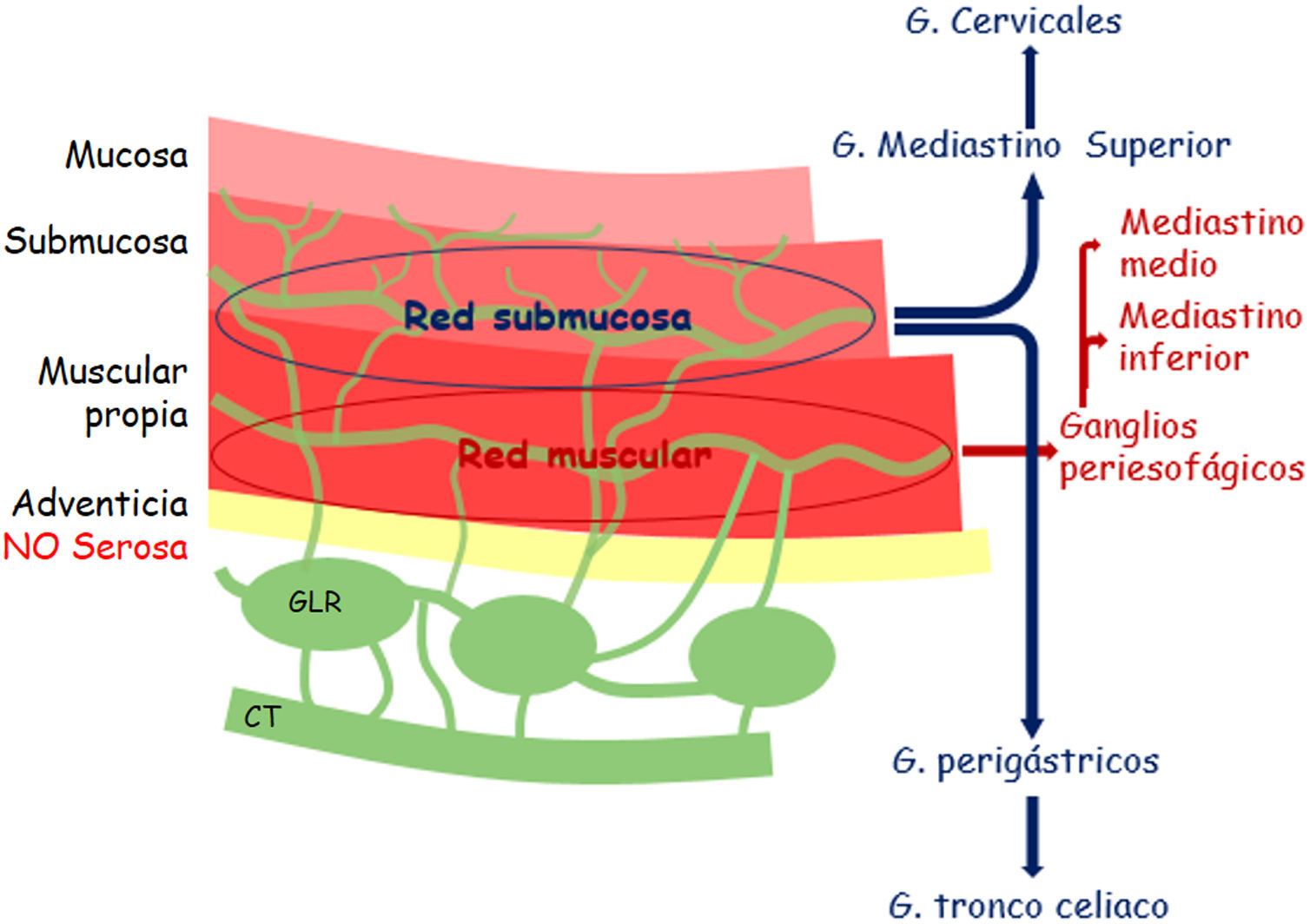
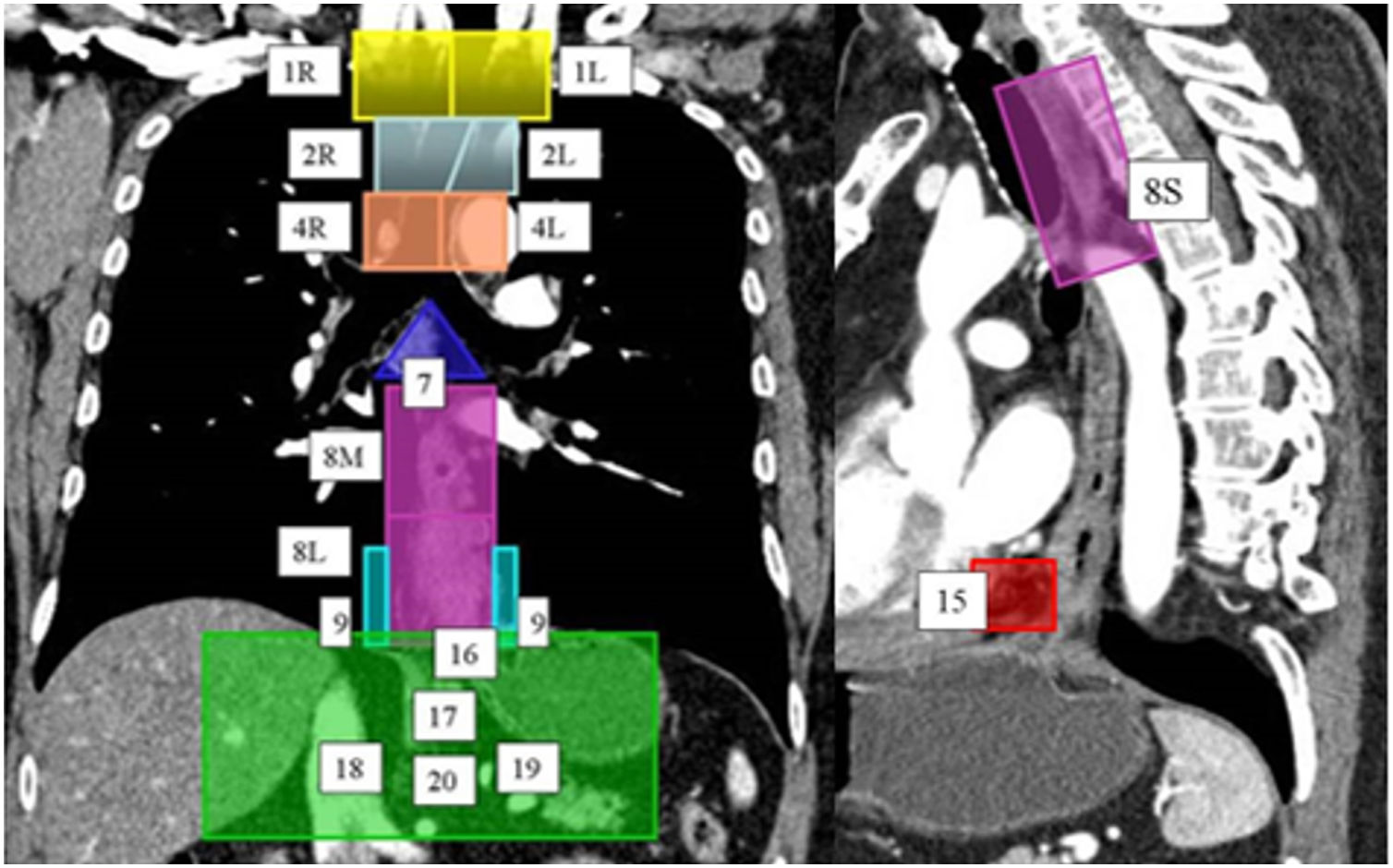
El drenaje linfático esófagico es intramural y longitudinal. Hay plexos linfáticos en cada capa esofágica, pero la red linfática está principalmente desarrollada en la capa submucosa y la lámina propia, y menos en la capa muscular y la adventicia. La densa red linfática de la submucosa es ininterrumpida y se continúa con la red linfática de la capa submucosa de la faringe y el estómago. En general, los dos tercios superiores del esófago drenan cranealmente y el tercio inferior caudalmente. El plexo submucoso puede unirse a los ganglios linfáticos regionales sin necesidad de conexión con el plexo linfático muscular. Además, puede drenar directamente al conducto torácico (CT), que ocurre aproximadamente en el 43% de las ocasiones4,6,7. Por último, puede unirse también al plexo linfático muscular, que está conectado al sistema linfático extramural6. De esta manera, aunque el tumor esofágico esté limitado a la submucosa, las células tumorales pueden diseminarse craneocaudalmente a lo largo del plexo submucoso y provocar afectación ganglionar lejos de la localización del tumor primario4,7. Es importante destacar, por tanto, que la presencia de ganglios patológicos a distancia no es indicativa de enfermedad avanzada. Cuando el tumor invade la capa muscular, aumenta la posibilidad de que se afecten también ganglios esofágicos y cadenas mediastínicas7 (fig. 2). El mapa de ganglios linfáticos más utilizado es el descrito por el AJCC para la estadificación del cáncer de esófago (fig. 3).
Capas de la pared del esófago y distribución del sistema linfático. Las células tumorales pueden extenderse cranealmente a ganglios del mediastino superior y cervicales, y caudalmente a ganglios perigástricos y celiacos. Cuando la red muscular está afectada, es más frecuente visualizar, aparte de los ganglios antes descritos, los periesofágicos y mediastínicos medio e inferiores. GLR: ganglio linfático regional; CT: conducto torácico.
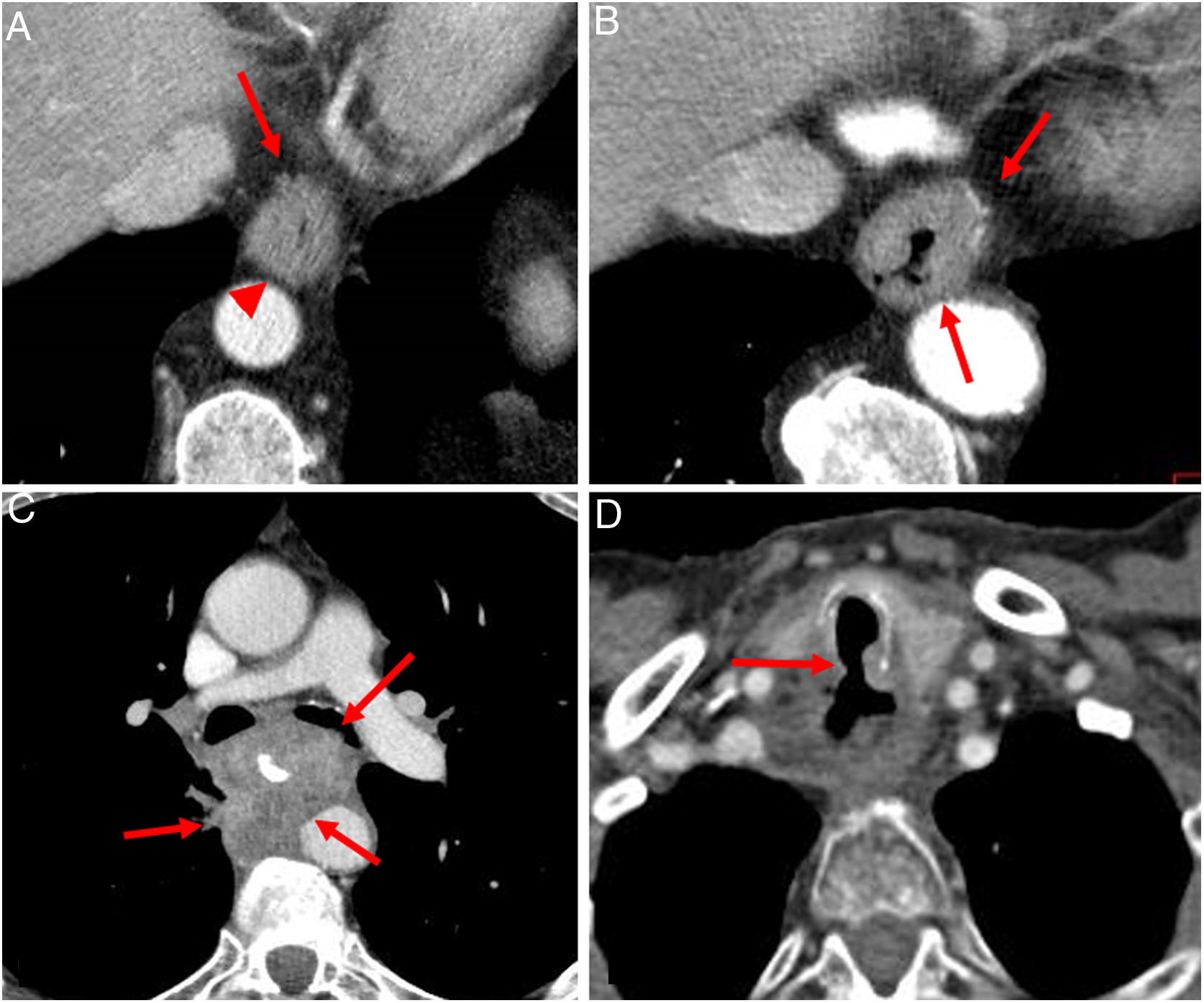
Cadenas de drenaje linfático del esófago. En una tomografía computarizada con reconstrucción coronal y sagital, utilizando colores y números, se muestra el mapa de ganglios linfáticos propuesto por el American Joint Committee on Cancer para la estadificación del cáncer de esófago. Cadenas ganglionares paratraqueales cervicales inferiores derechas (1R) e izquierdas (1L); paratraqueales superiores derechas (2R) e izquierdas (2L); paratraqueales inferiores derechas (4R) e izquierdas (4L); subcarinales (7); paraesofágicas torácicas superiores (8S), torácicas medias (8M) y torácicas inferiores (8L); del ligamento pulmonar derecho (9R) e izquierdo (9L); diafragmáticas (15); paracardiacas (16); gástricas izquierdas (17); de la hepática común (18); esplénicas (19), y celiacas (20).
La 8.ª edición del manual de estadificación del CE del AJCC se basa en datos actualizados, con un tamaño de muestra significativamente mayor y un número mayor de variables de ajuste de riesgo en comparación con la 7.ª edición4. Se utilizaron datos recopilados por la Worldwide Esophageal Cancer Collaboration, que abarcaba información de 33 centros y 22 654 pacientes2,4.
De manera resumida, las principales conclusiones que se obtuvieron fueron las expuestas a continuación2. Por un lado, la estadificación clínica, basada principalmente en la imagen, continuaba siendo inexacta. La estadificación clínica para la toma de decisiones y el pronóstico se basaba hasta la fecha en los grupos de estadios patológicos correspondientes. Se observó que la estadificación clínica no podía basarse en la estadificación posterior al tratamiento como lo había hecho en el pasado, y requirió de su propia agrupación por estadios. Por otro lado, la estadificación patológica basada solo en la esofagectomía estaba perdiendo relevancia para el cáncer en estadios avanzados. Sin embargo, seguía siendo relevante para los cánceres en etapa temprana y como punto de referencia de estadificación y supervivencia. Por último, dado que la terapia neoadyuvante afecta a la profundidad de la invasión del cáncer (T), a las metástasis de los ganglios linfáticos regionales (N) y a las metástasis a distancia (M) de forma diferente, este tratamiento produce combinaciones del TNM, y por lo tanto de su supervivencia, diferentes en comparación con el tratamiento único de esofagectomía. Es por esto por lo que se desarrolló también una estadificación separada del cáncer esofágico tras la terapia neoadyuvante.
En la 8.ª edición, las características individuales del cáncer pasan a denominarse categorías. El CE cuenta con categorías anatómicas [tumor primario (T), ganglios linfáticos regionales (N), metástasis a distancia (M)] y no anatómicas [tipo de célula histopatológica, grado histológico (G), localización (L)]. Un estadio de cáncer se considera la agrupación de categorías de un cáncer que refleja el pronóstico. Estos estadios pueden definirse en varios puntos de la historia de la vida y atención médica del paciente con cáncer, y se designan como clasificaciones del cáncer. En esta última edición de TNM para el CE y las UEG se incorpora como principal novedad clasificaciones separadas y relacionadas temporalmente para los CE y las UEG: un estadio clínico previo al tratamiento (cTNM), un estadio patológico tras esofagectomía (pTNM) y un estadio patológico posneoadyuvante (ypTNM)2,4.
El estadio cTNM se basa en el examen físico y la imagen, y raramente en el examen microscópico de muestras de biopsia. Está limitado por la resolución y la precisión de cada técnica de imagen. Por este motivo, la composición del grupo estadio clínico y los perfiles de supervivencia difieren de los del grupo estadio patológico. Las recomendaciones actuales para el estadio clínico incluyen el uso complementario de la ecografía endoscópica (EE) con o sin punción-aspiración con aguja fina (PAAF), la tomografía computarizada multidetector (TCMD), la tomografía por emisión de positrones asociada a la tomografía computarizada (PET-TC) y la resonancia magnética (RM)2.
El estadio ypTNM se basa en el tratamiento preoperatorio (quimioterapia±radioterapia) seguido de esofagectomía. Las categorías patológicas posneoadyuvantes se determinan mediante la evaluación patológica de las muestras de esofagectomía2.
El estadio pTNM se basa en el examen histológico tras la esofagectomía aislada. Con el uso cada vez mayor de la terapia neoadyuvante para la mayoría de los cánceres en etapa avanzada, esta estadificación probablemente será la más pertinente para los cánceres en etapa temprana2.
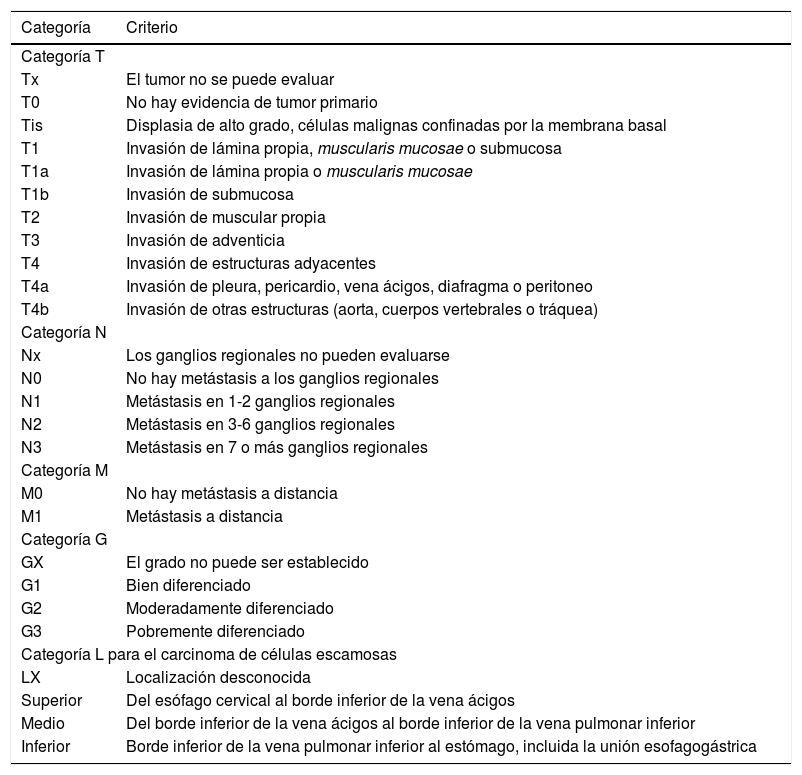
La 8.ª edición TNM para el CCE y ADC esofágicos se mantiene sin cambios en las categorías y subcategorías T, N y M, a excepción de la adición de invasión peritoneal a los criterios para T4a (tabla 2). En esta edición cambia la definición de localización del tumor para todos los cánceres; en la séptima era el borde superior y en la actual es el epicentro (centro geométrico del tejido tumoral) de la lesión. La localización tiene un valor pronóstico en el CCE para los estadios IIA-IIB2,4. Además, se produce un cambio en la definición de los cánceres de la UEG que sustituye a la clasificación de Siewert-Stein. Así, los cánceres que afectan a la UEG y cuyo epicentro se sitúa dentro de los 2 cm primeros del cardias (Siewert tipo I/II) se clasifican como esofágicos. Los que afectan a la UEG y cuyo epicentro queda a más de 2 cm (Siewert tipo III) o, estando en los 2 cm primeros, no afectan a la UEG se clasifican como gástricos2,4.
8.ª edición TNM del American Joint Committee on Cancer para carcinoma de células escamosas y adenocarcinoma esofágicos
| Categoría | Criterio |
|---|---|
| Categoría T | |
| Tx | El tumor no se puede evaluar |
| T0 | No hay evidencia de tumor primario |
| Tis | Displasia de alto grado, células malignas confinadas por la membrana basal |
| T1 | Invasión de lámina propia, muscularis mucosae o submucosa |
| T1a | Invasión de lámina propia o muscularis mucosae |
| T1b | Invasión de submucosa |
| T2 | Invasión de muscular propia |
| T3 | Invasión de adventicia |
| T4 | Invasión de estructuras adyacentes |
| T4a | Invasión de pleura, pericardio, vena ácigos, diafragma o peritoneo |
| T4b | Invasión de otras estructuras (aorta, cuerpos vertebrales o tráquea) |
| Categoría N | |
| Nx | Los ganglios regionales no pueden evaluarse |
| N0 | No hay metástasis a los ganglios regionales |
| N1 | Metástasis en 1-2 ganglios regionales |
| N2 | Metástasis en 3-6 ganglios regionales |
| N3 | Metástasis en 7 o más ganglios regionales |
| Categoría M | |
| M0 | No hay metástasis a distancia |
| M1 | Metástasis a distancia |
| Categoría G | |
| GX | El grado no puede ser establecido |
| G1 | Bien diferenciado |
| G2 | Moderadamente diferenciado |
| G3 | Pobremente diferenciado |
| Categoría L para el carcinoma de células escamosas | |
| LX | Localización desconocida |
| Superior | Del esófago cervical al borde inferior de la vena ácigos |
| Medio | Del borde inferior de la vena ácigos al borde inferior de la vena pulmonar inferior |
| Inferior | Borde inferior de la vena pulmonar inferior al estómago, incluida la unión esofagogástrica |
El radiólogo tiene un papel fundamental en el estadio clínico, ya que se basa principalmente en la imagen. Dada la disparidad de los resultados al comparar el cTNM y el pTNM, está clara la necesidad de modalidades de estadificación clínica más precisa. A continuación, resumiremos el papel actual de las principales técnicas de imagen utilizadas en el diagnóstico del CE.
Ecografía endoscópicaSe considera la prueba de imagen de elección para la estadificación locorregional del CE debido a su fiabilidad y su accesibilidad. La precisión general de la EE para la estadificación del CE oscila entre el 73% y el 93%, dependiendo del estadio8. Se considera la técnica más precisa en la valoración de la cT1.
El CE superficial se define como la malignidad limitada a la mucosa o submucosa, es decir, con profundidad de la invasión tumoral entre Tis y T1b8. Enfermedad avanzada se considera cualquier tumor que se extienda más allá de la submucosa (≥T2). La precisión general de la EE para la valoración de la categoría T es de 79%9 y aumenta al 100% en los tumores T310. La EE no tiene utilidad en tumores estenosantes, que abarcan el 20-36% de los CE8.
La EE es la modalidad más precisa disponible para la determinación de la afectación de los ganglios linfáticos locorregionales. Los criterios ecográficos sugestivos de malignidad incluyen un patrón ecográfico hipoecoico, bordes bien delimitados, contornos redondeados y diámetro superior a 1 cm. Cuando estas cuatro características están presentes, el diagnóstico de malignidad ganglionar en la histopatología puede predecirse con una precisión del 80-100%8. Sin embargo, solo un 25% de los ganglios patológicos muestran las cuatro características. La EE puede detectar ganglios patológicos cervicales, periesofágicos y perigástricos8.
Otra limitación de la EE es la estadificación tras terapia neoadyuvante. Un metaanálisis reciente11 reveló poca sensibilidad y especificidad para la estadificación T y N en pacientes sometidos a EE después de haber recibido quimioterapia. Esto se debe a la inflamación local y fibrosis causada por el tratamiento11. Por otro lado, es importante recalcar que la EE es dependiente de operador.
Tomografía computarizadaLa TCMD es la principal prueba de imagen en la estadificación clínica. Permite estudiar de manera no invasiva el tumor primario, así como metástasis ganglionares y viscerales. Es también la técnica más empleada en la valoración de respuesta a la neoadyuvancia. El estudio de TC para la estadificación clínica del CE suele contar con un estudio toracoabdominal tras la administración de contraste oral e intravenoso. Suele realizarse una primera hélice torácica a los 30 segundos tras la inyección del contraste, que abarca desde la región cervical inferior hasta los senos costofrénicos, y una hélice abdominopélvica a los 70 segundos, desde las cúpulas diafragmáticas hasta las tuberosidades isquiáticas1.
Los hallazgos radiológicos que sugieren un tumor esofágico son un engrosamiento irregular de la pared esofágica superior a 5 mm, la estenosis de la luz excéntrica y la dilatación proximal del esófago12 (fig. 4). La TC tiene un papel limitado en la determinación de la cT. En la mayoría de los estudios comparativos se ha visto que la precisión para la valoración de la categoría T es menor con TC que con EE12. La TC no diferencia adecuadamente la afectación cT1, cT2 y cT312. Sin embargo, es importante en la valoración cT3 y cT4. Los signos que orientan hacia T3 incluyen la extensión extramural sin infiltración de estructuras vecinas y la preservación de planos grasos. Se considera T3 el tejido tumoral indentando en la grasa mediastínica. Los signos que orientan a un T4 son la pérdida de planos grasos entre el tumor y las estructuras mediastínicas y el desplazamiento o deformidad de otras estructuras. El rol más importante de la TCMD en la valoración de la categoría T es la exclusión de la afectación cT44,12 (tabla 3 y fig. 5). La sensibilidad y especificidad de la TC para detectar invasión mediastínica en el cáncer esofágico son 88-100% y 85-100%, respectivamente12.
Carcinoma de esófago centrado en el esófago torácico medio con los hallazgos radiológicos característicos que pueden observarse en la tomografía computarizada multidetector: engrosamiento irregular de la pared esofágica mayor de 5 mm (flecha en la reconstrucción coronal), estenosis de la luz (cabeza de flecha en la reconstrucción sagital) y dilatación proximal (flecha en la reconstrucción sagital).
Hallazgos de tomografía computarizada multidetector sugestivos de invasión local cT4
| Aorta | Contacto ≥ 90Obliteración del triángulo graso entre esófago, aorta y vértebra |
| Tráquea y bronquios | Desplazamiento o deformidad de la pared posteriorFístula traqueoesofágicaCrecimiento del tumor en su luz |
| Pericardio | Engrosamiento pericárdicoDerrame pericárdicoDeformidad cardiaca con pérdida del plano graso pericárdico |
| Peritoneo | AscitisNódulos o placas de partes blandas en la superficie peritonealEstriación de la grasa intrabdominalEngrosamiento y/o realce peritoneal |
Valoración mediante tomografía computarizada multidetector de la profundidad de la invasión tumoral en el cáncer de esófago. A) Engrosamiento asimétrico+irregularidad de la grasa periesofágica (flecha) (cT3 por invasión de la adventicia). Plano graso de separación con la aorta (punta de flecha). B) Engrosamiento+irregularidad de la grasa+contacto con aorta inferior a 90° (flechas): cT3. C) CE cT4b: infiltración de la aorta, bronquio izquierdo y pulmón adyacente (flechas). D) Carcinoma de células escamosas con fístula traqueal (flecha) (cT4b).
Aunque la TC puede utilizarse para la valoración de la extensión ganglionar locorregional, no es óptima en su detección dada su baja precisión (46-58%)12. Los criterios de infiltración ganglionar son ganglios torácicos y abdominales con eje corto mayor de 10 mm, ganglios supraclaviculares superiores a 5 mm, alteraciones morfológicas (redondeados, sin hilio graso, con contorno irregular) y alteraciones de densidad (hipercaptación y necrosis)4,12 (fig. 6).
La TCMD es muy útil en la detección de metástasis a distancia. Es la prueba de imagen más ampliamente utilizada para descartar M1, con una sensibilidad del 90% para la detección de metástasis hepáticas superiores a 1 cm12. El 20-30% de los CE muestran metástasis al diagnóstico y son no-operables12. Las principales localizaciones son el hígado, el pulmón, el hueso, las suprarrenales, el peritoneo y el cerebro4.
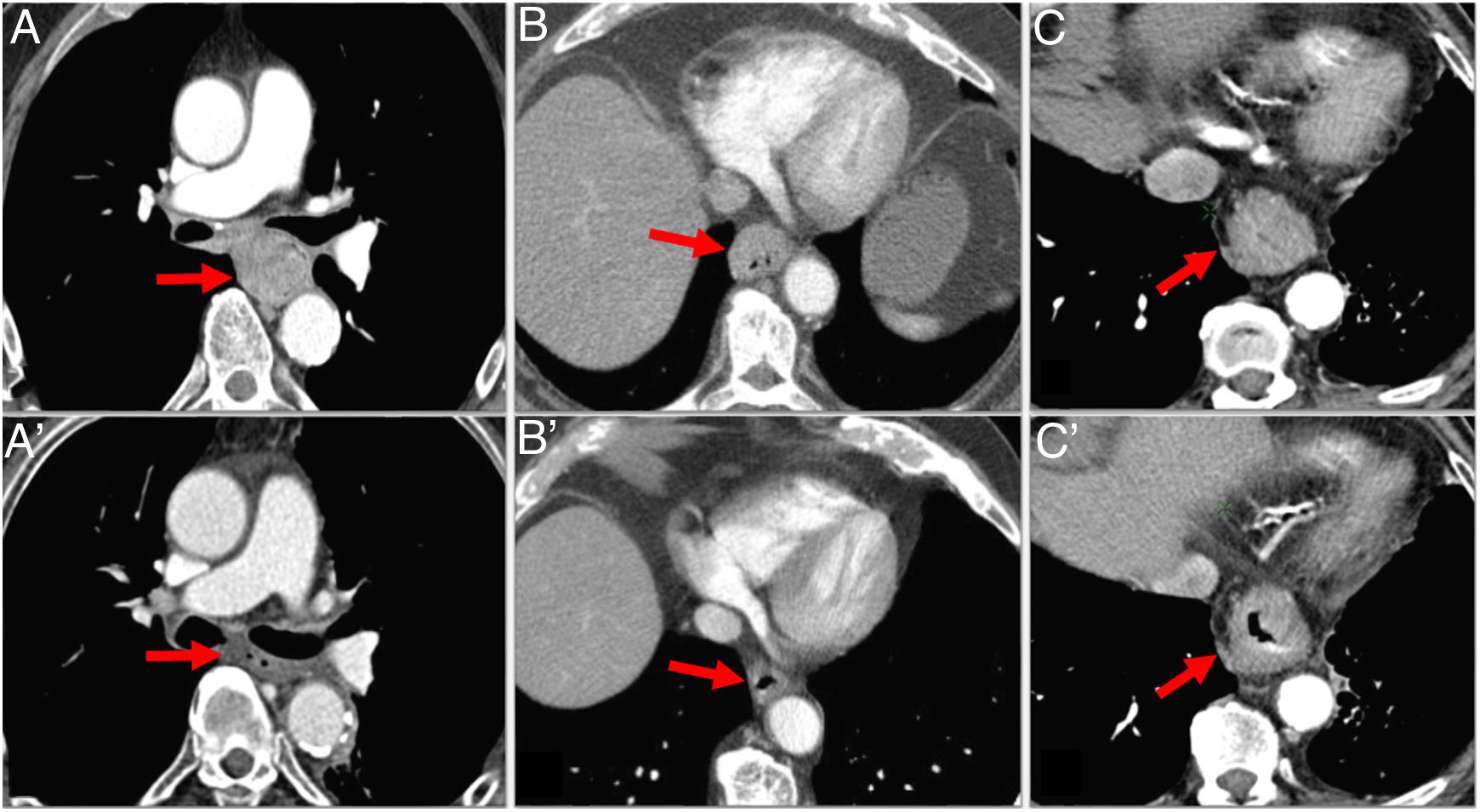
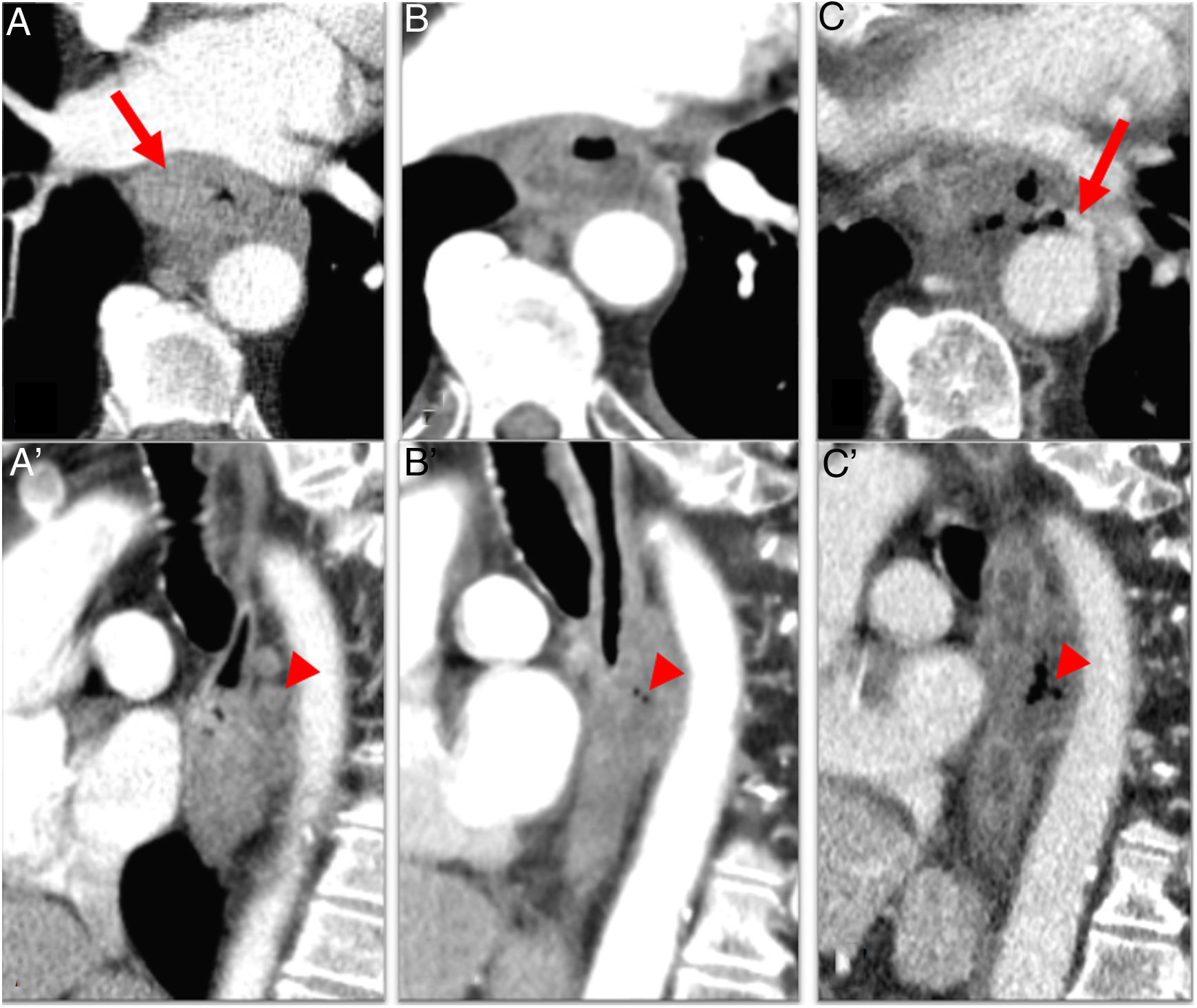
La TCMD es la prueba más utilizada para valorar respuesta posneoadyuvancia1. Las limitaciones de la TC vienen dadas por los cambios postratamiento, como el aumento de densidad de los planos grasos o la no diferencia entre fibrosis-inflamación y tumor viable12. Esto hace que la sobreestimación sea el error más frecuente. La variabilidad de la respuesta a la terapia neoadyuvante se extiende desde la respuesta total, pasando por la respuesta parcial, hasta la ausencia de esta (enfermedad estable) (fig. 7). Es importante saber que no todos los cambios son sobre el tamaño, y que los cambios postratamiento mencionados anteriormente deben reflejarse en el informe radiológico.
Valoración de respuesta tras terapia neoadyuvante con tomografía computarizada multidetector en 3 casos diferentes de cáncer de esófago (CE). A) CE torácico medio (flecha) con respuesta radiológica completa tras neoadyuvancia (flecha en A’). B) CE (flecha) que muestra disminución parcial de tamaño tras terapia neoadyuvante compatible con respuesta parcial (flecha en B’). C) CE torácico inferior (flecha) que no muestra cambios significativos tras terapia neoadyuvante (flecha en C’) compatible con enfermedad estable.
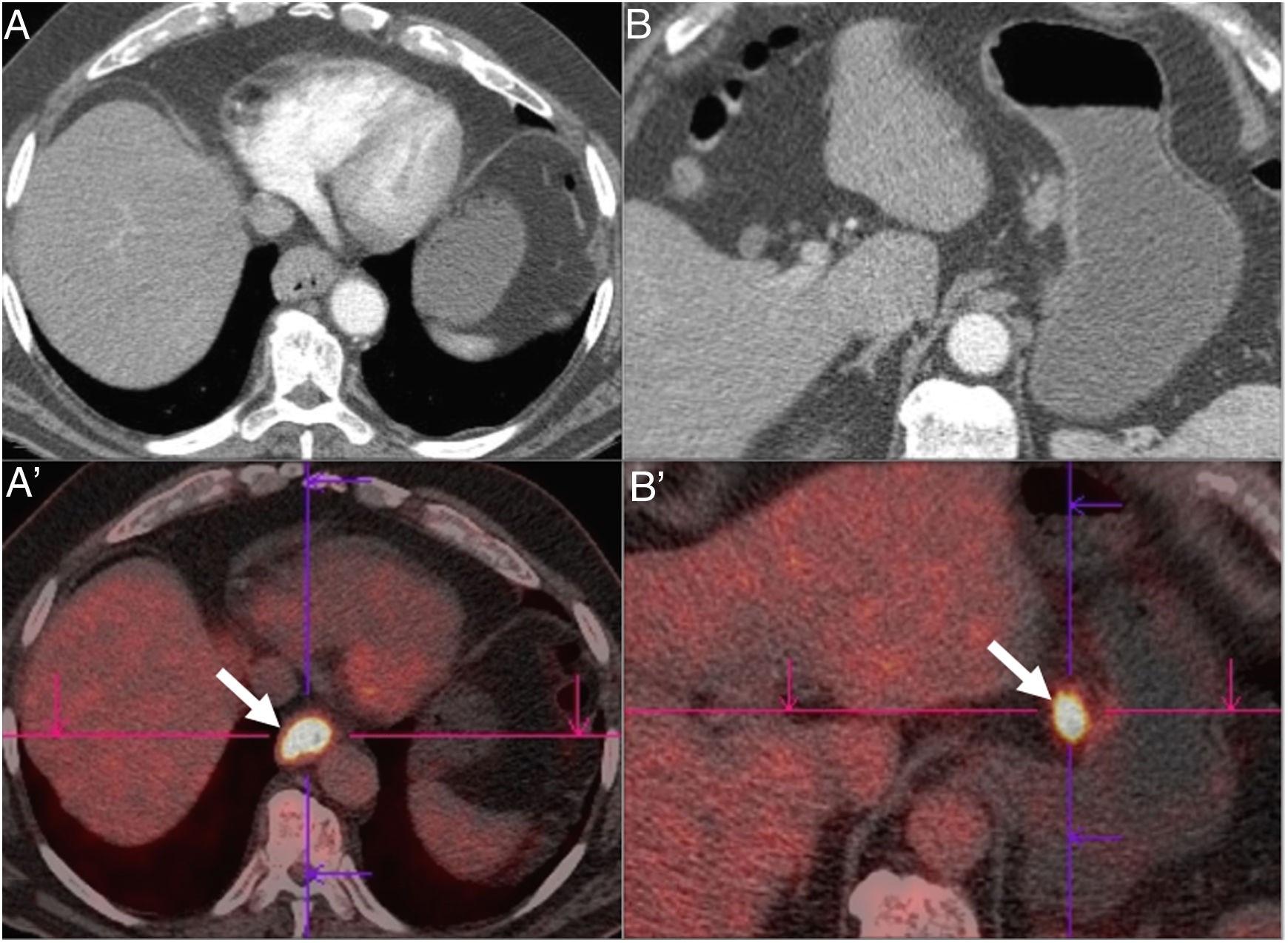
La PET-TC 18F-fluorodesoxiglucosa (PET-TC 18F-FDG) es útil en la identificación de metástasis no visibles en TC (aproximadamente el 15% de los pacientes), tumores sincrónicos y recurrencia tumoral1 (fig. 8). Sin embargo, hay que tener en cuenta que tiene cierta limitación en la resolución espacial para la valoración de T y N4. Por ejemplo, una intensa captación tumoral puede ocultar adenopatías adyacentes a la lesión.
Carcinoma de células escamosas de esófago distal con estadificación clínica cT3N1M0 por tomografía computarizada multidetector (A y B). Se confirman los mismos hallazgos en PET 18F-FDG (A’ y B’): aumento de la captación de 18F-FDG en la tumoración esofágica primaria y en ganglio linfático adyacente a la curvatura gástrica menor (flechas).
Esta técnica es también útil en la estadificación posneoadyuvancia. La disminución cuantitativa de la captación FDG tras el tratamiento neoadyuvante parece correlacionarse con la respuesta anatomopatológica a la terapia12. No obstante, son frecuentes los falsos positivos por cambios inflamatorios al tratamiento y los falsos negativos por respuesta parcial o escaso tumor viable12–14. Además, la PET-FDG tiene un papel importante en la detección de las metástasis de intervalo, descritas en el 8-17% de los pacientes12.
Resonancia magnéticaGracias a los avances tecnológicos que han propiciado nuevos protocolos con secuencias más rápidas y con sincronización cardíaca y respiratoria, se ha visto una mejoría importante en la calidad de la imagen de RM. La resolución de contraste tisular es incluso superior a la TC y PET-TC13–15. Las secuencias STIR y DWI mejoran la detección de ganglios regionales (cN) y permiten distinguirlos de la infiltración tumoral de la pared y de tejido periesofágico16,17. Se ha demostrado también la utilidad de la RM para detectar metástasis hepáticas con contraste hepatoespecífico y DWI con sensibilidad en torno al 90%18,19. Estudios recientes describen que la RM es útil en la evaluación de respuesta a la terapia neoadyuvante, cuando la TC y la PET-TC son contradictorios20,21, y en la planificación de la radioterapia22.
Complicaciones del cáncer esofágicoComplicaciones del tumor primarioEl CE puede acarrear varias complicaciones potencialmente fatales. Una de las complicaciones más graves es la perforación esofágica. Aunque la perforación del esófago ocurre más frecuentemente por instrumentación endoscópica y por procedimientos torácicos quirúrgicos, la progresión del tumor primario puede también ser la causa23. La falta de una capa serosa puede hacer que el esófago sea más susceptible a lesiones que otras partes del tracto gastrointestinal24. La radiografía de tórax puede ayudar a diagnosticar la perforación esofágica mediante signos indirectos como neumomediastino, neumotórax izquierdo y derrame pleural. En el esofagograma con contraste oral, la extravasación de contraste al mediastino es un signo inequívoco de perforación, aunque el 10% de los pacientes pueden tener un resultado falso negativo23. La TC puede usarse como método de imagen complementario, aunque hoy en día, gracias a su disponibilidad y a la rapidez del estudio, puede ser la técnica de elección en muchos casos.
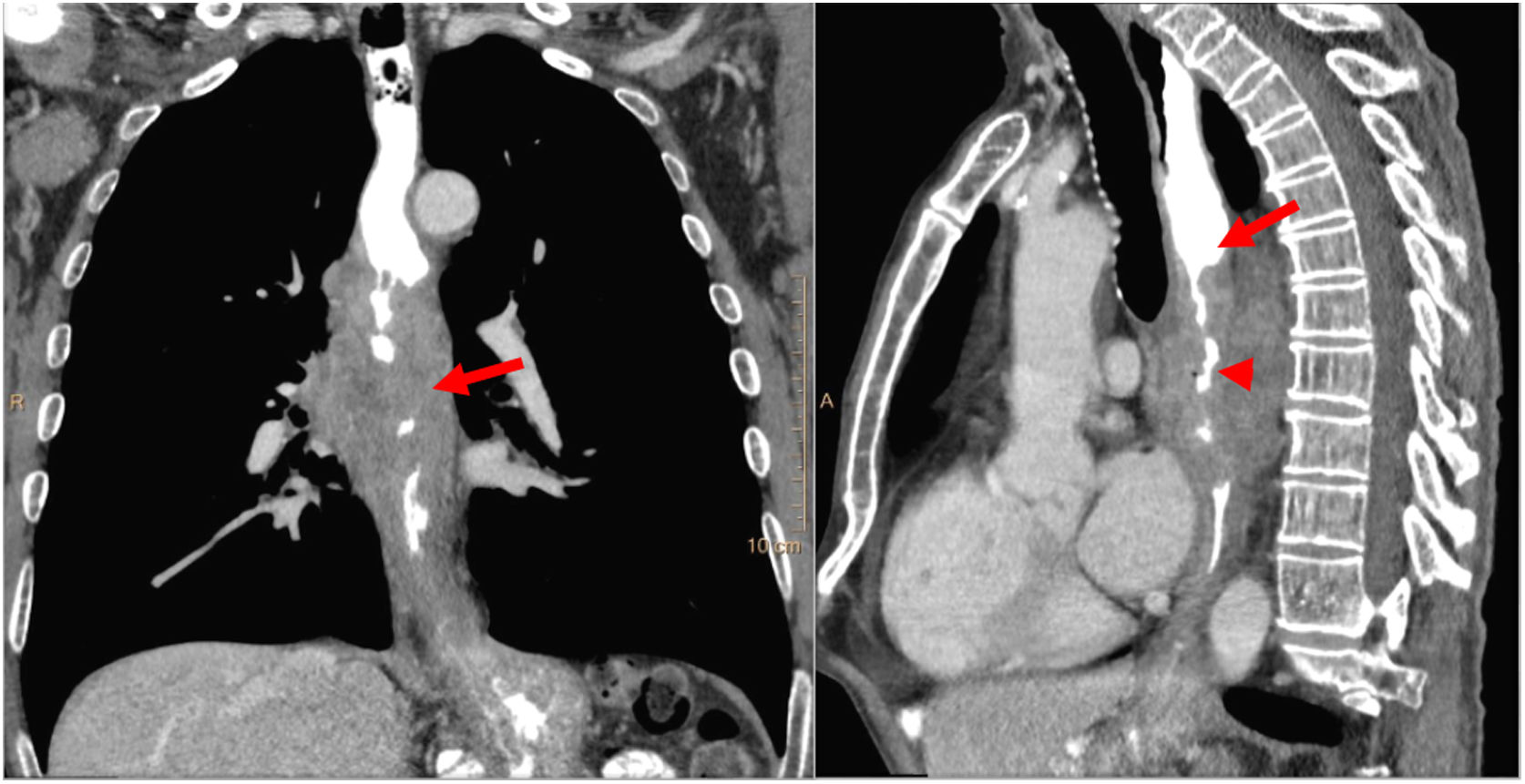
La formación de fístulas esofágicas a la tráquea, bronquio o pulmón ocurre en el 5-10% de los CE avanzados. El riesgo aumenta si existe radioterapia previa. Se debe sospechar ante cualquier paciente que muestre neumonías recurrentes. El diagnóstico puede hacerse mediante un esofagograma, y la TC puede mostrar el tracto fistuloso23 (fig. 5d). La fístula pleuroesofágica se asocia comúnmente al CE avanzado. La radiografía de tórax puede mostrar aire en la pleura o hidroneumotórax. La TC es la prueba de elección para su diagnóstico. También se ha descrito la fístula aortoesofágica como complicación infrecuente de la progresión tumoral25 (fig. 9).
Complicación del cáncer de esófago avanzado. A y A’) Carcinoma de células escamosas de esófago torácico medio cT3N1M1a por tomografía computarizada (TC); tumoración primaria (flecha) y adenopatías mediastínicas (cabeza de flecha). B y B’) TC posterapia neoadyuvante: respuesta tumoral parcial y fistulización entre tumoración y adenopatías (punta de flecha). C y C’) TC 10 días después con fístula aortoesofágica: perforación del esófago con burbujas de gas extraluminal (punta de flecha) y sangrado activo (flecha).
La esofagectomía es actualmente el tratamiento principal para la enfermedad local o localmente avanzada, y es la cirugía gastrointestinal electiva con mayor mortalidad (8-23%)26. Existen múltiples técnicas quirúrgicas para la esofagectomía. La base de datos de cirugía torácica general de la Sociedad de Cirujanos Torácicos enumera 14 métodos diferentes para su realización26. Las más frecuentes son la esofagectomía transtorácica, dentro de las que se encuentran la esofagectomía con técnica de Ivor Lewis, con técnica McKeown y con abordaje toracoabdominal izquierdo; la esofagectomía transhiatal, y la esofagectomía con interposición intestinal (con colon o intestino delgado). Independientemente de la técnica utilizada, la esofagectomía puede acarrear múltiples complicaciones (tabla 4).
Complicaciones postesofagectomía
| Complicaciones pulmonares | NeumoníaAspiraciónSíndrome de distrés respiratorio agudoEdema pulmonarDerrame pleuralNeumotóraxTromboembolismo pulmonar |
| Fuga anastomótica | |
| Complicaciones de la técnica | Lesión del nervio laríngeo recurrenteQuilotóraxHemorragiaLesión traqueobronquialTaponamiento cardiacoHernia diafragmática |
| Complicaciones funcionales | Vaciamiento gástrico retardado o gastroparesiaSíndrome de DumpingReflujo gastroesofágico |
| Complicaciones tardías | Estenosis anastomóticaRecurrencia de la enfermedad |
Son las complicaciones más frecuentes y representan dos tercios de las muertes postoperatorias26. Aumentan con la realización de la toracotomía27. Se incluyen: neumonía, aspiración, síndrome de distrés respiratorio agudo, edema pulmonar, derrame pleural, neumotórax y tromboembolismo pulmonar.
Fuga anastomóticaSe observa en el 10-44% de los pacientes postoperados y representa hasta el 40% de las muertes postoperatorias26,27. Normalmente ocurre en los primeros 10 días. Se atribuye a una tensión inadecuada28, tanto insuficiente como excesiva. Una tensión insuficiente de la anastomosis ocasiona una mala aposición de tejidos que finalmente conlleva extravasación. Si la tensión es excesiva, se propicia la isquemia y la necrosis, que es la complicación más temida, lo que favorece la fuga. La mayoría de las fugas ocurren en la anastomosis esofagogástrica. Son más frecuentes cuando la anastomosis es cervical y ocurren con mayor frecuencia con conducto gástrico que con colónico28,29. Las fugas pueden clasificarse de acuerdo a la clasificación de Lerut. La fuga de grado 1 es una fuga pequeña visualizada en estudio radiográfico sin sospecha clínica en paciente asintomático, y no requiere tratamiento. La fuga de grado 2 es una fuga pequeña contenida con síntomas mínimos. Requiere tratamiento conservador con drenaje y antibiótico. La fuga de grado 3 es una fuga grande con síntomas mayores, y el grado 4 se reserva para la necrosis del conducto. Estos dos últimos grados requieren cirugía urgente27,30.
Complicaciones técnicasEntre las complicaciones técnicas destacan la lesión del nervio laríngeo recurrente, que ocurre en el 10-20% de las veces que se realiza una anastomosis cervical, y el quilotórax, que ocurre en el 1-5% de las esofagectomías31. La hemorragia suele ocurrir como consecuencia de una lesión intraoperatoria del bazo, vena ácigos, vasos intercostales, arteria gástrica derecha y parénquima pulmonar31.
Complicaciones funcionalesLa gastroparesia o el retraso del vaciamiento gástrico ocurre en el 10% de los casos, normalmente asociado a vagotomía y reorganización anatómica. Suele ser más exagerado con la técnica de Ivor Lewis3,27o0. El síndrome de Dumping ocurre hasta en el 50% de los casos, a causa de un tránsito rápido de contenido hiperosmolar gástrico al intestino delgado29. El reflujo gastroesofágico es una complicación esperada en la mayoría de los casos; más frecuente tras piloroplastia. Puede causar úlceras y estenosis32.
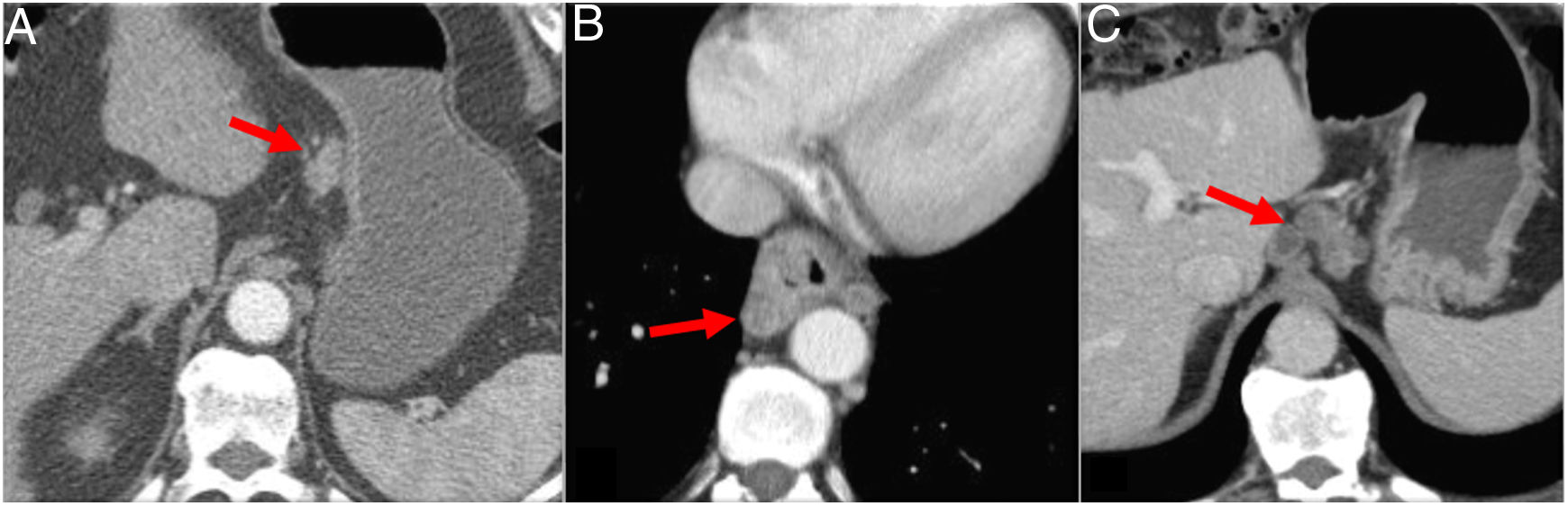
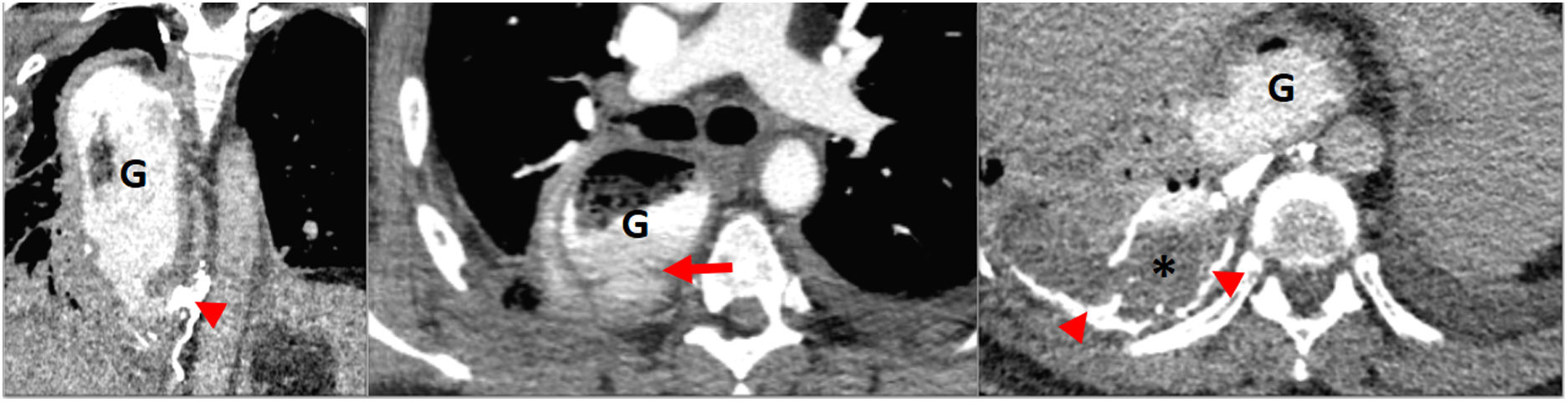
La detección temprana de estas complicaciones es esencial para mejorar el pronóstico de los pacientes tras la esofagectomía, y el estudio radiológico es fundamental para la valoración de la mayoría de estas complicaciones. Las pruebas de imagen más utilizadas son el esofagograma y la TC de tórax. El esofagograma sirve para evaluar fuga, obstrucción y retraso del vaciamiento gástrico. Forma parte de la evaluación rutinaria postoperatoria en la mayoría de los centros, normalmente entre los días 6 y 10 poscirugía26. Es importante realizar la prueba con el paciente en múltiples posiciones si se sospecha fuga. Para descartar fuga, primero se recomienda realizar el esofagograma con contraste hidrosoluble no-iónico de baja osmolaridad por sonda nasogástrica u oral, dado que los pacientes intervenidos de cáncer esofágico tienen mayor riesgo de aspiración, y los contrastes hidrosolubles de alta osmolaridad se han relacionado con edema pulmonar masivo en caso de aspiración26. Si no se observa fuga, se recomienda repetir el estudio con bario27,33,34. El uso únicamente de contraste hidrosoluble puede no demostrar la existencia de una fuga si es pequeña. El bario tiene mayor densidad que el contraste hidrosoluble y puede adherirse más fuertemente al sitio de la fuga26. La TC de tórax es útil para visualizar varias complicaciones postoperatorias, y especialmente en pacientes inestables. Es complementaria al esofagograma. En caso de fuga anastomótica, la TC demostrará extravasación de contraste oral en el mediastino o espacio pleural27,33 (fig. 10). Los abscesos son fácilmente identificables en la TC, tienden a desarrollarse adyacentes a las líneas de sutura y predisponen al paciente al desarrollo de fístulas. Además, la TC puede utilizarse para guiar procedimientos de drenaje en fugas, abscesos, derrames pleurales y neumotórax26.
Complicaciones posquirúrgicas del cáncer de esófago (CE). Paciente intervenido de CE con esofagectomía (técnica de Ivor Lewis) 7 días antes. TC de tórax urgente realizada por disnea: se observa solución de continuidad caudal a la anastomosis esofagogástrica cervical, compatible con fuga del conducto gástrico (G) (flecha). La extravasación se continúa por detrás del conducto gástrico como una columna de densidad similar a la endoluminal (por gastrografín oral), que se mezcla con el contenido de derrame pleural y componente de quilotórax derecho (estrella). Material denso compatible con lipiodol de embolización previa (cabezas de flecha) tras sección del conducto torácico durante la cirugía.
En la 8.ª edición TNM del cáncer esofágico, las clasificaciones ya no se comparten. Existen clasificaciones separadas para los grupos de estadios clínicos (cTNM), patológicos (pTNM) y posneoadyuvantes patológicos (ypTNM). El radiólogo debe conocer las peculiaridades y clasificación actual del cáncer esofágico. La correcta lectura de la imagen radiológica es esencial para planificar el manejo del paciente. El papel del radiólogo es fundamental no solo en la estadificación clínica del cáncer, sino también en su valoración postratamiento.
Autoría- 1.
Responsable de la integridad del estudio: PLS, NAA, IFF, JSB.
- 2.
Concepción del estudio: PLS, NAA, IFF, JSB.
- 3.
Diseño del estudio: PLS, NAA, IFF, JSB.
- 4.
Obtención de los datos: PLS, NAA, IFF, JSB.
- 5.
Análisis e interpretación de los datos: PLS, NAA, IFF, JSB.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: PLS, IFF.
- 8.
Redacción del trabajo: PLS, NAA, IFF, JSB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: PLS, NAA, IFF, JSB.
- 10.
Aprobación de la versión final: PLS, NAA, IFF, JSB.