Determinar las características ultrasonográficas de la patología metastásica hepática inducida en un modelo múrido, para evaluar la utilidad de la ecografía en la valoración no invasiva de la infiltración tumoral.
Material y métodosEl hígado de 46 ratas WAG/RijCrl fue diseminado con células singénicas de carcinoma colorrectal CC-531 mediante inoculación intraesplénica. En los días 21, 28, 35, 42 y 70 posteriores a la siembra tumoral, se realizaron series de ecografías para valorar inducción tumoral en diferentes grupos de animales; 37 ratas se estudiaron mediante sonda lineal de 10Mhz y 9 con sonda multifrecuencia de 6–18Mhz. Como signos ecográficos de desarrollo tumoral se consideró la detección de nódulos intrahepáticos, festoneado del contorno hepático, megalias de lóbulos y masas extrahepáticas. Los hallazgos ecográficos se verificaron tras necropsia, y en ambas técnicas se determinó el número de implantes, tamaño (<3, entre 3–7 y >7mm) y localización lobular.
ResultadosComparado con los resultados de la necropsia, en ecografía se detectaron lesiones en el 64% de los animales con patología. Todas las masas extrahepáticas fueron correctamente diagnosticadas. Se identificaron metástasis en el 90% de ratas afectadas por lesiones>7mm, en el 75% de animales con implantes de 3–7mm y en el 25% con lesiones<3mm. Con la sonda de 6–18Mhz se detectaron el 50% de lesionesmm.
ConclusiónLa ecografía resultó útil en la monitorización del modelo experimental y posibilitó, con razonable sensibilidad, la valoración oncológica no invasiva del hígado múrido.
To determine the ultrasonographic characteristics of liver metastases induced in a rat model; to evaluate the usefulness of ultrasonography in the noninvasive evaluation of tumor infiltration.
Material and methodsWe seeded the livers of 46 WAG/RijCrl rats with CC-531 syngeneic colorectal carcinoma cells by intrasplenic inoculation. At 21, 28, 35, 42, 70 days after tumor seeding, we performed a series of ultrasonographic examinations to evaluate tumor induction in different groups of animals: 37 rats were studied with a 10MHz linear probe and 9 were studied with a 6–18MHz multifrequency probe. The following signs were considered indicative of tumor development: intrahepatic nodules, sinuate liver borders, lobe enlargement, and extrahepatic masses. Ultrasonographic findings were verified at autopsy. We determined the number of implants, size (less than 3mm, between 3 and 7mm, or greater than 7mm), and lobe location for each technique.
ResultsCompared to the autopsy results, ultrasonography detected 64% of the animals with disease. All the extrahepatic masses were correctly diagnosed. Metastases were identified in 90% of the rats with lesions greater than 7mm, in 75% of those with implants between 3 and 7mm, and in 25% of those with lesions less than 3mm. In the group in which we used the 6–18MHz probe, we detected 50% of the lesions less than 3mm.
ConclusionUltrasonography was useful for monitoring the experimental model and enabled the noninvasive oncologic evaluation of the rat liver with reasonable sensitivity.
Las neoplasias colorrectales constituyen uno de los procesos tumorales más frecuentes en el mundo occidental, representan la tercera causa de patología neoplásica y son responsables de aproximadamente el 10% de muertes por cáncer1.
Casi la mitad de los pacientes aquejados de neoplasia colorrectal desarrollará metástasis hepáticas, y en un 15–25% de ellos está ya presente en el momento del diagnóstico2,3. El tratamiento de elección en la patología metastásica es el quirúrgico, el cual muestra la mejor supervivencia a largo plazo, con tasas a los 5 años en torno al 24–38%4 y que en series con pacientes muy seleccionados llegan a alcanzar el 58%5. Sin embargo, sólo un 8–27% de los afectados será candidato a cirugía6.
Para los pacientes no subsidiarios de terapia quirúrgica se han desarrollado alternativas terapéuticas locales, como la etanolización, la termoablación por radiofrecuencia o la quimioembolización transarterial. Sin embargo, estos procedimientos presentan una eficacia relativa, por lo que resulta preciso desarrollar nuevas terapéuticas que, previamente a su aplicación clínica, muestren un adecuado efecto antitumoral local y una mínima toxicidad sistémica. Es en este ámbito en donde los modelos experimentales oncológicos resultan de utilidad, puesto que permiten estimar in vivo la eficacia de las nuevas terapias. Clásicamente, el desarrollo del propio modelo experimental requiere de un seguimiento y control estrecho de la progresión tumoral, lo que habitualmente supone la realización de sacrificios selectivos de animales de diferentes series y en diferentes intervalos de tiempo. La posibilidad de aplicar métodos de diagnóstico por imagen capaces de detectar y monitorizar la progresión o regresión de un proceso neoplásico experimental de forma no invasiva supondría una alternativa a esta práctica.
El empleo de la ecografía como técnica de imagen aplicada al ámbito oncológico experimental no ha sido profusamente evaluado. En el presente trabajo, se han estudiado las características ecográficas de metástasis hepáticas de adenocarcinoma de colon inducidas en hígado múrido, con el objetivo de evaluar la utilidad de la ecografía en la valoración y monitorización no invasiva de un modelo oncológico experimental.
Material y métodosEl estudio experimental se realizó en 46 ratas WAG/RijCrl (17 machos y 29 hembras) de 170–286g. Todos los procedimientos se practicaron de acuerdo con la legislación vigente referente a la protección de los animales utilizados para experimentación y otros fines científicos (Real Decreto 1201/2005, de 10 de octubre).
Las ratas se mantuvieron en un estabulario en condiciones estándar: temperatura media de 22°C, humedad relativa del 55%, patrón alternante de 12h de luz y de oscuridad, y alimentación a base de pienso estándar y agua “ad libitum”.
Para la inducción metastásica hepática, el día cero del experimento los animales fueron inoculados con células singénicas de adenocarcinoma de colon (línea celular: CC-531). Como fuente de diseminación tumoral se aplicó la técnica de reservorio esplénico, procedimiento con el que se consigue inducir metástasis en el 60–70% de los animales. El procedimiento de inoculación requirió de la exposición del bazo mediante la práctica de una laparotomía media subxifoidea de 3cm de longitud, procedimiento que permitía la inyección intraesplénica directa de 250.000 células tumorales vehiculizadas en 0,5ml de solución de Hank. Para la inoculación celular se usó una aguja de 27G. A los 5min de la inyección se practicaba esplenectomía para evitar el desarrollo de un tumor primario y, finalmente, la laparotomía era suturada. En el proceso de inoculación tumoral, los animales se mantuvieron bajo anestesia inhalada inducida por halotano.
Las ecografías se practicaron con 2 ecógrafos de uso clínico: un equipo “Logiq 7” de la casa comercial General Electric Healthcare dotado de una sonda lineal de 10Mhz, y un ecógrafo “MyLab60 XVision” de Esaote dotado con una sonda lineal multifrecuencia de 6–18Mhz. Con el primer ecógrafo se evaluaron 37 ratas y con el segundo 9. Los 46 animales fueron estudiados en 5 grupos de experimentos: ECO-I (n=6), ECO-II (n=13), ECO-III (n=10), ECO-IV (n=13) y ECO-V (n=4), que fueron realizados a los 21, 28, 35, 42 y 70 días de la inyección esplénica de células tumorales, respectivamente. Los animales identificados del 11 al 19 fueron estudiados mediante la sonda multifrecuencia de 6–18Mhz (tabla 1). Para la práctica de las exploraciones ecográficas se utilizó anestesia intraperitoneal a base de una inyección de diacepam (5mg/kg) combinada posteriormente a los 10min con ketamina (100mg/kg). Como paso previo a la ecografía fue necesario depilar la mitad superior del abdomen de las ratas mediante la aplicación de una crema depilatoria estándar.
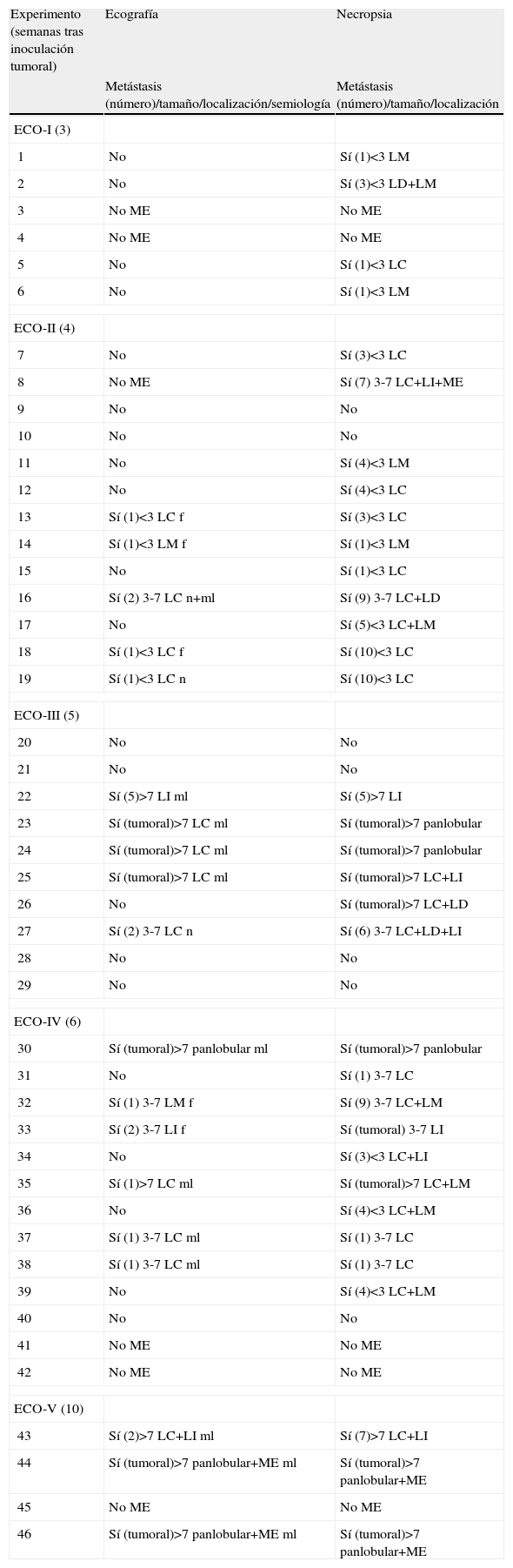
Correlación ecograficopatológica
| Experimento (semanas tras inoculación tumoral) | Ecografía | Necropsia |
| Metástasis (número)/tamaño/localización/semiología | Metástasis (número)/tamaño/localización | |
| ECO-I (3) | ||
| 1 | No | Sí (1)<3 LM |
| 2 | No | Sí (3)<3 LD+LM |
| 3 | No ME | No ME |
| 4 | No ME | No ME |
| 5 | No | Sí (1)<3 LC |
| 6 | No | Sí (1)<3 LM |
| ECO-II (4) | ||
| 7 | No | Sí (3)<3 LC |
| 8 | No ME | Sí (7) 3-7 LC+LI+ME |
| 9 | No | No |
| 10 | No | No |
| 11 | No | Sí (4)<3 LM |
| 12 | No | Sí (4)<3 LC |
| 13 | Sí (1)<3 LC f | Sí (3)<3 LC |
| 14 | Sí (1)<3 LM f | Sí (1)<3 LM |
| 15 | No | Sí (1)<3 LC |
| 16 | Sí (2) 3-7 LC n+ml | Sí (9) 3-7 LC+LD |
| 17 | No | Sí (5)<3 LC+LM |
| 18 | Sí (1)<3 LC f | Sí (10)<3 LC |
| 19 | Sí (1)<3 LC n | Sí (10)<3 LC |
| ECO-III (5) | ||
| 20 | No | No |
| 21 | No | No |
| 22 | Sí (5)>7 LI ml | Sí (5)>7 LI |
| 23 | Sí (tumoral)>7 LC ml | Sí (tumoral)>7 panlobular |
| 24 | Sí (tumoral)>7 LC ml | Sí (tumoral)>7 panlobular |
| 25 | Sí (tumoral)>7 LC ml | Sí (tumoral)>7 LC+LI |
| 26 | No | Sí (tumoral)>7 LC+LD |
| 27 | Sí (2) 3-7 LC n | Sí (6) 3-7 LC+LD+LI |
| 28 | No | No |
| 29 | No | No |
| ECO-IV (6) | ||
| 30 | Sí (tumoral)>7 panlobular ml | Sí (tumoral)>7 panlobular |
| 31 | No | Sí (1) 3-7 LC |
| 32 | Sí (1) 3-7 LM f | Sí (9) 3-7 LC+LM |
| 33 | Sí (2) 3-7 LI f | Sí (tumoral) 3-7 LI |
| 34 | No | Sí (3)<3 LC+LI |
| 35 | Sí (1)>7 LC ml | Sí (tumoral)>7 LC+LM |
| 36 | No | Sí (4)<3 LC+LM |
| 37 | Sí (1) 3-7 LC ml | Sí (1) 3-7 LC |
| 38 | Sí (1) 3-7 LC ml | Sí (1) 3-7 LC |
| 39 | No | Sí (4)<3 LC+LM |
| 40 | No | No |
| 41 | No ME | No ME |
| 42 | No ME | No ME |
| ECO-V (10) | ||
| 43 | Sí (2)>7 LC+LI ml | Sí (7)>7 LC+LI |
| 44 | Sí (tumoral)>7 panlobular+ME ml | Sí (tumoral)>7 panlobular+ME |
| 45 | No ME | No ME |
| 46 | Sí (tumoral)>7 panlobular+ME ml | Sí (tumoral)>7 panlobular+ME |
- •
En el apartado metástasis se hace relación a la presencia o no de éstas y entre paréntesis al número (número de implantes encontrados). El término “tumoral” hace referencia a infiltraciones muy profusas, en las que no es posible determinar el número exacto de metástasis independientes.
- •
Semiología ecográfica de desarrollo tumoral. f: festoneado de contorno; ml: megalias de lóbulos: n: nódulos intrahepáticos; tumoral: infiltración neoplásica extensa, metástasis confluentes no individualizables.
- •
Localización hepática de las metástasis. LC: lóbulo caudado; LD: lóbulo lateral derecho; LI: lóbulo lateral izquierdo; LM: lóbulo medial; ME: implantes tumorales de localización extrahepática; panlobular: implantes tumorales en todos los lóbulos hepáticos.
El hígado de la rata adulta es una víscera segmentada, de contornos uniformes, bordes angulosos y un tamaño anteroposterior máximo de 20mm. Anatómicamente, se han definido varios lóbulos hepáticos: medial derecho e izquierdo, lateral derecho, lateral izquierdo, y caudado. En las exploraciones ecográficas se valoró la sensibilidad de la técnica a la hora de establecer el diagnóstico de infiltración metastática hepática, así como las características ultrasonográficas de las metástasis. De acuerdo a criterios utilizados en patología humana7, como signos de desarrollo neoplásico, se consideraron los siguientes hallazgos:
- •
Nódulos intrahepáticos de ecoestructura diferente y distinguible del parénquima circundante.
- •
Festoneado del contorno hepático motivado por abombamientos focales en la superficie de la víscera.
- •
Megalias de lóbulos hepáticos caracterizadas por desorganización del patrón ecográfico y convexidad de bordes.
- •
Masas sólidas de localización extrahepática.
Tras la práctica de los estudios ecográficos, todos los animales fueron sacrificados mediante anestesia profunda inhalada mediada por éter y luxación cervical. Los hígados fueron extraídos y, tras diseccionar los diferentes lóbulos, se realizó análisis visual para determinar las características de la infiltración tumoral. Para contrastar los resultados de ecografía con los de necropsia, en ambas técnicas se determinó el número de implantes tumorales, así como su tamaño y localización. La sustitución del tejido hepático de un lóbulo por profusa infiltración neoplásica se describió como afectación “tumoral”, y en caso de que la invasión afectara a todos los lóbulos hepáticos se denominó “panlobular”. En función del tamaño, la infiltración neoplásica se clasificó en: nódulos<3mm, nódulos de 3–7mm, nódulos>7mm.
En 10 especímenes se tomaron también muestras para la práctica de análisis histológico. Estas muestras fueron fijadas en formol al 10% y posteriormente teñidas con hematoxilina-eosina para su estudio con microscopia óptica. De esta forma se corroboró la naturaleza neoplásica de las lesiones reveladas en la ecografía y en los análisis visuales macroscópicos de necropsia.
En lo referente al análisis estadístico de los resultados, las variables cualitativas se describieron mediante frecuencias. Así, los resultados relativos a porcentaje de detección global de lesiones neoplásicas, localización lobular de las metástasis y porcentajes de detección según el tamaño de los diferentes implantes, se calcularon basándose en los hallazgos de la necropsia, que se consideró la técnica de referencia.
ResultadosEn el conjunto de experimentos se comprobó el desarrollo neoplásico hepático en los estudios de necropsia en el 74% de las ratas inoculadas. Por otro lado, el uso de la ecografía hizo posible detectar lesiones neoplásicas en el 64% de los animales con patología (tabla 1).
En el estudio comparativo entre los hallazgos de imagen y de necropsia relativo a la localización lobular de las metástasis, mediante ecografía se identificaron metástasis en el 55% de animales que habían desarrollado afectación neoplásica en el lóbulo caudado. Los porcentajes de detección obtenidos en las infiltraciones tumorales presentes en los lóbulos izquierdo, derecho y medio, resultaron del 50, 33 y 33%, respectivamente. Todas las masas extrahepáticas, que en 5 animales no se encontraron asociadas a desarrollo tumoral hepático, fueron correctamente identificadas.
Por otro lado, en lo referente al tamaño tumoral y aunque en general se identificaron ecográficamente un número menor de implantes, se detectaron lesiones neoplásicas en el 90% de las ratas afectadas por metástasis>7mm, en el 75% de animales con implantes de 3–7mm, y en el 25% de ratas con lesiones de<3mm. Sin embargo, es de destacar que las lesiones<3mm fueron reveladas en los estudios practicados con la sonda multifrecuencia de 6–18Mhz, experimento que valorado de forma aislada mostró una tasa de detección en estas lesiones mínimas de un 50%. El tamaño de las masas extrahepáticas osciló entre los 5 y los 17mm.
Al cotejar los criterios ecográficos de desarrollo tumoral con los hallazgos de necropsia, fue posible relacionar los signos ultrasonográficos con las diferentes manifestaciones morfológicas de las más o menos profusas infiltraciones neoplásicas. Así, se identificaron nódulos intrahepáticos, redondeados e hiperecoicos, distinguibles del tejido hepático circundante, y que en el posterior estudio anatomopatológico se comprobó que traducían pequeñas metástasis rodeadas de tejido lobular sano (fig. 1). Los hallazgos ecográficos relativos al festoneado o abombamiento focal del contorno hepático, se correspondieron con pequeños implantes metastásicos subcapsulares (fig. 2). En nuestro estudio, las megalias de lóbulos se caracterizaron por abombamientos difusos de los contornos, pérdida de la morfología angulada de los bordes y un patrón ecográfico heterogéneo, en el que se alternaban áreas hiperecoicas con otros focos más isoecoicos respecto al parénquima hepático adyacente. Se comprobó que estos hallazgos eran la manifestación de profusas infiltraciones tumorales (fig. 3). Finalmente, en los estudios histológicos se corroboró la naturaleza neoplásica de las masas sólidas y lobuladas de localización extrahepática, y que eran la manifestación de implantes tumorales en omento o peritoneo.
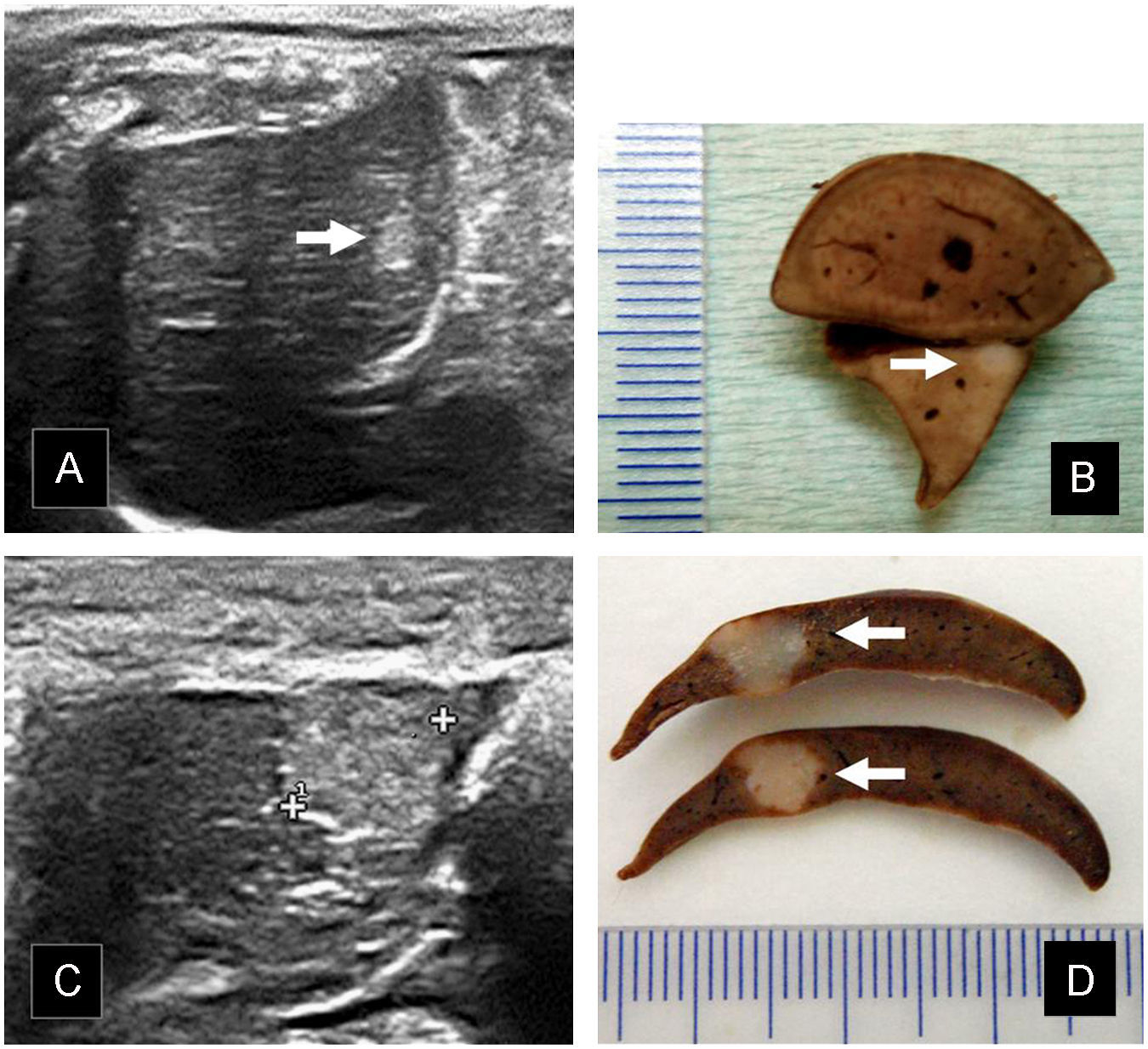
Nódulos intrahepáticos. A) En la ecografía con sonda de 18Mhz se identifica una metástasis hiperecoica de 2,5mm en vértice medial del lóbulo caudado (flecha). B) Tras extracción hepática y fijado en formol, en el corte histológico se señala el nódulo tumoral de aspecto nacarado. C) Ecografía hepática en la que se observa una masa hiperecoica de 5mm de diámetro. Alcanza la superficie de la víscera y la deforma discretamente. D) Secciones histológicas correspondientes a la lesión descrita en el apartado previo.
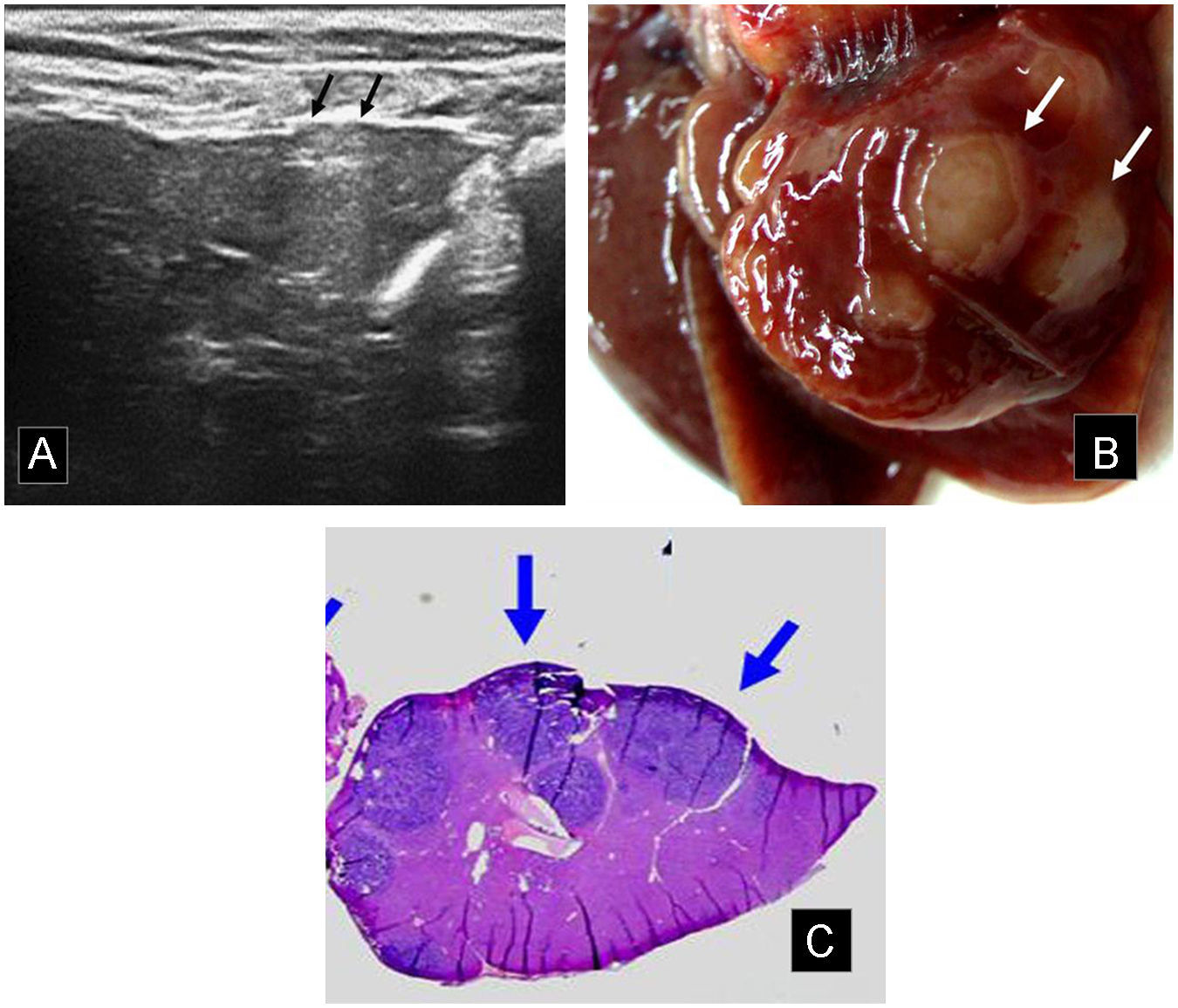
Implantes subcapsulares, festoneado del contorno. A) En la ecografía 2 lesiones hiperecoicas abomban la superficie del lóbulo caudado izquierdo (flechas) en una extensión de 3mm. B) Necropsia, detalle del lóbulo caudado. Se corrobora la presencia de los implantes subcapsulares detectados en la ecografía (flechas) y además se observa un mayor número de metástasis de menor tamaño. C) Sección histológica, tras fijado en formol y tinción. Las lesiones neoplásicas, de tonalidad más azulada (flechas), provocan festoneado de la superficie del lóbulo hepático.
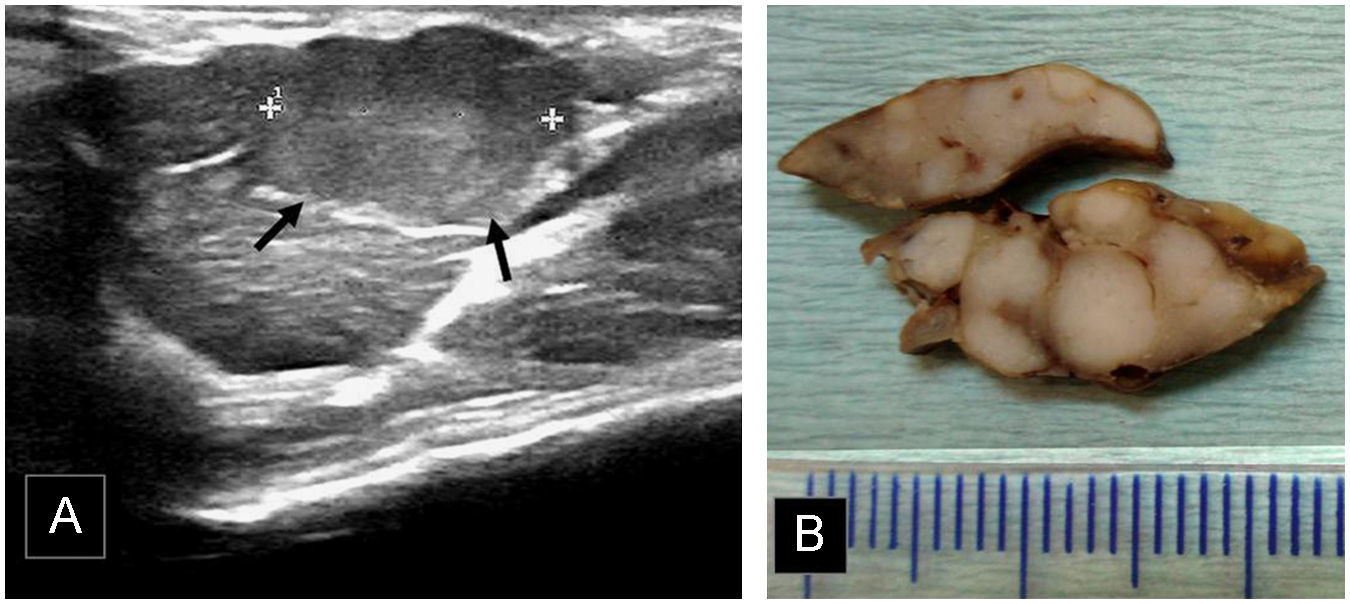
Megalias de lóbulos. A) Masa de 15mm que infiltra extensamente el lóbulo caudado (flechas), el cual muestra un aspecto hinchado. La ecogenicidad de la masa es similar a la hepática, sin embargo la deformación de la anatomía lobular permite su identificación. B) Necropsia, cortes histológicos tras fijado en formol. Extensa afectación neoplásica metastásica confluente, lóbulo caudado tumoral.
Los estudios oncológicos con animales reproducen situaciones semejantes al proceso neoplásico humano. El modelo artificial de inducción de metástasis sin neoplasia primaria se fundamenta en la inyección intravascular de gran cantidad de células tumorales anaplásicas, lo cual permite analizar las últimas fases del proceso metastásico. Para provocar la aparición de lesiones hepáticas, en nuestro estudio se ha utilizado la vía intraesplénica de inyección tumoral, procedimiento muy útil en los modelos experimentales de patología hepática metastásica8.
En los sistemas metastásicos experimentales debe controlarse el rendimiento metastásico, es decir, la capacidad de que se desarrollen metástasis en los modelos empleados. La estimación histológica del tamaño y número de metástasis es un procedimiento que permite evaluar la cantidad global de tejido neoplásico y su distribución por el parénquima del órgano colonizado9. Es un sistema ideal en la patología hepática, pues en este órgano la invasión tumoral se distribuye irregularmente por los lóbulos y, a menudo, es de ubicación profunda intraparenquimatosa8,10. En nuestro estudio, mediante ecografía se ha valorado el rendimiento metastásico en un modelo múrido de metástasis hepáticas.
En el ámbito clínico se han establecido una serie de signos ecográficos cuya identificación se relaciona con la presencia de patología tumoral hepática7. En general, los nódulos neoplásicos resultan reconocibles dado que presentan diferencias de impedancia acústica con respecto al tejido circundante11 y, en este contexto, es de destacar que aunque el aspecto ecográfico es inespecífico de la estirpe celular, las lesiones muy vascularizadas12,13 y las metástasis del tubo digestivo14–16 suelen ser hiperecoicas.
Mediante la observación de los diferentes signos ecográficos, ha sido posible detectar correctamente patología en el 64% de los animales portadores de lesiones malignas. Las masas extrahepáticas, consecuencia posiblemente de extravasaciones inadvertidas de células neoplásicas ocurridas durante el proceso de inyección esplénica, han resultado de diagnóstico sencillo, y su presencia se ha determinado correctamente en todos los casos. Este hecho, muy probablemente, ha venido motivado por las notables diferencias de impedancia acústica existentes entre el tejido tumoral y la grasa hiperecoica peritoneal que envuelve a estos implantes. La detección de las lesiones intrahepáticas ha entrañado más dificultades. En trabajos previamente publicados se han estudiado modelos experimentales de lesiones de asiento hepático, como hepatoma, metástasis de melanoma múrido o metástasis de carcinoma humano de colon y de mama17–19. En estos modelos, las lesiones tumorales presentaban invariablemente un aspecto hipoecoico y su distinción respecto del parénquima adyacente resultaba adecuada. Sin embargo, las características ecográficas de las lesiones observadas en nuestro modelo son distintas, pues las metástasis de colon se comportan como nódulos hiperecoicos.
Uno de los factores fundamentales a la hora de conseguir detectar lesiones en estadios más precoces viene determinado por la potencia acústica de las sondas ecográficas empleadas. En estudios experimentales de hepatoma múrido y utilizando sondas de 10Mhz, el límite de detección de las lesiones neoplásicas se ha establecido en 5mm de diámetro tumoral18. En otros estudios practicados con sondas de 15Mhz el límite ha quedado en 3,7mm19, y mediante técnicas de biomicroscopia ecográfica20 empleando sondas de 40Mhz con profundidad focal efectiva de 6mm, se ha conseguido detectar lesiones<0,3mm de diámetro17. En nuestro modelo se ha logrado identificar el 90% de las lesiones>7mm y sólo el 25% de las lesiones de tamaño<3mm. Sin embargo, cuando se han considerado de forma aislada los casos detectados con la sonda lineal multifrecuencia de 6–18Mhz, se consigue identificar el 50% de las lesiones de tamaño<3mm. Según estas consideraciones, resulta evidente que la mayor frecuencia sónica permite detectar lesiones en estadio más precoz. Sin embargo, en la elección de un equipo de ecografía también debe considerarse el tipo de animal que se va a estudiar. En nuestro modelo múrido, y para valorar la totalidad del hígado, ha sido preciso alcanzar una profundidad de exploración de hasta 25mm, requerimiento que limita la utilización de sondas de frecuencia muy elevada. Por tanto, a la hora de seleccionar un equipo de ecografía de uso experimental deberá conseguirse un balance adecuado entre la resolución espacial y la capacidad de penetración de los ultrasonidos en el organismo a estudio.
El presente estudio presenta limitaciones, sobre todo derivadas del menor número de exploraciones que han podido ser practicadas con la sonda de mayor frecuencia sónica. Sin embargo, dada la escasa bibliografía relacionada con la utilidad de técnicas de monitorización no invasiva en el ámbito oncológico experimental, creemos interesante aportar estos resultados preliminares, pues pueden servir de base para la realización de investigaciones más exhaustivas y que aporten datos de mayor relevancia estadística.
En conclusión, en nuestra experiencia ha sido posible obtener estudios ecográficos de la totalidad del hígado múrido, de aceptable sensibilidad en la detección neoplásica, sobre todo cuando se ha empleado una sonda de frecuencia razonablemente elevada (18Mhz). Basándose en estas consideraciones, se puede establecer que la competencia como método de control de progresión de la patología tumoral que brinda la ecografía resulta interesante, no sólo para aprender el curso natural de la enfermedad sino también porque abre la posibilidad de monitorizar de modo no invasivo y en experimentos ulteriores la eficacia de hipotéticos tratamientos antineoplásicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónLa realización de este trabajo ha sido posible gracias a la financiación procedente del programa de Ayudas a Proyectos de Investigación 2008 del Departamento de Sanidad del Gobierno Vasco, y del programa de Proyectos de Investigación FIS del Instituto Carlos III del Ministerio de Ciencia e Innovación.
AutoríaJ.J. Echevarria: responsable de la concepción, diseño, obtención de datos y redacción.
I. García-Alonso: responsable de la concepción, obtención de datos y revisión crítica.
I. Díaz: responsable de obtención de datos, análisis y redacción.
B. Herrero: responsable de obtención de datos, análisis y redacción.
J.L. Miguélez: responsable de obtención de datos, análisis y revisión crítica.
B. Fernandez-Ruanova: responsable de obtención de datos, análisis e interpretación, redacción y revisión crítica.
I. Zabalza: responsable de concepción y diseño, obtención de datos y análisis.
Todos los autores han leído y aprobado la versión final del artículo.