El carcinoma hepatocelular es un tumor de elevada incidencia y alta mortalidad. Estos datos justifican los programas de detección precoz para poder aplicar los tratamientos considerados curativos, lo que implicará una mayor supervivencia. La detección precoz debe realizarse mediante ecografía semestral en la población con riesgo de padecer este tipo de tumor, fundamentalmente en pacientes con cirrosis hepática. Debido a sus características vasculares, actualmente se puede realizar el diagnóstico de carcinoma hepatocelular por técnicas de imagen dinámicas (ecografía con contraste/TC/RM). En caso que el patrón de captación no sea característico en estas técnicas de imagen debe efectuarse una biopsia de la lesión.
Una vez diagnosticado, se realiza la estadificación del tumor, lo que junto al estado clínico del paciente, determinará la estrategia terapéutica más adecuada en cada caso.
Hepatocellular carcinoma is a tumor with a high incidence and high mortality. These data justify screening programs to enable curative treatments to improve survival rates. Screening the population at risk (mainly patients with cirrhosis of the liver) should include ultrasonographic examination twice yearly. Given the vascular characteristics of hepatocellular carcinoma, it can be detected using dynamic techniques (contrast-enhanced ultrasonography, CT, and MRI). In cases in which the enhancement pattern is not characteristic, these techniques should be complemented with lesion biopsy.
Once hepatocellular carcinoma is diagnosed, the tumor is staged, and together with the clinical condition of the patient, the stage will determine the most appropriate treatment strategy in each case.
El carcinoma hepatocelular (CHC) es la neoplasia primaria de hígado más frecuente. En los últimos años se ha constatado un aumento progresivo de su incidencia en países industrializados1 y actualmente constituye la sexta neoplasia más frecuente, con más de medio millón de nuevos casos al año, la tercera causa de muerte por cáncer2 y la principal causa de muerte en pacientes cirróticos3. Su distribución mundial es muy heterogénea y está estrechamente relacionada con la prevalencia variable de los diferentes factores de riesgo asociados a su desarrollo. En este sentido, la incidencia es máxima en África subsahariana y el sudeste asiático, donde la infección por el virus de la hepatitis B (VHB) es endémica y la incidencia excede 15casos/100.000hab/año. España presenta una incidencia intermedia, de 5–10casos/100.000hab/año, y los factores de riesgo más frecuentemente asociados son la infección crónica por virus de la hepatitis C (VHC) y el alcoholismo4,5. El desarrollo de CHC se observa principalmente en presencia de una enfermedad hepática crónica, siendo el riesgo máximo (3–7% anual) cuando el paciente desarrolla cirrosis4,5. La prevención eficaz de la muerte por CHC se debe conseguir evitando la adquisición de factores de riesgo (prevención primaria). El mejor ejemplo es la caída drástica de la incidencia de CHC en Taiwán tras la implementación universal de la vacuna frente al VHB6. Lamentablemente, una vez que se ha desarrollado la cirrosis hepática, el riesgo de CHC se mantiene a pesar de obtener una respuesta viral persistente tras tratamiento7 y el único método eficaz para poder disminuir la mortalidad asociada al CHC es diagnosticar la enfermedad de forma precoz mediante la aplicación de programas de detección precoz8,9.
Seguimiento para la detección precoz de CHCPara que la estrategia de diagnóstico precoz de un tumor sea efectiva y pueda impactar en la supervivencia de los pacientes se debe definir la población de riesgo a la que debe ir dirigido el estudio, planificar el tipo/s de exploración diagnóstica y el intervalo de tiempo entre cada prueba.
1. Población de Riesgo: la indicación para participar en un programa de seguimiento intencionado para diagnóstico precoz de CHC está determinado por el nivel de riesgo de padecer este tumor. En este sentido, serán candidatos aquellos pacientes con cirrosis hepática de cualquier etiología (vírica, abuso de alcohol, hemocromatosis, autoinmune, etc.), cuyo estado general permita un tratamiento en caso de encontrar una lesión focal hepática maligna8,9. En los pacientes afectos de una cirrosis evolucionada/descompensada (estadio Child-Pugh C), solo se recomendará seguimiento en caso de ser candidatos a trasplante hepático con la única finalidad de descartar un CHC avanzado que pudiera contraindicar la posibilidad de trasplante o detectar la aparición de un CHC que pudiera otorgar al paciente prioridad para ser trasplantado. Los pacientes con cirrosis hepática por virus B o C en los que se ha conseguido curar la infección con tratamientos antivirales, deberán continuar en seguimiento, ya que la cirrosis persiste y por tanto, el riesgo de desarrollar un CHC7.
Otros grupos de riesgo candidatos a participar en programa de detección precoz son aquellos pacientes con hepatitis crónica por VHB con gran replicación y aquellos en que hay antecedentes de CHC en la familia o con coexistencia de HIV. Finalmente, no existen datos, de momento, sobre la idoneidad de incluir los pacientes con esteatohepatitis no alcohólica, ya que se desconoce en parte la historia natural de la enfermedad y la incidencia real de CHC8.
2. Técnicas de cribado: la exploración de cribado para la detección precoz en fase asintomática del CHC debe realizarse con una técnica de bajo coste, sensibilidad aceptable, fácil aplicación, repetible, disponible y sin riesgos asociados. Estos requisitos permiten realizar programas de seguimiento a un coste adecuado para los años de vida ganados y aceptable para la población diana. Fundamentalmente los test que se realizan se dividen en dos grupos: 1) Serológicos (marcadores tumorales) y 2) Técnicas de Imagen.
- 1)
Pruebas Serológicas: uno de los marcadores tumorales más usados para cribado de CHC ha sido la alfa-fetoproteína (AFP), generalmente asociada a la ecografía. Los niveles plasmáticos de este marcador son proporcionales al tamaño y estadio evolutivo del tumor, de tal manera que solo el 10% de los enfermos con un tumor inferior a 5cm presentan niveles plasmáticos superiores a 100ng/ml, hecho que limita su uso en la detección precoz de la enfermedad. En diferentes estudios, la AFP ha mostrado un bajo rendimiento diagnóstico10–12, por lo que actualmente no se recomienda su uso como método de cribado8,13,14. Otros marcadores serológicos como la AFP glicosilada, la des-gamma–carboxi protrombina o el glypican-3 tampoco han demostrado tener unos niveles de precisión diagnóstica que justifiquen su uso de forma rutinaria en el seguimiento de los pacientes de riesgo12,15–17.
- 2)
Técnicas de Imagen: las técnicas de imagen disponibles que se podrían utilizar en el seguimiento son la ecografía, la tomografía computarizada (TC) y la resonancia magnética (RM). La TC realizada de forma pautada cada varios meses y a lo largo de un periodo largo de tiempo causaría una elevada irradiación de los pacientes y sería caro a nivel coste/beneficio18. La RM tiene una gran sensibilidad y especificidad en el diagnóstico del CHC de pequeño tamaño, pero debido a su coste y disponibilidad deberá reservarse para confirmación diagnóstica y estadificación una vez la lesión ya se ha detectado por ultrasonidos. La ecografía es la técnica menos invasiva, por lo que se puede repetir periódicamente sin ningún riesgo para el paciente y puede tener elevada sensibilidad (60–80%) y especificidad (45–96%) en el diagnóstico del CHC si se utilizan buenos equipos ultrasonográficos y las personas que realizan la exploración están entrenadas en este tipo de estudio y patología19. Por tanto, la ecografía es la técnica de cribado de elección. En alteraciones difusas del parénquima hepático será fácilmente detectable un nódulo bien definido, diferente del resto del parénquima, mientras que en el hígado muy nodular existirán tantas imágenes correspondientes a nódulos de regeneración que un nuevo nódulo puede pasar desapercibido.
El objetivo fundamental de los programas de detección precoz es identificar lesiones en fase inicial, preferiblemente cuando el CHC es menor de 2cm, ya que existe una alta probabilidad que la lesión esté localizada y no haya producido invasión vascular20, por lo que es potencialmente posible la curación del paciente tras tratamiento.
La eficacia de los programas de detección precoz del CHC viene avalada por un estudio prospectivo y aleatorizado que incluyó pacientes con infección crónica por VHB. Los pacientes se estudiaron mediante ecografía y AFP cada 6 meses y se demostró un incremento de la supervivencia en el grupo de pacientes incluidos en el seguimiento con estas técnicas frente a los que no se realizó seguimiento estricto21. Además, múltiples estudios de cohortes y coste-eficacia han confirmado el beneficio de establecer un seguimiento mediante ecografía abdominal cada 6 meses22–27, por lo que su idoneidad es incuestionable y hacen que actualmente la ecografía sea la técnica de imagen aceptada para la realización del seguimiento de los pacientes con riesgo de padecer un CHC8,9.
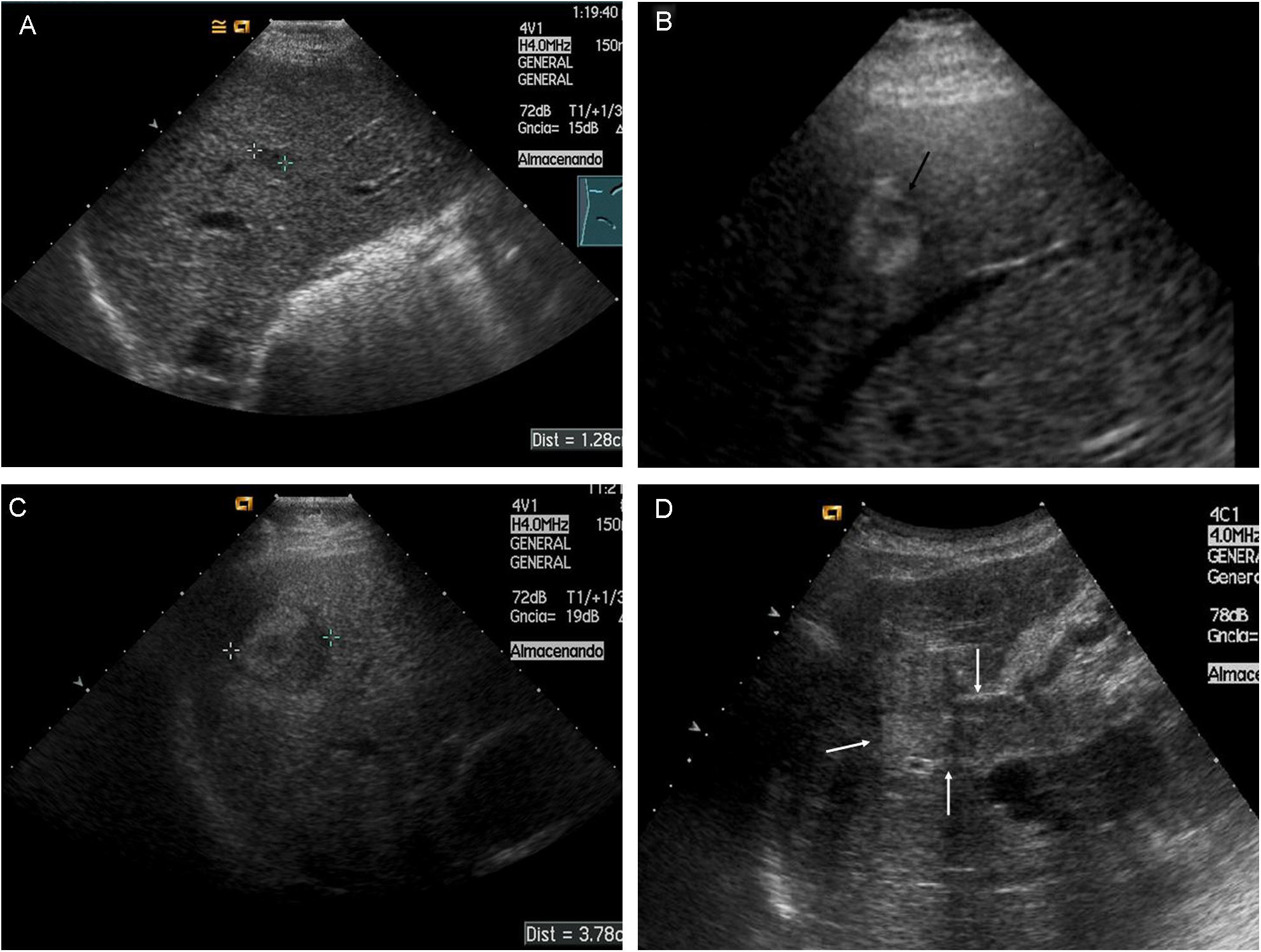
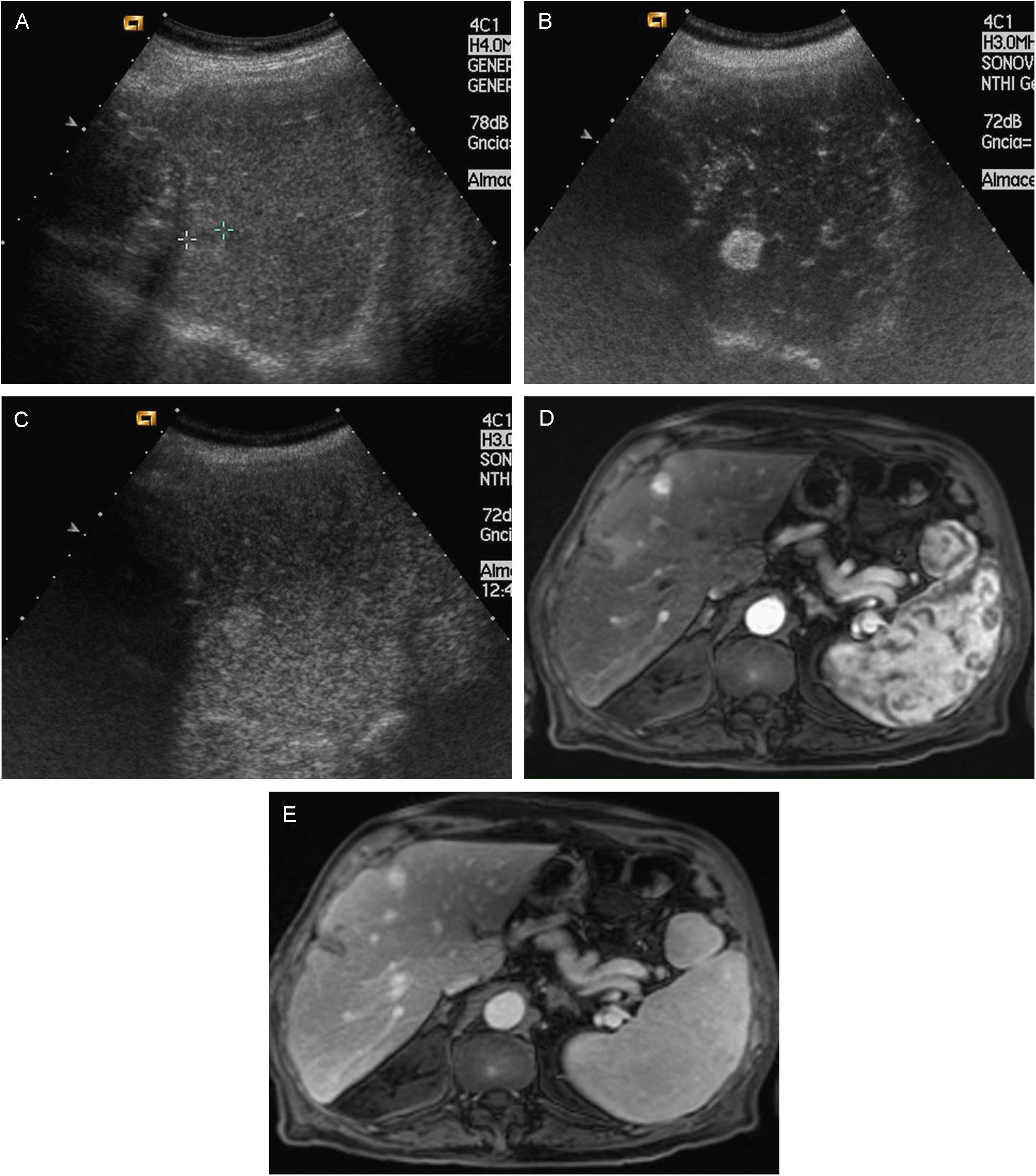
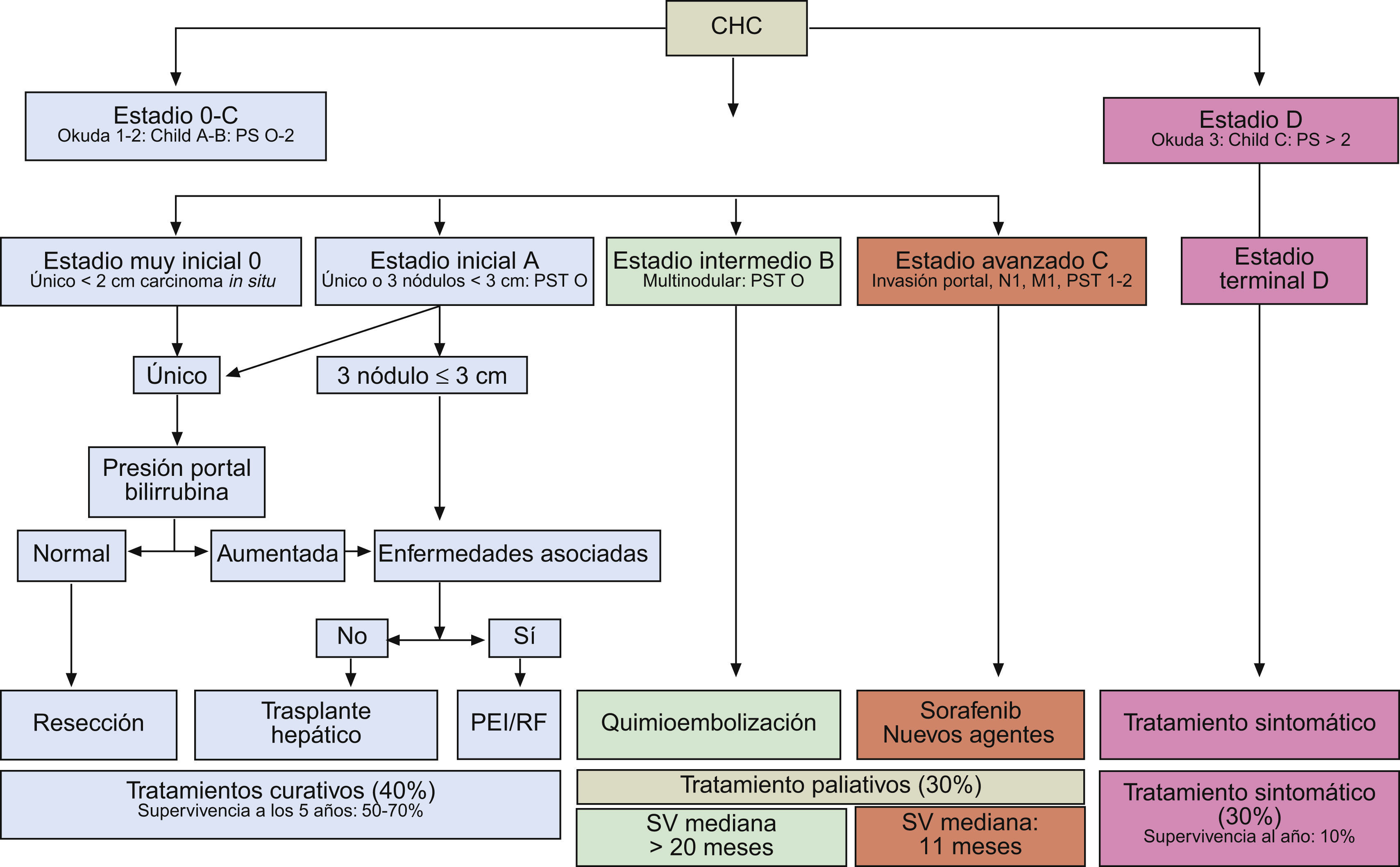
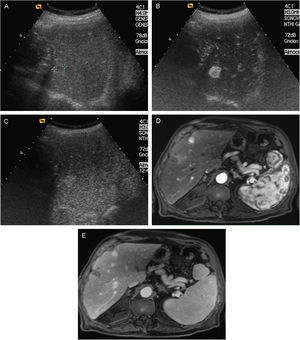
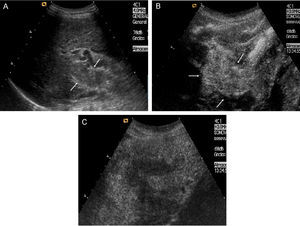
El CHC en fase inicial suele ser único, si bien en cerca del 20% de los casos puede ser multinodular por la aparición simultánea de varios focos de tumor. Los tumores pequeños son predominantemente hipoecoicos, pero la presencia de grasa hace que sean hiperecogénicos en algunos casos (fig. 1A y B).
Figura 1.Diferentes aspectos ecográficos del CHC. A) Pequeño nódulo hipoecoico de 13mm. En lóbulo derecho hepático (cursores). B) Nódulo ecogénico de 1,7cm (flecha). C) Nódulo de 3,7cm, heterogéneo, con halo hipoecoico, en cúpula del lóbulo derecho (cursores). D) Trombosis portal de aspecto expansivo, que traduce la invasión tumoral vascular en un paciente con CHC multinodular (flechas).
(0.3MB).El diagnóstico diferencial de los pequeños nódulos detectados durante el seguimiento deberá establecerse con lesiones benignas: angiomas, hamartomas, nódulos de regeneración y displasia de bajo grado. Las lesiones malignas que pueden hallarse en un paciente con cirrosis hepática son en, primer lugar el CHC, pero también podemos encontrar metástasis y colangiocarcinomas periféricos (CCP). La aparición de linfomas B asociados a los virus B y C son infrecuentes, pero el hecho de ser múltiples lesiones hipoecoicas de pequeño tamaño los puede diferenciar de las otras entidades28.
Los límites del CHC están relacionados con el tamaño y la agresividad. Así, mientras tumores en fase muy inicial, raramente reconocidos por técnicas de imagen, suelen ser agrupaciones celulares sin cápsula, los tumores de mayor tamaño pueden tener bordes imprecisos o bien un halo bien delimitado. Los de bordes imprecisos suelen ser tumores más agresivos, usualmente infiltrativos, mientras que los que tienen una pseudocápsula resultante de la compresión del tumor en el tejido de vecindad, son tumores expansivos con mejor pronóstico, siempre y cuando no sobrepasen la cápsula. Cuando el tumor es pequeño, el halo corresponde únicamente a la circulación periférica arterial.
Los tumores de gran tamaño suelen ser heterogéneos ya que presentan tabiques en el interior y zonas con diferente grado de necrosis, vascularización y fibrosis. Pueden persistir como una lesión única encapsulada (fig. 1C), pero en fases más avanzadas existirán múltiples lesiones de límites más o menos precisos y con invasión vascular29. El CHC tiene tendencia a invadir las venas hepáticas y/o porta, produciendo un aumento de tamaño del vaso cuyo aspecto es sólido, con vascularización arterial en su interior (fig. 1D).
3. Intervalo entre las pruebas: se desconoce cuál es el intervalo ideal entre cada test. Este intervalo se determina según la rapidez de crecimiento del tumor. El tiempo de duplicación del CHC no está bien establecido, aunque algunos estudios indican que está alrededor de los 2–4 meses30,31. Se han realizado diferentes estudios para ver cuál es la frecuencia de estudio con mayor coste/eficacia: exploraciones cada 3 meses comportan la observación de más imágenes nodulares comparado con los estudios cada 6 meses pero no incrementan el diagnóstico precoz ya que lo que se detecta son más nódulos benignos32. La ecografía anual no muestra peores resultados que la realizada cada 6 meses, si bien se observa una tendencia a hallar lesiones mas evolucionadas33. Las diferentes sociedades científicas han aceptado que el intervalo recomendado debe ser de 6 meses8,9,34.
En resumen, las recomendaciones de los expertos son:
- •
El seguimiento de los pacientes con riesgo de padecer un CHC debe efectuarse mediante ecografía cada 6 meses.
- •
No debe emplearse la AFP para el cribado.
Cuando en el transcurso del seguimiento de un paciente de riesgo se detecta un nódulo hepático, es preciso llegar a un diagnóstico concluyente de dicha lesión. Antes del año 2000, la confirmación diagnóstica del CHC debía realizarse mediante su estudio anatomopatológico. Los riesgos y, fundamentalmente, las limitaciones de la punción-biopsia hepática con aguja fina (PBHAF) llevaron a la búsqueda de otros posibles métodos diagnósticos alternativos. Las conclusiones de la conferencia monotemática de la EASL (European Association for the Study of the Liver) sobre el manejo del CHC celebrada en Barcelona en el año 2000 definieron por vez primera unos criterios de diagnóstico no invasivo que permitían establecer un diagnóstico definitivo de CHC en pacientes cirróticos sin necesidad de confirmación citohistológica en los nódulos mayores de 2cm34. En el año 2005 se revisaron los criterios de diagnóstico no invasivo por parte de la AASLD (American Association for the Study of Liver Diseases); dichos criterios se publicaron en las guías de práctica clínica del CHC8 y han sido aceptados por la EASL y por un grupo de expertos de las diferentes sociedades científicas nacionales implicadas en el manejo del CHC9. Estos criterios se basan en la detección del patrón vascular característico definido por captación homogénea del contraste en fase arterial seguido de lavado de contraste en fase venosa.
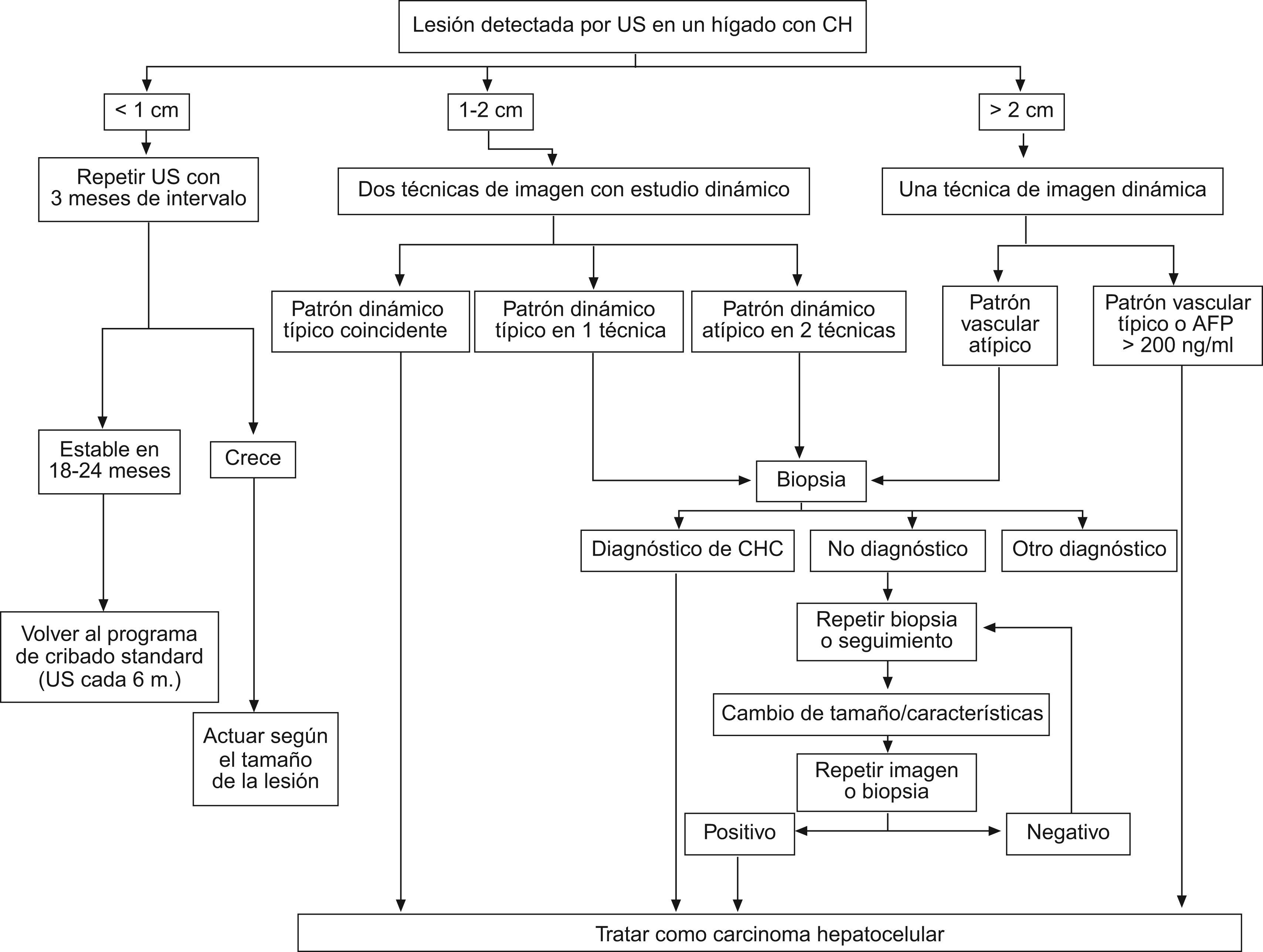
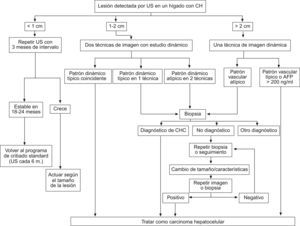
Con el fin de optimizar la estrategia diagnóstica, las guías de práctica clínica propuestas por la AASLD sugieren un algoritmo diagnóstico resumido en la figura 2, que se basa en la realización de técnicas de imagen dinámicas (US con contraste, TC multifásica, RM dinámica). La secuencia de las pruebas viene determinada por el tamaño del nódulo a estudiar:
- 1.
Lesión > de 2cm de diámetro: se puede establecer el diagnóstico concluyente de CHC si alguna de las técnicas de imagen descritas muestra el patrón vascular característico de CHC (fig. 3). En caso contrario se recomienda la obtención de una biopsia.
- 2.
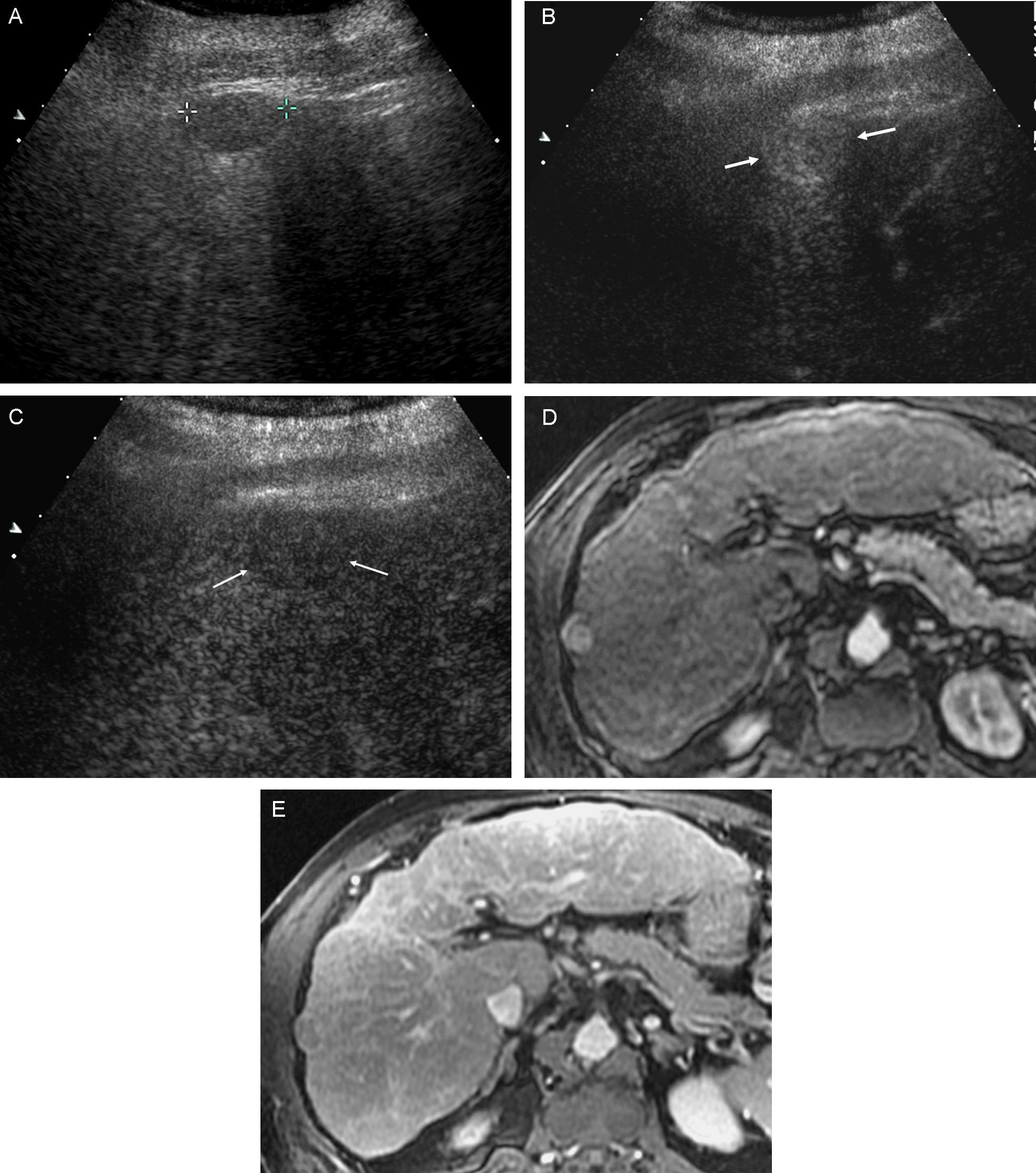
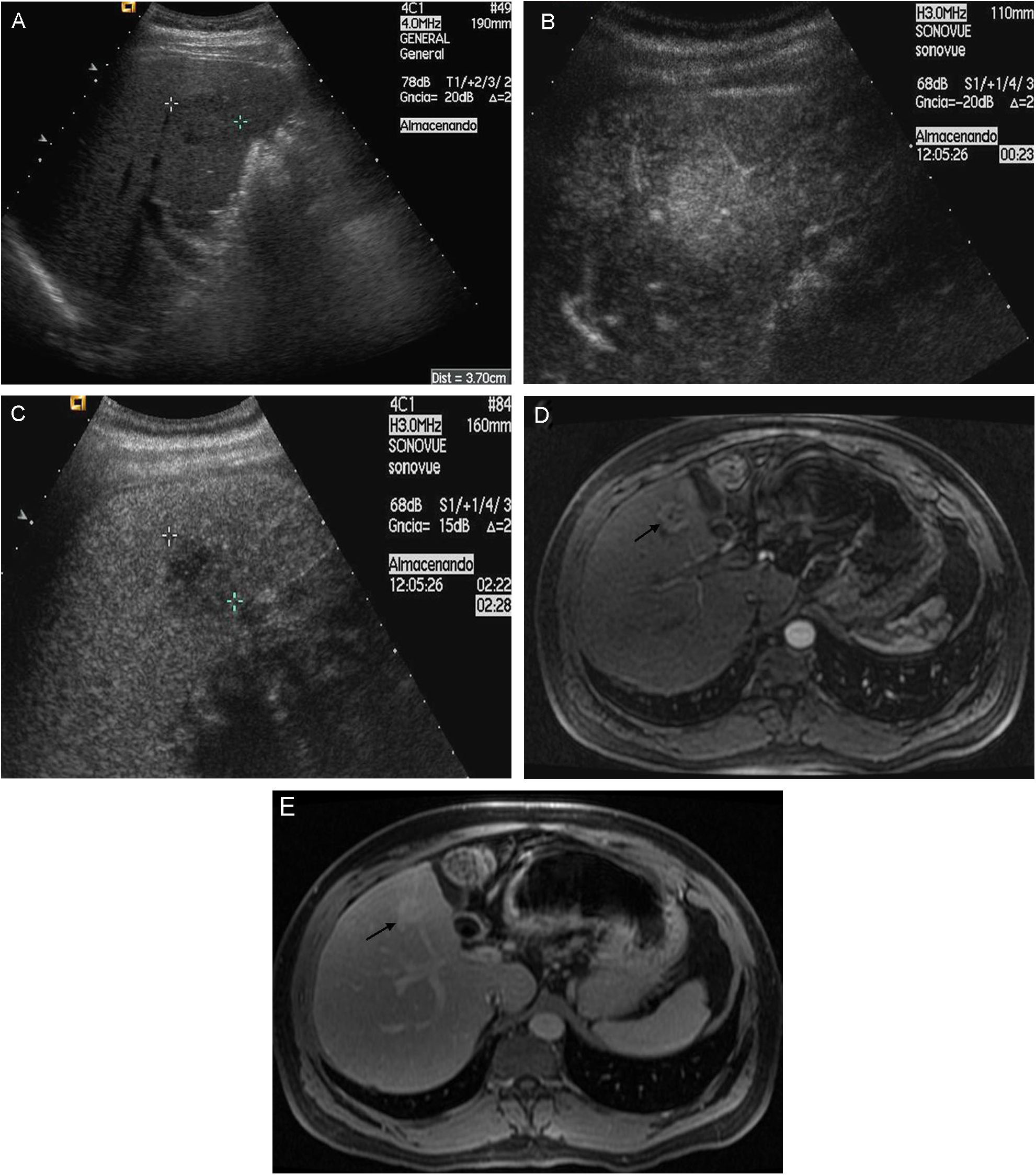
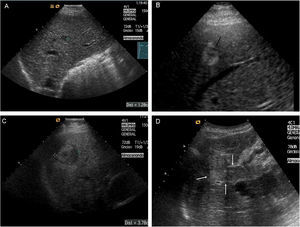
Lesión de 1–2cm de diámetro: con la finalidad de evitar lecturas controvertidas, se exige la demostración del patrón vascular característico de forma coincidente mediante 2 técnicas de imagen (fig. 4). En caso contrario, debe realizarse una biopsia.
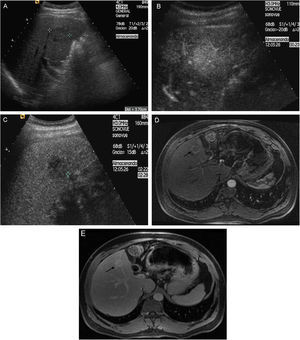
Figura 4.Nódulo subcapsular de CHC de 16mm En LHD con patrón vascular típico coincidente en dos técnicas de imagen. A) Nódulo hipoecoico en el estudio ecográfico basal (cursores). B) La USC en fase arterial confirma la naturaleza hipervascular de la lesión (flechas). C) USC: lavado en fase venosa (flechas). D) La fase arterial de la RM dinámica muestra captación arterial de la lesión. E) RM: la fase venosa muestra lavado del nódulo.
(0.44MB). - 3.
Lesionescm: en la mayoría de los casos son lesiones benignas que no crecen o bien desaparecen durante el seguimiento. Además, su correcta caracterización mediante técnicas de imagen o biopsia es en muchas ocasiones imposible. Por tanto, ante la detección de un nódulo infracentrimétrico se recomienda un control estrecho mediante ecografía con un intervalo de 3–4 meses. Si la lesión permanece estable al cabo de 18–24 meses, se puede volver al seguimiento estándar cada 6 meses mediante US. En caso de crecimiento, se actuará de acuerdo al tamaño que haya alcanzado el tumor.
Estrategia diagnóstica ante la detección de un nódulo hepático en una ecografía de cribado en pacientes con cirrosis hepática. Reproducción adaptada de Bruix and Sherman8.
Es interesante destacar que un pequeño porcentaje de nódulos de CHC de tamaño inferior a 20mm son hipovasculares en la fase arterial de los estudios dinámicos de imagen, probablemente por el desarrollo insuficiente de una red arterial de vasos neoformados20. Por ello, con los criterios de diagnóstico no invasivos, únicamente se podrán diagnosticar aquellos CHC que hayan desarrollado una completa neoangiogénesis, hecho que en muchas ocasiones no ocurre en lesiones por debajo de 2cm de tamaño. Por tanto, la biopsia tiene un rol importante en el diagnóstico precoz del CHC.
La biopsia de los nódulos hepáticos se hace habitualmente bajo control ecográfico. La punción puede realizarse indistintamente con aguja de aspiración (PAAF) o con aguja de corte. La elección de una u otra dependerá fundamentalmente de las preferencias del patólogo de cada centro. El calibre de la aguja utilizado oscila entre 18–20G. Lamentablemente, el rendimiento de la punción-biopsia para el diagnóstico precoz del CHC es bajo. En primer lugar, en algunos casos no es posible realizar la punción debido a la localización del nódulo, la presencia de ascitis o a trastornos severos de la coagulación. Además, la biopsia de estos nódulos de pequeño tamaño (< de 2cm) se asocia a una tasa de falsos negativos que puede llegar a ser de hasta un 30%, según algunos estudios, debido a errores de muestreo o a dificultades para diferenciar CHC bien diferenciado de otras lesiones premalignas (pej. nódulos displásicos)10,35,36. Con la finalidad de aumentar el rendimiento diagnóstico de la punción-biopsia, se ha propuesto el uso de técnicas inmunohistoquímicas37,38 o de genética molecular39; sin embargo, la utilidad de estas propuestas deberá ser validada en la práctica clínica. Por tanto, una biopsia negativa no descarta la posibilidad de CHC y se debe considerar la realización de una nueva biopsia o un seguimiento estrecho de la lesión.
Estas recomendaciones han sido recientemente validadas en un estudio prospectivo realizado en nuestra unidad. Se incluyeron 89 pacientes cirróticos, en los que se detectó durante el seguimiento con US un nódulo único de nueva aparición de entre 5 y 20mm10. Se les realizó de forma basal una ecografía con contraste (USC), RM dinámica y una biopsia (técnica gold-standard); esta última se repitió en caso de negatividad inicial. En caso de ausencia de diagnóstico concluyente se realizó un seguimiento estrecho mediante USC cada 3 meses y RM cada 6 meses para descartar la posibilidad de CHC. El diagnóstico final de las lesiones fue: 60 CHC, 1 colangiocarcinoma, y 28 lesiones benignas. Teniendo en cuenta el patrón vascular característico (hipervascularización en fase arterial y lavado en fase venosa), la sensibilidad y especificidad fueron 61,7% y 96,6% para la RM y 51,7% y 93,1% para la USC, respectivamente. En caso de exigir el patrón típico de forma coincidente en ambas técnicas, la especificidad fue de 100%, pero con una sensibilidad de 33,3%10. Además, la primera biopsia presentó una tasa de falsos negativos de 30%. Por tanto, este estudio valida la utilidad de los criterios no invasivos para el diagnóstico de CHC, confirma la necesidad de demostrar de forma coincidente en dos pruebas de imagen el patrón característico para evitar falsos diagnósticos de CHC, y por último, demuestra que la ausencia de vascularización arterial en un estudio dinámico o una biopsia negativa no descarta el diagnóstico de CHC.
En los últimos años han aparecido avances en el uso de técnicas de imagen para el diagnóstico del CHC. En este sentido, la RM empleando contrastes órgano-específicos como son los SPIO, captados por las células de Kuppfer, y los contrastes hepatobiliares, captados por los hepatocitos, han demostrado un rendimiento diagnóstico similar a la TC multidetector para la detección de lesiones de CHC, si bien estos estudios no están centrados específicamente en lesiones de pequeño tamaño40–43. Existen discrepancias en si el tipo de captación arterial o tardía del CHC puede relacionarse con el grado de diferenciación tumoral. Estudios previos realizados mediante ecografía con contraste44 o TC45 describen su relación, aunque otros estudios como el reciente de Frericks y cols efectuado con RM (Gd-EOB-DTPA) no lo ha validado43. Estos autores describen un patrón vascular del CHC típico tras la inyección de Gd-EOB-DTPA (captación arterial y lavado venoso) similar al descrito como característico cuando se emplea contraste paramagnético extracelular. Sin embargo, este patrón también ha sido recientemente descrito en 3 hemangiomas de alto flujo, limitando su fiabilidad46. Todo esto hace que por el momento no haya datos que permitan considerar a los contrastes específicos de RM en la primera línea de diagnóstico en los pacientes con CHC.
Otro avance importante en el campo del diagnóstico por imagen del CHC ha sido el desarrollo de la ecografía con contraste. Esta técnica permite caracterizar las lesiones nodulares detectadas mediante ecografía47 y constituye un complemento ideal para confirmar los hallazgos obtenidos mediante RM/TC48.
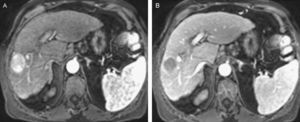
Deben realizarse algunas consideraciones referentes a las diferentes técnicas de imagen que se utilizan para establecer el diagnóstico. En primer lugar, debe tenerse en cuenta que los contrastes ecográficos que actualmente se utilizan son puramente intravasculares, a diferencia de los contrastes empleados en la TC y RM que pueden pasar al espacio intersticial. Esto puede condicionar resultados discordantes en el aspecto de algunas lesiones hepáticas estudiadas mediante Ecografía con contraste o la TC/RM49. Asimismo, puede ser útil exponer algunos aspectos de los patrones de captación de lesiones que podemos encontrar en el seguimiento de un paciente cirrótico. Los nódulos de regeneración, las displasias de bajo grado y los hamartomas no presentan captación arterial. Los angiomas presentan captación arterial periférica que posteriormente se hace iso-hipercaptante y homogénea en fases tardías, siendo el patrón característico. Los angiomas de pequeño tamaño pueden presentar infrecuentemente, captación arterial completa, permaneciendo iso-hipercaptantes con respecto al parénquima en fases tardías (fig. 5).
Lesión detectada en el seguimiento semestral mediante US en un paciente con CH, en la que debe realizarse un diagnóstico diferencial entre hemangioma/CHC. A) En la US basal se observa imagen nodular ecogénica, de 17mm, con centro algo más hipoecoico (cursores). B) USC: en la fase arterial la lesión presenta una clara captación nodular completa. C) USC: en la fase venosa tardía la lesión permanece hiperecogénica, lo que no es característico de CHC y apoya el diagnóstico de lesión benigna. D) Captación nodular completa de la lesión en la fase arterial de la RM. E) En la fase venosa tardía se aprecia una persistencia de la captación. La lesión fue caracterizada como hemangioma.
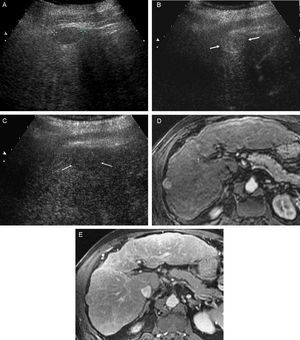
La displasia de alto grado suele presentar hipercaptación arterial, manteniéndose isocaptante en fases portales y tardías, ya que a diferencia del CHC, conservan la vascularización portal. Las metástasis hepáticas suelen presentar una captación arterial, habitualmente anular, seguida de un aclaramiento rápido del contraste en fases venosas, indicativas de malignidad. Los CCP también presentan generalmente captación arterial anular, pero se ha observado que en algunos casos de CCP, especialmente de pequeño tamaño, pueden presentar captación arterial nodular completa, seguido de lavado en fase venosa en los estudios mediante ecografía con contraste, imagen indistinguible de un CHC50,51. En estos tumores, la ausencia de lavado en la fase tardía de la RM ayuda a distinguirlos (fig. 6)52.
Paciente con CH por VHC, con lesión hepática diagnosticada de colangiocarcinoma intrahepático mediante biopsia percutánea. En este caso, el patrón de captación de contraste ecográfico fue indistinguible de un CHC. A) En la ecografía basal se aprecia lesión hipoecoica de 37mm. A nivel del lóbulo derecho hepático (cursores). B) En la fase arterial de la USC se aprecia hipercaptación completa de la lesión. C) En fase venosa tardía de la USC se aprecia claro lavado del contraste. D) En la fase arterial de la RM se observa captación casi completa de la lesión. E) Persistencia de captación en la fase venosa tardía de la RM.
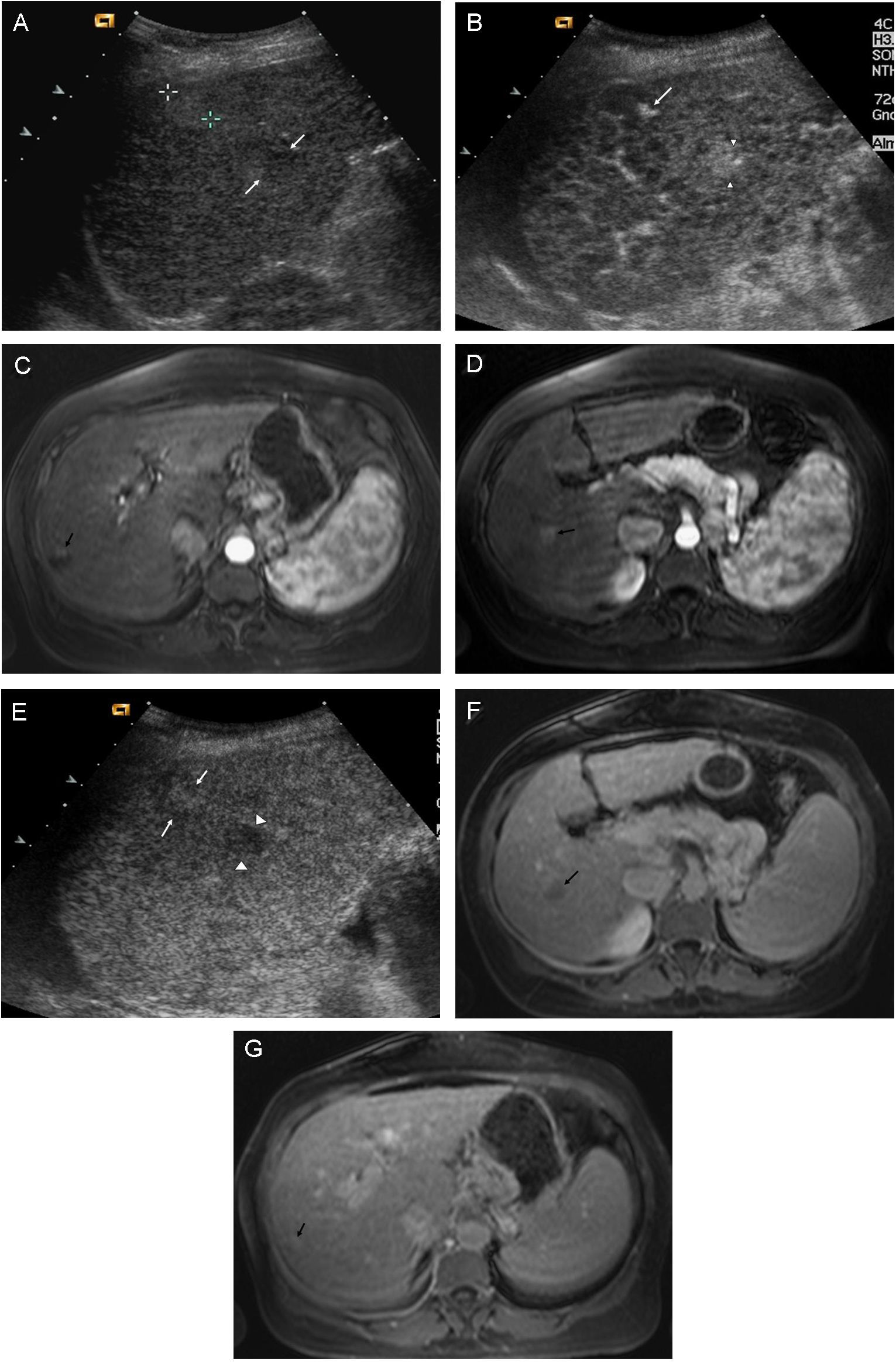
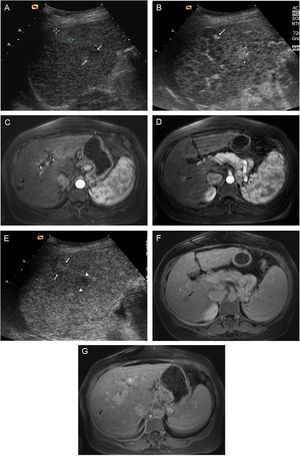
En ocasiones, en el mismo paciente se detecta de forma simultánea una lesión benigna y una maligna. En esos casos, las técnicas de imagen dinámicas nos pueden ayudar a diferenciarlas y precisar cuál es la lesión diana de posibles biopsias diagnósticas o tratamientos percutáneos (fig. 7).
Detección simultánea de 2 lesiones. Una lesión benigna (hemangioma) en situación subcapsular y otra maligna (CHC), en un paciente con Cirrosis Hepática. Las lesiones fueron estudiadas mediante USC y RM. A) En la ecografía basal se observan dos lesiones cercanas, en el lóbulo derecho hepático, una de ellas ligeramente ecogénica, más subcapsular (cursores) y otra hipoecoica más central (flechas). B) La administración de contraste permite observar, en la fase arterial de la USC, la diferente captación de las dos lesiones. En la lesión subcapsular se aprecia captación nodular periférica (flecha), mientras que en la lesión profunda se observa captación completa (cabezas de flecha). C) En la fase arterial de la RM se observa la misma captación nodular periférica de la lesión subcapsular (flecha). D) En la fase arterial de la RM se confirma la captación completa de la lesión profunda (flecha). E) En la fase venosa tardía de la USC, la lesión subcapsular permanece iso-hiperecogénica con respecto al resto del parénquima (flechas), mientras que la lesión profunda muestra un claro lavado del contraste (cabezas de flecha). F) En la fase venosa de la RM se observa también lavado de esta lesión profunda (flecha). G): En la fase venosa tardía de la RM se aprecia que la lesión subcapsular presenta una captación similar al resto del parénquima.
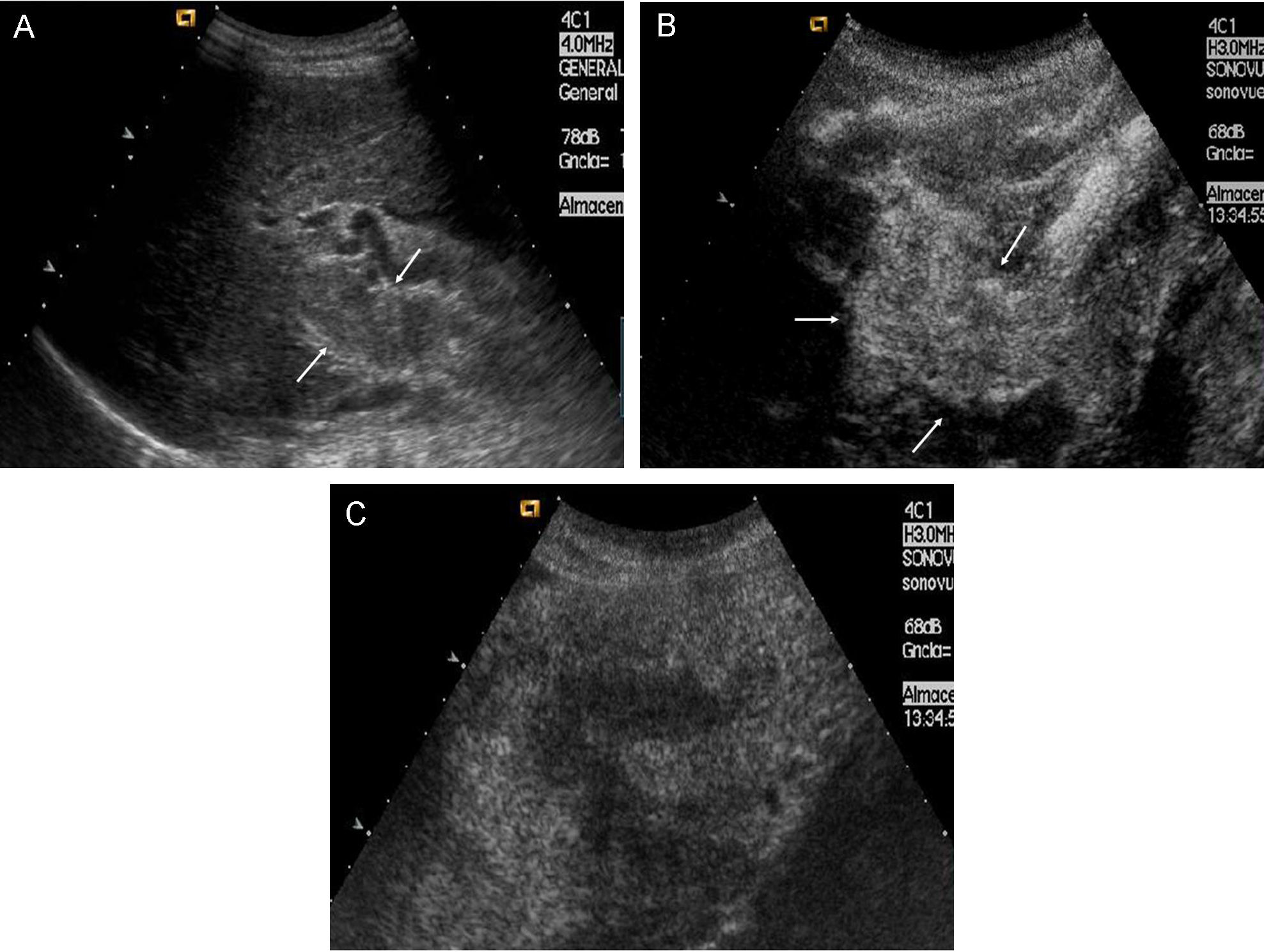
Una correcta estadificación tumoral es esencial para tomar la decisión terapéutica más adecuada en cada caso. La detección de nódulos adicionales y/o de invasión vascular son aspectos claves en el diagnóstico de extensión del CHC, ya que ambas circunstancias reflejan un estadio tumoral avanzado, y por ello, sin indicación de aplicar tratamientos con intención radical. La RM es la técnica de elección para la detección de lesiones adicionales de pequeño tamaño, con un rendimiento superior al de la TC helicoidal en nódulos de entre 10 y 20mm53. La TC multidetector supone una técnica alternativa válida. A pesar de los avances tecnológicos, las lesiones adicionales de tamaño inferior a 1cm resultan un problema diagnóstico aun sin resolver, ya que el rendimiento de la TC y RM para la detección y caracterización de estas lesiones es inferior al 50%53. La invasión tumoral vascular suele presentarse como una trombosis de aspecto expansivo, que en algunos casos puede presentar hipervascularización arterial. El uso de técnicas dinámicas (USC, TC y RM) ayuda a identificar la vascularización arterial intratumoral y permite distinguirlo de trombosis benignas y cavernomatosis portal (fig. 8). En casos dudosos, la punción biopsia con aguja fina del trombo puede establecer su naturaleza maligna54. La diseminación extrahepática es poco frecuente en estadios iniciales de la enfermedad. No obstante, se debe considerar la realización de una TC de tórax de acuerdo a criterio clínico. Las metástasis óseas son por lo general sintomáticas, y si se sospechan clínicamente, deben ser descartadas mediante gammagrafía ósea. Las metástasis cerebrales son excepcionales.
Paciente con CHC y trombosis portal tumoral. A) En la US basal se aprecia trombosis de aspecto sólido y expansivo que ocupa el tronco principal y la rama derecha portal (flechas). B) Tras administrar contraste ecográfico se aprecia intensa captación intratumoral en la fase arterial que demuestra la naturaleza tumoral de la trombosis. C) En la fase venosa tardía se aprecia un lavado de la captación tumoral intravascular con respecto al resto del parénquima hepático.
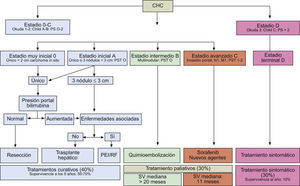
Una vez obtenido el diagnóstico, es necesario realizar el estudio de extensión de la enfermedad y una valoración pronóstica que nos permita informar al paciente y a los familiares sobre la expectativa de vida, elegir la opción terapéutica más adecuada y evaluar su respuesta. Teniendo en cuenta que el CHC aparece en la mayoría de los casos asociado a una cirrosis hepática, y que el grado de alteración de la función hepática determina las opciones terapéuticas y la supervivencia independientemente de la presencia del CHC, es imprescindible considerar este aspecto conjuntamente con la extensión tumoral. Además, la presencia de síntomas ha mostrado un gran valor pronóstico55, y al igual que el grado de reserva funcional hepática, determina la aplicabilidad de los diferentes tratamientos disponibles. Por tanto, aquellos sistemas pronósticos que tienen en cuenta únicamente la extensión tumoral como el TNM56, la función hepática como el sistema Child-Pugh57 o el sistema MELD58 o la presencia de síntomas como la clasificación ECOG Performance Status59 o el índice Karnofsky60 son imprecisos para evaluar el pronóstico del paciente afecto de CHC y únicamente son útiles para detectar enfermedad terminal. En los últimos años han aparecido múltiples sistemas de estadificación que tienen en cuenta factores asociados a la extensión tumoral y a la función hepática61. De todos ellos, el único que relaciona el estadio de la enfermedad con la recomendación terapéutica y que además ha sido validado en Europa62,63, Estados Unidos64 y Asia es el sistema Barcelona-Clinic-Liver-Cancer (BCLC) (fig. 9)65. Por su reconocida capacidad predictiva y su utilidad en el proceso de decisión de tratamiento ha sido el sistema recomendado por la AASLD8,66 y por las guías de práctica clínica españolas9.
Sistema de estadificación BCLC (Barcelona-Clinic-Liver-Cancer). Adaptado de Forner et al9.
El sistema BCLC incluye variables asociadas al estadio tumoral (tamaño y número de lesiones, presencia de invasión vascular y/o enfermedad extrahepática), función hepática (clasificación Child-Pugh) y presencia de síntomas (ECOG Performance Status) y distingue cuatro grupos pronóstico principales con su correspondiente recomendación terapéutica (fig. 9):
- •
Estadio inicial (estadio A): incluye pacientes asintomáticos con función hepática conservada (Child-Pugh A y B) con un CHC solitario o un máximo de 3 nódulos hasta 3cm de diámetro. En estos casos es posible aplicar tratamientos con intención curativa y la supervivencia esperada a los 5 años es de 50–75%. De forma resumida, son candidatos a resección quirúrgica los pacientes afectos de un CHC solitario. con función hepática conservada sin hipertensión portal clínicamente relevante y bilirrubina normal (<1mg/dl)67. Un subgrupo con especial buen pronóstico son aquellos pacientes con un CHC solitario menor de 2cm. (CHC muy inicial, estadio 0), que correspondería al concepto de carcinoma in situ20, en los que la resección quirúrgica o ablación percutánea ofrecerían una alta probabilidad de curación. En aquellos pacientes afectos de CHC multifocal (n≤3) y/o que presentan cierto grado de disfunción hepática, el tratamiento recomendado es el trasplante hepático. Finalmente, en aquellos pacientes no subsidiarios de trasplante hepático, el tratamiento primario de elección es la ablación percutánea.
- •
Estadio intermedio (estadio B): son pacientes con tumores multinodulares que exceden los criterios anteriormente descritos, sin invasión vascular ni extrahepática, con función hepática y estado general conservado. En este grupo de pacientes, el único tratamiento que ha mostrado beneficio en término de supervivencia es la quimioembolización68 y la supervivencia mediana esperada es superior a 20 meses.
- •
Estadio avanzado (estadio C): en este estadio encontramos pacientes con función hepática conservada, pero que presentan un CHC con invasión vascular y/o extrahepática o con afectación leve del estado general. Hasta ahora no se disponía de un tratamiento eficaz y estos pacientes eran candidatos a participar en ensayos clínicos para evaluar nuevas opciones terapéuticas. De todos los agentes evaluados, el único fármaco que ha demostrado beneficio en términos de supervivencia es el sorafenib69,70 y en el momento actual constituye el único tratamiento paliativo disponible en este estadio9,66.
- •
Estadio terminal (estadio D): son pacientes que presentan afectación grave del estado general y/o función hepática muy comprometida (Child-Pugh C) no candidatos a trasplante hepático. La mediana de supervivencia es menor de 3 meses y únicamente se debe indicar tratamiento sintomático.
Ramon Vilana: Diseño del trabajo. Redacción de parte del capítulo y revisión critica del mismo. Aprobación final a la versión que se envía para publicar.
El resto de autores obtención de datos , diseño y redacción de parte del trabajo.
Los autores han leido y aprueban la versión final del documento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al cierre de la edición de este número la Asociación Americana del Estudio de Enfermedades Hepáticas (AASLD) ha incorporado en su página Web la última actualización sobre el manejo del Carcinoma Hepatocecular (Bruix, J., and Sherman, M. Management of Hepatocellular Carcinoma: An Update. American Association for the Study of Liver Diseases. Retrieved September 28, 2010 from http://www.aasld.org/practiceguidelines). Estas Guías se publicarán en la revista Hepatology. Dado que existen cambios considerables, fundamentalmente en el diagnóstico del CHC por Técnicas de Imagen, próximamente los autores Vilana R et al, escribirán un adendum para este artículo.