La degeneración neuronal distal (DND) define el proceso de desintegración de una neurona o un circuito neuronal como consecuencia de una noxa localizada a distancia. Es un hallazgo frecuente debido al creciente número de realización de pruebas de imagen y a que refleja un desenlace común a múltiples etiologías. El objetivo de este artículo es definir los distintos tipos de daño neuronal a distancia, revisar la anatomía y función de los tractos más frecuentemente afectados e ilustrar la DND con esquemas y casos representativos de la práctica habitual.
ConclusiónEl conocimiento de la respuesta a distancia esperable según la topografía de una lesión neuronal es crucial para evitar errores diagnósticos. La degeneración axonal y transináptica puede ser tanto anterógrada como retrógrada. Los estudios de metabolismo cerebral, las secuencias de perfusión y de difusión muestran cambios cada vez más precoces del mismo proceso con los que debemos estar familiarizados.
Distal nerve degeneration refers to the process of disintegration of a neuron or neuronal circuit as a consequence of distal damage. The end result of multiple etiologies, this finding is becoming common due to the increasing number of imaging tests done. This paper aims to define the different types of distal nerve damage, review the anatomy and function of the most commonly affected tracts, and illustrate distal nerve damage through diagrams and representative cases from routine practice.
ConclusionKnowing the distant response that can be expected according to the topography of a neuronal lesion is crucial to avoid diagnostic errors. Axonal degeneration and transsynaptic degeneration can be both antegrade and retrograde. Studies of cerebral metabolism, perfusion sequences, and diffusion sequences are showing increasingly earlier changes related to the same process; radiologists need to be aware of these changes.
La degeneración neuronal distal (DND) o secundaria define el proceso de desmielinización y desintegración de una neurona o un circuito neuronal como consecuencia de una noxa localizada a distancia. Refleja un desenlace común a múltiples etiologías y con el creciente número pruebas de imagen el radiólogo debe estar familiarizado con los signos a distancia esperables de la DND en las vías neuronales principales. El objetivo de este artículo es definir los distintos tipos de daño neuronal a distancia y revisar la anatomía y la función de los tractos más frecuentemente afectados.
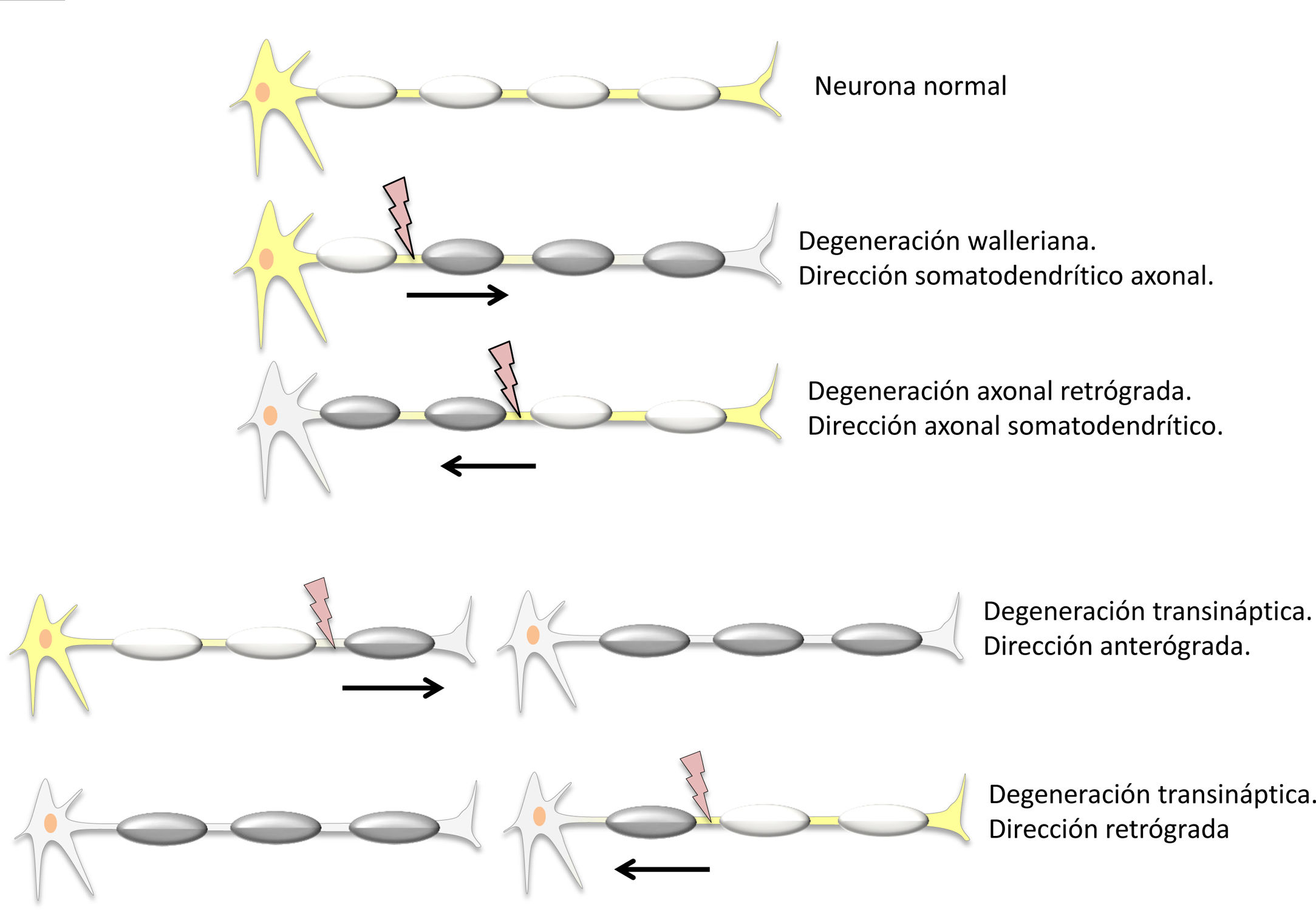
Tipos de degeneración neuronal secundariaLa degeneración axonal (DA) es la desintegración del axón por el daño recibido en el soma de la misma neurona. Se describió por primera vez por Waller1, que aplicó el término a neuronas periféricas, aunque se usa indistintamente para el sistema nervioso central. La DA en sentido anterógrado, desde el soma hacia el axón, se conoce como degeneración walleriana (DW). También puede darse la DA retrógrada cuando se degenera el soma neuronal a partir del daño axonal.
La degeneración transneuronal o transináptica (DT) es la desintegración de una neurona distinta de la que ha recibido el daño. Afecta a neuronas intactas pero sinápticamente relacionadas. La DT anterógrada es la afectación de la neurona distal, postsináptica, en sentido axonal-somatodendrítico. En la DT retrógrada se degenera la neurona proximal, presináptica, siendo el sentido somatodendrítico-axonal2 (fig. 1). Debe recordarse que tanto la DA como la transináptica pueden ser anterógradas o retrógradas.
Tras el daño, la desintegración física del axón no tiene repercusión a distancia. A las 4semanas, se destruyen los fragmentos proteicos de la mielina, con preservación de los lípidos, incrementando la ratio lípido-proteína. El ambiente hidrofóbico resulta en una señal hipointensa en secuencias de TR largo. En esta fase precoz se ha constatado una restricción de la difusión que puede resolverse, conociéndose como DA aguda o predegeneración walleriana3,4. A los 3meses aproximadamente, la reabsorción de lípidos y la respuesta astrocítica supone un ambiente más hidrofílico e incrementa la señal T2/FLAIR, con resolución en la secuencia de difusión (fig. 2). A largo plazo se producen la pérdida de volumen y la atrofia de los tractos axonales (fig. 3)5,6.
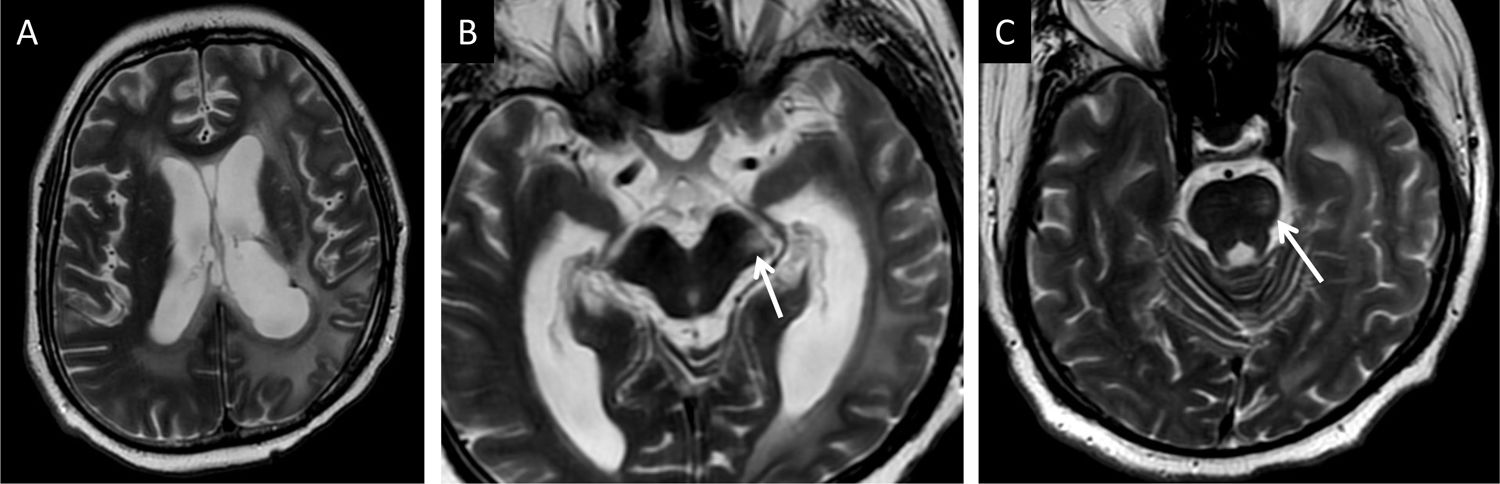
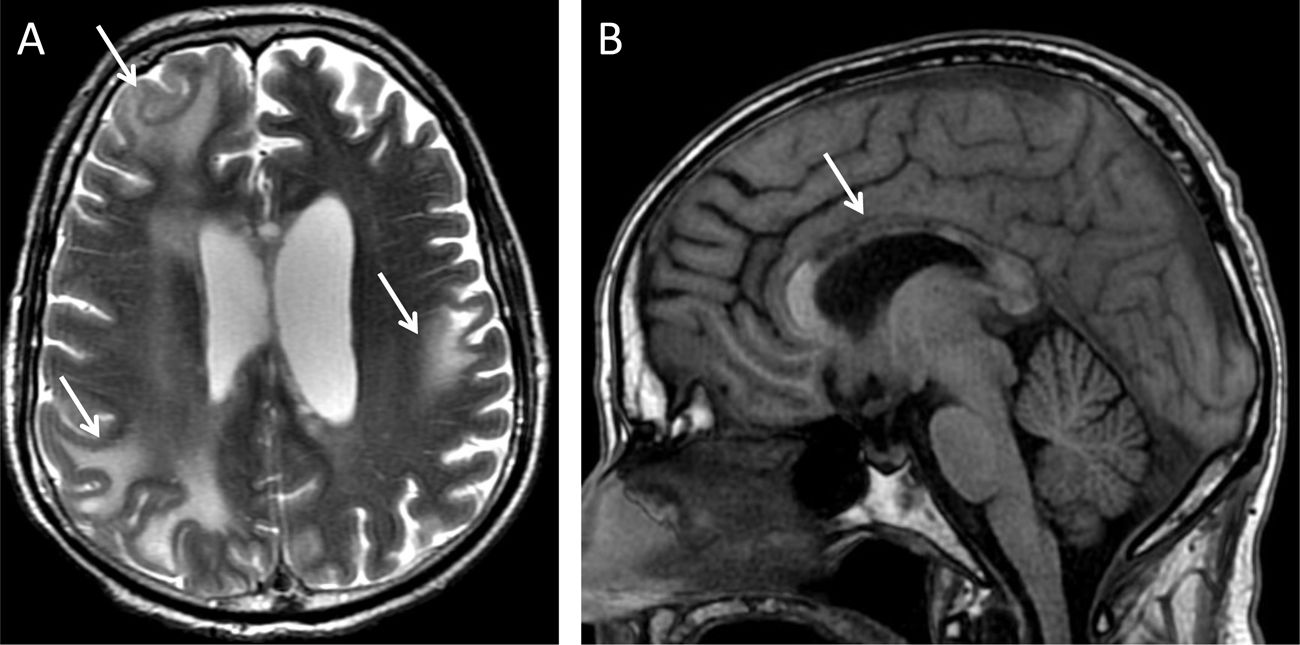
Varón de 22 años intervenido e irradiado por un tumor glial supratentorial con degeneración walleriana asociada del haz corticoespinal izquierdo. Presenta incremento de la intensidad de señal en T2 en el pedúnculo cerebral (flecha en B) y en hemiprotuberancia izquierda (flecha en C) preservando el volumen en ambas estructuras.
Niño de 3 años con infarto antiguo de arteria cerebral media derecha. Imágenes evolutivas potenciadas en T2 muestran la pérdida de volumen talámico (punta de flecha en A) por degeneración transináptica retrógrada de las proyecciones tálamo-corticales y del pedúnculo cerebral derecho (flecha amarilla en B) por degeneración walleriana del haz corticoespinal.
Se origina a partir de los somas neuronales de la corteza motora primaria y área suplementaria, desciende por la corona radiada, la rodilla y tercio posterior del brazo posterior de la cápsula interna, continúa por los pedúnculos cerebrales hasta la vertiente anterior de la protuberancia y bulbo. El 90% de las fibras cruzan al lado contralateral en la decusación piramidal en el inferior del bulbo y descienden por el tracto lateral del haz corticoespinal de la médula7. Transmiten los impulsos nerviosos desde la corteza cerebral motora hasta las motoneuronas alfa de las astas ventrales de la médula espinal.
Es la vía neuronal que más frecuentemente muestra DNS debido a la enfermedad isquémica de la arteria cerebral media. La DW es la respuesta más común, pero es posible visualizar degeneración retrógrada coexistiendo con la anterógrada cuando se afecta inicialmente la región subcortical y alteración transináptica en la motoneurona inferior8,9 (figs. 2 y 3).
Cuerpo callosoEl cuerpo calloso (CC) es la gran comisura de conexión interhemisférica, cuya función principal es conectar ambos hemisferios cerebrales. La mayor parte de las neuronas se proyectan desde la capa iii hacia el hemisferio contralateral y hacen sinapsis en neuronas contralaterales de las capas iii y iv. Precisamente la capa iii es la más vulnerable a la isquemia2,3,5.
Las mismas noxas que causan DW de la vía corticoespinal en un hemisferio pueden causar DW del axón que cruza al hemisferio contralateral. Cuando el número de fibras glióticas se limita a un haz concreto, puede resultar en atrofia focal del CC; existe correspondencia topográfica entre la atrofia focal del CC con la correspondiente atrofia cortical cerebral10. En cambio, las enfermedades degenerativas, como la demencia vascular o la enfermedad de Alzheimer, muestran atrofia difusa del CC11. El envejecimiento normal también conlleva el adelgazamiento de la rodilla y parte anterior del cuerpo de CC, siendo una manifestación indirecta de la atrofia de lóbulos frontales y de fibras interhemisféricas (figs. 4 y 5)12.
Varón de 18 años con encefalomielitis aguda diseminada de mala evolución. A) Imagen transversal potenciada en T2: se identifican múltiples áreas de alteración de señal y pérdida de volumen de sustancia blanca subcortical (flechas). Secundariamente se confirma la alteración de intensidad de señal y el adelgazamiento del cuerpo del CC y, en menor medida, del esplenio (flecha en B, imagen potenciada en T1).
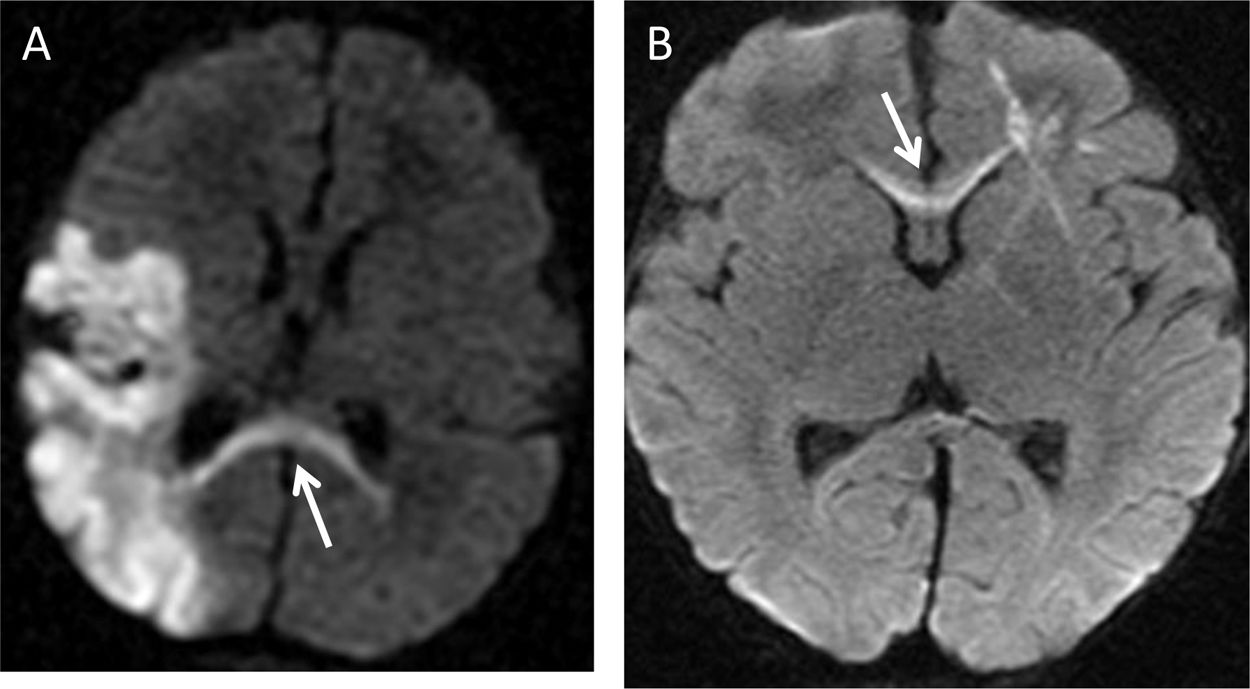
Lactante varón de 10 meses con infarto isquémico parietooccipital izquierdo. A) Secuencia de difusión identificando degeneración walleriana aguda en el esplenio (flecha). B) Lactante mujer de 15 meses con infarto venoso frontal derecho, asocia restricción del tracto axonal asociado en la rodilla del cuerpo calloso (flecha).
El estriado incluye el núcleo caudado y el putamen. Recibe aferencias casi exclusivamente del córtex frontal y las proyecciones frontoestriatales están organizadas siguiendo un gradiente de ventromedial a dorsolateral. Esta vía desempeña funciones cognitivas, límbicas y motoras. Es muy representativa la DW que se produce exclusivamente en el estriado tras cirugía o ablación en lóbulos frontales por afectación frontoestriatal13. En la secuencia de difusión se puede evaluar el daño precoz a distancia o la DA aguda. Se ha constatado una restricción de la difusión en la fase temprana de la degeneración neuronal secundaria, tanto walleriana como transneuronal. Esta restricción se suele producir a los pocos días del daño, mostrando un valor mínimo de ADC (Apparent Diffusion Coefficient)a los 7 días y posteriormente recuperar la intensidad de señal normal hacia los 30 días3,4,13 (figs. 5 y 6).
En el tálamo se agrupan núcleos y conexiones a los que llegan múltiples estímulos sensoriales antes de proyectarse al córtex. El daño cortical puede producir retrógradamente degeneración a través de las proyecciones tálamo-corticales. Las áreas corticales dañadas producen una degeneración secundaria que sigue la distribución anatómica de las conexiones con sus núcleos; de esta forma, la lesión en el lóbulo occipital producirá una alteración retrógrada del pulvinar, mientras que la noxa en el cíngulo anterior conduce a degeneración del núcleo anterior14. Es importante conocer esta correspondencia y plantear la posible DA retrógrada aguda ante incremento de la difusión como alternativa a un evento isquémico (fig. 6). Debe recordarse que la DA aguda es un hallazgo frecuente en secuencia de difusión, pero es susceptible de resolverse.
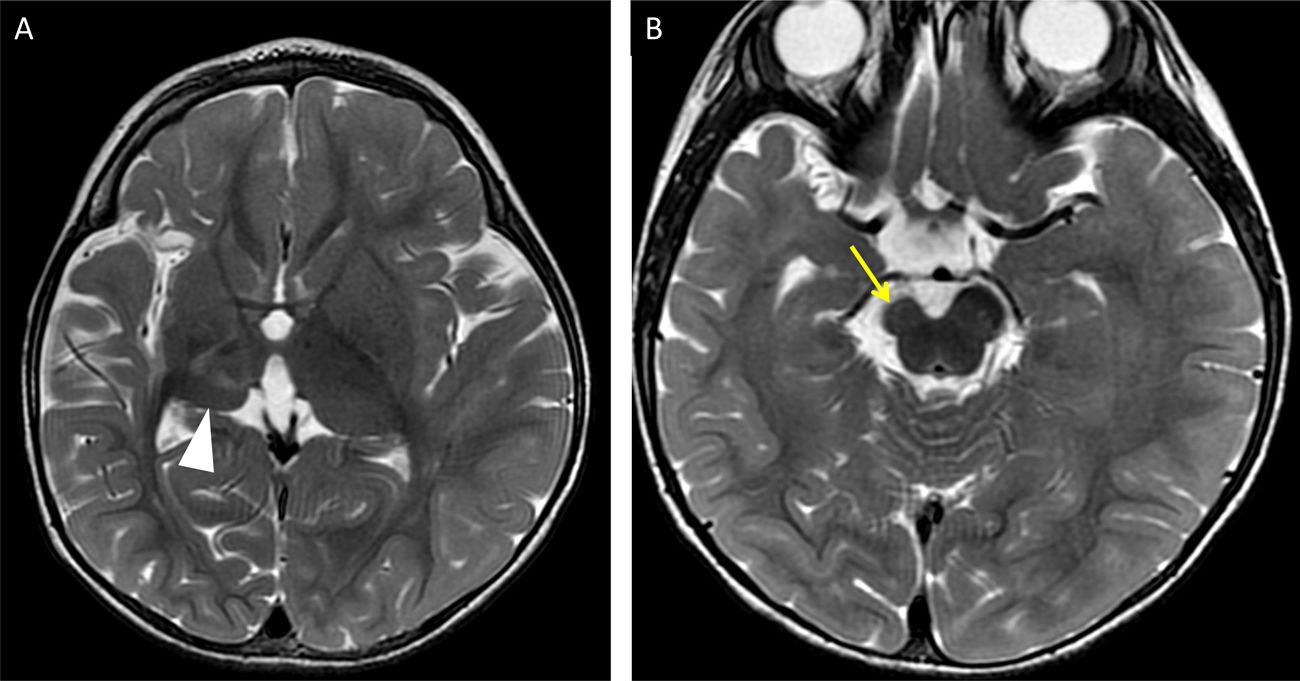
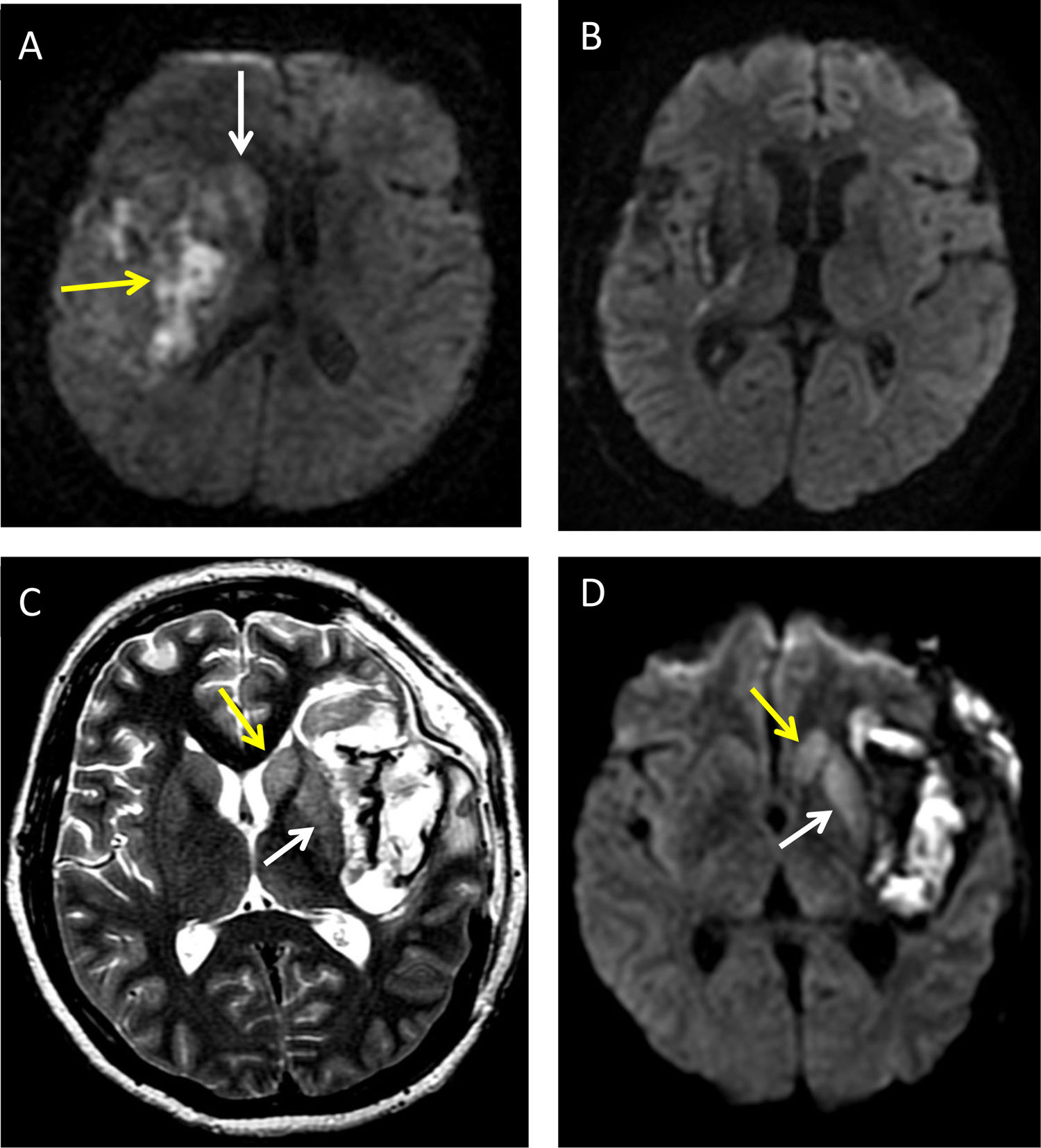
Niña de 8 años con hemorragia insular derecha (A y B). Imagen de difusión a los pocos días del evento, identificando la restricción heterogénea del sangrado (flecha amarilla) y la restricción aguda del caudado (flecha blanca) que a las semanas se resuelve (B). Mujer de 35 años con hemorragia subaracnoidea espontánea y componente intraparenquimatoso insular izquierdo asociado (C y D) indicando la degeneración axonal aguda asociada de caudado (flecha amarilla en C y D) y del putamen (flecha blanca en C y D) en T2 y en secuencia de difusión.
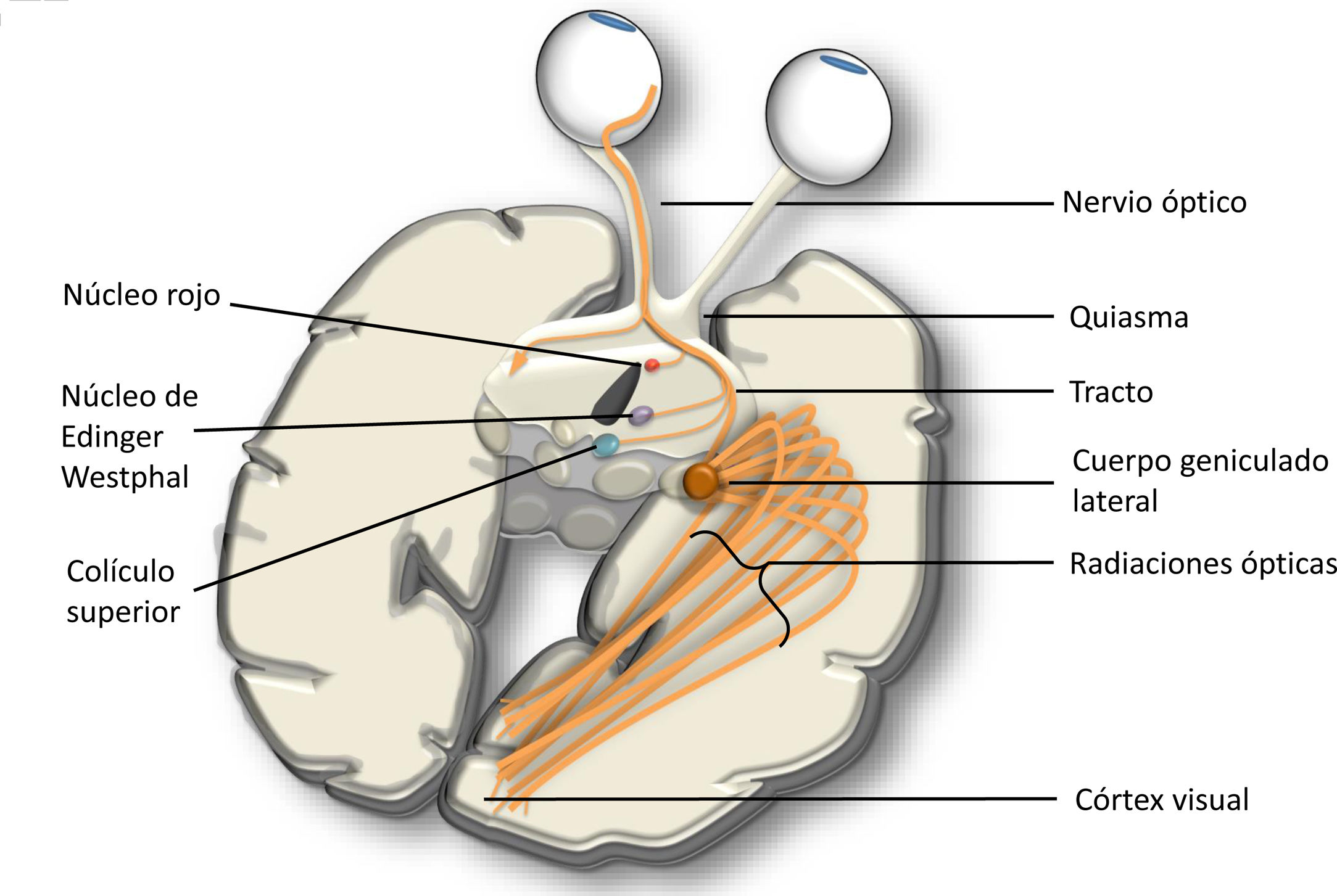
La vía óptica o visual consta de varias neuronas susceptibles de sufrir DT, tanto anterógrada como retrógrada. Las dos primeras sinapsis de la vía visual se producen a nivel retiniano y conectan los fotorreceptores a las células bipolares y a las ganglionares. Posteriormente, el nervio óptico une el quiasma con la retina. En el quiasma se decusan las fibras nasales y se unen con las temporales contralaterales formando el tracto óptico que hace sinapsis en el cuerpo geniculado lateral (CGL). El CGL se conecta al córtex de la cisura calcarina mediante las radiaciones ópticas. Además del esquema principal, también se producen conexiones con núcleos pretectales, con el hipotálamo y con el colículo superior (fig. 7).
Alteraciones severas de la retina como la degeneración pigmentaria conducen a cambios en el córtex; el incremento de anchura de la cisura calcarina es un marcador de DT anterógrada de toda la vía15. También se ha demostrado la relación entre la pérdida de altura del ganglio geniculado lateral y el estadio clínico del glaucoma, siendo un marcador de imagen no invasivo del estado de integridad de la vía, pudiendo visualizarse en potenciación T2 de alta resolución16,17 (fig. 8). Un ejemplo de DT retrógrada es el adelgazamiento de la retina, visualizado con tomografía de coherencia óptica, tras infartos occipitales de la arteria cerebral posterior18,19. Debe recordarse que la DT de la vía visual implica la alteración del CGL, siendo, por tanto, su preservación un indicador de la integridad de la vía.
A) Varón de 65 años, diabético de larga evolución, con vitrectomía. Imagen sagital potenciada en T1: la degeneración transináptica se pone de manifiesto al constatar el incremento de la cisura parietooccipital (flecha blanca) y calcarina (flecha amarilla) por atrofia del córtex visual. B) Varón de 30 años con exenteración por rabdomiosarcoma orbitario. Imagen transversal T1: se visualizan la degeneración axonal secundaria del nervio óptico izquierdo (flecha blanca) y quiasma. En imagen coronal T2 del mismo paciente (C) se constata un menor volumen del cuerpo geniculado lateral izquierdo (punta de flecha amarilla) con respecto al contralateral (punta de flecha blanca).
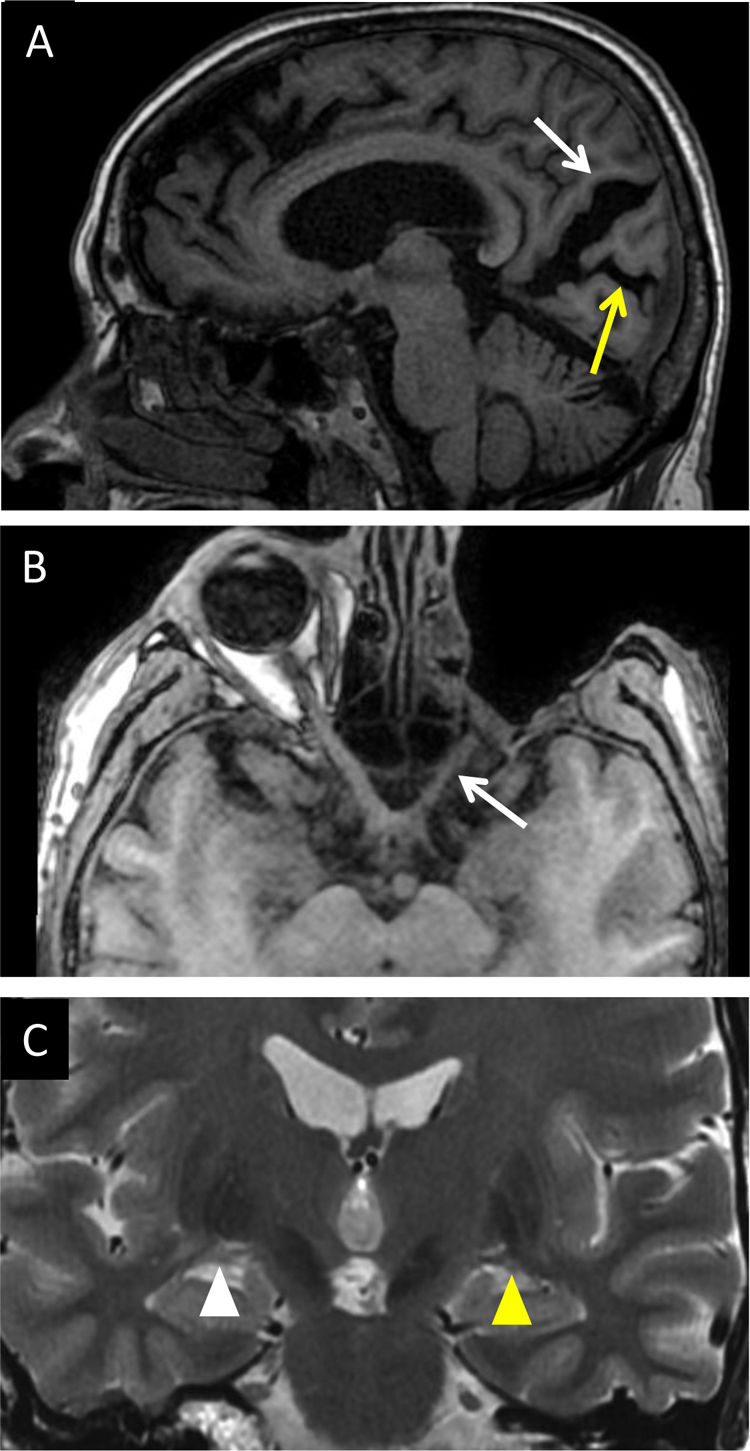
El cerebelo es un complejo centro de interconexión neuronal con múltiples vías y núcleos. Entre los haces aferentes destaca la vía córtico-ponto-cerebelosa, cuyas fibras descienden por la corona radiada y el brazo posterior de la cápsula interna hasta hacer sinapsis con los núcleos pontinos. Posteriormente se originan las fibras transversas de la protuberancia, cruzan la línea media e ingresan en el hemisferio cerebeloso por el pedúnculo cerebeloso medio. Es la vía más importante en la preparación, la iniciación y la ejecución del movimiento. Además de causas agudas, la vía se puede dañar de forma crónica en la atrofia multisistémica, visualizando el típico signo en cruz20. En cuanto a las eferencias, la mayoría de los axones hacen sinapsis en núcleos profundos antes de abandonar el cerebelo por los pedúnculos. Una de las vías principales que componen el pedúnculo cerebeloso superior (PCS) es el tracto dento-rubro-talámico. Además de causas agudas, existen enfermedades degenerativas, como la parálisis supranuclear progresiva o la ataxia de Friedrich, que conducen a la atrofia del PCS como secuela de DAS (Degeneración Axonal Secundaria)21. Como principio general, los pedúnculos cerebelosos superiores conectan el cerebelo con el mesencéfalo, los medios conectan el cerebelo con la protuberancia y los inferiores, el cerebelo con el bulbo raquídeo (fig. 9)22,23.
Mujer de 48 años con atrofia cerebelosa por hemorragia. A) Plano transversal potenciado en T2: se identifica el adelgazamiento del pedúnculo cerebeloso superior (flecha blanca) que se confirma en la imagen coronal T1 (flecha blanca en B) al comparar con el contralateral (flecha amarilla).
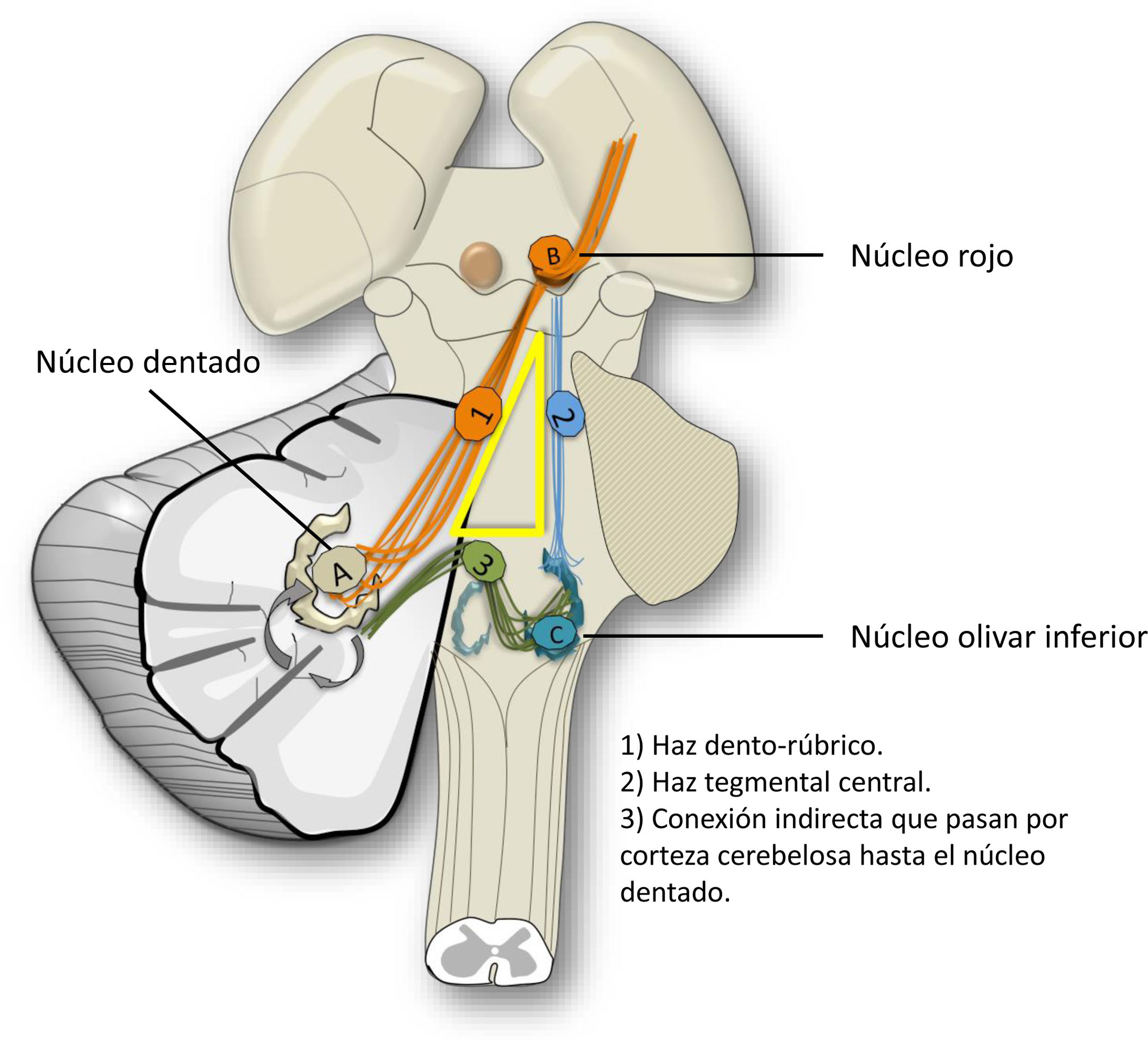
La hipertrofia olivar degenerativa es un tipo de DT conocida por la respuesta morfológica paradójica. Ocurre por lesiones en la vía dento-rubro-olivar. La conexión del núcleo dentado con el núcleo rojo y el olivar inferior contralaterales se conoce como triángulo de Guillain-Mollaret o triángulo mioclono, porque los pacientes pueden desarrollar mioclono del paladar (fig. 10).
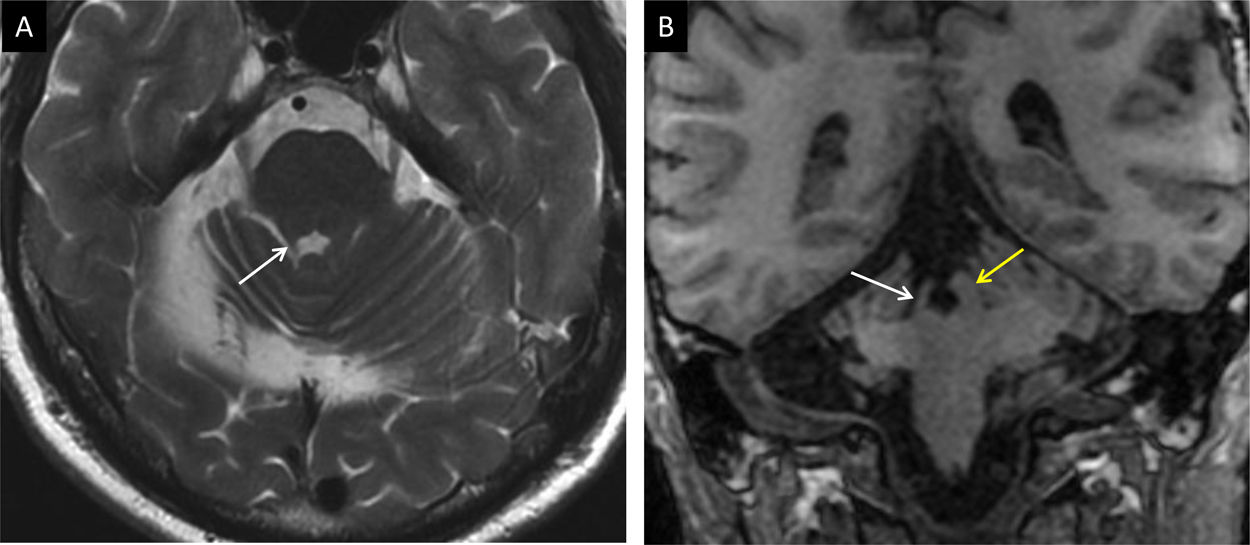
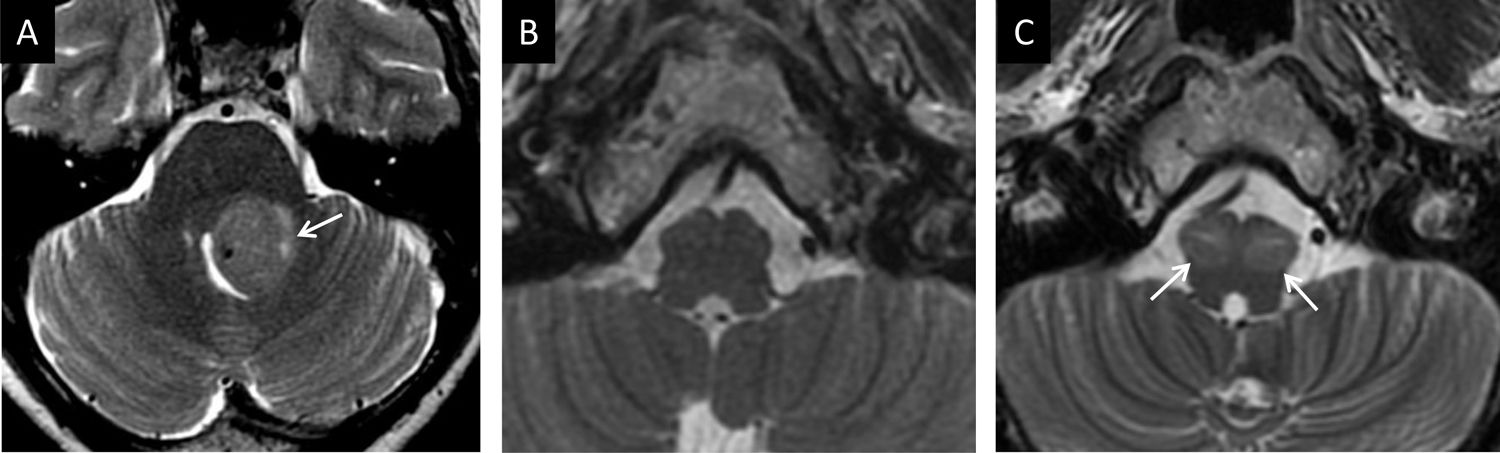
La respuesta hipertrófica del núcleo olivar ocurre por la desconexión tras lesiones que afectan al tracto tegmental central o a la vía dentorúbrica. La pérdida de la sinapsis conduce a la hipertrofia por degeneración vacuolar del citoplasma24. Según las estructuras afectadas, se puede producir hipertrofia olivar unilateral, contralateral o bilateral. Inicialmente, tras el daño se incrementa la señal en potenciación T2 sin hipertrofia. A los 6meses se añade la hipertrofia característica y más allá del año se resuelve la hipertrofia, pero persiste la hiperintensidad. La ausencia de realce tras el contraste en cualquiera de las fases es importante para diferenciarlo de otras entidades (fig. 11)25.
Varón de 35 años con ganglioglioma exofítico de asiento pontino-peduncular (flecha en A). En el momento del diagnóstico no se identifica alteración de volumen ni de señal en núcleos olivares (B). Tras cuatro meses de la biopsia se incrementa el volumen y la intensidad de los núcleos olivares por degeneración hipertrófica bilateral (flechas en C).
La diasquisis es la inhibición de la función de un área a consecuencia del daño a distancia. La diasquisis cerebelosa cruzada es, por tanto, la afectación remota del cerebelo por una lesión supratentorial contralateral. La alteración funcional, por desaferenciación, puede persistir y producir cambios morfológicos. Se ha constatado una reducción metabólica cruzada en estudios PET, del tiempo de tránsito al pico y del flujo cerebral relativo en estudios de perfusión. El estudio de RM con tensor de difusión supone un escalón intermedio entre los cambios funcionales y los morfológicos precoces. La menor restricción de la difusión por los haces de la sustancia blanca en el lado afectado se puede cuantificar debido a la fracción de anisotropía (fig. 12)26–28.
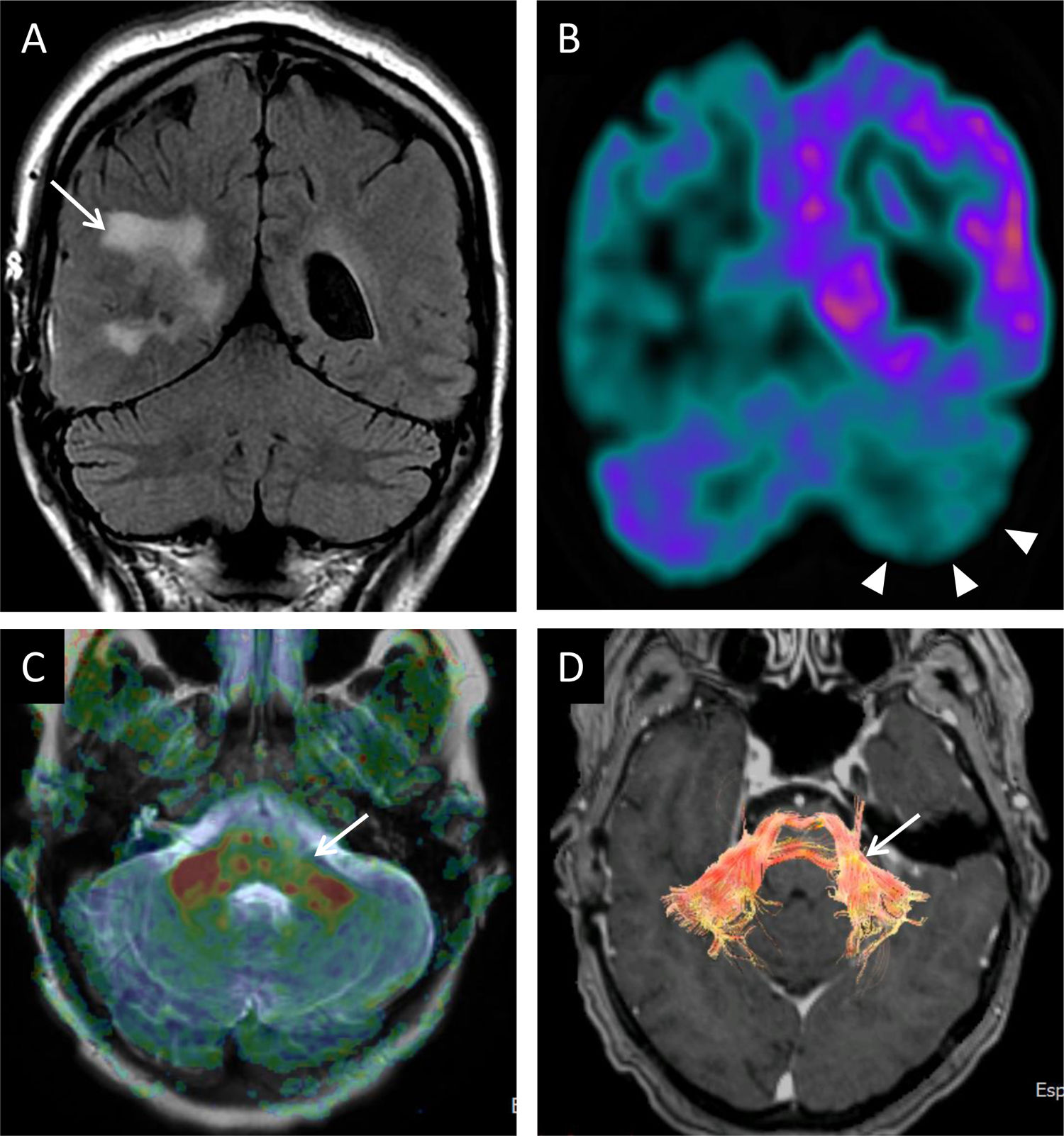
Mujer de 56 años intervenida de carcinoma de plexo coroideo derecho (flecha en A). A) Plano coronal FLAIR: no hay alteraciones cerebelosas morfológicas ni de intensidad de señal. En imagen coronal de PET con FDG se constata un hipometabolismo temporoparietal derecho y hemisférico cerebeloso izquierdo (puntas de flecha en B) atribuible a diasquisis cerebelosa cruzada. C) Mapa de anisotropía y reconstrucción de DTI (D) visualizando adelgazamiento de las fibras en el pedúnculo medio izquierdo (flechas en C y D).
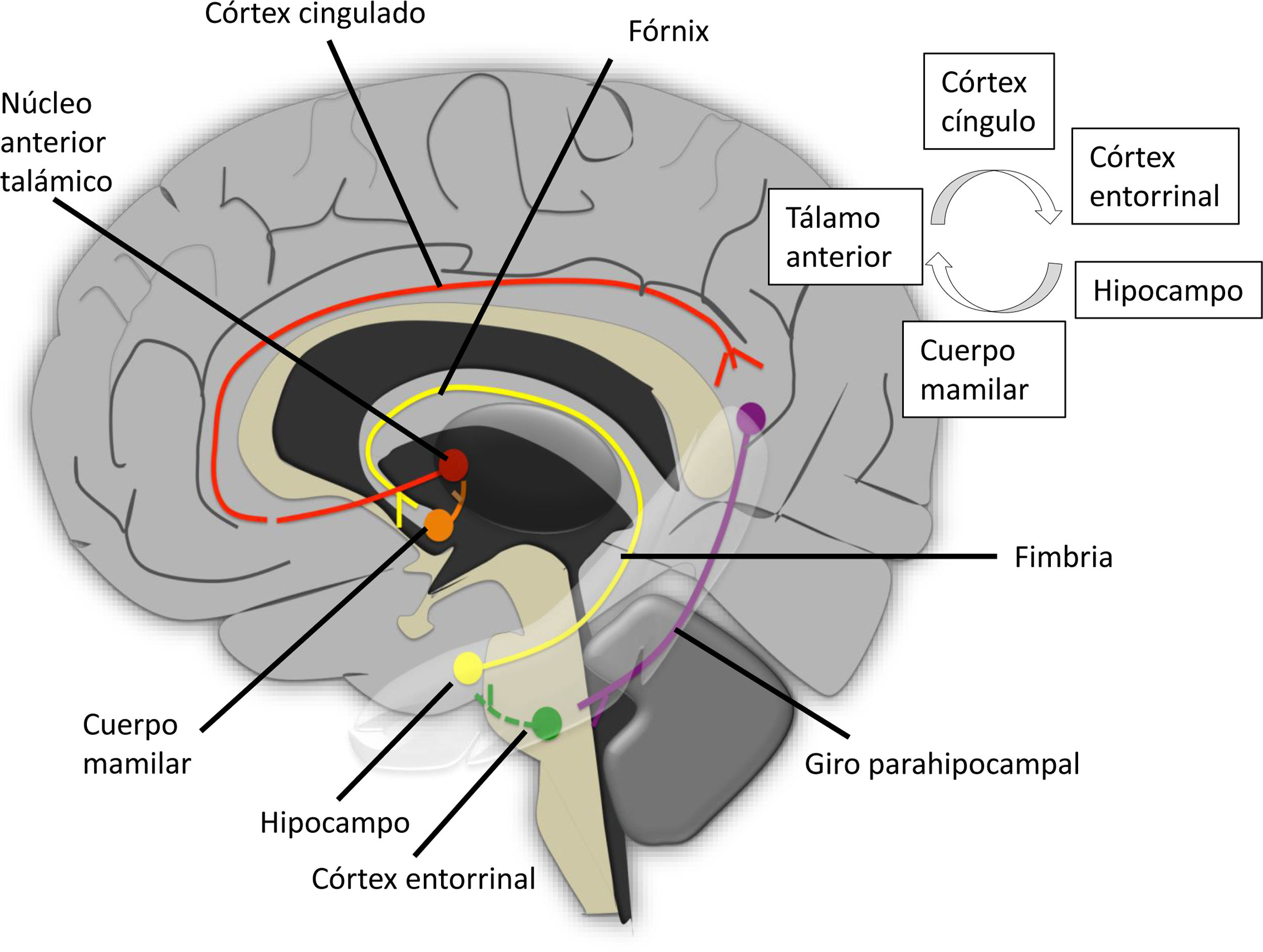
Es una compleja red neuronal compuesta por un circuito principal cerrado, el circuito de Papez, y múltiples aferencias. El circuito se inicia en el hipocampo, donde el subículum y el cornu ammonis se conectan mediante la primera neurona al cuerpo mamilar, mediante el tracto situado en el fórnix. En el cuerpo mamilar se produce la primera sinapsis y la segunda neurona discurre por el haz mamilotalámico hasta el núcleo talámico anterior. En esta localización se da otra sinapsis y una tercera neurona se proyecta hacia el giro cingulado. El circuito se completa por impulsos dirigidos al hipocampo a través del giro parahipocampal. (fig. 13).
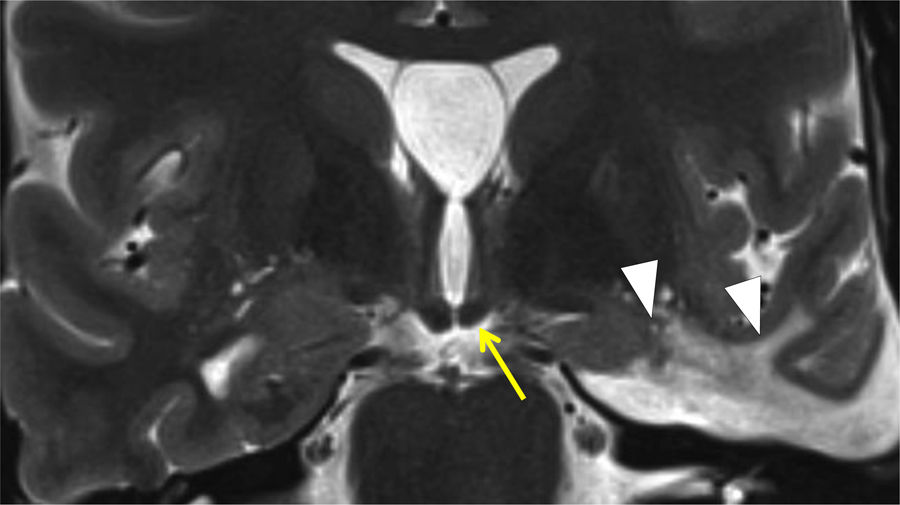
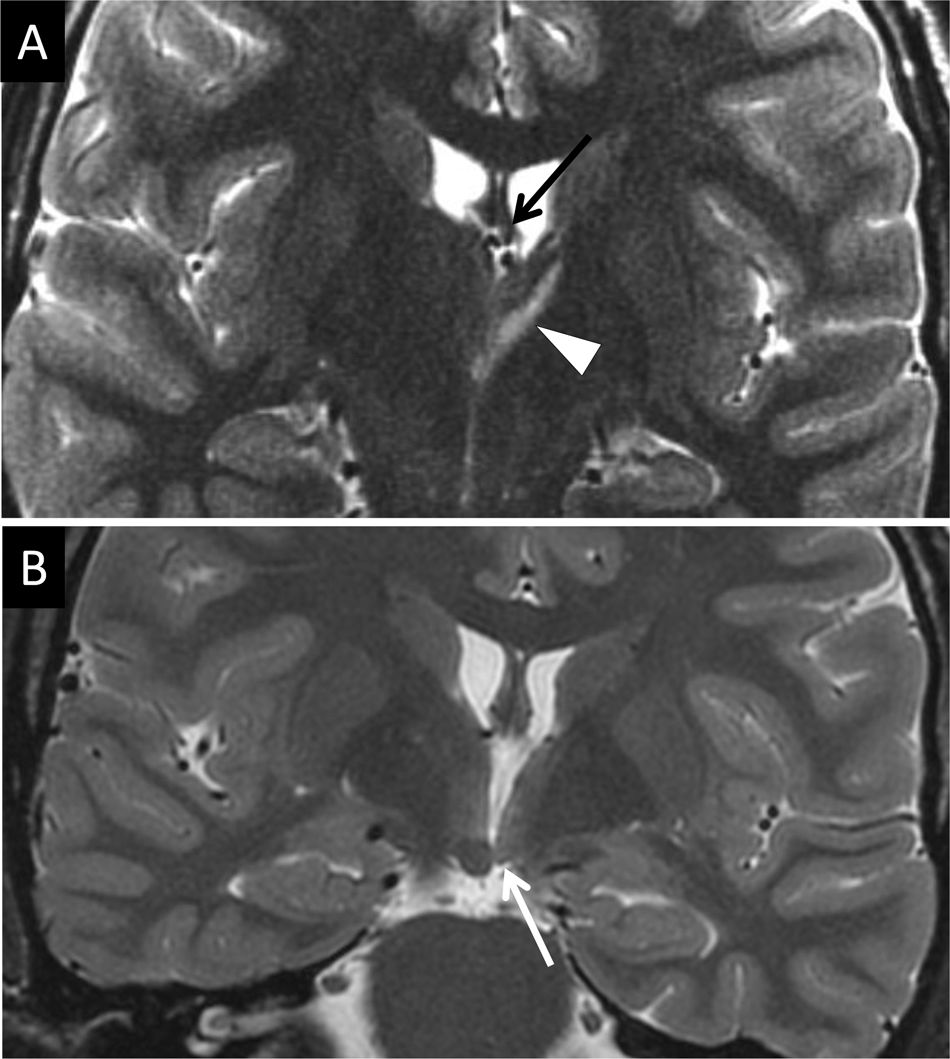
La esclerosis hipocampal es una causa frecuente de epilepsia del lóbulo temporal. Este daño puede provocar atrofia del fórnix ipsolateral como consecuencia de la DW de la primera neurona y causar atrofia del cuerpo mamilar por DT. La atrofia del cuerpo mamilar también puede producirse por afectación de estructuras fuera del sistema límbico pero interconectadas (fig. 14). La afectación de la segunda neurona conduce a una reducción del tamaño del cuerpo mamilar y el núcleo anterior del tálamo por lesión del haz mamilotalámico; es consecuencia generalmente de DT retrógrada, siendo la alteración del fórnix variable29 (fig. 15). En estos casos, el estudio con tensor de difusión es muy útil para visualizar afectación de fibras de giro cingulado en el lado afectado. El infarto por oclusión de la arteria hipocampal, rama de la cerebral posterior, es otra causa de afectación temporal medial y de daño secundario del fórnix y del cuerpo mamilar30.
Mujer de 31 años con lesión en el tálamo izquierdo (punta de flecha en A, plano coronal potenciado en T2) con adelgazamiento secundario del fórnix (flecha negra en A) y del cuerpo mamilar ipsolateral (punta de flecha negra en B) respecto al cuerpo mamilar derecho, indicado en punta de flecha blanca en B.
La DND es un hallazgo frecuente en la práctica habitual del radiólogo y un desenlace común de muchos procesos patológicos. El conocimiento de la respuesta esperable a distancia según la topografía de una lesión es crucial para evitar errores diagnósticos. Además, los estudios de metabolismo cerebral, las secuencias de perfusión y de difusión, cada vez muestran cambios más precoces del mismo proceso con los que debemos estar familiarizados.
FinanciaciónNo hay financiación que declarar.
Autoría- 1.
Responsable de la integridad del estudio: AM-F.
- 2.
Concepción del artículo: AM-F, JCP.
- 3.
Diseño del artículo: AM-F, JCP.
- 4.
Obtención de los datos: AM-F, JCP.
- 5.
Análisis e interpretación de los datos: no procede.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: AM-F, JCP, MG-JA, POF.
- 8.
Redacción del trabajo: AM-F, JCP, MG-JA.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JCP, POF, MG-JA.
- 10.
Aprobación de la versión final: AM-F, JCP, POF, MG-JA.
Los autores declaran no tener ningún conflicto de intereses.