Los medios de contraste basados en gadolinio son cada vez más utilizados en estudios de resonancia magnética. Son capaces de mejorar el contraste en las imágenes y aportar información sobre la función y el metabolismo, aumentando la sensibilidad así como la especificidad diagnóstica.
Se describen los diferentes medios de contraste basados en gadolinio aprobados para uso clínico actualmente, sus características principales en base a su estructura química, estabilidad y seguridad. En términos generales son compuestos seguros. No obstante, las reacciones adversas producidas, la posible nefrotoxicidad inducida por estos compuestos, así como la posibilidad de desarrollar fibrosis sistémica nefrogénica serán temas tratados en la presente publicación.
Por último, se mencionarán las actuales guías, recomendaciones y contraindicaciones en cuanto a su utilización en el ámbito clínico, incluyendo el manejo en pacientes gestantes y en la lactancia.
Gadolinium-based contrast agents are increasingly being used in magnetic resonance imaging. These agents can improve the contrast in images and provide information about function and metabolism, increasing both sensitivity and specificity.
We describe the gadolinium-based contrast agents that have been approved for clinical use, detailing their main characteristics based on their chemical structure, stability, and safety. In general terms, these compounds are safe. Nevertheless, adverse reactions, the possibility of nephrotoxicity from these compounds, and the possibility of developing nephrogenic systemic fibrosis will be covered in this article.
Lastly, the article will discuss the current guidelines, recommendations, and contraindications for their clinical use, including the management of pregnant and breast-feeding patients.
La resonancia magnética (RM) es una técnica de diagnóstico por imagen cuya utilización ha aumentado notablemente durante los últimos años, extendiéndose a todas las áreas anatómicas, patologías y grupos de edad. Permite la obtención de estudios anatómicos y funcionales, y posee una gran resolución espacial y de contraste, lo que le confiere una gran precisión tanto para detectar como para caracterizar tejidos y hallazgos patológicos. En RM se utilizan medios de contraste (MC) para mejorar la capacidad diagnóstica. Los MC están compuestos por elementos paramagnéticos capaces de modificar los tiempos de relajación T1 y T2, aumentando de este modo el contraste entre los tejidos. Su utilización está autorizada desde 1988 y se emplean distintos compuestos que se clasifican según su composición, propiedades magnéticas y modo de actuar sobre la relajación T1 y T2.
De manera práctica, los MC empleados en RM se dividen en MC basados en gadolinio (Gd) y MC basados en otros elementos, como el Mn y Fe.
Existen dos tipos de MC basados en Gd: los de distribución extracelular no específica y los órgano-específicos. Tres MC basados en Gd considerados órgano-específicos están aprobados por la Agencia Europea del Medicamento: dos de ellos empleados en estudios de patología hepatobiliar (gadobenato de dimeglumina –MultiHance®– y gadoxetato de disodio –Primovist®–), y uno utilizado en estudios angiográficos (gadofosveset –Vasovist®–). Los MC basados en Gd hepatoespecíficos, tras la fase de distribución extracelular son incorporados por hepatocitos funcionantes y excretados por vía biliar en hasta un 50% en el caso del gadoxetato de disodio (Primovist®). Esta propiedad permite su utilización para caracterizar lesiones tanto de estirpe hepatocitaria como no hepatocitaria, y tanto benignas como malignas. Hay que tener también en cuenta que el hecho de no ser totalmente órgano-específicos permite su uso para estudiar otros órganos y patologías. Por ejemplo el caso del gadobenato de dimeglumina (MultiHance®), se encuentra aprobado para el estudio del sistema nervioso central en mayores de 2 años y estudios vasculares mediante RM.
Están disponibles seis MC basados en Gd de distribución extracelular no específica que difieren en su composición y propiedades físico-químicas: gadobutrol (Gadovist®), gadodiamida (Omniscan®), gadopentetato de dimeglumina (Magnevist®), gadoterato de meglumina (Dotarem®), gadoteridol (ProHance®) y gadoversetamida (OptiMARK®).
La utilización de los MC basados en otros elementos es menos frecuente. En los últimos años se han desarrollado agentes con efecto T2 y T2* basados en partículas de óxido férrico superparamagnético: superparamagnetic iron oxide, con tropismo hepático, y ultrasmall superparamagnetic iron oxide, con tropismo linfático. Sin embargo, la mayoría de estos compuestos no se encuentran disponibles en la actualidad por diversas razones1,2. El MC de uso intravenoso basado en manganeso (mangafodipir, Teslascan®) fue autorizado en 1997 para caracterización de lesiones hepatobiliares, habiéndose retirado del mercado a petición del fabricante en 20123. En la actualidad existen otros tipos de medios de contraste en diferentes fases de desarrollo4.
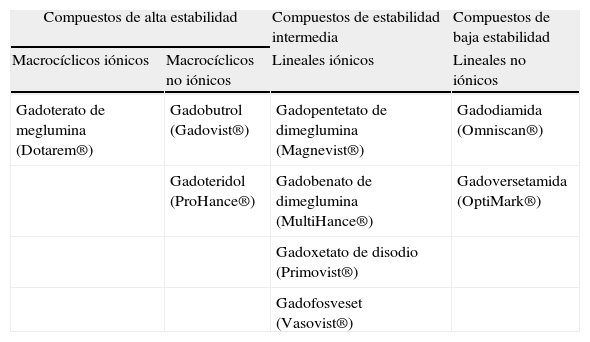
MEDIOS DE CONTRASTE BASADOS EN GADOLINIO UTILIZADOS EN RESONANCIA MAGNÉTICAEstructura química y estabilidadTodos los MC basados en Gd, metal del grupo de los lantánidos, se componen de Gd en forma iónica (Gd3+), elemento que en forma libre resulta tóxico para el organismo, y un quelante. Los quelantes son grandes moléculas orgánicas que forman un complejo con el Gd3+, convirtiéndolo en inerte y no tóxico. Los MC basados en Gd se clasifican en cuatro categorías atendiendo a su estructura bioquímica (lineal o macrocíclica) y a su carga (iónico o no iónico), como se muestra en la tabla 1. Se ha demostrado en numerosos estudios5–8 que los complejos macrocíclicos iónicos son los más estables y, por tanto, los menos propensos a liberar Gd3+ en el organismo, mientras que los menos estables son los lineales no iónicos.
Medios de contraste basados en gadolinio clasificados según su estructura química y estabilidad
| Compuestos de alta estabilidad | Compuestos de estabilidad intermedia | Compuestos de baja estabilidad | |
| Macrocíclicos iónicos | Macrocíclicos no iónicos | Lineales iónicos | Lineales no iónicos |
| Gadoterato de meglumina (Dotarem®) | Gadobutrol (Gadovist®) | Gadopentetato de dimeglumina (Magnevist®) | Gadodiamida (Omniscan®) |
| Gadoteridol (ProHance®) | Gadobenato de dimeglumina (MultiHance®) | Gadoversetamida (OptiMark®) | |
| Gadoxetato de disodio (Primovist®) | |||
| Gadofosveset (Vasovist®) | |||
El Gd3+ se libera mediante un proceso denominado transmetalación, que consiste en la sustitución del Gd3+ por un catión endógeno, principalmente, el zinc (Zn2+). De este modo, se produce el paso del Gd3+ al torrente circulatorio, donde puede unirse a aniones como fosfatos, citratos, hidróxidos o carbonatos y depositarse en los tejidos. Existen otros cationes como el hierro (Fe2+), cobre (Cu2+) y calcio (Ca2+) que, teóricamente, compiten también para desplazar el Gd3+, si bien in vivo la transmetalación se produce fundamentalmente entre el Gd3+ y Zn2+. Ello se debe a que el cobre se encuentra a baja concentración, el calcio presenta baja afinidad por ligandos orgánicos y el hierro se encuentra fuertemente unido a sus proteínas transportadoras o de reserva.
Tras su administración endovascular, los MC basados en Gd se distribuyen por el espacio extracelular y son eliminados vía renal por filtración glomerular, exceptuando el porcentaje de eliminación biliar, que varía en función del MC basado en Gd empleado. En general, su vida media en pacientes sanos es de unos 90 minutos y habitualmente se elimina más del 95% en menos de 24 horas. En el caso de insuficiencia renal moderada, la vida media puede llegar a rondar las 6 horas, mientras que en la insuficiencia renal severa, supera las 9 horas. En casos de tasa de filtrado glomerular estimada (TFGe) <5ml/min (fallo renal establecido o diálisis) llega a alcanzar 30 horas. Como se discutirá más adelante, se ha de tener en cuenta la función renal, eligiendo siempre que sea posible un MC basado en Gd de los considerados más estables (macrocíclicos) para minimizar el riesgo de toxicidad, ya que la estabilidad química del MC basado en Gd es directamente proporcional a su seguridad.
Complicaciones de los medios de contraste basados en gadolinioLos MC basados en Gd son, en general, considerados compuestos seguros, con una incidencia muy baja de efectos adversos. Según el «Manual of Contrast Media» del Colegio Americano de Radiología, tras su administración en dosis de 0,1 o 0,2 mmol/kg, el riesgo global de padecer una reacción adversa aguda es de 0,07-2,4%9, y es menor que en el caso de los medios de contraste yodados (MC yodados)10. Las reacciones adversas de tipo alérgico ocurren con una frecuencia que oscila entre 0,004-0,7%9. Se consideran factores de riesgo para sufrir una reacción de hipersensibilidad el sexo femenino, enfermedad alérgica preexistente, exposiciones repetidas al medio de contraste y antecedentes de hipersensibilidad al Gd (hasta 30% de riesgo de padecer una nueva reacción de hipersensibilidad)11.
Las reacciones graves presentan una incidencia baja, estimada en 0,001-0,01%9, y diversas publicaciones cifran la incidencia entre 1/10.000 y 1/40.00012–14. Las reacciones fatales a los MC basados en Gd son extremadamente raras, habiéndose descrito en aproximadamente uno entre un millón de los casos (40 muertes en 51 millones de dosis administradas entre 2004 y 2009 publicadas en la base de datos de la FDA)12.
Las guías de la European Society of Urogenital Radiology15 recomiendan tener disponible la medicación y el equipamiento de resucitación básico, y mantener a todos los pacientes unos 30 minutos en el servicio de radiodiagnóstico tras la administración del contraste.
Las características y recomendaciones detalladas para la prevención de las reacciones adversas son descritas en otro artículo de este suplemento.
Otro tipo de complicación aguda lo constituye la extravasación del MC. Como se detalla en el correspondiente artículo, su incidencia y gravedad son menores que cuando se produce una extravasación al inyectar un MC yodado.
A medio y largo plazo las complicaciones derivadas del uso de MC basados en Gd incluyen la nefrotoxicidad y la fibrosis sistémica nefrogénica (FSN). El riesgo de nefrotoxicidad utilizando las dosis aprobadas se considera prácticamente nulo9. Sin embargo, como se discutirá más adelante, es bien conocida la asociación entre la enfermedad renal y la FSN, entidad que puede aparecer tras un período de tiempo muy variable, que abarca desde días desde la administración del contraste hasta años después.
Gran parte de los efectos a largo plazo del Gd son desconocidos. No obstante, es conocida la capacidad del Gd de sustituir al calcio en la hidroxiapatita del hueso, con la consiguiente disminución del recambio celular óseo. Por tanto, teóricamente, enfermedades como la osteoporosis podrían liberar las moléculas de Gd retenidas en la matriz ósea de forma crónica16. La Agencia Europea del Medicamento ha propuesto una serie de estudios prospectivos y protocolos para evaluar los potenciales efectos del Gd acumulado en el hueso a largo plazo17.
Las medidas de prevención para reducir el riesgo de nefrotoxicidad y FSN serán discutidas en sus respectivos apartados.
CONTRASTES BASADOS EN GADOLINIO Y NEFROTOXICIDADLa prevalencia de la nefropatía crónica ha aumentado durante los últimos años de forma significativa debido al número de personas que padecen diabetes mellitus e hipertensión arterial. La nefrotoxicidad inducida por los MC yodados es un efecto adverso bien conocido desde hace décadas, y ampliamente descrito en la literatura científica. Produce una significativa morbimortalidad y un aumento de la estancia intrahospitalaria en los pacientes con riesgo de desarrollar una nefropatía inducida por los medios de contraste (NIC). Los MC basados en Gd muestran algunas características similares a las de los contrastes yodados, como son la alta osmolalidad (>1.300 mOsm/Kg en caso de Gd y 280-915 mOsm/Kg en los contrastes yodados no iónicos) y su eliminación principal a través del filtrado glomerular. Por ello, los MC basados en Gd constituyeron al inicio de su uso clínico un motivo de preocupación por la posibilidad de aparición de efectos secundarios similares a los de los MC yodados sobre la función renal. Sin embargo, la baja viscosidad de los MC basados en Gd y los pequeños volúmenes administrados (14-42ml) reducen significativamente su potencial nefrotóxico.
En varios estudios queda demostrado su bajo potencial nefrotóxico18,19. En un ensayo clínico fase III con 1.171 pacientes, tras la administración de MC basados en Gd, se constató tan solo en un pequeño subgrupo de pacientes con insuficiencia renal severa (con un filtrado glomerular de 20-40ml/min), una elevación muy discreta (media de 0,25mg/dl) de sus niveles basales de creatinina sérica medidos a lo largo de 5 días20. A pesar de esto, se recomienda extremar las medidas de precaución y evitar en lo posible la administración de MC basados en Gd en ese grupo de pacientes debido al conocido riesgo de aparición de FSN que se da en este mismo grupo de pacientes.
Según las pautas actuales propuestas por distintas guías clínicas9,15, se considera según los criterios propuestos por la American College of Radiology, que un medio de contraste intravenoso ha producido un daño renal agudo cuando en las primeras 48 horas tras la administración del preparado se produce un aumento de los niveles de creatinina sérica ≥ 0,3mg/dL y/o una elevación de ≥ 50% de los niveles basales de la creatinina sérica. A su vez, las guías de la European Society of Urogenital Radiology definen la NIC como una elevación de la creatinina sérica de >25% o 44μmol/l (0,5mg/dl) sobre sus niveles basales que ocurre en los 3 días siguientes tras la administración de MC basados en Gd.
Según la literatura científica, no existe evidencia que demuestre un incremento del riesgo de nefrotoxicidad tras la administración de MC basados en Gd en pacientes con insuficiencia renal leve-moderada. En pacientes con función renal normal el riesgo de desarrollo de fracaso renal agudo tras la administración de Gd es prácticamente inexistente cuando estos se administran a dosis aprobadas21.
La dosis, en la mayoría de los MC basados en Gd comercializados, no excede de 0,1 mmol/kg. En estudios experimentales en animales se ha podido comprobar un aumento significativo de la incidencia de fracaso renal agudo tras la administración de dosis elevadas de MC basadas en Gd (>3,0 mmol/kg). Así mismo, se debe evitar la administración repetida del medio de contraste a intervalos de menos de 7 días entre una dosis y la siguiente. En casos excepcionales puede administrarse una dosis de hasta 0,3 mmol/kg en forma de dos inyecciones consecutivas en embolada, con un intervalo de 20 minutos entre ambas, aunque la seguridad y eficacia de administraciones secuenciales no han sido bien establecidas22.
Medios de contraste basados en gadolinio en tomografía computarizada y angiografíaLos MC basados en Gd son radioopacos y en ocasiones, en las que la administración de MC yodados estaba contraindicada (pacientes con fracaso renal severo, antecedentes de reacciones adversas), se pensó que estos podrían sustituir a los MC yodados especialmente en tomografía computarizada (TC) y angiografía convencional. Sin embargo, el volumen de MC basados en Gd necesario para lograr una opacificación óptima de las estructuras de interés en un estudio de TC sería muy superior a las dosis utilizadas habitualmente en RM. Es imprescindible tomar en consideración siempre el límite de dosis única permitida de 0,1 mmol/Kg peso. Por encima de esta dosis aumenta el riesgo de nefrotoxicidad y de la aparición de FSN23–25. Actualmente se desaconseja el uso de MC basados en Gd como sustitución de los MC yodados en este tipo de estudios.
Prevención de la aparición de nefropatía inducida por medios de contrasteLas medidas profilácticas recomendadas para evitar la aparición de nefropatía cuando se emplean MC yodados no se ha demostrado que sean extensibles en el caso de los MC basados en Gd. Se duda de la utilidad real de medidas como la hidratación del paciente y la hemodiálisis para prevenir el riesgo de aparición de FSN. No obstante, el Committee on Drugs and Contrast Media de la American College of Radiology mantiene la recomendación de realizar una sesión de hemodiálisis tan pronto como sea posible, después de la administración de MC basados en Gd en pacientes con IRC avanzada en diálisis.
En general, se recomienda una evaluación de la función renal del paciente, mediante cuestionario, antes de realizar el estudio para poder evaluar correctamente su riesgo y así prevenir la NIC. Solo se considera necesario solicitar una analítica de función renal antes de la inyección de los MC basados en Gd cuando se van a emplear los que tienen mayor riesgo de inducir FSN, como veremos en el próximo apartado.
En resumen, se considera que el riesgo de nefrotoxicidad asociado al uso de MC basados en Gd a las dosis terapéuticas recomendadas y en pacientes adecuadamente seleccionados, sigue siendo prácticamente inexistente. En pacientes con insuficiencia renal su administración supone un riesgo, por lo que deben tomarse medidas de precaución adicionales, especialmente en pacientes con deterioro severo de la función debido al riesgo de desarrollo de FSN y/o exacerbación de su insuficiencia renal.
En este grupo de pacientes habría que valorar la posibilidad de un estudio mediante RM sin MC basados en Gd o la realización de otra prueba diagnóstica (ecografía-doppler, TC, PET, etc.).
Si finalmente, después de una cuidadosa valoración individualizada del riesgo/beneficio se decide su utilización, se administrará un MC basados en Gd a las dosis mínimas aprobadas y evitando las inyecciones repetidas.
FIBROSIS SISTÉMICA NEFROGÉNICALa FSN es un síndrome muy raro que se caracteriza principalmente por la aparición de fibrosis cutánea y del tejido celular subcutáneo, contractura muscular y reducción de la movilidad de las articulaciones. Al tratarse de un proceso sistémico, puede afectar a cualquier órgano y tejido, como los pulmones, corazón, esófago, etc. Inicialmente, por lo general, la sintomatología consiste en engrosamiento y empastamiento cutáneo que pueden asociarse a prurito.
Los síntomas pueden progresar rápidamente hacia la rigidez o limitación de la movilidad articular y a contracturas en flexión en las extremidades. La enfermedad es progresiva y se asocia con un incremento en la mortalidad en estos pacientes26,27. A día de hoy no hay tratamiento curativo eficaz.
La Food and Drug Administration ha documentado unos 1.600 casos28, mientras que el Registro Internacional de la FSN tiene recogidos más de 380 casos29, todos ellos con el antecedente común de haberse administrado MC basados en Gd en estudios de RM.
Dado el elevado número de pacientes a los que se les ha realizado una RM con MC basados en Gd, su riesgo de aparición es poco menos que remoto. Por lo general, aparece en los dos primeros meses que siguen a la administración del MC basados en Gd pero puede aparecer meses más tarde o incluso años después.
En 1997 fueron descritos los primeros casos y sus manifestaciones clínicas dermatológicas, por lo que se la denominó «dermopatía fibrosante nefrogénica». La primera publicación que describe esta nueva enfermedad con cambios fibróticos en la piel en pacientes en diálisis data del año 200030.
En el año 2006 se establece por primera vez una asociación entre la aparición de las lesiones cutáneas similares a la dermopatía fibrosante nefrogénica y la administración de un MC basados en Gd en pacientes con insuficiencia renal crónica avanzada31,32. Se estableció entonces una relación causal entre el uso de los MC basados en Gd y el síndrome que ya había comenzado a conocerse como FSN, al saber sus manifestaciones sistémicas, más allá de las cutáneas descritas en un primer momento.
No se conoce el mecanismo exacto por el cual aparece la FSN. No obstante, un factor importante y fundamental en su patogénesis puede ser la baja excreción renal existente en pacientes con insuficiencia renal avanzada. En estos casos, si se libera Gd (Gd +3) de los quelantes, puede unirse a un anión como el fosfato, formando un precipitado insoluble que se deposita en diferentes tejidos33. Existen otros posibles factores metabólicos implicados en su aparición, aún formulados de forma hipotética (véase factores de riesgo), pero no se conoce con exactitud el papel que pueden desempeñar.
El efecto fibrogénico de los lantánidos es conocido: promueven la polimerización del colágeno de la piel y la formación y depósito de fibras. Por otro lado, estimulan la proliferación de fibroblastos, aumentan el colágeno en la matriz extracelular y estimulan la producción de citoquinas proinflamatorias y profibróticas34. Por tanto, se desencadena una reacción fundamentalmente inflamatorio-fibrótica.
El diagnóstico de FSN es complejo y han de cumplirse rigurosamente una serie de criterios clínicos y patológicos para evitar falsos diagnósticos35. En los pacientes con insuficiencia renal crónica hay otras muchas lesiones cutáneas que pueden parecerse o simular la FSN, como son: el escleromixedema, la esclerosis sistémica o morfea, entre otros. Para alcanzar el diagnóstico es preciso obtener una biopsia de piel.
Actualmente no existe un tratamiento específico curativo para la FSN. Se intentan paliar sus efectos o reducir la velocidad a la que progresa mediante la utilización de diversos fármacos, como son los corticoides orales o emolientes tópicos, aunque sin resultados claramente satisfactorios36.
Factores y grupos de riesgo relacionados con la aparición de fibrosis sistémica nefrogénicaA. Relacionados con el MC basado en Gd:
Se han demostrado diferencias entre los diferentes tipos de contraste y relación con la dosis y vías de administración. Los contrastes lineales no iónicos (gadodiamida y gadoversetamida) son los que estadísticamente más se asocian con la aparición de FSN en pacientes con insuficiencia renal31–33,37–40.
Parece lógico sospechar que el riesgo de desarrollar FSN se incrementa con la administración de mayores dosis de lo habitual (mayores de 0,1 mmol/Kg). En este sentido algunos estudios postulan un efecto acumulativo41.
La vía de administración intraarterial incrementa el riesgo de aparición de FSN.
B. Relacionados con el paciente:
1. Insuficiencia renal
No existe riesgo en pacientes que padecen IR leve y es casi inexistente en caso de IR moderada. Sin embargo, en los casos de IR grave, a mayor grado de insuficiencia renal hay mayor riesgo de padecer FSN. La práctica totalidad de los casos demostrados de FSN se han producido en pacientes con insuficiencia renal grave (tasa de filtrado glomerular estimado, TFGe<30ml/min/1,73m2)33. Se considera que existe un aumento cierto del riesgo con TFGe<59ml/min/1,73m2, que se incrementa notablemente cuando se alcanza la TFGe<30ml/min/1,73m2, como ya se ha mencionado.
2. Trasplante hepático
Hasta hace poco se consideraba que los pacientes receptores de un injerto hepático tenían mayor riesgo de desarrollar FSN. La Agencia Europea del Medicamento en un comunicado de 2010 desaconsejó la utilización de MC basados en Gd de alto riesgo en este grupo de pacientes, y limitar el uso de los de riesgo medio y bajo17. No obstante, en una revisión reciente de más de 700 pacientes con trasplante hepático que han sido expuestos a MC basados en Gd, únicamente se ha encontrado un caso de FSN en un paciente que tenía un deterioro severo de la función renal (TFGe<15ml/min/1,73 m2)42. Por tanto, no parece que el transplante hepático sea un factor de riesgo independiente en el desarrollo de la FSN.
3. Otros factores de riesgo
Se postula la existencia de otros factores predisponentes que pueden exacerbar los síntomas de la FSN, como pueden ser la administración de hierro por vía intravenosa o eritropoyetina, la presencia de hipercalcemia, hiperfosfatemia, acidosis metabólica, el haber sido sometido a una cirugía vascular reciente, o la existencia de alguna patología inflamatoria aguda reciente, que pueden exacerbar los síntomas de la FSN36,43.
Guías y recomendacionesSe expone a continuación un resumen de la actualización de las nuevas guías actualizadas en 2012 por, Contrast Media Safety Committee de la European Society of Urogenital Radiology para la FSN relacionada con los medios de contraste basados en Gd15,16. En realidad, no suponen ningún cambio significativo respecto a la edición anterior pero se puntualizan algunos aspectos ya recogidos en la previa.
Los MC basados en Gd se clasifican en tres grupos según su seguridad (tabla 2). Se considera necesario conocer la función renal de los pacientes con riesgo de sufrir insuficiencia renal o con insuficiencia renal ya conocida o cuando se van a emplear MC basados en Gd del grupo con menor seguridad.
Clasificación de los medios de contraste basados en gadolinio en función del riesgo de aparición de fibrosis sistémica nefrogénica
| Bajo riesgo de aparición de FSN | Riesgo intermedio de aparición de FSN | Alto riesgo de aparición de FSN |
| Gadoterato de meglumina | Gadobenato de dimeglumina | Gadodiamida |
| Gadoteridol | Gadoxetato de disodio | Gadoversetamida |
| Gadobutrol | Gadofosveset | Gadopentetato de dimeglumina |
1. Recomendaciones para los MC basados en Gd de alto riesgo para el desarrollo de FSN (gadodiamida, gadopentotato de dimeglumina y gadoversetamida):
- (a)
Contraindicados en pacientes con IRC 4 y 5 (TFGe menos de 30ml/min/1,73 m2), pacientes en diálisis y pacientes con insuficiencia renal aguda.
- (b)
Contraindicado en neonatos y mujeres embarazadas. La función renal del neonato es inmadura. A la semana de vida la tasa media de filtrado glomerular estimado es de 40ml/min/1,73 m2, a las 2-8 semanas de unos 65ml/min/1,73 m2 y a las 8 semanas de 95ml/min/1,73 m2 aproximadamente44. Aunque no existan publicaciones sobre FSN en neonatos, es razonable sospechar que estarían en riesgo de desarrollarla, sobre todo si se administran los compuestos de mayor riesgo16.
- (c)
Deben usarse con precaución en pacientes con IRC 3 (TFGe 30-60ml/min/1,73 m2). Al menos 7 días de intervalo entre dos administraciones.
- (d)
Deben usarse con precaución en niños menores de un año.
- (e)
Las mujeres lactantes deben suspender la lactancia durante 24 horas después de la administración del medio de contraste. Se debe desechar también la leche en ese periodo.
- (f)
Es obligada la determinación de niveles de creatinina sérica, (TFGe) y valoración clínica del paciente antes de la administración de este tipo de medios de contraste.
- (g)
Nunca se deben administrar en dosis superiores a 0,1 mmol/kg.
2. Recomendaciones para los MC basados en Gd de riesgo intermedio (gadobenato de dimeglumina, gadofosveset, gadoxetato de disodio) y bajo (gadobutrol, gadoterato de meglumina y gadoteridol) para el desarrollo de FSN:
- (a)
Deben usarse con precaución en pacientes con IRC 4 y 5 (TFGe menos de 30ml/min/1,73 m2), incluidos pacientes en diálisis, con al menos 7 días de intervalo entre dos administraciones.
- (b)
Pueden administrarse en mujeres embarazadas siempre y cuando aporte información diagnóstica esencial; es decir, cuando sea imprescindible y preferible a otra técnica diagnóstica y tras considerar su riesgo individual.
- (c)
No es preciso suspender la lactancia en todos los casos durante 24 horas después de la administración del medio de contraste: se decidirá por consenso entre la madre, a la que se le informará de los riesgos, y su médico responsable.
- (d)
La determinación de niveles de creatinina sérica y de la TFGe antes de la administración del medio de contraste no es obligatorio cuando se emplean esta variedad de MC basados en Gd. La valoración de la función renal del paciente mediante un cuestionario es suficiente.
Al contrario de lo que ocurre con los medios de contraste de alto riesgo, no existen contraindicaciones absolutas para la utilización de los medios de contraste de riesgo intermedio (gadobenato de dimeglumina, gadofosvest trisodio, gadoxetato de disodio) o bajo riego para el desarrollo de FSN (gadobutrol, gadoterato de dimeglumina y gadoteridol).
No existen medidas preventivas para el desarrollo de FSN, tan solo una adecuada valoración del riesgo/beneficio individual de cada paciente y el seguimiento de las recomendaciones establecidas. Cuando la selección de los pacientes y del tipo de MC basado en Gd es el adecuado, no debería darse la FSN.
Se recomienda usar en todos los pacientes la menor cantidad de MC necesaria para obtener un resultado diagnóstico y registrar siempre el nombre, dosis y vía de administración del MC basado en Gd en la historia clínica del paciente.
Pacientes gestantes y lactanciaComo sucede con todos los fármacos, se debe reducir al máximo su utilización en estos grupos de pacientes, limitándolos a aquellos casos en que es imprescindible, una vez que se han valorado otras alternativas diagnósticas y la realización de una RM sin emplear medios de contraste. Si finalmente se decide utilizar un MC basado en Gd se debería recurrir a uno de los que presenta menor riesgo de inducir FSN, a la menor dosis posible.
Los MC basados en Gd atraviesan la placenta mediante un mecanismo de difusión simple. El pico de captación de MC basados en Gd por la placenta se produce a los 45 minutos y su lavado, a los 90. Se pueden acumular por tiempo indefinido en el líquido amniótico por lo que existe la posibilidad de que se liberen iones de Gd y que estos pudieran generar toxicidad. Los MC en el líquido amniótico pueden ser deglutidos por el feto, en cuyo caso, serían excretados a través de su aparato urinario.
En cuanto a la lactancia, igualmente se debe evitar su utilización y si se considera imprescindible su empleo, recurrir a uno de los MC basados en Gd más seguros. En este caso, no es preceptiva la suspensión de la lactancia durante 24 horas. La madre y su médico pueden decidir conjuntamente si prosiguen con la lactancia o la interrumpe. Solo es preceptiva su interrupción cuando se empleen MC basados en Gd que se encuentran entre los de alto riesgo, en virtud de su menor estabilidad química, que en cualquier caso, deberían ser evitados en este grupo de pacientes.
Solo una fracción mínima del MC basados en Gd es absorbida por el feto (menos del 0,0004%), mucho menos de la dosis permitida en estos pacientes, por lo que en principio su utilización se considera segura.
CONCLUSIÓNLos MC basados en Gd son compuestos empleados cada vez con mayor frecuencia en los estudios de RM.
Son compuestos seguros, que se emplean en dosis y volúmenes bajos, excepto en los pacientes con IR o neonatos, a los que por su inmadurez renal se les presupone un mayor riesgo.
Producen menos reacciones agudas que los MC yodados. También es menor su incidencia de extravasación y cuando se produce, sus consecuencias son, por lo general, más leves.
Son poco nefrotóxicos cuando se emplean a dosis estándar, si bien su potencial nefrotóxico aumenta con la dosis y cuando existe insuficiencia renal. No deben emplearse en pacientes con IR grave para prevenir la aparición de FSN. También podrían producir en estos pacientes empeoramiento de su función renal. Los casos documentados de FSN aparecen en prácticamente todos los casos, en pacientes que padecen IR grave y en los que se ha empleado un MC basado en Gd considerado de alto riesgo.
En las mujeres gestantes y recién nacidos, se deben emplear solo cuando es imprescindible, siempre escogiendo un MC basado en Gd de bajo riesgo y a la menor dosis posible. También durante la lactancia deben evitarse en la medida de lo posible, y cuando se emplean, ha de usarse un compuesto de riesgo intermedio o bajo. En el caso, no deseable, de utilizar un MC de riesgo elevado es preciso suspender la lactancia durante las 24 horas siguientes a su utilización.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.