El propósito de este artículo es destacar la utilidad de la técnica de distensión gástrica neumo-tomografía computarizada en la detección y caracterización morfológica de las lesiones subepiteliales gástricas estudiadas en nuestra institución, con su correlación de anatomía patológica y una revisión de la literatura.
ConclusiónLa neumo-tomografía computarizada combinada con las reconstrucciones multiplanares, las reconstrucciones tridimensionales y la endoscopia virtual es útil para delinear los detalles morfológicos de las lesiones subepiteliales gástricas debido a la distensión gástrica adicional. Se logra una mejor delimitación de sus bordes superior e inferior, así como las características de sus márgenes. Puede considerarse una técnica de imagen útil y no invasiva para la caracterización de estas lesiones.
This article aims to show the usefulness of the pneumo-computed tomography gastric distention technique in the detection and morphological characterization of subepithelial gastric lesions. We correlate the pneumo-computed tomography and pathology findings in lesions studied at our institution and review the relevant literature.
ConclusionPneumo-computed tomography, combined with multiplanar reconstructions, three-dimensional reconstructions, and virtual endoscopy, is useful for delineating the morphological details of subepithelial gastric lesions, thanks to the additional gastric distention. This technique better delimits and characterizes the upper and lower margins of the lesions. Pneumo-computed tomography can be considered a useful noninvasive imaging techniques for characterizing these lesions.
Una lesión subepitelial (LSE) gástrica se define como una lesión elevada o masa a menudo con una mucosa intacta1. Antes se llamaban lesiones submucosas; sin embargo, actualmente se denominan subepiteliales debido a la inclusión de una lesión originada de cualquier capa de la pared excepto el epitelio2.
Estas lesiones suelen estar circunscritas, con una mucosa intacta y crecen de forma endoluminal, exofítica o mixta. Las pequeñas lesiones que surgen en la submucosa suelen sobresalir en la luz gástrica y las masas más grandes suelen presentar un crecimiento exofítico3.
La mayoría se encuentra incidentalmente durante la endoscopia de rutina y son asintomáticas; otras causan dolor abdominal, hematoquecia, melena u otros síntomas si son de gran tamaño o ulceradas2.
Una vez detectadas, es necesario avanzar en el diagnóstico, existiendo diferentes técnicas con sus fortalezas y debilidades.
La tomografía computarizada multidetector (TCMD) con protocolos específicos de distensión gástrica (DG) utiliza agentes de contraste oral o gránulos efervescentes antes del examen4,5. La correcta DG permite el análisis de las siguientes características: ubicación, atenuación, realce con el contraste intravenoso y patrón de crecimiento. Sin embargo, la DG realizada con la ingestión de agua o gránulos efervescentes puede ser subóptima y la DG realizada con un contraste oral hiperdenso puede camuflar una lesión debido a una atenuación similar6,7.
La ultrasonografía endoscópica (USE) es útil para la detección de tumores tempranos ya que valora la penetración de la lesión y la presencia de adenopatías regionales, impactando en la estrategia terapéutica8. Sin embargo, no detecta metástasis en ganglios u órganos sólidos a distancia y se encuentra limitada ante la presencia de estenosis esofágicas infranqueables. También es un método que aumenta el tiempo en sala, encarece el procedimiento, aumenta la morbilidad y requiere un instrumentador con experiencia9.
La neumo-tomografía computarizada (neumo-TC) utiliza CO2 como técnica de distensión alternativa10. Consiste en la introducción transoral o transnasal de un catéter Foley colocado debajo de los músculos cricofaríngeos, insuflando CO2 a una presión regulada, continua y sostenida en forma automática con una bomba inyectora entre 15 y 25mmHg, para lograr una adecuada distensión esofágica y gástrica. Una vez obtenida la máxima distensión, se realizan adquisiciones del cuello, tórax, abdomen y pelvis. No requiere anestesia y solo genera molestia ante la colocación de la sonda10.
Luego se realizan reconstrucciones multiplanares y tridimensionales con diferentes configuraciones de ventana para permitir la visualización de la lesión. Además, la endoscopia virtual proporciona una vista desde el interior de la luz.
La principal indicación de la neumo-TC es el planeamiento quirúrgico de lesiones no resecables mediante endoscopia10. Con esta técnica el cirujano cuenta con una iconografía representativa previa para la planificación de la cirugía, definiendo el límite superior e inferior de las lesiones, valorando las relaciones anatómicas y detectando metástasis ganglionares y en órganos a distancia en un solo estudio. Además, está indicada cuando existe imposibilidad de realizar una USE o una estenosis esofágica10.
En este artículo mostramos la utilidad de la neumo-TC en la detección y la caracterización morfológica de las LSE gástricas estudiadas en nuestra institución mediante una correlación anatomo-radiológica de casos, con una revisión de la literatura.
Tumores del estroma gastrointestinalLos tumores del estroma gastrointestinal (GIST) derivan de las células intersticiales de Cajal y se originan más comúnmente en el estómago (60-70%) y el intestino delgado (30%); raramente en el recto, el esófago, el colon y el apéndice11. Ocasionalmente se originan fuera del tracto gastrointestinal, como el mesenterio o el epiplón.
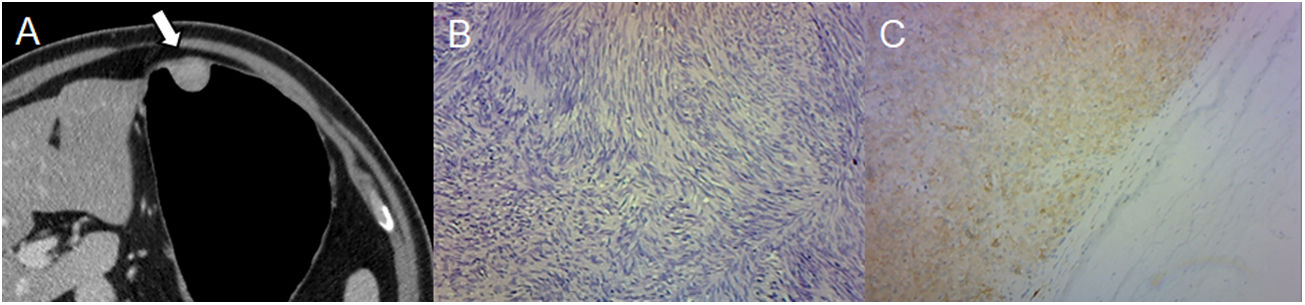
El cuerpo gástrico es el sitio más común, seguido por el fondo y el antro (fig. 1)12. Los GIST menores de 2cm no tienen potencial maligno o este es bajo13.
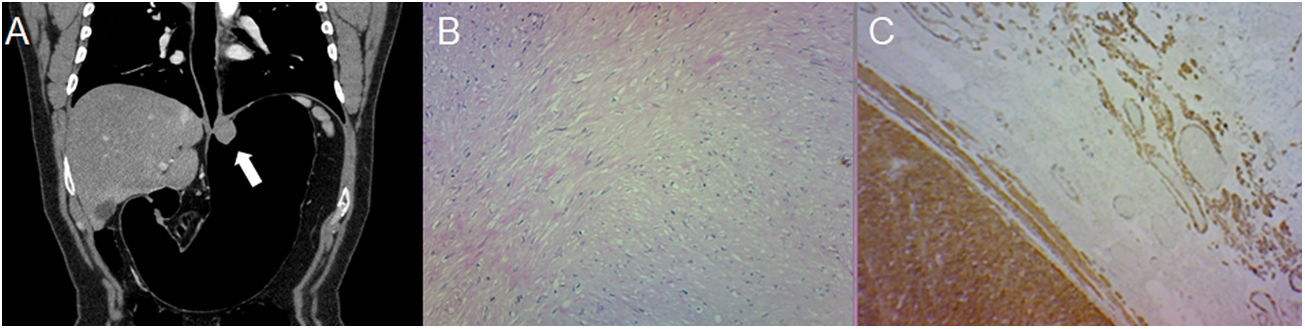
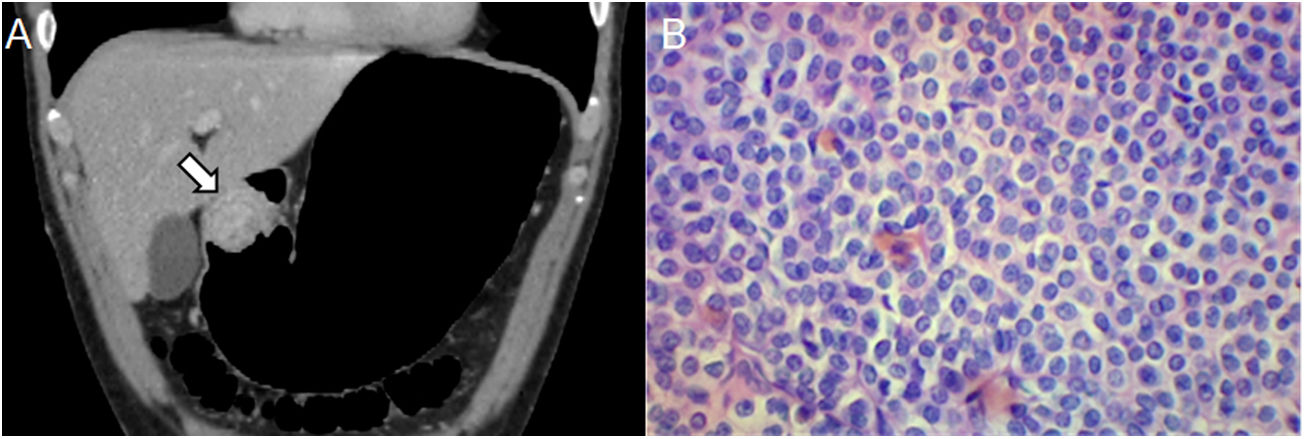
Varón de 43 años con hallazgo incidental de una lesión en endoscopia de rutina. A) Neumo-TC con contraste intravenoso, corte transversal que muestra una masa homogénea de crecimiento endofítico en el cuerpo gástrico (flecha). B) Histología (×100; tinción de hematoxilina-eosina) que muestra células fusiformes dispuestas en fascículos que se intersectan. C) La inmunorreactividad a CD117 confirma el diagnóstico de GIST. El principal diagnóstico diferencial es el leiomioma, solo distinguible mediante inmunohistoquímica, aunque son más frecuentes en el esófago y el cardias gástrico.
Los GIST asintomáticos pueden deberse a un pequeño tamaño o patrón de crecimiento exofítico. La ulceración de la mucosa puede provocar hemorragias gastrointestinales, incluyendo hematemesis, melena y anemia por deficiencia de hierro12.
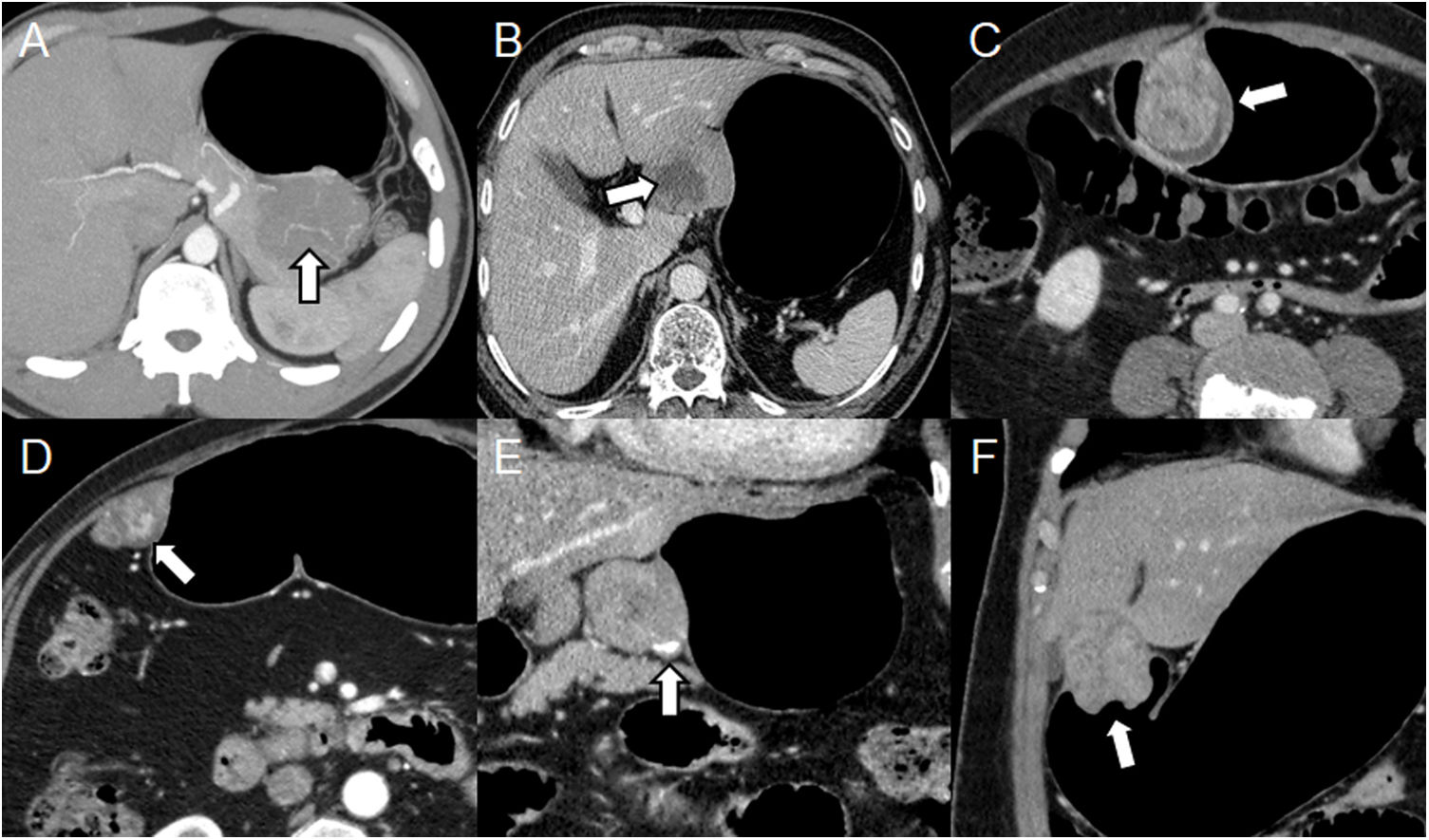
Debe recordarse que los GIST suelen tener un crecimiento exofítico o intramural ya que surgen de la muscularis propia profunda y el crecimiento endoluminal es menos común3. La apariencia en la TCMD depende del tamaño y la agresividad tumoral. Los tumores menores de 3cm aparecen como una masa endoluminal o polipoide de atenuación de tejido blando bien definida y homogénea, con grados variables de realce11. Los tumores grandes tienen márgenes irregulares, ulceración de la mucosa, realce hipervascular y son heterogéneos debido a la necrosis, la hemorragia o la degeneración quística11,12. A menudo presentan vasos en su interior y, raramente, calcificaciones (fig. 2)3,12.
Diferentes presentaciones de GIST. A-D) Neumo-TC con contraste intravenoso, cortes transversales de diferentes casos: proyección de máxima intensidad (MIP) muestra vasos dentro del tumor (A) (flecha); masa heterogénea debido a la necrosis central (B) (flecha); realce heterogéneo debido a áreas de degeneración quística (C) (flecha); realce hipervascular en fase arterial (D) (flecha). E, F) Neumo-TC con contraste intravenoso, reconstrucciones coronales: calcificación en la periferia del tumor (E) (flecha); afectación de la mucosa causando ulceración central (F) (flecha).
Aunque suelen desplazar los órganos y vasos adyacentes, las lesiones exofíticas pueden invadir estructuras como el páncreas, el colon o el diafragma3.
Las metástasis se producen principalmente en el hígado y el peritoneo, y en menor frecuencia en los ganglios linfáticos, los tejidos blandos, los pulmones y la pleura14.
El análisis histológico muestra un tumor compuesto por células fusiformes con citoplasma eosinofílico y núcleos alargados, dispuestos en fascículos que se intersectan. Los GIST muestran inmunorreactividad para CD117 (c-KIT) y DOG1.
En resumen, los GIST representan la mayoría de las LSE, variando desde pequeñas lesiones intraluminales hasta masas exofíticas, con áreas de hemorragia o necrosis.
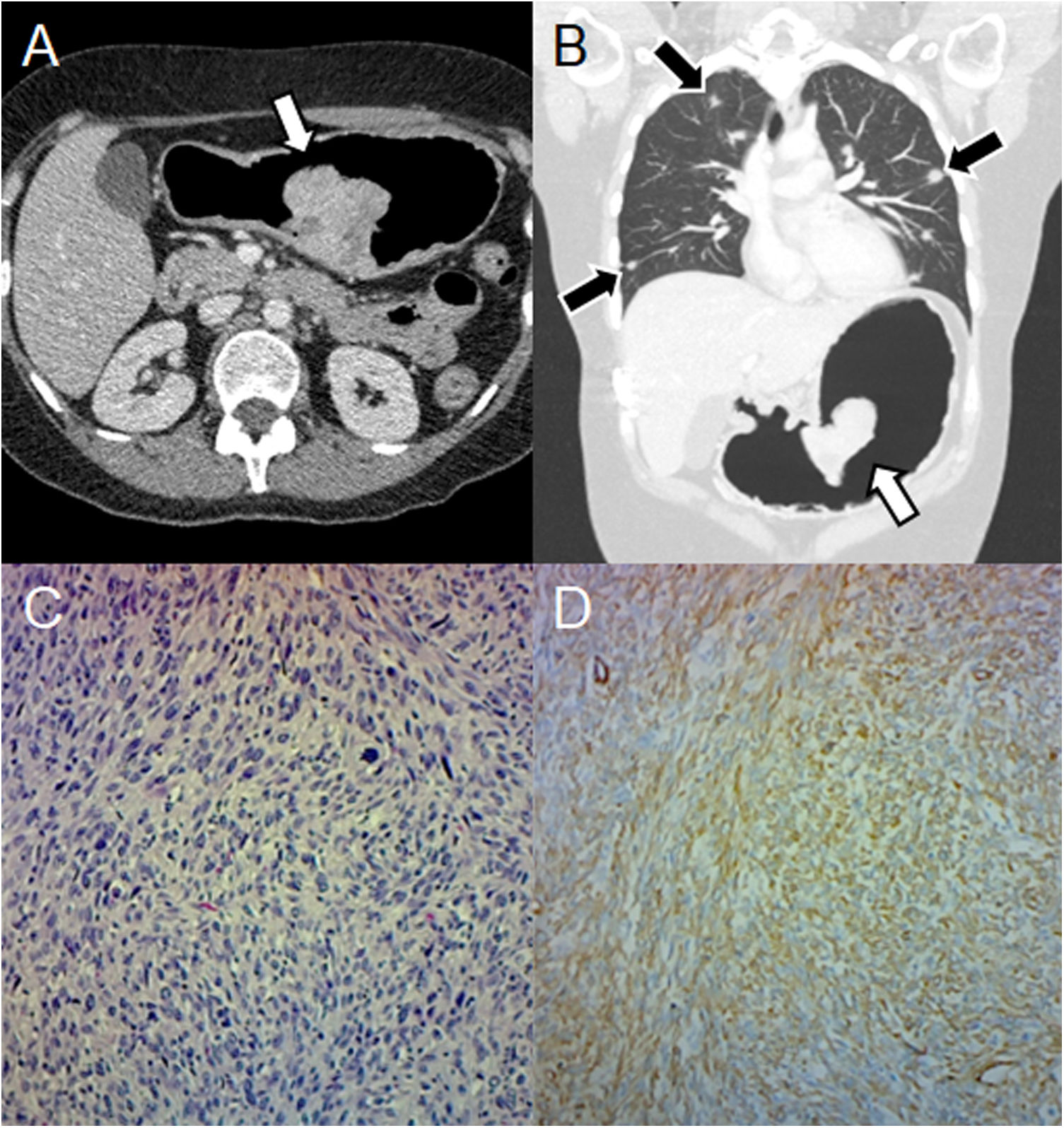
Otros sarcomas no GISTLos sarcomas distintos de los GIST incluyen leiomiosarcomas, liposarcomas y sarcomas no clasificados, pero son raros. Se presentan como grandes masas con realce heterogéneo y áreas de necrosis3. El leiomiosarcoma gástrico representa menos del 1% de las neoplasias malignas gastrointestinales15. Puede manifestarse como una masa exofítica, polipoide, ulcerosa o fungiforme16. Los sitios más comunes de metástasis son hígado y pulmones (fig. 3)17.
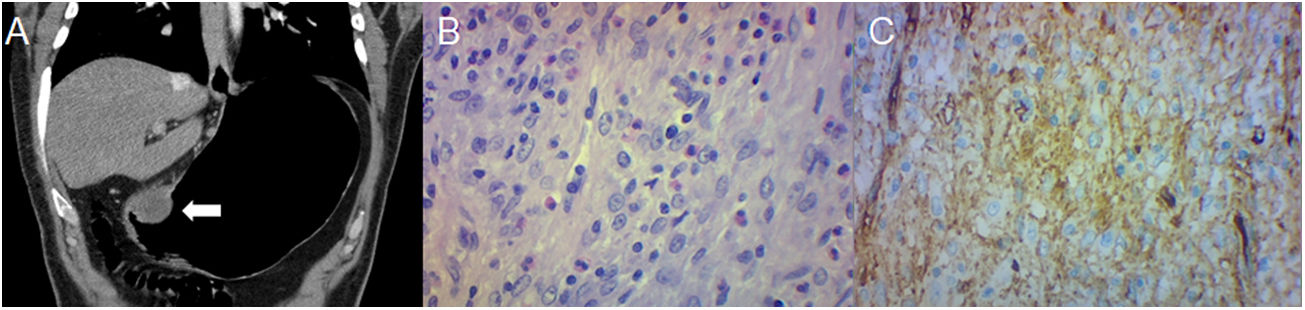
Leiomiosarcoma en una mujer de 41 años con hematemesis, melena y anemia. A) Neumo-TC con contraste intravenoso, corte transversal muestra una masa endoluminal con realce en la curvatura menor (flecha). B) Neumo-TC, reconstrucción coronal con ventana pulmonar revela metástasis pulmonares (flechas negras). C) La histología (×100; tinción de hematoxilina-eosina) muestra grupos de intersección de células fusiformes y una mayor celularidad que el GIST. D) La inmunohistoquímica muestra positividad para la actina del músculo liso. El principal diagnóstico diferencial es el GIST, siendo distinguible mediante histología e inmunohistoquímica, aunque la localización gástrica del leiomiosarcoma es extremadamente rara.
Como su apariencia es inespecífica, es necesaria la confirmación histológica3. El diagnóstico diferencial con los GIST es importante porque no hay consenso en el uso de quimioterapia y radioterapia, siendo la resección quirúrgica el tratamiento de elección18.
LeiomiomaSon neoplasias benignas poco frecuentes, siendo el tumor mesenquimatoso más frecuente del esófago13. Suelen estar localizados en el cardias y no se distinguen de los GIST, a menos que se utilicen técnicas de inmunohistoquímica. Los leiomiomas son negativos para CD117 y positivos para desmina y actina del músculo liso2. Histológicamente muestran células fusiformes hipocelulares con citoplasmas eosinófilos. Debe recordarse que la diferencia es importante porque los leiomiomas no metastatizan y los GIST están asociados con transformación maligna y metástasis. Por lo tanto, la resección quirúrgica es innecesaria a menos que se produzca una obstrucción o compresión18.
En la TCMD se manifiesta como una pequeña masa homogénea y de baja atenuación con un patrón de crecimiento endoluminal y un realce escaso o moderado (fig. 4)3,18. Los tumores mayores de 2cm pueden tener una ulceración central3.
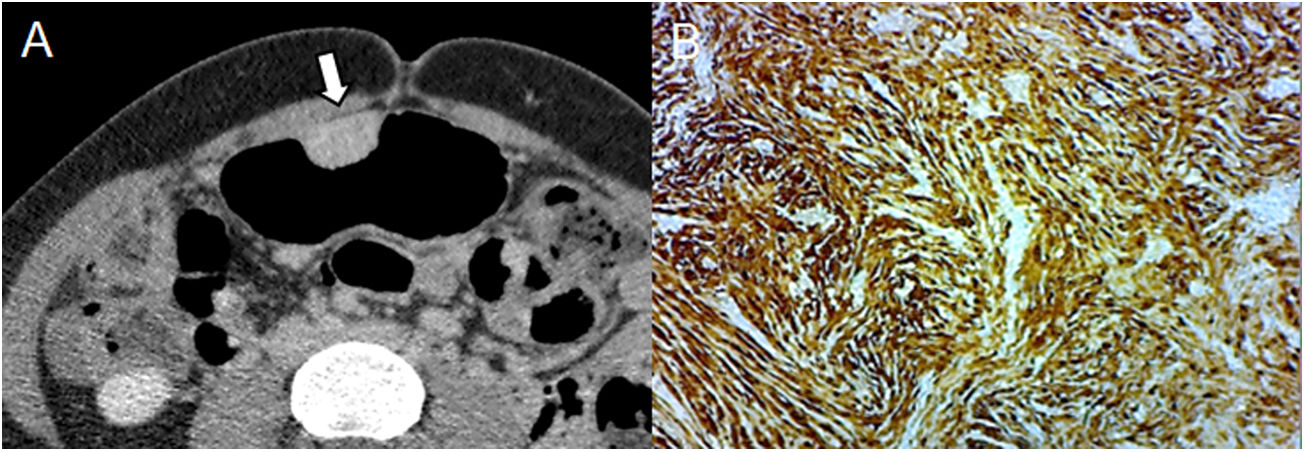
Varón de 48 años en estudio por dolor abdominal, dispepsia y pirosis. A) Neumo-TC con contraste intravenoso, reconstrucción coronal MPR curva muestra una masa homogénea de baja atenuación con un patrón de crecimiento endoluminal en el cardias gástrico (flecha). Nótese la óptima distensión gástrica obtenida en una zona de difícil distensión como la unión gastroesofágica. B) La histología (×100; tinción de hematoxilina-eosina) muestra una baja celularidad con fascículos de intersección de células fusiformes. C) Tinción de análisis inmunohistoquímico para la actina del músculo liso, que confirma el diagnóstico de leiomioma. El principal diagnóstico diferencial es el GIST, solo distinguible mediante inmunohistoquímica.
En resumen, el leiomioma se manifiesta como una lesión de baja atenuación en el cardias gástrico.
LipomaLos lipomas están compuestos por tejido adiposo rodeado por una cápsula fibrosa. Usualmente son pequeños, localizados en el antro, endoluminales y detectados incidentalmente19. Las lesiones mayores de 3cm pueden ulcerar la mucosa y causar hemorragia20. Los lipomas cercanos al píloro pueden prolapsar a través de él y causar obstrucción19.
En la TCMD se muestra como una masa bien definida con una atenuación de –70 a –120 UH (fig. 5)19. Debe recordarse que puede haber ulceración de la mucosa o hilos lineales de atenuación de tejidos blandos debido a inflamación20. La resección solo está indicada en casos sintomáticos3.
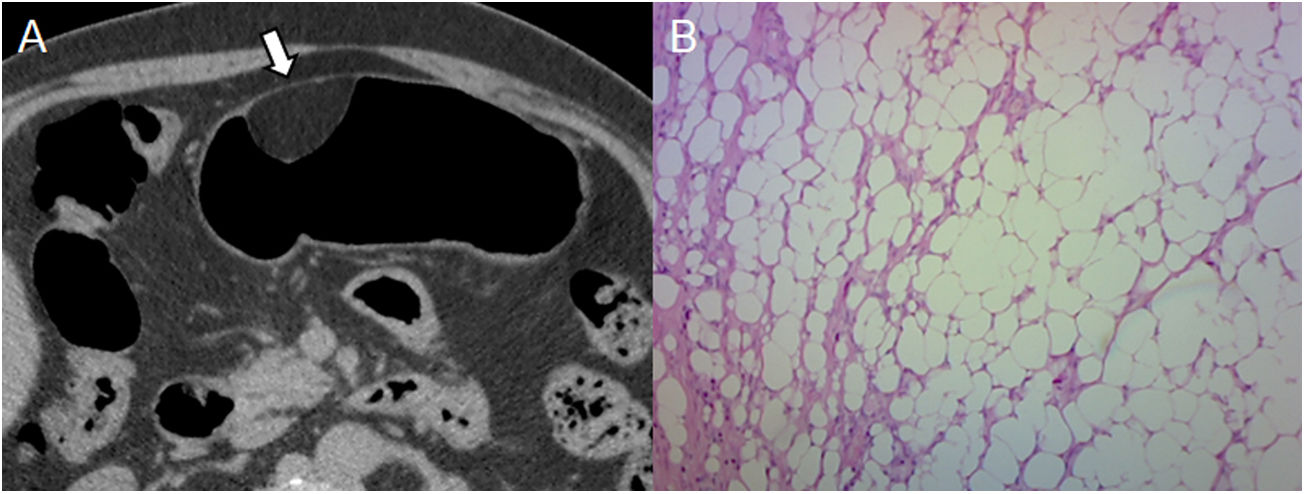
Lipoma encontrado en un varón de 60 años en una endoscopia de rutina. A) Neumo-TC con contraste: corte axial que muestra una lesión homogénea que se asienta en la curvatura mayor gástrica con una densidad negativa (flecha). B) La histología (×100; tinción de hematoxilina-eosina) confirma la presencia de tejido adiposo maduro. La densidad adiposa es característica del lipoma y es diagnosticada con la TC, siendo su principal diagnóstico diferencial el liposarcoma, el cual es extremadamente raro en el tracto gastrointestinal y el compromiso ganglionar o la metástasis a distancia podrían indicar su diagnóstico.
En resumen, una masa bien circunscrita con atenuación entre –70 y –120 UH es concordante con lipoma.
Páncreas ectópicoEs un tejido pancreático que carece de conexión vascular y ductal con el cuerpo pancreático principal, generalmente ubicado en estómago, duodeno o yeyuno.
Suelen ser asintomáticos y se descubren incidentalmente durante una cirugía o autopsia; otros manifiestan dolor abdominal, hemorragia u obstrucción21. Debe recordarse que el páncreas ectópico puede desarrollar complicaciones como pancreatitis, seudoquistes, distrofia quística, insulinomas y transformación maligna11.
Normalmente se encuentra en el antro prepilórico como un nódulo subepitelial intramural menor de 3cm, con una umbilicación central que representa un conducto pancreático rudimentario y su orificio (fig. 6)11. Puede mostrar un patrón de crecimiento endoluminal21.
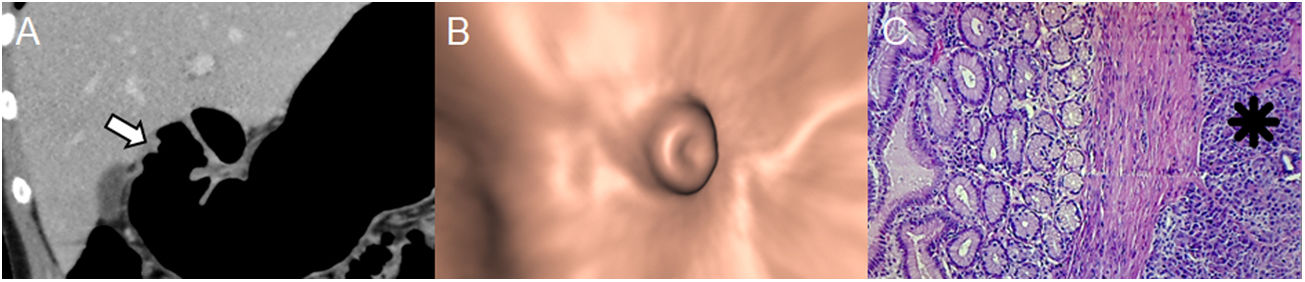
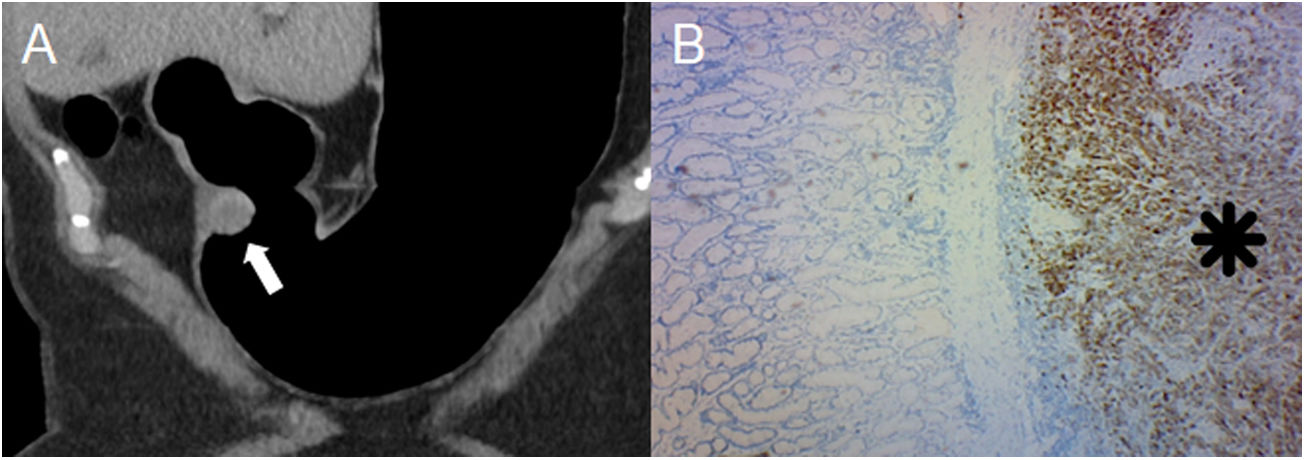
Páncreas ectópico en una mujer de 18 años con hematemesis y melena. A) Neumo-TC con contraste intravenoso, MPR curvo coronal que muestra una lesión elevada con umbilicación central en el antro gástrico (flecha). Nótese la óptima distensión gástrica obtenida en una zona de difícil distensión como la región pilórica. B) La endoscopia virtual muestra mejor el orificio central del conducto pancreático rudimentario. C) La histología (×100; tinción de hematoxilina-eosina) muestra las glándulas subepiteliales separadas por un estroma fibroso (asterisco). Los GIST, los tumores neuronales y los carcinoides gástricos son los principales diagnósticos diferenciales (figuras 1, 7 y 8, respectivamente), siendo en ocasiones un reto diagnóstico en el cual se debe considerar el realce de la mucosa suprayacente, la ubicación, el patrón de crecimiento, los márgenes de la lesión y la correlación con la ultrasonografía endoscópica.
En la TCMD muestra bordes mal definidos y un prominente realce mucoso similar al páncreas. Sin embargo, a veces muestra escaso realce debido a un componente menor de acinos pancreáticos22.
Los hallazgos histológicos incluyen aquellos de un páncreas normal: acinos pancreáticos, conductos, islotes de Langerhans y tejido conectivo18.
En resumen, el páncreas ectópico se localiza en el antro prepilórico como un nódulo intramural de crecimiento endoluminal menor de 3cm, con una umbilicación central.
Tumores neurogénicosConstituyen el 5-10% de los tumores gástricos benignos, siendo la mayoría tumores de la vaina del nervio como neurinomas, schwannomas y neuromas23.
Los schwannomas surgen del plexo mientérico dentro de la muscularis propia y se encuentran principalmente en el estómago (60-70%), seguido del colon y el recto24. Los schwannomas gastrointestinales son neoplasias claramente diferentes de los schwannomas convencionales de tejidos blandos y de sistema nervioso central debido a diferentes características histológicas, y además pueden estar asociados con la neurofibromatosis24. En el tracto gastrointestinal muestran un prominente manguito linfoide18.
Clínicamente, son asintomáticos o presentan dolor abdominal o hemorragia gastrointestinal si existe ulceración mucosa. Las lesiones grandes pueden causar síntomas obstructivos25.
El rasgo característico en la TCMD es la atenuación homogénea en fases sin y con contraste intravenoso, con realce tardío y un patrón de crecimiento exofítico o intramural (fig. 7)3,18. La hemorragia, la necrosis, la degeneración quística o la calcificación son raras3.
Mujer de 31 años en estudio por dolor abdominal y dispepsia. A) Neumo-TC con contraste intravenoso, corte transversal que muestra una masa endoluminal con realce tardío durante la fase de equilibrio, lo cual es característico de un schwannoma (flecha). B) Tinción de inmunohistoquímica positiva para S-100. El diagnóstico diferencial incluye GIST, leiomioma y linfoma, siendo la ausencia de hemorragia, la necrosis o la cavitación una característica a favor de un schwannoma.
Las características histológicas consisten en células fusiformes con infiltración linfocítica peritumoral en forma de manguito y centros germinales ocasionales18. La inmunohistoquímica muestra positividad para la proteína S-100.
En resumen, el schwannoma presenta atenuación homogénea y realce tardío.
Tumores neuroendocrinosSon tumores neuroendocrinos bien diferenciados originados en las células enterocromafines ubicadas en el tracto gastrointestinal, el tracto pancreatobiliar y el pulmón. Por lo tanto, son de origen epitelial, pero como el grueso del tumor es submucoso deben diferenciarse de otras LSE3. Los tumores carcinoides representan el 1,8% de las malignidades gástricas26.
Se manifiestan como uno o más pequeñas LSE intraluminales con un ávido realce en fase arterial. El carcinoma neuroendocrino puede aparecer como una gran masa ulcerada infiltrante y la presencia de metástasis y linfadenopatías perigástricas depende del tamaño tumoral (fig. 8)11. El pronóstico es malo, con una supervivencia del 20% a los 5 años3.
Varón de 42 años con hallazgo incidental de lesión gástrica en TCMD por hemangioma hepático. A) Neumo-TC con contraste intravenoso, reconstrucción coronal que muestra una masa endoluminal en la región antropilórica con realce heterogéneo (flecha). B) La histología (×400; tinción de hematoxilina-eosina) muestra una proliferación neoplásica dispuesta en nidos, hallazgo característico del carcinoma neuroendocrino. El diagnóstico diferencial en lesiones múltiples incluye los pólipos y las metástasis, y en una lesión única el adenocarcinoma, el linfoma y el GIST, siendo la histología el método que define el diagnóstico.
Las características histológicas muestran células pequeñas y uniformes dispuestas en patrones de nidos. Los tumores carcinoides de alto grado pueden ser similares a los carcinomas de células pequeñas y estas lesiones son inmunorreactivas a la cromogranina A y a la sinaptofisina18.
En resumen, el tumor carcinoide se manifiesta como una masa con ávido realce arterial.
Pólipo fibroide inflamatorioEl pólipo fibroide inflamatorio es una lesión submucosa no neoplásica y proliferante poco frecuente, caracterizada por la disposición distintiva de tejido fibroso y vasos sanguíneos con un infiltrado inflamatorio dominado por eosinófilos27. También se denomina tumor de Vanek, granuloma eosinofílico, fibroma submucoso y seudotumor inflamatorio.
Suelen ser solitarios y pueden desarrollarse en cualquier lugar del tracto gastrointestinal, pero el 75% aparece en el antro3. Suelen ser asintomáticos o manifestar dolor abdominal o hemorragia gastrointestinal. No muestran potencial maligno27.
En la TCMD se manifiestan como masas endoluminales bien definidas, redondas u ovoides, de contorno ligeramente lobulado, miden 2-5cm, y pueden mostrar ulceración e intenso realce mucoso (fig. 9)3,28. El realce puede variar desde la hiperatenuación hasta la hipoatenuación causada por diferencias en las características histológicas28.
Varón de 47 años con dolor abdominal y anemia. A) Neumo-TC con contraste intravenoso, MPR curvo coronal muestra una masa endoluminal en el antro gástrico (flecha). B) La histología (×400; tinción de hematoxilina-eosina) muestra células fusiformes con un componente inflamatorio de linfocitos y eosinófilos. C) Tinción de análisis inmunohistoquímico para CD34, confirmando el diagnóstico de pólipo fibroide inflamatorio. Se considera difícil su diagnóstico utilizando solo la TC y en el diagnóstico diferencial se incluyen los pólipos adenomatosos, los GIST endoluminales, los tumores carcinoides y los schwannomas.
En resumen, el pólipo fibroide inflamatorio surge como una masa polipoide en el antro con realce variable.
MetástasisLa metástasis gástrica ocurre por extensión directa de una carcinomatosis maligna primaria peritoneal con implantes serosos y como metástasis embólica con LSE intramural11. Se clasifican en hipervasculares o hipovasculares. Debe recordarse que las metástasis hipervasculares incluyen el melanoma maligno y el cáncer de mama, y con menor frecuencia el carcinoma de células renales, el coriocarcinoma, el carcinoma neuroendocrino y el sarcoma mesenquimatoso, y las metástasis hipovasculares más frecuentes son de origen pulmonar o esofágico29.
Los melanomas metastásicos se manifiestan como pequeños nódulos intramurales aislados o múltiples y masas polipoides con o sin ulceración (fig. 10)30. Las lesiones grandes pueden mostrar necrosis, hemorragia o cambios degenerativos.
Mujer de 72 años con antecedente de melanoma en estudio por anemia. A) Neumo-TC con contraste intravenoso: MPR curvo coronal muestra una masa endoluminal en la región antropilórica con realce periférico en la fase arterial (flecha). B) Inmunohistoquímica positiva para MELAN-A (asterisco) confirmando la presencia de metástasis de melanoma. La diferenciación de las metástasis gástricas con otras lesiones es dificultosa, siendo importante conocer el antecedente de tumor primario y sus características en la TC para ayudar a realizar un diagnóstico más preciso.
En resumen, las características del tumor primario definen el comportamiento de las metástasis.
ConclusionesLa neumo-TC combinada con las reconstrucciones multiplanares, tridimensionales y endoscopia virtual puede considerarse una técnica útil y no invasiva para la caracterización de estas lesiones debido a la DG adicional.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Autoría- 1.
Responsables de la integridad del estudio: RLG, LS y MU.
- 2.
Concepción del estudio: RLG y LS.
- 3.
Diseño del estudio: RLG, EG y MU.
- 4.
Obtención de los datos: RLG, EG y JPS.
- 5.
Análisis e interpretación de los datos: RLG, EG y LS.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: RLG, EG y JPS.
- 8.
Redacción del trabajo: RLG, EG, LS, JPS y MU.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: LS, JPS y MU.
- 10.
Aprobación de la versión final: RLG, EG, LS, JPS y MU.
Los autores declaran no tener ningún conflicto de intereses.