En mujeres con alto riesgo de padecer cáncer de mama, la detección precoz tiene un importante papel. Debido a la alta incidencia de cáncer mamario y a edades más tempranas que en la población general, se recomienda que el cribado comience en edad más joven, y existe amplia evidencia de que la resonancia magnética es la herramienta diagnóstica más sensible: las principales guías americanas y europeas coinciden en la recomendación de realizar resonancia magnética anual (con mamografía anual suplementaria) como modalidad óptima de cribado. No obstante, no hay un total consenso actual entre las guías sobre algunos subgrupos de pacientes a incluir en la recomendación de cribado con resonancia magnética.
El objetivo de esta primera parte de nuestro trabajo es, mediante una revisión de la bibliografía, explicar y valorar las ventajas que este tipo de cribado con resonancia magnética proporciona respecto al cribado solo con mamografía, como son: mayor detección de cánceres de menor tamaño y con menor afectación ganglionar asociada y una reducción de los cánceres de intervalo, lo que puede tener repercusión en supervivencia y mortalidad, con efectos comparables a otras medidas de prevención. Pero, a su vez, también queremos reflejar los inconvenientes que el cribado con resonancia magnética conlleva, y que dificultan su aplicabilidad.
Screening plays an important role in women with a high risk of breast cancer. Given this population's high incidence of breast cancer and younger age of onset compared to the general population, it is recommended that screening starts earlier. There is ample evidence that magnetic resonance imaging (MRI) is the most sensitive diagnostic tool, and American and the European guidelines both recommend annual MRI screening (with supplementary annual mammography) as the optimum screening modality. Nevertheless, the current guidelines do not totally agree about the recommendations for MRI screening in some subgroups of patients. The first part of this article on screening in women with increased risk of breast cancer reviews the literature to explain and evaluate the advantages of MRI screening compared to screening with mammography alone: increased detection of smaller cancers with less associated lymph node involvement and a reduction in the rate of interval cancers, which can have an impact on survival and mortality (with comparable effects to other preventative measures). At the same time, however, we would like to reflect on the drawbacks of MRI screening that affect its applicability.
A la hora de establecer estrategias de prevención de cáncer de mama (CM), es necesario tener en cuenta que el riesgo de padecer la enfermedad no es el mismo para toda la población. Existen factores que incrementan el riesgo y modifican el abordaje preventivo de las mujeres, en función de los cuales se pueden considerar tres grupos de riesgo: normal, intermedio y alto (según sea el riesgo absoluto de padecer CM a lo largo de la vida aproximadamente ≤ 15%, entre un 15% y 20% o ≥20%, respectivamente).
En pacientes con riesgo normal, riesgo absoluto a lo largo de la vida del 15% o menos, el cribado se realiza con mamografía, única técnica que ha reducido probadamente la mortalidad de modo significativo1–2. Persisten las controversias respecto al intervalo óptimo entre mamografías (anual vs. bienal), y la edad de inicio (entre 40 y 50 años) y finalización del cribado (70 vs.>70 años), como reflejan las diferentes recomendaciones de las guías de distintos países y continentes.
En pacientes con alto riesgo (AR), riesgo absoluto a lo largo de la vida de un 20-25% o superior, ha habido en los últimos años un acuerdo generalizado entre las principales sociedades radiológicas europeas y americanas (European Society of Breast Cancer Specialists [EUSOMA], European Society of Breast Imaging [EUSOBI], Society of Breast Imaging [SBI], American College of Radiology [ACR] y American Cancer Society [ACS]) en la recomendación de cribado con resonancia magnética (RM) y mamografía (MX), con intervalo anual, y en la inclusión de las siguientes pacientes: mujeres con predisposición genética, riesgo por historia familiar igual o superior al 20-25% o antecedente de radioterapia torácica a edad joven3–7 (tabla 1A). Se trata de pacientes con más alta incidencia de CM y a edades más tempranas que en la población general (la densidad mamográfica es mayor en edad más joven), y en las que hay tumores de crecimiento más rápido. En ellas, la mamografía detecta cánceres en estadio subóptimo, y la RM permite detectar mayor número de cánceres y en un estadio menor.
Pacientes de alto riesgo incluidas en la recomendación de cribado con resonancia magnética
| Pacientes con alto riesgo de padecer cáncer de mama (riesgo absoluto de cáncer de mama a lo largo de la vida ≥ 20-25%) incluidas en la recomendación de cribado con resonancia magnética en las principales guías americanas y europeasa (antes de la actualización de ACR en 2018) |
|---|
| 1. BRCA1 (55-85%) y BRCA2 (25-60%) o parientes de 1.er grado de portadores de mutación BRCA sin test |
| 2. Mujeres con riesgo del 20-25% (o mayor) definido por test BRCAPRO (u otros) que son muy dependientes de la historia familiar |
| 3. Síndromes: Li-Fraumeni (60-90%), Cowden (30-50%), Bannayan-Riley-Ruvalcaba (30-50%) o parientes de 1.er grado |
| 4. Exposición a radiación a edad inferior a 30 años (el riesgo de cáncer de mama aumenta 8 veces después de radiar el tórax) |
| 5. Combinación de los anteriores |
Acuerdo Society of Breast Imaging (SBI), American College of Radiology (ACR), American Cancer Society (ACS), European Society of Breast Cancer Specialists (EUSOMA), European Society of Breast Imaging (EUSOBI), antes de la actualización de la ACR de 2018 (1 y 2, basado en evidencia; 3 y 4 basado en opinión de consenso de expertos).
Nota adicional: dentro de los distintos test de medición de riesgo de cáncer de mama, en nuestro país (España) el de uso más generalizado por los oncólogos es el test BOADICEA7.
Las pacientes con historia personal de CM, antecedente de biopsia previa con resultado histológico de hiperplasia ductal atípica (HDA), hiperplasia lobulillar atípica (HLA) o carcinoma lobulillar in situ (CLIS), o con un riesgo por historia familiar de cáncer de mama entre el 15% y el 20%, se consideraron dentro del grupo de riesgo intermedio (elevado respecto al de la población general, pero con evidencia insuficiente para añadir RM al cribado con MX anual si no había otros factores de riesgo añadidos).
Pero, en 2018, la ACR8 en su actualización ha incluido en la recomendación de cribado con RM a algunas mujeres hasta ese momento integradas en el grupo de “riesgo intermedio”, concretamente: a “mujeres con historia personal de CM y mama densa“y a “mujeres con historia personal de CM, si el CM fue con menos de 50 años”. Indican también que se debería considerar la RM adicional en el resto de mujeres con historia personal de CM o con antecedente personal de biopsia previa con resultado de HDA o neoplasia lobular (CLIS o HLA), especialmente si hay otros factores de riesgo. (tabla 1B).
| El American College of Radiology, en su actualización en 20188, ha incluido (añadido) en la recomendación de cribado con resonancia magnética a otras pacientes: |
| Mujeres con historia personal de cáncer de mama y mama densa |
| Mujeres con historia personal de cáncer de mama, si el cáncer de mama fue con menos de 50 años |
| E indican que el resto de las mujeres con historia personal de cáncer de mama o antecedentes de biopsia con resultado de hiperplasia ductal atípica (HDA) o neoplasia lobular (NL) (carcinoma lobulillar in situ [CLIS] o hiperplasia lobulillar atípica [HLA]) deberían considerar la resonancia magnética adicional, especialmente si hay otros factores de riesgo |
Incluye, en la recomendación de cribado con resonancia magnética en pacientes con riesgo incrementado, a varios nuevos subgrupos de pacientes.
Nota adicional: dentro de los distintos test de medición de riesgo de cáncer de mama, en nuestro país (España) el de uso más generalizado por los oncólogos es el test BOADICEA7.
Argumentan para este cambio que las mujeres tratadas de CM tienen un riesgo de recurrencia del 19,3% a los 10 años y del 21,4% a los 15 años9. Concretamente en las mujeres con mama densa, la combinación de ambos factores de riesgo conllevaría un riesgo de padecer CM a lo largo de su vida superior al 20% y, en aquellas mujeres diagnosticadas con menos de 50 años, el riesgo de padecer un segundo CM sería también superior al 20%10. Las mujeres con historia personal de CM tienen más riesgo de padecer CM de intervalo que las mujeres sin ella (tasa de cáncer de intervalo 3,6 vs. 1,4 ‰ mujeres cribadas). Además11,12, la sensibilidad del cribado con MX en las mujeres con historia personal de CM es menor que en las mujeres sin ella (65,4% vs. 76,5%) y aún menor en los primeros 5 años. La detección precoz de un segundo CM mejora su pronóstico.
Numerosos trabajos de cribado con RM en mujeres con historia personal de CM muestran altas tasas de detección (media: 10-29‰ RM realizadas), con equivalente sensibilidad, menos falsos positivos (FP), y mayor especificidad que en pacientes con riesgo genético o familiar, con el principal beneficio similar a ellas: encontrar cánceres invasivos (CI) en estadios precoces13–17.
Aunque en nuestra práctica podría no ser factible por falta de medios hacer cribado con RM a todas esas pacientes con historia personal de CM, el cambio en la recomendación de la ACR “pone en evidencia” que la MX puede ser insuficiente en su seguimiento. En cambio, la mayoría del resto de guías recomiendan seguimiento solo con MX si la paciente no cumple criterios de AR, salvo la de la ESMO (European Society for Medical Oncology) (que recomienda MX y ecografía, e incluso RM en situaciones especiales como mujeres jóvenes con mama densa y predisposición genética o familiar)11,12,18.
Posiblemente sea conveniente realizar en pacientes con historia personal de CM una evaluación adicional de características relacionadas con el primer cáncer, tanto dependientes del paciente (edad de presentación, presentación clínica o densidad mamográfica) como del propio tumor primario (grado histológico, subtipo molecular), como del tipo de tratamiento recibido (si fue conservador, si recibió radioterapia). Porque conocer mejor los factores que influyen en el riesgo de cáncer y su detección por imagen podría guiarnos a la hora de realizar regímenes más específicos de seguimiento con distinta frecuencia de intervalo o con empleo de alguna modalidad suplementaria a la MX como la RM o la ecografía19. Habrá que investigar qué técnica suplementaria es más coste-efectiva. Evidentemente, la RM proporciona mayor detección, pero por coste y accesibilidad puede ser más factible la ecografía (que en mujeres con historia personal de CM también aporta una detección de cánceres adicionales a los detectados por MX, entre el 2,8‰ y el 5‰ si la mama es densa20,21, al igual que aporta al añadirse a la mama densa en general22). Los perjuicios por añadir RM o ecografía a la MX (ambas generan rellamadas y biopsias con FP), son aceptables dado el beneficio de encontrar cánceres más pequeños y con ganglios linfáticos negativos (cuyo tratamiento es más fácil que sea curativo).
En el trabajo publicado por Houssami et al. en 201812 sobre cribado en mujeres con historia personal de CM indican a qué pacientes debería añadírseles una segunda técnica adicional a la MX para aumentar la sensibilidad, teniendo en cuenta los factores significativos predictores de CI de intervalo un año después de una MX normal basándose en la evidencia descrita (mujeres con mayor riesgo de un segundo cáncer, como cáncer de intervalo, y en las que se estima que la sensibilidad de la MX sería inferior al 55%). La ecografía podría parecer más factible, disponible y aceptada por la paciente (tabla 2).
| Mujeres con historia personal de cáncer de mama con riesgo de segundo cáncer de mama de intervalo después de una mamografía normal (Houssami et al., 2018)12: |
| 1.er cáncer de mama a edad ≤40 años o <50 años al hacerse el control |
| 1.er cáncer de mama de intervalo |
| Mamas extremadamente densas |
| Tratamiento conservador sin radioterapia o más de uno de los siguientes: 1.er cáncer de mama invasivo de alto grado o sintomático, las mamas heterogéneamente densas o cirugía conservadora en el 1.er cáncer de mama |
Indican a qué pacientes debería añadírseles una segunda técnica adicional a la mamografía para aumentar la sensibilidad. En esas mujeres, la sensibilidad de la mamografía sería inferior al 55% (subóptima) y se estima que tienen mayor riesgo de un segundo cáncer como cáncer de intervalo.
Refieren que la ecografía podría parecer más factible, disponible y aceptada por la paciente.
En este contexto, la RM abreviada, con protocolos todavía pendientes de estandarizar y validar con estudios prospectivos multicéntricos antes de implementarse en la rutina clínica, podría hacer que en un futuro cercano la RM fuera más coste-efectiva y más accesible en el cribado23.
Otra técnica que considerar, que añadida a la mamografía convencional aumenta significativamente la sensibilidad, y de la que también se ha mostrado especial utilidad en mujeres con historia personal de CM, es la MX con contraste (con sensibilidad cercana a la de la RM, por lo que podría plantearse como otra alternativa24).
Actualizaciones recientes de guías de nuestro país van incluyendo en sus recomendaciones añadir técnicas adicionales a la MX en mujeres con historia personal de CM. La SESPM (Sociedad Española de Senología y Patología Mamaria) recomienda seguimiento con MX y ecografía (o RM) en mamas densas o alto riesgo de recidiva25. La SEOM (Sociedad Española de Oncología Médica) recomienda seguimiento con MX y ecografía (y la RM puede estar indicada en pacientes jóvenes especialmente en casos de mama densa y predisposición genética o familiar)26, en línea con la ESMO18.
La tendencia en mujeres con historia personal de CM debería ir hacia un seguimiento de imagen postratamiento personalizado, donde el objetivo sea detectar CM pequeños agresivos, disminuir CM de intervalo y la mortalidad23.
En la actualización de las recomendaciones de ACR-2018 en pacientes con riesgo incrementado, Monticciolo et al.8 indican que en pacientes con diagnóstico histológico previo de HDA y neoplasia lobular (HLA y CLIS) con mama densa ocurre algo similar que en aquellas pacientes con historia personal de CM con mama densa: que el riesgo de CM en su vida es igual o superior al 20%27. En este grupo de pacientes con HDA o neoplasia lobular existen también estudios publicados de cribado con RM con tasas de detección comparables a las de pacientes con mutación genética27–30 (con el beneficio similar de encontrar CI en estadios precoces).
Dentro de las pacientes con riesgo incrementado, es manifiesto por tanto que existe en este momento actual discordancia entre las guías respecto a qué subgrupos de mujeres incluir en la recomendación de RM.
El objetivo de este trabajo es, mediante una revisión de la bibliografía, explicar y valorar las ventajas que el cribado con RM proporciona para justificar su uso en pacientes con riesgo incrementado, ya que respecto al cribado “solo con MX” aporta una mayor detección de cánceres de menor tamaño y con menor afectación ganglionar asociada y una reducción de cánceres de intervalo, lo que puede tener repercusión en supervivencia y mortalidad con efectos comparables a otras medidas de prevención. Pero, a su vez, también queremos reflejar los inconvenientes que el cribado con RM conlleva, y que dificultan su aplicabilidad, entre los que destacan el aumento de coste y la escasa disponibilidad, especialmente a la hora de extender su uso a subgrupos de pacientes hasta ahora incluidas dentro del grupo de riesgo intermedio donde la MX se evidencia insuficiente.
Pros en la realización de cribado con resonancia magnéticaLa recomendación de añadir RM a la MX en el cribado en AR se basa en el aporte de importantes beneficios:
- 1.
Mayor tasa de detección de cáncer
En los primeros estudios prospectivos sobre el cribado con RM en pacientes de AR31–39 se observó que la sensibilidad de la RM duplica a la de la MX, beneficio que se confirma en estudios posteriores40–45. De hecho, actualmente, con la mayor experiencia de lectores y mejora de estándares de adquisición e informes, la sensibilidad de la RM alcanza el 90%39 mientras que la de la MX en pacientes de AR se sitúa entre 25% y el 59%8. Su especificidad es también alta, publicada entre el 78% y el 97%44 (media sobre 85-90%), y asciende tras la primera ronda, para alcanzar después hasta el 90-95%43,45.
La tasa de detección de CM de la RM en AR se halla entre el 16‰ y el 30‰ RM (frente a la de la MX, de aproximadamente 7,6-7,9‰ MX).
- 2.
Detección de cánceres en un estadio menor
El empleo de RM permite detectar cánceres en un estadio menor respecto a cuando el cribado se hace solo con MX:
- •
Por un lado, son cánceres con menor tamaño (tamaño medio de 7-18mm; en torno al 50% de los cánceres detectados con RM son carcinoma ductal in situ (CDIS) o T <1cm39. En un estudio prospectivo en población BRCA que compara detección en cribado con RM respecto a un grupo control solo con MX, refieren diferencias de tamaño medio en los CI detectados de 9mm vs. 18mm, y de tumores detectados con T> 2 cm del 3% frente al 29%46, respectivamente.
- •
Por otro lado, son cánceres con menor afectación axilar (un 11-29%39,41,42,46,47 de los cánceres detectados con RM tienen ganglios axilares positivos, con una media sobre un 15-16%, frente al 30-45% cuando el cribado se realiza solo con MX).
En resumen, con el uso de RM hay una significativa reducción de los CI grandes o con ganglios positivos (estadios II al IV).
- 3.
Menor tasa de cánceres de intervalo
Con el empleo de RM, la tasa de cánceres de intervalo ronda una media del 5,4%, menor del 10%39,46, frente a una media prácticamente del 50% cuando el cribado se hace solo con MX.
Tanto el punto 2 como el punto 3 son los que determinan la eficacia de un cribado.
- 4.
Aumento de supervivencia y disminución de mortalidad
Una de las grandes limitaciones de la mayoría de los estudios que han comparado cribado con “RM y MX” con “MX” es no haber evidenciado su repercusión en mortalidad. Indudablemente, los argumentos a favor de una disminución de mortalidad tienen que venir de datos de recurrencias y supervivencia de estudios observacionales durante largo tiempo.
Actualmente hay estudios observacionales con seguimientos de 6-10 años que han mostrado cómo el cribado con RM suplementaria a MX, junto con algunos cambios en protocolos de tratamiento, consiguen un aumento en la supervivencia y una disminución de mortalidad en pacientes de AR47–53 al detectar cánceres invasivos en estadios precoces.
No obstante, hay que tener en cuenta varios factores: a) la mortalidad en AR debe incluir largos y completos seguimientos de 10 años o más, y hay que esperar más resultados en ese sentido y b) ha habido valores más bajos de supervivencia de los esperados en el subgrupo BRCA1. En pacientes portadoras de la mutación BRCA1 se detecta un mayor número de cánceres de intervalo y con un estadio más alto en el momento del diagnóstico. El cribado con RM anual es menos efectivo, y hay más muertes. Esto es debido a una mayor frecuencia de tumores con subtipo molecular triple negativo. Existe evidencia en la relación tamaño tumoral-pronóstico, y los tumores triple negativo en el momento del diagnóstico en este subgrupo de pacientes son de mayor tamaño, lo que añadido a que una porción sustancial de ellos hacen metástasis a pesar de diagnosticarse con menos de 10-15mm, influye en esa peor evolución.
Los resultados de supervivencia de los estudios de Evans et al.47 (UK) y Rijnsburger et al.48 (Holanda) con seguimientos de 10 y 6 años, respectivamente, muestran aumentos de supervivencia al añadir RM: del 95,3% de supervivencia con cribado con RM y MX frente al 87% (cribado solo con MX) o 73,7% (sin cribado) en el estudio de Evans et al., y del 92,7% de supervivencia frente a 74,5% (cribado solo con MX) en el de Rijnsburger et al.
Passaperuma et al.49 (Canadá) reflejan en pacientes BRCA1/2 buenos resultados a largo plazo de: a) mortalidad (índice de mortalidad anual del 0,5% tras 8 años de seguimiento) y los compara con datos de Holanda48 (1,2% tras 6 años), y b) recurrencia a distancia (tras 8 años de solo 3,6%), que compara también con datos de Holanda48 (que refieren un 84% de pacientes libres de enfermedad tras 6 años).
Aunque por subgrupos las cifras de supervivencia son peores en BRCA1, si comparamos “supervivencia a 5 años” en BRCA1 a lo largo de distintas décadas, puede apreciarse que existe un aumento progresivo: supervivencia de un 50% en años 80/90 (donde no había cribado con RM ni las quimioterapias oncológicas actuales), frente a las primeras décadas del siglo xxi donde ronda el 90% (con cifras del 89±7%, tras 9,7 años de seguimiento del estudio italiano de Podo et al.50, parecidas a las de los estudios inglés47 y holandés48 mencionados antes). Möller et al.51 (Noruega) obtuvieron peores resultados, con una supervivencia del 75% a 5 años en BRCA1, posiblemente porque una menor proporción de sus pacientes recibieron quimioterapias adyuvantes (65% frente al 89% del estudio de Podo et al.). Podo et al.50 destacan la disminución de la diferencia en supervivencia que había entre “triple negativo” y “no triple negativo”: hallaron una diferencia no significativa de supervivencia con 5 años de seguimiento (86±9% en “triple negativo” vs. 93±5% en “no triple negativo”) a pesar de sus características más agresivas, influyendo en ello la detección temprana gracias al cribado con RM y los tratamientos más efectivos (quimioterapia adyuvante y mastectomía terapéutica y profiláctica). Las cifras de supervivencia son mejores en BRCA2 y resto de subgrupos de AR; algunos estudios hablan del 100% de las pacientes, y en los estudios con algunas muertes en pacientes BRCA2, estas son menores que en BRCA147,48,52.
Saadatmand et al.53 (Holanda) comparan supervivencia libre de metástasis en pacientes BRCA o con predisposición familiar con cribado con RM respecto a no cribadas en menores de 50 años y cribadas con MX bienal mayores de 50 años. En 10 años de seguimiento desarrollan metástasis 3 veces menos, y la diferencia en mujeres con riesgo familiar es más pronunciada que en BRCA1; las diferencias en BRCA2 no fueron significativas.
- 5.
Efecto en supervivencia comparable a la otra principal medida de prevención (mastectomía profiláctica)
Grann et al.54 realizaron, con un modelo analítico, una comparativa de medidas de prevención en BRCA1/2 y vieron que las cirugías preventivas y la quimioprevención son más coste-efectivas que el cribado con RM y MX (porque el cribado con RM es muy costoso). Dedujeron que:
- 1.
L a ooforectomía y mastectomía profiláctica es la estrategia más barata y con mayor supervivencia “en años de vida”, y por tanto es más coste-efectiva, pero tiene las menores tasas de preferencia por las mujeres.
- 2.
El cribado con RM y MX es la estrategia más efectiva por su alta tasa de preferencia por las mujeres y porque por su alta sensibilidad se asocia a una elevada supervivencia, con la mayor calidad ajustada en años de vida (QALY, quality adjusted survival), pero es la estrategia más cara, es recurrente y genera muchas biopsias/FP y posible sobrediagnóstico.
Kurian et al.55, con un modelo de simulación computada integrando datos de la literatura científica, realizaron un estudio para estimar la probabilidad de supervivencia y causas de muerte a las edades de 70 y 80 años para mujeres de 25 años BRCA1/2. Compararon diferentes estrategias para reducir la mortalidad por cáncer en ellas. Dedujeron que, reemplazando mastectomía profiláctica por cribado con RM y MX y manteniendo la ooforectomía profiláctica a los 40 años, se estima que la supervivencia solo baja un 3-5%, siendo muy alta su tasa de preferencia por las mujeres: el cribado con RM y MX es caro, pero efectivo.
Posteriormente, en un gran estudio prospectivo de Heemskerk-Gerritsen et al.56 que comparó eficacia de mastectomía profiláctica vs. seguimiento con RM y MX se observó que la mastectomía profiláctica baja la incidencia de CM, y las muertes por CM y por todas las causas, pero después de 10 años de seguimiento la reducción de mortalidad encontrada por CM y por todas las causas “no fue significativa”. La supervivencia global fue del 99% en el grupo de mastectomía profiláctica y del 96% en el grupo de seguimiento con RM y MX, lo que es comparable con el 3-5% de incremento en supervivencia descrito en el estudio de Kurian et al.
El metaanálisis de Li57 et al. refleja conclusiones semejantes. En su estudio valoran la efectividad de las cirugías profilácticas en pacientes BRCA1/2, revisando la bibliografía más representativa. En su estudio sí parece que podría ser significativa la reducción de mortalidad cuando la mastectomía profiláctica es contralateral, en pacientes ya diagnosticadas de un CM (tabla 3).
| • La mastectomía profiláctica condiciona la reducción de la incidencia de cáncer de mama significativa y la reducción de la mortalidad por cáncer de mama o por todas las causas, pero NO significativa |
| • La mastectomía profiláctica contralateral condiciona la reducción la de incidencia de cáncer de mama significativa y la reducción de la mortalidad por todas causas significativa |
| • La ooforectomía profiláctica condiciona la reducción de la mortalidad por todas las causas significativa |
| Se indica que son necesarios más estudios prospectivos (con mayores tamaños de muestra y mayores tiempos de seguimiento para estimación más precisa de beneficios/perjuicios de las cirugías profilácticas) |
El cribado con RM conlleva numerosos inconvenientes, que reflejamos a continuación.
- 1.
Investigación adicional generada por el resultado de la resonancia magnética de cribado
Genera tres principales perjuicios:
- •
Rellamadas-imágenes adicionales (ecografía dirigida post-RM): (4,1-28%; media sobre 16-17%).
- •
Biopsias adicionales: (3-15%).
- •
Seguimientos a corto plazo: (7-16%).
Pero esos perjuicios van disminuyendo después de la 1.ª ronda, tras la cual aumentan la especificidad y el valor predictivo positivo de las rellamadas y biopsias, alcanzando valores aceptables en las siguientes rondas39,44.
Aunque la tasa de detección de cáncer baja después de la 1.ª ronda45 (lo que muestra la fracción de cánceres prevalentes en el inicio del cribado), se mantiene el rendimiento continuo de la técnica de RM en detección de cáncer en rondas posteriores. No se han detectado diferencias en el estadio T, el estadio N, ni el grado del tumor entre la 1.ª ronda de cribado y las rondas sucesivas44,45.
- 2.
Alto coste
El cribado con RM supone un alto coste, pero es coste-efectivo en pacientes BRCA y en mujeres de AR no portadoras58–62.
Los beneficios de la detección precoz en esa población (los CM en estadio precoz cuestan menos de tratar) sopesan el coste y los FP, pero el coste-efectividad es muy dependiente del precio de la RM. El coste-efectividad del cribado con RM depende de: a) la incidencia de cáncer en la población a estudio, y estamos hablando de población con muy alta incidencia/prevalencia de CM y b) del coste del examen, no solo del examen en sí, sino de lo que deriva de él, como las biopsias RM-guiadas.
- 3.
Tiempo de realización del estudio (ocupación de aparato de resonancia) y tiempo de interpretación-informe
Una manera de aumentar la eficiencia/coste-efectividad es precisamente bajar el tiempo de adquisición de examen e interpretación-realización de informe radiológico mediante protocolos abreviados de RM. El uso de un menor número de secuencias o secuencias de adquisición rápida, sin bajar significativamente la detección, puede hacer que el cribado con RM sea coste-efectivo para un mayor abanico de población23,63.
Los “protocolos abreviados” se basan en que los cánceres se observan mejor en la fase arterial, donde hay mayor contraste entre tumor y tejido. Se disminuye el número de secuencias respecto al protocolo completo estándar: se realizan secuencias T1 basal y precoz poscontraste que se sustraen y reconstruyen (MIP, proyección de máxima intensidad), que son fundamentales para la detección. Proporcionan información morfológica de las lesiones que realzan en fase precoz. Se prescinde de las secuencias tardías poscontraste o adicionales tipo T2 o STIR, que sirven para caracterizar mejor las lesiones y cuya ausencia condiciona menor seguridad diagnóstica y un ligero aumento de seguimientos y rellamadas64–66. Pero hay trabajos que proponen “protocolos abreviados combinados”67–70 que sí incluyen, a expensas de muy ligera penalización en el tiempo, alguna otra de esas secuencias T2 o STIR o fases intermedias o más tardías del estudio dinámico poscontraste, que ayudan en la caracterización de lesiones, recalcando alguno de ellos70 la importancia de la fase final poscontraste para la realización de curvas cinéticas y no prescindir de la información dinámica. Habría que estandarizar el protocolo de secuencias y faltan estudios prospectivos para confirmar el beneficio y validar la RM abreviada como alternativa viable a la RM estándar, pero los resultados hasta ahora son prometedores. También están en estudio protocolos cortos de RM que emplean técnicas de imagen dinámica de rápida adquisición usando secuencias “ultrarrápidas” que obtienen imágenes diagnósticas de alta resolución espacial mientras capturan la entrada de contraste de las lesiones mamarias. Son estudios realizados con aparatos de 3 teslas, que combinan la información morfológica con la dinámica y proporcionan alta resolución espacial y temporal71–74. Estas secuencias pueden añadirse a su vez a un protocolo abreviado convencional75.
- 4.
Disponibilidad de aparato de resonancia magnética dentro de un servicio de radiodiagnóstico
Existen otras múltiples secciones en los servicios de radiodiagnóstico con las que ha de compartirse el aparato de RM, por lo que no siempre disponemos de los huecos necesarios de RM o biopsias guidas por RM.
- 5.
Disponibilidad de sistema de biopsia guiada por resonancia magnética
Sabemos que la ecografía dirigida post-RM y biopsia posterior con guía ecográfica es el paso más coste-efectivo y eficiente en la evaluación de lesiones detectadas en RM. Pero un 30-40% de las lesiones halladas en RM no se logran localizar en la ecografía post-RM, y de ellas, entre un 11% y un 22% (media de 15%) son malignas: la ausencia de traducción ecográfica no excluye la necesidad de biopsia (con guía de RM)76–80 (fig. 1).
- 6
Uso de gadolinio
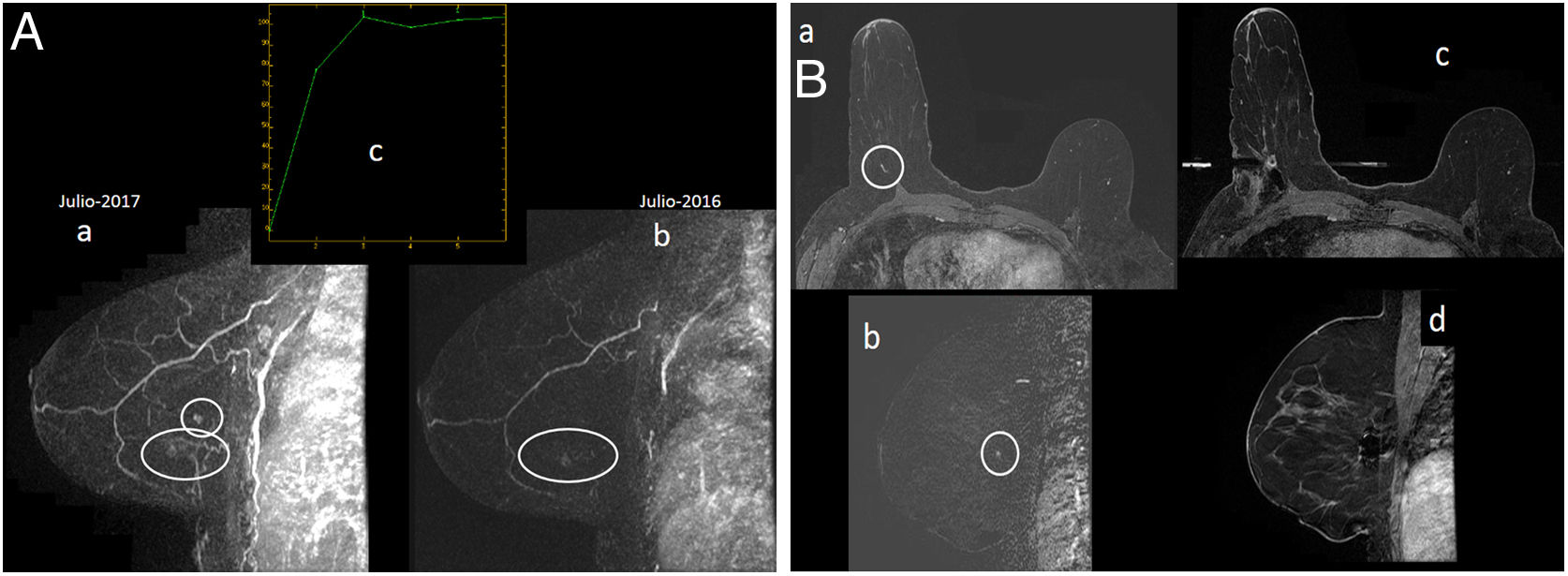
Paciente de 53 años. Seguimiento con resonancia magnética (RM) y mamografía por ser portadora de mutación BRCA1, con antecedente de cáncer de mama en mama izquierda (carcinoma ductal infiltrante en agosto de 2002, con mastectomía y reconstrucción con colgajo de piel y grasa abdominal). Ooforectomía bilateral profiláctica en 2010. En mamografía unilateral derecha “ACR B” (no mostrada), solo era apreciable el hamartoma de cuadrante inferoexterno de mama derecha, conocido y estable. A) RM con contraste intravenoso. Reconstrucción MIP (proyección de máxima intensidad) sagital precoz de mama derecha (imagen “a” en 2017 y “b” en 2016): foco de realce de nueva aparición en intercuadrantes externos de mama derecha en RM de julio de 2017 (círculo en “a”) adyacente a otro realce focal conocido en cuadrante inferoexterno correspondiente a hamartoma, estable respecto a RM previa de julio de 2016 (elipse en “a” y “b”). El foco tiene curva de captación tipo 2 (imagen “c”). Se considera al foco de intercuadrantes externos un hallazgo sospechoso por ser nuevo. B) RM con contraste intravenoso y biopsia asistida por vacío guiada por RM. No se demostró traducción ecográfica del foco de intercuadrantes externos de mama derecha, por lo que se procedió a biopsia guiada por RM. Se muestran axial 3D retardado con sustracción grasa (“a”) y sustracción sagital precoz de mama derecha (“b”), donde se aprecia el foco de realce nuevo en intercuadrantes externos de mama derecha (círculo). Se muestran también axial 3D con sustracción grasa (“c”) y sustracción sagital precoz de mama derecha (“d”), ambos posbiopsia, con vacío de señal relacionado con marcador metálico depositado posbiopsia. Resultado de la biopsia asistida por vacío guiada por RM: carcinoma ductal infiltrante grado III (1mm) + carcinoma ductal in situ de alto grado (grupo 3 de Van Nuys). Subtipo molecular: triple negativo. La biopsia de ganglio centinela fue negativa.
El gadolinio puede provocar reacciones adversas, está contraindicado en pacientes con función renal afectada, se acumula en el organismo y se ha demostrado que condiciona cambios de señal en los núcleos dentados (aunque no se sabe bien la repercusión clínica de este depósito)63,81. Además, aumenta el coste de la prueba.
- 7.
Sobrediagnóstico
Es bien sabido que la MX lleva a biopsias innecesarias y al sobrediagnóstico de lesiones indolentes y CDIS. El sobrediagnóstico en RM, en contraposición, no ha sido evaluado44,61. Pero en favor del sobrediagnóstico del cribado con RM comparado con el cribado con MX hay que destacar que los CI son detectados más por la RM, mientras que la mayoría de los CM detectados con MX son CDIS. La RM detecta casi todos los CI, y los CDIS relevantes biológicamente82, es decir, los CDIS de grado intermedio y alto, potencialmente invasivos, potencialmente metastásicos, cuya detección no representaría sobrediagnóstico. En cambio, los CM que no detecta la RM son pocos y casi siempre CDIS de bajo grado34, por lo cual es de esperar que no haya repercusión significativa en la mortalidad.
Además, los FP que incluyen “atipias” en cribado con RM son más numerosos (algún estudio indica que incluso el doble83) que los hallados en cribado con MX/tomosíntesis, lo cual tiene importancia pronóstica y repercusiones clínicas: ¡No todos los FP son iguales!83.
- 8.
Falsos negativos en el diagnóstico
Un considerable número de cánceres, aproximadamente un 42,5% de media si se analiza la bibliografía de la última década84–89, son visibles retrospectivamente en rondas previas (en RM anteriores). Los falsos negativos (FN) pueden producirse por no detección (cáncer no detectado por causa técnica), mala interpretación (se interpreta como benigno un hallazgo detectado, que en realidad es maligno), o mal manejo (generalmente una mala correlación entre RM y ecografía post-RM).
Es importante conocer las principales causas de FN y saber qué medidas es posible tomar para intentar evitar errores o retrasos en el diagnóstico de algunos cánceres. Las analizamos a continuación:
- 1.
Examen técnicamente inadecuado:
- •
Es necesaria y esencial una correcta calidad técnica para la detección de CI pequeños y CDIS.
- •
Hay que emplear cortes de 1-3mm de espesor y un tamaño de píxel submilimétrico88, evitar artefactos de movimiento87 y tener la seguridad de incluir siempre la lesión en el campo87 (precaución de incluir lesiones preaxilares en la antena).
- 2.
Pequeño tamaño de la lesión: los “focos”, realces seudonodulares ≤ 4mm, son hallazgos frecuentes, y habitualmente benignos.
- •
Deberíamos plantear la biopsia de un foco si aumenta, tiene características sospechosas o es de nueva aparición (hay controversia en este último supuesto)84,86,90 (fig. 2).
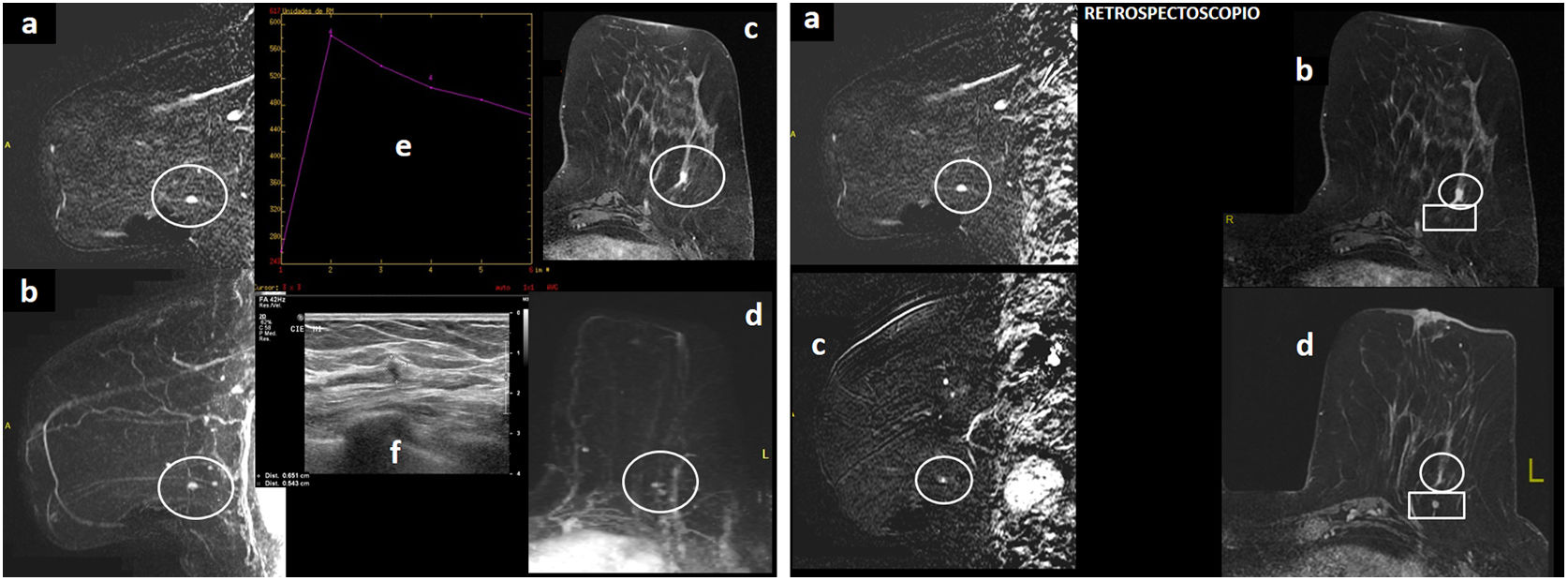
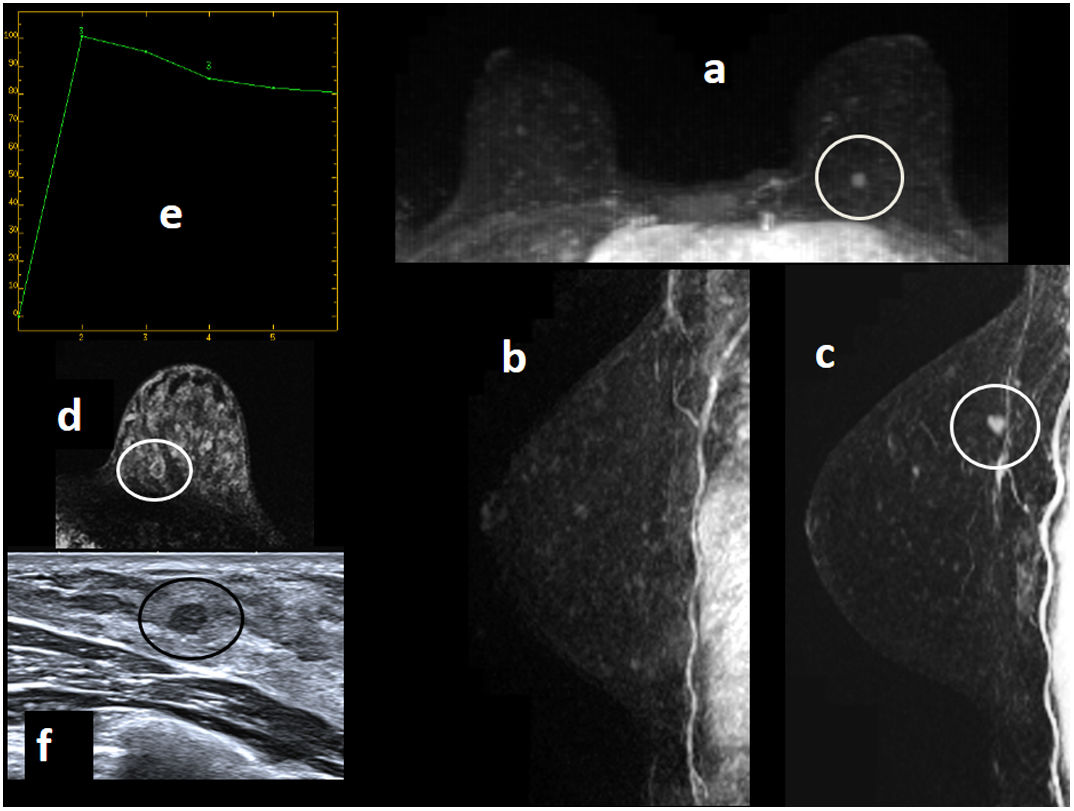
Figura 2.Paciente de 68 años portadora de mutación BRCA2, con antecedente de mastectomía derecha por cáncer de mama, seguimiento con resonancia magnética (RM) y mamografía. Mamografía unilateral izquierda “ACR A” (no mostrada), sin hallazgos evidentes. A) RM con contraste intravenoso. Sustracción sagital precoz de mama izquierda (“a”) y reconstrucción MIP (proyección de máxima intensidad) sagital de mama izquierda precoz (“b”), axial 3D retardado con saturación grasa (“c”) y reconstrucción MIP axial precoz (“d”): se aprecia foco/realce nodular de 5mm (círculo) en cuadrante inferoexterno de mama izquierda. Tiene curva de captación tipo 3 (“e”), y en ecografía post-RM (“f”) se observa como un nódulo hipoecoico sólido de márgenes irregulares de 5,5mm. Se trata de una lesión sospechosa por RM. B) RM con contraste intravenoso. Sustración sagital precoz y axial 3D retardado con saturación grasa del momento del diagnóstico (“a” y”b”), con foco sospechoso (círculo) e idénticas secuencias de RM de año anterior-ronda previa (“c” y “d”), donde a posteriori (con el “retrospectoscopio”) se apreciaba un foco puntiforme sutil de realce en esa localización (círculo) que pasó desapercibido por su ínfimo tamaño (falso negativo). El foco sospechoso se sitúa por delante de nódulo milimétrico circunscrito que se corresponde con ganglio intramamario (rectángulo), hallazgo benigno estable. El resultado de la biopsia con aguja gruesa realizada con guía ecográfica del foco sospechoso de cuadrante inferoexterno de mama izquierda fue: carcinoma lobulillar infiltrante. Subtipo molecular: luminal A. La biopsia de ganglio centinela mostró 1500 copias (micrometástasis).
(0.15MB). - •
Entre las características morfológicas sospechosas cabe destacar que los focos sean aislados, más intensos que los demás, con curvas tipo 3, si cambian la curva o la pendiente inicial de la curva, o simplemente con pendiente máxima inicial86,89.
- •
Algún autor aduce que, con los focos, las curvas son frecuentemente de poca ayuda, porque algunos CI pequeños (o CDIS) no tienen curvas tipo 3, y también valorar su morfología es difícil84,89.
- •
Hay cierta controversia en el manejo de los focos de nueva aparición. Algunos autores recomiendan seguimiento en 6-12 meses90 apoyándose en la baja frecuencia de lesiones malignas. Otros son partidarios de biopsiarlos84,91 teniendo en cuenta que algunos cánceres presentan lento crecimiento, que la estabilidad no descarta siempre malignidad y que puede ser difícil percibir crecimiento en lesiones pequeñas en intervalos de tiempo cortos. Algunos autores han descrito, por ejemplo, algún foco con curva de captación tipo 2 o 3 que aparece posteriormente como cáncer de intervalo, sobre todo en pacientes BRCA188.
- 3.
Estabilidad en tamaño:
- •
La estabilidad no excluye malignidad. Aunque en pacientes de AR los cánceres son más agresivos, su tasa de crecimiento es variable y pueden presentar periodos de estabilidad84. De ahí que muchos autores ante un foco de nueva aparición prefieren la biopsia frente al seguimiento (fig. 3).
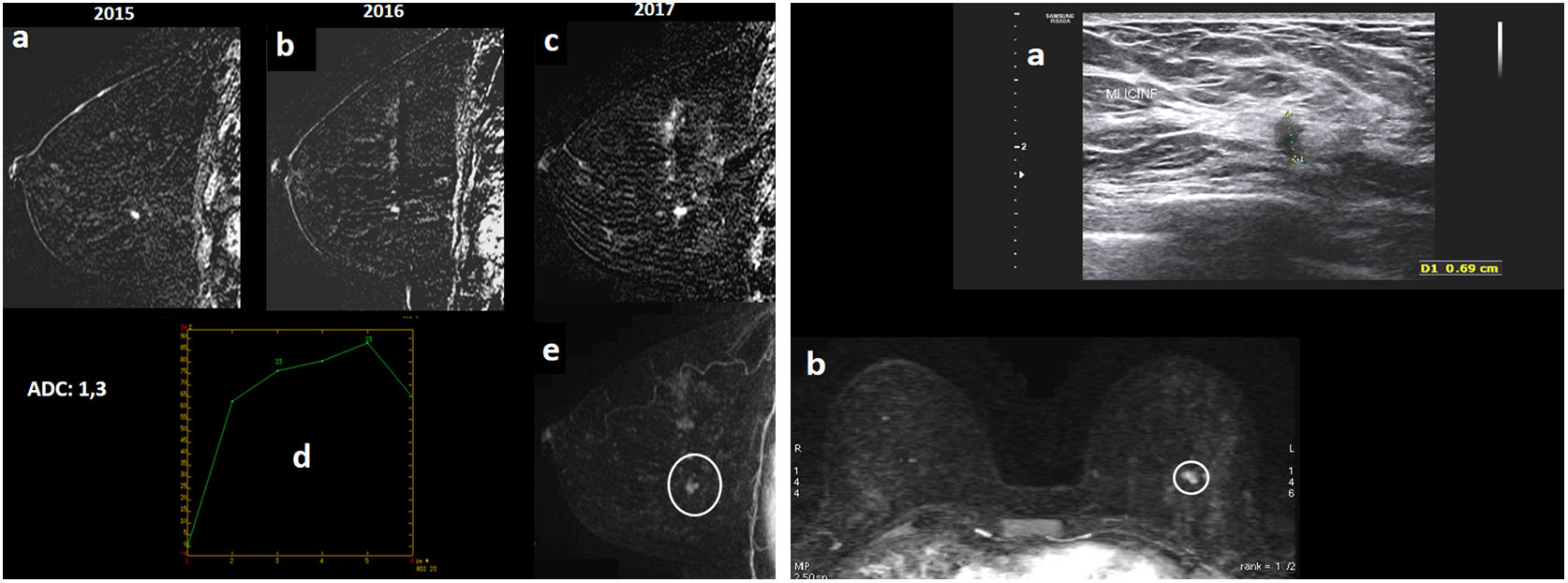
Figura 3.Paciente de 46 años, portadora de mutación BRCA1, que acude a cribado anual (seguimiento habitual con RM y mamografía anual por alto riesgo). Mamografía bilateral “ACR C” (no mostrada), sin hallazgos. A) RM con contraste intravenoso. Se muestran sustracciones sagitales precoces de mama izquierda de 2015, 2016 y 2017 (“a”, “b” y “c”). Estudio con artefactos por movimiento de la paciente, que disminuyen la calidad de las imágenes. Se aprecia que un foco de realce en cuadrante inferoexterno de mama izquierda, que permanecía estable en RM previa de 2016 respecto a 2015, crece en control de 2017 (realce nodular de unos 6-7mm). Reflejamos transcrito su valor ADC (coeficiente de difusión aparente) (ADC=1,3×10-3 mm2/s, mapa de difusión no mostrado); mostramos su curva de realce (“d”) que es progresiva con máxima pendiente en primer minuto y leve descenso/lavado final; y mostramos reconstrucción MIP sagital precoz de mama izquierda (“e”): con realce nodular descrito en cuadrante inferoexterno de mama izquierda (círculo). B) Se muestra imagen ecográfica post-RM (“a”): el realce nodular en ecografía se corresponde con nódulo sólido hipoecogénico de márgenes irregulares de 6,9mm; y reconstrucción MIP axial precoz (“b”), con realce nodular milimétrico descrito en cuadrante inferoexterno de mama izquierda (círculo): se considera hallazgo sospechoso de malignidad, y se realiza biopsia con aguja gruesa con guía ecográfica con resultado: carcinoma ductal infiltrante grado I. Subtipo molecular luminal A. La biopsia de ganglio centinela fue negativa.
(0.13MB). - •
Los realces tipo no masa que permanecen estables o con leve crecimiento pueden ser cánceres84. Si son CDIS, pueden tener microinfiltración en la cirugía. Por ello, con los realces tipo no masa hay que limitar los seguimientos a corto plazo a áreas de muy baja sospecha. Probablemente lo adecuado sería realizar un control en 3 meses y si no se resuelve en distintos ciclos menstruales, hacer biopsia. Los realces tipo no masa nuevos, persistentes y sospechosos deben ser biopsiados.
- 4.
Extenso realce parenquimatoso de fondo:
- •
El realce parenquimatoso de fondo parece asociarse a mayor riesgo92–94 y menor detección de CM94,95, pero hay controversia en la literatura científica con artículos a favor y en contra de ambas cosas. El realce parenquimatoso de fondo puede producir un efecto de enmascaramiento del cáncer. Varios trabajos sobre cribado con RM señalan el realce parenquimatoso de fondo como una de las causas de sus FN86–88.
- 5.
Márgenes circunscritos:
- •
La presencia de márgenes circunscritos no excluye malignidad. Los cánceres en pacientes de AR pueden ser circunscritos en aproximadamente un 17% de los casos y puede haber también septos sin realce, clásicamente descritos en los fibroadenomas87,96,97. Sin embargo, en un artículo reciente, Marino et al.98 indican que los fenotipos de los cánceres detectados en cribado en mujeres de AR usando la 5.ª edición del BIRADS (con MX, ecografía y RM) tienen en todas las modalidades alguna característica de malignidad (fig. 4).
Figura 4.Paciente de 38 años, con alto riesgo familiar, que acude a su primera ronda de cribado anual con RM y mamografía (catalogada como paciente de alto riesgo por antecedentes familiares en consulta de consejo genético). Mamografía: mama densa “ACR D” no mostrada, sin hallazgos. Resonancia magnética (RM) con contraste intravenoso: se muestran reconstrucción MIP (proyección de máxima intensidad) axial precoz (“a”), reconstrucción MIP sagital precoz de mama derecha (“b”) y de mama izquierda (“c”), axial 3D retardado con saturación grasa de mama izquierda (“d”): se aprecia un realce nodular circunscrito prepectoral en cuadrante superointerno de mama izquierda cerca de intercuadrantes superiores, de unos 6-7mm (círculo); curva de realce (“e”): tipo 3; ecografía post-RM (“f”): se corresponde con un nódulo sólido iso/levemente hipoecoico y circunscrito, de unos 6,7mm (círculo). Se considera un hallazgo sospechoso. Se realiza biopsia con aguja gruesa post-RM (guiada por ecografía) con resultado: carcinoma ductal infiltrante grado I + carcinoma ductal in situ. Subtipo molecular luminal B, HER 2+. La biopsia de ganglio centinela fue negativa.
(0.1MB).
- 6.
Correlación inadecuada RM-ecografía post-RM:
- •
La correlación es esencial para asegurar muestreo de la lesión de interés87,91. Es conveniente usar marcadores metálicos para comprobar que la lesión biopsiada por ecografía (post-RM) se corresponde con el realce de interés de la RM, ya sea con seguimiento en 6 meses, o preferiblemente en el momento ya que, si no hay correlación, no demoraríamos 6 meses el diagnóstico correcto de un posible cáncer99 (fig. 5). Se describe en la literatura científica que existe inadecuado muestreo hasta en un 8-12% de los casos91.
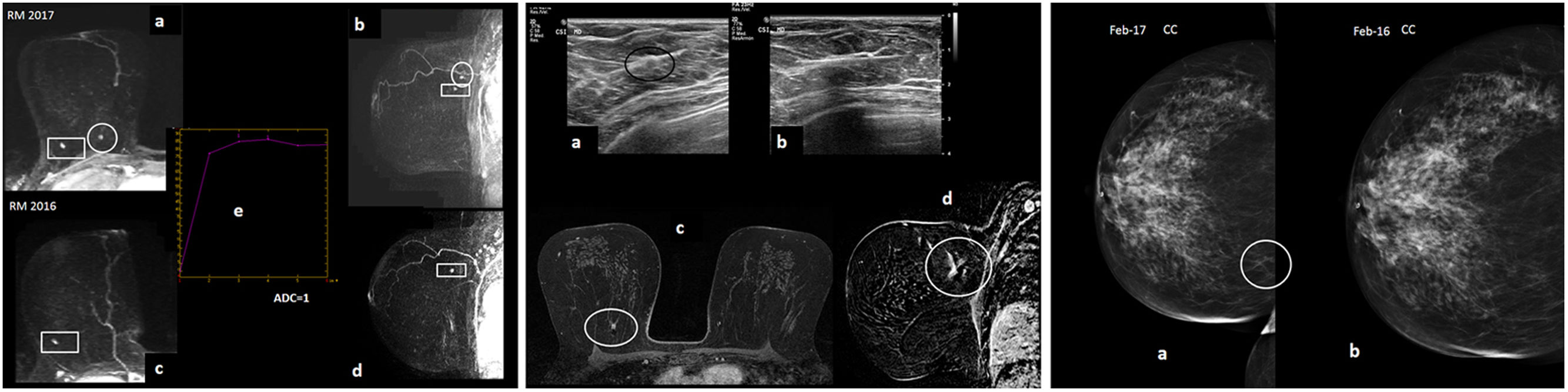
Figura 5.Paciente de 49 años portadora de mutación BRCA1, que acude a cribado anual (seguimiento habitual con resonancia magnética [RM] y mamografía anual por alto riesgo). A) RM con contraste intravenoso. Se muestran reconstrucción MIP (proyección de máxima intensidad) axial y sagital de mama derecha precoces de 2017 (“a” y “b”) y de 2016 (“c” y “d”). Se aprecia foco de realce en cuadrante superointerno de mama derecha de nueva aparición en RM de 2017 respecto a ronda anterior de 2016 (círculo), por lo que se considera sospechoso. Tiene curva tipo 2 de realce (“e”) y se transcribe su valor ADC (coeficiente de difusión aparente) (ADC=1×10-3 mm2/s, mapa ADC no mostrado). Hay otro realce nodular milimétrico en cuadrante superoexterno de mama derecha estable que se corresponde con ganglio intramamario, hallazgo benigno (rectángulo). B) Ecografía post-RM (“a”): el foco de realce nuevo de cuadrante superointerno de mama derecha se corresponde con un nódulo isoecoico aparentemente circunscrito (tan sutil, que en una mama tan grande pueden surgir dudas de si se corresponde con el realce de interés de la RM). Realizamos biopsia con aguja gruesa post-RM con guía ecogáfica (“b”) y depositamos marcador metálico, con control de RM posbiopsia (mostramos axial retardado 3D con saturación grasa: “c” y sustracción sagital: “d”) con el que confirmamos que el vacío de señal correspondiente al marcador depositado en el nódulo ecográfico biopsiado coincide exactamente con el realce de sospecha de la RM. Resultado de la biopsia: carcinoma ductal infiltrante de grado nuclear III con focos de necrosis. Subtipo molecular triple negativo. La biopsia del ganglio centinela fue negativa. C) Se muestra la proyección mamográfica craneocaudal de mama derecha (“a”, la del momento del diagnóstico en 2017 y “b”, la de un año antes, 2016): patrón “ACR B”, se aprecia una leve traducción mamográfica del cáncer como sutil asimetría focal de nueva aparición en cuadrantes internos en 2017 (círculo), que fue valorada a posteriori, ya que en esa etapa realizábamos todavía la RM y mamografía síncronas (y ya habíamos valorado la RM en el momento de realizar la mamografía, por lo que íbamos dirigidos).
(0.2MB). - •
Si la biopsia por ecografía no es representativa o si el marcador no coincide con la lesión sospechosa de RM: debería realizarse biopsia guiada por RM.
- •
Y si la biopsia por RM no es representativa o no se ha acertado en el muestreo: debería repetirse o realizarse escisión quirúrgica.
- 7.
Localización en zona posquirúrgica:
- •
Un realce sospechoso no debe asumirse como benigno por el mero hecho de encontrarse en la zona posquirúrgica; debe biopsiarse69.
- 8.
Ausencia de doble lectura o “computer aided diagnosis” (CAD):
- •
Tanto el empleo de doble lectura84,88 como el de sistemas de ayuda informáticos como el CAD85 aumentan la detección de CM.
Un trabajo de muy reciente publicación indica que la mayoría de los cánceres diagnosticados tras seguimiento en 6 meses de lesiones categorizadas como BI-RADS 3 en cribado con RM en población de AR se diagnostican en estadio precoz, y que el seguimiento a corto plazo (6 meses) es seguro, lo que permite evitar biopsias innecesarias100. Reflejan una tasa de malignidad de las lesiones BI-RADS 3 de un 6%, pero enfatizan el hecho de que el porcentaje de malignidad es mayor en las lesiones categorizadas como BI-RADS 3 en rondas posteriores (9%) respecto a las categorizadas en la primera ronda (2%), por lo que hemos de ser cautos en el empleo de BI-RADS 3 en rondas posteriores a la basal.
ConclusiónEl cribado con RM en mujeres que tienen AR de CM permite la detección de CI en estadios precoces. Este hecho es uno de los factores que permite a las pacientes de este subgrupo de población, que no han optado por la mastectomía profiláctica, tener más posibilidades de no morir a causa del CM. Los datos sobre repercusión en la mortalidad se basan aún en estudios con seguimientos iguales o inferiores a 10 años.
El sobrediagnóstico que genera comparado con el del cribado mamográfico tiene distinta repercusión clínica con importancia pronóstica.
Los mayores problemas son el alto coste (aunque se ha evidenciado el coste-efectividad en pacientes BRCA y de AR no portadoras) y sobre todo su aplicabilidad. Esto podría mejorar si en el futuro se validaran protocolos abreviados que están en estudio.
Todo ello hace pensar que la balanza entre pros y contras a la hora de realizar el cribado con RM se incline hacia el lado de los pros.
Autoría- 1.
Responsable de la integridad del estudio: SAR.
- 2.
Concepción del estudio: SAR.
- 3.
Diseño del estudio: SAR.
- 4.
Obtención de los datos: SAR, ABD, JAL, BCC y SSJ.
- 5.
Análisis e interpretación de los datos: SAR, ABD, JAL, BCC y SSJ.
- 6.
Tratamiento estadístico: SAR y JAL.
- 7.
Búsqueda bibliográfica: SAR.
- 8.
Redacción del trabajo: SAR.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SAR, ABD, JAL y BCC.
- 10.
Aprobación de la versión final: SAR, ABD, JAL, BCC y SSJ.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consentimiento informado y datos de los pacientesEste trabajo tiene la aprobación del comité ético de nuestro centro.
Disponemos de los consentimientos informados escritos de los pacientes cuyas imágenes de distintas pruebas de imagen se muestran en el presente trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos manifestar nuestro agradecimiento al resto de servicios de nuestro centro hospitalario que participan en el manejo de la patología mamaria (Ginecología, Oncología, Anatomía Patológica y Medicina Nuclear), por su implicación y su estrecha y continua colaboración con nosotros (porque el buen fruto profesional y científico tiene su base en el gran trabajo de todos y en la buena conexión y cohesión multidisciplinar, y en intentar siempre hacer las cosas lo mejor posible con los medios que tenemos, sin olvidar nunca el principal objetivo: el beneficio de las pacientes).
Como primera autora, gracias a mi familia, por su paciencia y por ese tiempo que mi dedicación científica les resta de mi dedicación a ellos.
Gracias también a Ann Marsden, por su amable colaboración en la traducción del resumen al inglés.













![Paciente de 49 años portadora de mutación BRCA1, que acude a cribado anual (seguimiento habitual con resonancia magnética [RM] y mamografía anual por alto riesgo). A) RM con contraste intravenoso. Se muestran reconstrucción MIP (proyección de máxima intensidad) axial y sagital de mama derecha precoces de 2017 (“a” y “b”) y de 2016 (“c” y “d”). Se aprecia foco de realce en cuadrante superointerno de mama derecha de nueva aparición en RM de 2017 respecto a ronda anterior de 2016 (círculo), por lo que se considera sospechoso. Tiene curva tipo 2 de realce (“e”) y se transcribe su valor ADC (coeficiente de difusión aparente) (ADC=1×10-3 mm2/s, mapa ADC no mostrado). Hay otro realce nodular milimétrico en cuadrante superoexterno de mama derecha estable que se corresponde con ganglio intramamario, hallazgo benigno (rectángulo). B) Ecografía post-RM (“a”): el foco de realce nuevo de cuadrante superointerno de mama derecha se corresponde con un nódulo isoecoico aparentemente circunscrito (tan sutil, que en una mama tan grande pueden surgir dudas de si se corresponde con el realce de interés de la RM). Realizamos biopsia con aguja gruesa post-RM con guía ecogáfica (“b”) y depositamos marcador metálico, con control de RM posbiopsia (mostramos axial retardado 3D con saturación grasa: “c” y sustracción sagital: “d”) con el que confirmamos que el vacío de señal correspondiente al marcador depositado en el nódulo ecográfico biopsiado coincide exactamente con el realce de sospecha de la RM. Resultado de la biopsia: carcinoma ductal infiltrante de grado nuclear III con focos de necrosis. Subtipo molecular triple negativo. La biopsia del ganglio centinela fue negativa. C) Se muestra la proyección mamográfica craneocaudal de mama derecha (“a”, la del momento del diagnóstico en 2017 y “b”, la de un año antes, 2016): patrón “ACR B”, se aprecia una leve traducción mamográfica del cáncer como sutil asimetría focal de nueva aparición en cuadrantes internos en 2017 (círculo), que fue valorada a posteriori, ya que en esa etapa realizábamos todavía la RM y mamografía síncronas (y ya habíamos valorado la RM en el momento de realizar la mamografía, por lo que íbamos dirigidos). Paciente de 49 años portadora de mutación BRCA1, que acude a cribado anual (seguimiento habitual con resonancia magnética [RM] y mamografía anual por alto riesgo). A) RM con contraste intravenoso. Se muestran reconstrucción MIP (proyección de máxima intensidad) axial y sagital de mama derecha precoces de 2017 (“a” y “b”) y de 2016 (“c” y “d”). Se aprecia foco de realce en cuadrante superointerno de mama derecha de nueva aparición en RM de 2017 respecto a ronda anterior de 2016 (círculo), por lo que se considera sospechoso. Tiene curva tipo 2 de realce (“e”) y se transcribe su valor ADC (coeficiente de difusión aparente) (ADC=1×10-3 mm2/s, mapa ADC no mostrado). Hay otro realce nodular milimétrico en cuadrante superoexterno de mama derecha estable que se corresponde con ganglio intramamario, hallazgo benigno (rectángulo). B) Ecografía post-RM (“a”): el foco de realce nuevo de cuadrante superointerno de mama derecha se corresponde con un nódulo isoecoico aparentemente circunscrito (tan sutil, que en una mama tan grande pueden surgir dudas de si se corresponde con el realce de interés de la RM). Realizamos biopsia con aguja gruesa post-RM con guía ecogáfica (“b”) y depositamos marcador metálico, con control de RM posbiopsia (mostramos axial retardado 3D con saturación grasa: “c” y sustracción sagital: “d”) con el que confirmamos que el vacío de señal correspondiente al marcador depositado en el nódulo ecográfico biopsiado coincide exactamente con el realce de sospecha de la RM. Resultado de la biopsia: carcinoma ductal infiltrante de grado nuclear III con focos de necrosis. Subtipo molecular triple negativo. La biopsia del ganglio centinela fue negativa. C) Se muestra la proyección mamográfica craneocaudal de mama derecha (“a”, la del momento del diagnóstico en 2017 y “b”, la de un año antes, 2016): patrón “ACR B”, se aprecia una leve traducción mamográfica del cáncer como sutil asimetría focal de nueva aparición en cuadrantes internos en 2017 (círculo), que fue valorada a posteriori, ya que en esa etapa realizábamos todavía la RM y mamografía síncronas (y ya habíamos valorado la RM en el momento de realizar la mamografía, por lo que íbamos dirigidos).](https://static.elsevier.es/multimedia/00338338/0000006200000004/v2_202009020809/S0033833820300308/v2_202009020809/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

