En mujeres con alto riesgo de padecer cáncer de mama, la detección precoz tiene un importante papel. Debido a la alta incidencia de cáncer de mama en ellas, y a edades más tempranas que en la población general, el cribado comienza antes, y existe amplia evidencia de que la resonancia magnética es la herramienta diagnóstica más sensible. Las principales guías americanas y europeas coinciden en la recomendación de realizar resonancia magnética anual (con suplemento mamográfico anual) como modalidad óptima de cribado.
Además de la ausencia de consenso actual sobre qué pacientes deben incluirse en la recomendación de cribado con resonancia magnética (ampliamente tratada en la introducción de la parte 1 de esta actualización (Radiología. DOI: 10.1016/j.rx.2020.01.007), existen otros aspectos no coincidentes en diferentes guías, o no concretados, o susceptibles de modificación según la evidencia de tantos años de experiencia, que hemos denominado «controversias», como son: la edad de comienzo del cribado, la posible conveniencia de emplear diferente estrategia en distintos subgrupos, la realización alterna vs. síncrona de la resonancia y la mamografía, la edad de finalización de las dos técnicas o la forma de realizar el seguimiento tras cirugía de reducción de riesgo. El objetivo de la segunda parte de nuestro trabajo es realizar, revisando la literatura científica, una actualización sobre esas principales «controversias» en el cribado con resonancia magnética en alto riesgo. Y finalmente, basándose en ello, proponer un posible modelo de protocolo de cribado óptimo y actualizado.
For women with a high risk of breast cancer, early detection plays an important role. Due to the high incidence of breast cancer, and at a younger age than in the general population, screening begins earlier, and there is considerable evidence that magnetic resonance is the most sensitive diagnostic tool, and the principal American and European guidelines agree on the recommendation to perform annual magnetic resonance (with supplemental annual mammography) as an optimal mode of screening.
In addition to the absence of current consensus on which patients should be included in the recommendation for magnetic resonance screening (widely discussed in the introduction of part 1 of this work), there are other aspects that are different between guidelines, that are not specified, or that are susceptible to change based on the evidence of several years of experience, that we have called «controversies», such as the age to begin screening, the possible advisability of using a different strategy in different subgroups, performing alternate versus synchronous magnetic resonance and mammography, the age at which to terminate the two techniques, or how to follow up after risk reduction surgery.The aim of the second part of the paper is, by reviewing the literature, to provide an update in relation to some of the main «controversies» in high risk screening with magnetic resonance. And finally, based on all this, to propose a possible model of optimal and updated screening protocol.
Tal y como se expuso en la primera parte de esta actualización «Cribado en pacientes con riesgo incrementado de cáncer de mama (parte 1). Pros y contras del cribado con resonancia magnética» (Radiología. DOI: 10.1016/j.rx.2020.01.007), y como se vio desde los primeros estudios principales prospectivos de cribado con resonancia magnética (RM) en alto riesgo (AR)1–9, reafirmado por estudios posteriores10–16, la sensibilidad de la RM (90%)9,16 dobla a la de la mamografía (MX) (25-59%17), con una especificidad de la RM también alta (del 78-97%14, media sobre 85-90%, que asciende tras la primera ronda y llega a alcanzar posteriormente el 90-95%13,15,16).
El empleo de RM permite una mayor tasa de detección de cáncer de mama (CM) respecto a cuando el cribado se hace solo con MX (del 16-30‰ con RM18 frente al 7,6-7,9‰ con MX19), y en un estadio menor: cánceres con menor tamaño (tamaño medio: 7-18 mm; 50% cánceres in situ (CDIS) o T<1 cm9) y con menor afectación ganglionar axilar asociada (11-29%9,11,12, una media del 15-16%, frente al 30-45% con cribado solo con MX). Además, hay menor tasa de cánceres de intervalo (media sobre un 5,4%, menor del 10%9, frente a prácticamente una media del 50% con cribado solo con MX). La RM ha proporcionado, por tanto, un cribado más eficaz en estas pacientes que ha justificado su empleo generalizado. Añadir ecografía coincidiendo con la RM y MX anuales no aumenta significativamente la tasa de detección5,6,12,13, aunque la ecografía tiene un papel crítico en la investigación de lesiones detectadas por RM.
En nuestra experiencia, hemos obtenido unos resultados que se adaptan fielmente a los descritos en la literatura científica. Actualmente, nuestra detección de CM es del 19,7‰ con RM. Hemos detectado 13 cánceres: 11 cánceres invasivos (CI) y 2 CDIS (84,62% CI y 15,38% CDIS). El 84,6% de los CM fueron «CM mínimos» (PT1 a/b o CDIS); hubo un CI PT1c y un CI T2 (el T2 fue un cáncer de intervalo en una paciente BRCA1 que hizo respuesta completa radiológica y patológica a la neoadyuvancia). Solo tuvimos 1 de 13 casos (7,69%) con macrometástasis ganglionares y 1 de 13 casos (7,69%) de cánceres de intervalo.
En pacientes con AR de CM, riesgo absoluto a lo largo de la vida igual o superior al 20-25%, ha habido en los últimos años acuerdo generalizado entre las principales sociedades radiológicas europeas y americanas (European Society of Breast Cancer Specialists [EUSOMA], European Society of Breast Imaging [EUSOBI], Society of Breast Imaging [SBI], American College of Radiology [ACR], American Cancer Society [ACS]) en la recomendación de cribado anual con RM añadida a mamografía20, cuyas guías coincidían en las pacientes incluidas21–28: pacientes portadoras de mutación genética asociada a alto riesgo de padecer CM o sus parientes de primer grado, pacientes con riesgo por historia familiar igual o superior al 20-25%, y pacientes que hubieran sufrido exposición a radiación torácica (en manto) a una edad inferior a 30 años.
En 2018, la ACR en su actualización17 incluyó en la recomendación de cribado con RM a algunos subgrupos de mujeres hasta ese momento integradas en el grupo de”riesgo intermedio”, concretamente a «mujeres con historia personal de CM y mama densa» y a”mujeres con historia personal de CM, si el CM fue con menos de 50 años”. Indica también que se debería considerar la RM adicional en el resto de las mujeres con historia personal de CM o con antecedente personal de biopsia previa con resultado de hiperplasia ductal atípica (HDA) o neoplasia lobular (carcinoma lobulillar in situ [CLIS] o hiperplasia lobulillar atípica [HLA]), especialmente si hay otros factores de riesgo.
Alguna otra guía americana (National Comprehensive Cancer Network [NCCN])29 recomienda considerar cribado con RM ante el diagnóstico de CLIS, HLA o HDA, con base en la evidencia emergente si el riesgo es del 20% o superior.
La ACS, en su última actualización de 201930, refiere que se están revisando las recomendaciones en otros subgrupos de pacientes hasta ahora no incluidos en la recomendación de cribado con RM por falta de evidencia desde lo establecido en 200721: historia personal de CM, diagnóstico previo de lesión histológica de alto riesgo, mamas significativamente densas, uso de tratamiento hormonal sustitutivo, raza negra.
Mostramos en la tabla 1 los genes cuyas mutaciones se consideran asociadas a alto riesgo de CM, y hemos añadido alguno nuevo a los originalmente incluidos17,29,31.
Genes asociados a alto riesgo de cáncer de mama (portadoras de mutaciones en estos genes, incluidas en protocolo de cribado de alto riesgo)36
| • BRCA1 |
| • BRCA2 |
| • TP53 (Li Fraumeni) |
| • PTEN (Cowden, Bannayan-Riley-Ruvalcaba) |
| • PALB2a |
Las portadoras de mutación en PALB2 se considera que tienen la misma probabilidad de cáncer de mama que las portadoras de mutación en BRCA2 (por lo que también se incluyen en la recomendación de cribado con RM actualmente). (Hay otros genes asociados a menor riesgo que los citados, aunque también elevado, mencionados en algunas guías, e incluidos en la recomendación de cribado con RM: SKT11, CDH1, CHEK 2, ATM, NBN, NF1…)17,29,31.
Además de la ausencia de consenso actual entre las principales sociedades sobre qué pacientes deben incluirse en la recomendación de cribado con RM, especialmente desde la actualización de la ACR en 201817 (tema ampliamente tratado en la introducción de la parte 1 de esta actualización), existen otros aspectos no coincidentes en diferentes guías, o no siempre especificados, o susceptibles de modificación con base en la evidencia de tantos años de experiencia, que hemos denominado «controversias», como son: la edad de comienzo del cribado, la posible conveniencia de emplear diferente estrategia en distintos subgrupos, la realización alterna vs. síncrona de la RM y la MX, la edad de finalización de las dos técnicas o la forma de realizar el seguimiento tras cirugía de reducción de riesgo. El objetivo de la segunda parte de nuestro trabajo es realizar, revisando la literatura especializada, una actualización sobre esas principales «controversias» en el cribado con RM en AR. Y finalmente, en función de esa revisión, proponer un posible modelo de protocolo de cribado óptimo y actualizado.
Controversias1- Edad de comienzo del cribado (¿25 o 30 años?)Hay discordancia entre guías con respecto a la edad de comienzo del cribado (25-30 años), con cierta variabilidad también en función de si existen o no mutaciones genéticas (tabla 2).
Tabla resumen con las recomendaciones de cribado en alto riesgo de las principales sociedades americanas y europeas (y añadimos alguna otra representativa específica de algún país como España, Reino Unido y Canadá)
| RManual | MAMOGRAFÍA(MX) anual | (*) | |
|---|---|---|---|
| ACR17(American College of Radiology)(Estados Unidos) | Desde 25 a 30aBRCA: 25aTras radioterapia torácica con <30a: A los 8a después de acabarla o los 25a (lo que sea más tarde)…hasta 75a (o más si buen estado de salud, lo apropiado basado en expectativa de vida) | Desde 30a(Retrasar en BRCA1 a 40a, si cribado con RM anual desde 25a)……hasta 75a (o más si buen estado de salud, lo apropiado basado en expectativa de vida) | -Mujeres con historia personal de CM y mama densa-Mujeres con historia personal de CM, si CM fue con <50aIndican también que se debería considerar la RM adicional en el resto de mujeres con historia personal de CM o con antecedente personal de biopsia previa con resultado de HDA o neoplasia lobular (CLIS o HLA), especialmente si hay otros factores de riesgo |
| ACS21,22,30(American Cancer Society)(Estados Unidos) | Desde 30a(BRCA: puede empezarse entre 25 y 35a21)…hasta 75a (o más si buen estado de salud, lo apropiado basado en expectativa de vida) | Desde 30a…hasta 75a (o más si buen estado de salud, lo apropiado basado en expectativa de vida) | |
| NCCN29National ComprehensiveCancer Network(Estados Unidos) | BRCA: Desde 25a (25-29a sola y considerarla de 30-75a añadida a la MX)Li-Fraumeni: Desde 20a (20-29a sola y de 30-75a añadida a la MX)PTEN (Cowden): desde 30-35a o 5 años antes de edad del pariente más joven…hasta 75aTras radioterapia torácica recibida entre 10-30a: Desde 10a después de acabarla (no antes de los 25a)Historia familiar: Desde 10a antes del CM más joven (no antes de 25a) | BRCA: Desde 30a… hasta 75aLi-Fraumeni: Desde 30a… hasta 75aPTEN (Cowden): desde 30-35a o 5 años antes de edad del pariente más joven…hasta 75aTras radioterapia torácica recibida entre 10-30a: Desde 10a después de acabarla (no antes de los 30a)Historia familiar: Desde 10a antes del CM más joven (no antes de 30a) | Considerar RM si antecedente personal de CLIS, HLA o HDA (si riesgo >20%):RM anual desde el diagnóstico (no antes de los 25a)+MX anual desde el diagnóstico (no antes de los 30a) |
| EUSOMA23European Society ofBreast Cancer Specialists | Desde 30aBRCA: Desde 25 a 29aTP53: Desde 20aTras radioterapia en manto <30a: A los 8a después de acabarla | Desde 35aLi Fraumeni: no MX | |
| EUSOBI24European Society ofBreast Imaging | Desde 30a(o 5a antes del CM más joven) | Desde 5a antes del CM más joven | |
| ESMO31European SocietyforMedical Oncology | BRCA: Desde 25a…… hasta 75aLi-Fraumeni: Desde 20a… hasta 75aPTEN (Cowden): Desde 30a… hasta 75aHistoria familiar: Desde 10a antes del CM más joven | BRCA: Desde 30a… hasta 75aLi-Fraumeni: no MXPTEN (Cowden): Desde 30a… hasta 75aHistoria familiar: Desde 10a antes del CM más joven | |
| SEOM36Sociedad Española de Oncología Médica | BRCA: Desde 25a…hasta 70aTP53: Desde 20aPTEN (Cowden):Desde 30aHistoria familiar: Desde 25a | BRCA: Desde 30-35a...hasta 75aTP53: Desde 30aPTEN (Cowden): Desde 30aHistoria familiar: Desde 40a o 10a antes del CM más joven | |
| NICE37The National InstituteFor Health and Care Excellence(Reino Unido) | Desde 30a ….hasta 50a (la mantienen hasta 70a si mama densa)BRCA, TP53 o riesgo por historia familiar>30%: | Desde 40a (de 30 a 40a también se indica considerar MX) …En BRCA anual hasta 70a …En riesgo por historia familiar>30%: anual hasta 60a, y luego a cribado mamográfico poblacionalLi Fraumeni: no MX | |
| NHS39Breast Screening Programme (NHSBSP) guidance and recommendations(Reino Unido) | BRCA o equivalente alto riesgo sin test: Desde 30aTP53: Desde 20aTras radioterapia supradiafragmática antes de 30a: Desde 30a | BRCA o equivalente alto riesgo sin test: Desde 40a(a partir de 50a, MX +/-RM)TP53: Desde 40a(a partir de 50a, MX +/-RM)Tras radioterapia supradiafragmática antes de 30a: Desde 40a(a partir de 50a, MX +/-RM) | |
| CCO38Cancer Care Ontario(Canadá) | Desde 30a…hasta 70aBRCA, riesgo por historia familiar > 25%, tras radioterapia torácica <30 a: a los 8a después de acabarla | Desde 30 años…hasta 70a | Incluyen también RM si antecedente personal de CLIS, HLA o HDA |
Indicamos edades de inicio de cribado con RM y de introducción de mamografía (y edades de finalización “en las que lo especifican”), que muestran la variabilidad en las recomendaciones de las diferentes guías.
Todas las sociedades principales americanas y europeas incluyen en la recomendación de cribado con RM y mamografía anual a pacientes portadoras de mutación genética asociada a alto riesgo de padecer CM o sus parientes de 1° grado, a mujeres con riesgo por historia familiar ≥20-25%, y a pacientes que hayan sufrido exposición a radiación torácica (en manto) a edad <30 años. Pero alguna guía incluye actualmente además a otros subgrupos de pacientes en la recomendación (*).
La guía NICE- The National Institute For Health and Care Excellence, en el subgrupo de mujeres con riesgo por historia familiar especifica que con riesgo ≥30%.
(Abreviaturas utilizadas: “CM”= cáncer de mama; “a”= años; “HDA”= hiperplasia ductal atípica; “CLIS”= carcinoma lobulillar in situ; “HLA”= hiperplasia lobulillar atípica).
Se estima que la ganancia en expectativa de vida es poca empezando a los 25 en vez de a los 30 años32.
Un trabajo de Tilanus-Linthorst et al.33 muestra que la edad del diagnóstico del CM es parcialmente dependiente de la historia familiar, y recomienda tener en cuenta la edad del cáncer más joven en la familia para determinar la edad de comienzo.
Dos trabajos que comparan coste-efectividad de distintas estrategias de cribado en pacientes BRCA1/232,34 y que curiosamente recomiendan distintas edades de comienzo (2532 y 30 años34) indican también que puede modificarse la edad de comienzo (25 o 30 años) en función de la edad del cáncer más joven en la familia.
Básandose en esta bibliografía32–34 y valorando el compendio de las principales guías, una pauta de actuación óptima podría ser:
- •
En el subgrupo BRCA (donde un pequeño número de pacientes tienen CM antes de los 30 años): comenzar con 25 años17,23,31,35,36. Se podría contemplar comenzar con 30 años si el pariente más joven con CM tenía 40 años o más31.
- •
En alto riesgo familiar: comenzar con 30 años17,21–23,30,35,37,38. Se podría contemplar comenzar con 25 si el pariente más joven con CM tenía 35 años o menos34.
Excepciones:
- •
Li-Fraumeni-portadoras de mutación TP53: comenzar con 20 años23,29,31,37,39, recomendándose en alguna guía no incluir MX, por su alta susceptibilidad a la radiación23,37.
- •
Antecedente de radioterapia torácica previa a una edad inferior a 30 años: comenzar con 25 años, u 8 años después de acabar la radioterapia, lo que sea más tarde de las dos cosas17,23,27.
La cohorte de pacientes a las que se realiza cribado por AR (BRCA1/2, síndromes raros, antecedente de radioterapia torácica, AR familiar, etc.) es muy heterogénea.
Ya en 2010, Rijnsburger et al.40 indicaron que posiblemente hubiera que establecer diferentes estrategias en distintos subgrupos de AR por diferentes cánceres e historia natural. Los CM en pacientes portadoras de mutaciones en BRCA1 son distintos de los asociados a mutaciones en BRCA2 y de los esporádicos (tabla 3).
Características de los cánceres de mama en subgrupos de portadoras de mutación en genes BRCA1 y BRCA2
| Características de los cánceres de mama en portadoras de mutación enBRCA1 | Características de los cánceres de mama en portadoras de mutación enBRCA2 |
|---|---|
| - Frecuentemente muestran receptores hormonales y “HER2” negativos (triple negativo), tienen alto grado histológico y nuclear, y mayor tendencia diferenciación medular (mayor proporción con morfología benigna, circunscritos). - Más agresivos, con más rápido crecimiento. - Bajo porcentaje de cánceres in situ (ausencia de microcalcificaciones en mamografía).- Más cánceres invasivos con pronóstico más desfavorable.- Más cánceres de intervalo.- Mayor proporción en localización prepectoral, en cuadrante superoexterno.La sensibilidad de la mamografía es más baja en BRCA1. | - Frecuentemente muestran receptores hormonales positivos y más bajo grado histológico y nuclear.- Es más frecuente su presentación como cánceres in situ puro o cánceres in situ asociado a infiltrante.- No tienen preferencia por localización prepectoral/cuadrante superoexterno. La sensibilidad de la mamografía es más alta en BRCA2. |
En BRCA1:
- •
Frecuentemente muestran receptores hormonales y «HER2» negativos (triple negativo), tienen alto grado histológico y nuclear, y mayor tendencia a la diferenciación medular (por eso hay mayor proporción de CM con morfología benigna).
- •
Son más agresivos, con más rápido crecimiento.
- •
Hay bajo porcentaje de CDIS (ausencia de microcalcificaciones en MX).
- •
Hay más CI con pronóstico más desfavorable.
- •
Hay más cánceres de intervalo.
- •
Hay mayor proporción en localización prepectoral, en cuadrante superoexterno.
- •
La sensibilidad de la MX es más baja en BRCA1.
En BRCA2:
- •
Frecuentemente muestran receptores hormonales positivos y más bajo grado histológico y nuclear.
- •
Es más frecuente su presentación como CDIS puro o CDIS asociado a CI.
- •
No tienen preferencia por localización prepectoral/cuadrante superoexterno.
- •
La sensibilidad de la MX es más alta en BRCA2.
En pacientes con antecedente de linfoma y radioterapia torácica:
- •
Los CM en pacientes con antecedente de linfoma de Hodgkin tratados con radioterapia en manto presentan características similares a aquellos asociados a mutaciones en BRCA241 (menor tamaño y grado histológico, mayor proporción de receptores hormonales positivos y mayor proporción de CDIS). Algunos autores (Ng et al.41, Mariscotti et al.42, Sung et al.43) coinciden en que la sensibilidad de la RM es menor que en otros subgrupos de pacientes con AR, aunque esto no se cumple en otros trabajos (Tieu et al.44, Freitas et al.45). Detectar precozmente CM en este subgrupo puede evitarles radioterapia de pared torácica posmastectomía o quimioterapia cardiotóxica.
En el subgrupo BRCA1, el cribado anual con RM y MX es menos efectivo: se encuentran CM de mayor tamaño, con mayor afectación de ganglios linfáticos axilares positivos y mayor proporción de cánceres de intervalo15,46–48. Y la sensibilidad global del cribado con RM y MX es más baja (algunos trabajos hablan de un 81,3%15 o hasta de un 60%48) (fig. 1). En este subgrupo parece evidente que hay que acortar el intervalo. En el resto de los subgrupos (BRCA2, antecedente de radioterapia torácica, AR familiar) la estrategia de cribado con RM y MX anual es beneficiosa, con la mayoría de los tumores detectados T1a/b o CDIS, con sensibilidad del cribado con RM y MX ≥ 90%15,47,49,50.
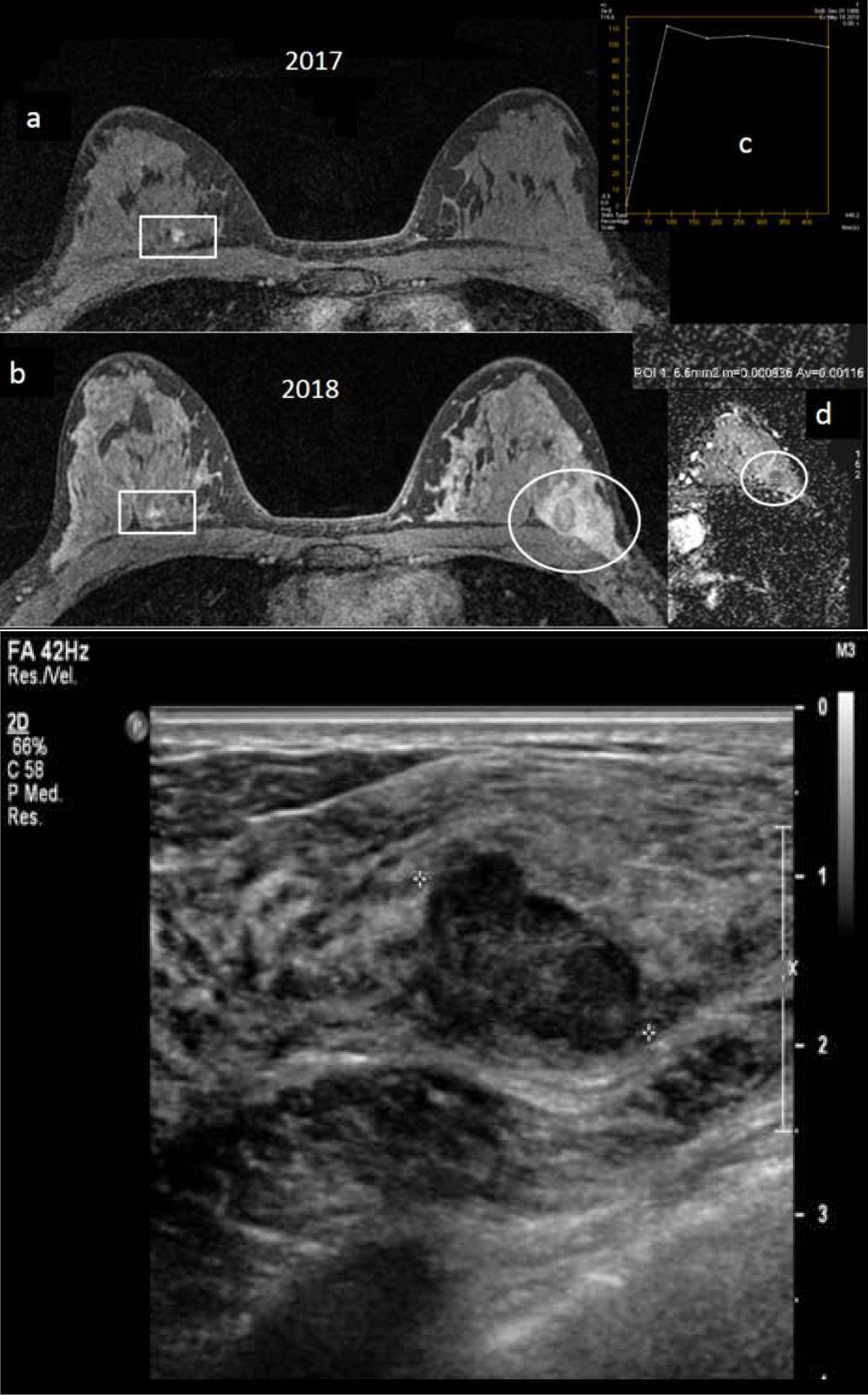
Paciente BRCA1 de 32 años, en quien al año de la última resonancia magnética (RM) de cribado y antes del siguiente control de RM anual se palpa un nódulo nuevo en mama izquierda. A) RM mamaria con contraste intravenoso: secuencia axial 3D retardada con saturación grasa de 2017 (a) y de 2018/momento del diagnóstico (b), donde se aprecia en la RM de 2018 un nódulo nuevo en cuadrante superoexterno de mama izquierda, ovalado, lobulado, que ha lavado el contaste en relación con el tejido circundante en esa secuencia axial 3D retardada (círculo). En la mama contralateral (rectángulo) se aprecia un nódulo prepectoral circunscrito con realce interno homogéneo, ya conocido, con biopsia previa con resultado de fibroadenoma, estable. Curva de captación del nódulo de mama izquierda, tipo 3 (c) y mapa de difusión axial con valor ADC (coeficiente difusión aparente)=1,1×10-3 mm2/s del nódulo (d). El nódulo de la mama izquierda no era visible en la RM de 2017. B) Ecografía mamaria: nódulo sólido hipoecoico ovalado, lobulado, de márgenes no totalmente circunscritos de casi 3cm, subyacente a nódulo palpable de mama izquierda. Se realizó biopsia con aguja gruesa guiada por ecografía con resultado de «carcinoma ductal infiltrante grado III». Subtipo molecular triple negativo. Es el único caso de cáncer de intervalo que hemos tenido en nuestro centro hasta la fecha actual en paciente BRCA1.
En el binomio RM y MX, la técnica con mayor sensibilidad es la RM9,12,13,15,16, sea cual sea la edad, grupo de riesgo y densidad mamográfica13 (fig. 2). La MX añade poco a la RM, no aumenta mucho la sensibilidad12,13,16. Los cánceres detectados solo por MX son un muy bajo porcentaje y además son en su mayor parte CDIS (y de bajo grado)11,12. Varios estudios describen que sobre un 30% de los cánceres12,16,49 son detectados solamente por RM (algún estudio ha reflejado hasta un 45%50 o 50%11). La MX utiliza radiaciones ionizantes y tiene menor sensibilidad. Además, en jóvenes, los CDIS que calcifican son raros. Por todo ello, EUSOMA23 ha mantenido la recomendación de no introducir la MX hasta los 35 años y nunca antes de los 30, mientras que las principales guías americanas siguen recomendando la introducción de la MX a los 30 años17,21,30.
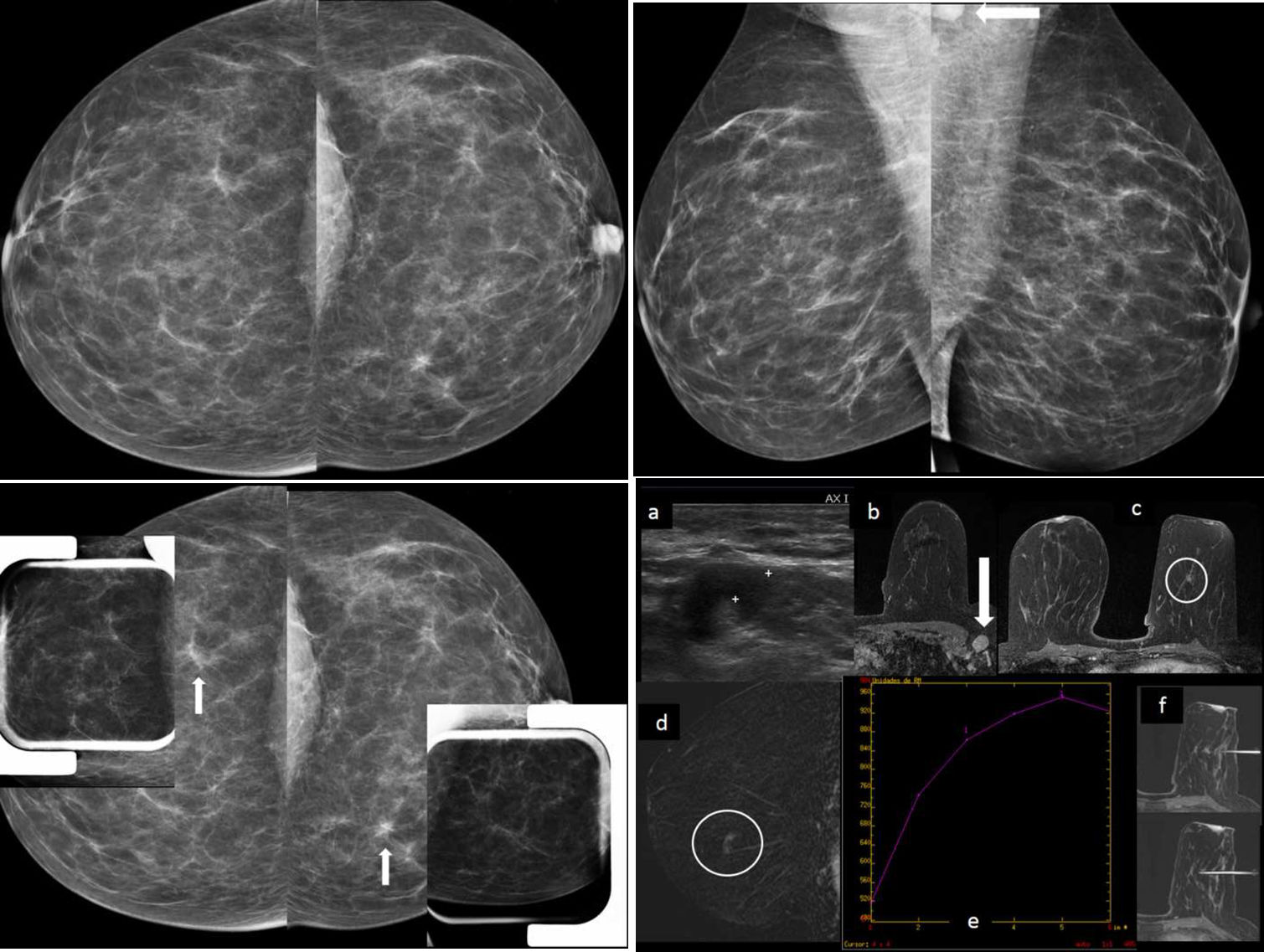
Caso de cáncer detectado en estudio de cribado en una paciente de 47 años BRCA2. Ganglio patológico axilar detectado en resonancia magnética (RM) y en ecografía post-RM con punción aspirativa con aguja fina (PAAF) positiva para células malignas con hallazgos de carcinoma metastásico y cáncer milimétrico (8mm) en mama ipsilateral, solo visible por RM como un realce focal seudonodular no circunscrito, milimétrico, en intercuadrantes inferiores, que se biopsió con guía de RM, con resultado de «cáncer ductal infiltrante grado II + carcinoma ductal in situ de moderado grado». No hay traducción mamográfica del cáncer de región intermedia de intercuadrantes inferiores de mama izquierda (de 8mm) detectado en RM, a pesar de la densidad predominatemente grasa. Se daba la circunstancia de que esta paciente (único caso en nuestro centro con macrometástasis axilares) tenía sus anteriores RM mamarias 3 y 2 años antes poco valorables por múltiples realces por lactancia y no hay estudio de RM en año anterior al diagnóstico. A) Mamografía bilateral, proyecciones craneocaudales: mamas «ACR A», sin lesiones evidentes (normal). B) Mamografía bilateral, proyecciones oblicuas mediolaterales. Mamas «ACR A», sin lesiones evidentes (normal). Se observa parcialmente adenopatía axilar en la proyección oblicua mediolateral izquierda (flecha). C) Compresiones focales mamográficas sobre asimetrías de cuadrantes externos de mama derecha y cuadrantes internos de mama izquierda de las proyecciones craneocaudales basales (flechas), que no persisten, por lo que se deduce que son zonas de superposición de tejido. D) Ecografía axilar izquierda (a): adenopatía axilar izquierda patológica, con cortical difusamente engrosada con PAAF: «positiva para células malignas con hallazgos de carcinoma metastásico». La ecografía mamaria no demostró hallazgos evidentes. RM mamaria con contraste intravenoso: en axial 3D retardado con saturación grasa (b) se observa adenopatía axilar patológica (flecha), y en axial 3D retardado con saturación grasa (c) se observa realce focal seudonodular no circunscrito de 8mm en intercuadrantes inferiores de MI (círculo); sustracción sagital precoz (d): realce focal seudonodular no circunscrito de 8mm en intercuadrantes inferiores de mama izquierda (círculo); curva de captación (e): tipo 1. Fue el único realce intramamario evidente, que se consideró sospechoso de malignidad; y biopsia asistida por vacío (BAV) guiada por RM, axial 3D con saturación grasa (e): el realce focal seudonodular no circunscrito de 8mm en intercuadrantes inferiores de mama izquierda sin traducción ecográfica se biopsió con guía de RM, con resultado de «carcinoma ductal infiltrante grado II + carcinoma ductal in situ de moderado grado». Subtipo molecular luminal B.
Dada la baja sensibilidad de la MX para detectar cánceres en pacientes con mutación en BRCA (especialmente BRCA1) y el riesgo potencial en ellas de carcinogénesis por radiación, se ha planteado la posibilidad de eliminar la MX, especialmente en el cribado de mujeres menores de 40 años. Se ha propuesto retrasar a los 40 años51 o incluso omitir la MX en las portadoras de mutación en BRCA152. El trabajo de Objeijn et al.53 concluyó que omitirla por debajo de esa edad era incluso coste-efectivo.
Hay trabajos que recomiendan quitar la MX en mujeres jóvenes (<40 años), incluso en todos los subgrupos48,54, y muchos trabajos que ponen en duda el papel de la MX en el cribado en AR en general15,16,49,50,55,56, apoyándose en el escaso valor adicional de la MX en el diagnóstico, en línea con otros trabajos previos11–13. El hecho de que todavía permanezca la recomendación en las guías de añadir MX al cribado con RM en AR se debe fundamentalmente a los datos aportados por dos importantes trabajos: un metaanálisis de Phi et al.57, basado en resultados de 6 estudios multicéntricos, y un trabajo de Heijnsdijk et al.47 que combina también resultados de 3 estudios. Ambos sugieren que la MX puede ser de valor, especialmente en BRCA2.
En el momento actual, hay guías que recomiendan en pacientes de AR retrasar a los 40 años la introducción de la MX en BRCA1. La ACR17 en la actualización de 2018 ya acepta que eso «puede considerarse», pero refiere que hace falta más evidencia para ver el papel de la MX en BRCA1, y que es más beneficiosa para BRCA2; y siguen introduciendo la MX con 30 años al resto de subgrupos, como el resto de las guías americanas. En realidad, prácticamente toda la bibliografía mencionada apoya el escaso valor de la MX en pacientes BRCA1 menores de 40 años, lo que se puede considerar ya una clara evidencia. En algunas guías en países europeos (como Reino Unido39 o Alemania; tabla 435) ya consideran retrasar la introducción de la MX a los 40 años en AR. Por tanto, dentro de la variabilidad existente en las guías y de actuación en distintos centros respecto al momento de introducción de la MX en el cribado en AR, se aprecia la tendencia progresiva a retrasarla. Está aún por ver qué papel tendrá la MX en el cribado de pacientes de AR en un futuro. Incluso sería posible, dada la progresión, que la MX llegara a omitirse salvo en aquellas pacientes en las que no pudiera realizarse RM por alguna contraindicación.
Programa de seguimiento de alto riesgo con resonancia magnética. German Consortium of Hereditary Breast and Ovarian Cancer (GC-HBOC), Alemania35
| Establecido | 2005, recomendaciones actualizadas en 2013 |
| Centros de cribado | Actualmente 15 centros universitarios especializados en Alemania, que también proporcionan consejo genético y test para mujeres de alto riesgo |
| Fondos | Financiado a través de contratos especiales de asistencia sanitaria integrada entre pagadores y centros participantes |
| Criterios de ingreso | Portadores de una mutación conocida en un gen de susceptibilidad al cáncer de mama o con alto riesgo basado en la historia familiar |
| Rango de edad cubierto (años) | |
| • Portadores de mutación BRCA1/2 | 25-70 años |
| • Portadores de otros genes de riesgo moderado | 30-70 años |
| • Mujeres de alto riesgo sin mutación conocida | 30-50 años |
| RM | Anualmente |
| Ecografía | |
| → Portadores de mutación BRCA1/2 | Cada 6 meses |
| → Todos los demás | Anualmente |
| Mamografía | Decisión individualizada, por ejemplo, cada 1-2 años a partir de los 40 |
Adaptación al español basada en el programa de seguimiento de alto riesgo con RM, de GC-HBOC (German Consortium of Hereditary Breast and Ovarian Cancer), Alemania35. Esta guía introduce la ecografía en el protocolo con el argumento de que la ecografía realizada después de la RM y el examen clínico puede aumentar la especificidad de la RM, y puede disminuir rellamadas y ansiedad de pacientes, siendo generalmente bien aceptado por las pacientes como parte de los programas de cribado. Se ofrece la ecografía a pacientes con mutación genética con intervalos de 6 meses y en esos casos la ecografía del momento del examen anual sirve como importante comparación para el examen de ecografía semianual única.
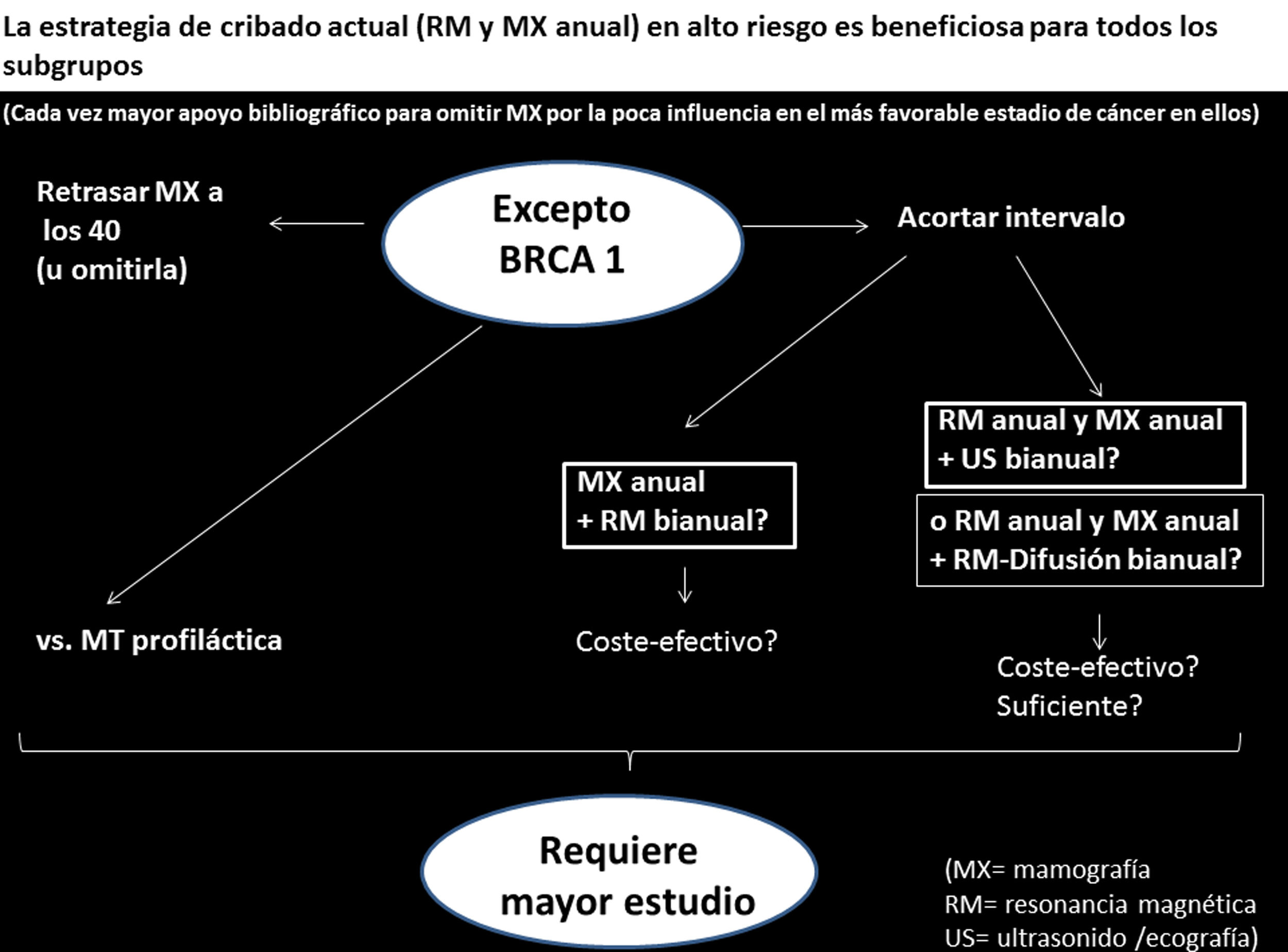
En resumen, en todos los subgrupos de AR la estrategia de cribado actual es beneficiosa, cada vez con mayor apoyo bibliográfico para omitir la MX por la poca influencia en el más favorable estadio de cáncer en ellos, pero no lo es tanto en el subgrupo BRCA1, donde parece claro que el efecto protector del cribado con RM es menor. Por tanto, en BRCA1 se plantea como necesario acortar el intervalo. ¿De qué manera podemos hacerlo? (fig. 3):
A. ¿Haciendo RM bianual (semestral)?Hay un estudio muy reciente de Guindalini et al.58 que valoró la realización de cribado intensivo mediante RM con contraste intravenoso bianual y MX anual. Sus autores concluyen que usando RM cada 6 meses se puede bajar el estadio de los CM en BRCA1 sin afectar excesivamente las rellamadas o biopsias. Obtuvieron mayor valor predictivo positivo y menos falsos positivos en pacientes BRCA1 que en otros subgrupos; todos los CM detectados fueron menores de 1cm y sin ganglios axilares positivos, y no hubo CM de intervalo. Sus resultados se lograron a pesar de haber diagnosticado tumores agresivos de rápido crecimiento y tumores desdiferenciados de grado III en tres cuartas partes de los casos. Deducen que esta estrategia es más beneficiosa para BRCA1 y concluyen también que se puede omitir la MX porque no aumenta la detección de CI, en línea con la abundante bibliografía a este respecto referida anteriormente. Habrá que valorar en el futuro si es coste-efectiva.
Kuhl et al.59 sugieren que una estrategia para mejorar el acceso a esa RM bianual en portadoras de mutación BRCA1 sea la RM abreviada (con comparable detección, pero menor coste por menor tiempo de máquina y lectura como ya explicamos en la parte 1 de esta actualización), ya que disminuiría la carga financiera. Dichos autores plantean que podría ser prudente hacer una RM inicial con protocolo completo y después los estudios de seguimiento, o al menos los realizados a mitad del año, con protocolo abreviado. Indican que los estudios que investiguen la relación coste-eficacia de esta RM bianual deberán valorar no solo costes directos e indirectos de RM y biopsias generadas, sino también las oportunidades de disminuir costes por mamografías ahorradas o impacto por disminución de terapias sistémicas o de años perdidos de vida.
B. ¿Añadiendo ecografía bianual (semestral) a la resonancia y la mamografía anual?Hay dos estudios (Bosse et al.60 y Cortesi et al.61) que indican que con ecografía bianual (dos veces al año, cada 6 meses) sí se obtiene valor adicional al cribado con RM y MX anual, con detección del 11,1% y 18,8% de CM adicionales, aunque la ecografía incrementa algo el número de biopsias y falsos positivos.
Bick et al., cuyo programa de seguimiento de AR (GC-HBOC- German Consortium of Hereditary Breast and Ovarian Cancer, véase tabla 4) ofrece «a las pacientes con mutación genética» la ecografía bianual añadida a la RM y MX anual (la MX desde los 40 años)35, con una ecografía coincidiendo con la RM y MX anual y otra ecografía a los 6 meses, indican que la contribución de la ecografía en términos de tasa de detección de CM ha sido baja, con muy pocos cánceres detectados solo por ecografía en su experiencia de 10 años16 (2 de 221 CM detectados solo por ecografía, lo que supone un 0,9%).
También encontramos el estudio de van Zelst et al.48, que indica que el «Automated Breast US» (ABUS) bianual no obtiene valor adicional al cribado con RM y MX anual, pero si analizamos este trabajo con detenimiento, leemos que 2 de sus 16 CM estaban en un ABUS previo, fueron falsos negativos porque eran 2 nódulos circunscritos e hipoecoicos y fueron confundidos con quistes. Esto supone un 12% de CM adicionales, en línea con las cifras de los autores anteriormente citados que sí deducen un valor adicional de la ecografía.
En un pequeño subgrupo de pacientes del estudio prospectivo alemán «EVA-trial» a las que se realizó ecografía bianual no se encontró valor adicional en la detección de CM11.
Habría que valorar también si la ecografía adicional bianual es coste-efectiva y si sigue siendo insuficiente «porque es evidente que su tasa de detección sería menor que la aportada por la opción de RM bianual».
C. ¿Y añadiendo RM-difusión a la resonancia y mamografía anual?Aunque no hemos encontrado en la bibliografía trabajos que hayan estudiado añadir RM-difusión bianual (semestral) a la RM y la MX anual, nos basamos para plantearlo en el valor de la RM-difusión en detección tumoral. La pauta podía ser, si se usa un protocolo «alterno», añadir una RM-difusión coincidiendo con la MX a los 6 meses de la RM anual con contraste (RM con contraste que puede llevar añadida secuencia de difusión). Hay múltiples trabajos que describen una sensibilidad de la RM-difusión entre el 45% y el 94%62–67. La RM-difusión tiene mayor tasa de detección de CM adicionales que la ecografía (8‰ frente al 4‰); además, la ecografía consume mucho tiempo y tiene muy baja especificidad usada como cribado65. Implementar en la práctica clínica la RM-difusión tiene todavía muchas limitaciones que deben superarse, y para ello es necesario:
- •
Ajustar-estandarizar secuencias adecuadas, para aumentar la agudeza diagnóstica.
- •
Mejorar en resolución espacial, ya que puede alterar la detección de pequeños CM.
- •
Resolver problemas técnicos de artefactos.
- •
Entrenamiento de lectores.
Todo ello hace que la RM-difusión no sea una alternativa real en la práctica.
En resumen, se requiere un mayor estudio para determinar cuál es la mejor manera de acortar el intervalo de seguimiento en las pacientes con mutación en BRCA1 (cribado más intensivo), aunque parece que la RM bianual (semestral) puede ser lo más idóneo y efectivo. Incluso habría que comparar esta opción frente a la realización de mastectomía profiláctica analizando los resultados de ambas a largo plazo.
3- Resonancia magnética alterna vs. síncronaOtro aspecto debatido es si la RM y la MX anual deben hacerse síncronas o alternas. Parece que puede ser beneficioso alternarlas, ya que:
- •
Algunos estudios con análisis con modelos matemáticos que comparan alternativas indican que es más efectivo32,34.
- •
Y algunos estudios describen cánceres detectados en MX intermedia con RM previa normal 6 meses antes68–70 o en RM con MX previa normal 6 meses antes71. Deducen, por tanto, que algún beneficio debe haber en ello. Lo que no se sabe es si esa anomalía mamográfica detectada en la MX intermedia se habría visto 6 meses antes si la MX se hubiera hecho con la RM o si una RM en el momento de esa MX habría detectado también ese CM, y al revés en caso de que la detección fuera por la RM intermedia.
Por otro lado, en un estudio de Othman et al.72, que compara las dos modalidades (síncrona/alterna), se observa que la tasa de falsos positivos es similar en ambas estrategias y que la sensibilidad al realizarlas alternas71 es del 92% (un rango similar a aquellas series en que se hicieron de forma síncrona). Los autores de este estudio concluyen que ambas alternativas son válidas y aluden a la necesidad de realizar estudios multiinstitucionales para compararlas y determinar el protocolo óptimo, aunque admiten también que estos estudios requerirían reclutar numerosos pacientes y conllevarían un alto coste.
En nuestro centro realizamos el cambio a modalidad alterna hace algo más de un año, porque pensamos que obtenemos un ligero posible beneficio respecto a la síncrona. En el momento de realizar una MX después de 6 meses de una RM normal añadimos una ecografía para intentar aumentar la sensibilidad respecto a la MX sola, especialmente pensando en el subgrupo BRCA1 donde hay más cánceres de intervalo. Pensamos que obtenemos un posible beneficio respecto a la síncrona, amparados por la bibliografía que indica un valor-aporte adicional de la ecografía semestral añadida al cribado con RM y MX anual, como los trabajos de Bosse et al.60 y Cortesi et al.61, que ponen énfasis en las características de los tumores detectados en pacientes con mutación BRCA en ecografías realizadas 6 meses después de una RM: la mayoría son cánceres infiltrantes, T1, y asintomáticos.
Con dicha modalidad alterna, añadimos la ecografía de cribado a la RM solo si se trata de la primera ronda de cribado (porque aumenta la especificidad de la RM, que en la primera ronda es más baja debido a lesiones benignas preexistentes).
4- Techo (límite superior de edad) de la resonancia y la mamografía (¿hasta cuándo?)También ha sido un tema especialmente controvertido si se debe seguir haciendo RM por encima de los 50 años. Pero vamos a analizar la evidencia:
- •
Tenemos estudios de cribado con RM y MX que han detallado la detección por edades, que muestran una alta incidencia en mayores de 50 años; por ejemplo, el estudio multicéntrico italiano12, con un 60% de sus cánceres detectados en mayores de 50 años, y el 27% en mayores de 60 años.
- •
Tenemos múltiples estudios que muestran que la RM encuentra cánceres que no detecta la MX en mayores de 50 años12,47,73,74 (mucha mayor sensibilidad).
- •
Tenemos estudios/metaanálisis que indican que añadir RM a la MX en el cribado en pacientes mayores de 50 años aumenta la detección de cáncer en una magnitud similar a la observada en jóvenes, tanto en pacientes BRCA75 como en pacientes de AR no portadoras49. Y sorprendentemente, en pacientes BRCA, la sensibilidad de la MX no fue mayor en mayores de 50 años que en jóvenes75, sí en cambio en pacientes de AR no portadoras49.
Por tanto, se plantean las siguientes consideraciones:
- •
Debería ser igualmente justificable ofrecer RM a las pacientes mayores de 50 años que a las más jóvenes ya que en ambos subgrupos se logra detectar cánceres adicionales por RM.
- •
El argumento a favor de realizar cribado solo con MX en pacientes mayores de 50 años con mutación en BRCA75 es que a mayor edad se espera una menor densidad radiográfica, lo que haría suponer un aumento de la sensibilidad de la MX que, sin embargo, no se ha observado en un metaanálisis en pacientes portadoras de esta mutación. En un metaanálisis en no portadoras49, aunque sí se demostró un leve aumento de sensibilidad de la MX con la edad, el 32% de los cánceres en mujeres mayores de 50 años los detectó la RM sola.
- •
En pacientes portadoras de mutación en BRCA, los tumores crecen dos veces más rápido que en no portadoras, sin evidencia de cambios en la biología del tumor por el hecho de cumplir 50 o 60 años.
Parece lógico y justificable, por todo ello, continuar el cribado con RM más allá de los 50 años, al menos hasta los 70 años35,36,38 (con evidencia IIA36) y mantener también la MX anual hasta los 75 años36 (igualmente con evidencia IIA36), o bien mantener RM y MX anual hasta los 75 años17,29–31. Actualmente, la mayoría de las principales guías recomienda una de esas dos opciones (véase tabla 2). Alguna guía que pone techo de cribado con RM y MX en 70 años lo justifica teniendo en cuenta factores como la disminución del riesgo relativo de cáncer con la edad en pacientes con riesgo hereditario, que ha habido pocas pacientes mayores de 69 años incluidas en estudios o que el cribado en CM no ha demostrado un beneficio de mortalidad en mujeres mayores de 70 años en la población general38.
5- Seguimiento tras cirugía de reducción de riesgoMuchos centros no ofrecen una guía específica para después de la cirugía de reducción de riesgo (CRR)76. Se necesitan datos prospectivos para establecer el esquema más efectivo en el seguimiento post-CRR en las mujeres con mutación BRCA.
Hoy sabemos77 que la incidencia de CM tras CRR es baja: 0,7% por paciente; 0,35% por mama (atribuidas a presencia de tejido fibroglandular). También, que tras las principales CRR actuales (mastectomía preservadora de areola-pezón y mastectomía preservadora de piel), la RM es la técnica que permite una medición-cuantificación más robusta y reproducible del tejido fibroglandular. Detecta tejido fibroglandular en el 20% de los casos (50% en mastectomía preservadora de areola-pezón vs. 13% en mastectomía preservadora de piel), y no solo en zona retroareolar, sino también en zonas más periféricas de la mama (31% en mastectomía preservadora de areola-pezón vs. 13% en mastectomía preservadora de piel). Y detecta mayores proporciones de tejido fibroglandular en mastectomía preservadora de areola-pezón (7,9%) que en mastectomía preservadora de piel (1,7%).
En cirugías profilácticas es crucial quitar el mayor tejido fibroglandular posible que en otras cirugías. Debería hacerse una RM prequirúrgica 6 meses antes de la cirugía para descartar CM, que debe servir también para ayudar al cirujano a no dejar después tejido fibroglandular, y una RM posquirúrgica para ver si queda tejido (cuantificación del tejido fibroglandular): si no queda, se podría hacer el seguimiento con ecografía, y si queda, debería plantearse hacer el seguimiento con RM, e incluso identificar pacientes que pudieran beneficiarse de una segunda cirugía. Los cirujanos han de informar del tejido fibroglandular cuantificado porque constituye permanencia de riesgo de cáncer.
La mastectomía preservadora de areola-pezón ha sido aceptada como igualmente segura que la mastectomía preservadora de piel y mejor estéticamente, y aunque puede haber controversia respecto al riesgo de desarrollo de cáncer o recurrencia que todavía existe, hay trabajos recientes que apoyan que la mastectomía preservadora de areola-pezón es segura78.
6- Cribado en varones de alto riesgoEn cuanto a varones de alto riesgo, actualmente no hay suficiente evidencia para justificar cribado con pruebas de imagen31. Alguna guía recomienda, con muy baja evidencia (IIIC), considerar mamografía a los 40 años, especialmente si hay ginecomastia o en portadores de mutación BRCA236. No obstante, hay un trabajo muy reciente que muestra en varones de AR un potencial beneficio del cribado con mamografía anual, con tasas de detección de cáncer mayores que en mujeres, ocultos en la exploración y en estadios precoces. Hacen falta más estudios para validar esos resultados y proporcionar recomendaciones más definitivas sobre cuándo y cómo evaluar a varones de alto riesgo79.
ConclusiónEn pacientes con AR de CM (riesgo absoluto de padecer CM ≥ 20-25% a lo largo de la vida), se recomienda realizar cribado con RM y MX anual, y con la evidencia de la literatura expuesta, este sería el protocolo que proponemos:
- •
Comienzo de cribado: a los 25 o 30 años.
- a)
En subgrupo BRCA: comenzar con 25 años, aunque podría contemplarse comenzar con 30 si el pariente más joven con CM tenía 40 años o más. También en portadoras de otros genes asociados a AR (véase tabla 1).
- b)
En AR familiar: comenzar con 30 años, aunque podría contemplarse comenzar con 25 si el pariente más joven con CM tenía 35 años o menos.
- c)
Excepciones:
- –
Li-Fraumeni: comenzar con 20 años, recomendándose no incluir MX, por su alta susceptibilidad a la radiación.
- –
Antecedente de radioterapia torácica previa, comenzar con 25 años, u 8 años después de acabar la radioterapia (lo que sea más tarde de las dos cosas).
- •
Introducción de la MX: a los 35 años como regla general (siguiendo directrices del grupo europeo/EUSOMA).
- a)
En AR familiar: puede introducirse a los 40 años o 10 años antes pariente más joven; no antes de 35 años36.
- b)
Considerar en BRCA1 retrasar MX a los 40 años:
- 1.
¿u omitir la MX en BRCA1?
- 2.
¿u omitir MX a todas las menores de 40 años?
- 3.
¿u omitir la MX en un futuro?
Estas tres opciones (1, 2 y 3) quizá requieren mayor estudio, aunque la evidencia va progresivamente en esa línea.
Entre 25-35 años (hasta introducir la MX): RM y ecografía anual.
- •
Protocolo síncrono vs. alterno de RM y MX: puede ser beneficioso alternar.
- •
Puede ser beneficioso acortar intervalo en BRCA 1 (¿con RM bianual? o ¿añadiendo ecografía bianual?...): requiere mayor estudio, aunque parece que la RM bianual puede ser lo óptimo y requerirá valoración también de su coste-efectividad.
- •
Mantener la RM hasta al menos hasta 70 años. Finalizar cribado a los 75 años.
Es conveniente realizar la RM en la segunda semana del ciclo (para optimizar la especificidad).
A aquellas pacientes en las que esté contraindicada la RM por claustrofobia, alergia al contraste, implantes incompatibles u otras causas, el cribado se realizaría con MX y ecografía (MX anual y ecografía bianual)61, o incluso habría que valorar cirugía profiláctica a las BRCA1. A las pacientes embarazadas, solo con ecografía, aunque puede ser razonable ofrecerles ecografía a intervalos más cortos35.
La RM no está contraindicada en la lactancia, y aunque el realce parenquimatoso de fondo puede limitar, la RM sigue detectando cánceres y lesiones satélites, pudiendo emplearse imágenes suplementarias de sustracción para disminuir el realce parenquimatoso de fondo y facilitar el diagnóstico80.
La mamografía con contraste es una nueva técnica prometedora que puede ser una opción en centros que no dispongan de RM o en mujeres en quienes la RM esté contraindicada. Igual que la RM, proporciona evaluación funcional de la neovascularización tisular tras inyección de contaste yodado81.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consentimiento informado y datos de los pacientesEste trabajo tiene la aprobación del comité ético de nuestro centro. Disponemos de los consentimientos informados escritos de los pacientes cuyas imágenes de distintas pruebas de imagen se muestran en el presente trabajo.
Autoría- 1.
Responsable de la integridad del estudio: SAR.
- 2.
Concepción del estudio: SAR.
- 3.
Diseño del estudio: SAR.
- 4.
Obtención de los datos: SAR, ABD, JAL, BCC, ALR.
- 5.
Análisis e interpretación de los datos: SAR, ABD, JAL, BCC, ALR.
- 6.
Tratamiento estadístico: SAR, JAL.
- 7.
Búsqueda bibliográfica: SAR.
- 8.
Redacción del trabajo: SAR.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SAR, ABD, JAL, BCC.
- 10.
Aprobación de la versión final: SAR, ABD, JAL, BCC, ALR.
Los autores declaran no tener ningún conflicto de intereses
Queremos manifestar nuestro agradecimiento al resto de servicios de nuestro centro hospitalario que participan en el manejo de la patología mamaria (Ginecología, Oncología, Anatomía Patológica y Medicina Nuclear), por su implicación y su estrecha y continua colaboración con nosotros (porque el buen fruto profesional y científico tiene su base en el gran trabajo de todos y en la buena conexión y cohesión multidisciplinar, y en intentar siempre hacer las cosas lo mejor posible con los medios que tenemos, sin olvidar nunca el principal objetivo: el beneficio de las pacientes).
Como primera autora, gracias a mi familia, por su paciencia y por ese tiempo que mi dedicación científica les resta de mi dedicación a ellos.
Gracias a Ann Marsden, por su amable colaboración en la traducción del resumen al inglés.