Los estudios de neuroimagen son esenciales en los pacientes epilépticos, tanto para su diagnóstico como para el manejo quirúrgico. Este artículo se centra en el paciente epiléptico adulto y repasa los criterios clínicos actualizados según la ILAE (International League Against Epilepsy) para las definiciones de crisis comicial, epilepsia y estatus epiléptico. Además, se describen los distintos tipos de epilepsia, las diferentes presentaciones, la semiología, el enfoque radiológico para el manejo de las crisis epilépticas y las distinciones entre epilepsia generalizada y focal. Finalmente, se describen las relaciones de los posibles déficits funcionales cerebrales secundarios a las lesiones potencialmente epileptógenas y a la cirugía de la epilepsia, remarcando la relevancia de los estudios de resonancia magnética funcional.
Neuroimaging studies are essential in patients with epilepsy, both for diagnosis and surgical management. This article focuses on adult epileptic patients, reviewing the updated clinical criteria published by the International League Against Epilepsy for the definitions of seizures, epilepsy, and status epilepticus. It also describes the different types of epilepsy, the different presentations, the signs, the radiologic approach to managing seizures, and the differences between generalized and focal seizures. Finally, it discusses the relations between possible functional cerebral deficits secondary to potentially epileptogenic lesions and epilepsy surgery, underlining the importance of functional magnetic resonance imaging studies.
La epilepsia es uno de los trastornos neurológicos crónicos más frecuentes, que afecta a alrededor del 1% de la población mundial, con mayor incidencia en países en vías de desarrollo, y tiene un alto impacto en la vida de los que la padecen1–3. Se ha observado que los pacientes con una única crisis en 5 años presentaban peor nivel educativo y laboral, así como mayor estigmatización social que aquellos libres de crisis durante el mismo periodo4.
La tasa de mortalidad estandarizada global descrita en pacientes con epilepsia es de 2 a 7 veces superior respecto a la población general5. Este aumento en el riesgo de mortalidad está relacionado con la etiología de la epilepsia, el grado de control de las crisis y el grado de discapacidad neurológica. Las causas más frecuentes de mortalidad son la muerte súbita inexplicada y los accidentes secundarios6.
El manejo de los pacientes con epilepsia generalmente se consigue a través de fármacos antiepilépticos; sin embargo, es importante conocer si existe una causa subyacente de epilepsia que pueda poner en riesgo la vida del paciente, como, por ejemplo, la aparición de tumores cerebrales que se manifiestan con crisis comiciales. La neuroimagen tiene desde hace tiempo un peso importante en la demostración de patología subyacente causante de crisis comiciales, tal como malformaciones vasculares, tumores y lesiones cicatriciales cerebrales, entre otras. Los avances en resonancia magnética (RM) en las últimas décadas han permitido visualizar pequeñas malformaciones del desarrollo cortical, esclerosis a nivel hipocámpico u otras lesiones cerebrales que puedan candidatas a cirugía resectiva.
Es importante destacar que durante la aparición de crisis se produce una disrupción de las redes neuronales y esto se traduce en déficits neurológicos que suelen ser debidos a la disfunción transitoria de los circuitos neuronales. Esta disfunción puede provocar daño neuronal y convertirse en permanente si las crisis no se controlan.
La semiología clínica y el patrón eléctrico son esenciales en la clasificación del tipo de epilepsia, y en muchas ocasiones proporcionan información sobre el posible origen de las crisis basándose en los signos clínicos lateralizadores. Los estudios de neuroimagen en muchas ocasiones ayudan a confirmar la sospecha clínica, bien mostrando una lesión estructural, mediante RM o tomografía computarizada (TC), o mediante la presentación de cambios funcionales de perfusión o metabolismo con la tomografía por emisión de positrones (PET) o la tomografía por emisión de fotón único (SPECT).
El objetivo de este artículo es hacer una actualización de semiología clínica, etiología y clasificación de los pacientes epilépticos, su correlato radiológico, y revisar las indicaciones, el protocolo y los hallazgos de imagen.
Valoración clínica del paciente epilépticoDefinición clínica de crisis comicial y epilepsiaEn 2005, la International League Against Epilepsy (ILAE) formuló de forma conceptual la definición de crisis epiléptica como la aparición transitoria de signos y síntomas debidos a una descarga anormalmente excesiva del cerebro o a una actividad cerebral sincrónica, y definió la epilepsia como una enfermedad crónica, caracterizada por una predisposición duradera a generar crisis recurrentes, con consecuencias a nivel cognitivo, neurobiológico, psicológico y social7.
En 2014, la ILAE adoptó las recomendaciones del grupo de trabajo y modificó la definición de epilepsia8. Actualmente, se realiza un diagnóstico de epilepsia tras la aparición de al menos dos crisis no provocadas, o también llamadas reflejas, separadas al menos 24 horas en el tiempo; o tras una única crisis no provocada si el paciente presenta un riesgo de padecer más crisis durante los 10 años siguientes, similar al riesgo de recurrencia general después de dos crisis no provocadas, que es de al menos un 60%. Esto último puede identificarse precozmente mediante la detección de anomalías epileptiformes en el electroencefalograma (EEG) o de lesiones potencialmente epileptógenas en neuroimagen, particularmente en la RM8. Por último, entra dentro de la definición de epilepsia el diagnóstico de un síndrome epiléptico, que hace referencia a una conjunción de particularidades clínicas o del tipo de crisis, características electroencefalográficas y/o de imagen que suelen agruparse; algunos ejemplos son el síndrome de West o la epilepsia de ausencia infantil. Por lo general, asocian implicaciones etiológicas, pronósticas y terapéuticas.
Desde el punto de vista etiológico, la epilepsia puede clasificarse como genética, estructural, metabólica, inmunitaria, infecciosa o desconocida. Una misma entidad puede pertenecer a dos categorías diferentes, como es el caso de la esclerosis tuberosa, que presenta una etiología estructural y genética9.
En ocasiones, los pacientes epilépticos pueden presentar estatus epilépticos (SE), cuando las crisis persisten en el tiempo sin autodelimitarse y como consecuencia desencadenan un daño neurológico secundario a edema citotóxico o vasogénico que provoca muerte o lesión neuronal, así como disfunción de redes neuronales según el tipo y duración de las crisis. El SE se produce tanto por fallo de los mecanismos responsables de delimitar o finalizar las crisis como por la puesta en marcha de mecanismos que derivan en crisis anormalmente prolongadas. Los SE pueden clasificarse según su semiología en dos categorías:
- •
Con síntomas motores prominentes: SE convulsivo, SE mioclónico, SE motor focal, SE hipercinético y estatus tónico.
- •
Sin síntomas motores prominentes: estatus no convulsivo (NCSE, nonconvulsive status epilepticus) con coma y NCSE sin coma (generalizado o focal)10.
Clásicamente se diagnosticaba de SE a un paciente con dos o más crisis repetidas sin llegar a recuperar el conocimiento o crisis persistentes durante 30 minutos o más11. Sin embargo, recientemente se han modificado los criterios y en la actualidad se considera SE convulsivo tónico-clónico tras un tiempo de persistencia de crisis mayor de 5 minutos y que no se resuelve con tratamiento hasta los 30 minutos, o una duración superior a 10 minutos sin resolución hasta completar los 60 minutos en el SE focal con alteración del nivel de conciencia10. Además, se han introducido novedades en el abordaje del NCSE mediante el uso combinado de los estudios neurofisiológicos12.
Patrón semiológico-eléctrico de la epilepsiaSegún su patrón semiológico, la epilepsia se clasifica por el tipo de crisis como focal, generalizada, combinada focal y generalizada o de origen incierto. Las crisis focales se originan en redes limitadas a un hemisferio, aunque su localización puede ser amplia. El inicio puede producirse en estructuras corticales y subcorticales, pero para cada tipo de crisis el comienzo ictal debe ser consistente entre crisis, con patrones preferenciales de propagación que pueden llegar a afectar al hemisferio contralateral. Por otra parte, se habla de crisis generalizada cuando se origina en las redes de descarga rápida bilateral, que pueden incluir estructuras corticales y subcorticales, pero no necesariamente la totalidad del córtex9.
Es importante definir el tipo de epilepsia de cara a su manejo terapéutico y pronóstico. El análisis detallado de la semiología de las crisis es esencial para la aproximación diagnóstica. En el caso de que las crisis sean focales o se dude de si las crisis no son generalizadas o paroxísticas, el primer paso para poder clasificar el tipo de crisis es la realización de una monitorización vídeo-electroencefalográfica, que permite una evaluación rigurosa de la semiología de las crisis y su correlación eléctrica con los cambios en el EEG. Esto favorece la identificación de signos localizadores, es decir, información sobre el lóbulo de inicio o propagación de las crisis (frontal, temporal, parietal u occipital), y signos lateralizadores, que hace referencia al hemisferio de inicio o propagación (derecha o izquierda), que son de gran ayuda en la determinación del tipo de epilepsia que presenta el paciente13.
La información eléctrico-clínica ayuda a clasificar la epilepsia focal, de forma “simplificada”, en epilepsia de origen temporal, que se puede clasificar en epilepsia temporal mesial o epilepsia temporal lateral, también llamada neocortical, y epilepsia de origen extratemporal, que puede ser frontal, parietal, occipital o insular14.
Evaluación radiológica del paciente epilépticoEl estudio neurorradiológico tiene un rol imprescindible en el manejo de los pacientes con crisis comiciales. En este sentido, puede confirmar el diagnóstico de crisis o epilepsia, añadir información sobre la etiología, determinar el tratamiento adecuado y aportar información sobre el pronóstico. Como se ha mencionado previamente, existe una distinción entre crisis comiciales y epilepsia, y por lo tanto su manejo radiológico debe ser diferente.
Manejo radiológico urgente en una primera crisis comicialEl objetivo principal en un paciente con una primera crisis comicial no es realizar el diagnóstico de epilepsia, sino más bien establecer si lo que ha provocado la crisis es un proceso que puede poner en riesgo la vida del paciente. Así pues, el papel de los estudios de imagen en este caso es el de identificar si existe una enfermedad subyacente, que se manifiesta con sintomatología epiléptica y que sea tratable. Existen además signos clínicos que sugieren gravedad y que requieren intervención inmediata, lo que en inglés se denomina “red flags”, y que indican la necesidad de un estudio de neuroimagen urgente (tabla 1).
Señales de alarma clínica (red flags) que requieren un estudio de neuroimagen urgente16
| Crisis recurrentes |
| Crisis de inicio focal |
| Alteración de la consciencia persistente |
| Déficits neurológicos focales |
| Cefalea |
| Historia de trauma reciente |
| Fiebre |
| Hipertensión u otros signos vitales alterados |
| Viaje reciente a un país endémico de cisticercosis |
| Uso de anticoagulantes |
| Antecedente de infarto cerebral |
| Alteración de la coagulación |
| Historia previa de hidrocefalia |
| VIH y otros estados inmunosupresores |
| Antecedente de neoplasia maligna |
VIH: virus de la inmunodeficiencia humana.
Según una revisión de la literatura basada en la evidencia de los servicios de urgencia, realizada por la American Academy of Neurology, entre un 30% y un 50% de los pacientes atendidos por una primera crisis epiléptica mostraron anomalías en los estudios con TC15.
En el estudio radiológico del paciente con una primera crisis comicial, la TC es la técnica de elección, dado que, aunque tiene menor sensibilidad diagnóstica que la RM para detectar pequeñas lesiones corticales, es rápida, está disponible en la mayor parte de los centros y es coste-efectiva en urgencias. Además, la TC es sensible en la detección de las etiologías estructurales que con mayor frecuencia cursan con crisis epilépticas sintomáticas agudas como son la hemorragia intracraneal, el traumatismo craneoencefálico (TCE), la hidrocefalia aguda o las lesiones estructurales grandes como malformaciones arteriovenosas, tumores o abscesos intracraneales. Actualmente se recomienda su realización sin contraste y se reserva la administración de contraste cuando la TC basal es patológica o cuando hay una sospecha etiológica de infección, como por ejemplo en los pacientes con infección por el virus de la inmunodeficiencia humana (VIH)16. Los estudios de RM en urgencias solo se realizarán en casos graves de alta sospecha que sean indetectables con la TC inicial, como por ejemplo encefalitis o síndrome de encefalopatía posterior reversible (PRES).
Manejo radiológico urgente en el estatus epilépticoEs imprescindible realizar una TC en urgencias para poder descartar las causas agudas del SE, y solo en casos particulares, mayoritariamente cuando no se visualice ninguna causa aparente, se puede realizar una RM.
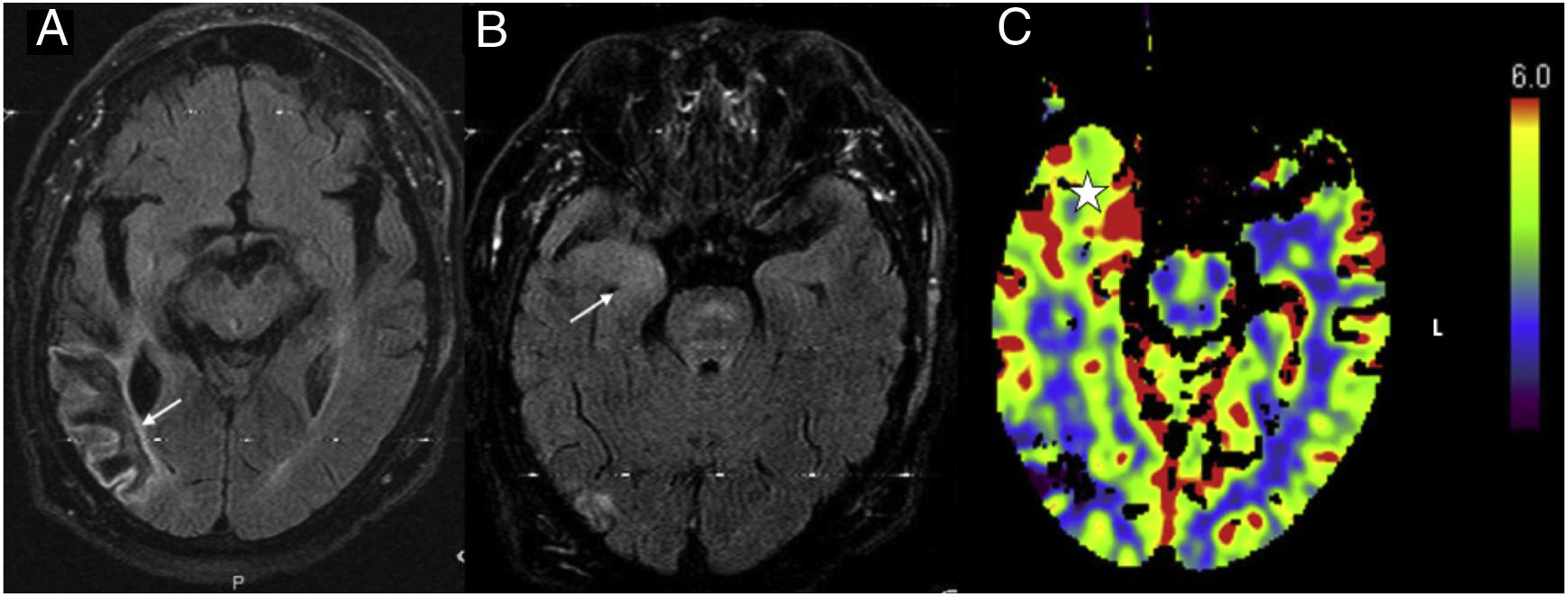
En los estudios de RM y TC con perfusión se pueden detectar cambios relacionados con el propio SE, pero no con su etiología. Estos cambios se observan entre un 25% y un 30% de los casos, según los estudios realizados17. El motivo por el que únicamente algunos pacientes muestran cambios en los estudios de imagen no está bien estudiado y existen distintas hipótesis, como la duración del estatus o la presencia de descargas epileptiformes lateralizadas periódicas que podrían favorecer la aparición de estas alteraciones. El hallazgo más frecuentemente observado es el cambio en la secuencia de difusión durante el periodo periictal, que puede afectar a varias zonas cerebrales, principalmente áreas corticales o subcorticales, o bien estructuras como el tálamo, hipocampos y el tronco del encéfalo. También se han descrito alteraciones de señal en FLAIR (Fluid attenuation inversion recovery) y aumento del volumen sanguíneo cerebral (VSC) relativo mediante técnicas de TC o RM de perfusión (fig. 1)18.
Cambios asociados a estatus epiléptico. Paciente con antecedente de lesión isquémica antigua en región temporoparietal derecha que presenta clínica de estatus epiléptico. A) FLAIR axial donde se observa la lesión isquémica antigua (flecha). B) FLAIR axial en una imagen a nivel de hipocampos donde se aprecia una alteración de la señal FLAIR en el hipocampo y amígdala derecha (flecha blanca). C) Mapa de volumen sanguíneo cerebral (VSC) relativo, obtenido con TC de perfusión, en el que se aprecia un aumento del volumen sanguíneo en el polo temporal derecho (estrella); este aumento del VSC ayuda a diferenciarlo de un tumor de bajo grado. La localización de la lesión en el hipocampo junto con este aumento de perfusión y el patrón eléctrico de estatus epiléptico sugieren que se trate de cambios postestatus. En este paciente no fue posible realizar seguimiento en nuestro hospital y no hay confirmación histológica.
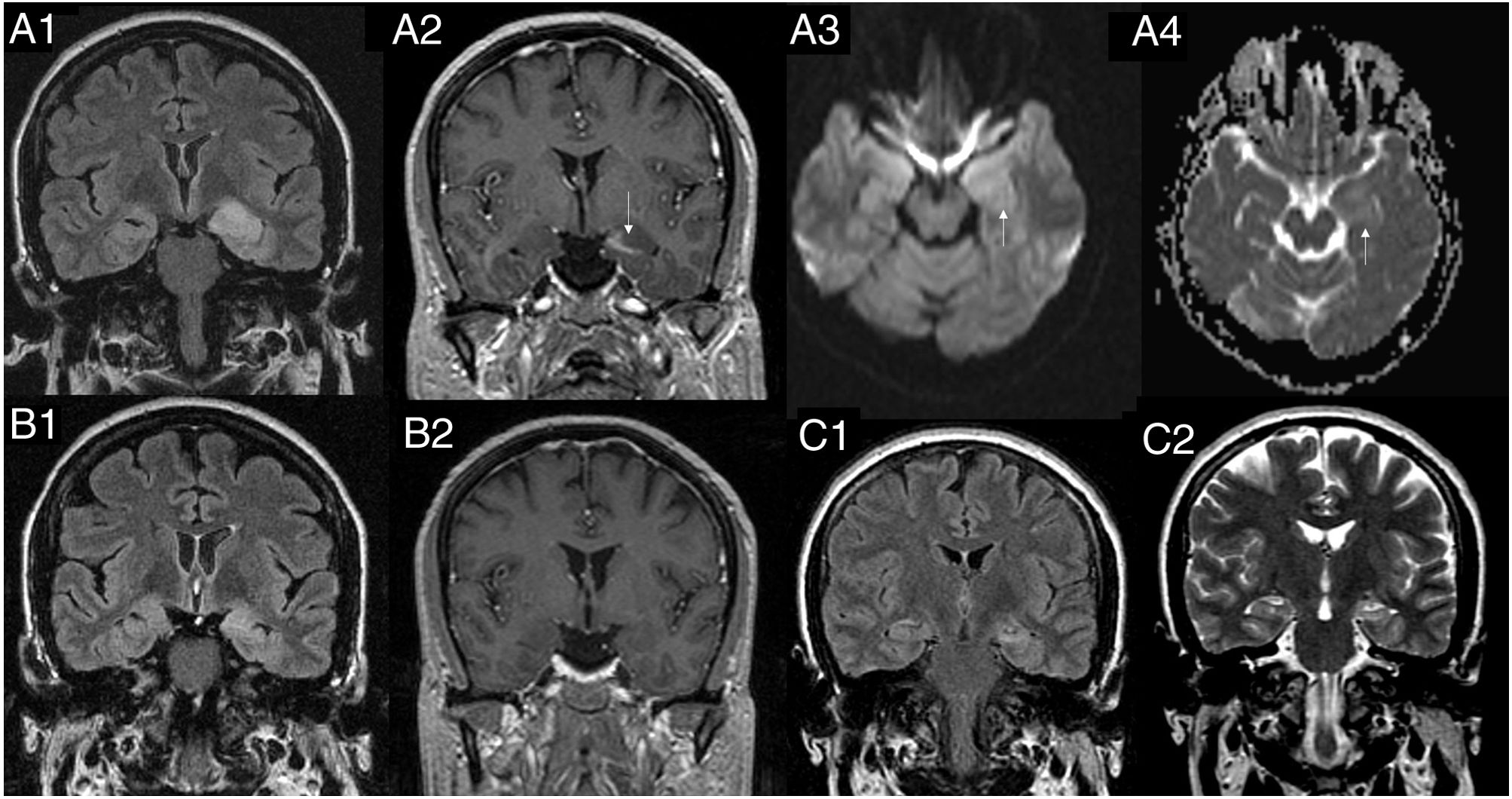
Es interesante destacar que los cambios en las secuencias en difusión muestran en ocasiones aumento o restricción de la misma indicando que probablemente pueda existir un componente de edema citotóxico o vasogénico bastante similar al que se observa en el PRES y que estaría causado por una desregulación de la membrana celular, la mayoría de los casos reversible, aunque si el SE es duradero, acabará provocando una isquémica celular que causará una posterior atrofia cortical o de las estructuras afectadas (fig. 2)18.
Evolución de los cambios estructurales asociados a estatus epiléptico. Paciente que presenta por primera vez estatus epiléptico (SE) sin antecedentes previos de epilepsia. Las imágenes A1 a A4 corresponden al estudio inicial. Las imágenes B1 y B2 corresponden al mes después de la recuperación del SE y las imágenes C1 y C2 corresponden al estudio longitudinal al cabo de 1 año. A1) FLAIR coronal a nivel de hipocampos, donde se observa una lesión hiperintensa tumefacta que afecta a la cabeza del hipocampo y la amígdala y parece extenderse hacia el córtex parahipocámpico y fusiforme izquierdo. A2) T1 con contraste en coronal, donde se observa una captación lineal en la cabeza del hipocampo (véase flecha). A3) Imagen ponderada en difusión axial, donde se observa un tenue aumento de señal en la región del hipocampo y amígdala izquierda (flecha). A4) Mapa de coeficiente de atenuación, donde se aprecia un aumento de la difusión en la región de la cabeza del hipocampo y la amígdala que sugiere presencia de edema vasogénico o intersticial. B1-FLAIR coronal y B2-T1 con contraste coronal a nivel de los hipocampos. Se observa una disminución del aspecto tumefacto del hipocampo, con persistencia de aumento de señal en FLAIR y ausencia de captación de contraste.
Estudio realizado al cabo de 1 año de los síntomas: FLAIR coronal (C1) y T2 coronal (C2) a nivel de la cabeza de hipocampos donde se aprecia una atrofia del hipocampo izquierdo con aumento de señal tanto en secuencias FLAIR como en T2 con una apariencia de esclerosis de hipocampo izquierda. En su estancia en nuestro hospital, el cuadro clínico, neurofisiológico y analítico no era compatible con una encefalitis límbica, autoinmunitaria o infecciosa.
Una vez establecido que no hay ninguna causa aguda, y en el caso de que se confirme que el paciente es epiléptico, entonces se deberá realizar una RM de forma electiva. Según la ILAE, se debería realizar un estudio de RM a todos los pacientes epilépticos, excepto aquellos con las formas típicas de epilepsia generalizada primaria (p. ej., en la epilepsia mioclónica juvenil, en la epilepsia de ausencia infantil o en las epilepsias focales benignas de la infancia), que muestran un patrón característico clínico y eléctrico y con buena respuesta al tratamiento antiepiléptico.
Además, la ILAE define las siguientes situaciones en las que el estudio de neuroimagen es imprescindible: la aparición de crisis focales a cualquier edad de inicio, inicio de crisis generalizadas o inclasificables durante el primer año de vida o durante la edad adulta, la evidencia de un déficit neurológico o neuropsicológico relacionado con la epilepsia, la dificultad de controlar las crisis mediante la primera línea de fármacos antiepilépticos, si existe una pérdida de control de las crisis mediante el tratamiento farmacológico, y por último, si se observa un cambio en el patrón de las crisis19.
En la práctica clínica nos encontraremos tres situaciones básicas en las que estará indicado realizar estudio de neuroimagen: cuando existe un inicio reciente de epilepsia, en la epilepsia de larga evolución que previamente no ha sido estudiada por imagen y en los pacientes epilépticos farmacorresistentes, los cuales son candidatos potenciales a cirugía de la epilepsia. En cada uno de estos casos, el abordaje radiológico será diferente19,20. Para determinar qué tipo de protocolo de RM se debe de realizar, es importante tener información suficiente del tipo de epilepsia, si es una epilepsia generalizada o focal, y si hay sospecha de focal, si puede ser de probable origen temporal o extratemporal.
Epilepsia generalizadaEn la epilepsia generalizada, el rendimiento de las pruebas de imagen no es elevado. En un 24% de los casos, los estudios de RM pueden ser anormales, pero en un 88% estos hallazgos son inespecíficos, como reducciones de ambos hipocampos, anomalías en ganglios basales, anomalías ventriculares o atrofia cortical difusa21. Sin embargo, estos hallazgos no tienen un correlato clínico.
Es importante tener en cuenta que hay epilepsias de origen focal que se generalizan rápido y que pueden estar erróneamente clasificadas como epilepsias generalizadas. Así pues, ante la mínima sospecha de que el paciente puede tener una epilepsia de origen focal se deberá realizar una RM con el protocolo más específico de epilepsia focal.
Epilepsia focalEn el caso de que el paciente tenga una epilepsia de origen focal, el protocolo de RM deberá ser más específico con el fin de poder identificar una lesión epileptógena susceptible de ser resecada quirúrgicamente si el paciente es farmacorresistente. Este protocolo específico debe ser diseñado con el objetivo de poder visualizar lesiones sutiles no apreciables en una RM convencional; el hallazgo de una lesión potencialmente epileptógena en la RM tiene un gran valor y es un marcador de buen pronóstico tras la cirugía22.
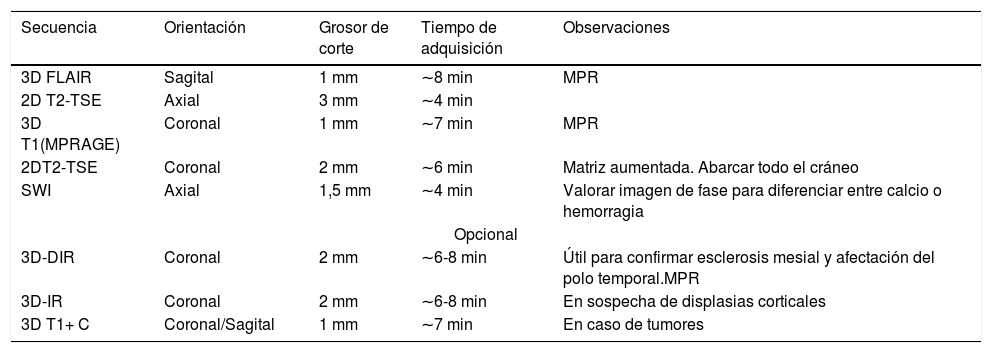
En la tabla 2 se describe el protocolo de RM para el estudio de la epilepsia farmacorresistente en nuestro centro, un hospital terciario con unidad funcional de cirugía de epilepsia. Es importante tener en cuenta que estos pacientes se benefician de realizar el estudio de RM en una máquina de alto campo, ya que es más sensible en la detección de pequeñas lesiones corticales23.
Protocolo de resonancia magnética en pacientes con epilepsia focal. Hospital terciario con Unidad de epilepsia. Equipo de 3T TRIO SIEMENS
| Secuencia | Orientación | Grosor de corte | Tiempo de adquisición | Observaciones |
|---|---|---|---|---|
| 3D FLAIR | Sagital | 1 mm | ∼8 min | MPR |
| 2D T2-TSE | Axial | 3 mm | ∼4 min | |
| 3D T1(MPRAGE) | Coronal | 1 mm | ∼7 min | MPR |
| 2DT2-TSE | Coronal | 2 mm | ∼6 min | Matriz aumentada. Abarcar todo el cráneo |
| SWI | Axial | 1,5 mm | ∼4 min | Valorar imagen de fase para diferenciar entre calcio o hemorragia |
| Opcional | ||||
| 3D-DIR | Coronal | 2 mm | ∼6-8 min | Útil para confirmar esclerosis mesial y afectación del polo temporal.MPR |
| 3D-IR | Coronal | 2 mm | ∼6-8 min | En sospecha de displasias corticales |
| 3D T1+ C | Coronal/Sagital | 1 mm | ∼7 min | En caso de tumores |
DIR: double inversion recovery; FLAIR: fluid attenuation inversion recovery; MPR: multiparametric reconstruction; MPRAGE: magnetization prepared rapid acquisition gradient echo; SWI: susceptibility weighted image; IR: inversion recovery; T1 +C: T1 con contraste; TSE: Turbo Spin echo.
La identificación neuroanatómica de la zona de inicio ictal, así como su propagación, es clave en el conocimiento de la red epileptógena. Las crisis epilépticas pueden presentar como primer síntoma un aura, que es una sensación premonitoria que puede alertar sobre la activación patológica o disfunción de una red epiléptica7.
En la epilepsia de origen temporal, dentro de los fenómenos premonitorios, la sensación epigástrica, los síntomas emocionales o afectivos de miedo, secundarios a afectación predominante del hipocampo, estructura muy interconectada con la amígdala, la cual se encarga del procesado multimodal del reconocimiento emocional, y los estados de ensoñación (“déjà vu/jamais vu”) se han asociado a origen mesial9, mientras que las auras autonómicas, psíquicas, visuales complejas, auditivas y vertiginosas aparecen con mayor frecuencia asociadas a la epilepsia temporal lateral o neocortical.
Tras el aura, las crisis temporales originadas en región mesial se continúan, con frecuencia, de desconexión del medio acompañada de automatismos orales o manuales, con frecuencia ipsilaterales a la región de origen de crisis. Es habitual, además, la presencia de postura distónica de un miembro acompañada de automatismos de la extremidad contralateral. La aparición precoz de muecas o clonías faciales y actividad motora clónica sin automatismos orales hace pensar en epilepsia temporal neocortical14. Las crisis neocorticales presentan, por lo general, una semiología más heterogénea, una duración menor, desconexión del medio más precoz que cuando se originan en región mesial y con mayor frecuencia evolucionan a generalización tónico-clónica secundaria. Si el paciente presenta afasia tras las crisis es probable que el hemisferio afectado sea el dominante para el lenguaje.
En la epilepsia temporal, el hallazgo más frecuente por RM es la esclerosis mesial temporal, que consiste, principalmente, en una atrofia del hipocampo y otras estructuras límbicas como el fórnix, la amígdala o la corteza entorrinal, junto con alteración de señal FLAIR y T2 del hipocampo, que indica gliosis astrocitaria24.
Existe un correlato entre la evolución de la epilepsia temporal mesial no controlada con fármacos antiepilépticos y la pérdida de memoria25,26. La función del aprendizaje y la memoria a corto plazo se localiza en los hipocampos. El hipocampo localizado en el hemisferio dominante para el lenguaje, normalmente el izquierdo, suele tener un papel más relevante en la memoria verbal, mientras que el hipocampo del hemisferio no dominante tiene una función más selectiva de memoria visual27.
Mediante test neuropsicológicos se puede determinar cómo está la función de memoria verbal y visual28. Esto es muy importante para el manejo clínico de estos pacientes, ya que la cirugía en un hipocampo con función de memoria preservada tiene un alto riesgo de causar déficits de memoria verbal que impedirán al paciente tener una vida laboral activa. Otro déficit quirúrgico que se debe evitar es la amnesia anterógrada. Esto puede suceder si se extirpa un hipocampo sano o deficitario funcionalmente y el hipocampo contralateral tiene también poca reserva de memoria porque también está dañado. Es conocido que las epilepsias temporales de larga evolución acaban afectando al hipocampo contralateral por la propagación de las crisis29.
En la epilepsia de origen temporal neocortical, los estudios de neuroimagen pueden ser negativos en un porcentaje más alto (hasta un 30%)22. Aunque en los estudios de RM se observe una esclerosis mesial, no se descarta que el origen sea neocortical y que el hipocampo se vea afectado secundariamente (patología dual), situación que puede ocurrir en un 5-20% de los casos30.
Muchas de las displasias corticales de tipo I se sitúan en los lóbulos temporales. Estas malformaciones del desarrollo pueden tener poca traducción en los estudios de neuroimagen, y en un alto porcentaje las RM son normales o bien únicamente demuestran una leve asimetría a nivel temporal. Otros sustratos epileptógenos que se pueden localizar en el neocórtex temporal y que sí son detectadas en las pruebas de imagen son los tumores relacionados con epilepsia de larga evolución como los DNET (tumor disembrioplástico neuroepitelial), gangliogliomas, malformaciones vasculares como los cavernomas y malformaciones del desarrollo cortical como las displasias corticales de tipo II y III.
Existen distintos tipos de abordaje quirúrgico en los casos de epilepsia temporal farmacorresistente. La más utilizada ha sido la resección temporal anteromedial (RTAM), utilizada tanto en la epilepsia temporal mesial como la neocortical. Este abordaje, si se realiza en el hemisferio dominante para el lenguaje, puede causar déficits no únicamente de memoria verbal, sino también disnomia. La función de la denominación de palabras tanto en presentación visual como auditiva se sitúa en el polo temporal. Sin embargo, no todos los pacientes van a presentar disnomia posquirúrgica, aunque se considera que los pacientes que presentan poca reserva en funciones del lenguaje como la comprensión o la memoria lógica tienen más posibilidades de presentar estos déficits tras la cirugía28.
El segundo tipo de abordaje más frecuentemente empleado en la epilepsia temporal mesial es la amigdalohipocampectomía selectiva, que ha mostrado resultados similares a la RTAM en la literatura especializada; esta técnica quirúrgica es más restringida y reduce significativamente el riesgo de disnomia al extirpar solo el hipocampo y la amígdala. Si la evaluación prequirúrgica lo permite, puede ser una opción a considerar para minimizar los déficits posquirúrgicos31.
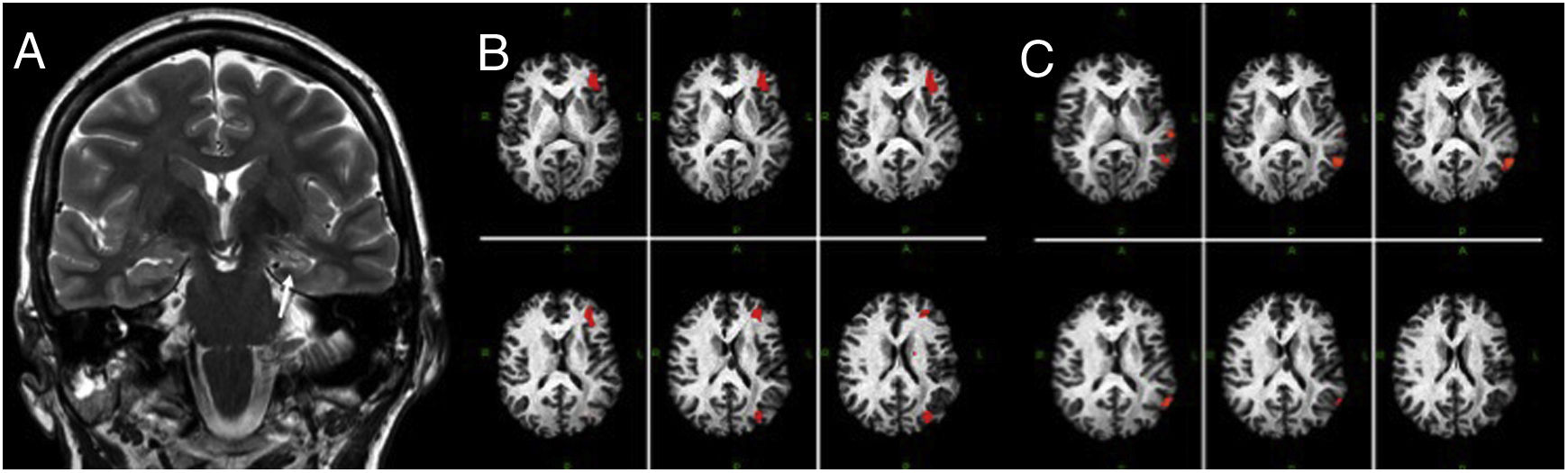
Previamente a la realización de una resección del lóbulo temporal es imprescindible averiguar el hemisferio dominante para el lenguaje. Es bien conocido que entre los pacientes epilépticos hay un alto porcentaje de pacientes zurdos con localizaciones atípicas del hemisferio dominante para el lenguaje32. Para ello, actualmente se puede utilizar la RM funcional del lenguaje mediante paradigmas de generación de palabras, denominación o de comprensión que permitirán obtener activaciones de las principales áreas del lenguaje (frontal inferior, temporal posterior y temporal anterior). Véase figura 3.
Paciente diestro con epilepsia temporal mesial izquierda. A) Corte coronal potenciado en T2 donde se observa la atrofia e hiperseñal del hipocampo izquierdo característicos de la esclerosis de hipocampo (flecha). B) Estudio de RM funcional con un paradigma de categorías semánticas que muestra una activación en las circunvoluciones frontales media e inferior y región parietotemporal izquierda. C) Estudio de resonancia mangética funcional, con paradigma de comprensión auditiva, donde se observa una activación izquierda en la región temporal posterior. Este paciente tiene un alto riesgo de pérdida de memoria y disnomia tras la resección quirúrgica del hipocampo, dado que se trata de un paciente con hemisferio izquierdo dominante para el lenguaje.
En las epilepsias de origen frontal, las crisis no se caracterizan por un aura específica33, aunque pueden presentar síntomas afectivos (miedo, terror, ansiedad, irritabilidad) y autonómicos (eructos, sed, palpitaciones, cambios en la respiración). Suelen presentar un inicio y fin abruptos, su duración es corta generalmente (inferior a 60 segundos), se agrupa a menudo en racimos (riesgo incrementado de SE), presenta rápida generalización secundaria y tiene predominio nocturno. La semiología es muy variable, aunque es frecuente la clínica motora ictal en forma de postura tónica de extremidades o axial, crisis focales de inicio motor (balanceo, movimientos pélvicos, flexión de tronco, rotación), crisis hipercinéticas (actividad motora intensa, pedaleo, intentos de salir corriendo) y vocalización compleja. Su comportamiento abigarrado provoca en ocasiones confusión y pueden ser diagnosticadas como eventos paroxísticos no epilépticos.
La epilepsia que se origina a nivel parietooccipital suele asociar auras y propagar rápidamente hacia los lóbulos temporal y frontal. Tras el aura, con frecuencia, presentan sintomatología de apariencia electroclínica frontotemporal24. La sintomatología somatosensorial, alteraciones de la imagen corporal y las ilusiones visuales complejas o alucinaciones (áreas de asociación visual) sugieren un foco epileptógeno parietooccipital. Las auras de tipo vertiginoso, auditivas complejas, perseverancia visual o fenómenos autoscópicos (percepciones alucinatorias complejas del propio cuerpo duplicado, en el espacio extrapersonal) implican a la zona de unión temporoparietooccipital34.
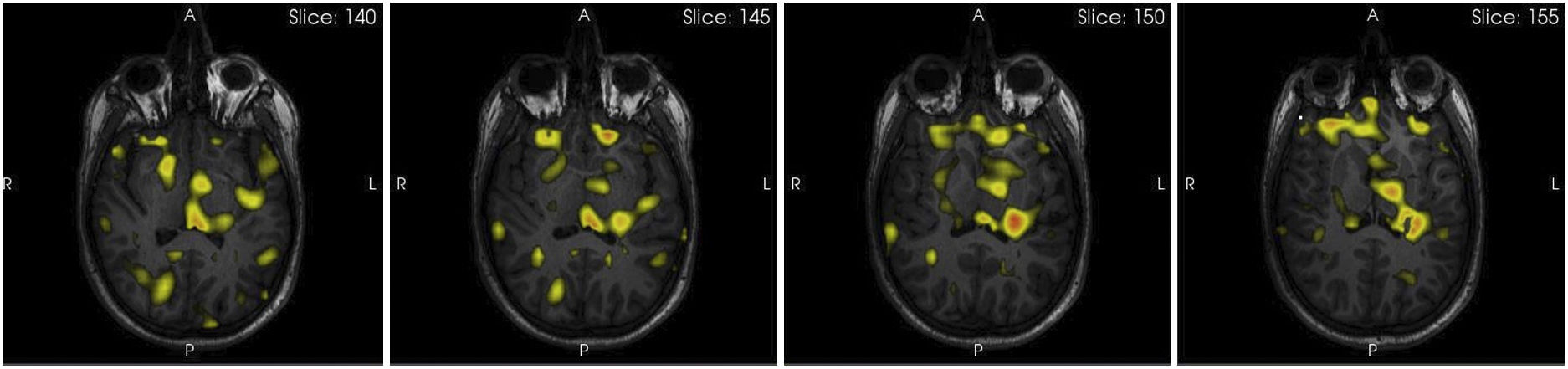
Las crisis insulares producen una clínica muy variable debido a sus extensas conexiones con regiones adyacentes, y dan lugar a sintomatología somatosensorial, visceral o motora, que puede simular crisis de otros orígenes. Suelen acompañarse de auras somatosensoriales, típicamente parestesias localizadas a nivel focal o involucrando amplios territorios cutáneos, o sensación de calor, tensión o corriente eléctrica. Se ha notificado con frecuencia la sensación de constricción orofaríngea, sensaciones dolorosas localizadas, disartria o disfonía, y manifestaciones motoras focales (fig. 4)13.
SISCOM (substracted ictal SPECT corregistred with MR). Paciente con probable epilepsia insular, en el que se observa el foco de mayor perfusión (en rojo) en la parte posterior de la ínsula izquierda y su rápida propagación hacia el tálamo homolateral y otras regiones, como las regiones mesiales frontotemporales.
En la epilepsia extratemporal, los estudios de neuroimagen tienen un rendimiento alto si se realiza un protocolo específico que abarque todo el cerebro con imágenes de alta resolución. Los hallazgos más frecuentes que se pueden observar son malformaciones del desarrollo cortical como displasias de tipo II o bien malformaciones congénitas del desarrollo cortical como heterotopias, polimicrogirias o alteraciones cerebrales residuales a eventos isquémicos, infecciosos o traumáticos previos.
Es evidente que si la zona epileptógena está situada en un área elocuente o en su cercanía, el paciente presentará déficits relacionados con esa área durante las crisis o de forma crónica. Si la lesión se localiza cerca de la corteza motora o sensitiva primaria, normalmente el paciente no será candidato a cirugía por los posibles déficits motores secundarios (fig. 5), mientras que si se localiza en el área suplementaria motora, los pacientes podrán presentar déficits motores y del lenguaje en el postoperatorio inmediato, con recuperación ad integrum posterior.
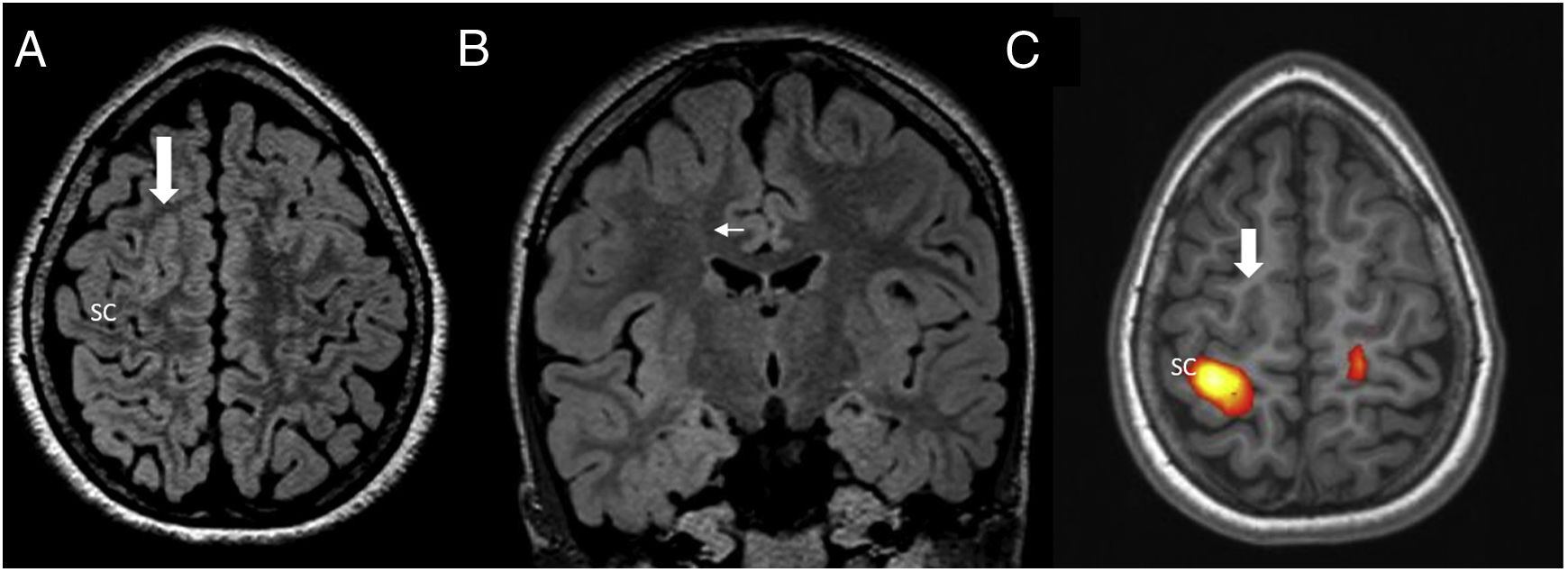
Displasia del fondo de surco en la región del córtex frontal superior derecho. A) Axial FLAIR donde se aprecia un engrosamiento del córtex frontal superior derecho, con leve aumento de señal FLAIR (flecha). B) FLAIR coronal que muestra parte del engrosamiento del córtex frontal y de la mala delimitación entre sustancia blanca y sustancia gris, un signo de transmanto que se extiende desde la región cortical afectada hasta el ventrículo (flecha), siendo sugestivo de y que se asocia a la displasia focal cortical tipo IIB. C) Resonancia magnética funcional con paradigma motor que consiste en tocar secuencialmente los dedos de la mano izquierda con el pulgar (finger tapping) y que produce activación de la corteza motora primaria. En este caso, la zona de activación se sitúa sobre el surco central (SC) indicando donde se sitúa el área motora primaria y su relación con la displasia cortical. Nótese que también se observa una pequeña activación en el área primaria motora izquierda. Esta activación ipsilateral a la mano utilizada en la tarea se puede observar sobre todo en movimientos complejos.
Por otro lado, si la zona afectada es la ínsula izquierda o región frontal izquierda, en un hemisferio dominante para el lenguaje, las opciones quirúrgicas disminuyen, ante el riesgo de déficit en funciones del lenguaje.
Los déficits visuales pueden ser muy evidentes en los casos de epilepsia de cuadrantes posteriores, pero también se pueden ver en la epilepsia temporal cuando se produce resección de las radiaciones ópticas o el asa de Meyer; por ello, el neurocirujano debe tener alta experiencia para mejor control de la morbilidad operatoria.
Si la lesión causante de epilepsia se localiza en un área elocuente y es una malformación del desarrollo cortical o una lesión residual a un evento ocurrido en los primeros años de la infancia, es posible que se haya producido el fenómeno de plasticidad cerebral y la función afectada se haya reorganizado en otra localización del cerebro. Un ejemplo sería el traslado de la función del lenguaje hacia el hemisferio sano (fig. 6). Sin embargo, esto no es siempre así; en ocasiones observamos que la malformación del desarrollo cortical situada en un área elocuente mantiene su función (fig. 7). Sin embargo, en estos casos es frecuente observar que se activan otras áreas relacionadas con la función35,36.
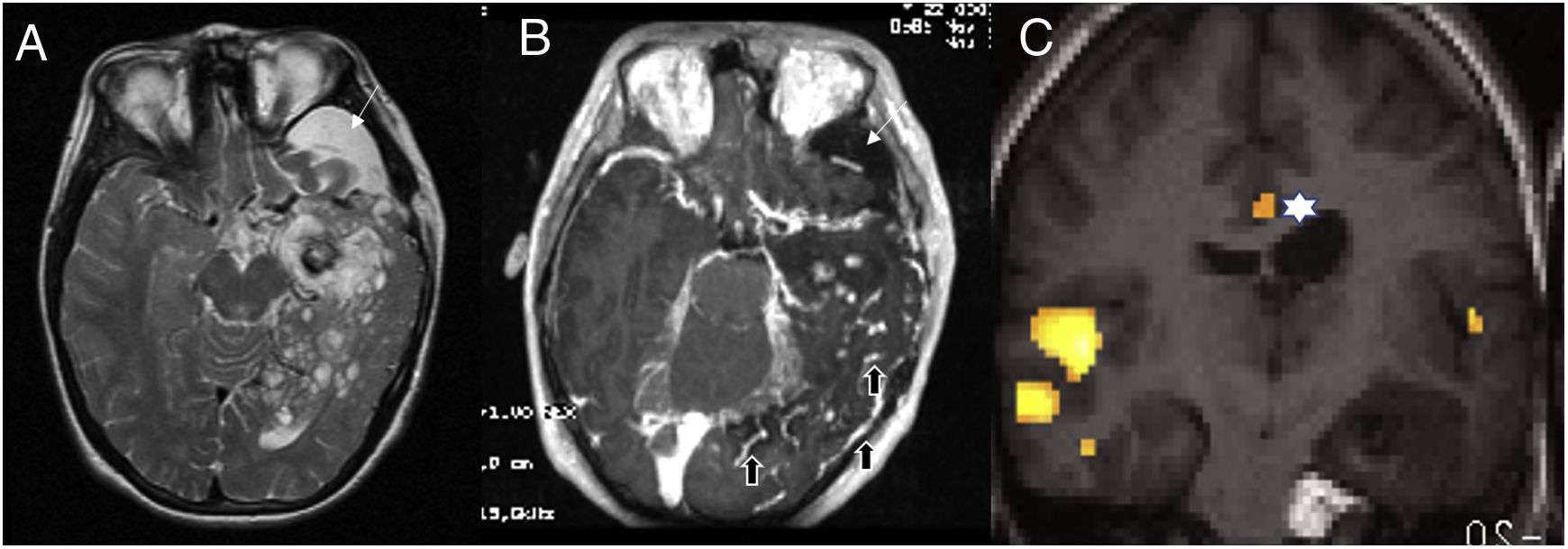
Síndrome de lipomatosis encefalocraneocutánea (facomatosis), paciente diestro. A) T2 axial y B) T1 axial con contraste que muestran una gran malformación del desarrollo cortical que afecta a la región temporooccipital izquierda y que muestra una marcada heterogeneidad de señal del parénquima con lesiones quísticas y nódulos captantes, un quiste de fosa media craneal (flecha larga) y una angiomatosis leptomeníngea (flechas gruesas). C) RM funcional con un paradigma de comprensión auditiva, donde el paciente tiene que oír una historia narrativa con intervalos en los que oye palabras leídas al revés para anular la activación auditiva primaria. Con este paradigma se espera activar la región temporal posterior y que corresponde al área de Wernicke. En este paciente, la activación se localiza principalmente en la región temporal derecha, con muy escasa activación temporal izquierda y activación del córtex cingular que se relaciona con la atención (estrella*) indicando probablemente que el lenguaje se ha transferido. Nótese que en la secuencia T1 existe un lipoma en el conducto auditivo interno que es característico de esta enfermedad.
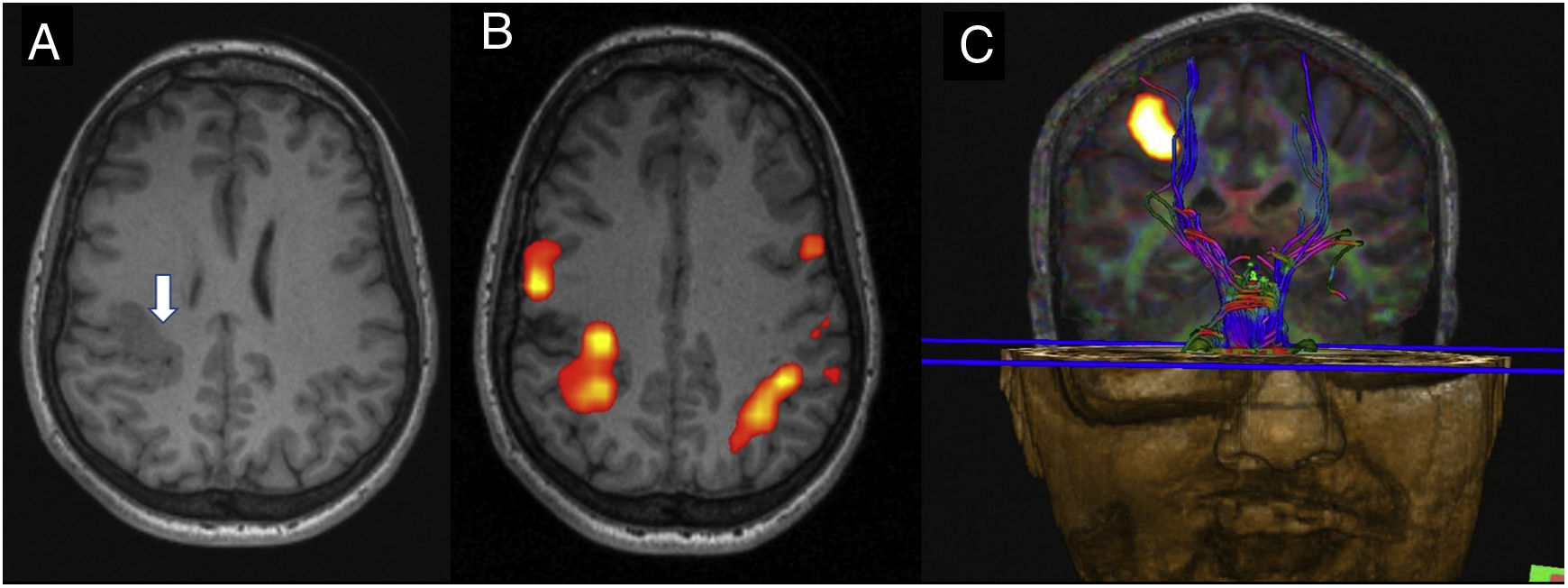
Malformación del desarrollo cortical (MDC) localizada en la región perirrolándica derecha. A) T1 axial que muestra un engrosamiento irregular del córtex en dicha región (flecha). B) Resonancia magnética (RM) funcional motora con movimiento complejo de los dedos de la mano izquierda que muestra activación en el área displásica, aunque también hay activación contralateral. Se observa una activación bilateral de las áreas motoras primarias. Al tratarse de una MDC localizada en el área motora primaria, se podría hipotetizar que para poder realizar la tarea requiere de más contribución cortical ipsilateral, ya que probablemente la función motora en el córtex displásico no es tan efectiva. La activación ipsilateral al movimiento de la mano se puede encontrar en casos en que la tarea sea compleja, se haya realizado con alta frecuencia y si se realiza con la mano no dominante. Esta activación bilateral se cree que proviene o bien por la existencia de fibras de proyección no cruzadas unilaterales o bien por conexiones interhemisféricas transcallosas. C) Fusión de RM funcional motora de mano izquierda y tractografía con imagen con tensores de difusión que muestra el desplazamiento medial de la vía piramidal adyacente a la displasia que mantiene la función elocuente motora.
Establecer dónde se localizan las funciones cerebrales, motoras, visuales y del lenguaje mediante la RM funcional, antes de realizar una intervención quirúrgica, es por tanto importante.
ConclusiónEn el manejo radiológico de los pacientes con epilepsia es fundamental conocer si se trata de crisis generalizadas o focales, y de estas últimas, también es importante conocer la orientación del neurólogo acerca de la zona epileptógena, es decir, el lugar donde se generan las crisis, ya que esto condicionará el tipo de protocolo de RM a emplear según el tipo de lesiones que se espera encontrar.
La neuroimagen es también fundamental en la decisión quirúrgica, ya que usando técnicas avanzadas como la RM funcional o la DTI (imagen con tensores de difusión) proporcionamos información funcional y microestructural que condicionará el abordaje quirúrgico y a su vez el pronóstico de estos pacientes.
FinanciaciónEste estudio esta parcialmente financiado por el ISCIII PI17/01211.
Conflicto de interesesAmbas autoras declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a CERCA Programme/Generalitat de Catalunya.