La demencia es una enfermedad cada vez más frecuente en la población que envejece. Se revisa su prevalencia, encabezada por la enfermedad de Alzheimer, seguida por la demencia vascular, la demencia de cuerpos de Lewy y la degeneración lobar frontotemporal. Aunque son entidades distintas, presentan síntomas superponibles y comorbilidades frecuentes. Se revisa la importancia de reconocer los síntomas y signos precoces de la demencia y de advertir las diferencias claves entre ellas. Se ilustra, desde el punto de vista radiológico, lo fundamental que es diferenciar las que son reversibles y establecer la forma de seguimiento de las no reversibles.
Dementia is becoming more common as the population ages. We review the prevalence of different causes of dementia. Alzheimer's disease heads the list, followed by vascular dementia, Lewy body dementia, and frontotemporal lobar degeneration. Although these are distinct entities, their symptoms overlap and they have many comorbid conditions in common. We review the importance of recognizing the early symptoms and signs of dementia and point out the key differences between different types of dementia. We illustrate the fundamental importance of differentiating between reversible and irreversible disease on imaging and of establishing the follow-up of patients with irreversible conditions.
Somos lo que recordamos
Italo Calvino
IntroducciónEl término demencia hace alusión al síndrome de deterioro intelectual persistente del intelecto manifestado por alteración en la memoria como hallazgo cardinal, además de otros trastornos cognitivos y de la personalidad. La inmensa mayoría son progresivas, y sólo es reversible el 15% de ellas (tabla 1). Como reversible, se entiende la búsqueda de una etiología que requiera un tratamiento específico, aunque el paciente no recupere completamente el deterioro cognitivo previo1.
Causas de demencias tratables: déficit cognitivo no necesariamente reversible
| Causas tratables | Diagnósticos que se han de identificar |
| Vasculares | Enfermedad multiinfarto, infarto cerebral silencioso, hematoma subdural crónico, hematomas parenquimatosos, vasculitis primaria del sistema nervioso central y vasculitis secundarias (p. ej., colagenopatías) |
| Endocrinas metabólicas | Enfermedad tiroidea, paratiroidea, hepática, síndrome de Cushing, enfermedad de Addison, hipopituitarismo, insuficiencia renal, insuficiencia hepática, porfiria, deficiencia de vitamina B12, déficit de folatos, pelagra, deficiencia de tiamina, enfermedad de Wilson, hipo o hipermagnesemia, hipo o hipercalcemia, deshidratación, encefalopatía inducida por diálisis, hiperlipidemia, insulinoma |
| Tóxicas | Fármacos (anticolinérgicos, antihistamínicos, neurolépticos), alcohol, metales pesados (arsénico, plomo, mercurio), manganeso |
| Infecciosas | Neurosífilis, micosis, enfermedad de Lyme, complejo demencia-sida, encefalitis herpética, meningitis bacteriana, otras encefalitis virales, enfermedad de Whipple, leucoencefalopatía multifocal progresiva |
| Neoplásicas | Tumores primarios y metastásicos, síndromes paraneoplásicos |
| Traumáticas | Higromas, hematomas, contusión hemorrágica, daño anoxicoisquémico |
| Hidrocefalia | Comunicante frente a no comunicante, crónica del adulto |
| Neuropsiquiátricas | Depresión, delirio, enfermedad bipolar |
| Autoinmunes | Sarcoidosis, lupus eritematoso generalizado, síndrome de Sjögren, enfermedad de Behçet, arteritis temporal, vasculitis sistémicas, púrpura trombocitopénica trombótica |
| Misceláneas | Esclerosis múltiple, síndrome hipereosinofílico idiopático, enfermedad pulmonar obstructiva crónica, síndrome de apnea obstructiva del sueño, insuficiencia cardíaca congestiva, demencia inducida por radiación |
| Mixtas | Combinación de las anteriores |
Reproducida de referencia1, con permiso de Viguera Editores.
Es un gravísimo problema de salud y es la sexta causa de muerte en España2. De los 4 millones mayores de 80 años que hay, 170.000 personas enfermarán cada año (85‰) en medio de una expectativa de vida en aumento. Dada esta alta prevalencia, es necesario que los radiólogos conozcan los principales rasgos de estas enfermedades.
No hay un mecanismo fisiopatológico único que produzca todas las clases de demencia, pero el destino final es la pérdida de neuronas (o de sus conexiones) en una o más de las regiones corticales de asociación multimodal (córtex prefrontal, sistema límbico y lóbulo parietal). Aunque la etiología de la mayoría es desconocida, los factores de riesgo asociados son la edad, el bajo nivel cultural y los ictus3. El riesgo cardiovascular agrava el curso de la demencia y, en la mediana edad, el factor más deletéreo es la hipertensión y, posteriormente, la diabetes4. Si bien son un complejo grupo de difícil clasificación, se tiende a clasificarlas basándose en la inmunohistoquimia, especialmente con el tipo de proteína que se acumula y que se relaciona con el daño cerebral5. Así, la enfermedad de Alzheimer (EA) presenta depósitos de proteína β-amiloide, mientras que la degeneración lobar frontotemporal (DLF) comprende el grupo de las taupatías, con inclusiones de proteína tau. La demencia con cuerpos de Lewy pertenece a las sinucleinopatías neuronales progresivas, que se caracterizan por la formación de cuerpos y neuritas de Lewy (inmunorreactivos para α-sinucleína) mientras la enfermedad de Creutzfeldt-Jakob (ECJ) se debe a un acúmulo de la partícula proteinácea infecciosa no viral llamada prión5.
ClínicaLa mayoría de pacientes desarrolla pérdida del cociente intelectual, que empieza habitualmente con pérdida de memoria, tiene dificultad en aprender nueva información y expresa sutiles afasias y apraxias, que luego se agravan. Independientemente de la demencia, los estadios de afectación se gradúan según las escalas Clinical Dementia Rating (CDR), entre 0 y 3, así como la Global Dementia Scale (GDS), entre 0 y 76.
El deterioro cognitivo ligero (DCL) es el término usado para describir los signos y síntomas más precoces de una demencia5, que se clasifica como 0,5 en la escala CDR. El DCL presenta únicamente deterioro subjetivo de la memoria, que se corrobora por el acompañante y el paciente tiene pruebas de memoria que están, al menos, 1,5 desviaciones estándar por debajo del rango normal para su edad y educación. El estudio a largo plazo de estos individuos con DCL muestra que el 4% por año desarrollan demencia, comparados con el 1% de los controles emparejados por edad7. Los primeros cambios patológicos afectan a las neuronas de proyección de la circunvolución parahipocampal. Esto se traduce en cambios en el córtex entorrinal y el hipocampo que pueden llegar a visualizarse en resonancia magnética (RM). El paso de envejecimiento cerebral “normal” a la fase de demencia preclínica ocurre lentamente y, todavía, no hay evidencia de que este cambio sea detectable. En el momento actual, las pruebas de memoria episódica son los mejores predictores neuropsicológicos de conversión de demencia preclínica a demencia8,9. Cuando se evalúa a esta población, siempre es adecuado tener presente los cambios que aparecen en el envejecimiento neurológicamente normal mediante los estudios de neuroimagen:
- •
Pérdida de volumen cortical a partir de los 40 años, con aumento de los espacios subaracnoideos10. La pérdida de volumen anual para el sujeto normal es de un 0,45% por año, frente al paciente con demencia que sería del 1% anual10. Hay un gradiente anteroposterior, y se afectan más los córtex de asociación y menos las áreas primarias10,11.
- •
Hiperintensidades de sustancia blanca periventriculares (en halo) y lesiones puntiformes subcorticales no confluentes12. Presentan un gradiente periatrial a frontal, habiendo también una pérdida de volumen de la sustancia blanca, con una tasa de 0,23% anual10.
- •
Infartos lacunares (≥3mm) en la quinta década de la vida hasta en un 10% de la población. Esta frecuencia aumenta con la edad, y llega al 35% en la novena década11. Cuanto mayor número de infartos y lesiones de sustancia blanca, más frecuente es el deterioro cognitivo subclínico13.
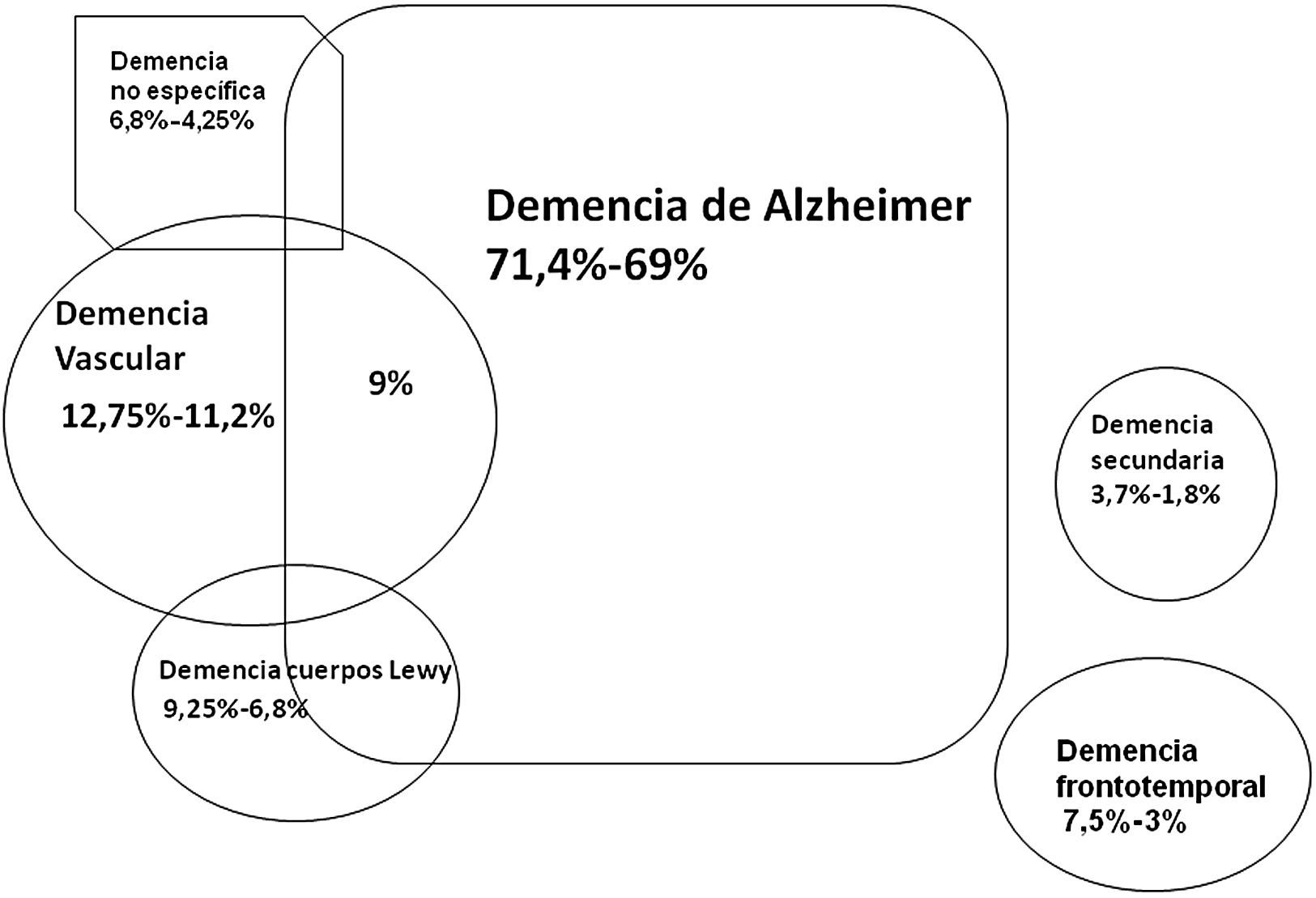
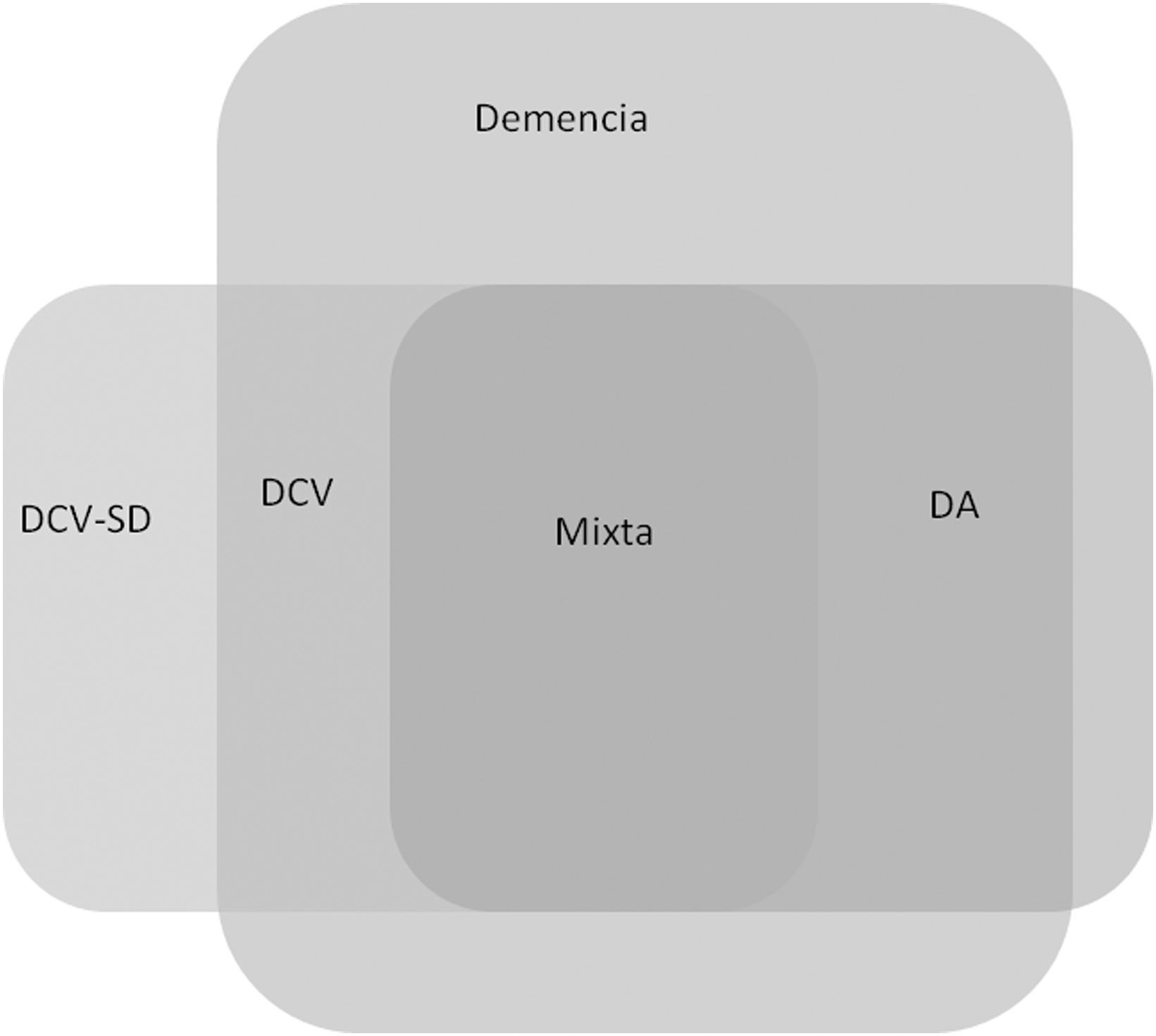
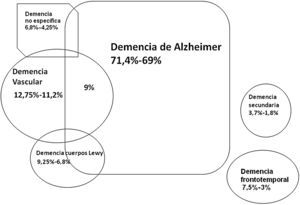
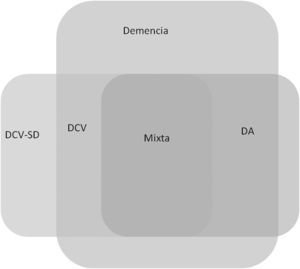
La demencia de Alzheimer es la más frecuente en nuestro medio, seguida por la demencia vascular (DV) y la demencia con cuerpos de Lewy14 (fig. 1). Dependiendo de los grupos étnicos, la segunda causa la ocupa la demencia con cuerpos de Lewy, y la tercera es la DLF, especialmente en zonas donde hay antecedentes europeos15.
Esquema de las prevalencias actuales de los distintos tipos de demencia con criterios estrictos (no restrictivos) en España, basado en los datos de referencias 3 y 14. La demencia de cuerpos de Lewy también incluye la demencia asociada a parkinsonismo en general3.
En los pacientes menores de 65 años, denominada demencia de comienzo temprano, las etiologías difieren. Así, disminuye la EA y son más prevalentes las asociadas a traumatismos, alcohol y la asociada al virus de la inmunodeficiencia humana (VIH)16.
Beneficios y problemas del diagnóstico precozAdemás de identificar las causas físicas y psíquicas tratables, permite el tratamiento de la comorbilidad, así como el apoyo psicológico y el tratamiento farmacológico sintomático, que es más efectivo en sus primeras fases, al carecer de tratamiento etiológico. El diagnóstico suele hacerse tardío, entre otras razones, por el comienzo insidioso y variable del síndrome, sin clara delimitación hasta fases avanzadas. Pacientes, familias y médicos son reacios, en general, al diagnóstico, porque es una enfermedad tan seria y poco modificable que comporta un gran estigma8.
Diagnóstico de la demenciaEs un diagnóstico fundamentalmente clínico, que se basa en la tríada de anamnesis, información del acompañante y estudio cognitivo8,9.
El uso de neuroimagen estructural está ampliamente aceptado, y está recomendado tanto por la Sociedad Española de Neurología como por la Academia Americana de Neurología17,18. No hay evidencia para decir cuál técnica de neuroimagen es mejor. La tomografía computarizada (TC) es la más disponible y es válida para descartar la mayoría de las causas reversibles. La RM suele ser la técnica de elección para la DV dada su superior sensibilidad a los cambios vasculares19,20. En la tabla 2 se expone un protocolo de exploración.
Protocolo de imagen para estudios de demencia¿
| Tomografía computarizada | Resonancia magnética |
| Generalmente para descartar demencias tratables | Sagital T1 |
| Seguimiento+. Cortes orientados con el plano del lóbulo temporal con espesor de 2–3mm | Axial DP y T2 (o al menos T2) |
| Coronal FLAIR/STIR | |
| Axial potenciado en difusión B0/B 1.000s/mm2 | |
| Axial eco de gradiente potenciado en T2¿ | |
| ++ 3D eco de gradiente T1. Tamaño del vóxel 0,86mm×0,86mm×1,6mm | |
| +++ espectroscopia con secuencia PRESS, 128 repeticiones. Dos tiempos de eco (TE, 31 y 136 ms) y un mismo tiempo de repetición (TR) de 2.000ms |
+: seguimiento: enfermos que no pueden ser explorados por resonancia magnética; ++: estudios de volumetría; +++: espectroscopia. Al menos tiempo de eco (TE) corto y localización en cíngulo posterior.
Hay evidencia de que la imagen estructural influye el tratamiento del paciente durante la evaluación inicial de demencia19,20. En los pacientes menores de 65 años de edad, la presencia de signos de focalización y la corta duración de la evolución del deterioro cognitivo (menos de 1 año) son características que hacen que el estudio de neuroimagen sea probablemente de mayor utilidad1,16. En este grupo, la imagen permite detectar lesiones en la sustancia blanca, las vasculares, las óseas y las etiologías como las infecciosas o postraumáticas, no tan comunes en el grupo más anciano1.
Sin embargo, la precisión diagnóstica de la neuroimagen estructural no es mayor con la medición de volúmenes que con la evaluación visual de la atrofia, especialmente en casos leves. La exactitud es todavía comparable al examen clínico y hay estudios en los que la evaluación visual supera a la volumetría19. Es importante mencionar que muchos de los hallazgos encontrados en la imagen no tienen confirmación patológica y, por tanto, representan el síndrome clínico y no la patología11.
Objetivos de la imagen- •
Excluir una causa potencialmente reversible de la demencia. En nuestro medio sólo son demencias tratables entre el 1 y el 15%1.
- •
Valorar el subtipo específico de demencia, en particular para diferenciar EA de DV y de la DLF.
- •
Como objetivos futuros de la imagen, que todavía no pueden prestarse, estarían:
- •
Cuantificar el estadio de la enfermedad para seguir su respuesta al tratamiento.
- •
Identificar sujetos que puedan responder al tratamiento.
- •
La EA es una demencia progresiva neurodegenerativa de presentación tardía, sólo el 10% de los casos ocurre en menores de 65 años. Su característica patológica definitoria es la acumulación de ovillos neurofibrilares y placas seniles. La mayoría de casos son esporádicos y el principal gen de susceptibilidad asociado con estos casos es la apolipoproteína (Apo) ε. El alelo más prevalente en la población general es el ε3, aproximadamente un 80%. La forma ε4 se asocia a un riesgo elevado de EA, llegando en los homocigotos a un 50–90% de probabilidades, en contraste con el 20% de la población general6.
Esta enfermedad implica disfunción cognitiva por pérdida de neuronas y sinapsis. Comienza en el córtex límbico y, según progresa la enfermedad, se extiende al neocortéx. Además del lóbulo temporal, hay cambios funcionales y morfológicos en otras regiones, como el cíngulo posterior. La tomografía por emisión de positrones (PET) identifica esta área como la región funcional más precozmente afectada del cerebro, tanto en pacientes con EA precoz como en portadores asintomáticos del alelo ApoE ε421. Además de los cambios histopatológicos, hay una pérdida gradual de función colinérgica, que es la base del tratamiento inhibidor de la colinesterasa, que es la enzima que degrada el neurotransmisor acetilcolina. Mediante su inhibición, se logra un mayor nivel de interconexión neuronal, retrasando el declive cognitivo22. Las lesiones vasculares frecuentemente coexisten con la EA, considerándose actualmente que la EA y la DV pueden actuar de forma sinérgica. Además, hay crecientes pruebas de una etiopatogenia común23.
EpidemiologíaEs la causa más frecuente de demencia y su prevalencia aumenta con la edad. En España la prevalencia de demencia en mayores de 65 años es del 9,2%, más alta en mujeres (11,1%), que en varones (6,5%). Esta prevalencia aumentan con la edad hasta los nonagenarios, donde se estabiliza en un 25–54%2,3,14.
DiagnósticoSon válidos los criterios diagnósticos utilizados, tanto del Manual diagnóstico y estadístico de enfermedades mentales (DSM-IIIR) como del National Institute of Neurologic, Communicative Disorders y Stroke-Alzheimer Disease and Related Disorders Association (NINCDS-ADRDA), aunque se prefiere este último20. Sin embargo, presentan limitaciones que pueden variar con la gravedad de la enfermedad y la pericia del clínico19. El diagnóstico de certeza de EA no puede ser sólo clínico y requiere una confirmación histológica. Con los datos clínicos sólo se puede llegar al diagnóstico de posible o probable EA. Las recomendaciones más recientes de diagnóstico post mortem de EA definen la EA como una entidad clinicopatológica, y hacen hincapié en la impresión clínica para el diagnóstico patológico.
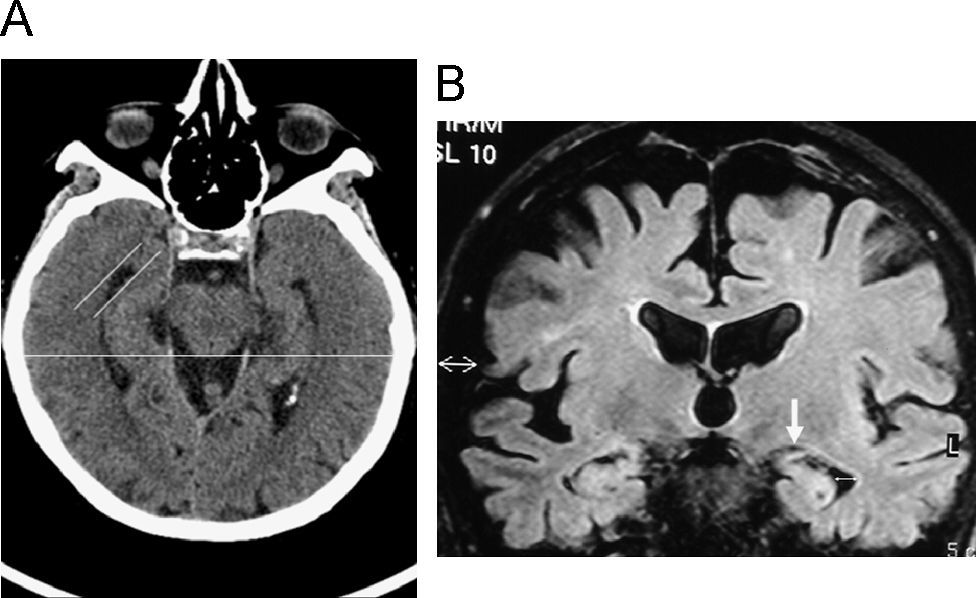
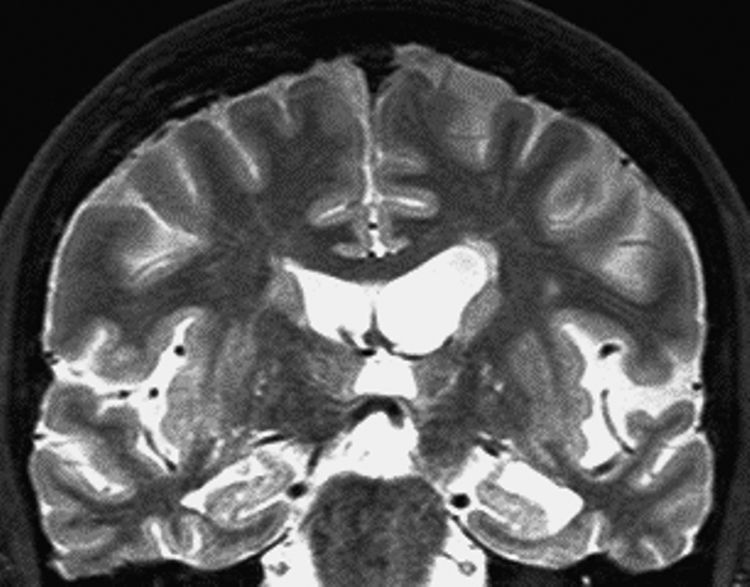
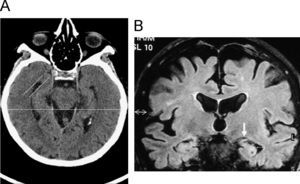
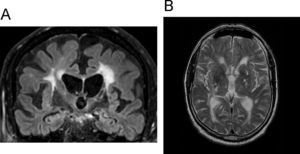
Hallazgos radiológicos fundamentalesLos hallazgos característicos de la EA no son fácilmente apreciables en los estadios iniciales, en los que hay una pérdida difusa de volumen cortical. Según progresa la enfermedad se muestra una acelerada pérdida de volumen focal en los lóbulos temporales mediales, en particular el hipocampo, la circonvolución parahipocampal, el córtex entorrinal y la amígdala. En la práctica clínica, la anchura del asta del ventrículo lateral es la medida más reproducible para evaluar esta atrofia (fig. 2). La TC es una técnica válida; habitualmente también es la primera prueba que se realiza, especialmente si hay contraindicaciones a la práctica de RM. Con TC adquirida en el plano orbitomeatal, la medida más adecuada para distinguir la enfermedad es la anchura del asta temporal del ventrículo lateral. Con estos planos, se obtiene un cociente de la anchura radial del asta temporal respecto al diámetro biparietal (fig. 2A). Así, se ajusta la pérdida de volumen al diámetro cefálico, siendo más útiles para seguimiento individual y diferencias intergrupos. Los sujetos normales presentan una media de 0,025, los pacientes con EA de 0,038 y aquellos con EA con extensas lesiones de sustancia blanca de 0,04424.
A) Medición de la atrofia del lóbulo temporal en tomografía computarizada (TC). Orientación del lóbulo temporal, imagen axial de TC en la que se muestra la medición de la anchura del asta temporal del ventrículo lateral respecto al diámetro biparietal. B) Atrofia del lóbulo temporal en resonancia magnética. Imagen coronal potenciada en FLAIR que muestra el método de medida del ancho del asta temporal del ventrículo lateral (flecha doble) así como de la cisura coroidea (flecha gruesa).
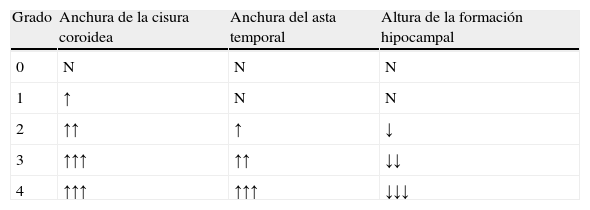
Con RM (fig. 2B), el mejor plano es el coronal y se debe evaluar siempre en el mismo nivel (p. ej., cuerpos mamilares) para comprobar su evolución. Con una escala de sólo 5 grados se puede conseguir una adecuada precisión diagnóstica, entre el 83 y el 96% (tabla 3; fig. 3)25. Un estudio realizado con RM en población italiana por encima de 60 años, ha estimado que para EA leve el asta temporal mide 6,5mm y para EA avanzada, 7,2mm. Manteniendo una especificidad del 95% para ambos, su sensibilidad es del 74% para la EA leve y del 82% para EA moderada26.
Criterios de Scheltens et al para la valoración de la atrofia de lóbulos temporales25
| Grado | Anchura de la cisura coroidea | Anchura del asta temporal | Altura de la formación hipocampal |
| 0 | N | N | N |
| 1 | ↑ | N | N |
| 2 | ↑↑ | ↑ | ↓ |
| 3 | ↑↑↑ | ↑↑ | ↓↓ |
| 4 | ↑↑↑ | ↑↑↑ | ↓↓↓ |
↑: aumento; ↓: disminución; N: normal.
La validez de las técnicas de imagen como marcadores intermedios para la eficacia terapéutica en la EA no se ha probado en un ensayo clínico positivo con un fármaco que modifique la enfermedad. Por lo tanto, la evidencia es insuficiente para recomendarlas en la práctica clínica19.
Respecto a la morfometría basada en vóxeles (MBV), la tasa de variación de los volúmenes del hipocampo en estudios de RM consecutivos se ha mostrado como el marcador volumétrico más específico para la identificación de una EA precoz27. Sin embargo, la atrofia medial del lóbulo temporal no es específica para EA y se ve en otras demencias, lo que limita su utilidad para el diagnóstico diferencial19. Aunque ocurre de forma temprana, tanto en DCL y en EA, la superposición es demasiado grande para tener valor en pacientes individuales. Hay recientes datos de que la VBV automática de todo el cerebro clasifica tan bien como el diagnóstico clínico28.
La precisión diagnóstica de la espectroscopia 1H por RM (H1ERM), la tomografía por emisión de fotón único (SPECT) o la PET no es mayor que la de los criterios clínicos en EA —evidencia moderada—19. Aun así, estas 2 últimas técnicas funcionales parecen adecuadas para diferenciar la DLF y demencia con cuerpos de Lewy respecto a la EA19. La H1ERM revela un descenso de N-acetilaspartato y un incremento de mio-inositol en la EA respecto a sujetos sanos, medido en parietal posterior. La RM funcional muestra activación disminuida en varias regiones, incluido el lóbulo temporal en tareas de memoria en estos pacientes comparado con sujetos controles24,29. La PET muestra un patrón anormal de baja captación de F18-fluordeoxiglucosa en regiones cingular posterior, precúneo, temporoparietal y cortex frontal. Similares patrones de hipoperfusión se han identificado con la SPECT y la RM de perfusión con contraste30, aunque la PET diferencia mejor EA y pacientes control. Hay una moderada evidencia de que la PET en la demencia precoz puede aumentar la precisión del diagnóstico clínico sin añadir costes globales19. Se espera una mayor exactitud (90%) con el PIB-PET, con un ligando específico para la proteína β-amiloide30. Estas técnicas funcionales y espectroscópicas no son coste-efectivas para el diagnóstico de la EA actualmente, asumida la mínima efectividad farmacológica actual (moderada evidencia). Si apareciera un fármaco que cambiara significativamente el curso de la enfermedad, podría cambiar el coste-efectividad de las pruebas diagnósticas19.
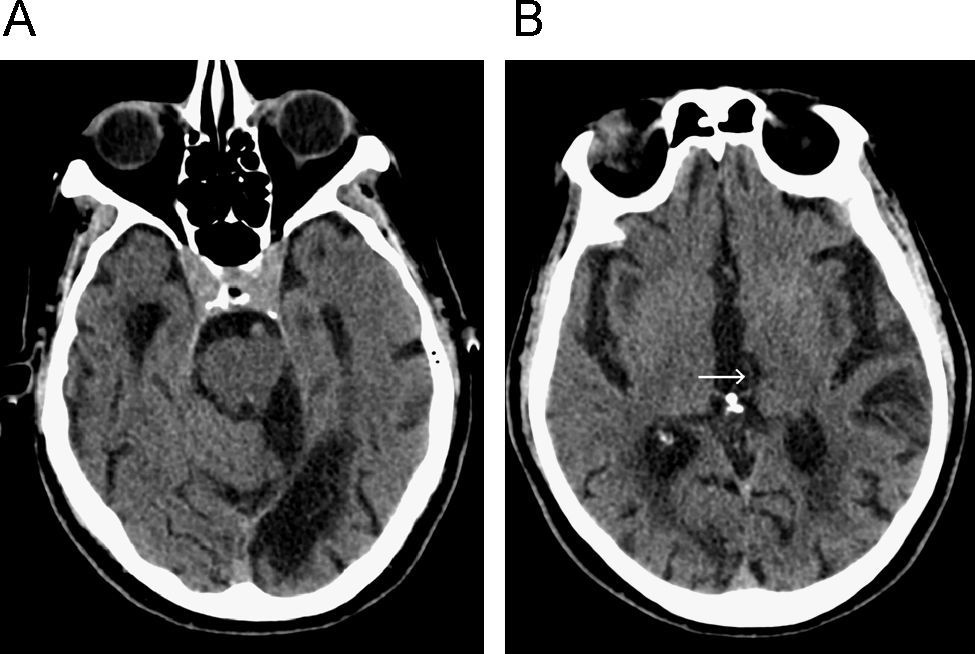
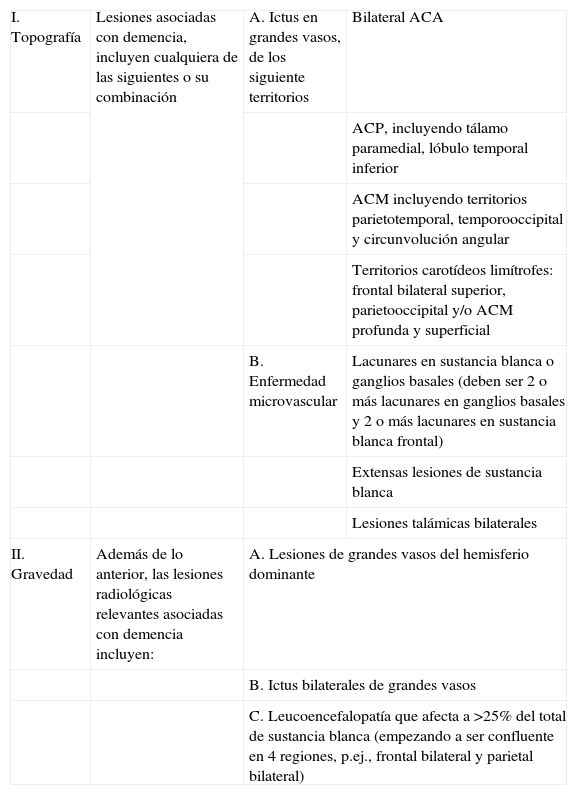
Demencia vascularDatos patológicos, clínicos y generalesEs la segunda forma más frecuente de demencia y ningún patrón específico de deterioro cognitivo puede diferenciarla de la EA, aunque predomina la sintomatología disejecutiva17. Las pruebas de imagen son imprescindibles para su diagnóstico, pero no hay evidencia de su impacto. Los criterios más utilizados para su aplicación son los NINDS-AIREN20,31 (tabla 4), aunque son poco sensibles (50%) y altamente específicos (85%)17. Es decir, si un paciente los cumple, casi seguro que será una DV. Estos criterios son de difícil aplicación, porque además de la topografía del infarto se requiere su gravedad32, y más variables que en la EA (p. ej., el infarto de la arteria cerebral posterior tiene que ser bilateral) (fig. 4A). Además, hay 4 localizaciones estratégicas donde un infarto, por sí solo, puede ser responsable del deterioro cognitivo: hipocampo, tálamo medial, núcleo caudado y lóbulo parietal derecho32 (fig. 4B).
Demencia vascular. Criterios de gradación de los criterios NINDS-AIREN
| I. Topografía | Lesiones asociadas con demencia, incluyen cualquiera de las siguientes o su combinación | A. Ictus en grandes vasos, de los siguiente territorios | Bilateral ACA |
| ACP, incluyendo tálamo paramedial, lóbulo temporal inferior | |||
| ACM incluyendo territorios parietotemporal, temporooccipital y circunvolución angular | |||
| Territorios carotídeos limítrofes: frontal bilateral superior, parietooccipital y/o ACM profunda y superficial | |||
| B. Enfermedad microvascular | Lacunares en sustancia blanca o ganglios basales (deben ser 2 o más lacunares en ganglios basales y 2 o más lacunares en sustancia blanca frontal) | ||
| Extensas lesiones de sustancia blanca | |||
| Lesiones talámicas bilaterales | |||
| II. Gravedad | Además de lo anterior, las lesiones radiológicas relevantes asociadas con demencia incluyen: | A. Lesiones de grandes vasos del hemisferio dominante | |
| B. Ictus bilaterales de grandes vasos | |||
| C. Leucoencefalopatía que afecta a >25% del total de sustancia blanca (empezando a ser confluente en 4 regiones, p.ej., frontal bilateral y parietal bilateral) | |||
ACA; ACM; ACP.
Una lesión se considera confluente cuando mide más de 20mm o consiste en 2 o más lesiones más pequeñas.
Derechos de reproducción del National Institute of Neurological Disorders and Stroke, Gobierno de Estados Unidos.
Demencia vascular. A) Imagen axial donde se observa un infarto en territorio de arteria cerebral posterior izquierda. B) Tomografía computarizada axial donde se observa un infarto en tálamo medial (flecha). Esta lesión, por sí sola ya es responsable de la clínica de deterioro cognitivo.
Los mejores predictores del diagnóstico de DV son, en orden decreciente de importancia: a) relación temporal entre un ictus y el comienzo de la demencia; b) ictus de sustancia gris bilaterales (frontales, temporales, parietales, ganglios basales o tálamos), y c) síntomas o signos de ictus previos.
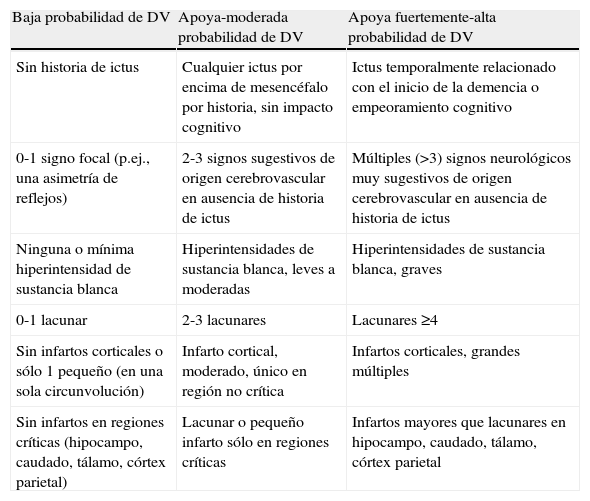
Para solventar estas dificultades hay unos criterios más funcionales que pueden aplicarse en la práctica clínica (tabla 5), pero no se ha documentado su mayor efectividad respecto a los NINDS-AIREN33. La DV puede ser el resultado de un único infarto estratégico, múltiples infartos corticales o lacunares, o bien de lesión microvascular, en la cual ni hay síntomas de ictus ni infartos en la imagen. Sin embargo, la neuroimagen no puede confirmar fiablemente la cronología de las lesiones ni informar la contribución relativa de los procesos degenerativos y/o isquémicos en la clínica34,35. Dada la baja sensibilidad de los criterios NINDS-AIREN para detectar estos pacientes y la comorbilidad de factores de riesgo (más de la mitad de las demencias vasculares son mixtas con EA), se ha propuesto un nuevo modelo de clasificación del deterioro cognitivo y la demencia35 (fig. 5). Hay una forma de demencia de origen vascular que afecta a pacientes jóvenes, denominada enfermedad de CADASIL (arteriopatía autosómica dominante con infartos subcorticales y leucoencefalopatía). Es una enfermedad hereditaria reconocida recientemente que se caracteriza por ataques isquémicos transitorios, ictus, demencia subcortical progresiva, migrañas y cambios en el humor31.
Criterios de demencia vascular (DV) en la práctica clínica
| Baja probabilidad de DV | Apoya-moderada probabilidad de DV | Apoya fuertemente-alta probabilidad de DV |
| Sin historia de ictus | Cualquier ictus por encima de mesencéfalo por historia, sin impacto cognitivo | Ictus temporalmente relacionado con el inicio de la demencia o empeoramiento cognitivo |
| 0-1 signo focal (p.ej., una asimetría de reflejos) | 2-3 signos sugestivos de origen cerebrovascular en ausencia de historia de ictus | Múltiples (>3) signos neurológicos muy sugestivos de origen cerebrovascular en ausencia de historia de ictus |
| Ninguna o mínima hiperintensidad de sustancia blanca | Hiperintensidades de sustancia blanca, leves a moderadas | Hiperintensidades de sustancia blanca, graves |
| 0-1 lacunar | 2-3 lacunares | Lacunares ≥4 |
| Sin infartos corticales o sólo 1 pequeño (en una sola circunvolución) | Infarto cortical, moderado, único en región no crítica | Infartos corticales, grandes múltiples |
| Sin infartos en regiones críticas (hipocampo, caudado, tálamo, córtex parietal) | Lacunar o pequeño infarto sólo en regiones críticas | Infartos mayores que lacunares en hipocampo, caudado, tálamo, córtex parietal |
Traducida y reproducida de Mayo Clin Proc. 2006;81:223–30, con permiso de Dowden Health Media.
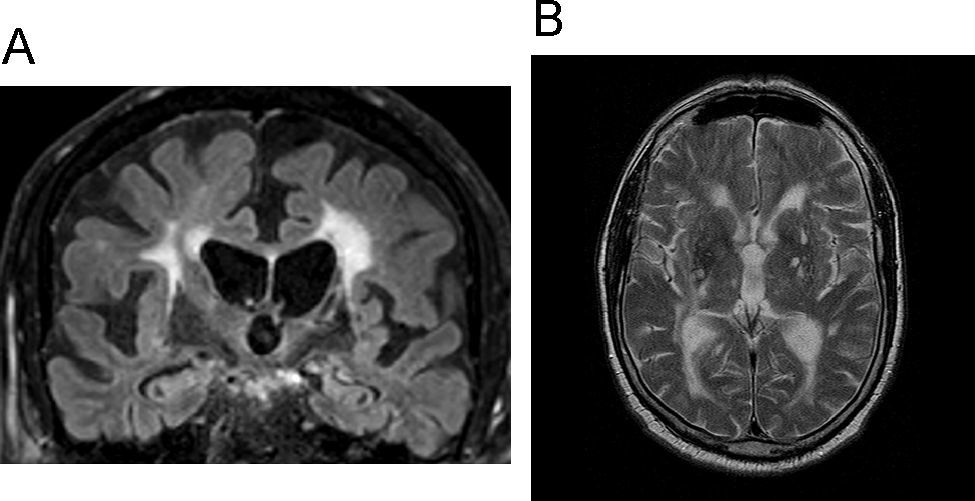
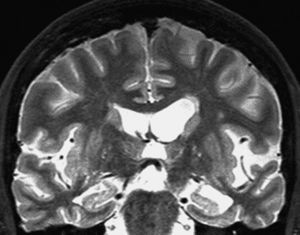
La RM es la prueba idónea para demostrar las lesiones20,33. Los hallazgos característicos son infartos corticales, lacunares y extensas lesiones de sustancia blanca, también conocidas como leucoaraiosis. Las imágenes siempre tiene que contar con una secuencia T2, dada la insensibilidad del FLAIR (fluid attenuated inversión recovery) a los infartos talámicos (fig. 6)36. Las lesiones presentes en CADASIL son fundamentalmente subcorticales, en los lóbulos temporal anterior y frontal con afectación de las fibras U, mientras el córtex está respetado.
Demencia vascular. A) Imagen coronal potenciada en FLAIR que muestra lesiones de sustancia blanca y probables lesiones en ambos tálamos de predomino izquierdo. B) Imagen axial potenciada en T2 que muestra infartos lacunares en ambos tálamos con mucha más nitidez que la imagen FLAIR.
De todas las demencias, ésta es la que con mayor frecuencia, 65%, presenta microsangrados, en tanto que la EA sólo alcanzaría un 18%37. En la angiopatía cerebral amiloidea, el hallazgo característico son las hemorragias lobares en distinto estadios. Se localizan en frecuencia descendente en los lóbulos frontal, parietal, temporal y occipital. Las lesiones hemorrágicas corticales/subcorticales son clínicamente silentes y se detectan mejor con secuencias eco de gradiente potenciadas en T2 (fig. 7).
Angiopatía amiloide. A) Imagen axial potenciada en T2* donde se observa una hemorragia corticosubocrtical parietal posterior derecha. También se aprecia otro foco hemorrágico en cápsula interna. B) Nivel más inferior donde se observan otros focos hemorrágicos subcorticales en cerebelo.
Uno de los errores más frecuentes en el diagnóstico de esta demencia es atribuir las lesiones de sustancia blanca a la DV y, por tanto, al diagnóstico del paciente, en ausencia de hallazgos más específicos de DV32. Cuanto más extensas sean las lesiones de sustancia blanca, es más probable que el paciente tenga factores de riesgo cerebrovascular, alteraciones cognitivas y deterioro cognitivo. Para valorar estas lesiones, hay escalas visuales o bien cuantificación de éstas con softwares especiales. En ausencia de cuantificación, se recomienda una escala validada para su gradación38. Es importante recordar las hiperintensidades normales presentes en el envejecimiento (v. anteriormente). Sin embargo, las lesiones confluentes se deben a enfermedad arteriolar12. Los hallazgos radiológicos más frecuentes, responsables del diagnóstico de DV, es la enfermedad de pequeño vaso en el 74% de los casos39. Esto se traduce en una imagen por lesiones de sustancia blanca que afecta a más del 25% de ésta, y/o lesiones de sustancia blanca junto con infartos lacunares39. Hay atrofia cortical, aunque no del mismo grado que en la EA y sin patrón específico, aunque también contribuye al deterioro cognitivo40.
Demencia con cuerpos de LewyDatos patológicos, clínicos y generalesEsta denominación se utiliza para los pacientes que presentan parkinsonismo espontáneo (no inducido por fármacos), demencia y alucinaciones visuales precoces y persistentes. Su epidemiología es poco conocida, aunque similar a la EA, sin definiciones precisas de su distribución por edad, sexo o factores de riesgo potenciales. Muchos pacientes con demencia de cuerpos de Lewy también tienen EA patológicamente, lo que altera su presentación clínica, aunque el deterioro cognitivo es más pronunciado que en la EA. Los criterios clínicos de consenso son específicos pero poco sensibles41. El método final de diagnóstico es la tinción histoquímica que detecta cuerpos de Lewy (inclusiones pálidas eosinófilas) y puede usarse de forma semicuantitativa41.
La distinción de esta demencia de otras formas neurodegenerativas es importante, porque los pacientes con demencia con cuerpos de Lewy pueden desarrollar síntomas extrapiramidales irreversibles cuando se les administra el tratamiento antidopaminérgico y anticolinérgico estándar que se usa para tratar la psicosis asociada a la demencia. También pueden desarrollar sensibilidad a neurolépticos, una reacción potencialmente mortal, que se piensa que está mediada por bloqueo agudo de los receptores D2. Estas complicaciones pueden presentarse hasta en la mitad de pacientes con esta dolencia27. Esta entidad se confunde con la enfermedad de Parkinson, ya que muchos pacientes parkinsonianos presentan demencia. Para su diagnóstico se emplea arbitrariamente la regla del año para separarlas: paciente que comienza la demencia en el primer año tras los síntomas parkinsonianos, se califica como demencia con cuerpos de Lewy, y demencia que empieza más de 1 año desde el inicio de los síntomas parkinsonianos, como demencia de la enfermedad de Parkinson (evidencia insuficiente)20.
Hallazgos radiológicos fundamentalesLas pruebas de imagen tienen un mero papel de soporte y los hallazgos con RM y TC son inespecíficos, mostrando una discreta atrofia cortical difusa27. Hay una mayor atrofia del mesencéfalo y una menor afectación relativa de hipocampos respecto a la EA, de momento sólo apreciable con estudios cuantitativos con MBV42. El estudio de SPECT demuestra una menor hipoperfusión del lóbulo occipital que en la EA. En los pacientes donde persiste la duda diagnóstica se recomienda realizar el FP-CIT-SPECT que muestra baja captación de los transportadores dopaminérgicos, mientras que es normal en la EA30.
Degeneración lobar frontotemporalDatos patológicos, clínicos y generalesEsta enfermedad, anteriormente llamada demencia frontotemporal, comprende un grupo diverso de entidades como la degeneración corticobasal y la parálisis supranuclear progresiva37. Patológicamente, hay atrofia, espongiosis y gliosis, y no se diferencian fiablemente los fenotipos clínicos de estas enfermedades5,43. Los recientes criterios las clasifican en función de su positividad a la proteína tau, y dentro de éstas según la isoforma presente de esta proteína44. Desde el punto de vista clínico práctico, se suele dividir en variantes sindrómicas que muestran diferentes, aunque superponibles, patrones de atrofia. Éstas son la conductual, la semántica y la afásica progresiva no fluente. En la variedad conductual la presentación más habitual son cambios profundos en la personalidad y conducta social, incluyendo una pérdida de maneras y hábito social, incongruentes con el hábito del paciente. En las otras 2 son una alteración del lenguaje, habitualmente como una afasia progresiva no fluente. La variante conductual de DFT (DFTc) se presenta con anomalías precoces del comportamiento y se asocia con una mayor pérdida de volumen del lóbulo frontal. Los pacientes que tienen una demencia semántica muestran un patrón bien definido de atrofia que afecta a los lóbulos temporales anteriores más predominantemente. La progresión a la muerte es mucho más rápida que en la EA, de media 4,2 y 6 años, respectivamente.
Hallazgos radiológicos fundamentalesLa RM de pacientes con DFT frecuentemente muestra atrofia asimétrica de los lóbulos frontales y temporales, generalmente de predominio izquierdo27 (fig. 8). El mayor gradiente de atrofia anteroposterior en pacientes con DFT puede ayudar a distinguirlas de la EA, que muestra un sesgo más posterior y simétrico. El estudio funcional (PET o SPECT) muestra anomalías asimétricas en el córtex ventromedial frontal de manera más precoz. El estudio longitudinal con PET revela que en el estadio inicial la DFT se limita al lóbulo frontal y en fases posteriores pasa a las corticales temporal y parietal45.
Degeneración lobar frontotemporal, variedad afásica. Imagen coronal potenciada en STIR que muestra marcada atrofia cortical de predominio frontotemproal izquierdo. Nótese la asimetría respecto a contralateral, especialmente respecto a la cisura de Silvio, cisura coroidea y asta temporal.
Actualmente, se estima que la RM es más útil para la enfermedad por priones que para cualquier otra demencia46.
La ECJ es una causa rara de demencia rápidamente progresiva, que ocurre con una incidencia aproximada de 1 caso por millón cada año. La mayoría de casos son esporádicos y su clínica es de deterioro cognitivo, frecuentemente con psicosis y delirio. Presenta un curso rápido con síntomas motores (mioclono) y finalmente coma. Hay varios tipos de ECJ, comprende la esporádica (la más frecuente), la familiar, la iatrogénica (causada por receptores de tejidos contaminados, administración de hormona o instrumentos quirúrgicos contaminados) y la variante de ECJ que se ha asociado con la ingestión de productos cárnicos contaminados con priones46.
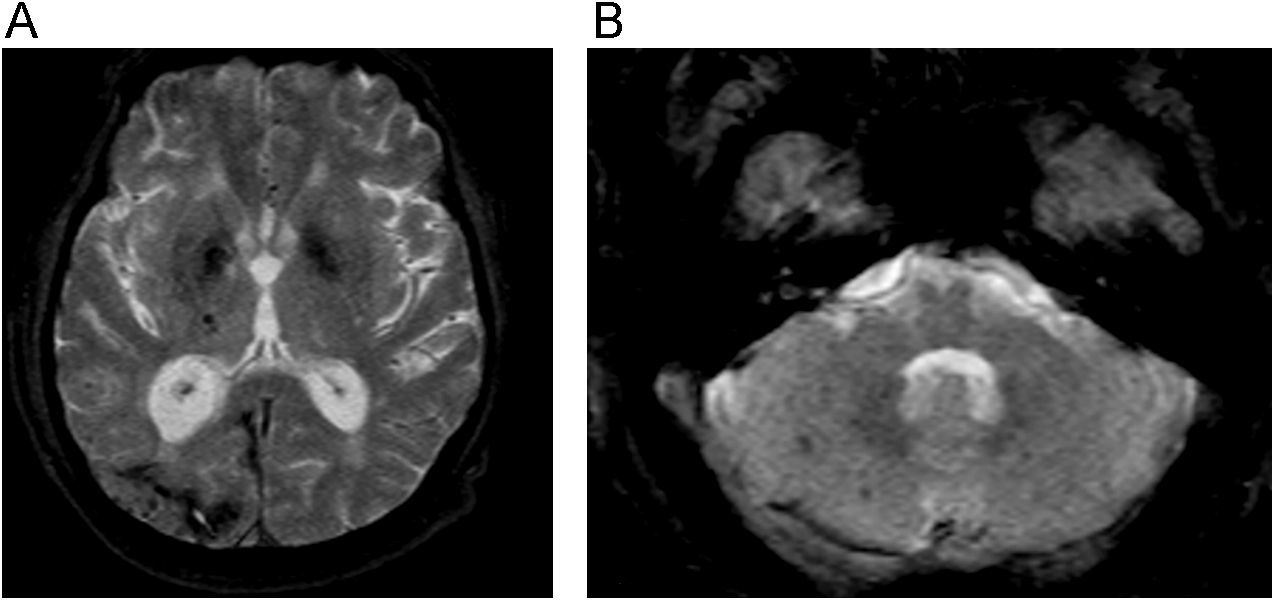
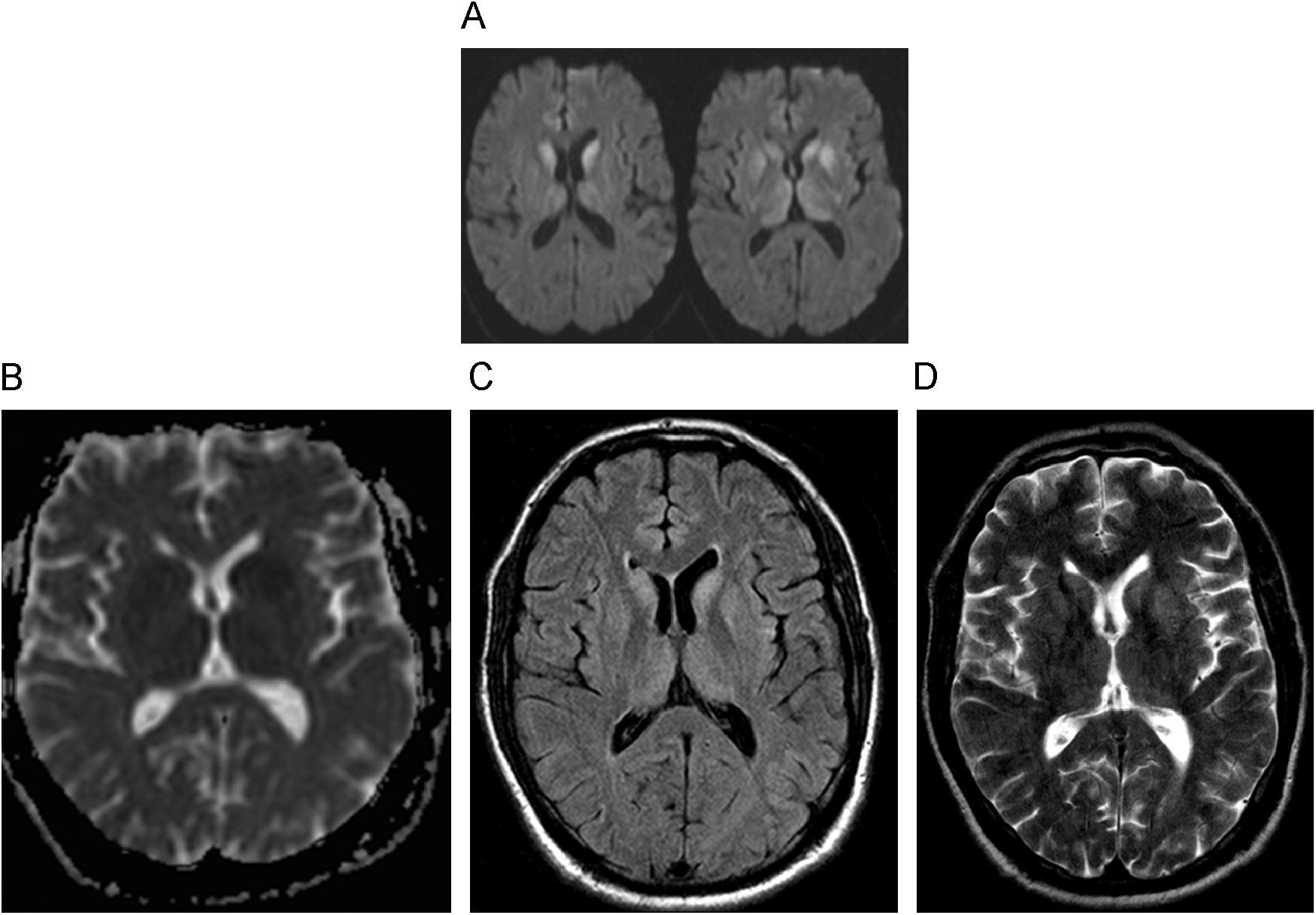
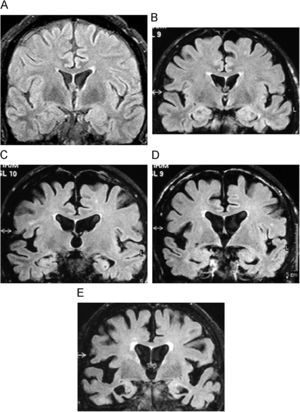
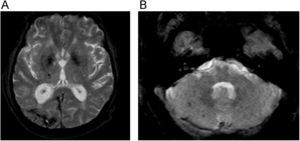
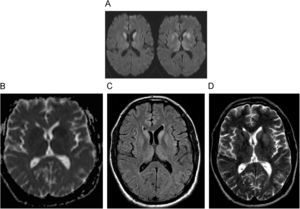
Hallazgos radiológicos fundamentalesLas imágenes potenciadas en difusión son las más sensibles y precoces para detectar las anomalías en las primeras fases de la enfermedad, antes de que aparezcan alteraciones en las imágenes potenciadas en FLAIR y finalmente en T2 (fig. 9) (46). Esto causa una característica disminución de señal simétrica de los ganglios basales. También puede observarse un descenso de la difusión menos simétrico de los tálamos y afectación cortical asimétrica. La restricción de la difusión refleja la reducción del movimiento del agua dentro de las vacuolas, típico de la degeneración espongiforme46. Las mediciones de los coeficientes de difusión aparente pueden ser útiles para detectar cambios en esta secuencia, antes que las alteraciones de la señal en la imagen por difusión46.
Enfermedad de Creutzfeldt-Jakob. A) Imágenes potenciadas en difusión (B 1.000s/mm2) observándose hiperintensidad de señal de ganglios basales. B) En el mapa de coeficiente de difusión aparente (ADC), se aprecia el descenso de señal de los núcleos caudados y putámenes. Imagen FLAIR (C) y potenciada en T2 (D). Estas alteraciones son menos visibles y tardías que en las imágenes precedentes. Cortesía del Dr. A. Rovira, Barcelona).
La forma variante de la ECJ tiene una apariencia característica en las secuencias de RM convencional (el llamado signo pulvinar), representada como alta intensidad de señal simétrica en tálamo posterior en imágenes potenciadas en T2 y FLAIR27.
Posteriormente, se desarrolla una rápida atrofia difusa, que puede incluir al cerebelo. Debe resaltarse que una RM normal inicial no excluye ECJ en un paciente de mediana edad o anciano con demencia de rápido comienzo.
Demencia por virus de la inmunodeficiencia humanaLa demencia VIH, también conocida como complejo demencia sida, se piensa que es por la infección directa de los macrófagos y microglía del sistema nervioso central por el retrovirus del VIH27. Antes de los antivirales altamente activos, hasta el 20% de los pacientes infectados por el VIH desarrollaba demencia y, asimismo, la demencia VIH es la enfermedad definitoria de sida en aproximadamente el 5% de los portadores de VIH. Sin embargo, en los pacientes en los que falla el tratamiento, aparece una grave leucoencefalopatía. Ésta se caracteriza patológicamente por una marcada infiltración de los espacios perivasculares por los monocitos y macrófagos infectados por VIH.
Hallazgos radiológicos fundamentalesEl hallazgo más frecuente de la demencia por sida es una atrofia cortical generalizada. Se identifica como un aumento de los surcos cerebrales desproporcionado para la edad del paciente21,47. Además hay una afectación simétrica, parcheada o confluente, de sustancia blanca periventricular y profunda adyacente, visible tanto con TC como con RM. Hay un predominio frontal que puede afectar a la rodilla del cuerpo calloso. No produce efecto masa ni realce de contraste, y si algo de esto se observa, se debe considerar otro diagnóstico47.
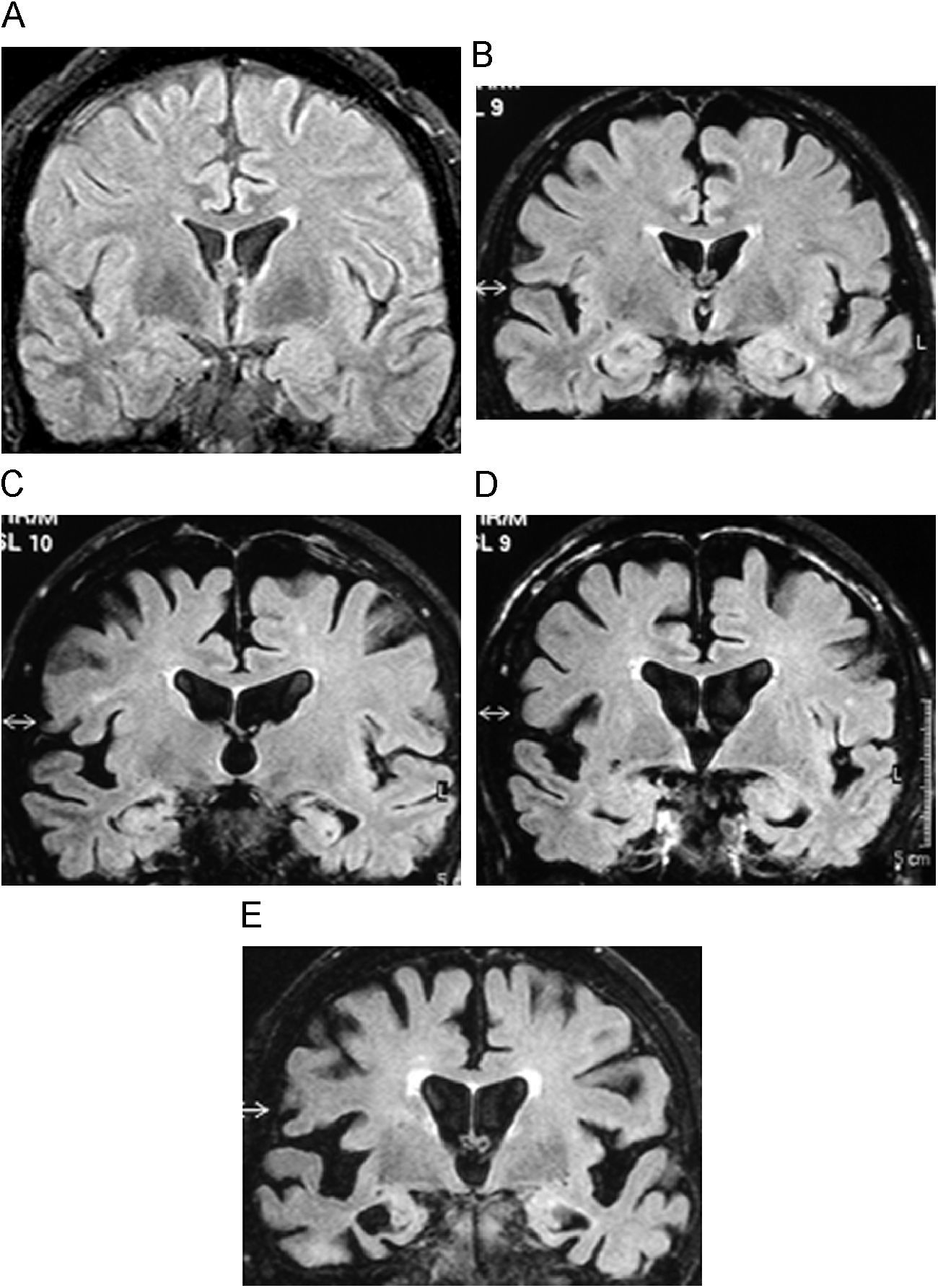
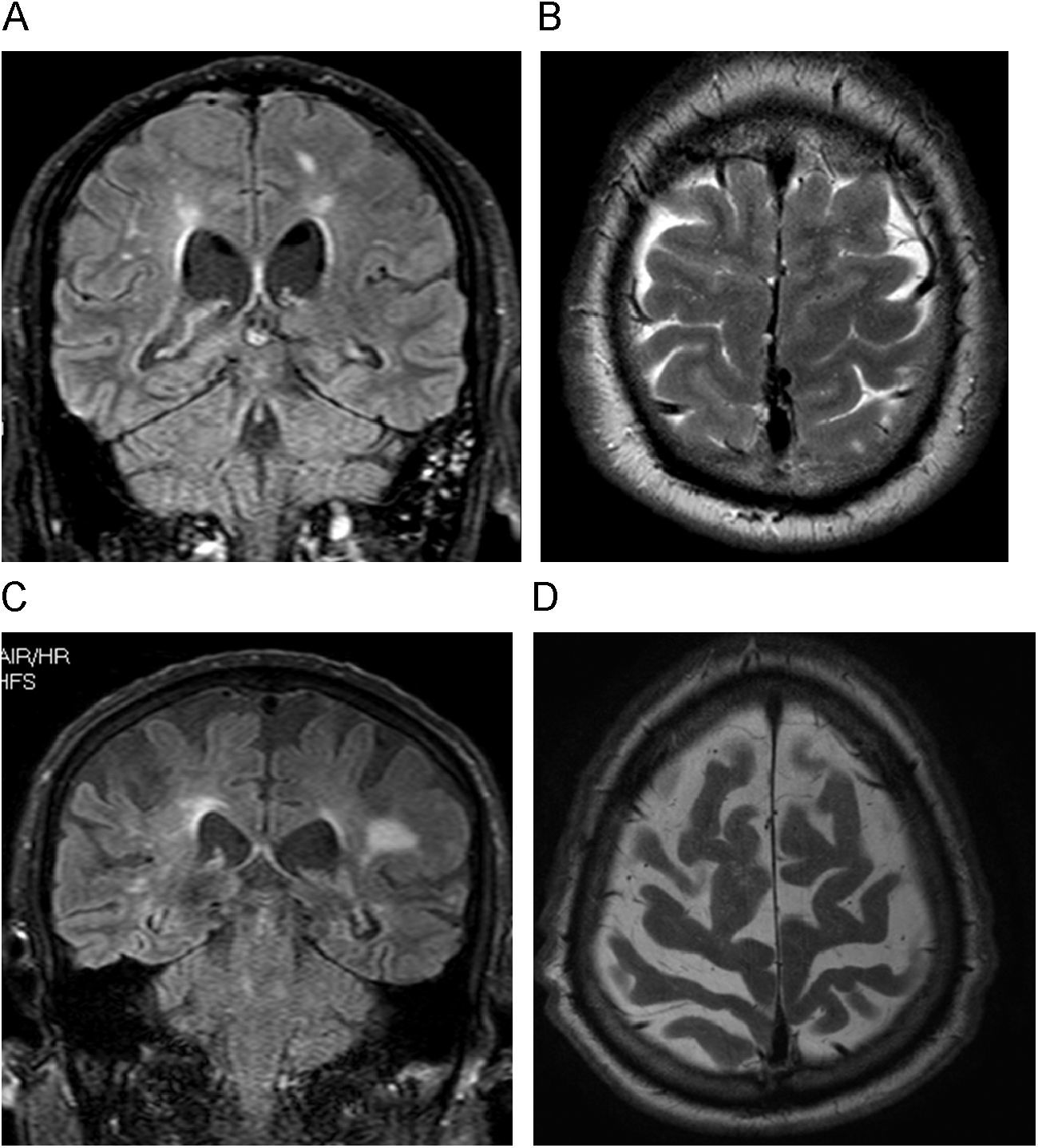
Hidrocefalia crónica del adultoLa hidrocefalia crónica del adulto (HCA) es la causa más frecuente de demencia reversible y clásicamente se manifiesta con la tríada, no patognomónica, de demencia, apraxia de la marcha de inicio precoz e incontinencia urinaria. Es un síndrome complejo, con una fisiopatología e historia natural poco conocidas, y que comienza insidiosamente por los síntomas cognitivos48. Se prefiere esta denominación a la de hidrocefalia normopresiva, porque hay gradientes de presión y no una referencia “normal”, mientras que tampoco indica una fisiopatología concreta —como hace el término normopresiva—49. El diagnóstico definitivo es mediante clínica y mejoría con la derivación ventriculoperitoneal.
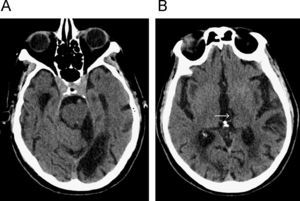
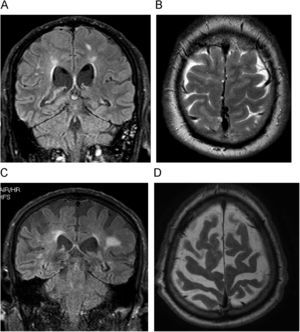
Hallazgos radiológicosEl hallazgo radiológico fundamental es la dilatación del sistema ventricular, en particular de las astas frontales de los ventrículos laterales, desproporcionado a la apariencia de los surcos corticales49. El índice de Evans (marcador de dilatación ventricular: distancia interastas frontales dividido por el diámetro biparietal en atrios), es patológico por encima de 0,30; pero no sirve aisladamente. Esta dilatación de las astas frontales y un tercer ventrículo con morfología esférica son indicativos de hidrocefalia del adulto48. Lo que más ayuda a distinguir pacientes con tamaños ventriculares similares son las imágenes axiales cerca de la convexidad27. En aquellos con HCA no hay apenas líquido cefalorraquídeo en los surcos, mientras en la EA persisten los surcos con líquido cefalorraquídeo (fig. 10). Hay lesiones de sustancia blanca y puede coexistir con las otras formas de demencia49. Los estudios con contraste de fase en RM, que se emplean para demostrar el hiperdinamismo del líquido cefalorraquídeo, no se han demostrado útiles para predecir qué pacientes responderán al tratamiento50.
Hidrocefalia crónica del adulto (hidrocefalia normopresiva). A) Imagen coronal potenciada en FLAIR. Para un discreto aumento del tamaño de los ventrículos laterales. B) Imagen axial potenciada en T2, observándose el colapso de los surcos en vértex. C) Imagen coronal potenciada en FLAIR. Otro paciente con demencia de Alzheimer con similar aumento de ventrículos y dilatación de los surcos con líquido cefalorraquídeo en convexidad. D) Imagen axial potenciada en T2 de este último paciente, donde se aprecia la prominencia de los surcos, respecto a B.
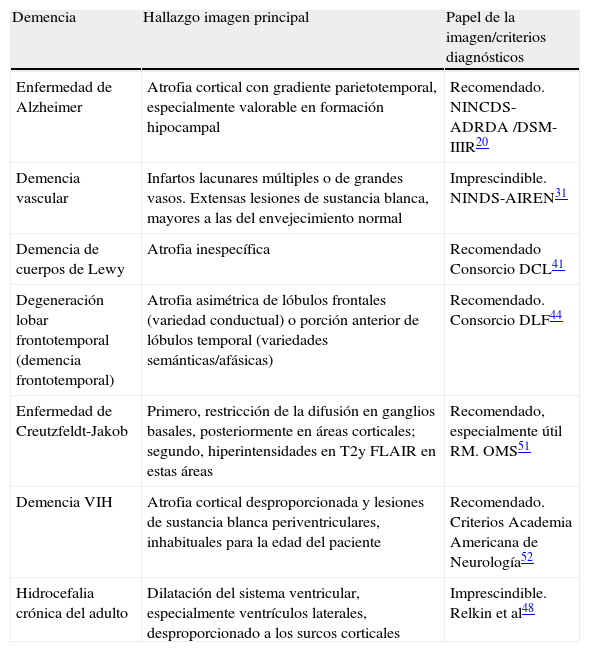
En la tabla 6 se resumen las conclusiones de los principales hallazgos en imagen.
Principales hallazgos en imagen estructural de las demencias más frecuentes
| Demencia | Hallazgo imagen principal | Papel de la imagen/criterios diagnósticos |
| Enfermedad de Alzheimer | Atrofia cortical con gradiente parietotemporal, especialmente valorable en formación hipocampal | Recomendado. NINCDS-ADRDA /DSM-IIIR20 |
| Demencia vascular | Infartos lacunares múltiples o de grandes vasos. Extensas lesiones de sustancia blanca, mayores a las del envejecimiento normal | Imprescindible. NINDS-AIREN31 |
| Demencia de cuerpos de Lewy | Atrofia inespecífica | Recomendado Consorcio DCL41 |
| Degeneración lobar frontotemporal (demencia frontotemporal) | Atrofia asimétrica de lóbulos frontales (variedad conductual) o porción anterior de lóbulos temporal (variedades semánticas/afásicas) | Recomendado. Consorcio DLF44 |
| Enfermedad de Creutzfeldt-Jakob | Primero, restricción de la difusión en ganglios basales, posteriormente en áreas corticales; segundo, hiperintensidades en T2y FLAIR en estas áreas | Recomendado, especialmente útil RM. OMS51 |
| Demencia VIH | Atrofia cortical desproporcionada y lesiones de sustancia blanca periventriculares, inhabituales para la edad del paciente | Recomendado. Criterios Academia Americana de Neurología52 |
| Hidrocefalia crónica del adulto | Dilatación del sistema ventricular, especialmente ventrículos laterales, desproporcionado a los surcos corticales | Imprescindible. Relkin et al48 |
RM: resonancia magnética; VIH: virus de la inmunodeficiencia humana.
El autor declara no tener ningún conflicto de intereses.
Al Dr. Álex Rovira, por su amable cesión de imágenes. A todos los pacientes con deterioro cognitivo.