El dolor pélvico agudo es una causa frecuente de consulta en los servicios de urgencias. Los síntomas inespecíficos hacen que a menudo se encuentre patología ginecológica en pacientes remitidas por otras sospechas diagnósticas. Por eso es importante familiarizarse con este tipo de patología y ser capaces de identificar sus hallazgos más representativos. El objetivo de este artículo es revisar las principales causas del dolor pélvico agudo de origen ginecológico, aportando datos clave que permitan establecer un diagnóstico acertado y orientar el tratamiento adecuado
Acute pelvic pain is a common condition in emergency. The sources of acute pelvic pain are multifactorial, so it is important to be familiar with this type of pathologies. The purpose of this article is review the main causes of gynecological acute pelvic pain and their radiologic appearances to be able to make an accurate diagnosis and provide objective criteria for patient management
El dolor pélvico agudo en la mujer es un síntoma común de consulta en los servicios de urgencias1. La ecografía abdominal se considera la técnica de evaluación inicial2. Antes de comenzar los estudios de imagen es fundamental obtener los datos clínicos más relevantes, que junto con los datos de laboratorio son fundamentales para la orientación diagnóstica3,4. Lo primero que debe valorarse es la posibilidad de un embarazo ectópico, que podría convertirse en una situación de riesgo vital.
Haremos un breve repaso de la fisiología del ciclo ovárico y de la aplicación de las diferentes técnicas de imagen en la valoración del dolor pélvico agudo de origen ginecológico.
Con este artículo pretendemos revisar las principales causas del dolor pélvico agudo: quistes funcionales, embarazo ectópico, enfermedad pélvica aguda, torsión de ovario, endometriosis y miomas complicados, proporcionando un enfoque práctico que permita al radiólogo identificar las diferentes afecciones, hacer un diagnóstico diferencial adecuado y orientar el tratamiento de forma acertada5 (tabla 1).
Dolor pélvico agudo de origen ginecológico: puntos claves en su diagnóstico y manejo
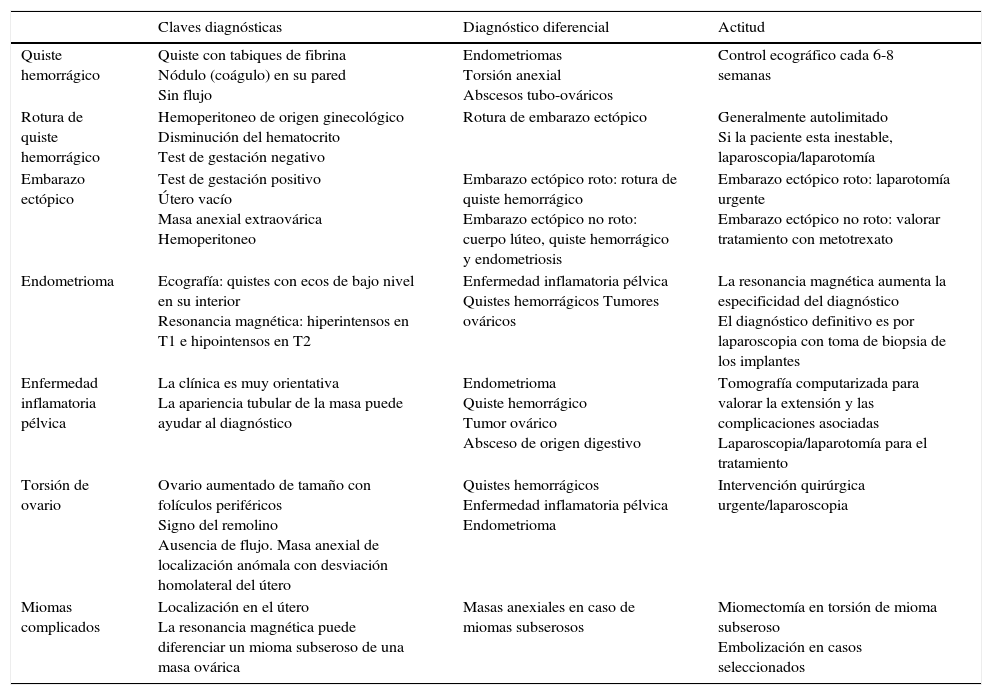
| Claves diagnósticas | Diagnóstico diferencial | Actitud | |
|---|---|---|---|
| Quiste hemorrágico | Quiste con tabiques de fibrina Nódulo (coágulo) en su pared Sin flujo | Endometriomas Torsión anexial Abscesos tubo-ováricos | Control ecográfico cada 6-8 semanas |
| Rotura de quiste hemorrágico | Hemoperitoneo de origen ginecológico Disminución del hematocrito Test de gestación negativo | Rotura de embarazo ectópico | Generalmente autolimitado Si la paciente esta inestable, laparoscopia/laparotomía |
| Embarazo ectópico | Test de gestación positivo Útero vacío Masa anexial extraovárica Hemoperitoneo | Embarazo ectópico roto: rotura de quiste hemorrágico Embarazo ectópico no roto: cuerpo lúteo, quiste hemorrágico y endometriosis | Embarazo ectópico roto: laparotomía urgente Embarazo ectópico no roto: valorar tratamiento con metotrexato |
| Endometrioma | Ecografía: quistes con ecos de bajo nivel en su interior Resonancia magnética: hiperintensos en T1 e hipointensos en T2 | Enfermedad inflamatoria pélvica Quistes hemorrágicos Tumores ováricos | La resonancia magnética aumenta la especificidad del diagnóstico El diagnóstico definitivo es por laparoscopia con toma de biopsia de los implantes |
| Enfermedad inflamatoria pélvica | La clínica es muy orientativa La apariencia tubular de la masa puede ayudar al diagnóstico | Endometrioma Quiste hemorrágico Tumor ovárico Absceso de origen digestivo | Tomografía computarizada para valorar la extensión y las complicaciones asociadas Laparoscopia/laparotomía para el tratamiento |
| Torsión de ovario | Ovario aumentado de tamaño con folículos periféricos Signo del remolino Ausencia de flujo. Masa anexial de localización anómala con desviación homolateral del útero | Quistes hemorrágicos Enfermedad inflamatoria pélvica Endometrioma | Intervención quirúrgica urgente/laparoscopia |
| Miomas complicados | Localización en el útero La resonancia magnética puede diferenciar un mioma subseroso de una masa ovárica | Masas anexiales en caso de miomas subserosos | Miomectomía en torsión de mioma subseroso Embolización en casos seleccionados |
La ecografía abdominal se considera la técnica de evaluación inicial. Permite una valoración general e identificar causas tanto ginecológicas como no ginecológicas del dolor pélvico agudo, y ha demostrado ser altamente precisa para detectar y caracterizar la mayoría de las causas de patología ginecológica urgente4.
Ecografía transvaginalSe realiza con la vejiga vacía. El transductor se introduce en la cavidad vaginal protegido por un preservativo, tras impregnarlo de un gel especial para ecografía. Proporciona un mayor detalle de la estructura interna del útero y de los ovarios, pero tiene limitaciones para estudiar masas de gran tamaño. Su uso está contraindicado en mujeres vírgenes y en ancianas con distrofia vulvar u otras alteraciones que hagan imposible el abordaje por vía vaginal.
Tomografía computarizadaEn la patología ginecológica aguda puede ser de utilidad en caso de dudas diagnósticas o bien para valorar la extensión del proceso o posibles complicaciones6. El protocolo estándar incluye cortes axiales desde la cúpula diafragmática hasta la sínfisis del pubis, con una adquisición de los cortes de 5mm y posterior reconstrucción. Se realiza con contraste intravenoso (100ml a 3ml/s) en fase venosa (60-70 s).
Resonancia magnéticaRepresenta el mayor avance en la exploración de la pelvis femenina gracias a su excelente caracterización tisular y su capacidad multiplanar. Es de gran utilidad en la caracterización de masas anexiales. No es una técnica utilizada habitualmente en los servicios de urgencias7.
En última instancia, si la situación de inestabilidad clínica de la paciente impide la realización de estudios de imagen, o estos no aportan información precisa para el diagnóstico, la opción quirúrgica tendrá fines tanto diagnósticos como terapéuticos4.
Fisiología del ciclo ováricoEl aspecto del ovario normal en una mujer en edad reproductiva varía en función de la fase del ciclo menstrual8.
En la fase folicular existen muchos pequeños folículos en la corteza ovárica. Hacia el octavo o noveno días se hace dominante un folículo, destinado a la ovulación, y los demás se vuelven atrésicos. Mediante ecografía, los folículos aparecen como estructuras quísticas, anecoicas, redondas u ovales, de paredes finas y sin flujo mediante Doppler color. Los folículos o quistes de hasta 3cm de diámetro máximo deben considerarse hallazgos fisiológicos normales.
En la fase lútea, tras la ovulación, se desarrolla el cuerpo lúteo8. El cuerpo lúteo es típicamente un quiste de pared ecogénica gruesa e irregular, de forma difusa, proclive al sangrado debido a la marcada neoangiogénesis de la capa granulosa. Mide menos de 3cm de diámetro. Por lo general tiene ecos internos y el Doppler color pone de manifiesto un característico anillo de vascularización periférica («anillo de fuego»)3,9 (fig. 1).
a) Ecografía, corte transversal. Quiste folicular bien delimitado, de pared fina, con contenido anecoico (flecha). b) Ecografía Doppler color, corte transversal, de un cuerpo lúteo. Imagen quística con pared más gruesa, ecogénica y vascularizada (flecha). c) Tomografía computarizada (TC) con contraste, corte axial. Imagen típica de un cuerpo lúteo con pared engrosada, hiperdensa, con bordes festoneados (flecha). d) TC, VR: se identifica el anillo vascularizado del cuerpo lúteo (flecha).
En la menopausia cesa la foliculogénesis y los ovarios disminuyen su tamaño. Pueden verse pequeños quistes simples de hasta 1cm en el 21% de las mujeres10–12, y deben considerarse un hallazgo sin significación clínica3.
En los ovarios neonatales y premenárquicos pueden observarse pequeños folículos.
Los ovarios pueden presentar una posición variable. La no visualización ecográfica de un ovario no excluye la posibilidad de una lesión ovárica.
Principales causas de dolor pélvico agudo de origen ginecológicoQuistes funcionales: quistes folicularesLos quistes foliculares son las masas quísticas anexiales más comunes1. Se producen por el crecimiento de folículos dominantes que no llegan a expeler el óvulo, superando los 3cm de diámetro máximo.
El crecimiento rápido de estos quistes puede originar dolor pélvico, pero habitualmente son hallazgos incidentales.
- •
Diagnóstico diferencial:
Quistes paraováricos, hidrosálpinx y tumores quísticos benignos.
- •
Manejo:
Los quistes anexiales simples de hasta 10cm en una paciente de cualquier edad son con alta probabilidad benignos13–15. Los quistes que se descubren incidentalmente presentan en general un tamaño de entre 3 y 8cm, y suelen desaparecer o involucionar en el transcurso de uno o dos ciclos menstruales. El periodo óptimo para realizar una ecografía de control y verificar su resolución es entre los días 5 y 10 (fase folicular) de un ciclo menstrual posterior1. La Society of Radiologists in Ultrasound Consensus Conference Statement3 establece las siguientes recomendaciones de seguimiento:
- a)
En mujeres en edad reproductiva:
- –
Quistes ≤3cm: hallazgos fisiológicos normales, no necesitan ser descritos en el informe y no requieren seguimiento.
- –
Quistes >3 y ≤5cm: se describen en el informe como hallazgos muy probablemente benignos y no requieren seguimiento.
- –
Quistes >5 y ≤7cm: se describen en el informe como hallazgos muy probablemente benignos, pero se recomienda seguimiento ecográfico anual.
- –
Quistes >7cm: pueden ser difíciles de evaluar por completo con ecografía, por lo que debe recomendarse su evaluación con resonancia magnética (RM) o cirugía.
- –
- b)
En mujeres posmenopáusicas:
- –
Quistes ≤1cm: clínicamente intrascendentes, no necesitan ser descritos en el informe y no requieren seguimiento.
- –
Quistes >1 y ≤7cm: se describen en el informe como un hallazgo muy probablemente benigno, pero se recomienda seguimiento anual, al menos inicialmente, con ecografía. Se puede optar por aumentar el umbral para el seguimiento de 1 a 3cm.
- –
Quistes >7cm: pueden ser difíciles de evaluar por completo con ecografía, por lo que debe recomendarse su evaluación con RM o cirugía.
- –
- a)
Es la causa más frecuente de dolor pélvico agudo de origen ginecológico en la mujer joven y suele presentarse clínicamente como un dolor intenso y súbito en el hipogastrio. El punto doloroso coincide con la localización del quiste. Es casi exclusivo de mujeres en edad fértil, posmenopáusicas en tratamiento hormonal sustitutivo y embarazadas16.
Se produce por sangrado de un quiste folicular o, más frecuentemente, de un cuerpo lúteo.
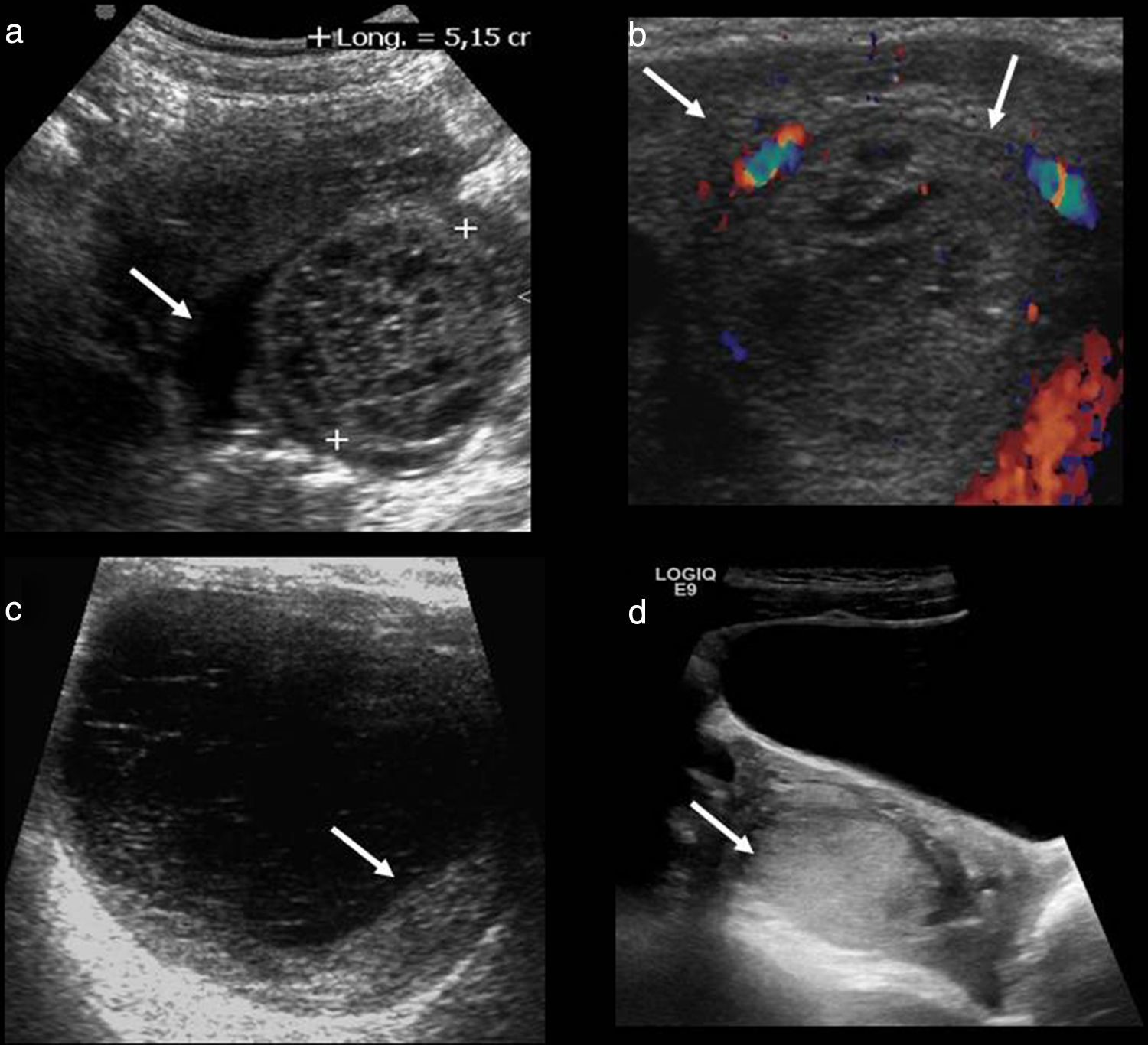
Su apariencia ecográfica varía en función del estadio evolutivo en que se encuentre el sangrado (fig. 2). Inicialmente, en relación con el sangrado agudo, puede ser hiperecogénico y simular una masa sólida que, sin embargo, presenta el refuerzo acústico posterior característico de las lesiones quísticas. La apariencia más típica es la de una lesión quística compleja (sin flujo mediante Doppler color) con refuerzo posterior, con un patrón reticular fino en su interior debido a bandas de fibrina, que producen una apariencia de «red de pescar», y que es característico de una fase subaguda17.
Diferentes manifestaciones ecográficas de los quistes hemorrágicos. a) Apariencia típica en «red de pescar» con bandas lineales hiperecogénicas (entre marcas) y líquido libre (flecha). b) Sangrado dentro de un cuerpo lúteo que muestra flujo circunferencial mediante Doppler color, en «anillo de fuego» (flechas). c) Quiste con patrón reticular fino y coágulo adherido a su pared (flecha). d) Quiste con apariencia sólida, que simula un ovario aumentado de tamaño (flecha).
A veces puede presentarse con un nivel líquido-líquido. Otra apariencia habitual es la existencia de un coágulo adherido a la pared, que puede simular una nodulación mural neoplásica. El coágulo suele ser hiperecogénico y es característicamente de márgenes cóncavos y avascular13,18, mientras que el nódulo neoplásico tiene márgenes convexos y es isoecogénico y vascularizado.
El espesor de la pared es variable, dependiendo de su procedencia. Cuando el quiste hemorrágico se produce por sangrado de un cuerpo lúteo puede identificarse el típico «anillo de fuego» producido por la hipervascularización de su pared.
- •
Diagnóstico diferencial:
Fundamentalmente con endometriomas, pero también con torsión de anejos y abscesos tubo-ováricos.
- •
Manejo:
Normalmente se resuelven en 6-8 semanas (dos a tres ciclos menstruales) de forma espontánea16,19. Si se hace seguimiento y no desaparecen, hay que plantearse la posibilidad de una neoplasia quística.
Las recomendaciones de seguimiento de la Society of Radiologists in Ultrasound Consensus Conference Statement3 son:
- a)
En mujeres en edad reproductiva:
- –
Quistes ≤3cm: no necesitan ser descritos en el informe y no requieren seguimiento.
- –
Quistes >3 y ≤5cm: se describen en el informe, pero no necesitan seguimiento.
- –
Quistes >5cm: se describen en el informe y se recomienda seguimiento ecográfico en 6-12 semanas para asegurar la resolución. Si no desaparecen está indicada una evaluación con RM.
- –
- b)
En mujeres posmenopáusicas:
- –
Menopausia temprana: se describen en el informe y se recomienda control ecográfico en 6 -12 semanas. Si no desaparece, evaluación con RM o cirugía.
- –
Menopausia tardía: cualquier quiste hemorrágico debe ser considerado como probable neoplasia, por lo que se recomienda evaluación con RM o cirugía.
- –
- a)
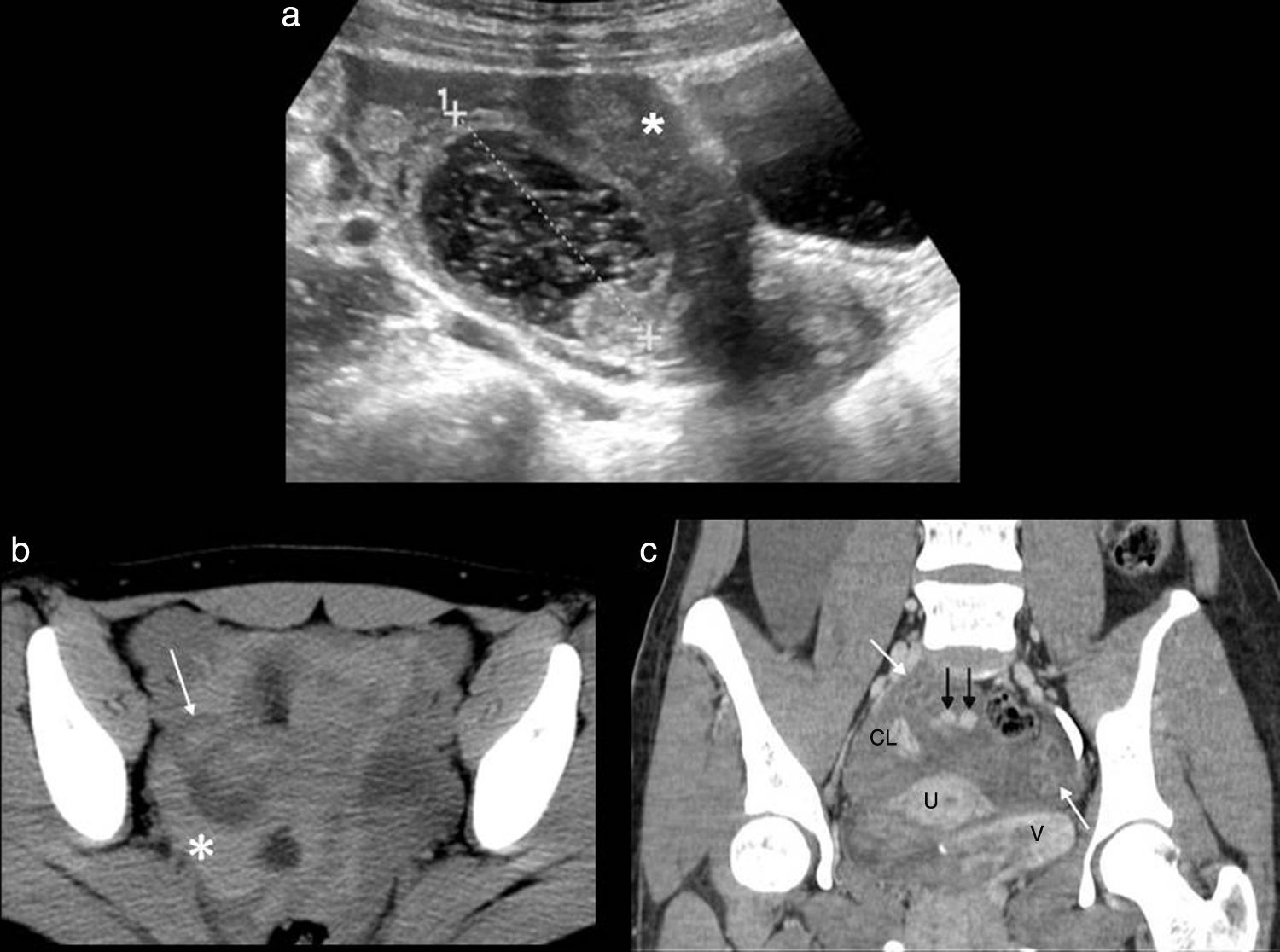
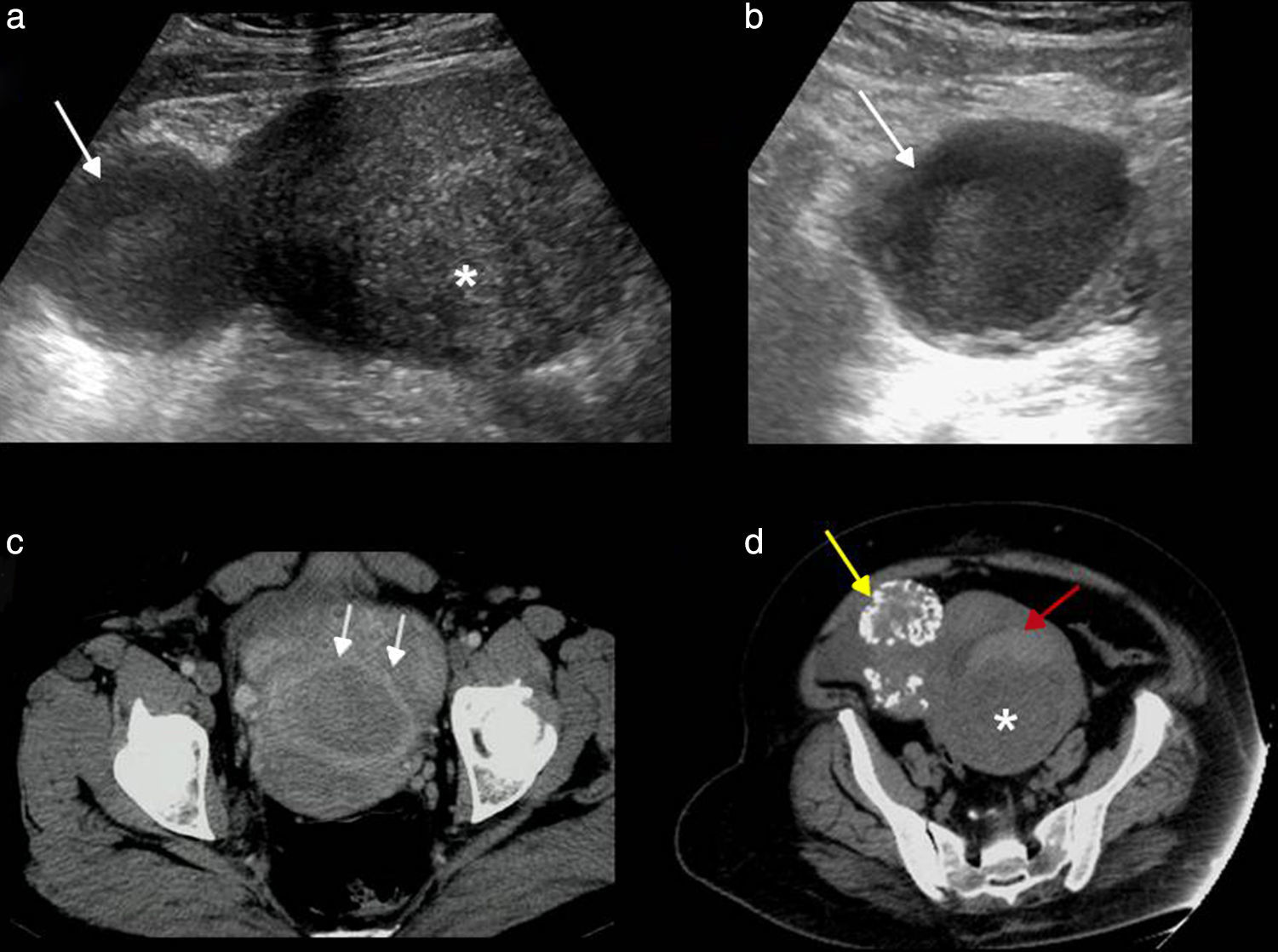
Cuando un quiste hemorrágico se rompe, lo cual no es infrecuente, este se identifica junto con líquido libre que puede limitarse a la pelvis o extenderse a la cavidad abdominal. El líquido, dependiendo del tiempo de sangrado, puede ser anecoico o de aspecto complejo con contenido ecogénico (hemoperitoneo) (fig. 3).
Rotura de quiste hemorrágico. a) Ecografía, corte longitudinal. Quiste hemorrágico, con apariencia típica en «red de pescar» (entre marcas) y líquido libre complejo (hemoperitoneo). b) Tomografía computarizada (TC) sin contraste, corte axial. Imagen quística con contenido hiperdenso en su interior por sangrado (flecha blanca) y líquido libre hiperdenso en la pelvis por hemoperitoneo (asterisco). c) TC con contraste, corte coronal. Focos hiperdensos debidos a extravasación del contraste por sangrado activo (flechas negras). Útero (U), ovarios (flechas blancas), vejiga (V) y cuerpo lúteo en ovario derecho (CL).
La tomografía computarizada (TC) con contraste intravenoso puede poner de manifiesto la presencia de sangrado activo.
- •
Diagnóstico diferencial:
Es indispensable un test de gestación con resultado negativo, ya que la rotura de una gestación ectópica presenta una clínica y unos hallazgos similares5.
- •
Manejo:
Actitud expectante según la evolución clínica y analítica (caída del hematocrito), ya que normalmente son procesos autolimitados. Si el hemoperitoneo es extenso y produce inestabilidad hemodinámica, se valorará la realización de una laparoscopia/laparotomía diagnóstica y terapéutica20.
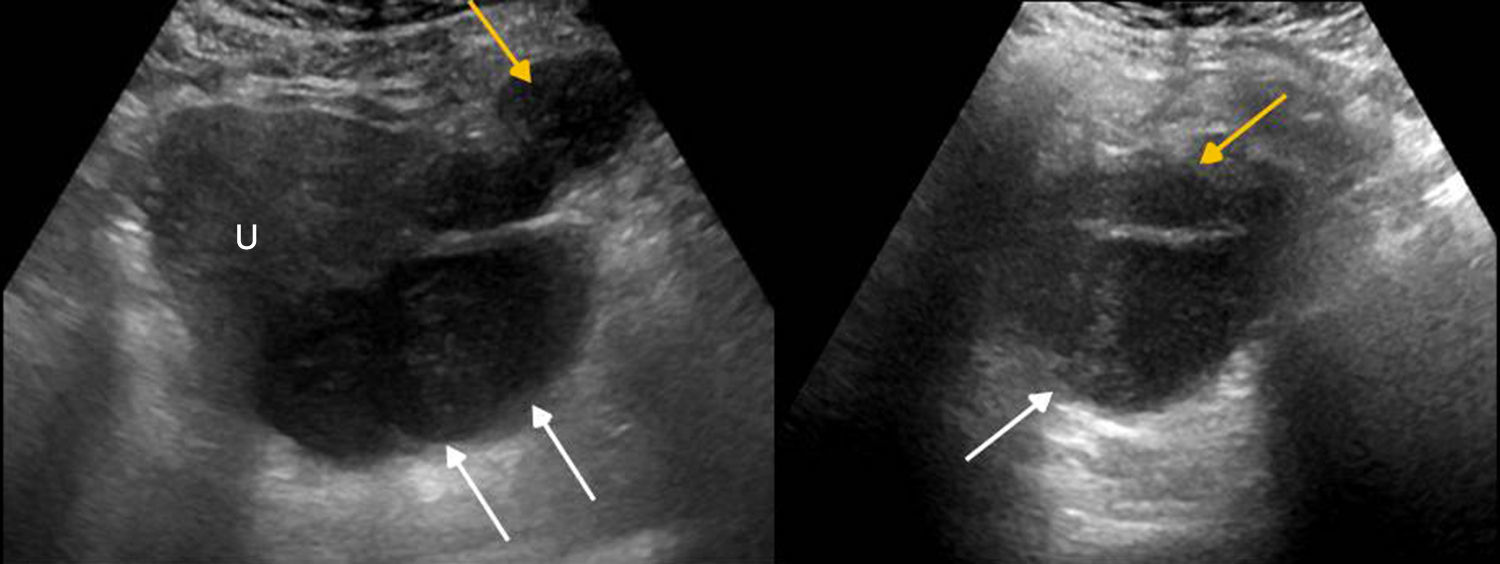
Se considera embarazo ectópico la implantación del saco gestacional fuera de la cavidad endometrial. En el 95% de los casos dicha implantación se produce en la trompa de Falopio (con más frecuencia en la región ampular y el istmo)21.
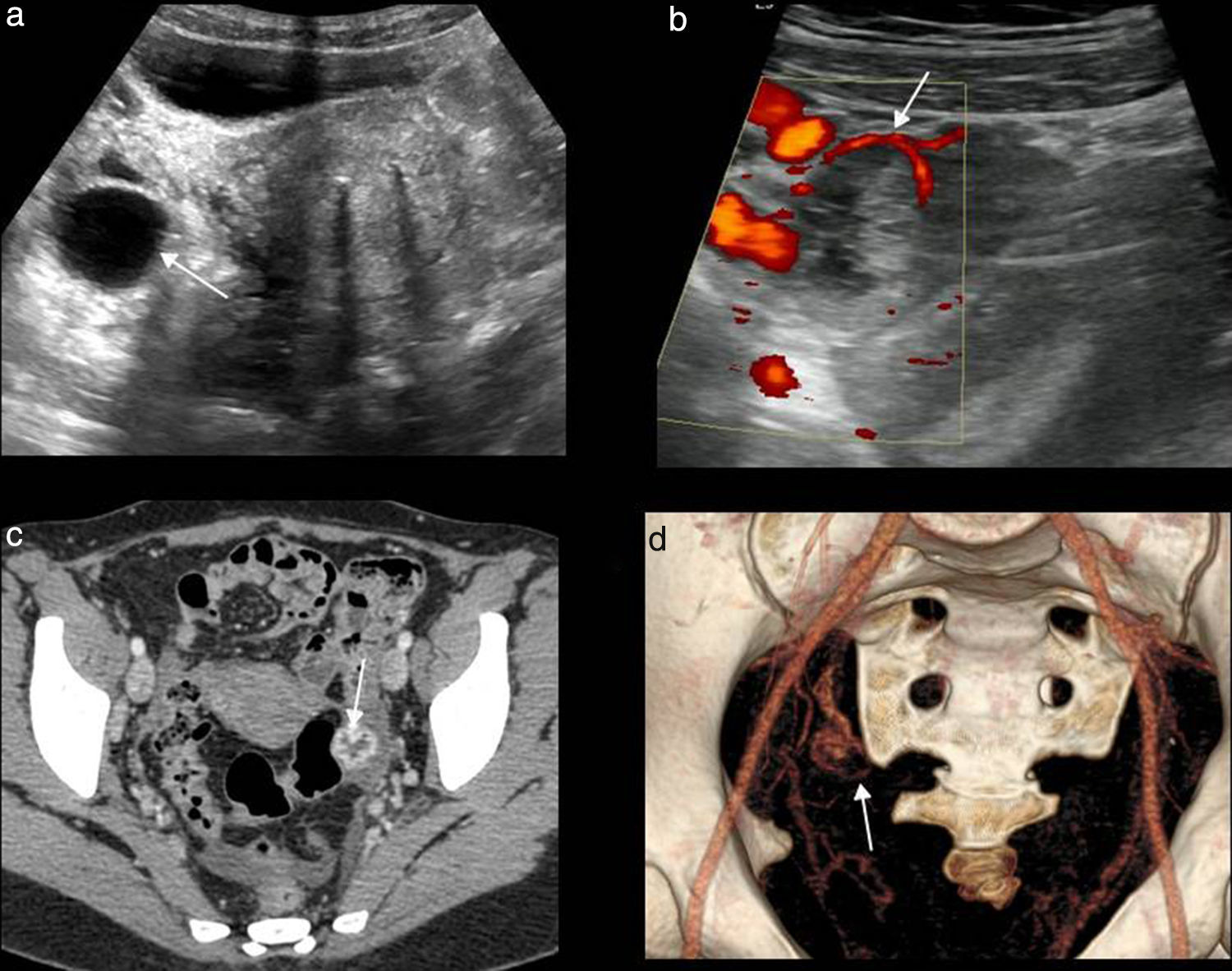
En una mujer en edad fértil con gonadotropina coriónica humana beta elevada o un test de gestación positivo y ausencia de gestación intrauterina, la identificación por ecografía de una masa anexial, extraovárica, debe considerarse un embarazo ectópico mientras no se demuestre lo contrario21 (fig. 4).
Rotura de embarazo ectópico. Ecografía, corte axial. Líquido libre con tabiques y ecos en su interior que se localiza posterior al útero, compatible con hemoperitoneo (asteriscos), e imagen de masa anexial izquierda (flecha) de aspecto complejo, con área quística y polo sólido en su interior.
La presencia de un embarazo intrauterino prácticamente excluye el diagnóstico de embarazo ectópico coexistente, excepto en pacientes de alto riesgo, como las que se encuentran sometidas a fertilización asistida20.
La incidencia de embarazo ectópico es mayor cuando existen antecedentes de otra gestación ectópica, de enfermedad inflamatoria pélvica, de endometriosis, de cirugía sobre las trompas, de uso de dispositivo intrauterino y de tratamiento para la infertilidad22.
Cuando un embarazo ectópico aumenta, su riesgo de rotura también aumenta. La urgencia del embarazo ectópico se produce cuando este se rompe. La rotura de la gestación ectópica es infrecuente, pero es causa del 10% de las muertes maternas21. Suele presentarse con dolor agudo y sangrado vaginal. Entre los hallazgos ecográficos que podemos encontrarnos se encuentran:
- –
El más fiable, con una especificidad del 100%, pero infrecuente, es la demostración del saco gestacional con un embrión vivo en localización extrauterina (fig. 5).
- –
El segundo signo más específico es la presencia de una masa anexial, extraovárica, sólida o quística, con una pared gruesa e hiperecogénica de tejido trofoblástico («anillo tubárico»)18, con marcada vascularización mediante Doppler color («anillo de fuego»), que puede contener un saco vitelino o un embrión. Si no contiene saco ni embrión, es importante confirmar que es independiente del ovario para no confundirlo con un cuerpo lúteo (un embarazo ectópico ovárico es excepcional).
- –
El líquido libre ecogénico, por hemoperitoneo, en una paciente con gonadotropina coriónica humana beta positiva, tiene un valor predictivo positivo para embarazo ectópico del 86% al 93%. En un 15% de los embarazos ectópicos, la presencia de líquido libre puede ser el único hallazgo ecográfico16.
- •
Diagnóstico diferencial:
- –
Embarazo ectópico roto: rotura de quiste hemorrágico.
- –
Embarazo ectópico no roto: cuerpo lúteo, quiste hemorrágico y endometriosis.
- –
- •
Manejo:
- –
Embarazo ectópico roto: es una situación de emergencia que pone en peligro la vida y que requiere una intervención quirúrgica urgente. Si la paciente se encuentra clínicamente inestable no es importante la diferenciación entre rotura de embarazo ectópico o de quiste hemorrágico, estando en ambos casos indicada la laparotomía de urgencia.
- –
Embarazo ectópico no roto: valorar tratamiento médico con metotrexato.
- –
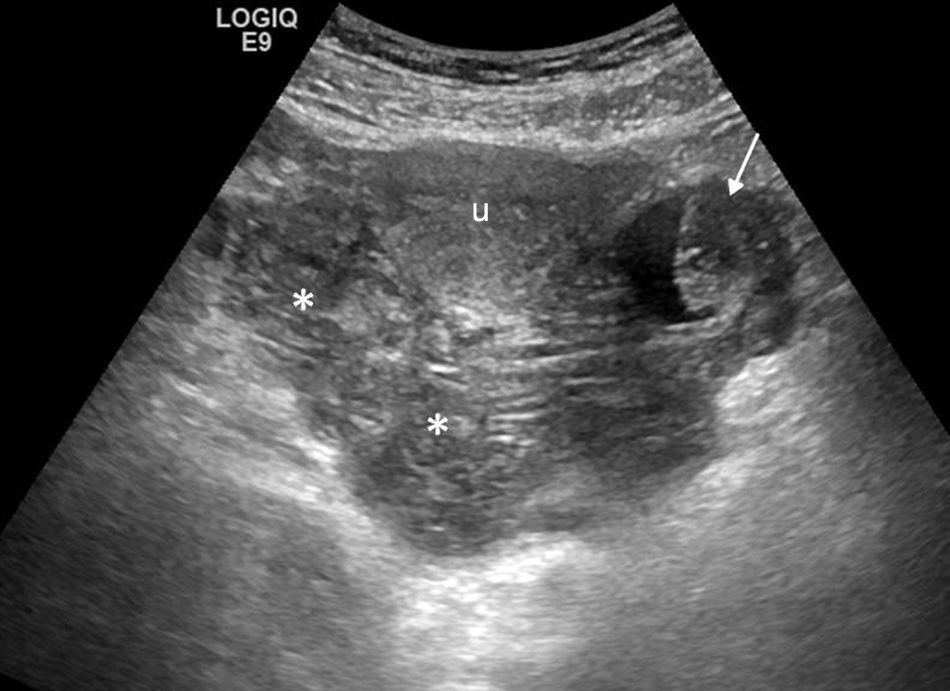
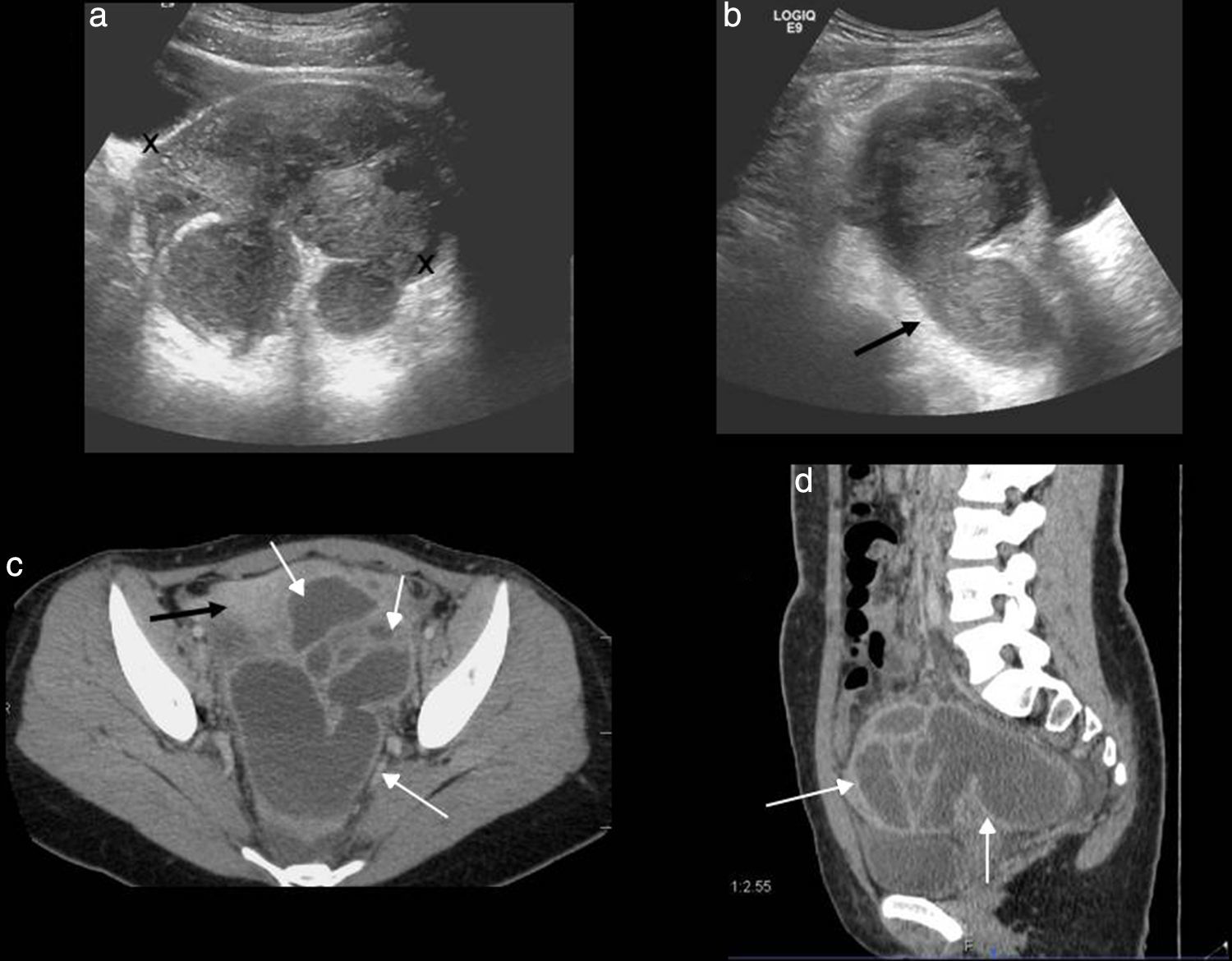
Hasta un 24% de las consultas a los servicios de urgencias por dolor ginecológico son atribuibles a enfermedad inflamatoria pélvica1, una afectación inflamatoria-infecciosa del tracto genital superior que clínicamente se caracteriza por dolor pélvico agudo, fiebre, secreción vaginal y dolor a la movilización cervical. En su mayoría suele ser secundaria a una infección ascendente del aparato genital inferior transmitida por vía sexual, aunque la diseminación hematógena y la extensión directa de una infección adyacente también son posibles. La infección vaginal o cervical progresa por vía ascendente y produce endometritis, seguida de salpingitis. Sin tratamiento adecuado, la enfermedad inflamatoria pélvica puede extenderse al ovario y dar lugar a abscesos tubo-ováricos. Neisseria gonorrhoeae y Chlamydia trachomatis son los agentes causales en dos tercios de los casos1. Las pacientes portadoras de dispositivo intrauterino son propensas a presentar un tipo especial de enfermedad inflamatoria pélvica producida por Actinomyces israelii, que da lugar a una infección supurativa crónica, a veces difícil de diferenciar de las neoplasias pélvicas con carcinomatosis6. En estadios precoces de la infección pueden no reconocerse cambios, y la ecografía y la TC ser normales. Otras veces, las manifestaciones son sutiles y no específicas, pudiendo identificarse un útero aumentado de tamaño y mal definido, o líquido libre en la pelvis o endometrial (signo muy inespecífico y frecuente en las mujeres jóvenes). Es importante identificar la existencia de pequeñas cantidades de líquido complejo en la pelvis que nos hagan sospechar que se trate de pus libre23. La identificación de una trompa uterina dilatada es el hallazgo más característico (fig. 6)24. Son frecuentes las adherencias dentro de las trompas produciendo obstrucción tubárica, con hidrosálpinx y piosálpinx. En caso de piosálpinx puede identificarse una estructura tubular, serpiginosa, que contiene material ecogénico en su interior correspondiente a pus, niveles liquido-líquido o realce aumentado en la TC. En etapas posteriores pueden formarse abscesos tubo-ováricos, que son conglomerados inflamatorios que engloban el ovario y la trompa uterina, con complejas colecciones líquidas que a veces contienen burbujas de gas. En la ecografía y la TC la apariencia es variable, pudiendo presentarse como masas anexiales puramente quísticas, con múltiples loculaciones, con paredes y tabiques gruesos que realzan con el contraste en la TC, y residuos (fig. 7). La ecografía Doppler muestra característicamente un aumento de la vascularización. Puede haber afectación de estructuras adyacentes, provocando un íleo adinámico de las asas intestinales, una dilatación ureteral o hidronefrosis por obstrucción mecánica o funcional de los uréteres, o un síndrome de Fitz-Hugh-Curtis24 cuando los exudados inflamatorios pélvicos se extienden por la gotiera paracólica hasta la superficie peritoneal anterior del hígado produciendo perihepatitis asociada a enfermedad inflamatoria pélvica.
- •
Diagnóstico diferencial:
Endometriomas, quiste hemorrágico, tumores ováricos y apendicitis.
- •
Manejo:
La ecografía es el método inicial de estudio. La TC se utiliza para valorar la extensión del proceso y posibles complicaciones asociadas. Con los actuales métodos de imagen, la laparoscopia/laparotomía queda reservada para los casos complejos o complicados, con fines tanto diagnósticos como terapéuticos.
Enfermedad inflamatoria pélvica avanzada. a) Ecografía, corte transversal. Absceso tubo-ovárico (entre marcas) que se presenta como una masa loculada, de apariencia compleja, afectando a la trompa uterina y al ovario. b) Ecografía, corte longitudinal. Piosálpinx con trompa uterina dilatada con contenido líquido complejo en su interior (flecha). c y d) Tomografía computarizada con contraste, cortes axial y sagital. Masa loculada, con múltiples estructuras quísticas serpiginosas de paredes engrosadas, compatibles con abscesos (flechas blancas). Se aprecia realce del peritoneo adyacente (flecha negra).
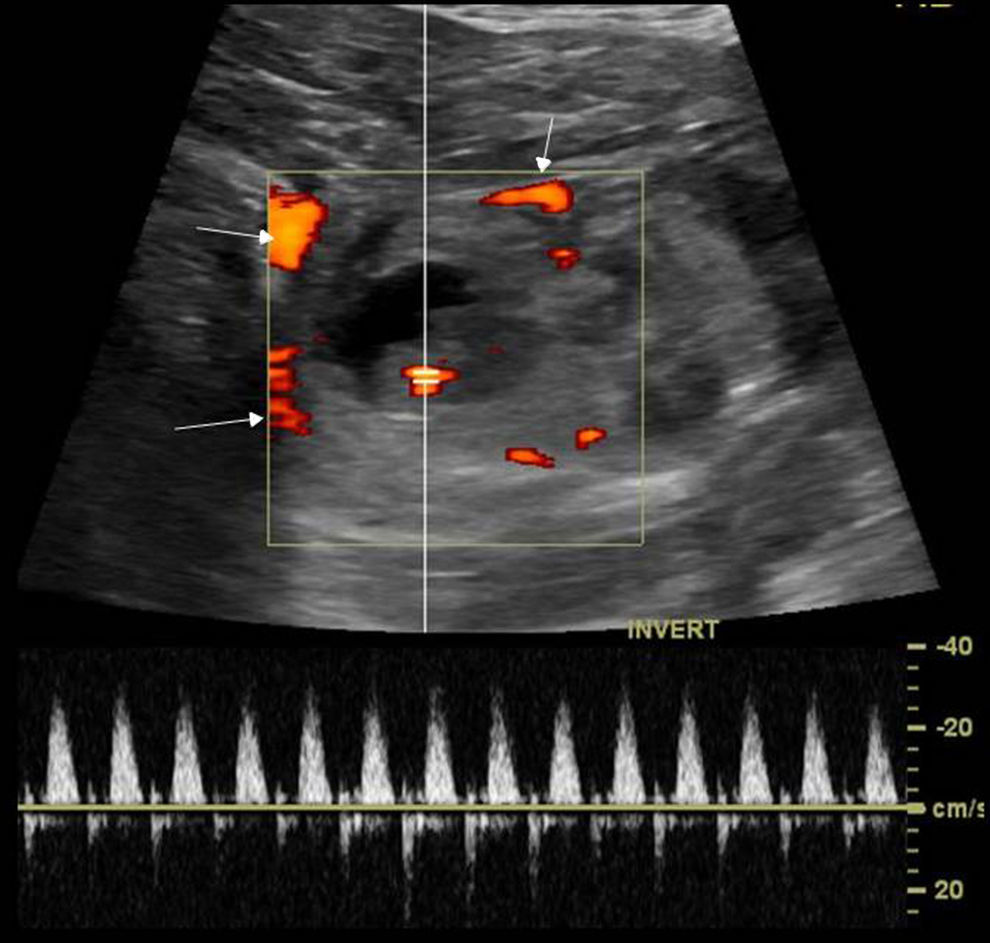
La torsión de anejos es una causa infrecuente, pero grave, de dolor pélvico agudo25 que se produce por la rotación parcial o completa del ovario o la trompa, y con más frecuencia de ambos, sobre su ligamento suspensorio y pedículo vascular, ocasionando una afectación progresiva del flujo linfático, venoso y arterial que provoca congestión del parénquima, y si se mantiene, infarto y necrosis26. Puede ocurrir en los ovarios y las trompas normales (principalmente en adolescentes con laxitud de los ligamentos suspensorios o hipermovilidad tubárica)27, o ser secundario a quistes o masas (mayores de 5cm), siendo el teratoma quístico maduro o quiste dermoide28 el tumor que más a menudo predispone a la torsión.
Los quistes dermoides son en general asintomáticos y se descubren de forma fortuita. En la TC presentan atenuación grasa en más del 90% de los casos. Ante un dolor pélvico intenso y un quiste dermoide de gran tamaño debemos pensar en la posibilidad de torsión. En estos casos se puede identificar un engrosamiento mural del mismo29 o líquido libre.
La torsión anexial es infrecuente en pacientes con antecedentes de enfermedad inflamatoria pélvica, endometriosis o neoplasias malignas, lo cual puede deberse a la presencia de adherencias que inmovilizan relativamente el ovario26.
Los hallazgos ecográficos en modo B son variables, dependiendo del tiempo de evolución, del grado de afectación vascular y de si existe o no una masa asociada30 (fig. 8). Entre estos hallazgos se encuentran:
- •
El signo más frecuente es un aumento de tamaño del ovario, mayor de 4cm, que aparece hiperecogénico por la congestión venosa.
- •
Signo del collar de perlas: múltiples pequeños folículos en la periferia del ovario aumentado de tamaño, desplazados por el edema y la congestión venosa. Es el único signo relativamente específico, aunque no siempre está presente.
- •
El ovario torsionado se sitúa en posición medial, por encima del útero, estando este desviado hacia el ovario afecto; hallazgo presente en más del 40% de los casos30.
- –
Masa anexial asociada: las mayores de 5cm tienen más riesgo de torsión.
- –
Líquido libre en la pelvis: no específico.
- –
Puede visualizarse el pedículo vascular torsionado como una imagen en diana, adoptando los vasos torsionados una morfología circular o en espiral («signo del remolino»)30,31. Este signo se ha sugerido como patognomónico.
- –
Torsión de ovario. a) Ecografía, corte longitudinal. Ovario aumentado de tamaño, hiperecogénico, con folículos periféricos, b) Ecografía, corte longitudinal. Imagen quística que corresponde a necrosis ovárica por torsión de largo tiempo de evolución. c) Tomografía computarizada (TC) sin contraste, corte coronal. Ovario izquierdo en posición anómala, aumentado de tamaño y con múltiples folículos periféricos. Útero (U) desplazado hacia el lado afecto, trompa uterina engrosada y edematosa (flecha blanca) y líquido libre (flecha amarilla). d) TC sin contraste, corte coronal. Tumor dermoide que contiene grasa y calcio (asterisco) con engrosamiento mural, líquido libre (flechas blancas) y aumento de densidad de la grasa adyacente (asterisco).
Mediante Doppler color, los hallazgos son muy variables30. La ausencia de señal Doppler color no es un criterio fiable de torsión porque puede haber ausencia de señal en ovarios normales, y la presencia de señal arterial Doppler no excluye el diagnóstico de torsión, debido a que el ovario recibe una doble vascularización arterial y a la posibilidad de una torsión incompleta. En cambio, la presencia de curvas de ondas de flujo arterial de alta resistencia con flujo venoso ausente es muy sugerente de torsión en un contexto clínico adecuado. La importancia del Doppler radica en la determinación de la viabilidad preoperatoria del ovario, aunque esto puede resultar difícil. La existencia de flujo en el interior del ovario sugiere que el ovario puede ser viable, en especial si el flujo es central. Un dato de inviabilidad del ovario es la ausencia de flujo Doppler en el pedículo vascular torsionado, que se corresponde con un ovario necrótico o infartado en la cirugía. La precisión global de la TC es inferior a la de la ecografía en el diagnóstico de torsión anexial32.
Las complicaciones de la torsión anexial incluyen infarto, hemorragia, necrosis, infección y peritonitis.
- •
Diagnóstico diferencial:
Quistes hemorrágicos, enfermedad inflamatoria pélvica y endometriomas.
- •
Manejo:
La sospecha de torsión requiere una actuación quirúrgica urgente para salvar el máximo de tejido ovárico33.
La endometriosis se define como la presencia de tejido endometrial funcionante fuera de la cavidad uterina. El sitio más común es el ovario (80%), seguido por los ligamentos uterinos, el fondo de saco de Douglas, el peritoneo pélvico, las trompas uterinas, la vejiga y el recto-sigmoides34. Se caracteriza clínicamente por dolor pélvico de características cíclicas, debido a que este tejido endometrial ectópico es sensible a los estrógenos y prolifera sincrónicamente con el endometrio.
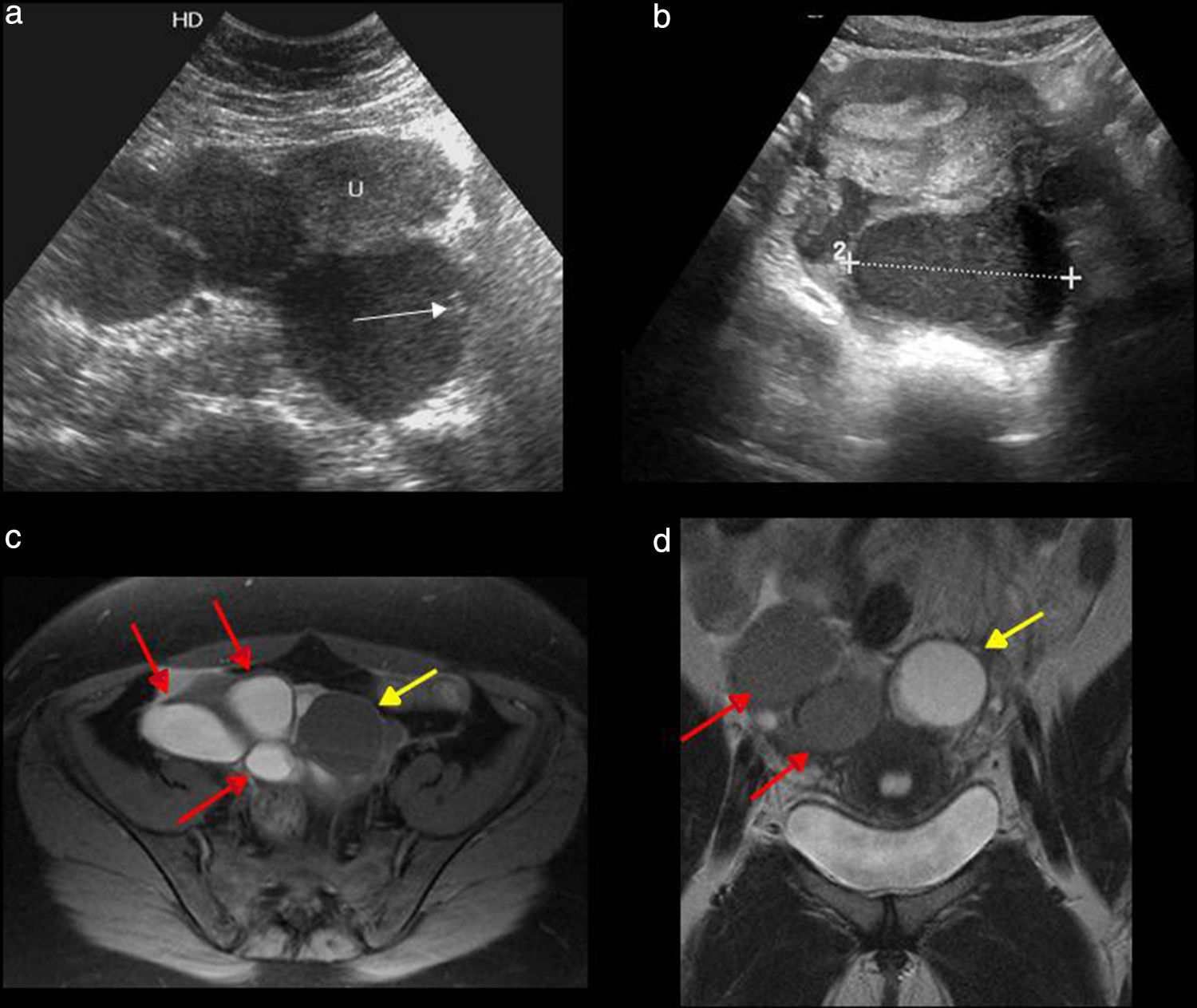
La tríada clínica clásica es dispareunia, dismenorrea e infertilidad36. Los hallazgos típicos de la endometriosis son los implantes endometriósicos, los endometriomas o quistes de chocolate (masas quísticas producidas por sangrados cíclicos repetidos), y las adherencias (secundarias al sangrado y a los cambios inflamatorios repetidos)35. Los signos ecográficos varían, pero la apariencia típica de los endometriomas es la de una masa anexial con ecos de bajo nivel en su interior, con ausencia de vascularización interna mediante Doppler color18. A veces tienen una apariencia sólida, pueden ser múltiples y presentar multiloculaciones con tabiques finos o gruesos (fig. 9 a y b). La apariencia de los ovarios «besándose» (unidos por detrás del fondo de saco uterino)34 es un signo indirecto de endometriosis, en particular de la forma más grave de la enfermedad, en la que existe una importante extensión pélvica con densas adherencias.
Endometriomas. a y b) Ecografías, cortes transversales. a) Múltiples quistes con contenido ecogénico de bajo nivel, uno de ellos con foco ecogénico debido a calcio en su pared (flecha). b) Imagen típica de endometrioma (línea punteada entre marcas) con ecos internos de bajo nivel. c) Resonancia magnética (RM), T1, con saturación grasa, corte axial. Estructuras quísticas hiperintensas que corresponden a endometriomas (flechas rojas), y quiste funcional de baja intensidad de señal (flecha amarilla). d) RM, T2, corte coronal. Endometriomas con baja señal de intensidad, efecto shadding (flechas rojas), y quiste funcional hiperintenso (flecha amarilla).
La RM ha demostrado una sensibilidad del 90% y una especificidad del 98% en la detección de endometriomas33. Los hallazgos en la RM son quistes hiperintensos en T1 e hipointensos en T2. Este fenómeno de shading o sombreado en T2 se produce por la alta viscosidad de la hemorragia recurrente dentro del quiste (fig. 9 c y d). En raras ocasiones puede presentarse como un cuadro agudo, con rotura o infección de un endometrioma1. En estos casos, en los que son indistinguibles de un absceso tubo-ovárico, solo el empleo de la RM puede definir la existencia de una endometriosis subyacente36. También puede ocurrir la presentación aguda en forma de oclusión o suboclusión intestinal por implantes subserosos intestinales que infiltran la pared, o por adherencias asociadas a implantes peritoneales.
- •
Diagnóstico diferencial:
Enfermedad inflamatoria pélvica, quistes hemorrágicos y tumores ováricos.
- •
Manejo:
El estudio inicial es la ecografía. Las masas quísticas con características clásicas de un endometrioma deben seguirse con ecografía si no se extirpan. La frecuencia del seguimiento es variable3, pero en general debe ser al menos anual para asegurarse de que no aumentan de tamaño y no presentan cambios en la arquitectura interna, ya que aproximadamente el 1% de los endometriomas (en general mayores de 9cm) pueden sufrir una transformación maligna, que suele ser endometrioide o carcinoma de células claras37,38.
El diagnóstico definitivo de la endometriosis es por laparoscopia con toma de biopsia33.
La RM es fundamental para determinar el grado de extensión y la profundidad de los infiltrados, en especial cuando la inspección laparoscópica está limitada por las adhesiones.
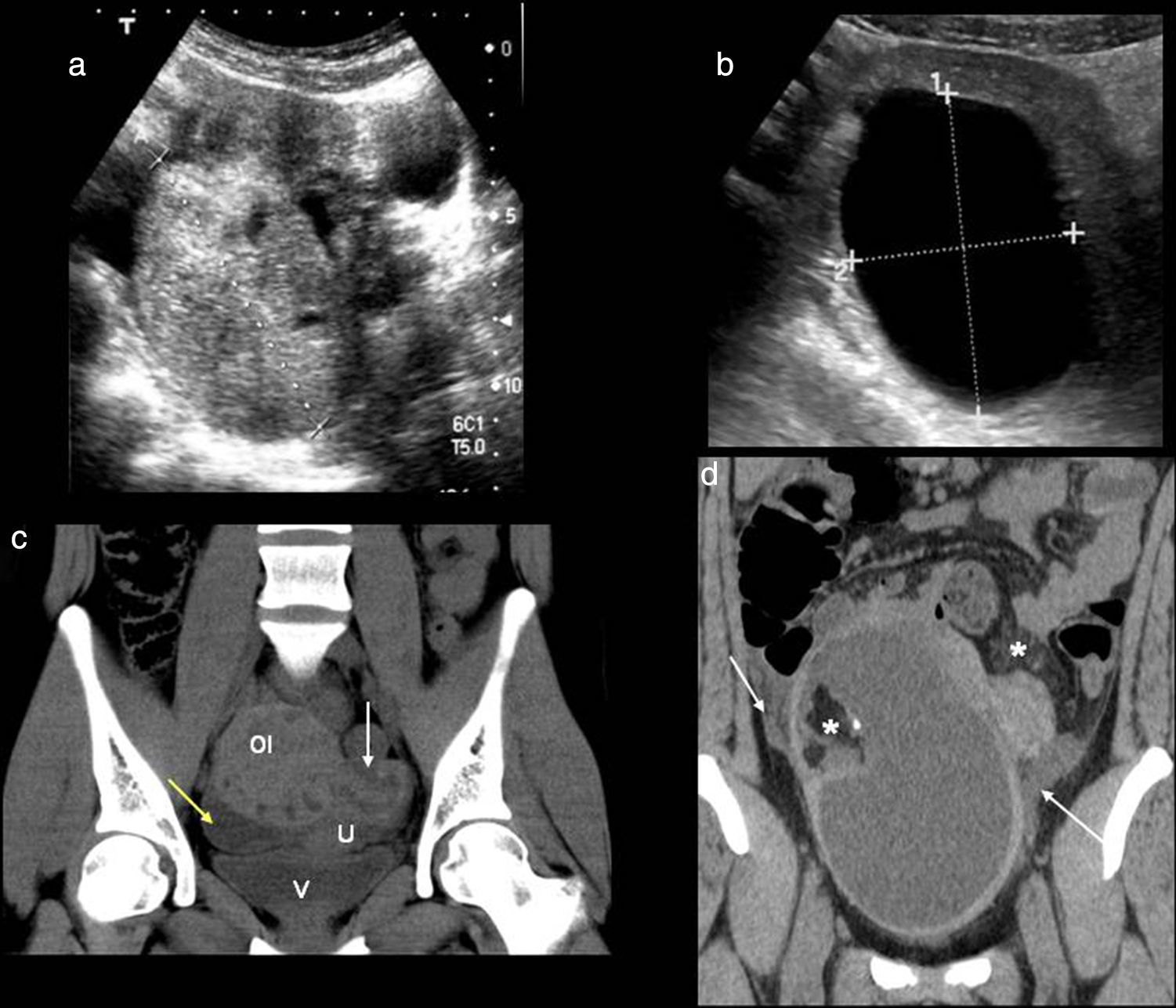
Torsión o degeneración aguda de un miomaLos tumores benignos del músculo liso (leiomiomas) son los tumores más frecuentes del útero y se encuentran en más de una quinta parte de las mujeres mayores de 30 años13. Son dependientes de estrógenos. En orden decreciente, su localización más frecuente es intramural, seguida de subserosa y submucosa. En la ecografía los encontramos como masas uterinas sólidas, tanto homogéneas como heterogéneas (por degeneración interna), que pueden tener calcificaciones en su interior (solo presentes en el 10% de los casos).
Estos tumores pueden comprimir estructuras vecinas, torsionarse o degenerar (degeneración quística, mixoide, hemorrágica) (fig. 10), provocando dolor pélvico en aproximadamente el 30% de las pacientes. Además del dolor, es posible el sangrado o el exudado vaginal, y no es raro que se acompañe de febrícula y leucocitosis. Los fenómenos de degeneración se producen cuando el crecimiento del mioma rebasa la capacidad de aporte vascular, como ocurre por ejemplo en las primeras 10 semanas del embarazo39. Radiológicamente se identifica un foco más o menos amplio e irregular de contenido líquido en el seno de una tumoración sólida que, si se dispone de estudios previos, habrá crecido notablemente en un corto tiempo. Los miomas pedunculados están predispuestos a la torsión40. Cuando esto ocurre, y se necrosan, muestran una ausencia de flujo Doppler en su interior o de realce en la TC con contraste intravenoso.
- •
Diagnóstico diferencial:
Masas anexiales en el caso de miomas subserosos.
- •
Manejo:
Miomectomía en caso de torsión. Embolización del mioma en casos seleccionados.
Miomas. a y b) Ecografías, cortes transversales. Mioma intramural (asterisco) y mioma subseroso con un área anecoica en su interior que representa un foco de degeneración hialina (flechas). c) Tomografía computarizada (TC) con contraste, corte axial. Mioma intramural con degeneración hialina que se muestra como una masa hipodensa que no realza con el contraste (flechas). d) TC sin contrate, corte axial. Mioma intramural (asterisco) con imagen semilunar hiperdensa debido a contenido hemorrágico. Mioma subseroso calcificado (flecha amarilla).
La patología ginecológica siempre debe estar presente en el diagnóstico diferencial del dolor pélvico agudo en la mujer. Numerosas afecciones de origen ginecológico, e incluso los cambios fisiológicos normales, pueden ser causa de dolor. La ecografía es el principal método de evaluación diagnóstica, ya que es una técnica no invasiva, accesible y rentable, y con resultados precisos. La TC queda relegada a los casos de dudas diagnósticas y para la valoración de la extensión del proceso o de posibles complicaciones. Los datos clínicos, junto con los hallazgos radiológicos, van a permitir en la mayoría de los casos realizar un diagnóstico diferencial adecuado que permita un tratamiento correcto.
Autoría- 1.
Responsabilidad de la integridad del estudio: ARD, AMJ
- 2.
Concepción del estudio: ARD, AGO, DAM
- 3.
Diseño del estudio: ARD, AMJ
- 4.
Obtención de los datos: ARD, AMJ, AGO, DAM, LCA
- 5.
Análisis e interpretación de los datos: ARD, AMJ, AGO, DAM,
- 6.
Tratamiento estadístico: no aplicable:
- 7.
Busqueda bibliográfica: AMJ, ARD
- 8.
Redacción del trabajo: ARD, AMJ
- 9.
Revisión crítica del manuscrito con aportaciones de interés relevante: ARD,
- 10.
AMJ, AGO, DAM, LCA.
- 11.
Aprobación de la versión final: ARD, AMJ, AGO, DAM, LCA
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo noaparecen datos del paciente.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.