Editado por: Dr. José Luis del Cura Rodríguez - Servicio de Radiodiagnóstico, Hospital Universitario Donostia, Donostia-San Sebastián, España
Más datosAunque el contraste intravenoso no es necesario en la inmensa mayoría de los procedimientos realizados con guía ecográfica, su uso puede permitir realizar procedimientos en aquellas lesiones que solo se visualizan con ecografía con contraste.
Los problemas que tiene son dos: el tiempo limitado del realce producido por el contraste, que requiere con frecuencia planificar varias inyecciones, y la mala visualización de la aguja, que requiere el uso de doble ventana de visualización.
Puede ser usada en la planificación y el control de los procedimientos diagnósticos y terapéuticos, tanto en la guía del procedimiento, para monitorizar el alcance del tratamiento, como en los controles posteriores. Su uso permite mejorar los resultados de ambos tipos de procedimientos. Puede ser usada también intracavitariamente.
Although not necessary for the vast majority of ultrasound-guided procedures, intravenous contrast agents can be useful for procedures aimed at lesions that require contrast enhancement to be seen on ultrasonography.
Using contrast-enhanced ultrasonography to guide procedures has two drawbacks: first, because enhancement from ultrasound contrast agents is short lived, it is often necessary to plan several injections; second, because the needle is poorly seen on contrast-enhanced ultrasonography, a dual image display format is necessary.
Contrast-enhanced ultrasonography can be used for planning and monitoring diagnostic and therapeutic procedures, for guiding the procedures, and for follow-up. Using contrast-enhanced ultrasonography enables better results in both types of procedures; moreover, it can be used within cavities.
La ecografía es sin duda la técnica ideal para guiar procedimientos en radiología: es barata, ampliamente disponible, no usa radiaciones ionizantes, permite un control en tiempo real de la posición de la aguja o catéter y un acceso versátil a cualquier lesión. Además, los ecógrafos se pueden trasladar a cualquier lugar y el tiempo requerido es inferior que con otras técnicas1.
Sin embargo, la condición fundamental para realizar un procedimiento con guía ecográfica es que la lesión sobre la que se va a actuar sea visible en la ecografía1. Ello hace que muchas lesiones, especialmente en el abdomen, no puedan ser biopsiadas o tratadas con control ecográfico.
En este contexto y, aunque el contraste intravenoso no es necesario en la inmensa mayoría de los procedimientos realizados con guía ecográfica, su uso puede permitir acceder a aquellas lesiones que se visualizan con ecografía con contraste, o incluso puede ser útil en aquellas en las que las lesiones son mejor visualizadas con el contraste2–4.
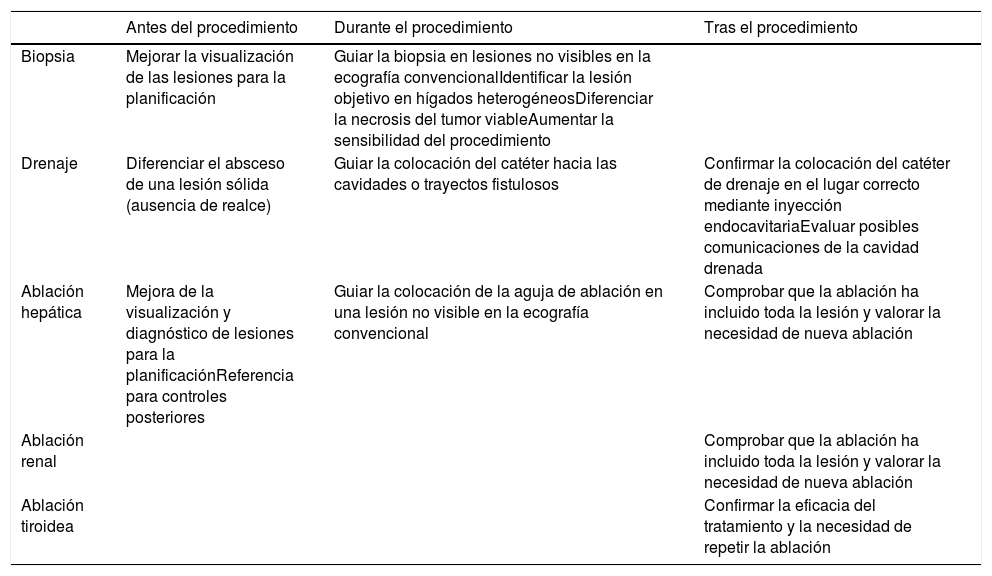
La ecografía con contraste puede asimismo ser usada en el control de los procedimientos terapéuticos, tanto durante el procedimiento, para monitorizar el alcance del tratamiento, como después de este, en los controles periódicos tras el mismo5–13 (tabla 1).
Usos de la ecografía con contraste en los procedimientos ecoguiados de radiología intervencionista
| Antes del procedimiento | Durante el procedimiento | Tras el procedimiento | |
|---|---|---|---|
| Biopsia | Mejorar la visualización de las lesiones para la planificación | Guiar la biopsia en lesiones no visibles en la ecografía convencionalIdentificar la lesión objetivo en hígados heterogéneosDiferenciar la necrosis del tumor viableAumentar la sensibilidad del procedimiento | |
| Drenaje | Diferenciar el absceso de una lesión sólida (ausencia de realce) | Guiar la colocación del catéter hacia las cavidades o trayectos fistulosos | Confirmar la colocación del catéter de drenaje en el lugar correcto mediante inyección endocavitariaEvaluar posibles comunicaciones de la cavidad drenada |
| Ablación hepática | Mejora de la visualización y diagnóstico de lesiones para la planificaciónReferencia para controles posteriores | Guiar la colocación de la aguja de ablación en una lesión no visible en la ecografía convencional | Comprobar que la ablación ha incluido toda la lesión y valorar la necesidad de nueva ablación |
| Ablación renal | Comprobar que la ablación ha incluido toda la lesión y valorar la necesidad de nueva ablación | ||
| Ablación tiroidea | Confirmar la eficacia del tratamiento y la necesidad de repetir la ablación |
La ecografía con contraste puede ser usada en la guía de procedimientos diagnósticos, como la biopsia, y terapéuticos, como la ablación percutánea de tumores. La técnica de los procedimientos cuando se usa la ecografía con contraste es similar a cuando no se usa este1. Sin embargo, hay ciertas diferencias que dependen de la necesidad de inyectar el contraste, de la duración del realce ecográfico, y de las diferencias en la visualización en el modo ecográfico de contraste de las agujas o catéteres empleados con respecto a la ecografía convencional.
Problemas específicosInyección de contraste ecográfico durante el procedimientoLa duración del realce producida por el contraste ecográfico es limitada en el tiempo. Ello condiciona que el tiempo empleado para el procedimiento específico (toma de biopsia, colocación del electrodo o de la antena en la lesión, etc.) esté limitado por lo que dura este realce.
El uso del contraste es útil en dos fases: durante la planificación del procedimiento, para identificar la lesión sobre la que se va a actuar, y posteriormente al realizar el procedimiento en sí. Por ello es frecuentemente necesario planificar al menos dos inyecciones, una antes y otra durante el procedimiento.
A veces el procedimiento dura más tiempo que lo que que dura el realce, en cuyo caso es conveniente preparar más de una dosis para inyectar la segunda (o sucesivas) en caso de necesidad. Una alternativa es el uso de una infusión continua, especialmente en la segunda fase, aunque no es algo imprescindible. Existen dispositivos en el mercado que permiten realizar esta infusión continua de contraste e incluso variar la velocidad de inyección.
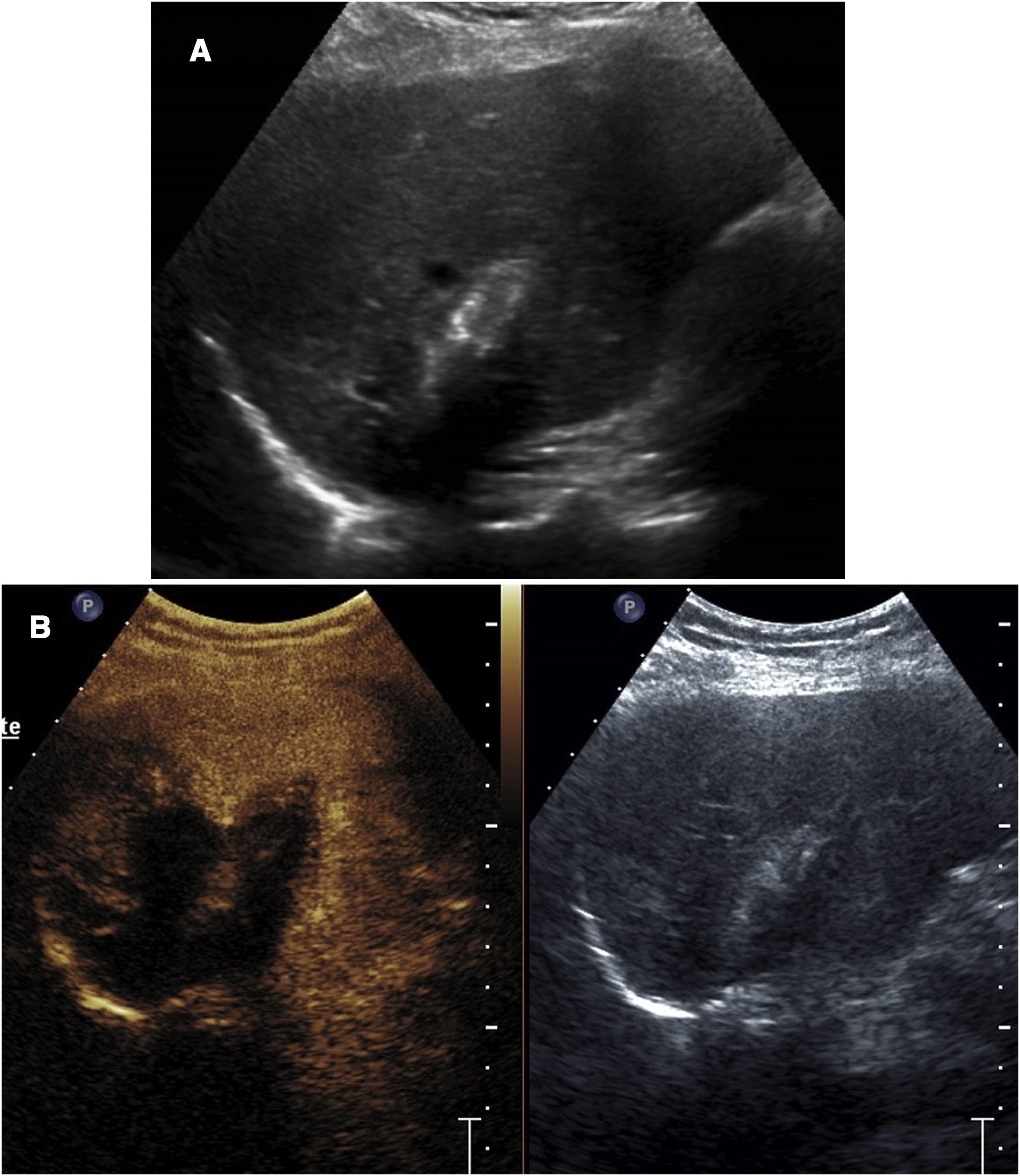
Visualización de las agujas durante el procedimientoSi se usa contraste, el modo de exploración que se va a usar al menos durante la parte crítica del procedimiento es el modo contraste. Este modo plantea ciertas dificultades a la realización de la técnica. Por una parte, los tejidos que no se realzan no son visibles en la ecografía. Por otra, la visualización de la aguja es mucho menos precisa que en la ecografía convencional. Con frecuencia la aguja aparece muy ecogénica, con un grosor aparente mayor que el real. A veces la posición aparente de la aguja con respecto a la lesión objetivo no es totalmente fiable (fig. 1).
Biopsia de metástasis hepática no visible en ecografía convencional. A) La imagen en dos ventanas muestra la lesión (flecha) visible en la ventana de contraste. En esa ventana, la aguja de biopsia casi es inapreciable, pero se ve perfectamente en la ventana de ecografía convencional. B) La biopsia se ha completado con éxito.
Por este motivo es recomendable usar la doble visualización durante la fase del procedimiento en que la aguja se introduce hacia la lesión. La ventana convencional, aunque de menor resolución que la ecografía estándar, permite monitorizar la aguja y sirve de complemento a la imagen contrastada para identificar con precisión la situación real de la aguja durante el procedimiento.
Ecografía con contraste como ayuda en la biopsiaBiopsia de lesiones no visibles en ecografía convencionalEn oncología, los métodos de imagen más sensibles y utilizados, tanto para diagnosticar como para estadificar las lesiones, son la tomografía computarizada (TC) y la resonancia magnética (RM), a los que hay que añadir con frecuencia la tomografía por emisión de positrones/tomografía computarizada (PET-TC).
En la medicina moderna, la biopsia se ha convertido en una herramienta altamente demandada, no solo para el diagnóstico de las lesiones, sino para identificar las dianas terapéuticas en los tratamientos oncológicos. En teoría, la TC y la RM serían las técnicas más adecuadas para guiar la obtención de una biopsia de una lesión. Sin embargo, la versatilidad de la ecografía, su capacidad multiplanar o la posibilidad de realizar los procedimientos en tiempo real y de forma mucho más sencilla han convertido a la ecografía en la técnica más adecuada para estos procedimientos cuando la lesión es visible en la ecografía1.
Sin embargo, puede ocurrir que una lesión que ha sido detectada mediante TC o RM no sea visible en la ecografía. Las alternativas en ese caso incluyen usar técnicas de fusión de imagen de ecografía y TC o RM, o realizar la biopsia con guía de TC.
Sin embargo, si la lesión es visible usando ecografía con contraste, aún es posible realizar la biopsia con ecografía, guiando la técnica en el modo contraste. Se ha comprobado que el uso de ecografía con contraste permite realizar biopsias de lesiones no visibles en ecografía convencional con un éxito técnico del 86-88,5%14–16 (fig. 1).
Incluso cuando la ecografía convencional es capaz de identificar una lesión, pero su acceso es complejo o peligroso, la ecografía con contraste permite en ocasiones identificar otras lesiones no visibles en la imagen basal que pueden ser biopsiadas de forma más sencilla o segura.
Planificación del procedimientoLas principales causas de muestra inadecuada en las biopsias son dos: no alcanzar el blanco, problema más habitual en lesiones de pequeño tamaño, y muestrear zonas necróticas de las lesiones, algo que ocurre especialmente en las lesiones de gran tamaño. Otro problema es la existencia de un hígado heterogéneo, en el que la identificación de la lesión que se intenta biopsiar puede ser difícil, algo que ocurre especialmente en pacientes cirróticos17.
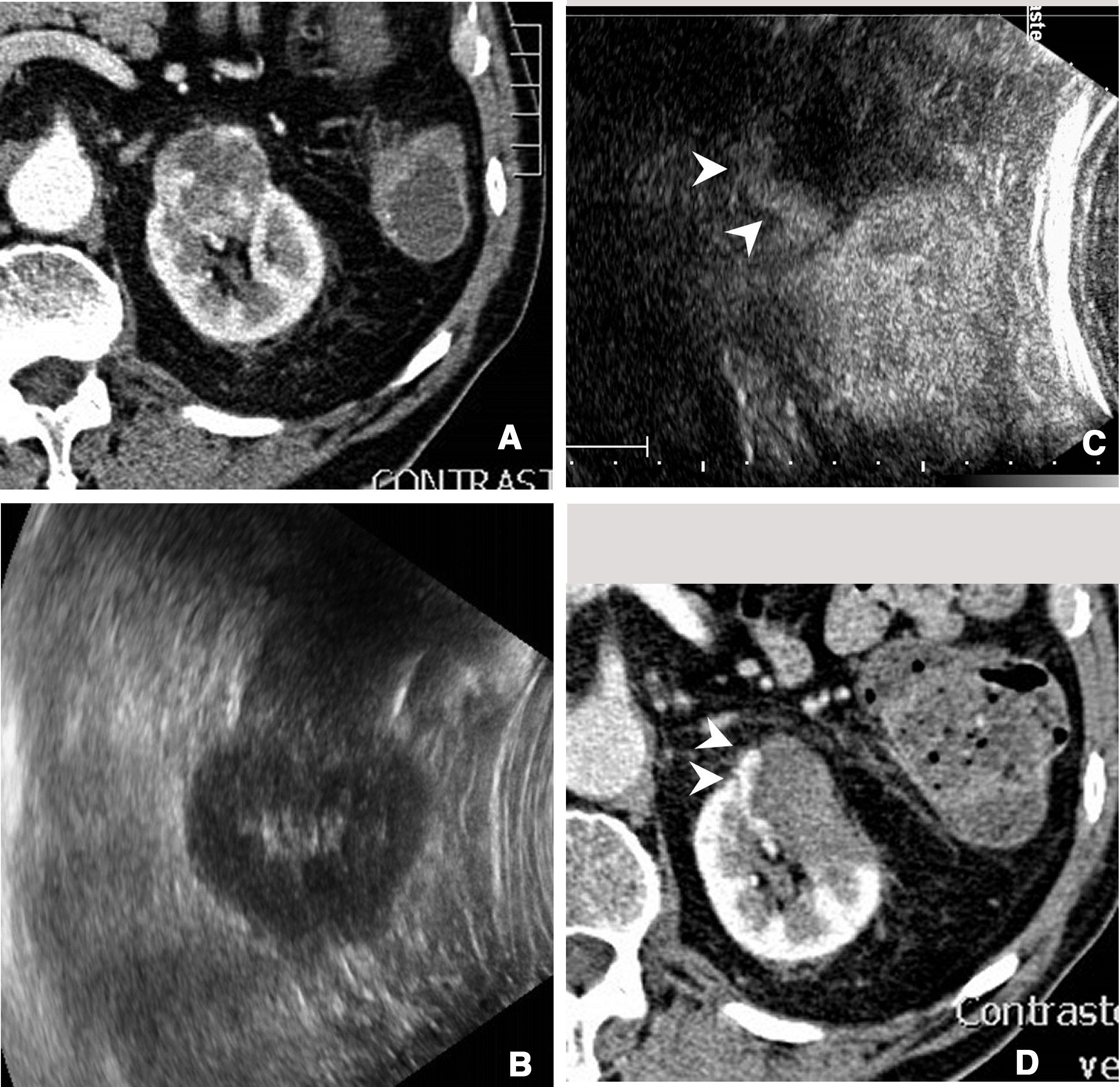
En los dos últimos problemas, el uso de la ecografía con contraste puede ser útil. En la planificación de la biopsia hepática aumenta en un 5-8% la fiabilidad de la técnica, siendo su efecto mayor en las lesiones malignas18,19 (fig. 2).
Metástasis hepática en la que se indicó biopsia con guía ecográfica. A) Al realizar la ecografía, la identificación de la lesión no estaba clara, por lo que se decidió realizar ecografía con contraste. B) La ecografía con contraste permitió identificar la lesión (flecha). C) Una vez identificada, la biopsia se dirigió a dicha lesión, con éxito.
El contraste ecográfico proporciona una herramienta excelente para la planificación de la biopsia, al permitir identificar las zonas necróticas del tumor que son aquellas que no se realzan. Posteriormente, se puede dirigir la biopsia a las zonas que se realzan. También permite en ocasiones identificar nuevas lesiones que pueden ser más accesibles a la biopsia2,4.
Mejorar la sensibilidad de la biopsiaEl contraste ecográfico, usado tanto antes como durante el procedimiento, ha demostrado su utilidad para aumentar la sensibilidad de la biopsia y disminuir el número punciones necesarias en cada procedimiento19. En un estudio prospectivo sobre 171 tumores hepáticos se comprobó que en el grupo en el que se usó ecografía con contraste para guiar la biopsia se consiguió una sensibilidad significativamente más alta que en los que se usó la ecografía convencional (96,5% frente a 81,5%). Esta mejor sensibilidad se obtenía sobre todo en hígado cirrótico (95,2% frente a 75%), en lesiones mal visualizadas en ecografía convencional (100% frente a 66,6%) y en lesiones de más de 6cm (97,8% frente a 82%). La causa, en los dos primeros casos, es que el contraste permite mejorar la identificación de las lesiones, mientras que en el último el contraste ayuda a evitar las zonas necróticas17.
Este aumento de la sensibilidad de la biopsia usando contraste ecográfico ha sido demostrado también en pulmón, cuello y en tumores musculoesqueléticos, especialmente en los sarcomas, y se produce especialmente en las lesiones grandes, en las malignas y en las lesiones metastásicas con componente necrótico significativo4,20–23.
Ecografía con contraste como ayuda en los procedimientos ablativosLos tratamientos ablativos percutáneos vienen siendo cada vez más utilizados como opciones no quirúrgicas, a veces incluso de primera elección, en el tratamiento de tumores en hígado, riñón, tiroides, hueso, suprarrenales, próstata o útero. Para la guía de estos procedimientos se pueden usar tanto la TC como la ecografía. La crioablación, por sus características específicas, requiere de guía por TC, pero para el resto de las técnicas, radiofrecuencia y microondas, la guía ecográfica es la preferida para el acceso a la lesión, por las mismas razones que ocurrían con la biopsia1.
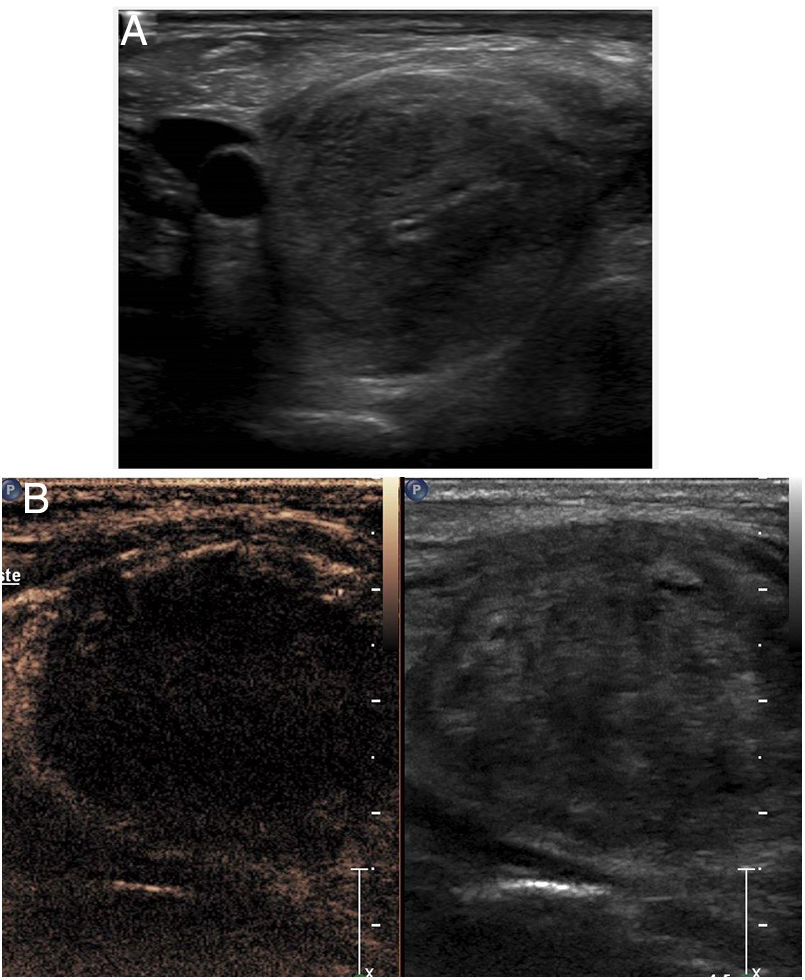
La ecografía con contraste puede usarse en la ablación, al igual que en la biopsia, para la guía de los procedimientos en lesiones mal visualizadas en la ecografía convencional (fig. 3).
Ablación de metástasis hepática, no visible en ecografía convencional. A) La lesión (flecha) solo es visible en la ventana de contraste. En la ventana de ecografía convencional, la aguja de ablación se identifica mejor (puntas de flecha). B) La ablación ha comenzado, pudiéndose observar la formación de burbujas ecogénicas en la punta de la aguja.
Pero además puede usarse como herramienta diagnóstica tanto en la evaluación inmediata del resultado de la ablación como en el seguimiento de las lesiones tras el tratamiento para la detección de recidivas.
HígadoPlanificación del tratamientoComo se ha comentado al hablar de la biopsia, la ecografía con contraste permite aumentar la sensibilidad de la ecografía en la detección de las lesiones hepáticas, lo cual es útil también de cara al tratamiento. Los pacientes que son evaluados con ecografía con contraste antes de la ablación tienen una menor tasa de recidivas o ablaciones incompletas que los que son evaluados solo con ecografía. Los bordes de los tumores son mejor detectados tras administrar contraste ecográfico y permite identificar mejor su relación con las estructuras circundantes, lo que facilita adaptar la estrategia de tratamiento y reduce los riesgos de complicaciones24,25.
Asimismo, el contar con una exploración previa de ecografía con contraste sirve de referencia para controles posteriores mediante esta técnica, tanto los realizados durante el procedimiento de ablación como los controles posteriores a la ablación.
Durante la ablaciónPor el mismo motivo, puede usarse para guiar la colocación del electrodo o la antena de ablación en una lesión no visible en la ecografía sin contraste. La técnica de acceso a la lesión es la misma que se ha descrito para la biopsia, aunque en este caso la colocación de la aguja es más fácil debido a su mayor grosor, que la hace más visible. La aguja se inserta cuando la lesión es visible, y se guía hacia esta26–29 (fig. 3).
Se ha demostrado que el uso de guía con ecografía con contraste permite aumentar la eficacia de la ablación respecto al uso de ecografía convencional para el guiado, disminuyendo el número de sesiones necesarias para obtener una ablación completa y aumentando la ratio de ablaciones completas en una sola sesión del 84% al 94%26,27.
Al finalizar la ablaciónLa ecografía con contraste es útil para comprobar, al final del procedimiento, si el volumen de ablación es suficiente e incluye todas las áreas objetivo. El uso de contraste añade a la ecografía una información funcional que la ecografía convencional, basada en la morfología, no tiene. La necrosis de los tejidos hace que se destruya su red microvascular y que no capten contraste ecográfico5–7. Este es el signo clave en esta aplicación del contraste. También permite detectar complicaciones, como los infartos causados por la lesión de los vasos como consecuencia del tratamiento.
Este uso plantea dificultades específicas, pues durante la ablación se forma una nube de burbujas que dificulta mucho la interpretación de la exploración. Es conveniente, por tanto, esperar unos 10 minutos al menos a que estas burbujas se disipen, antes de inyectar el contraste.
Esto es útil para valorar si se necesitan ablaciones adicionales para completar el tratamiento, incrementando así la eficacia de la técnica5–7. Se usa con menos frecuencia, dadas las dificultades descritas, pero está especialmente indicada cuando el electrodo o la aguja se han desplazado durante la ablación o cuando hay un vaso cercano que puede refrigerar la zona tratada dejando áreas del tumor sin tratar.
Si se realizan nuevos tratamientos, se pueden administrar dosis adicionales de contraste para volver a evaluar los resultados.
Seguimiento de las lesiones tratadasLos criterios de evaluación de respuesta al tratamiento antitumoral en tumores sólidos (RECIST) no son adecuados para el tratamiento locorregional debido a la escasa relación entre la necrosis y el tamaño del tumor. Después de las ablaciones térmicas, los tumores completamente necróticos pueden permanecer sin cambios en tamaño, mientras que los tumores que se contraen pueden ser parcialmente viables. Para el carcinoma hepatocelular, el indicador de imagen de la ablación completa es la desaparición de cualquier realce intralesional. Este mismo criterio se aplica a la ecografía con contraste2,7–10,30.
Aunque la ecografía con contraste puede ser fiable a la hora de detectar la presencia de recurrencia local o ablación incompleta en un nódulo tratado, la TC y la RM tienen una notable ventaja, y es que proporcionan una visión general del hígado, lo que permite detectar tumores más allá de la zona tratada, e incluso más allá del hígado, por lo que no pueden ser reemplazadas en el seguimiento de los tumores tras la ablación.
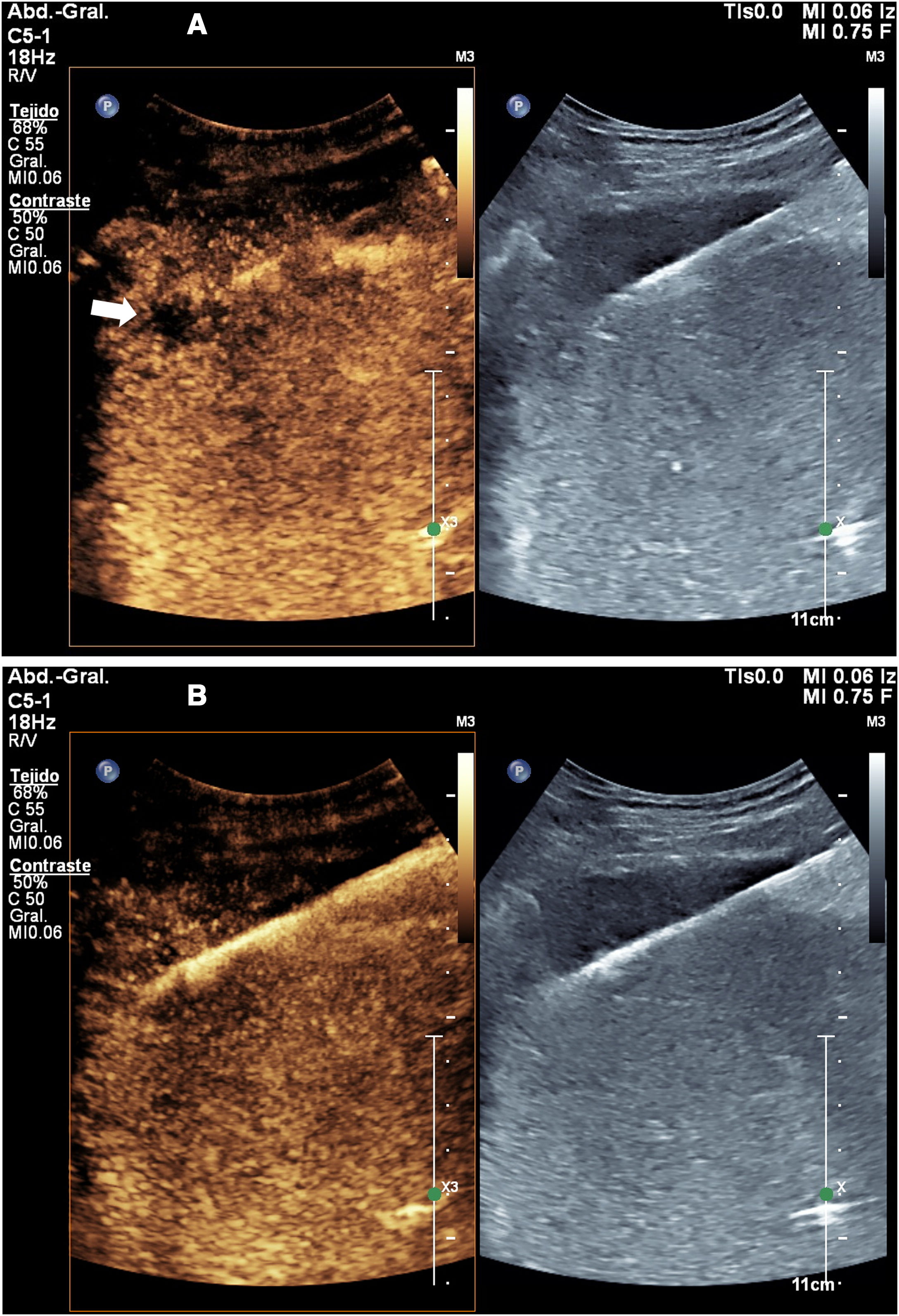
Hemos encontrado útil realizar una ecografía con contraste a las 24 horas de la ablación, ya que nos permite identificar el resultado de la ablación, visualizar el volumen real de tratamiento y compararlo con el volumen teórico, identificar áreas insuficientemente tratadas, y diagnosticar algunas complicaciones, especialmente las vasculares (fig. 4). La información obtenida en esta exploración nos ha permitido modificar nuestra técnica de ablación, adaptándola a cada circunstancia específica, obteniendo así mejores resultados y, en algún caso, detectar lesiones insuficientemente tratadas que han requerido nuevos procedimientos.
Control a las 24 horas de ablación por microondas de metástasis hepática. A) La ecografía muestra la característica imagen en líneas paralelas del tracto de ablación por microondas. La extensión de la zona tratada no puede determinarse. B) La ecografía con contraste permite identificar la zona coagulada, que no se realza.
Al realizar la ecografía con contraste de una lesión que ha sido tratada, se debe evaluar todo el volumen de cada tumor que ha sido sometido a ablación, comparándolo con el volumen antes del tratamiento. Es útil usar imagen dual contraste/no contraste.
En la evaluación postablativa temprana (dentro de los primeros 30 días), puede verse un realce alrededor de la región necrótica, similar a los hallazgos en la TC. Este halo hiperémico perilesional es fisiológico y no debe interpretarse como tumor viable residual2,7–10,30.
Las lesiones metastásicas, por su parte, son difíciles de evaluar debido a que o no presentan realce o este es breve, lo que en general no permite distinguir una recidiva de una zona de ablación29. En estas lesiones, la ecografía con contraste carece de interés para los controles.
RiñónLa ablación percutánea es una de las opciones de tratamiento en los tumores renales y en concreto en el carcinoma de células renales. Está indicada especialmente en tumores T1a (<4 cm). Sus resultados son excelentes, con un éxito terapéutico de alrededor del 90%. La American Urological Association la recomienda incluso como primera opción en pacientes con enfermedad con alto riesgo quirúrgico o en caso de riñón único31.
Antes de la ablaciónDebido a que los tumores renales captan contraste de forma similar al parénquima renal (con la excepción del papilar y el cromófobo), la utilidad de la ecografía con contraste es menor en la planificación del procedimiento de ablación renal. Puede ser útil, sin embargo, realizar una ecografía con contraste antes de la ablación para que sirva de referencia en controles posteriores.
Durante el procedimientoLa ecografía con contraste renal tiene los mismos problemas que en el hígado, debido a la aparición de burbujas aéreas como consecuencia del tratamiento. Sin embargo, puede ser útil, al igual que en el hígado, para comprobar, al final del procedimiento, si el volumen de ablación es suficiente e incluye todas las áreas objetivo, y algunos autores han demostrado un aumento de la eficacia terapéutica de la ablación cuando se usa la ecografía con contraste de este modo. También aquí hay que dejar pasar al menos 10 minutos antes de realizar la exploración para permitir que el gas generado por la ablación se disipe4,10,32,33.
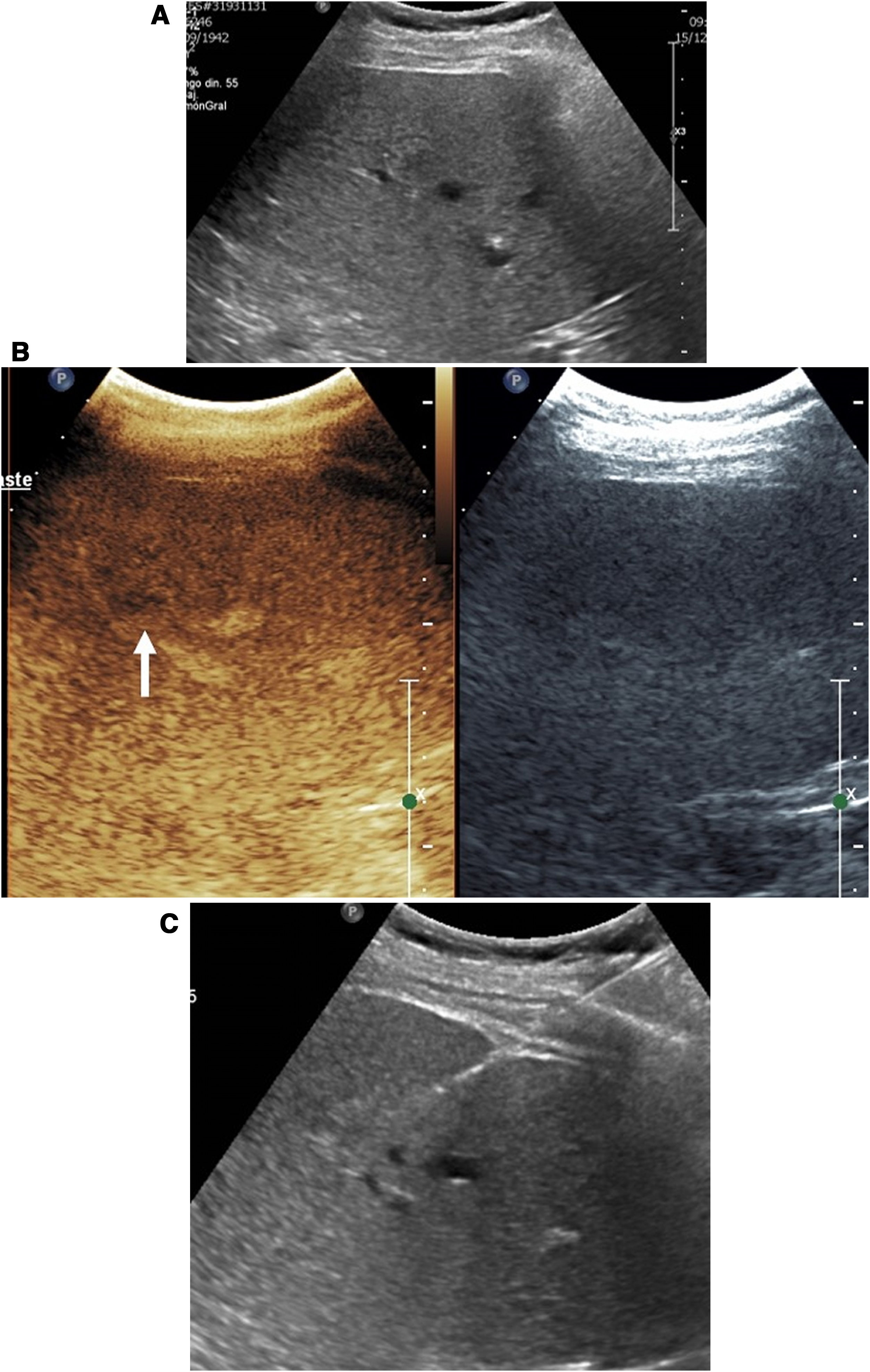
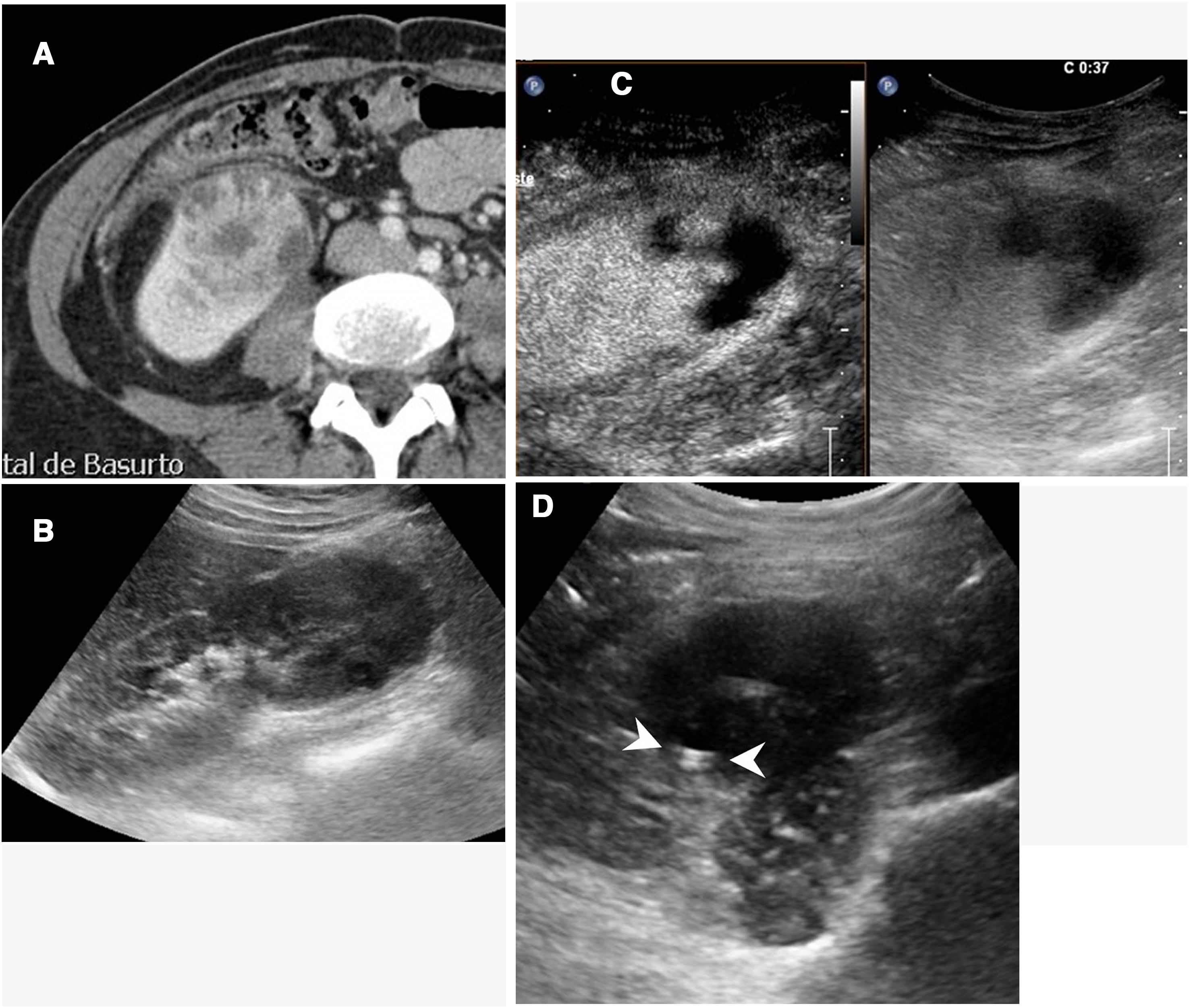
En el seguimientoLa principal utilidad de la ecografía con contraste en el riñón es en la evaluación inicial al día siguiente de realizar la ablación33 (fig. 5). Usada de esta manera, permite demostrar precozmente la existencia de ablaciones incompletas.
Ablación incompleta de carcinoma renal. Tomografía computarizada (A) y ecografía (B) renal mostrando un tumor sólido. Se decidió tratamiento mediante ablación por radiofrecuencia. C) La ecografía con contraste realizada a las 24 horas de la ablación mostró una semiluna de captación en la periferia del tumor tratado (puntas de flecha), indicando ablación incompleta. D) La tomografía realizada a continuación mostró exactamente el mismo hallazgo (puntas de flecha).
En el seguimiento posterior, la ecografía con contraste tiene una concordancia del 80-100% con los resultados de la TC y la RM en la detección de recidivas, aunque se ha descrito una cierta tendencia a presentar falsos positivos4,10–13,32,33. En cualquier caso, y dado que los tumores renales con frecuencia tienen una presentación múltiple y metacrónica, la ecografía con contraste no puede usarse como sustituto a la TC y la RM en los controles rutinarios de seguimiento postablación, aunque sí puede usarse para sustituir algunos de los controles.
TiroidesEn los últimos años se está produciendo un creciente interés en los tratamientos ablativos en tiroides. Se utiliza sobre todo como alternativa a la cirugía para disminuir el volumen en lesiones benignas, siendo la radiofrecuencia y el láser las técnicas más utilizadas para este fin.
La ecografía con contraste es la exploración ideal para la evaluación de los resultados de la ablación tiroidea (fig. 6). El tiroides es fácilmente accesible a la exploración ecográfica y el contraste proporciona información sobre el éxito terapéutico, tanto inmediato como en los controles sucesivos4,34. Nosotros la usamos como técnica de referencia (junto a la evaluación volumétrica de la lesión) para el seguimiento de las lesiones tratadas, programado una exploración cada 3-6 meses durante 2 años.
Usos intracavitariosLa inyección intracavitaria de contraste ecográfico puede ser una alternativa a los procedimientos radiográficos con inyección de contraste, siendo útil especialmente durante procedimientos que se realizan con guía ecográfica.
El problema del uso intracavitario reside en que el contraste, si se utiliza en la concentración empleada para su uso vascular, produce una pantalla sónica que oscurece los planos posteriores y dificulta la visualización de las estructuras. Por ello debe usarse más diluido, empleando una concentración similar a la usada en la ecocistografía. Las concentraciones que deben usarse han de tener en cuenta la necesidad de mantener la visualización del contraste durante el tiempo del procedimiento, que puede ser largo. Por ello es preferible que no estén en los rangos bajos de lo descrito en la literatura científica para balancear la duración de la visualización y la ausencia de sombra. Nosotros usamos 0,1 de contraste por cada 10ml de suero salino4,35–37.
Colangiografía y nefrostomía percutáneaSe ha descrito el uso de contraste ecográfico durante la colangiografía retrógrada endoscópica35. Aunque no es un procedimiento radiológico, abre la posibilidad de su uso en procedimientos intervencionistas biliares radiológicos.
En la nefrostomía percutánea se ha descrito que permite confirmar la posición de la aguja o el catéter, evaluar el sitio de la obstrucción y evaluar las complicaciones relacionadas con el catéter4,36.
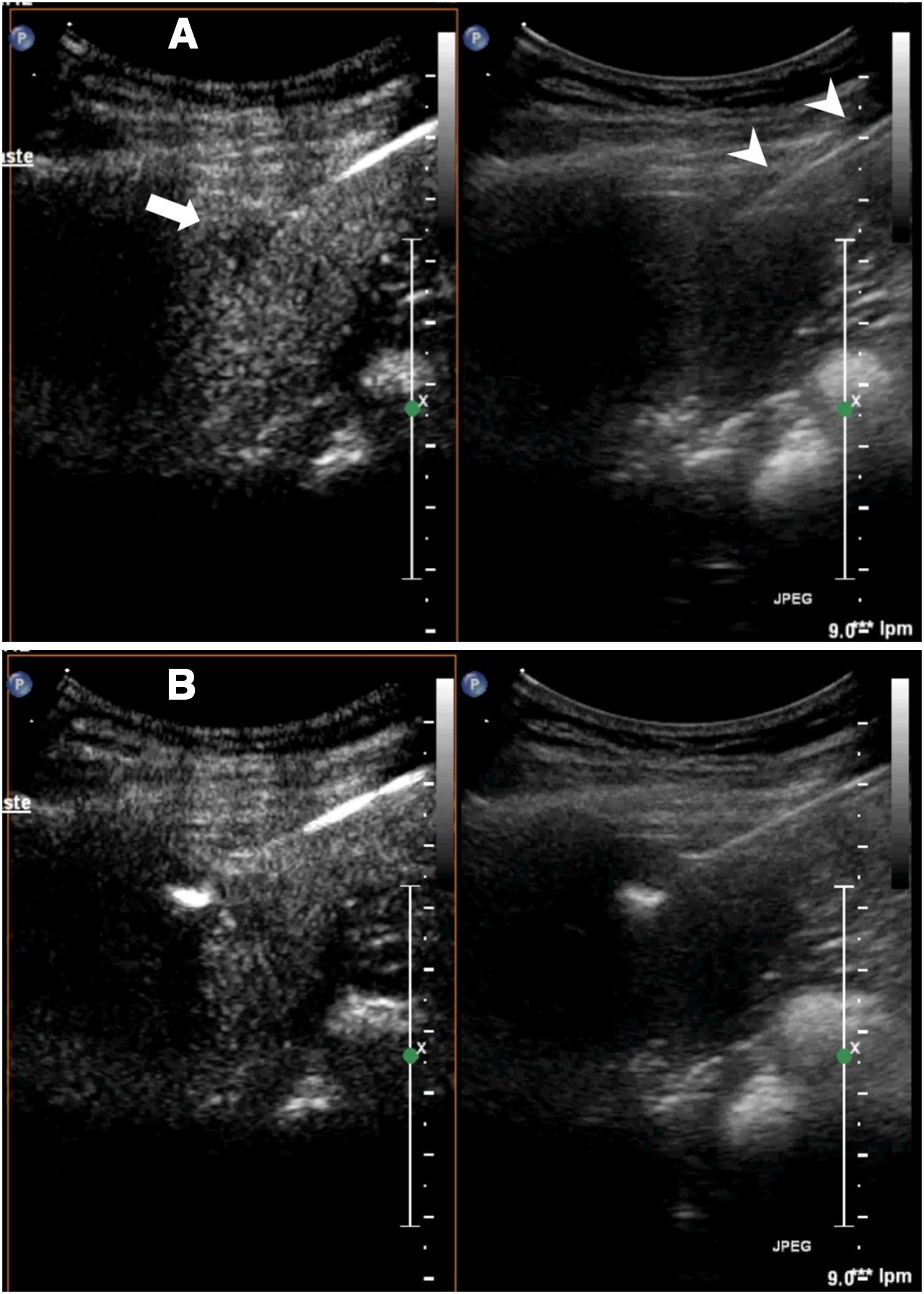
Drenaje de abscesosLa ecografía con contraste permite guiar la colocación percutánea de un drenaje en los casos en los que la distinción entre cavidad y tejido adyacente es dificultosa (fig. 7). Por una parte, permite identificar con confianza las zonas abscesificadas, que no se realzan y, por otra, se puede guiar el catéter hacia la zona que no se realza usando el modo contraste.
Absceso renal derecho. A) La tomografía computarizada muestra una imagen heterogénea en el polo inferior renal, con áreas líquidas. Se decidió realizar drenaje percutáneo. B) La ecografía muestra una lesión hipoecoica, pero no permite identificar con claridad el área líquida, por lo que la guía del procedimiento era complicada. C) La ecografía con contraste permitió identificar la zona de absceso, que no se realzaba, y guiar hacia ella el procedimiento. D) El catéter (puntas de flecha) está dentro de la cavidad. El paciente evolucionó rápidamente hacia la curación.
Asimismo, y al igual que para la nefrostomía, se ha descrito que la inyección directa de contraste ecográfico en un absceso facilita la confirmación de la posición correcta de la aguja o el catéter durante el procedimiento de drenaje percutáneo y permite la evaluación de cualquier comunicación entre cavidades en abscesos complejos4,37.
Nosotros lo hemos usado para detectar comunicaciones fistulosas, especialmente con tubo digestivo, en abscesos con un débito alto mantenido después de una semana de drenaje. Este procedimiento, sin embargo, puede hacerse de forma más económica inyectando contraste radiológico. También lo hemos usado, y esta aplicación no puede realizarse con ninguna otra técnica, para realzar una fístula de forma que permita inyectar con guía ecográfica en ella cianoacrilato para sellarla.
ConclusionesEl uso de la ecografía con contraste permite ampliar las indicaciones de los procedimientos guiados por ecografía a muchas lesiones no visibles en ecografía convencional.
Asimismo, ayuda en la planificación y el control de los procedimientos diagnósticos y terapéuticos, mejora la sensibilidad de las biopsias y la eficacia de los procedimientos terapéuticos y permite realizar un control inmediato del resultado de las ablaciones.
El uso de ecografía con contraste debe ser un procedimiento estándar en cualquier unidad que realice procedimientos con guía ecográfica, especialmente en el abdomen.
Autoría- 1.
Responsable de la integridad del estudio: JLC.
- 2.
Concepción del estudio: JLC.
- 3.
Diseño del estudio: JLC.
- 4.
Obtención de los datos: JLC, GC, RZ, IK.
- 5.
Análisis e interpretación de los datos: N/A.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: JLC, GC.
- 8.
Redacción del trabajo: JLC, GC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: RZ, IK.
- 10.
Aprobación de la versión final: JLC, GC, RZ, IK.
Los autores declaran no tener ningún conflicto de intereses.