Editado por: Dr. Tomás Ripollés González - Servicio de Radiodiagnóstico, Hospital Universitari Doctor Peset, València, España
Más datosEl abdomen agudo es un motivo de consulta habitual en los servicios de urgencias. Sus causas son múltiples, y entre ellas se encuentran diversas enfermedades del tracto gastrointestinal. Si bien la tomografía computarizada es la técnica más aceptada, con frecuencia se lleva a cabo una ecografía abdominal inicialmente, mediante la cual es posible establecer la sospecha de patología intestinal. Este artículo describe las características ecográficas de diversos trastornos intestinales que cursan con abdomen agudo, como la diverticulitis aguda, la obstrucción intestinal, la perforación gastrointestinal, la isquemia intestinal, la necrosis aguda de la grasa intraabdominal y una miscelánea de procesos, como endometriosis, cuerpos extraños o vasculitis. Debemos conocer las diferentes apariencias ecográficas del intestino anormal, ya que pueden detectarse incidentalmente en pacientes en quienes no se sospecha clínicamente. La semiología ecográfica de la patología intestinal, así como la apendicitis aguda, la enfermedad inflamatoria intestinal o las enfermedades infecciosas, se tratan en otros artículos de la serie.
Acute abdomen is a common reason for consultation in the emergency department. A broad spectrum of entities, including diverse diseases of the gastrointestinal tract, can cause acute abdomen. Although computed tomography is the technique most widely used to evaluate acute abdomen in the emergency department, abdominal ultrasound is often performed first and allows bowel disease to be suspected. This article describes the ultrasound features of diverse bowel diseases that can cause acute abdomen, such as acute diverticulitis, bowel obstruction, gastrointestinal perforation, bowel ischemia, intraabdominal fat necrosis, and miscellaneous processes such as endometriosis, foreign bodies, or vasculitis. Radiologists must be familiar with the different features of abnormal bowel that can be detected incidentally in patients without clinical suspicion of bowel disease. This article focuses on ultrasonographic signs of bowel disease; other articles in this series cover the ultrasonographic signs of acute appendicitis, inflammatory bowel disease, and infectious diseases.
Los pacientes con dolor abdominal agudo son un desafío para el radiólogo. En más de un tercio de ellos, la causa reside en una enfermedad intestinal urgente1. La ecografía se utiliza con frecuencia como herramienta de imagen inicial para la evaluación diagnóstica de estos pacientes y de aquellos con dolor abdominal inespecífico. El radiólogo debe conocer los diferentes patrones ecográficos del intestino normal y patológico2, ya que dichas alteraciones pueden detectarse incidentalmente, a pesar de no haberse sospechado clínicamente.
Algunos trastornos intestinales que cursan con abdomen agudo, como la apendicitis aguda3, la enfermedad inflamatoria intestinal o enfermedades infecciosas, se tratan en otros artículos de la serie. El actual trabajo aborda las otras urgencias intestinales más importantes, como la diverticulitis, la obstrucción intestinal, la perforación gastrointestinal, la isquemia intestinal, la necrosis aguda de la grasa intraabdominal y una miscelánea de procesos, con el objetivo de facilitar su detección y la correcta interpretación de sus hallazgos en la exploración ecográfica.
Diverticulitis agudaDiverticulitis aguda de colon izquierdoLos divertículos del colon izquierdo son herniaciones de las capas mucosa y submucosa; son falsos divertículos, sin capa muscular4. La hipertrofia muscular constituye el hallazgo morfológico distintivo y es visible ecográficamente en la mayoría de los casos. La diverticulosis afecta principalmente al sigma, debido a la mayor presión intraluminal. Tiene una incidencia superior al 50% en la población mayor de 60 años, que aumenta con la edad. Los divertículos indemnes se visualizan como pequeñas protrusiones hiperecogénicas por fuera de la pared intestinal, suelen contener aire y producen artefacto de reverberación5.
La diverticulitis aguda sucede por la inflamación de un divertículo tras su oclusión por material fecal. Es la causa más frecuente de dolor en el cuadrante inferior izquierdo. El diagnóstico debe confirmarse por imagen, ya que la evaluación clínica asocia una alta tasa de diagnósticos incorrectos y no permite determinar con fiabilidad si la diverticulitis está o no complicada. La ecografía y la tomografía computarizada (TC) han demostrado una eficacia similar para el diagnóstico de diverticulitis sigmoidea6,7. Una estrategia aceptada es emplear la ecografía como técnica inicial, y realizar una TC únicamente en los casos no concluyentes o por falta de experiencia8,9.
Existen numerosas clasificaciones de la diverticulitis aguda de colon izquierdo. La clasificación de Hinchey10, la más utilizada en las últimas décadas, depende de los hallazgos quirúrgicos y distingue cuatro niveles de gravedad: 1) absceso pericólico; 2) absceso pélvico, intraabdominal o retroperitoneal; 3) peritonitis generalizada purulenta, y 4) peritonitis generalizada fecaloidea.
En 2016, el grupo de la World Society of Emergency Surgery (WSES) propuso un sistema de clasificación basado en la extensión de los hallazgos en TC11, fácilmente aplicable en la práctica y con recomendaciones sobre el manejo; divide la diverticulitis aguda en complicada y no complicada, en función de que el proceso quede limitado a la pared del colon o se extienda al peritoneo, respectivamente (tabla 1). Los hallazgos ecográficos de la diverticulitis aguda no complicada (fig. 1A) son: a) discreto engrosamiento parietal concéntrico (4-5 mm) en el segmento de colon afectado; b) divertículo inflamado con escaso o nulo contenido gaseoso, con predominio de contenido hipoecogénico, y c) hiperecogenicidad de la grasa pericolónica adyacente al divertículo inflamado.
Clasificación de la diverticulitis aguda de colon izquierdo según la World Society of Emergency Surgery11
| Tipos | Hallazgos | Tratamiento |
|---|---|---|
| No complicadas | ||
| Tipo 0 | Inflamación diverticularEngrosamiento de paredes colónicasAlteración flemonosa del mesocolon | Conservador |
| Complicadas | ||
| Tipo 1a | Burbujas de gasPequeña colección sin absceso (a una distancia <5 cm del divertículo) | Conservador |
| Tipo 1b | Absceso <4 cm de tamaño | Conservador |
| Tipo 2a | Absceso >4 cm de tamaño | Drenaje |
| Tipo 2b | Gas ectópico distal (a una distancia> 5 cm del divertículo) | Conservador o cirugía |
| Tipo 3 | Líquido libre difuso sin gas ectópico distal (sin solución de continuidad parietal) | Conservador o cirugía |
| Tipo 4 | Líquido libre difuso con gas ectópico distal (con solución de continuidad parietal) | Cirugía |
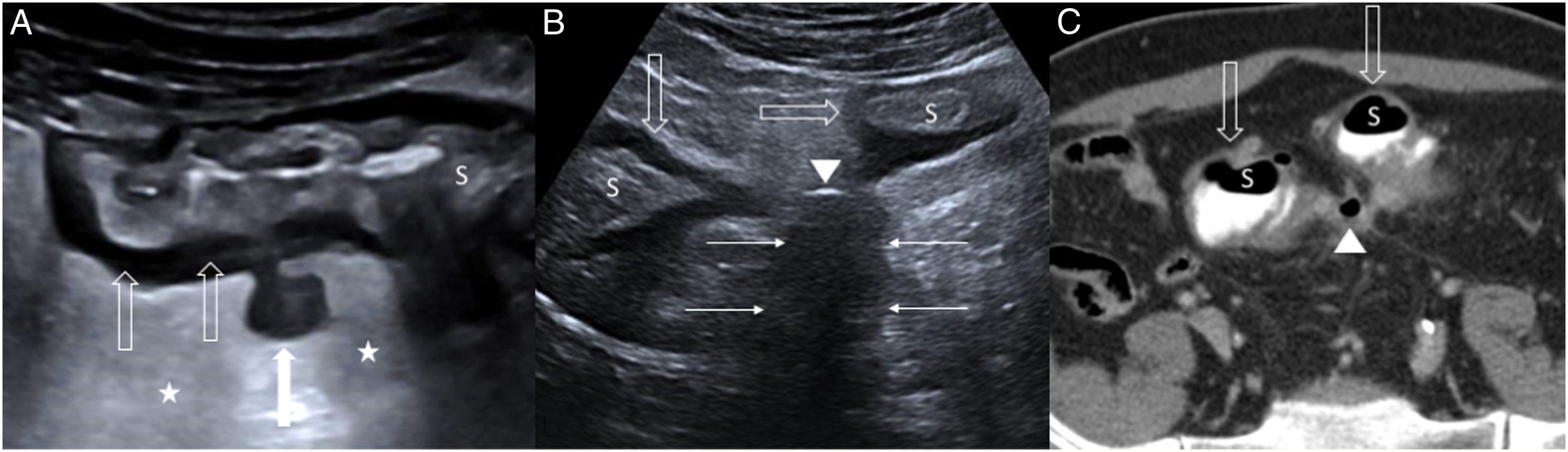
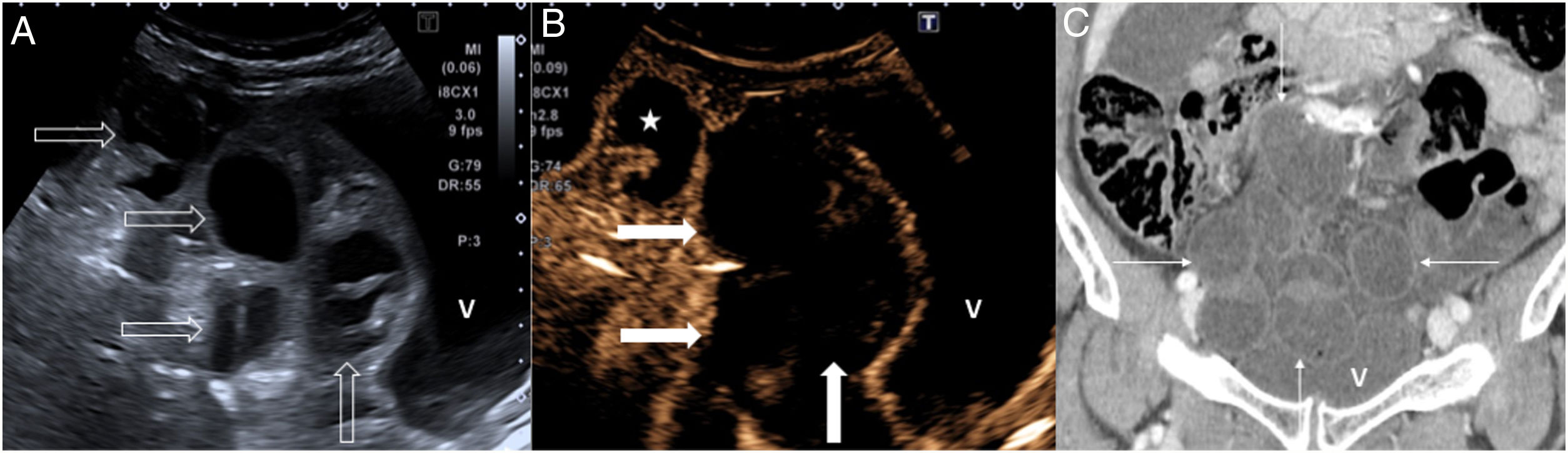
A) Diverticulitis aguda de colon no complicada (tipo 0) en ecografía. Divertículo inflamado con contenido hipoecogénico (flecha blanca), engrosamiento parietal concéntrico (flechas huecas) en el sigma (S) con conservación de la ecoestructura en capas, e hiperecogenicidad de la grasa perisigmoidea (estrellas) por inflamación. B y C) Diverticulitis aguda de colon complicada (tipo 1b) en ecografía y tomografía computarizada, respectivamente. Colección líquida (únicamente mostrada en ecografía) hipoecogénica, inferior a 4 cm (flechas finas), junto al sigma (S), el cual presenta engrosamiento parietal circunferencial (flechas huecas); existe una burbuja de gas extraluminal (punta de flecha) en el interior de dicha colección.
Las complicaciones características son la formación de abscesos, perforación, fístulas y estenosis. Los abscesos se observan como colecciones hipoecogénicas, que a veces contienen detritos ecogénicos o burbujas de gas en su interior (fig. 1B y C). La ecografía con contraste es útil para discriminar entre área flemonosa y absceso, ya que éste no demuestra realce interno, y para delimitar correctamente su tamaño12. Las fístulas se detectan como estructuras lineales hipoecogénicas en forma de banda, con o sin burbujas de gas en el trayecto. El gas intravesical es un signo indirecto de fístula sigmoidea-vesical. El signo clásico de perforación intestinal contenida es el gas ectópico localizado en el mesenterio o dentro de una colección líquida. Para distinguir la estenosis sigmoidea por diverticulitis aguda de la originada por un adenocarcinoma perforado, es preciso valorar los signos recogidos en la tabla 213. Los signos inflamatorios, como la alteración de la grasa o las colecciones, no son útiles para su diferenciación.
Signos ecográficos de estenosis sigmoidea secundaria a diverticulitis aguda y adenocarcinoma13
| Signos de estenosis por diverticulitis aguda | Signos de estenosis por adenocarcinoma |
|---|---|
| Estenosis> 10 cm de longitud | Estenosis <10 cm de longitud |
| Engrosamiento parietal concéntrico <15 mm | Engrosamiento parietal excéntrico> 15 mm |
| Conservación de los pliegues de las haustras | Pérdida de la haustración |
| Bordes romos | Bordes abruptos e irregulares |
| Preservación de las capas parietales internas | Pérdida de las capas parietales internas |
| Engrosamiento de la capa muscular | Desestructuración de la pared |
| Diverticulosis | Presencia o no de divertículos |
| Signos de extensión neoplásica regional o a distancia |
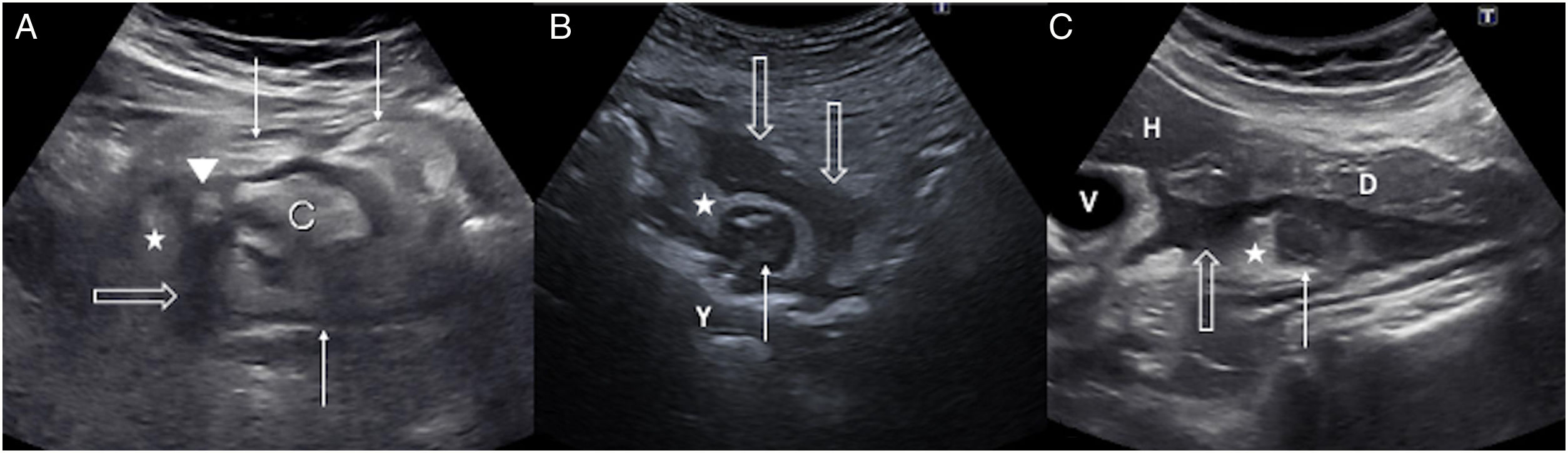
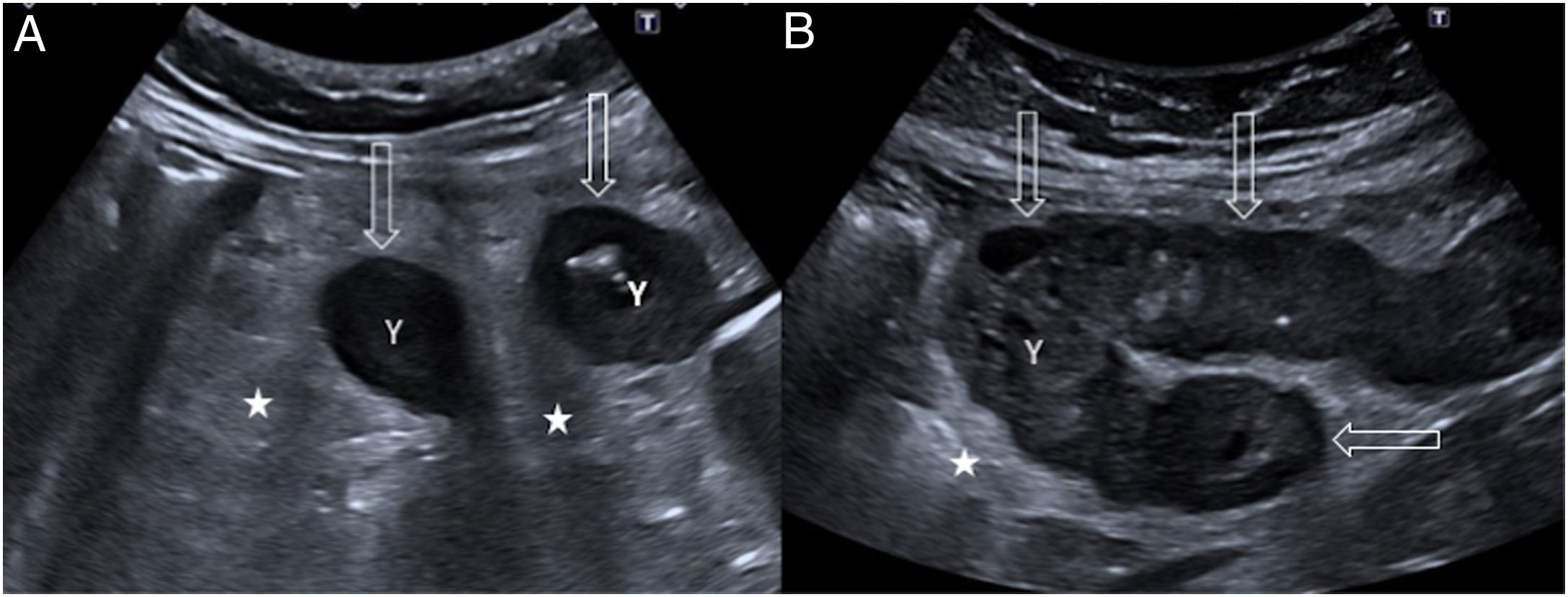
Es relativamente infrecuente (izquierda:derecha - 15:1) y presenta varias particularidades. Los divertículos dependientes del ciego y del colon ascendente son usualmente congénitos, únicos y verdaderos, ya que contienen todas las capas parietales. Debido a que causan abdomen agudo en la fosa ilíaca derecha, es crucial un correcto diagnóstico para evitar apendicectomías innecesarias. Los hallazgos ecográficos son similares a los de la diverticulitis sigmoidea, aunque las complicaciones son muy raras4,12 (fig. 2A).
A) Diverticulitis aguda en el ciego. Divertículo (punta de flecha) de pared engrosada dependiente de la cara lateral del ciego (C). Existe engrosamiento parietal concéntrico del ciego (flechas finas), una colección líquida laminar peridiverticular (flecha hueca) y alteración flemonosa de la grasa circundante (estrella). B) Diverticulitis aguda en el yeyuno. Divertículo (flecha fina) de pared engrosada y con hiperecogenicidad central cercano a un asa yeyunal (Y). Asocia cambios inflamatorios en la grasa circundante (estrella) y una colección líquida hipoecogénica (flechas huecas). C) Diverticulitis aguda duodenal. Divertículo inflamado (flecha fina) con contenido hipoecogénico dependiente de la cara posterior del duodeno (D); hiperecogenicidad de la grasa adyacente por alteración flemonosa (estrella) y colección líquida hipoecogénica (flecha hueca). H: lóbulo hepático izquierdo; V: vesícula biliar.
Los divertículos de yeyuno e íleon son falsos, sin capa muscular, y se sitúan en el borde mesentérico. Su prevalencia es del 1-2%. La localización más frecuente es el yeyuno proximal (75%), seguida del yeyuno distal (20%) y el íleon (5%). Normalmente son mayores en tamaño y número en el yeyuno proximal, una tendencia que se invierte al progresar distalmente en el intestino delgado14.
En ecografía, los divertículos inflamados se observan como estructuras irregulares con centro hiperecogénico, comunicadas con la luz intestinal (fig. 2B). La alteración flemonosa de la grasa circundante es, en muchos casos, el primer signo detectado, asociado a engrosamiento concéntrico de la pared intestinal. La microperforación puede manifestarse como colecciones líquidas con burbujas de gas ectópico en su interior.
Diverticulitis aguda duodenalEl duodeno es el segundo lugar donde con más frecuencia se desarrollan divertículos. Su incidencia alcanza el 22%15. Predominan en el borde pancreático de la segunda y tercera porción duodenal16. Su tendencia a la inflamación es menor que en el colon. La diverticulitis duodenal complicada es clínicamente inespecífica y confundible con la colecistitis aguda, pancreatitis aguda, neoplasia pancreática o úlcera péptica. El diagnóstico diferencial más difícil se plantea con la úlcera duodenal perforada, si bien esta suele afectar a porciones más proximales y cercanas al bulbo duodenal17.
Los hallazgos ecográficos son la inflamación diverticular, engrosamiento mural duodenal, alteración flemonosa de la grasa adyacente, líquido libre en el saco menor y gas extraluminal en caso de perforación (fig. 2C).
Perforación gastrointestinalEs una complicación que habitualmente presenta un curso agudo y precisa cirugía urgente. Entre sus numerosas causas se encuentran la isquemia intestinal, obstrucción, diverticulitis, úlcera péptica, neoplasia, enfermedad inflamatoria intestinal, traumatismo, iatrogenia y cuerpo extraño18,19. Aunque el dolor abdominal súbito es un síntoma constante, las manifestaciones clínicas son variables y, en ocasiones, comportan un diagnóstico tardío.
La TC es la técnica de elección y detecta el sitio de la perforación en el 86% de los casos20. Cuando los síntomas son inespecíficos, es frecuente realizar una ecografía inicialmente, cuya sensibilidad para detectar neumoperitoneo es superior a la de la radiografía simple de abdomen21. Asimismo, la TC y ecografía son apropiadas para plantear diagnósticos alternativos22 y valorar hallazgos adicionales de perforación, como el engrosamiento parietal segmentario, íleo, alteración de la grasa mesentérica, líquido libre, absceso o fístula19,20,22.
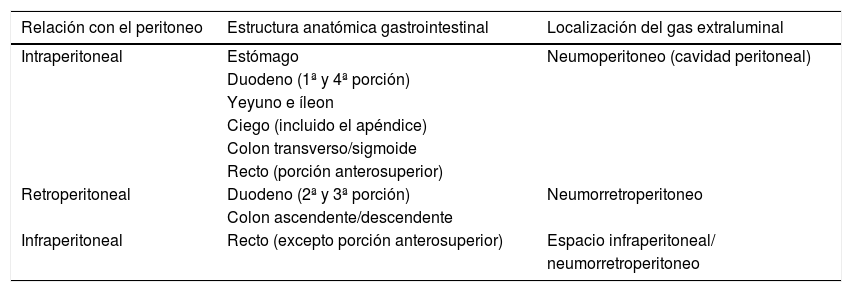
La localización de la perforación condiciona la ubicación del gas extraluminal (tabla 3). En general, las perforaciones gastroduodenales provocan neumoperitoneo alrededor del hígado, duodeno y estómago23. Aquellas que afectan al duodeno retroperitoneal, menos comunes, asocian neumorretroperitoneo en el espacio pararrenal anterior derecho23,24. En el yeyuno e íleon suelen generar escaso gas libre en el compartimento inframesocólico19, mientras que en el intestino grueso dan lugar a una cantidad variable de gas en diferentes localizaciones o difuso24.
Relación entre las estructuras anatómicas gastrointestinales y el peritoneo, lo que determina la localización del gas extraluminal en caso de perforación
| Relación con el peritoneo | Estructura anatómica gastrointestinal | Localización del gas extraluminal |
|---|---|---|
| Intraperitoneal | Estómago | Neumoperitoneo (cavidad peritoneal) |
| Duodeno (1ª y 4ª porción) | ||
| Yeyuno e íleon | ||
| Ciego (incluido el apéndice) | ||
| Colon transverso/sigmoide | ||
| Recto (porción anterosuperior) | ||
| Retroperitoneal | Duodeno (2ª y 3ª porción) | Neumorretroperitoneo |
| Colon ascendente/descendente | ||
| Infraperitoneal | Recto (excepto porción anterosuperior) | Espacio infraperitoneal/ |
| neumorretroperitoneo |
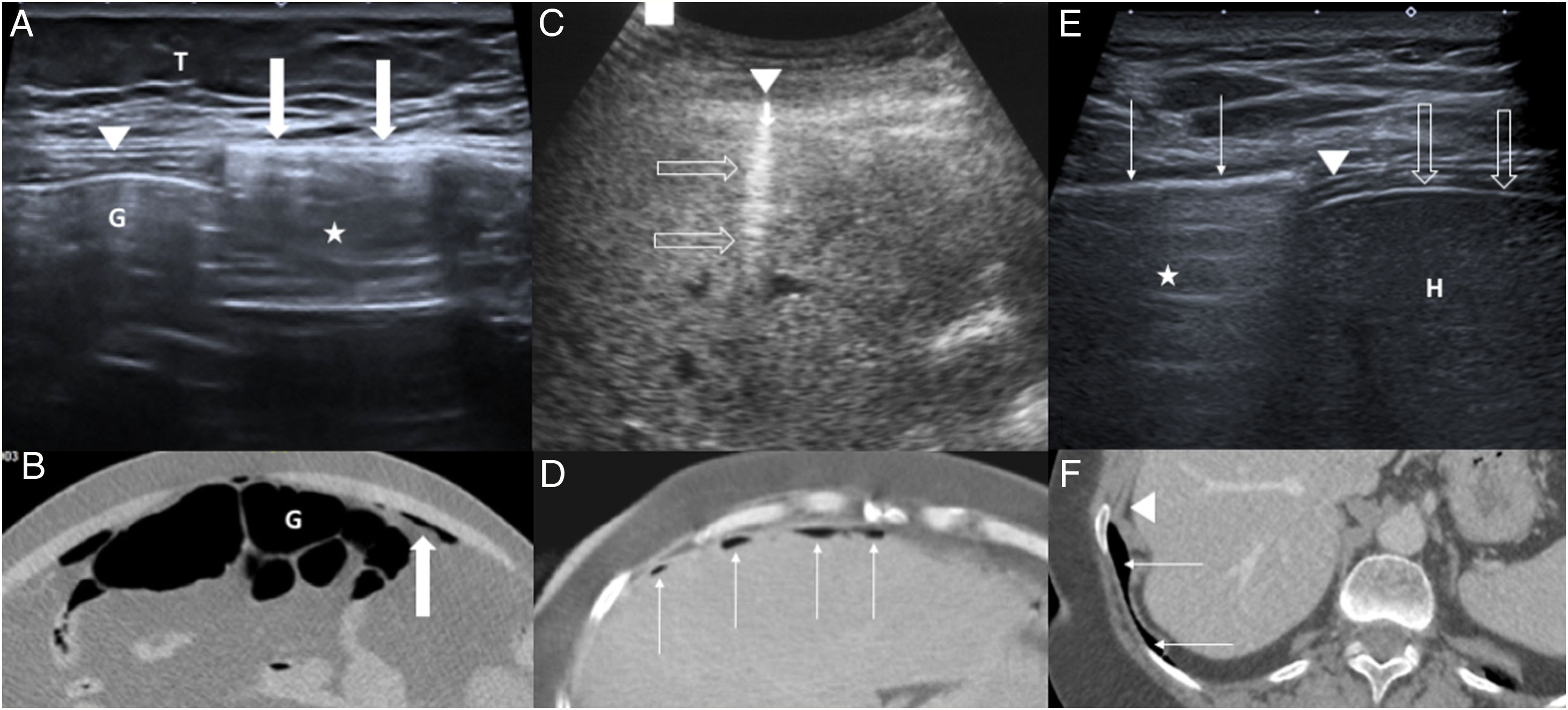
Para identificar neumoperitoneo en ecografía son útiles los transductores convexos y lineales de distintas frecuencias22. Se debe incidir en el área sintomática18 y en el epigastrio, así como en el hipocondrio derecho tras colocar al paciente en decúbito lateral izquierdo21. El realce de la línea peritoneal, que normalmente es una fina línea ecogénica, se considera un signo sensible y específico de neumoperitoneo25 (fig. 3A y B). Puede acompañarse de artefactos de reverberación y “ring-down”, como sucede en los focos hiperecogénicos que reflejan pequeñas burbujas de gas extraluminal25 (fig. 3C y D). El desplazamiento del gas con los movimientos del paciente o al aumentar momentáneamente la presión del transductor26, incluso con su borde caudal (“scissors maneuver”)27, asegura su localización intraperitoneal. Los falsos positivos ocurren al malinterpretar el gas intraluminal o de las bases pulmonares como neumoperitoneo (fig. 3E y F). En algunos casos se aprecia líquido libre ecogénico o “sucio” por el vertido de contenidos gástricos o entéricos que incluyen partículas alimenticias y burbujas gaseosas28.
A y B) Paciente de 45 años con neumoperitoneo por perforación gástrica. Ecografía axial (A) del epigastrio donde se detecta el signo del realce de la línea peritoneal (flechas), que asocia artefacto de reverberación (estrella). El gas intestinal (G) se encuentra profundamente en relación con la línea peritoneal adyacente normal (punta de flecha). T: tejido celular subcutáneo. Correlación con una imagen axial de TC sin contraste (B): gas intraluminal (G) y extraluminal (flecha). C y D) Paciente de 72 años con perforación del bulbo duodenal. Foco hiperecogénico (punta de flecha) con artefacto de reverberación (flechas huecas) sobre la superficie hepática en ecografía axial del epigastrio (C), que corresponde a una burbuja de neumoperitoneo. Correlación con una imagen axial de TC con contraste intravenoso (D): múltiples focos de neumoperitoneo (flechas finas) en el epigastrio e hipocondrio derecho. E y F) Mujer de 61 años con dolor abdominal agudo. Ecografía intercostal del hipocondrio derecho (E) en decúbito lateral izquierdo, que muestra una línea hiperecogénica (flechas finas) con artefacto de reverberación (estrella) sobre el diafragma (punta de flecha), que corresponde a gas pulmonar, el cual se desplaza con la respiración. H: hígado; cápsula hepática (flechas huecas). Correlación con una imagen axial de TC con contraste intravenoso (F): gas pulmonar (flechas finas) y diafragma (punta de flecha).
A diferencia del neumoperitoneo, el neumorretroperitoneo no muestra fenómeno de desplazamiento22 y se caracteriza por la presencia de gas alrededor del duodeno y de la cabeza pancreática, además de por la imposibilidad de visualizar el riñón derecho o los grandes vasos abdominales, que son oscurecidos por el gas19,29. Un diagnóstico ecográfico de neumoperitoneo o neumorretroperitoneo debe confirmarse con TC.
Cuerpos extrañosAunque su ingestión es relativamente común, la mayoría pasan a través del tracto alimentario sin complicaciones18. El alcoholismo, una dentadura postiza, la ingestión rápida de alimentos y el retraso mental son factores de riesgo. Los que causan perforación suelen ser puntiagudos (espinas de pescado, huesos de pollo y mondadientes). Las manifestaciones clínicas incluyen dolor abdominal en diferentes localizaciones, náuseas, vómitos, fiebre o peritonitis, síntomas inespecíficos, por lo que no es raro realizar una ecografía como primera técnica de imagen. Muchos pacientes no recuerdan el antecedente de cuerpo extraño ingerido y, en algunos casos, transcurren días o meses hasta el inicio de la sintomatología.
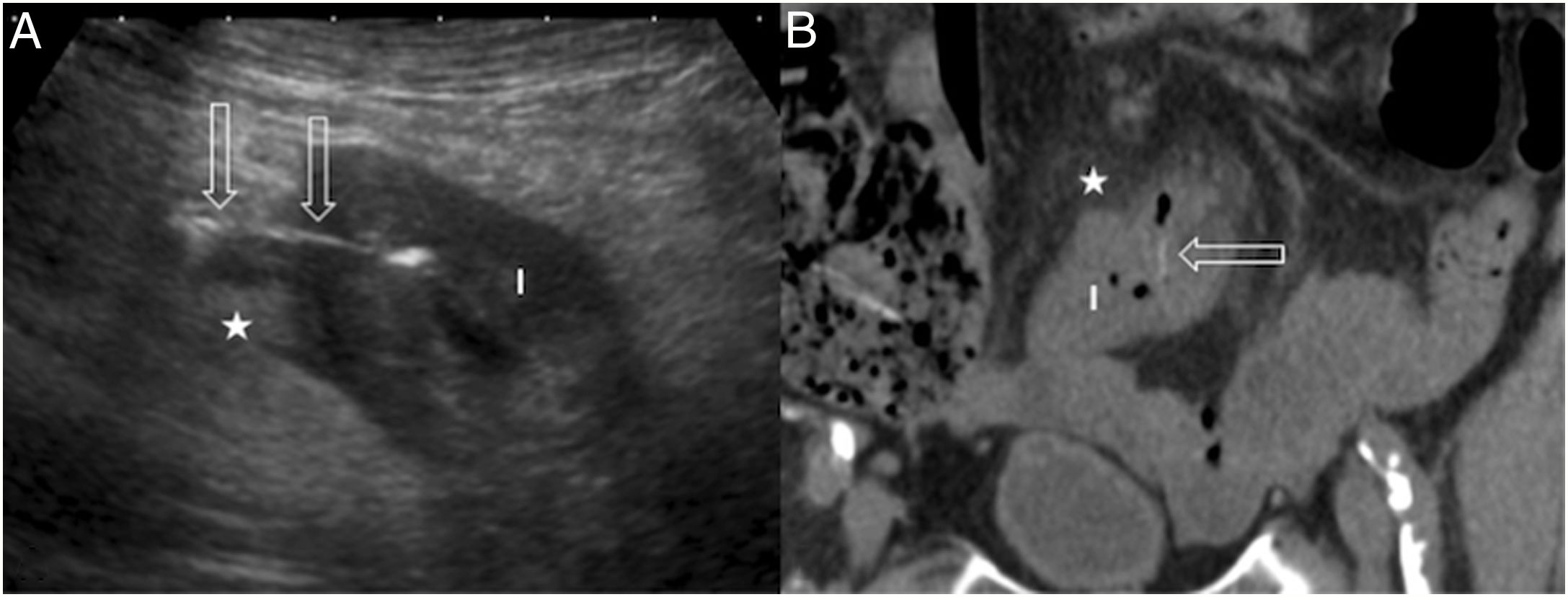
Una vez detectados signos ecográficos secundarios de perforación, como colecciones líquidas laminares e hiperecogenicidad de la grasa adyacente, con o sin burbujas de gas30, se debe buscar el cuerpo extraño junto al segmento intestinal engrosado, sobre todo en los contextos epidemiológicos descritos. Este se visualiza típicamente en el plano longitudinal como una línea ecogénica delgada y recta, con sombra acústica variable, y como un punto hiperecogénico con sombra acústica nítida en una vista transversal31 (fig. 4).
Hombre de 90 años con dolor inespecífico en el hemiabdomen inferior. A) Corte ecográfico trasversal de fosa inferior derecha donde se observa un asa intestinal (I) con la pared engrosada, aumento de la ecogenicidad de la grasa adyacente (estrella) y una imagen lineal hiperecogénica (flechas huecas) que atraviesa la pared intestinal hasta el meso, que corresponde a una espina de pescado. B) Correlación con una imagen coronal de tomografía computarizada sin contraste: asa intestinal de pared engrosada (I), hiperdensidad de la grasa adyacente por inflamación (estrella) y espina de pescado hiperdensa (flecha hueca).
La ecografía es apta para detectar cuerpos extraños de madera (sensibilidad del 52-82%)32 o espinas de pescado, difíciles de reconocer en TC por su baja densidad, y que requieren una cuidadosa interpretación de las reconstrucciones multiplanares oblicuas30,33.
Isquemia intestinalIsquemia mesentérica agudaClásicamente, la isquemia mesentérica aguda (IMA) se asocia con un inicio súbito de dolor abdominal, desproporcionado respecto al examen físico34. Se produce por embolismo arterial, trombosis arterial, trombosis venosa o isquemia mesentérica no oclusiva; la etiología arterial es más frecuente que la venosa35. La TC-angiografía urgente es el método de elección. Sin embargo, la ecografía es la primera prueba de imagen en algunos pacientes con síntomas inespecíficos34.
El engrosamiento de la pared intestinal es el signo ecográfico más frecuente35. Inicialmente existe hiperperistalsis, seguida de íleo adinámico, ascitis e incremento de las secreciones intraluminales. No obstante, estos signos son inespecíficos. El aumento del aire intraluminal puede dificultar la evaluación del intestino36. Si la oclusión está próxima al origen de la arteria mesentérica superior, es posible confirmar la ausencia de flujo mediante Doppler color37. Cuando progresa a infarto intestinal transmural, puede asociar neumatosis intestinal y gas venoso portomesentérico.
En manos expertas, el uso de contraste ecográfico aumenta la sensibilidad para demostrar la hipoperfusión de la pared intestinal en la IMA. Está indicado en pacientes con insuficiencia renal y, además, es adecuado para valorar la perfusión de las asas en la isquemia intestinal secundaria a obstrucción intestinal38,39 (fig. 5).
Mujer de 86 años con dolor abdominal inespecífico de 24 horas de evolución. A) Imagen ecográfica longitudinal de la pelvis menor donde se observan múltiples asas intestinales dilatadas y con pared ligeramente engrosada (flechas huecas). V: vejiga. B) En la ecografía con contraste se evidencia la ausencia de realce parietal de varias asas (flechas). Compárese con el realce normal de otra asa intestinal (estrella). C) Reconstrucción coronal de tomografía computarizada con contraste intravenoso que muestra dilatación del intestino delgado (flechas finas) en el hipogastrio y leve realce parietal, en relación con oclusión intestinal por una probable hernia interna. La cirugía confirmó el sufrimiento vascular de varias asas intestinales por una brida mesentérica; tras adhesiólisis y lavado con suero caliente, se observó un cambio de coloración y peristaltismo de toda la porción de asas contundidas, por lo que finalmente se decidió no realizar resección intestinal.
Es la forma más común de isquemia intestinal y la segunda causa más frecuente de hemorragia digestiva baja. Existe una presentación gangrenosa (10-20%), con necrosis transmural y una alta mortalidad, y una presentación transitoria (80-90%), cuyo manejo es conservador y se caracteriza por lesiones reversibles en la mucosa o submucosa40. Los síntomas comunes son hematoquecia, diarrea persistente y dolor abdominal40. La colonoscopia es la prueba de elección.
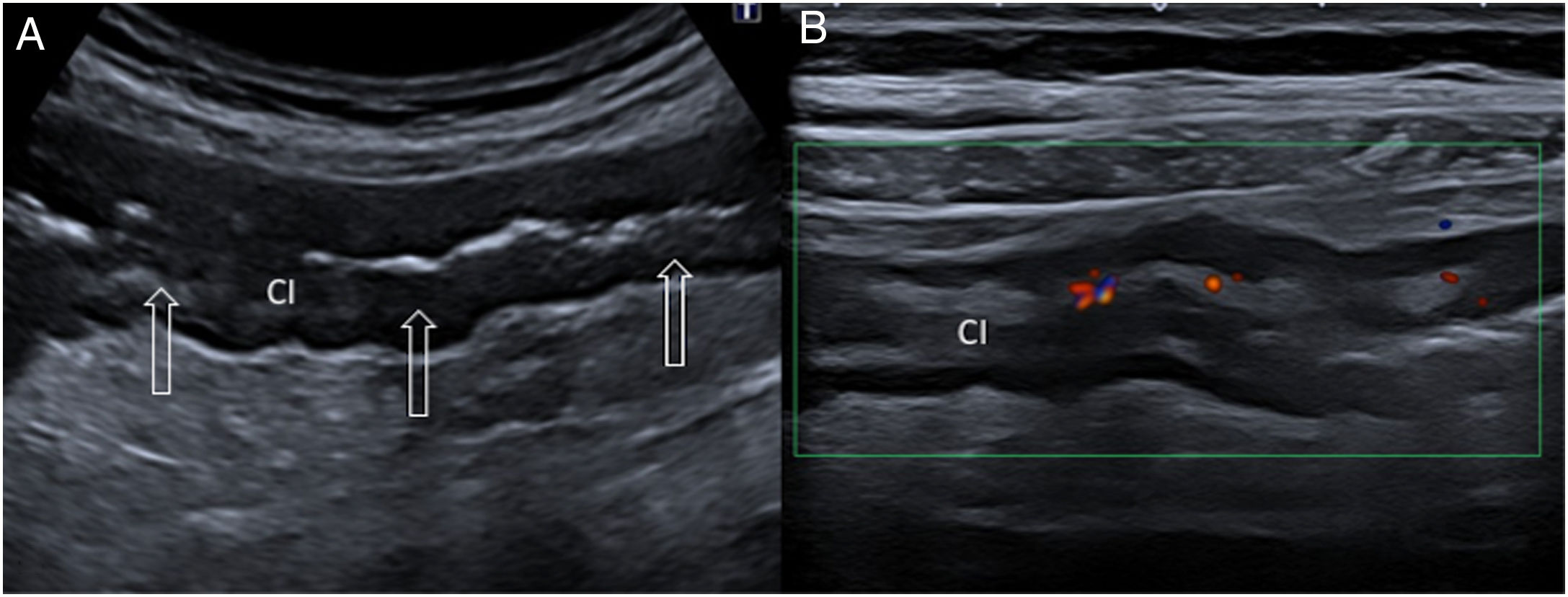
La colitis isquémica (CI) no oclusiva generalmente afecta al colon de manera segmentaria, en mayor medida al ángulo esplénico, colon descendente y sigma. La ecografía es útil para su detección precoz41. En pacientes con clínica y edad avanzada debe sospecharse cuando el examen ecográfico muestra engrosamiento de un segmento largo de colon (>10 cm), particularmente del lado izquierdo, con señal Doppler color escasa o ausente41,42 (fig. 6). El valor predictivo positivo de estos hallazgos para CI es del 90%43. En los casos reversibles se puede detectar hiperemia en la pared intestinal por reperfusión con Doppler color. La grasa perientérica alterada se ha asociado con necrosis transmural41,42. La CI sin necrosis transmural es autolimitada, con una rápida recuperación de las lesiones mucosas. La ausencia de mejoría en el seguimiento ecográfico sugiere necrosis transmural, y requiere técnicas radiológicas adicionales o endoscopia para confirmar el diagnóstico y excluir una neoplasia subyacente41.
Hombre de 72 años con cuadro brusco de dolor en el hemiabdomen inferior izquierdo y rectorragia. A) Ecografía sagital del vacío izquierdo que muestra engrosamiento concéntrico (flechas huecas) de un segmento largo de colon izquierdo (CI). B) El modo Doppler color demuestra escaso flujo en el colon izquierdo (CI) engrosado, el cual conserva la estructura en capas de la pared. La detección ecográfica de engrosamiento de un segmento largo de colon izquierdo con escaso flujo Doppler color en un paciente con cuadro clínico característico tiene un valor predictivo positivo muy alto para el diagnóstico de colitis isquémica.
El rendimiento diagnóstico de la ecografía y TC es similar en la CI, excepto para la neumatosis intestinal, un hallazgo raro y tardío de mal pronóstico, que es difícil de detectar con ecografía38,44.
Obstrucción intestinalLas causas más frecuentes de obstrucción de intestino delgado (OID) son las adherencias posquirúrgicas (80%), hernias, enfermedad de Crohn, neoplasias y vólvulos, mientras que en el intestino grueso predominan las neoplasias22. La endometriosis, cuerpos extraños, invaginación, íleo biliar o bezoares son causas infrecuentes. Los pacientes presentan dolor abdominal, distensión, náuseas y vómitos, si bien una presentación subaguda es posible en las estenosis tumorales22.
La ecografía está indicada como técnica inicial cuando se sospecha OID22. Tiene una sensibilidad (92%) y especificidad (96%) similar a la TC45 y superior a la radiografía simple46. Sin embargo, la TC es más fiable para determinar su localización y etiología, principalmente en las hernias internas y vólvulos, así como las complicaciones22.
En la exploración ecográfica han de valorarse el estómago y las distintas partes del intestino. Entre los signos de obstrucción intestinal se encuentran la dilatación de las asas intestinales proximales al punto de transición (≥25 mm de diámetro), el colapso del intestino distal, el contenido líquido intraluminal y un leve engrosamiento de la pared intestinal. Es característica la visualización en tiempo real de un peristaltismo aumentado en las fases iniciales (video en material suplementario), con un movimiento de vaivén (“to-and-fro”)22. A medida que evoluciona el proceso, la disminución o ausencia de peristaltismo, junto con el engrosamiento parietal y el líquido libre, resultan sospechosos de isquemia o perforación47. El modo Doppler y la administración de contraste permiten valorar la perfusión intestinal y, en consecuencia, su viabilidad39 (fig. 5).
Al contrario que en la obstrucción mecánica, la ausencia prolongada de peristaltismo en un segmento intestinal relleno de líquido es más indicativa de íleo adinámico22.
EndometriosisSe caracteriza por la presencia de tejido endometrial funcional ectópico fuera de la cavidad uterina, en forma de endometriomas ováricos, implantes peritoneales y endometriosis pélvica profunda48. La clínica incluye infertilidad y dolor pélvico. El tracto intestinal representa el sitio más común de endometriosis extragenital (5-37% de casos)49, con una frecuencia descendente en la región rectosigmoidea (65%), íleon terminal, ciego y apéndice50. Aunque es infrecuente, puede manifestarse como estenosis y obstrucción intestinal. El diagnóstico definitivo requiere confirmación histológica.
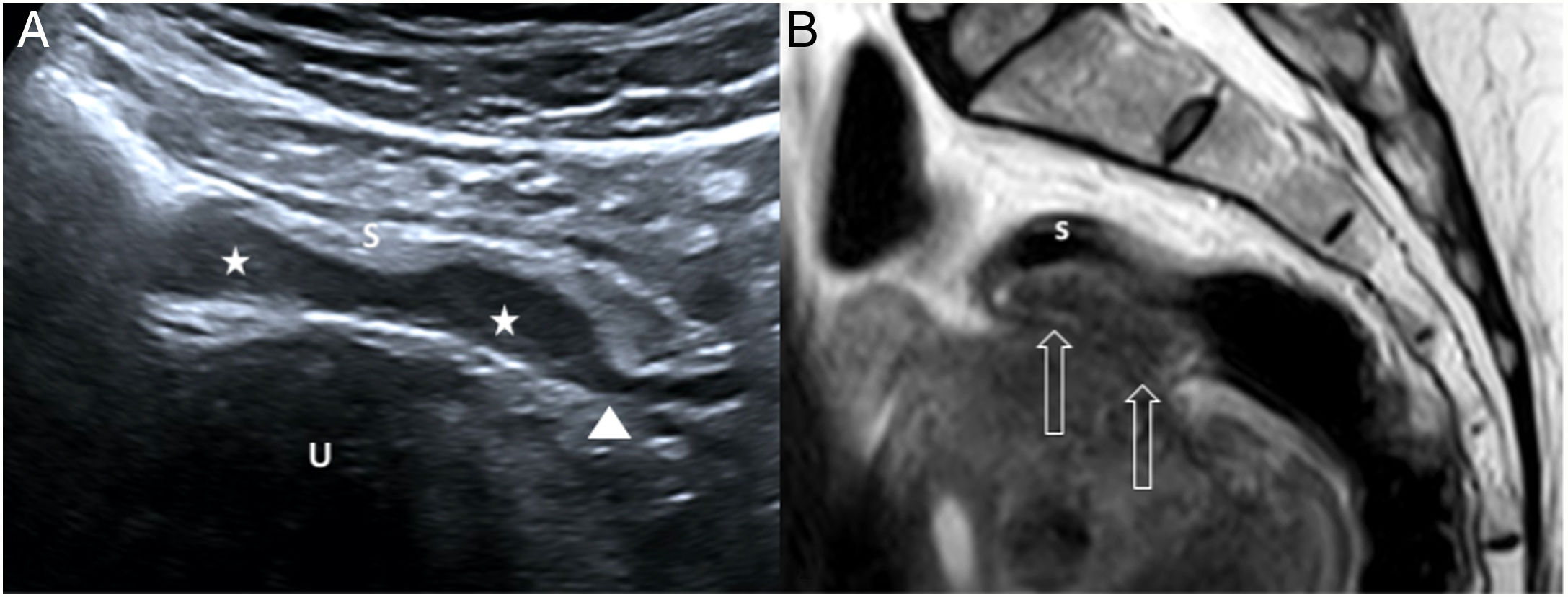
Los implantes endometriósicos se visualizan en ecografía como masas hipoecogénicas fusiformes en la serosa o muscularis propia; las espiculaciones en los extremos del área engrosada dan lugar a una imagen en cola de cometa49–52 (fig. 7). Con contraste ecográfico presentan una leve vascularización puramente vascular, lo que refleja su capacidad de neovascularización53. La evaluación transvaginal ayuda a detectar focos de endometriosis rectales y en la unión rectosigmoidea, adherencias entre el útero y rectosigma51, y evidencia dolor profundo al presionar las lesiones con el transductor. El diagnóstico diferencial incluye el adenocarcinoma primario y las metástasis peritoneales de origen gastrointestinal o ginecológico48; en la endometriosis, la submucosa y mucosa suelen estar intactas, al contrario de lo que ocurre en el primero54.
Mujer de 46 años con dolor abdominal episódico junto a heces mucosanguinolentas en los últimos 6 meses. A) En la ecografía abdominal se observan dos pequeñas masas hipoecogénicas (estrellas) adheridas a la serosa del sigma (S), que improntan el resto de capas de la pared, sugestivo de endometriosis con patrón de crecimiento “en placa”. Nótese el signo de la cola de cometa (punta de flecha), continuando con la hipoecogenicidad de la capa muscular. U: útero. B) Imagen sagital de resonancia magnética pélvica (secuencia T2 FSE) que confirma la existencia de una lesión hipointensa excéntrica en placa (flechas huecas) en la pared anterior del sigma distal. El estudio anatomopatológico confirmó el diagnóstico de endometriosis intestinal. s: capa submucosa sigmoidea.
Consisten en la protusión del contenido de la cavidad abdominal a través de un defecto congénito o adquirido. Se clasifican en hernias externas (inguinales, crurales, umbilicales, epigástricas, de Spiegel o incisionales) e internas, según el orificio se localice en la pared abdominal o en el peritoneo o mesenterio, respectivamente. Lo más usual es encontrar grasa e intestino en el contenido. Las hernias externas son muy comunes y, en la mayoría de los casos, asintomáticas, aunque pueden complicarse con obstrucción intestinal, incarceración o estrangulación. Las hernias internas tienen una baja incidencia, pero necesitan cirugía urgente porque normalmente cursan con OID estrangulada, como resultado de una obstrucción en asa cerrada55.
El estudio de las hernias de la pared abdominal requiere el uso de transductores lineales de alta frecuencia (≥10 MHz). El conocimiento de las referencias anatómicas y de la localización habitual de las distintas hernias disminuye los falsos negativos. Es importante documentar la hernia en dos planos ortogonales y realizar un estudio dinámico, mediante la aplicación de maniobras de Valsalva o de compresión56. La visualización en el plano sagital ayuda a evitar errores en las hernias inguinales. Una vez confirmado el diagnóstico ecográfico de hernia, se debe registrar su tamaño y las características del contenido, analizar si es reducible e investigar posibles signos de OID, como la dilatación del intestino proximal o de las asas herniadas, el estrechamiento de ambos extremos en el cuello herniario, y el calibre normal o disminuido del intestino distal57. Adicionalmente, sugieren isquemia del segmento intestinal herniado el engrosamiento parietal, la hiperecogenicidad del tejido graso, ascitis, congestión de los vasos mesentéricos y disminución de la vascularización parietal al emplear Doppler o contraste intravenoso57.
En cuanto a las hernias internas, cuya sintomatología a veces es inespecífica, son un reto diagnóstico tanto clínico como radiológico. La TC es la técnica de elección. La ecografía puede orientar el diagnóstico cuando se observa un patrón de OID acompañado de congestión y desplazamiento de los vasos mesentéricos, sobre todo en pacientes sin antecedentes de cirugía o traumatismo abdominal55.
Necrosis focal aguda de la grasa intraabdominalApendicitis epiploicaLos apéndices epiploicos son pequeñas estructuras constituidas por grasa y vasos sanguíneos, que protruyen desde la serosa del colon hacia la cavidad peritoneal. Son más frecuentes en el ciego y el colon izquierdo58. El líquido intraperitoneal facilita su visualización con ecografía5. Su morfología pediculada y movilidad facilitan la torsión o trombosis, con el consiguiente infarto hemorrágico. Los pacientes presentan dolor abdominal agudo, que suele localizarse a punta de dedo y asocia peritonismo59,60.
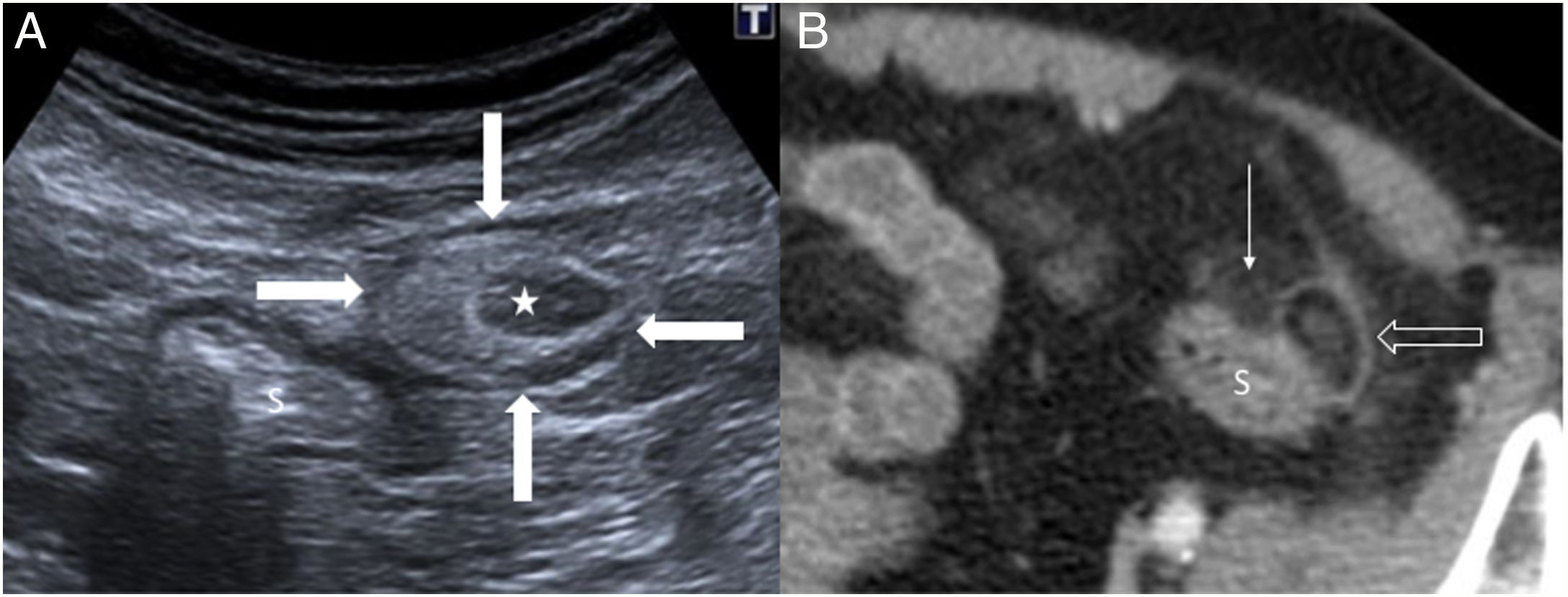
El estudio ecográfico dirigido a la zona de mayor dolor demuestra una lesión sólida hiperecogénica, ovoidea y no compresible, con un fino halo hipoecogénico e hiperecogenicidad de la grasa adyacente44 (fig. 8). La lesión se localiza junto al colon, cuya pared solo se engruesa en el 10% de los casos44, y se encuentra adherida a la pared abdominal anterior, un hecho fácilmente reconocible durante los movimientos respiratorios del paciente9. El modo Doppler y el contraste ecográfico muestran ausencia de flujo central y realce periférico. Ocasionalmente, se identifica un pequeño foco central hipoecogénico, que representa la trombosis venosa61,62.
Apendicitis epiploica en una mujer con dolor brusco en la fosa ilíaca izquierda (FII). A) Imagen axial de ecografía que revela una masa inflamatoria de morfología ovalada y ecogenicidad heterogénea (estrella) en la grasa intraperitoneal, rodeada por un halo hipoecogénico (flechas); contacta con el sigma (S), cuyas paredes son de grosor normal. B) En la tomografía computarizada axial con contraste intravenoso de la FII se aprecia que la lesión (flecha hueca) presenta una densidad grasa, un foco central hiperdenso y un anillo hiperdenso; existe inflamación focal del tejido graso adyacente (flecha fina), pero la pared del sigma (S) no está engrosada.
El infarto omental primario se produce por un compromiso vascular con estasis venosa, congestión, edema y necrosis hemorrágica. Además, puede ser secundario a traumatismo, inflamación, neoplasia o cirugía abdominal reciente44. Es más frecuente en proximidad al ciego o colon ascendente, debido a la mayor longitud y movilidad del omento en este lado. Al igual que la apendicitis epiploica, es una entidad autolimitada y su manejo es conservador.
Generalmente, se observa en ecografía como una masa hiperecogénica no compresible, de más de 5 cm de tamaño35, con áreas nodulares hipoecogénicas mal definidas, hiperemia periférica y ausencia de vascularización interna63.
MisceláneaVasculitis gastrointestinalLas vasculitis constituyen un grupo heterogéneo de enfermedades primarias o secundarias (infección, autoinmune o neoplasia), en las cuales es posible demostrar inflamación vascular histológicamente o por imagen64. Se clasifican en vasculitis de pequeños, medianos o grandes vasos, así como de vaso de tamaño variable y de órgano aislado65. Pueden afectar a diferentes órganos y sistemas, entre ellos el tracto gastrointestinal, lo que determina la clínica.
En función del territorio y tamaño del vaso afectado, las alteraciones gastrointestinales varían de leves (íleo paralítico o edema-hemorragia submucosa) a graves (isquemia, perforación o estenosis), ya sea con un patrón focal o segmentario66. Los hallazgos ecográficos no son específicos de cada tipo de vasculitis y dependen del curso evolutivo: engrosamiento de la pared intestinal, hiperecogenicidad de la grasa mesentérica, líquido libre, úlceras por isquemia, perforación, estenosis u obstrucción intestinal.
La entidad con mayor tasa de afectación digestiva (50-75%) es la vasculitis por IgA (púrpura de Schönlein-Henoch) (fig. 9), que afecta a vasos de pequeño calibre y predomina en niños64. Presentan manifestaciones clínicas cutáneas, renales, articulares y gastrointestinales; las dos últimas pueden preceder a la púrpura64. Los engrosamientos focales hiperecogénicos submucosos secundarios a hemorragia intramural son característicos en ecografía. La mayoría de los casos pediátricos se resuelven sin complicaciones, entre las cuales destaca la invaginación67.
Paciente pediátrico con dolor en el mesogastrio, febrícula, vómitos, diarrea con sangre y exantema eritematoso violáceo en las extremidades inferiores. A y B) Ecografía axial y sagital del vacío izquierdo, respectivamente, que revela engrosamiento circunferencial de un segmento largo de yeyuno (Y) e hiperecogenicidad de la grasa mesentérica adyacente (estrellas) por inflamación, secundario a afectación intestinal por vasculitis por IgA (púrpura de Schönlein-Henoch).
Puede producirse cuando el intestino delgado o el intestino grueso se encuentran en el campo de radioterapia. Los efectos secundarios agudos se inician precozmente durante el tratamiento, mientras que los tardíos aparecen 3 meses o más después de finalizarlo68 y, a veces, son irreversibles. La combinación con quimioterapia incrementa el riesgo.
La forma aguda se caracteriza por diarrea, dolor abdominal, náuseas y vómitos. El principal hallazgo ecográfico es el engrosamiento de la pared intestinal en la región irradiada, con preservación de la estructura en capas. En el diagnóstico diferencial se contempla la gastroenteritis infecciosa.
Respecto a la toxicidad tardía, que incluye malabsorción y diarrea, es más probable en aquellos pacientes que desarrollaron lesiones agudas. Entre sus signos ecográficos están el engrosamiento segmentario de la pared intestinal a expensas de la capa submucosa, alteración de la ecogenicidad de la grasa mesentérica, formación de abscesos o fístulas, y obstrucción intestinal secundaria a estenosis o adherencias69.
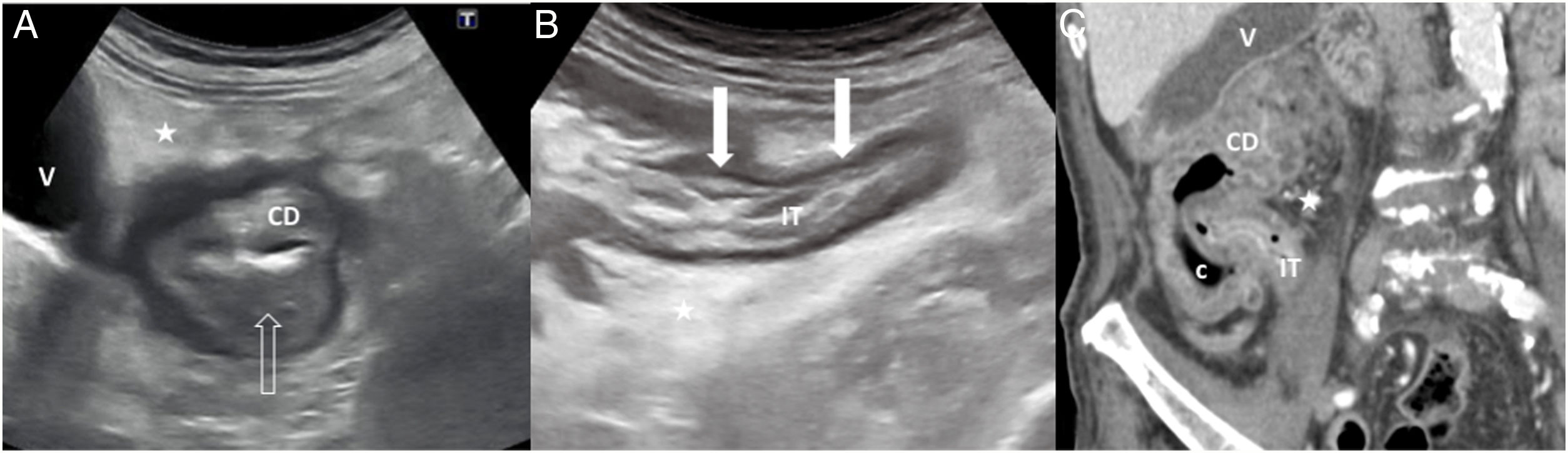
Enterocolitis neutropénicaComplicación grave de la neutropenia severa originada por altas dosis de quimioterapia, sobre todo en pacientes con neoplasias hematológicas. Se manifiesta por dolor abdominal, principalmente en la fosa ilíaca derecha, peritonismo, fiebre y diarrea acuosa o sanguinolenta70.
En ecografía es típico el engrosamiento importante (hasta 1 cm) de la pared intestinal, a expensas de la capa submucosa, que afecta al ciego y se extiende al colon derecho e íleon terminal (fig. 10). La vascularización y las capas parietales están conservadas. La hiperecogenicidad de la grasa pericecal y el líquido libre reflejan una mayor gravedad. Es posible observar contenido líquido intraluminal y peristaltismo disminuido en los segmentos intestinales afectados71. El gas intramural secundario a sobreinfección, gas extraluminal por perforación o abscesos indican complicación.
Ileocolitis neutropénica en un hombre de 79 años con rectorragia, melenas, dolor y defensa en el vacío derecho. Leucemia y antecedente de adenocarcinoma gástrico. A) Ecografía axial del flanco derecho que demuestra engrosamiento circunferencial severo de la pared del colon derecho (CD), de predominio submucoso (flecha hueca), con preservación de la ecoestructura en capas. Existe aumento de la ecogenicidad de la grasa pericolónica (estrella) por afectación inflamatoria. V: vesícula biliar. B) Ecografía axial del flanco derecho, donde se observa engrosamiento parietal (flechas) del íleon terminal (IT), con preservación de la ecoestructura en capas, asociado a alteración flemonosa del tejido graso adyacente (estrella). C) Correlación con una imagen coronal de TC con contraste intravenoso: engrosamiento circunferencial severo de la pared del colon derecho (CD), ciego (c) e íleon terminal (IT), e hiperdensidad de la grasa adyacente por inflamación. V: vesícula biliar.
Trastorno multisistémico de origen bacteriano, que cursa con malabsorción intestinal. La bacteria que lo ocasiona se denomina Tropheryma whippelii y pertenece al grupo Actinomyces. Se considera una enfermedad rara, más frecuente entre los 40 y los 50 años72. Clásicamente existe diarrea, pérdida de peso, dolor abdominal y artralgias. Aunque puede sospecharse en función de los datos clínicos, analíticos, radiológicos y anatomopatológicos, el diagnóstico definitivo requiere la detección del germen con PCR.
La valoración ecográfica permite identificar el engrosamiento de la pared intestinal y de los pliegues mucosos, sobre todo en el yeyuno, el calibre normal o aumentado del intestino delgado, y adenopatías mesentéricas o retroperitoneales redondeadas e hiperecogénicas, con focos hipoecogénicos73. Sin embargo, son hallazgos inespecíficos que pueden verse en otros síndromes malabsortivos.
Enteropatía inducida por antiinflamatorios no esteroideosEl uso prolongado de antiinflamatorios no esteroideos (AINE) produce efectos adversos en el intestino delgado y colon, tanto de presentación aguda como crónica, si bien la mayoría de los casos son subclínicos. Un rasgo distintivo es la formación de diafragmas, que son lesiones circunferenciales cicatriciales que estenosan las asas intestinales74.
La semiología radiológica de esta entidad se ha descrito principalmente en TC, como estenosis intestinales cortas y múltiples, engrosamiento parietal focal con hiperrealce y dilatación intestinal74, que puede progresar a obstrucción o perforación intestinal. Se han publicado casos aislados en los cuales la ecografía demostró engrosamiento de la pared ileocólica, aumento de la vascularización parietal, adenopatías mesentéricas reactivas y líquido libre75.
Puesto que plantea el diagnóstico diferencial con la enfermedad de Crohn, es preciso investigar el antecedente de ingesta de AINE. Otros fármacos (ácido acetilsalicílico, quimioterapia o inmunoterapia) también son causa conocida de toxicidad gastrointestinal.
Autoría- 1.
Responsable de la integridad del estudio: TRG.
- 2.
Concepción del estudio: TRG.
- 3.
Diseño del estudio: JVR.
- 4.
Obtención de los datos: JVR, TRG, GMB, JAMB, TS.
- 5.
Análisis e interpretación de los datos: JVR, TRG, GMB, JAMB, TS.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: JVR, TRG, GMB, JAMB, TS.
- 8.
Redacción del trabajo: JVR, TRG, GMB, JAMB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: TRG, JVR, GMB, JAMB, TS.
- 10.
Aprobación de la versión final: JVR, TRG, GMB, JAMB, TS.
Los autores declaran no tener ningún conflicto de intereses.