Editado por: Dr. Tomás Ripollés González - Servicio de Radiodiagnóstico, Hospital Universitari Doctor Peset, València, España
Más datosLa ecografía es la técnica de imagen de elección en el estudio del tubo digestivo en pediatría, desde la época neonatal hasta la adolescencia. Su carácter dinámico, ausencia de radiación y escasa preparación requerida la sitúan por delante de los estudios fluoroscópicos contrastados, la tomografía computarizada o la resonancia magnética. Los avances técnicos en ecografía, con el desarrollo de sondas multifrecuencia de alta resolución, estudio panorámico, dóppler color, dóppler con microvascularización, elastografía y la introducción en edad pediátrica del contraste ecográfico, han aumentado su sensibilidad y especificidad diagnóstica.
Está indicada en patología de etiopatogenia diversa: congénita, infecciosa, inflamatoria, tumoral y vascular. Conocer el desarrollo embriológico y las características normales del tubo digestivo ayuda a identificar, reconocer e interpretar los hallazgos ecográficos de la diferente patología pediátrica.
Nuestro objetivo es mostrar las indicaciones de imagen, los hallazgos ecográficos y el manejo de la patología gastrointestinal más frecuente en edad pediátrica.
Ultrasonography is the imaging technique of choice for studying the digestive tract in pediatric patients from the neonatal period to adolescence. Its dynamic character, absence of radiation, and scant preparation required make ultrasonography preferable to contrast-enhanced fluoroscopy, computed tomography, or magnetic resonance imaging. Technical advances in ultrasound, including high-resolution multifrequency probes, panoramic studies, color Doppler, Doppler with microvascularization, elastography, and contrast agents for use in children, have increased the sensitivity and specificity of this technique.
Intestinal ultrasound is indicated for conditions with diverse etiologies and pathogenesis: congenital, infectious, inflammatory, tumor-related, and vascular. Knowledge of embryological development and the normal characteristics of the digestive tract help in identifying, recognizing, and interpreting the ultrasound findings of the different conditions in pediatric patients.
This paper aims to show the indications for ultrasound studies of the digestive tract in children, the findings on these studies, and the management of the most common gastrointestinal conditions in pediatric patients.
La ecografía o ultrasonografía (US) es la técnica de elección en el estudio del tubo digestivo (TD) en niños debido a su carácter dinámico, inocuidad y portabilidad, sin necesitad de preparación ni sedación. Requiere, no obstante, de un aprendizaje. Para aumentar su rendimiento diagnóstico hay que estar familiarizado con la técnica, la anatomía y la patología intestinal pediátrica. Los avances técnicos con transductores lineales multifrecuencia permiten estudios de alta calidad desde neonatos hasta adolescentes. La visión panorámica, el dóppler color con microvascularización, la elastografía y la ecografía con contraste intravenoso son herramientas complementarias al estudio ecográfico en modo B.
TécnicaLa US intestinal no requiere de ninguna preparación en niños. Permanecer en ayunas para evitar gas abdominal o no tomar líquidos para rellenar las asas no se ha visto que aumente la calidad del estudio ecográfico, ya que ocasiona mayor malestar e incomodidad. El abordaje es transabdominal con técnica de compresión anterior1,2.
Una sistemática de estudio de cada segmento intestinal es imprescindible. Los parámetros que se han de considerar con sus peculiaridades pediátricas son los siguientes3–7:
- 1.
Identificación de la pared del tubo digestivo con sus capas estratificadas (mucosa, muscular de la mucosa, submucosa, muscular propia y serosa). Esta estratificación de cinco capas se visualiza desde el recién nacido a término hasta el niño mayor; pero en los prematuros la inmadurez de la pared intestinal con una mucosa permeable y fina junto a la escasez de placas de Peyer y centros germinales en la capa muscular de la mucosa produce una estratificación en tres capas: submucosa, muscular propia y serosa.
- 2.
Grosor; considerando normal la pared del estómago entre 3 y 6mm, el íleon distal entre 1 y 3mm (por la presencia de folículos linfoides) e intestino delgado y colon entre 0,5 y 2mm3. Dado que el grosor aumenta con la edad desde el yeyuno hasta el colon, se considera patológico cualquier segmento intestinal por encima de 3mm.
- 3.
Vascularización con dóppler color: presente, aumentada o disminuida.
- 4.
Peristalsis normal, hiperperistalsis o paresia de las asas.
- 5.
Compresibilidad o no de la pared intestinal a la presión con el transductor ecográfico.
- 6.
Valoración extraintestinal abdominal: mesenterio, adenopatías y resto de cavidad abdominal.
Nuestro objetivo es mostrar las indicaciones de imagen, los hallazgos ecográficos y el manejo de la patología gastrointestinal más frecuente en edad pediátrica desde el neonato al adolescente.
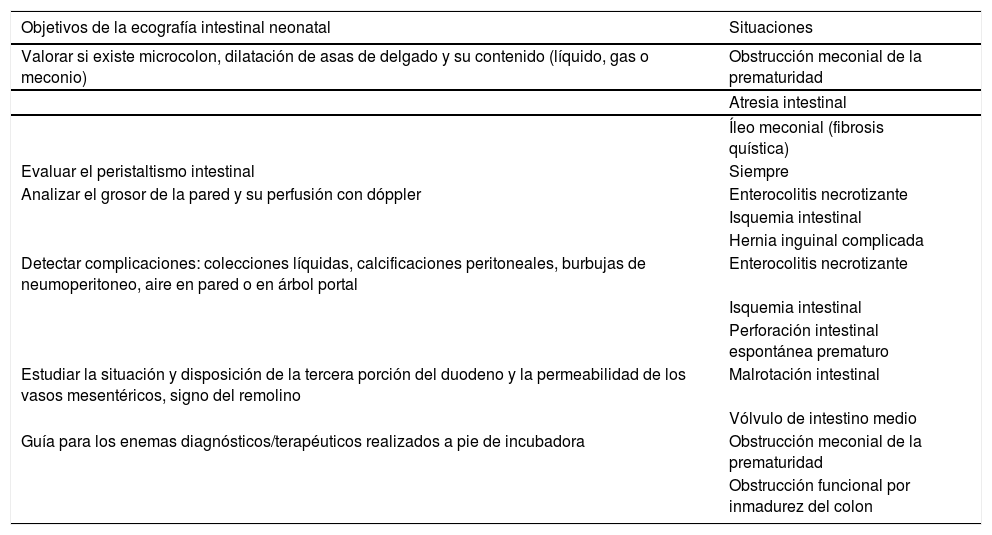
Patología intestinal del neonatoEn el diagnóstico por imagen de la patología gastrointestinal del recién nacido (RN), el pilar ha sido y sigue siendo la radiografía simple de abdomen. En algunos casos, los estudios convencionales con contraste radiopaco (tránsito gastrointestinal o enemas opacos) son necesarios. El papel de la US no está bien definido, ni siquiera está incluida en muchos algoritmos diagnósticos de la patología gastrointestinal neonatal8,9; no obstante, se está implementado cada vez más en la práctica clínica habitual, no solo para descartar anomalías asociadas con patología gastrointestinal, sino para obtener información complementaria a la radiografía y a los estudios contrastados o llegar a sustituirlos como técnica diagnóstica de elección10–12 (tabla 1). Revisamos y actualizamos el papel de la ecografía intestinal neonatal distinguiendo el RN pretérmino del RN a término por sus diferencias fisiológicas y por presentar entidades propias.
Objetivos de la ecografía intestinal en el neonato y las situaciones clínicas más frecuentes en las que se deben cumplir estos objetivos
| Objetivos de la ecografía intestinal neonatal | Situaciones |
|---|---|
| Valorar si existe microcolon, dilatación de asas de delgado y su contenido (líquido, gas o meconio) | Obstrucción meconial de la prematuridad |
| Atresia intestinal | |
| Íleo meconial (fibrosis quística) | |
| Evaluar el peristaltismo intestinal | Siempre |
| Analizar el grosor de la pared y su perfusión con dóppler | Enterocolitis necrotizante |
| Isquemia intestinal | |
| Hernia inguinal complicada | |
| Detectar complicaciones: colecciones líquidas, calcificaciones peritoneales, burbujas de neumoperitoneo, aire en pared o en árbol portal | Enterocolitis necrotizante |
| Isquemia intestinal | |
| Perforación intestinal espontánea prematuro | |
| Estudiar la situación y disposición de la tercera porción del duodeno y la permeabilidad de los vasos mesentéricos, signo del remolino | Malrotación intestinal |
| Vólvulo de intestino medio | |
| Guía para los enemas diagnósticos/terapéuticos realizados a pie de incubadora | Obstrucción meconial de la prematuridad |
| Obstrucción funcional por inmadurez del colon |
La prematuridad es cada vez más frecuente en países desarrollados. Los RN prematuros extremos, antes de las 28 semanas de gestación o con peso al nacimiento menor de 1000 gramos, presentan múltiples complicaciones; entre ellas, las gastrointestinales tienen elevada morbimortalidad13. Se distinguen tres cuadros clínicos intestinales en el recién nacido prematuro (RNPT) extremo donde la US intestinal tiene un papel relevante:
- 1.
RNPT con ausencia o escasa eliminación de meconio los primeros días de vida: Obstrucción meconial de la prematuridad (OMP). La sospecha clínica y radiológica es fundamental, ya que puede pasar desapercibida al presentarse como un abdomen discretamente distendido, difícil de valorar en los prematuros extremos, que a su vez asocian múltiple patología (cerebral, pulmonar, cardiaca, etc.). Con el antecedente de escasa eliminación de meconio, la radiografía de abdomen debe valorar la dilatación de asas de delgado. La US tiene como objetivo demostrar un microcolon por desuso con un diámetro inferior a 9mm y presencia de moldes meconiales ecogénicos en el íleon distal que confirman el diagnóstico de OMP. La US es, además, fundamental para guiar el enema realizado a pie de incubadora, ya que estos pacientes no pueden ser trasladados al servicio de radiología por su inestabilidad y especial vulnerabilidad. El objetivo es demostrar que el contraste hidrosoluble administrado por vía rectal vaya despegando los moldes meconiales del colon y del íleon terminal. Al finalizar el enema se realiza una radiografía portátil de abdomen para confirmar la presencia de contraste en íleon distal y descartar complicaciones (fig. 1). Si es efectivo, se inicia el tránsito intestinal en el paciente, con lo que mejora su tolerancia y distensión abdominal14,15.
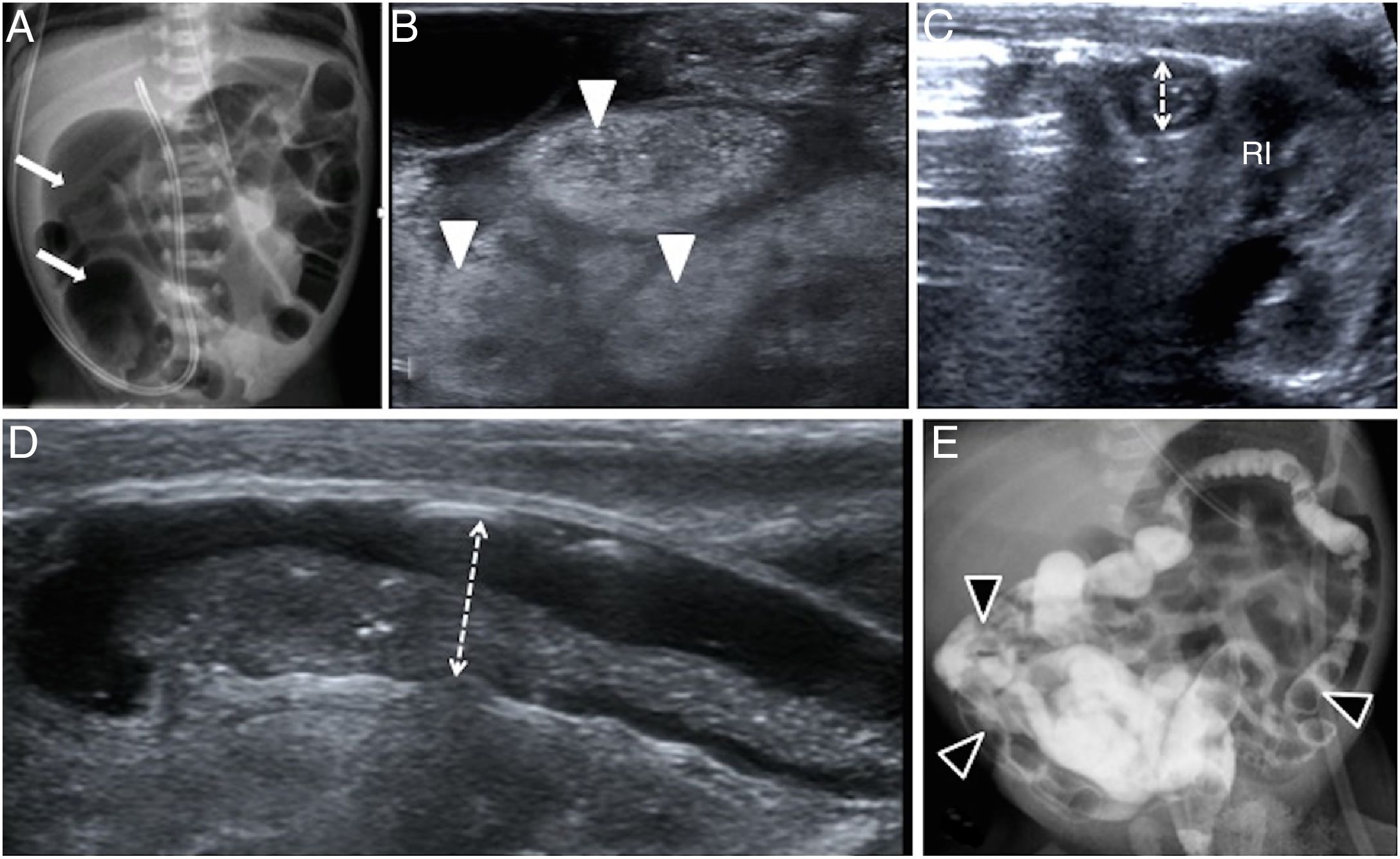
Figura 1.Recién nacido prematuro extremo de 25 semanas de vida, con restricción del crecimiento intrauterino y muy bajo peso (500 g). A los 5 días de vida presenta distensión abdominal y muy escasa deposición meconial. A) Radiografía simple de abdomen: dilatación de asas de delgado con gran asa en hemiabdomen derecho (flechas) en paciente con sospecha de obstrucción meconial de la prematuridad. B) Ecografía intestinal con sonda lineal: asas ileales con moldes meconiales ecogénicos (cabezas de flecha blancas). C) Ecografía transversal del flanco izquierdo que muestra un microcolon (doble flecha) por delante del riñón izquierdo (RI). D) Se procede a enema ecoguiado con contraste hidrosoluble, observando cómo se despega el molde meconial de la pared intestinal (colon izquierdo distendido, doble flecha). E) Tras completar el enema al identificar el paso de contraste a asas ileales distales, se realiza radiografía de abdomen para valorar cómo hay múltiples moldes meconiales en colon e íleon distal (cabezas de flecha negras). El enema resulta terapéutico, con evacuación de abundantes restos meconiales en las siguientes horas, y recuperando un tránsito intestinal normal.
(0.26MB). - 2.
RNPT con distensión abdominal, intolerancia digestiva y restos biliosos en la primera semana de vida: Perforación intestinal aislada (PIA) o espontánea. Son prematuros extremos de muy bajo peso, que a los pocos días de vida presentan restos biliosos y mala o nula tolerancia alimenticia. Con frecuencia han recibido tratamiento para el cierre de la persistencia del conducto arterioso (ibuprofeno, etc.). Pueden presentar mal estado y empeoramiento brusco que obliga a descartar la PIA. La radiografía simple de abdomen muestra patrones variables: ausencia de aireación o asas dilatadas. La sospecha de PIA hace necesaria la radiografía en decúbito lateral con rayo horizontal para descartar neumoperitoneo. Si la radiografía no lo confirma, se requiere completar estudio con US. En caso de PIA, la US detecta pequeños focos ecogénicos puntiformes correspondientes a burbujas aéreas libres (generalmente en la superficie hepática o en los flancos), presencia de asas de delgado engrosadas con signos de sufrimiento y colecciones de líquido hiperecoico, con septos o residuos en su interior, hallazgos típicos de perforación intestinal que indican cirugía abdominal urgente16,17 (fig. 2). En la cirugía casi siempre se descubren perforaciones aisladas típicamente en el íleon distal. La US permite, pues, un diagnóstico y tratamiento precoz en estos pacientes.
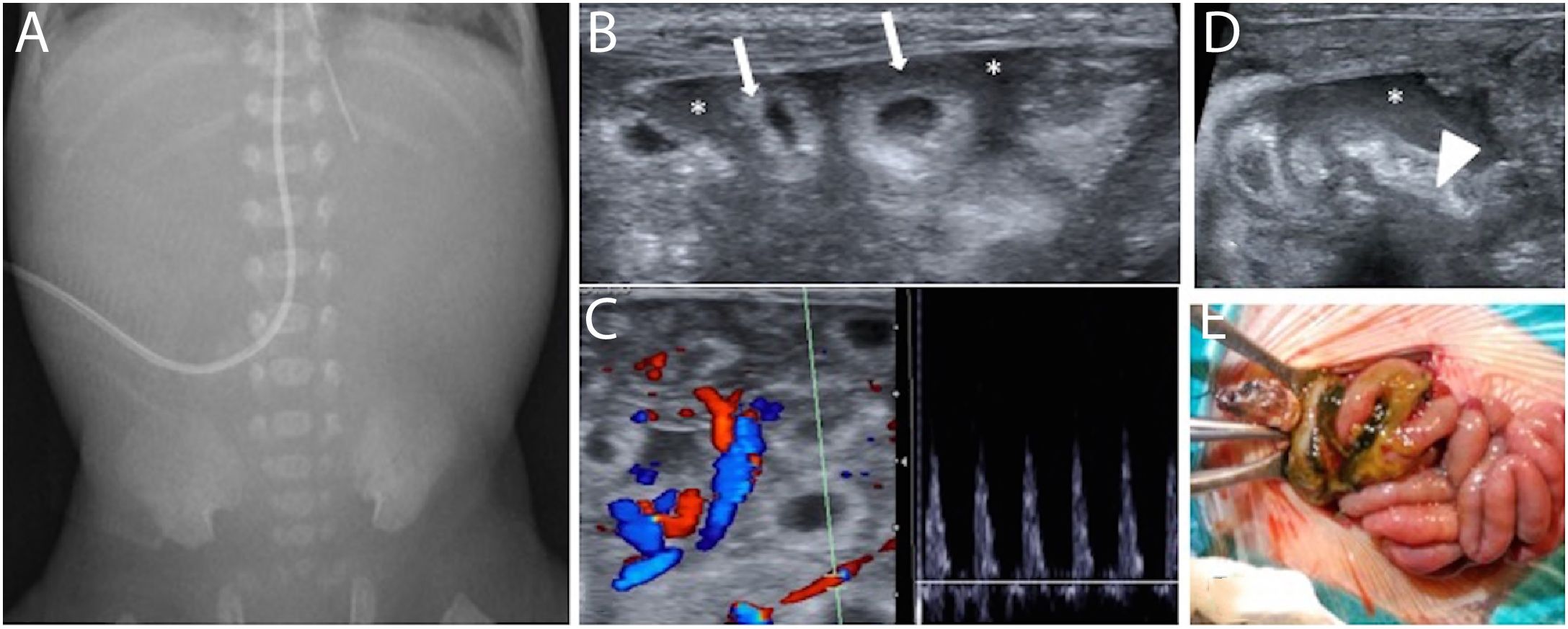
Figura 2.Recién nacido prematuro extremo de 24 semanas, actualmente con 6 días de vida y en tratamiento con ibuprofeno para cierre médico del conducto arterioso. Presenta restos biliosos y abdomen doloroso a la palpación. A) Radiografía simple de abdomen que muestra silencio aéreo abdominal. B) Ecografía con sonda lineal: asas intestinales de pared engrosada y ecogénica (flechas), con líquido libre interasas (*). C) Ecografía dóppler color y pulsado que muestra inversión diastólica en rama arterial mesentérica. D) En fosa ilíaca derecha se observa líquido libre hiperecoico (*) rodeando asas de íleon distal patológicas (cabeza de flecha). E) Tras diagnóstico ecográfico de perforación intestinal, se interviene y se confirma perforación encubierta en íleon terminal.
(0.19MB). - 3.
RNPT con distensión abdominal y empeoramiento clínico brusco, que ha recibido nutrición enteral la primera semana de vida y que comienza con restos biliosos y afectación sistémica en la segunda semana de vida: Enterocolitis necrotizante (ECN). Es el cuadro abdominal más conocido en el RNPT. Su diagnóstico de sospecha es clínico y debe confirmarse con radiografía con el hallazgo de neumatosis intestinal. Las radiografías seriadas han sido el único método de imagen en estos pacientes durante décadas, pero la US tiene cada vez un uso más extendido en el diagnóstico y manejo de la ECN, ya que permite detectar gas intramural incipiente cuando la radiografía es dudosa o presenta poca aireación, y define su ubicación mural con mayor confianza que la radiografía, por lo que es útil buscarlo en la porción mural antideclive para diferenciarlo del gas intraluminal18,19. También puede detectar el engrosamiento y adelgazamiento de la pared intestinal, valorar la presencia de líquido abdominal, pequeñas burbujas de neumoperitoneo y alteraciones de la perfusión de la pared intestinal mediante el dóppler20. Estos hallazgos pueden cambiar el manejo de los pacientes y por tanto influir en el pronóstico21 (fig. 3). En algunos centros ya es posible realizar estudios de ecografía con contraste en estos pacientes12.
Figura 3.Recién nacido prematuro de 28 semanas, en su segunda semana de vida, que presenta distensión abdominal y restos hemáticos en heces. A) Radiografía simple de abdomen: dilatación de asas intestinales con imágenes de neumatosis intestinal en asas del hemiabdomen izquierdo (cabezas de flecha). B) Ecografía hepática horas más tarde: numerosas burbujas aéreas en árbol portal, que identifican burbujas ascendiendo por porta principal (flecha). C) Ecografía con sonda lineal de colon que muestra aire dentro del pared intestinal, hallazgo de neumatosis con aire submucoso y subseroso. D) A las horas, empeoramiento clínico, demostrando la ecografía presencia de burbuja de aire libre extraluminal por neumoperitoneo (cabeza de flecha) que requirió cirugía urgente.
(0.16MB).
El cuadro clínico gastrointestinal más frecuente en el neonato a término es la obstrucción intestinal. Se distinguen dos momentos diagnósticos: obstrucción intestinal precoz, con clínica de distensión abdominal e intolerancia a las pocas horas de nacer, y obstrucción intestinal tardía, por complicación de una malrotación intestinal o la estenosis hipertrófica de píloro que se presentan hacia la tercera semana o al mes de vida:
Obstrucción intestinal precoz. Su sospecha diagnóstica prenatal es actualmente frecuente. El primer estudio es una radiografía simple de abdomen, que excepcionalmente requiere alguna proyección adicional (lateral o con rayo horizontal). Si la obstrucción es alta con signo radiológico claro de doble o triple burbuja y sin aire distal, como sucede en la atresia duodenal o yeyunal respectivamente, su tratamiento es quirúrgico y no es necesaria la US antes de la cirugía8.
Cuando la obstrucción es alta pero incompleta, baja o la radiografía es inespecífica, hay que completar el estudio de imagen. Tradicionalmente, la siguiente exploración ha sido un tránsito en caso de obstrucción alta incompleta o un enema opaco si es baja9. Hoy en día deben evitarse y ser sustituidos por la US, ya que la US diferencia entre asas ileales con moldes meconiales patológicos y microcolon de un RN por un íleo meconial, de las complicaciones del íleo meconial (signos de peritonitis meconial) y de la presencia de un bolsón atrésico ileal15 (fig. 4). Esta US dirige el tratamiento a seguir: cirugía en el caso de íleo meconial complicado o atresia intestinal, o bien realizar un enema terapéutico con contraste hidrosoluble en el caso de un íleo meconial simple22. En otros cuadros obstructivos bajos, como en la enfermedad de Hirschsprung, el enema sigue siendo la técnica diagnóstica principal:
- •
El íleo meconial es un cuadro de presentación abdominal en RN con fibrosis quística en los que el meconio, por ser más espeso, provoca una obstrucción en íleon distal. El diagnóstico se realiza mediante una radiografía que distingue entre un íleo simple (dilatación de asas de intestino delgado) o complicado (signos de perforación o signos de peritonitis meconial). La US identifica los moldes meconiales espesos ecogénicos en el íleon distal y la presencia de un microcolon por desuso, similar a los vistos en la OMP de los RNPT. El enema tiene un doble fin diagnóstico y terapéutico, ya que facilita la evacuación meconial utilizando contraste hidrosoluble hiperosmolar23,24.
- •
La peritonitis meconial es un cuadro de perforación intestinal producido intraútero, generalmente por atresia de intestino delgado, vólvulo intestinal o idiopática. Cursa con ascitis fetal y polihidramnios. La US prenatal detecta calcificaciones en el abdomen fetal25. La radiografía de abdomen posnatal es el primer estudio, pero la US debe ser realizada siempre porque aporta información que influye en el cambio de manejo del paciente: detección de seudoquiste meconial (fig. 4), ascitis, vólvulo o neumoperitoneo26.
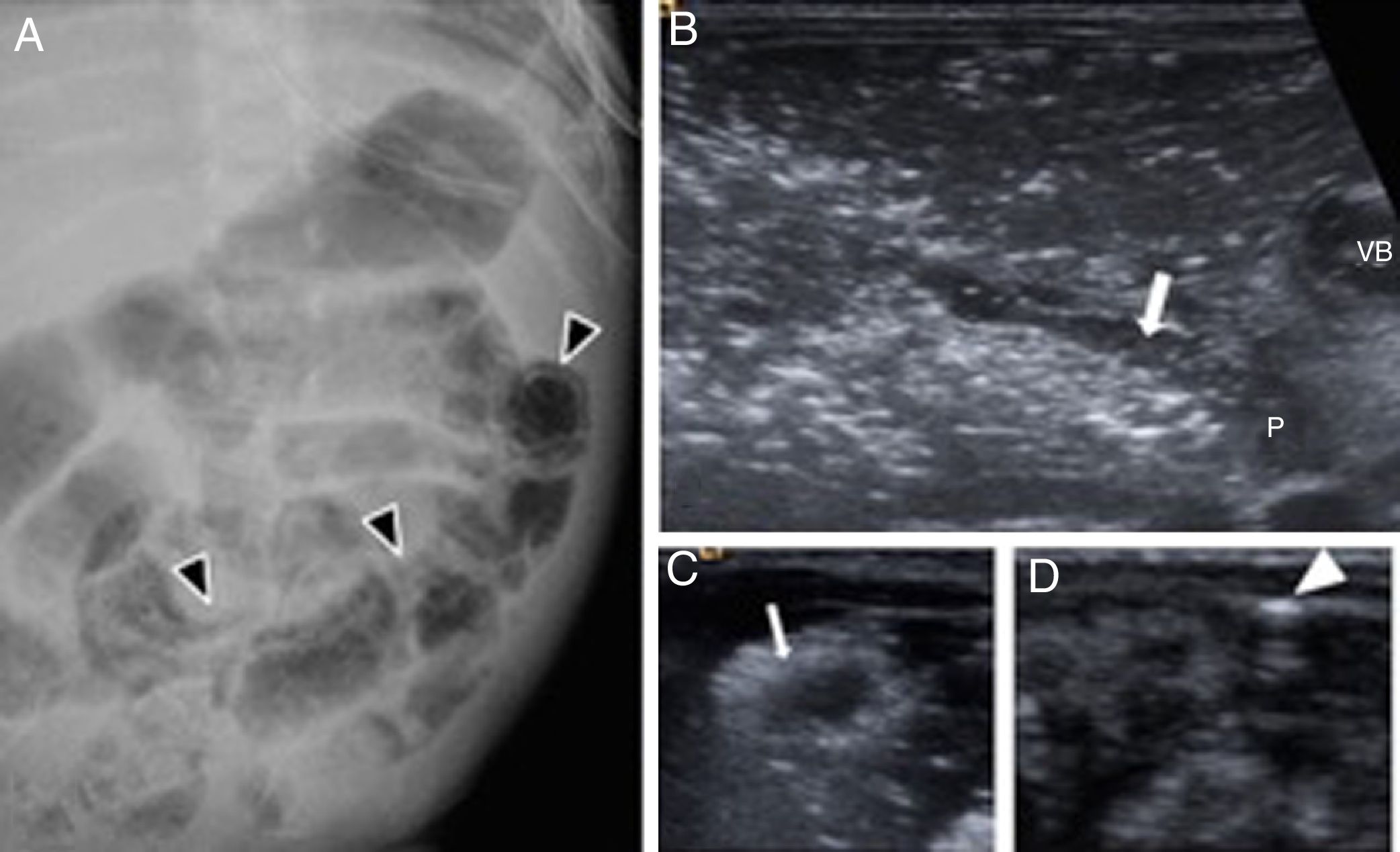
Recién nacido a término con obstrucción intestinal congénita. A-C) Atresia ileal. A) Ecografía de abdomen prenatal: asas dilatadas con contenido meconial hipoecoico en su interior (flechas). B) Radiografía simple de abdomen: dilatación de asas intestinales proximales, sospecha de atresia yeyuno-ileal. C) Ecografía con sonda lineal: se demuestra el bolsón atrésico en la región ileal con contenido meconial en su interior (cabezas de flecha blancas), así como asas intestinales de delgado colapsadas postatréticas (cabeza de flecha negra). D) Hallazgos quirúrgicos de atresia ileal tipo “peladura de manzana”. E-G) Peritonitis meconial. E) Ecografía de abdomen fetal que muestra imagen de contornos muy ecogénicos (cabezas de flecha) adyacente al borde hepático. No se observa ascitis fetal ni polihidramnios. F) Radiografía simple de abdomen posnatal: no hay dilatación de asas intestinales, pero sí múltiples imágenes cálcicas (cabezas de flecha) en el hemiabdomen izquierdo alcanzando la pelvis. G) Ecografía que confirma la presencia de un gran seudoquiste meconial por perforación intestinal intraútero con peritonitis meconial. Se realiza cirugía con resección del seudoquiste, con buena evolución.
Obstrucción intestinal neonatal tardía. Comprende:
- •
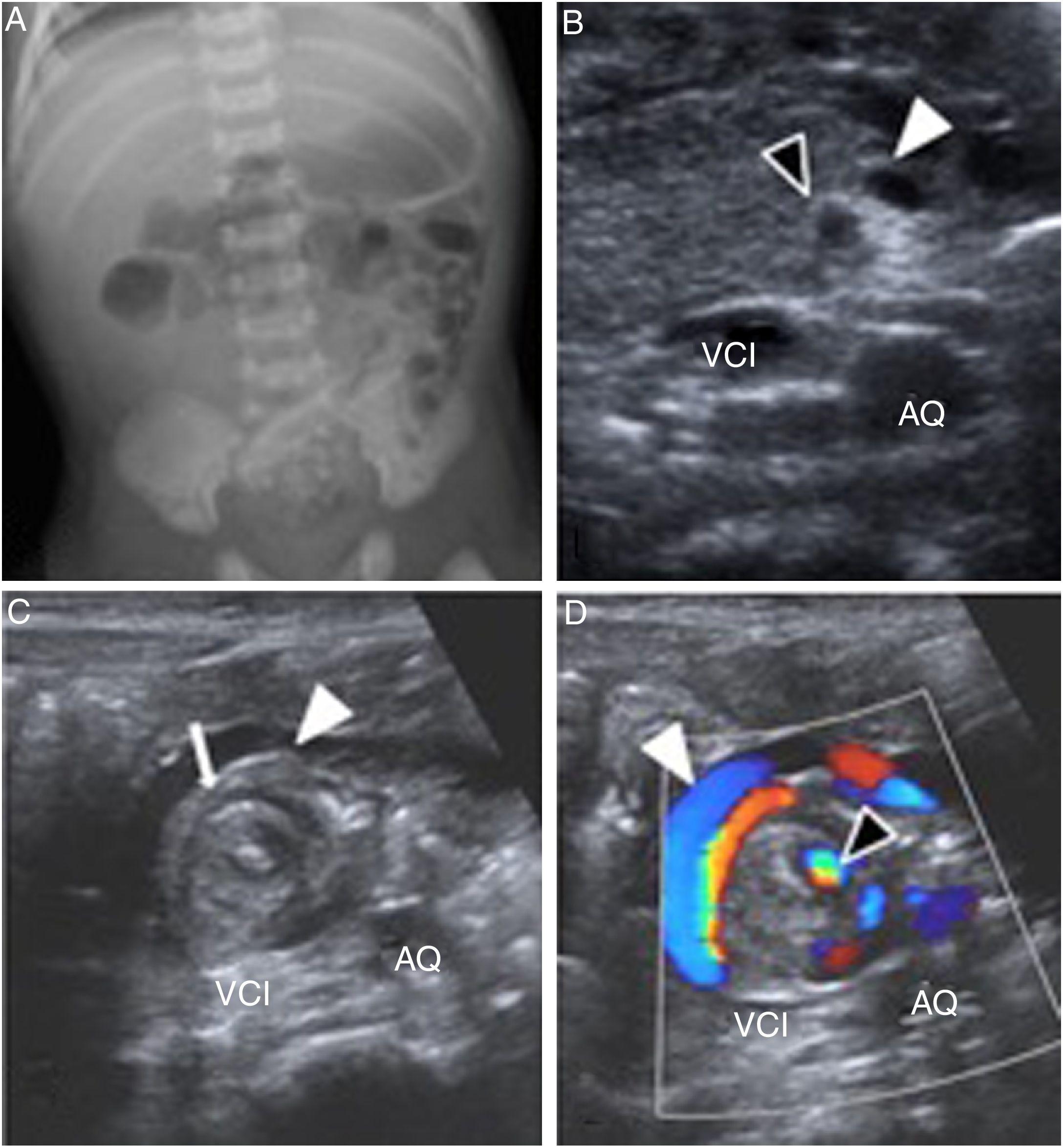
RN con obstrucción duodenal y vómitos biliosos: Malrotación intestinal y vólvulo de intestino medio (VIM). Un RN con vómitos biliosos y con repercusión en su estado clínico debe alertar al radiólogo y obliga a descartar una malrotación intestinal y su complicación en forma de VIM. La radiografía simple de abdomen debe ser el primer estudio que valore el cuadro obstructivo, pero si es normal o inespecífica, está indicada una ecografía. Aunque todavía hay autores que proponen el tránsito intestinal superior (TIS) como prueba principal en su diagnóstico27, en nuestra experiencia, al igual que la aportada por Zhou, la US es de elección como técnica inicial para diagnosticar VIM28. El estudio ecográfico se centra en el epigastrio para buscar el “signo del remolino” (fig. 5), que representa la torsión del mesenterio y la vena mesentérica superior (VMS) alrededor del eje que forma la arteria mesentérica superior (AMS)29.
Figura 5.Recién nacida a término, sin antecedentes prenatales ni perinatales de interés. Es llevada a urgencias por malestar, irritabilidad y vómitos verdosos. A) Radiografía simple de abdomen que muestra anormal distribución del gas intestinal, sin aire en hemiabdomen derecho, pero sin signos de oclusión intestinal. B) Ecografía abdominal con sonda lineal, plano transversal en epigastrio: inversión de la posición de la vena mesentérica superior (cabeza de flecha blanca) con respecto a la arteria mesentérica (cabeza de flecha negra). C) Inmediatamente inferior al plano anterior se observa imagen donde el mesenterio forma una imagen circular (flecha blanca) con la vena mesentérica rodeándolo (cabeza de flecha) o “signo del remolino” que se visualiza mejor con dóppler color (D) y es diagnóstico de vólvulo de intestino medio. Se realiza cirugía urgente.
Ao: Aorta; VCI: vena cava inferior.
(0.29MB).
La US permite además demostrar la posición normal de la tercera porción duodenal entre la aorta y la AMS descartando una malrotación intestinal; y, por el contrario, puede identificar la inversión anatómica de la VMS respecto a la AMS confirmando una malrotación intestinal, recordando que la posición normal de los vasos no descarta malrotación28,29 (fig. 5).
- •
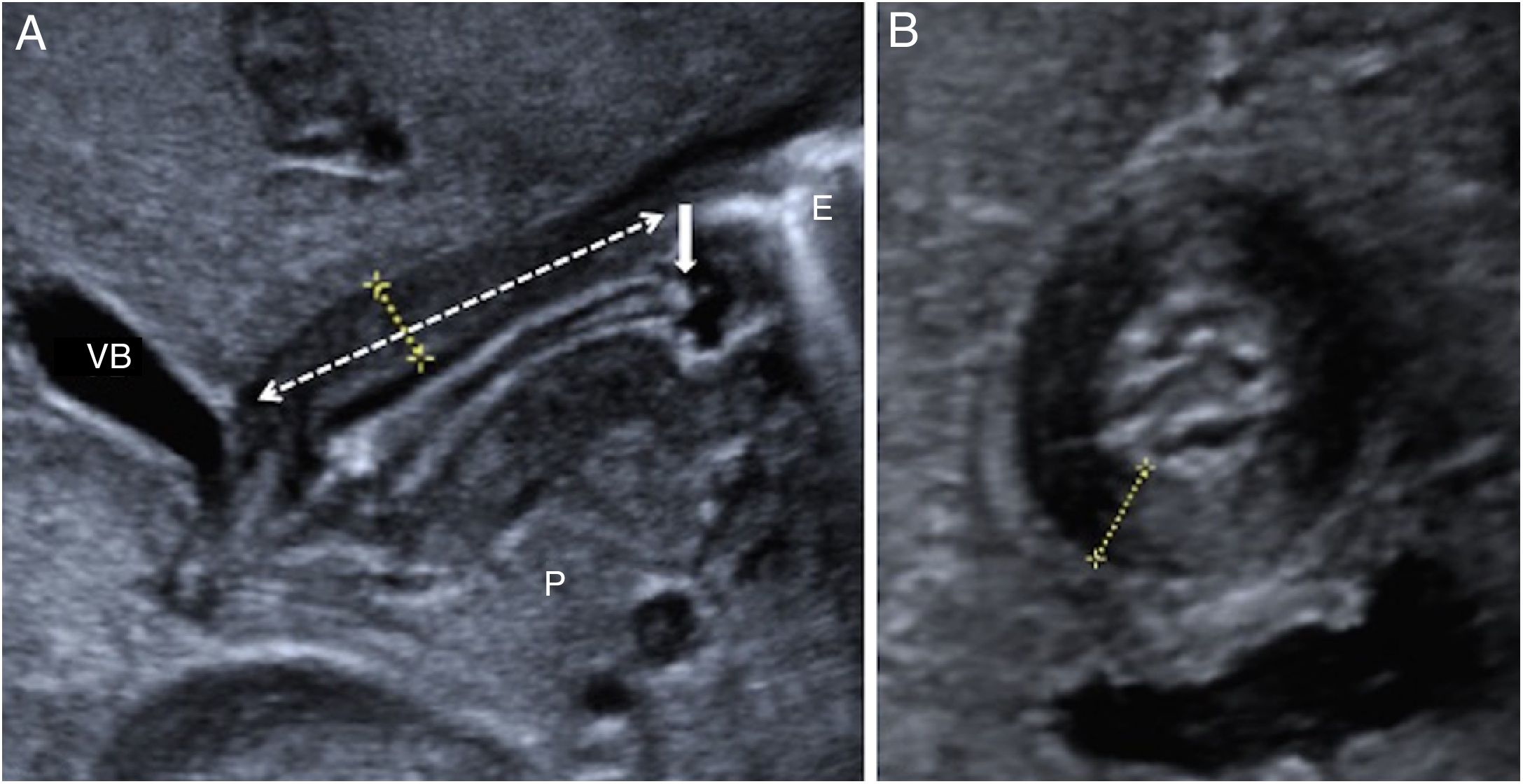
RN entorno al mes de vida con vómitos alimenticios proyectivos: Estenosis hipertrófica del píloro. La US es de elección para su diagnóstico30. Un grosor de la muscular del canal pilórico mayor de 3mm y una longitud del canal pilórico mayor de 15mm son criterios ecográficos diagnósticos y no requieren de otros estudios de imagen. Hay que tener en cuenta la edad gestacional del paciente cuando se diagnostica, porque puede haber cierta variabilidad respecto a esta31–33 (fig. 6). El tratamiento es quirúrgico: piloroplastia.
Figura 6.Recién nacido a término con 25 días de vida y vómitos alimenticios proyectivos en todas las tomas desde hace 3 días. A) Ecografía abdominal con sonda lineal: engrosamiento de la muscular hipoecoica (entre marcas), elongación del canal pilórico (flecha discontinua), protrusión de la mucosa en el antro gástrico (flecha blanca continua). Hallazgos de estenosis hipertrófica del píloro. B) Plano ecográfico transversal del píloro que muestra clásica morfología en “donut” por el engrosamiento de la capa muscular (entre marcas). VB: vesícula biliar; P: cabeza de páncreas/proceso uncinado; E: estómago.
(0.19MB).
Otras indicaciones de ecografía intestinal neonatal son el estudio transperineal en las malformaciones anorrectales34, la detección de masas quísticas abdominales como las malformaciones de origen linfático en el mesenterio, o los quistes de duplicación entérica15.
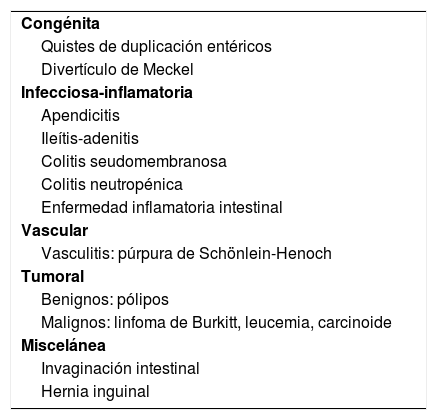
Patología intestinal del niñoLa US es de elección ante la sospecha de patología intestinal en el niño. La radiografía no debe preceder al estudio ecográfico ni emplearse como cribado debido a su escasa sensibilidad diagnóstica. Revisamos los hallazgos ecográficos de la patología gastrointestinal más frecuente (tabla 2).
Patología del tracto digestivo en niños
| Congénita |
| Quistes de duplicación entéricos |
| Divertículo de Meckel |
| Infecciosa-inflamatoria |
| Apendicitis |
| Ileítis-adenitis |
| Colitis seudomembranosa |
| Colitis neutropénica |
| Enfermedad inflamatoria intestinal |
| Vascular |
| Vasculitis: púrpura de Schönlein-Henoch |
| Tumoral |
| Benignos: pólipos |
| Malignos: linfoma de Burkitt, leucemia, carcinoide |
| Miscelánea |
| Invaginación intestinal |
| Hernia inguinal |
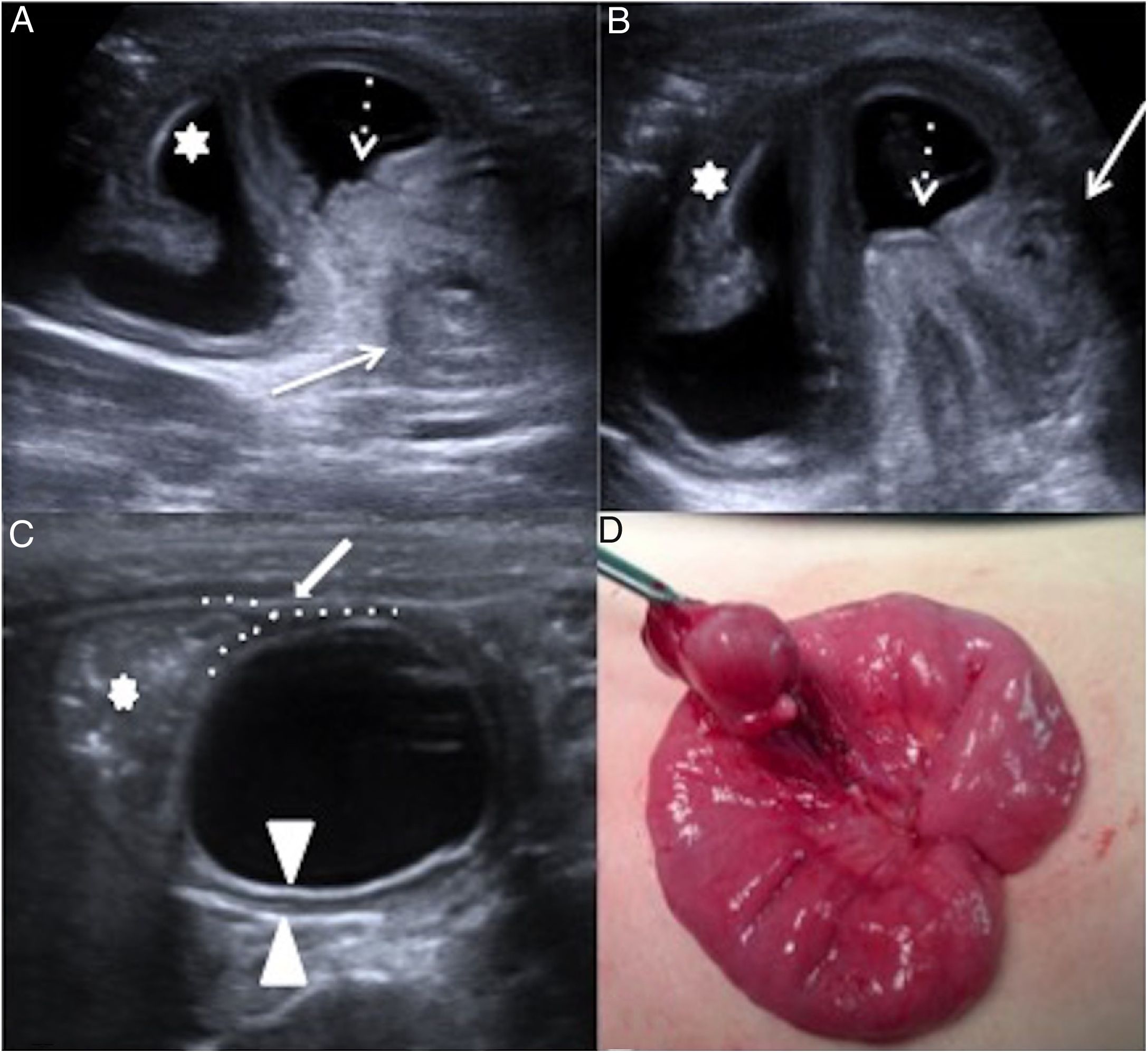
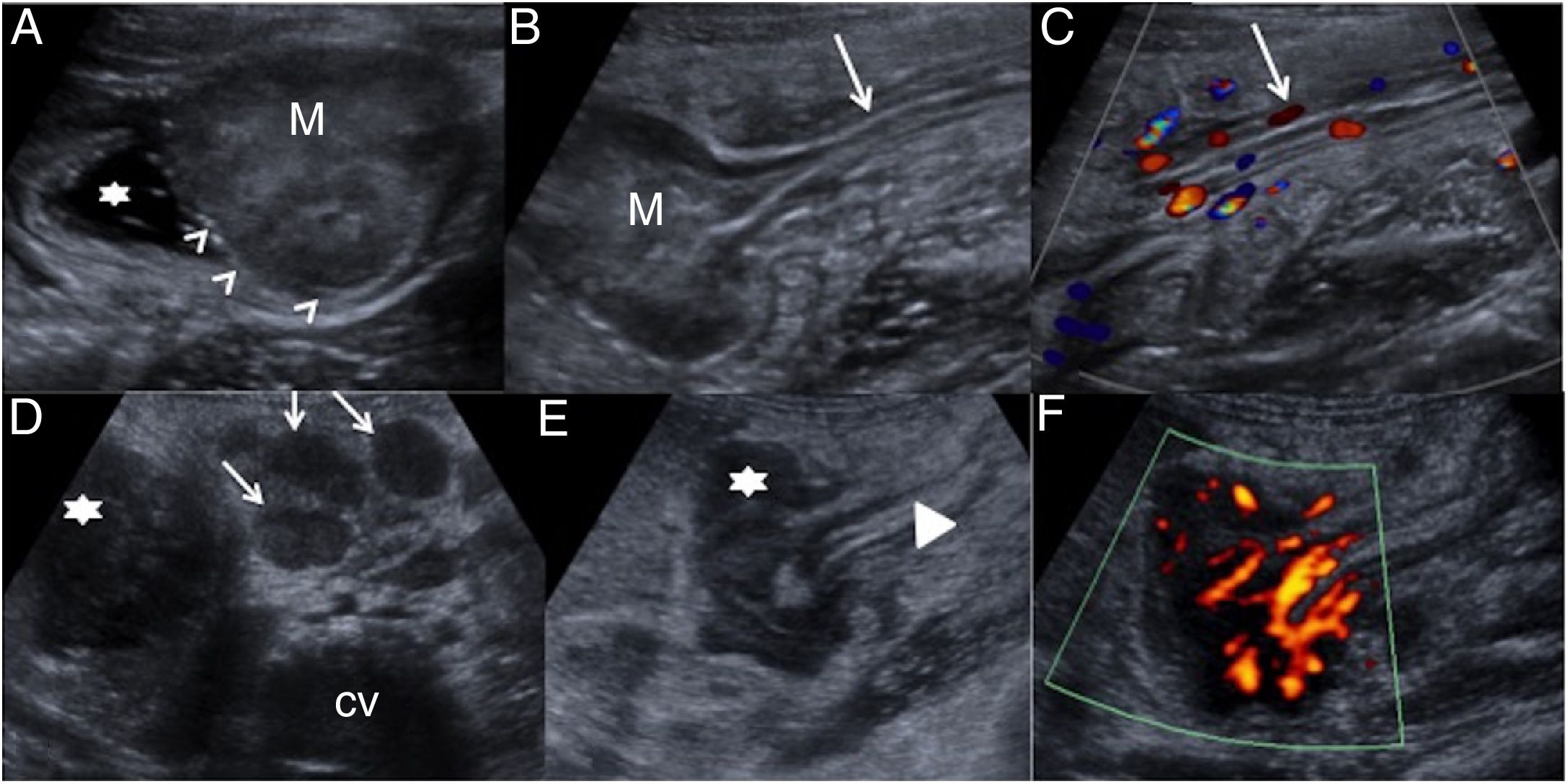
El divertículo de Meckel (DM) es la malformación congénita intestinal más común, con una prevalencia del 2-3%35. Se produce por fallo en la regresión del conducto onfalomesentérico y se localiza en el borde antimesentérico a 40-60cm de la válvula ileocecal. Como verdadero divertículo, presenta todas las capas intestinales, pudiendo contener mucosa gástrica (40% de casos) y pancreática. Las complicaciones más frecuentes son: sangrado, inflamación e invaginación36,37. El DM no complicado raramente se diagnostica por imagen, aunque la presencia de una lesión quística ciega con pared intestinal, dependiente de un asa peristáltica, sugiere su diagnóstico. La inflamación del DM origina una seudomasa hiperémica con dóppler en fosa iliaca derecha (FID) que se confunde a menudo con un plastrón apendicular. Si el divertículo se evierte, puede actuar como cabeza de invaginación generando en US una imagen de doble cabeza o “doble target”, correspondiendo una al divertículo y otra al asa invaginada38–40 (fig. 7). La gammagrafía con Tc-99 solo detecta divertículos con mucosa gástrica. El tratamiento es la resección quirúrgica.
Patología congénita. A y B) Divertículo de Meckel complicado con invaginación intestinal. Niño de 19 meses con llanto y dolor abdominal. Ecografía abdominal. Asa intestinal proximal dilatada con líquido (estrella) y punto de invaginación (flecha discontinua) con presencia de dos lesiones target (flechas blancas). La desinvaginación no resulta exitosa. En la cirugía se encuentra un divertículo de Meckel causante de la invaginación. C y D) Duplicación ileal. Niño de 3 meses que acude a urgencias por vómitos de repetición. Ecografía abdominal. Lesión quística esférica que muestra las cinco capas de la pared intestinal (cabezas de flecha) y signo de “Y” (flecha) que demuestra la pared muscular compartida entre el quiste de duplicación y el asa ileal (asterisco). Pieza quirúrgica del quiste de duplicación de íleon en borde mesentérico.
El quiste de duplicación entérica (QDE) es una malformación congénita rara formada durante el desarrollo embrionario del TD. Debe cumplir tres premisas: poseer mucosa digestiva, capa muscular y compartir pared con el TD. Aparecen desde la boca hasta el recto, siendo el íleon la localización más frecuente. Cada vez más, se detectan ya intraútero. Inicialmente asintomáticos, pueden complicarse con infección, sangrado, perforación e incluso actuar como cabeza de invaginación. Son esféricas (80%) o tubulares (20%). La US es el método de elección para su diagnóstico. La presencia de un quiste en el borde mesentérico con signo de la doble pared (mucosa-muscular) es un hallazgo característico; sin embargo, identificar las cinco capas del TD o el signo de “Y” mostrando la muscular que comparten el quiste y el asa resultan de elevada especificidad (fig. 7). La cirugía debe ser precoz para evitar complicaciones y posible degeneración tumoral. La resonancia magnética (RM) está indicada en caso de duplicaciones esofágicas o rectales que requieran una aproximación quirúrgica complicada41,42.
Infecciosa-inflamatoriaCecoileítisSimulan clínica de apendicitis aguda: dolor abdominal en FID, febrícula, diarrea. La causa más frecuente es la infección bacteriana (Yersinia enterocolitica, Campylobacter) que afecta al área ileocecal43. El germen invade la mucosa, produciendo úlceras y llegando al tejido linfoide de la capa muscular mucosa que está característicamente aumentada. La US muestra engrosamiento de la capa submucosa prominente en el ciego, con hiperplasia linfoide del íleon distal y ganglios mesentéricos. El dóppler demuestra hiperemia moderada de la pared con escasa afectación extramural. Es clave la normalización ecográfica en 10-15 días para diferenciarla del inicio de una enfermedad inflamatoria intestinal (EII).
La afectación del ciego y el colon ascendente es característica en la infección por Salmonella enteritidis con marcado engrosamiento e hiperemia de la mucosa.
Colitis seudomembranosaProducida por Clostridioide difficile. Más frecuente en grupos de riesgo sometidos a tratamiento antibiótico repetido: niños oncológicos o con fibrosis quística. Cursa con diarrea, dolor abdominal intenso y fiebre. Es una verdadera pancolitis. La US muestra un patrón en “acordeón”, producido por criptas rellenas de moco y membranas, que genera un aumento significativo del grosor de la pared, perdiendo la estratificación y conservando la haustración, con colapso de la luz44–46. Los hallazgos ecográficos junto al coprocultivo positivo establecen el diagnóstico.
Colitis neutropénicaEs una enfermedad inflamatoria necrotizante en niños con neutropenia severa, generalmente de causa oncológica. La quimioterapia y la baja inmunidad favorecen la disrupción de la mucosa y la invasión intramural de gérmenes. Afecta sobre todo al área ileocecal con extensión al colon ascendente. La US dóppler muestra una submucosa muy engrosada por edema y hemorragia con hiperemia. Es criterio de mal pronóstico un grosor de pared superior a 10mm con su progresión a necrosis, aire intramural y perforación44,45,47.
Apendicitis agudaLa apendicitis aguda (AA) es la urgencia quirúrgica más prevalente en niños. El pico de incidencia coincide con el momento en que los folículos linfoides alcanzan su máximo tamaño, alrededor de los 11-12 años. El diagnóstico es clínico y analítico: dolor en FID, vómitos, fiebre y leucocitosis. La elevada proporción de apéndices retro o laterocecales (hasta un 30%) altera la focalidad de los síntomas y dificulta el diagnóstico. Solo si existe duda clínica se debe realizar una prueba de imagen. La radiología simple no está indicada por su baja sensibilidad.
La US es de elección, con una sensibilidad del 89% y una especificidad del 95% cuando es realizada por radiólogos expertos48. Si resulta negativa, no requiere realizar nada más; si es positiva, se trata bien de manera quirúrgica o bien de forma conservadora (antibioticoterapia) según el centro. Solo en estudios ecográficos no concluyentes (por obesidad, interposición de aire) el cirujano, de acuerdo con el radiólogo pediátrico, debe valorar la posibilidad de repetir la ecografía en unas horas, completar el estudio con tomografía computarizada (TC) o realizar laparoscopia exploradora.
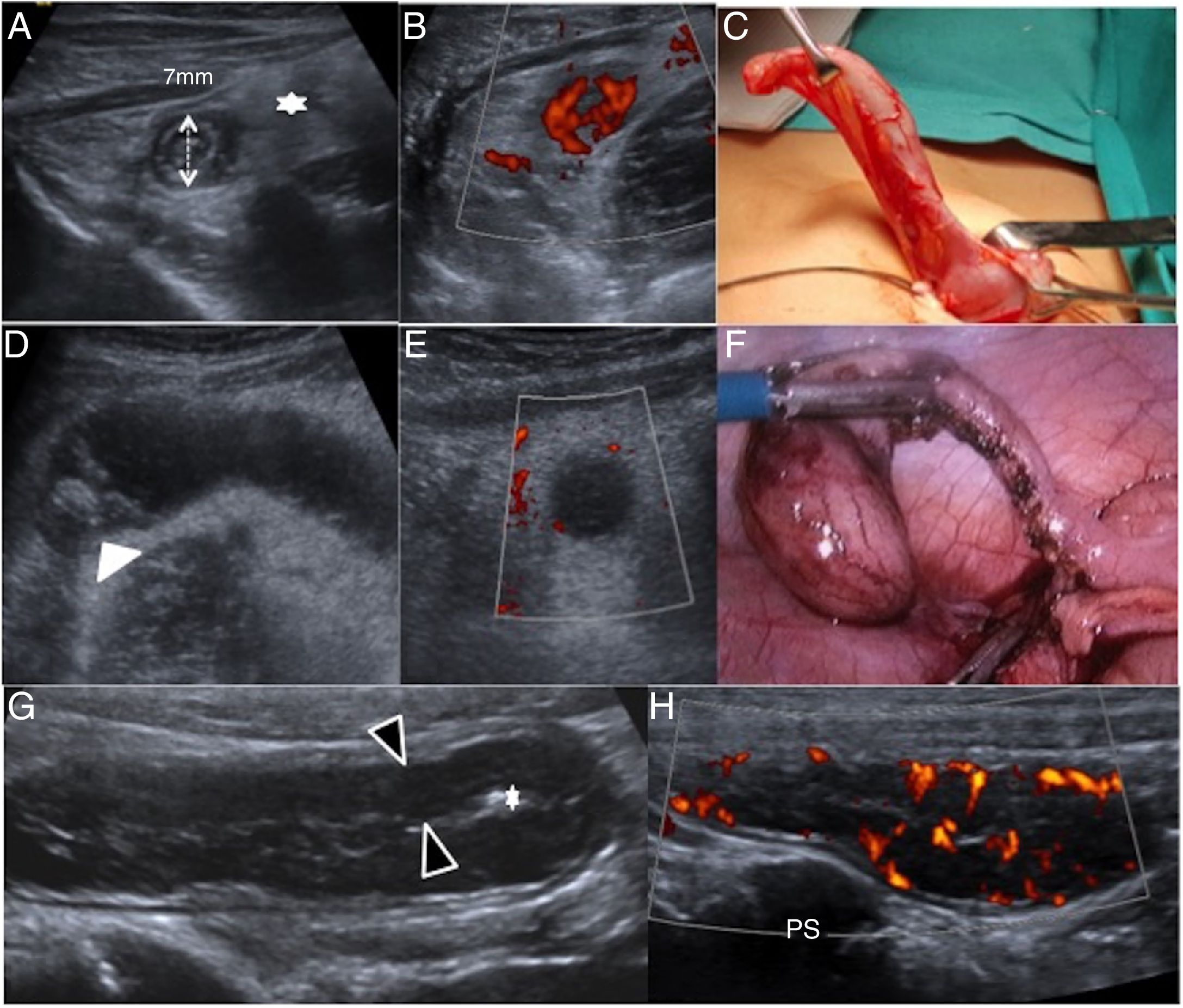
El apéndice se identifica como una estructura tubular en fondo de saco saliendo del ciego. Junto a la compresibilidad, el diámetro apendicular es uno de los criterios más empleados para el diagnóstico de AA. Por debajo de 6mm es normal en el 97,4% de los casos, y por encima de 8mm se considera AA en el 96,1%. Entre 6 y 8mm, la posibilidad de AA aumenta con el grosor y, en esta franja, es la presencia de hallazgos secundarios (mesenterio engrosado, colecciones, asas dilatadas y fijas, líquido libre) la que apoya su diagnóstico49–51. Con la instauración del proceso inflamatorio se modifican las capas de la pared apendicular: de predominar la capa muscular de la mucosa por los folículos linfoides, pasa a un aumento de la submucosa con hiperemia en estudio dóppler. Si progresa a perforación y gangrena, se pierde la estratificación, adelgaza la pared y queda avascular (fig. 8). El apéndice perforado puede estar digerido y no identificarse. El líquido libre purulento es signo de peritonitis por perforación52,53. La elastografía está todavía en desarrollo en el estudio de AA54,55.
Patología infecciosa-inflamatoria. A-C) Apendicitis aguda no complicada. Niño 11 años con dolor abdominal y fiebre. Ecografía abdominal y dóppler power (corte transversal) que muestran un apéndice de 7mm que conserva sus capas, con presencia de meso aumentado (estrella) e hiperemia de la pared apendicular. Por umbiloscopia se extrae un apéndice flemonoso, no complicado. D-F) Apendicitis aguda complicada. Niño de 12 años con dolor abdominal y leucocitosis. La ecografía abdominal y el dóppler power muestran un apéndice dilatado con apendicolito (cabeza de flecha), pérdida de capas y ausencia de vascularización en la pared con meso adyacente ecogénico. La cirugía laparoscópica muestra un apéndice gangrenoso, complicado. G y H) Hiperplasia linfoide apendicular. Niña de 13 años con dolor abdominal localizado en la fosa iliaca derecha. Ecografía abdominal que muestra un notable engrosamiento del apéndice a expensas de la muscular mucosa (entre cabeza de flechas) y colapso de la luz (estrella) con hiperemia en el dóppler power. El diagnóstico es de hiperplasia linfoidea y el tratamiento conservador. PS: psoas.
La US diagnostica procesos alternativos a AA en un 30% de los casos: adenitis mesentérica, ileítis, infarto de omento o patología ginecológica48.
Formas especiales de presentación de AA en niños:
- •
AA del preescolar: en menores de 5 años, la AA es menos frecuente por su forma coniforme. El diagnóstico se demora al confundirse clínicamente con gastroenteritis. La perforación alcanza el 85% en menores de 1 año y el 60% en menores de 5 años favorecida por la inmadurez del omento. La US muestra el plastrón con imagen de seudomasa o seudorriñón hiperémica que llega a confundirse con imagen de invaginación intestinal56.
- •
Hiperplasia linfoide apendicular: la etiología viral de la linfadenitis mesentérica afecta también al tejido linfoide apendicular. El apéndice aparece engrosado entre 6 y 8mm a expensas de la muscular de la mucosa y no de la submucosa. No requiere tratamiento, de ahí la importancia en reconocerla57,58 (fig. 8).
- •
Apendicitis de la punta: el 5% de la AA pediátricas; supone el 15% de los falsos negativos de AA por no visualizar el apéndice completamente. Si hay apendicolito, está más allá de la base apendicular, bien en tercio medio o distal59.
- •
Niños con fibrosis quística: el apéndice lleno de material mucoide puede formar un verdadero mucocele sin signos de inflamación. Los hallazgos secundarios son imprescindibles para poder diagnosticarla de AA60,61.
Presenta características pediátricas particulares. Se describe en otro de los artículos de ecografía intestinal de esta serie.
VascularPúrpura de Schönlein-HenochLa púrpura de Schönlein-Henoch (PSH) es la vasculitis más común en niños. Típicamente se presenta con exantema cutáneo y dolor abdominal, y puede acompañarse de sangrado intestinal. La afectación del TD ocurre en más del 50% de los niños con púrpura. El duodeno, el yeyuno y el íleon son los más afectados62,63. La sensibilidad y especificidad de la US para la valoración gastrointestinal de la púrpura es del 83% y 100%, respectivamente, mostrando un engrosamiento simétrico o asimétrico con pliegues regulares36. La pérdida de estratificación de la pared ocurre por hemorragia, inflamación e infarto. La invaginación transitoria íleo-ileal es frecuente, y más rara la obstrucción con neumatosis secundaria. La hiperemia de la pared es por inflamación, pero cuando se instaura ausencia de dóppler color, indica isquemia y riesgo de perforación62.
TumoralTumores benignosPóliposEl pólipo juvenil de colon es el más frecuente en niños. Pueden aparecer aislados o dentro de síndromes: Peutz-Jeghers, Cronkhite-Canada, Gardner, Sturge-Weber36. La US muestra una masa intraluminal sólida y móvil, de predominio hipoecoico con halo ecogénico periférico. El dóppler color ayuda a identificar un pedículo vascular, lo que facilita su diagnóstico (fig. 9). El pólipo puede actuar como cabeza invaginante de una invaginación3,36,63.
Patología tumoral. A-C) Pólipo intestinal. Niña de 6 años con síndrome de Peutz-Jeghers. Presenta dolor abdominal agudo. Ecografía abdominal con dóppler color. A) Masa (M) sólida heterogénea con borde ecogénico periférico, bien delimitada, que protruye dentro de la luz intestinal (estrella) con (B y C) presencia de un pedículo vascular largo (flechas) (B y C) diagnóstico de pólipo. D-F) Linfoma de Burkitt. Niño de 4 años con dolor abdominal de un mes de evolución y pérdida de peso. Ecografía abdominal. D) Corte transversal abdominal que muestra masa irregular hipoecoica en flanco derecho (estrella) con múltiples ganglios mesentéricos (flechas). CV: columna vertebral. E) La ecografía muestra la dependencia de la masa (estrella) de un asa intestinal (punta de flecha). F) Notable hiperemia con dóppler power.
Linfoma no Hodgkin
Raros, el linfoma no Hodgkin tipo Burkitt es el más común, con un pico de incidencia entre los 5 y los 10 años35. El área ileocecal es la más afectada. Se presenta clínicamente como una masa de rápido crecimiento, con dolor abdominal o cuadro obstructivo por invaginación, al actuar el tumor como cabeza de invaginación. La infiltración tumoral se extiende por la submucosa, y la US muestra un engrosamiento de la pared hipoecoica con pérdida de la estratificación o bien una masa compleja bien vascularizada (fig. 9). Se acompaña de adenopatías mesentéricas o retroperitoneales35,64. Tras establecerse la sospecha diagnóstica, la PET-TC determina la extensión y el estadio.
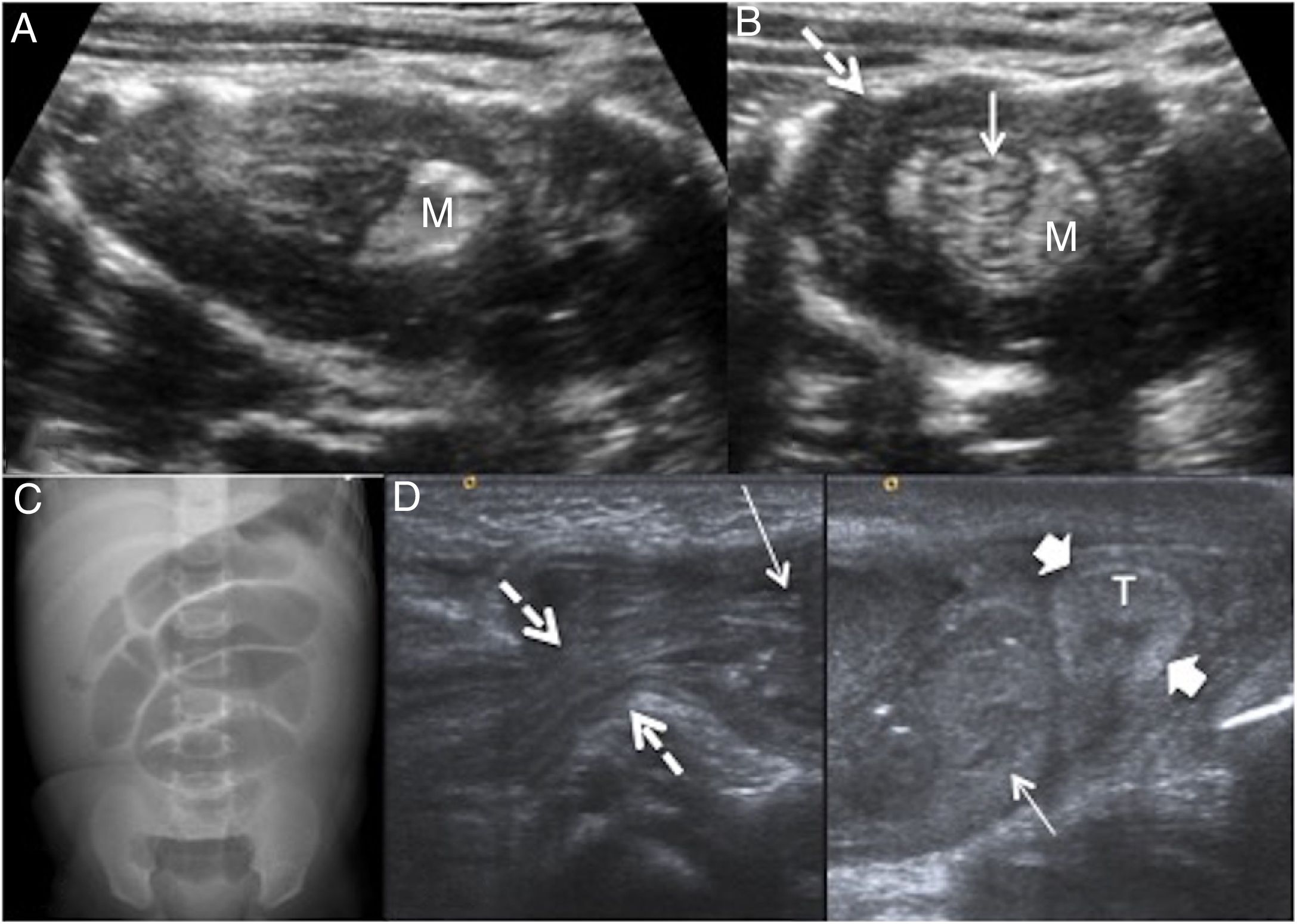
MisceláneaInvaginación intestinalLa invaginación intestinal constituye una de las consultas más habituales en la urgencia pediátrica. La triada clásica de presentación: dolor abdominal cólico, masa y sangre en heces aparece en menos del 25% de los casos. Ocurre cuando se introduce un segmento proximal intestinal (intususceptum) en un segmento continuo distal (intususcipiens); la más frecuente es la ileocólica (90%)3,65. Es la causa más común de obstrucción intestinal en niños entre 6 meses y 2 años, siendo hasta el 90% menores de 2 años65. Un 90% son idiopáticas, atribuidas a la hipertrofia de tejido linfoide en el íleon terminal y presencia de adenopatías mesentéricas tras una infección viral, que actúan como cabeza de invaginación. La presencia de invaginación intestinal en niños mayores de 4 años obliga a descartar causa subyacente (DM, QDE, pólipo o linfoma).
La US es la técnica diagnóstica de elección, con una sensibilidad y especificidad cercana al 100%3. Los hallazgos son característicos: imagen en seudorriñón en longitudinal y “donut” o diana en transversal, y se alternan anillos concéntricos hipo e hiperecoicos que representan las capas del intestino invaginado e invaginante, quedando atrapadas la grasa mesentérica y adenopatías (fig. 10). El tratamiento de elección es la reducción hidrostática ecoguiada. Las contraindicaciones a la misma son la perforación y/o la peritonitis. Tras sedar al niño, se realiza enema con suero salino, que resulta exitoso cuando se observa paso de líquido a través de la válvula ileocecal. La tasa de éxitos está por encima del 85%66. La presencia de líquido atrapado entre las capas y el engrosamiento de la pared más externa superior a 10mm con ausencia de vascularización se consideran signos de fracaso en la reducción3. Las recurrencias (10%) ocurren en las primeras 48 horas, y no está indicada la US de control previa al alta hospitalaria salvo sospecha clínica de reinvaginación.
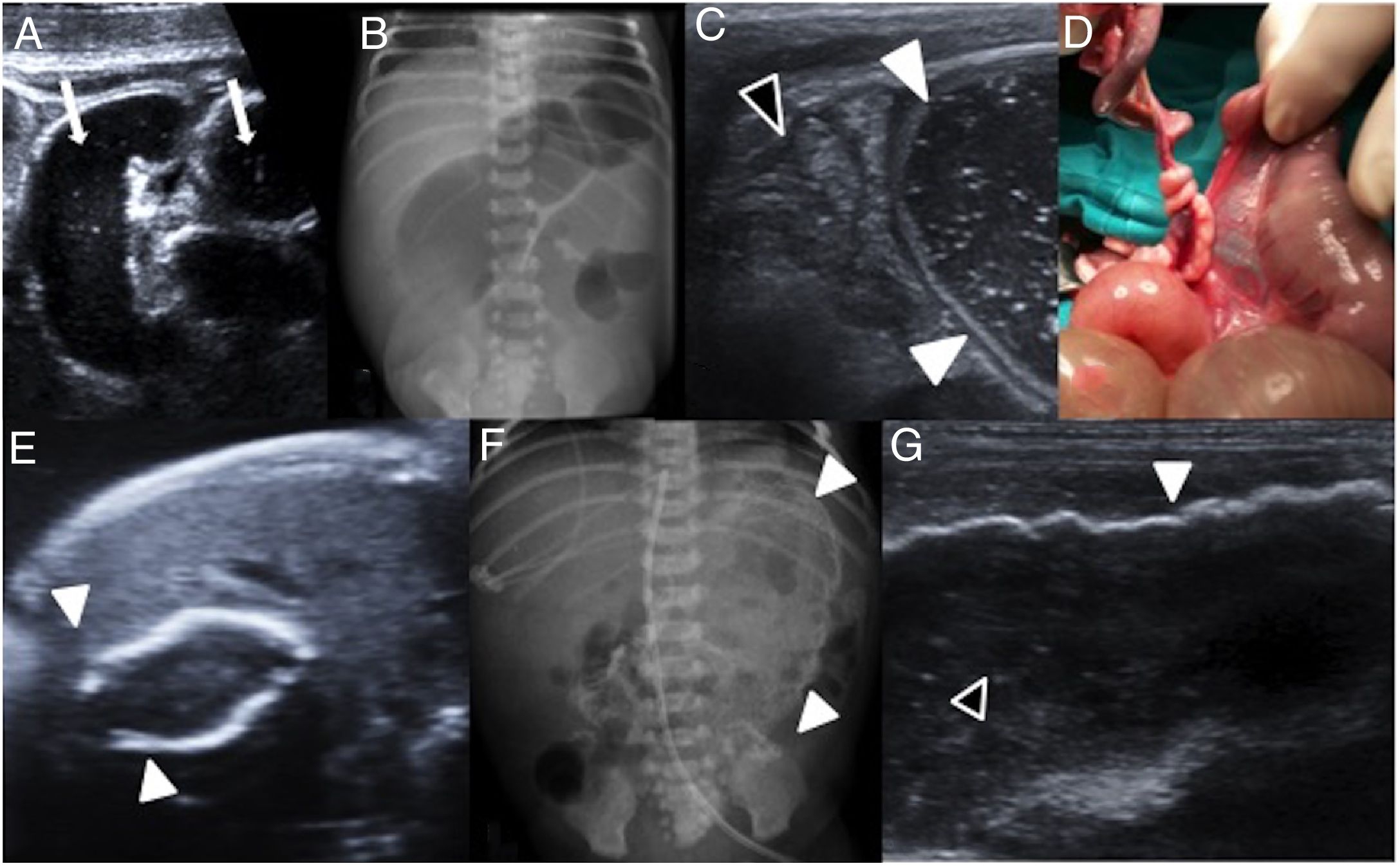
Patología obstructiva. A-C) Invaginación intestinal. Niña de 15 meses con llanto, dolor abdominal y encogimiento de piernas. Ecografía abdominal en modo B. A) Corte longitudinal, imagen en seudorriñón. B) Corte transversal, imagen en “donut” que muestra un asa invaginada (flecha) dentro de otra asa (flecha discontinua) con atrapamiento del meso (M). C y D) Hernia inguinal izquierda. Niño de 3 meses con llanto y dolor abdominal. C) Radiografía simple de abdomen que muestra cuadro de obstrucción con dilatación de asas de delgado. D) Canal inguinal amplio (entre flechas discontinuas) introduciéndose por el mismo asas intestinales que presentan pared normal (flechas) desplazando al testículo (T, entre flechas gruesas) al fondo de la bolsa escrotal.
Es importante diferenciar una invaginación ileocólica de una ileoileal. Las invaginaciones ileoileales son debidas al hiperperistaltismo intestinal, presentan un tamaño transversal por debajo de 2cm y son más frecuentes en hemiabdomen izquierdo. Son transitorias y el tratamiento es conservador67.
Hernia inguinalEn niños, la hernia inguinal es secundaria a un fallo en el cierre del proceso peritoneovaginal, y constituye la causa más frecuente de cirugía en la infancia. El saco contiene asas de intestino delgado y a veces omento.
El diagnóstico es clínico, con aumento del volumen sobre el anillo inguinal superficial que empeora con el llanto o con la maniobra de Valsalva. Las complicaciones más habituales son el estrangulamiento del asa y la compresión sobre el testículo con atrofia secundaria del mismo. La US presenta una seguridad diagnóstica superior al 95% cuando el diámetro del canal inguinal es superior a 4mm62. En el asa herniada se valora el grosor de la pared (normal o aumentado por el edema) y su vascularización (curva dóppler normal o invertida y ausente en caso de sufrimiento vascular), así como la ecoestructura, tamaño y vascularización del testículo ipsilateral. La US realizada tras la reducción manual verifica su eficacia en el tratamiento5,62 (fig. 10).
ConclusiónLa US es la técnica de elección en el estudio de la patología del TD del niño, y está cada vez más implementada en la del neonato debido a su carácter inocuo y portabilidad. Requiere de un aprendizaje de la técnica y de un conocimiento tanto de la anatomía normal como de la patología gastrointestinal pediátrica para aumentar su rendimiento diagnóstico.
Autoría- 1.
Responsable de la integridad del trabajo: CSN y RLLS.
- 2.
Concepción del trabajo: CSN y RLLS.
- 3.
Diseño del estudio: CSN y RLLS.
- 4.
Obtención de los datos: No aplica.
- 5.
Análisis e interpretación de los datos: No aplica.
- 6.
Tratamiento estadístico: No aplica.
- 7.
Búsqueda bibliográfica: CSN y RLLS.
- 8.
Redacción del trabajo: CSN y RLLS.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CSN y RLLS.
- 10.
Aprobación de la versión final: CSN y RLLS.
Los autores declaran no tener ningún conflicto de intereses.