Editado por: Dr. Tomás Ripollés González - Servicio de Radiodiagnóstico, Hospital Universitari Doctor Peset, València, España
Más datosLa ecografía no es la técnica de imagen más citada para la valoración de la patología infecciosa y tumoral del tubo digestivo y el peritoneo, pero a menudo es la inicialmente empleada ante cuadros inespecíficos. Aunque no exenta de limitaciones, presenta fortalezas que pueden permitirle aportar información diagnóstica significativa. Discutimos los datos ecográficos, clínicos y epidemiológicos más relevantes en la patología infecciosa, siguiendo un abordaje topográfico: estómago (Anisakis), intestino delgado proximal (Giardia lamblia, Strongyloides stercolaris, complejo Mycobacterium-avium-intracelulare y Criptosporidium), intestino delgado distal (Yersinia, Salmonella, Campylobacter) íleon terminal y ciego (tuberculosis), colon derecho (Entamoeba histolytica), colon izquierdo (Shigella), recto-sigma, pancolitis (Clostridium difficile, Citomegalovirus, Escherichia coli) y peritoneo. Abordamos los hallazgos ecográficos y clínicos de la patología neoplásica más frecuente con un patrón nosológico: lesiones polipoideas como precursoras de neoplasias, carcinomas, tumores neuroendocrinos, hematológicos, mesenquimales y metástasis. Discutimos brevemente la patología tumoral del peritoneo y la ecografía como guía de biopsia percutánea.
Ultrasonography is not the most cited imaging technique for the evaluation of infectious and neoplastic diseases of the gastrointestinal tract and the peritoneum, but it is often the initial technique used in the initial workup for nonspecific clinical syndromes. Despite its limitations, ultrasonography's strengths enable it to provide meaningful diagnostic information.
To discuss the most important ultrasonographic, clinical, and epidemiological findings for infectious disease, we follow a topographical approach: stomach (Anisakis), proximal small bowel (Giardia lamblia, Strongyloides stercoralis, Mycobacterium avium-intracellulare complex, and Cryptosporidium), distal small bowel (Yersinia, Salmonella, and Campylobacter), terminal ileum and cecum (tuberculosis), right colon (Entamoeba histolytica), left colon (Shigella), sigmoid colon and rectum, pancolitis (Clostridium difficile, Cytomegalovirus, and Escherichia coli), and peritoneum.
To discuss the ultrasonographic and clinical findings of the most common neoplastic diseases, we follow a nosological approach: polyploid lesions as precursors of tumors, carcinomas, neuroendocrine tumors, hematological tumors, mesenchymal tumors, and metastases. We briefly discuss tumors of the peritoneum and the use of ultrasonography to guide percutaneous biopsy procedures.
Numerosos patógenos, siendo los virus los más frecuentes, bacterias, hongos y parásitos, pueden originar una infección intestinal, causa frecuente de dolor abdominal, náuseas y vómitos, diarrea (en ocasiones acuosa y abundante o con sangre) y fiebre. Habitualmente tienen un curso autolimitado, con escasa repercusión clínica, y el diagnóstico suele recaer en datos epidemiológicos, coprocultivos o serologías. No suelen requerir pruebas de imagen, pero en ocasiones estas tienen un papel importante.
Si bien la técnica de imagen habitual en este escenario es la tomografía computarizada (TC), la ecografía aporta gran utilidad. Frecuentemente, es la primera prueba solicitada ante un cuadro de dolor abdominal inespecífico. Debe emplearse especialmente en niños y mujeres embarazadas. En el control evolutivo de casos graves, permite valorar la gravedad y extensión de la afectación intestinal y descartar complicaciones quirúrgicas, aprovechando su mayor disponibilidad, portabilidad y ausencia de radiación y contraste nefrotóxico. Finalmente, aporta la valoración más dinámica del peristaltismo intestinal, pudiendo añadir información adicional.
El aspecto ecográfico característico de la infección intestinal es el engrosamiento de la pared, generalmente respetando su estratificación, afectando a la mucosa y submucosa, sin implicación de la muscular. Puede acompañarse de adenopatías locorregionales, cambios inflamatorios en los planos grasos adyacentes o líquido libre. En casos de diarrea secretora, el hallazgo inicial son asas intestinales rellenas de líquido. El Doppler muestra aumento de la vascularización con índices de resistencia bajos (<0,60), a diferencia de las lesiones neoplásicas1. Las técnicas especiales como la ecografía con contraste y la elastografía tienen aquí escasa utilidad2.
Estos hallazgos son inespecíficos y no permiten establecer un diagnóstico etiológico definitivo, pero algunas características, como la distribución de la afectación, el estado inmunitario del paciente y la presencia de manifestaciones extraintestinales, permiten orientar el posible origen del cuadro. Presentamos algunas de las causas más frecuentes en nuestro medio, siguiendo un esquema topográfico, que se resumen en la tabla 1.
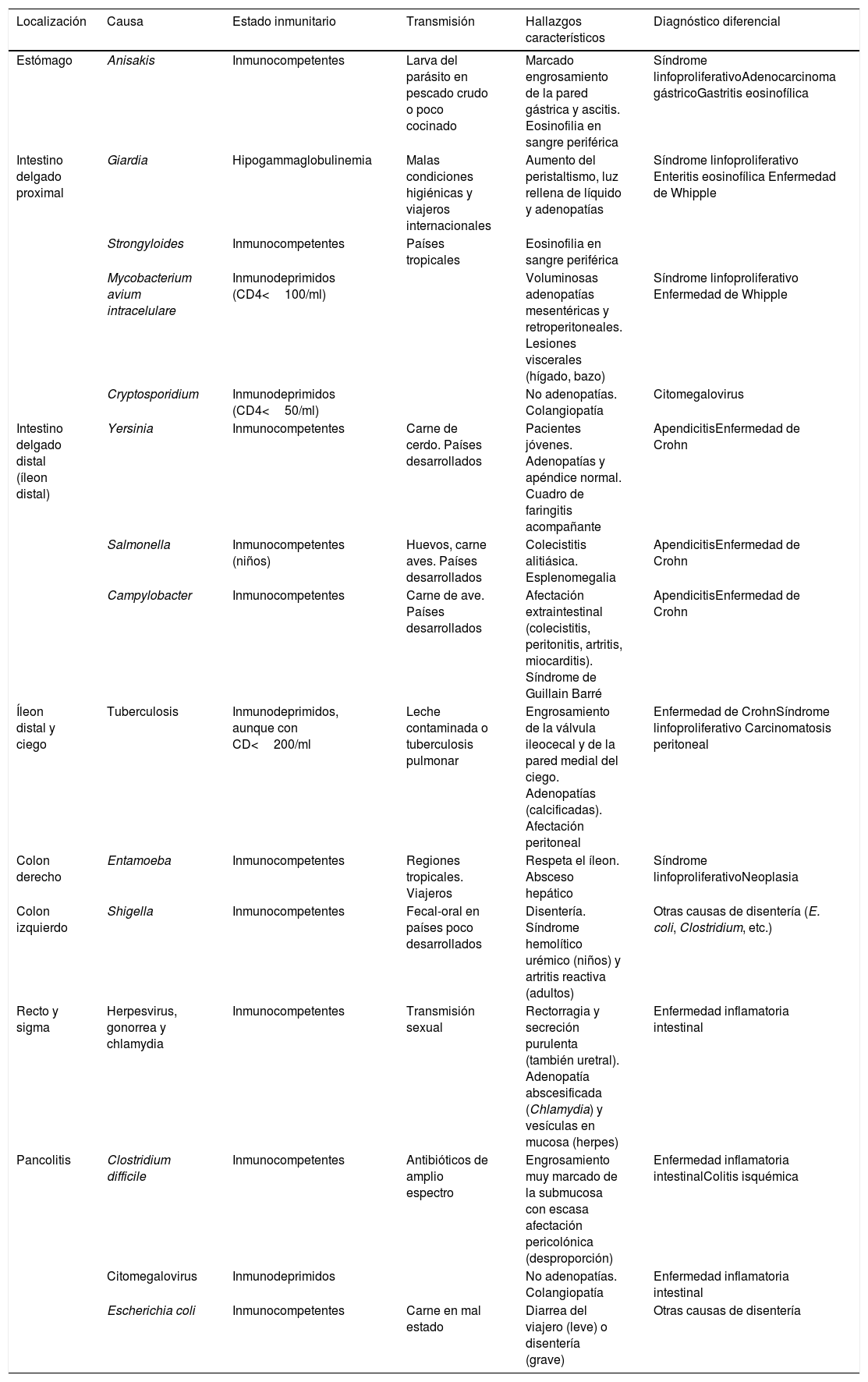
Resumen de infecciones del tracto gastrointestinal
| Localización | Causa | Estado inmunitario | Transmisión | Hallazgos característicos | Diagnóstico diferencial |
|---|---|---|---|---|---|
| Estómago | Anisakis | Inmunocompetentes | Larva del parásito en pescado crudo o poco cocinado | Marcado engrosamiento de la pared gástrica y ascitis. Eosinofilia en sangre periférica | Síndrome linfoproliferativoAdenocarcinoma gástricoGastritis eosinofílica |
| Intestino delgado proximal | Giardia | Hipogammaglobulinemia | Malas condiciones higiénicas y viajeros internacionales | Aumento del peristaltismo, luz rellena de líquido y adenopatías | Síndrome linfoproliferativo Enteritis eosinofílica Enfermedad de Whipple |
| Strongyloides | Inmunocompetentes | Países tropicales | Eosinofilia en sangre periférica | ||
| Mycobacterium avium intracelulare | Inmunodeprimidos (CD4<100/ml) | Voluminosas adenopatías mesentéricas y retroperitoneales. Lesiones viscerales (hígado, bazo) | Síndrome linfoproliferativo Enfermedad de Whipple | ||
| Cryptosporidium | Inmunodeprimidos (CD4<50/ml) | No adenopatías. Colangiopatía | Citomegalovirus | ||
| Intestino delgado distal (íleon distal) | Yersinia | Inmunocompetentes | Carne de cerdo. Países desarrollados | Pacientes jóvenes. Adenopatías y apéndice normal. Cuadro de faringitis acompañante | ApendicitisEnfermedad de Crohn |
| Salmonella | Inmunocompetentes (niños) | Huevos, carne aves. Países desarrollados | Colecistitis alitiásica. Esplenomegalia | ApendicitisEnfermedad de Crohn | |
| Campylobacter | Inmunocompetentes | Carne de ave. Países desarrollados | Afectación extraintestinal (colecistitis, peritonitis, artritis, miocarditis). Síndrome de Guillain Barré | ApendicitisEnfermedad de Crohn | |
| Íleon distal y ciego | Tuberculosis | Inmunodeprimidos, aunque con CD<200/ml | Leche contaminada o tuberculosis pulmonar | Engrosamiento de la válvula ileocecal y de la pared medial del ciego. Adenopatías (calcificadas). Afectación peritoneal | Enfermedad de CrohnSíndrome linfoproliferativo Carcinomatosis peritoneal |
| Colon derecho | Entamoeba | Inmunocompetentes | Regiones tropicales. Viajeros | Respeta el íleon. Absceso hepático | Síndrome linfoproliferativoNeoplasia |
| Colon izquierdo | Shigella | Inmunocompetentes | Fecal-oral en países poco desarrollados | Disentería. Síndrome hemolítico urémico (niños) y artritis reactiva (adultos) | Otras causas de disentería (E. coli, Clostridium, etc.) |
| Recto y sigma | Herpesvirus, gonorrea y chlamydia | Inmunocompetentes | Transmisión sexual | Rectorragia y secreción purulenta (también uretral). Adenopatía abscesificada (Chlamydia) y vesículas en mucosa (herpes) | Enfermedad inflamatoria intestinal |
| Pancolitis | Clostridium difficile | Inmunocompetentes | Antibióticos de amplio espectro | Engrosamiento muy marcado de la submucosa con escasa afectación pericolónica (desproporción) | Enfermedad inflamatoria intestinalColitis isquémica |
| Citomegalovirus | Inmunodeprimidos | No adenopatías. Colangiopatía | Enfermedad inflamatoria intestinal | ||
| Escherichia coli | Inmunocompetentes | Carne en mal estado | Diarrea del viajero (leve) o disentería (grave) | Otras causas de disentería |
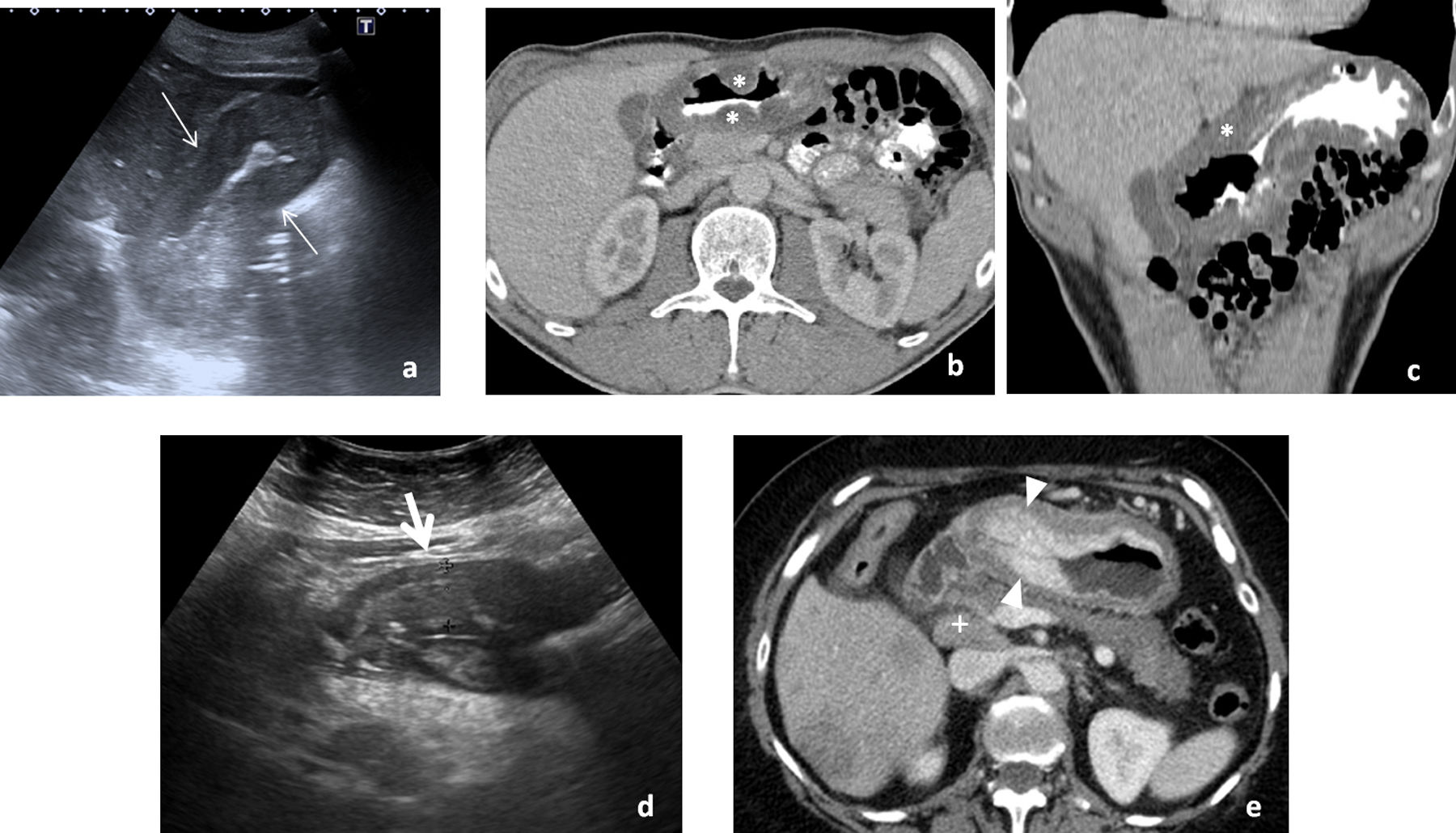
Consecuencia de la ingesta de la larva del parásito en pescado crudo o poco cocinado; aunque los primeros casos se describen en países asiáticos, se ha globalizado. Cuando, como ocurre habitualmente, afecta al estómago, la sintomatología aparece en menos de 24 horas. Provoca intenso dolor agudo en epigastrio, náuseas y vómitos, pudiendo simular patología pancreatobiliar. La ecografía, muchas veces urgente, muestra un importante engrosamiento difuso de la pared gástrica (fig. 1A) y ascitis, planteando diagnóstico diferencial con patología tumoral (linfoma o adenocarcinoma difuso) o gastritis eosinofílica (fig. 1B).
Afectación infecciosa del estómago. A-C) Primer caso de paciente que acude a urgencias por dolor intenso en epigastrio, con náuseas y vómitos abundantes de pocas horas de evolución, por el que se solicita ecografía urgente (A). Engrosamiento circunferencial y simétrico (flechas finas) de la pared de cuerpo y antro gástrico, que se correlaciona con las imágenes de tomografía computarizada (TC) en incidencia axial (B) y reconstrucción coronal (C) que se realizó a continuación, donde predomina un engrosamiento hipodenso (*) que orienta a edema submucoso. Con la sospecha de cuadro inflamatorio sin poder descartar otras causas, el paciente es sometido a endoscopia que muestra engrosamiento de pliegues gástricos y eritema mucoso con el resultado histológico en la biopsia de gastritis crónica superficial con eosinofilia, muy sugerente de gastritis por anisakis, aunque no pudo identificarse el parásito. El cuadro se resolvió en pocos días con tratamiento sintomático. D y E) Segundo caso de paciente que refiere dolor epigástrico de semanas de evolución con vómitos ocasionales. Se solicita ecografía como prueba de estudio inicial, que muestra un engrosamiento de la pared del antro gástrico, asimétrico, más marcado en la pared anterior (flecha gruesa), sospechoso de origen tumoral (D). La TC realizada posteriormente (E) presenta un hallazgo similar, mostrando una captación irregular de contraste (cabezas de flecha) de la mucosa gástrica, con una adenopatía prominente por delante de la vena cava inferior (+) sospechosa de diseminación ganglionar. La endoscopia y biopsia posterior confirman el diagnóstico de adenocarcinoma.
La anisakiasis intestinal, mucho menos frecuente, implica al íleon terminal y puede extenderse al colon, retrasándose los síntomas hasta los 5 días y simulando enfermedad inflamatoria intestinal, apendicitis, diverticulitis u obstrucción intestinal. Condiciona un engrosamiento segmentario de la pared del íleon con discreta dilatación proximal y ascitis.
Ambas pueden coexistir. Ocasionalmente hay síntomas alérgicos y es frecuente la eosinofilia. El antecedente epidemiológico orienta el diagnóstico, y la detección endoscópica de la larva, la infiltración eosinofílica de la pared en estudio histológico y el aumento de IgE específica permiten confirmarlo3–5.
Intestino delgado proximalGiardia lambliaParasitosis que afecta al duodeno y yeyuno, favorecida en caso de hipogammaglobulinemia, que provoca diarrea y malabsorción. Es frecuente en países en desarrollo con malas condiciones higiénicas, en niños y en viajeros internacionales. Puede encontrarse una luz intestinal rellena de líquido con peristaltismo aumentado y pared de grosor normal6, o edema de la submucosa, ocasionalmente de aspecto seudonodular por hiperplasia linfoide, en el contexto del trastorno autoinmune7. Se acompaña frecuentemente de adenopatías mesentéricas, que obligan a considerar el diagnóstico de síndrome linfoproliferativo, enteritis eosinofílica o enfermedad de Whipple8.
Strongyloides stercolarisMás frecuente en regiones tropicales, muestra hallazgos similares. Característicamente presenta eosinofilia periférica9 y puede provocar un cuadro diseminado severo en inmunodeprimidos10.
Complejo Mycobacterium avium intracelulareDebe considerarse en inmunodeprimidos, especialmente en pacientes VIH con niveles de linfocitos CD4<100/ml. Afecta habitualmente al yeyuno, que aparece engrosado, aunque puede asentar en cualquier segmento del intestino delgado. Se acompaña de ascitis y voluminosas adenopatías mesentéricas y retroperitoneales, en ocasiones con centro hipoecoico, similar a la enfermedad de Whipple. Por ausencia de respuesta inmunitaria6 pueden no mostrar dicho hallazgo, en cuyo caso no puede descartarse linfoma. En las formas diseminadas, aparecen adenopatías en otras cadenas (mediastínicas o cervicales) o lesiones en vísceras sólidas (hígado, bazo o riñones)11.
CryptosporidiumHabitualmente en pacientes con niveles de linfocitos CD4<50/ml. Implica al intestino delgado proximal, sin adenopatías asociadas. Puede acompañarse de colangiopatía (dilatación de la vía biliar, estenosis del colédoco distal o colecistitis alitiásica), similar al CMV.
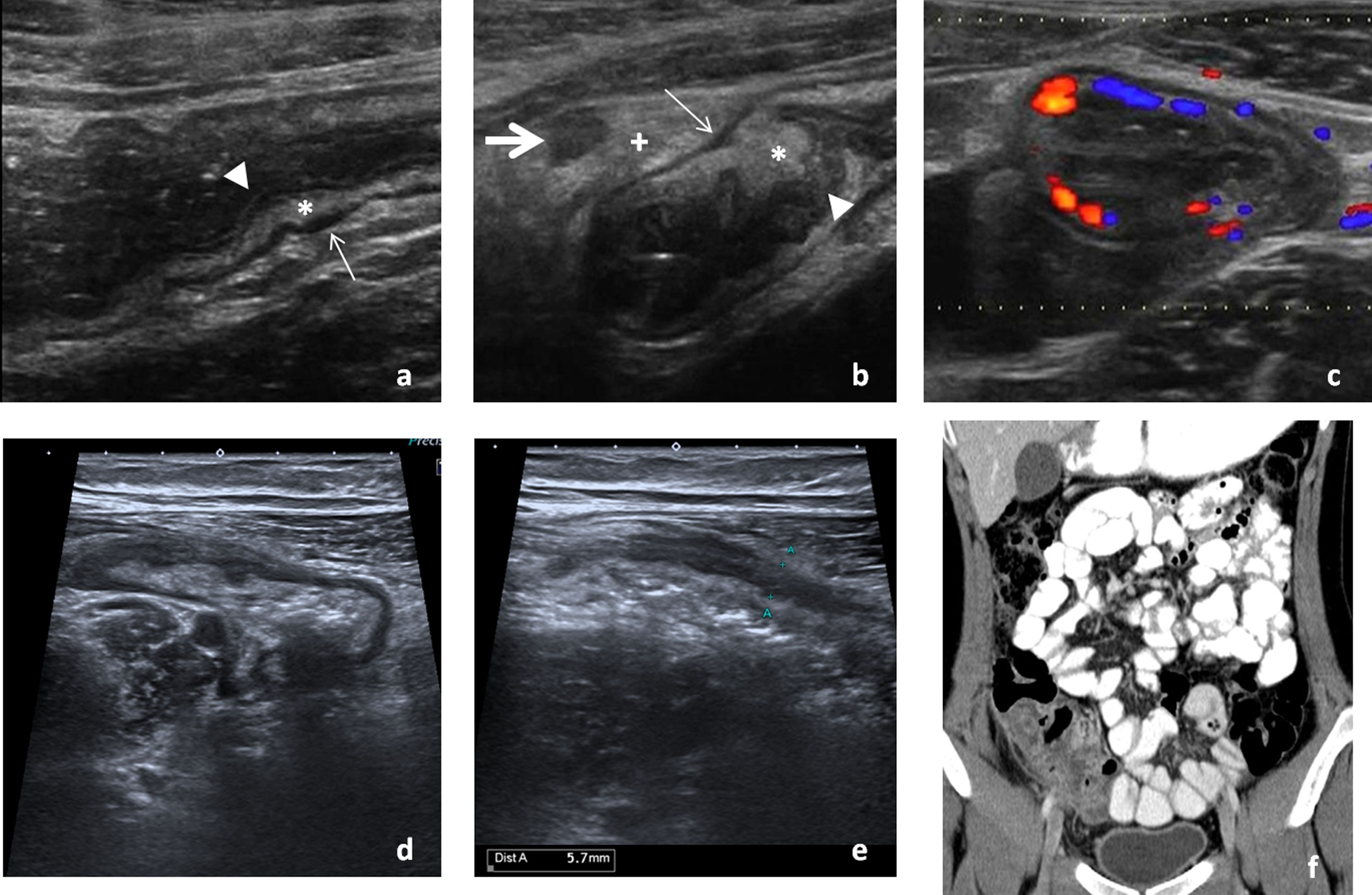
Intestino delgado distalLas infecciones del íleon terminal con frecuencia pueden extenderse al ciego (fig. 2). El principal diagnóstico diferencial es la enfermedad inflamatoria intestinal, en etapas precoces habitualmente indistinguible (tabla 2).
Afectación infecciosa del íleon distal. Primer caso de paciente joven con dolor abdominal y diarrea que consulta en el servicio de urgencias. Se realiza ecografía para filiar el origen del cuadro. Presentamos imágenes en corte longitudinal (A y B) del íleon terminal, objetivando un engrosamiento de la pared que conserva la estratificación de sus capas, afectando a la capa mucosa (cabezas de flecha) y submucosa (*) y respetando la capa muscular (flechas finas), característico de las enteritis infecciosas frente a otras causas de afectación intestinal. El estudio mediante Doppler color muestra un aumento de la vascularización secundaria al cuadro infeccioso (C). Se acompaña de tumefacción e hiperecogenicidad de la grasa mesentérica adyacente (+) y un ganglio ileocólico aumentado de tamaño de naturaleza reactiva (flecha gruesa). El cultivo de heces resultó positivo para Yersinia enterocolitica. Tras tratamiento antibiótico y sintomático, la paciente mejoró progresivamente hasta al alta. Segundo caso de paciente de 18 años, que acude al servicio de urgencias por febrícula y dolor abdominal en fosa iliaca derecha de horas de evolución. En la valoración inicial se realiza ecografía con la sospecha de apendicitis aguda, en la que se aprecia un engrosamiento de la pared de íleon terminal que se extiende al ciego (D) y un apéndice ileocecal de calibre normal (E), que orienta a cuadro infeccioso, descartando la sospecha diagnóstica que motivó la petición. A las 24 horas, se solicita una tomografía computarizada abdominal. Mostramos una imagen de reconstrucción coronal del estudio en la zona de interés (F), que muestra los mismos hallazgos. Dada la persistencia de la clínica, se decide intervenir quirúrgicamente a la paciente, practicando una resección ileocólica con el resultado histológico de enterocolitis supurada con apéndice normal. No pudo determinarse en el estudio microbiológico el agente infeccioso que originó el cuadro.
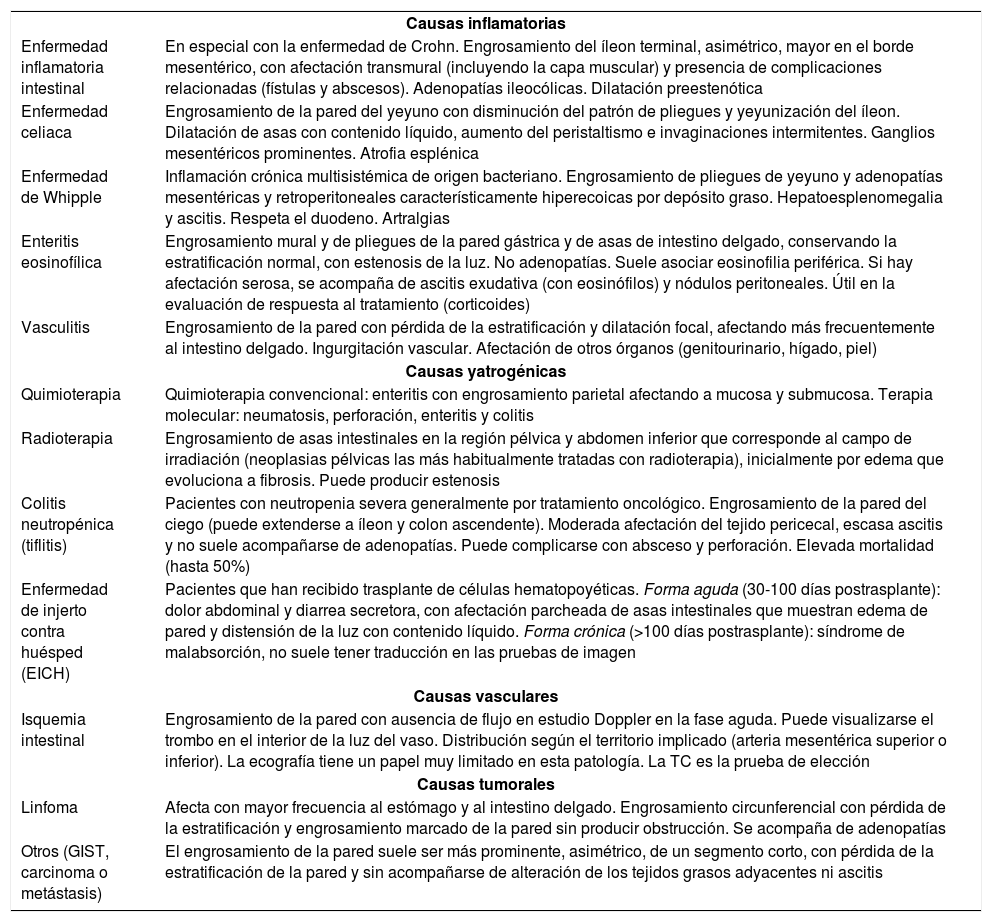
Diagnóstico diferencial de las enterocolitis infecciosas. Otras causas de afectación intestinal difusa
| Causas inflamatorias | |
| Enfermedad inflamatoria intestinal | En especial con la enfermedad de Crohn. Engrosamiento del íleon terminal, asimétrico, mayor en el borde mesentérico, con afectación transmural (incluyendo la capa muscular) y presencia de complicaciones relacionadas (fístulas y abscesos). Adenopatías ileocólicas. Dilatación preestenótica |
| Enfermedad celiaca | Engrosamiento de la pared del yeyuno con disminución del patrón de pliegues y yeyunización del íleon. Dilatación de asas con contenido líquido, aumento del peristaltismo e invaginaciones intermitentes. Ganglios mesentéricos prominentes. Atrofia esplénica |
| Enfermedad de Whipple | Inflamación crónica multisistémica de origen bacteriano. Engrosamiento de pliegues de yeyuno y adenopatías mesentéricas y retroperitoneales característicamente hiperecoicas por depósito graso. Hepatoesplenomegalia y ascitis. Respeta el duodeno. Artralgias |
| Enteritis eosinofílica | Engrosamiento mural y de pliegues de la pared gástrica y de asas de intestino delgado, conservando la estratificación normal, con estenosis de la luz. No adenopatías. Suele asociar eosinofilia periférica. Si hay afectación serosa, se acompaña de ascitis exudativa (con eosinófilos) y nódulos peritoneales. Útil en la evaluación de respuesta al tratamiento (corticoides) |
| Vasculitis | Engrosamiento de la pared con pérdida de la estratificación y dilatación focal, afectando más frecuentemente al intestino delgado. Ingurgitación vascular. Afectación de otros órganos (genitourinario, hígado, piel) |
| Causas yatrogénicas | |
| Quimioterapia | Quimioterapia convencional: enteritis con engrosamiento parietal afectando a mucosa y submucosa. Terapia molecular: neumatosis, perforación, enteritis y colitis |
| Radioterapia | Engrosamiento de asas intestinales en la región pélvica y abdomen inferior que corresponde al campo de irradiación (neoplasias pélvicas las más habitualmente tratadas con radioterapia), inicialmente por edema que evoluciona a fibrosis. Puede producir estenosis |
| Colitis neutropénica (tiflitis) | Pacientes con neutropenia severa generalmente por tratamiento oncológico. Engrosamiento de la pared del ciego (puede extenderse a íleon y colon ascendente). Moderada afectación del tejido pericecal, escasa ascitis y no suele acompañarse de adenopatías. Puede complicarse con absceso y perforación. Elevada mortalidad (hasta 50%) |
| Enfermedad de injerto contra huésped (EICH) | Pacientes que han recibido trasplante de células hematopoyéticas. Forma aguda (30-100 días postrasplante): dolor abdominal y diarrea secretora, con afectación parcheada de asas intestinales que muestran edema de pared y distensión de la luz con contenido líquido. Forma crónica (>100 días postrasplante): síndrome de malabsorción, no suele tener traducción en las pruebas de imagen |
| Causas vasculares | |
| Isquemia intestinal | Engrosamiento de la pared con ausencia de flujo en estudio Doppler en la fase aguda. Puede visualizarse el trombo en el interior de la luz del vaso. Distribución según el territorio implicado (arteria mesentérica superior o inferior). La ecografía tiene un papel muy limitado en esta patología. La TC es la prueba de elección |
| Causas tumorales | |
| Linfoma | Afecta con mayor frecuencia al estómago y al intestino delgado. Engrosamiento circunferencial con pérdida de la estratificación y engrosamiento marcado de la pared sin producir obstrucción. Se acompaña de adenopatías |
| Otros (GIST, carcinoma o metástasis) | El engrosamiento de la pared suele ser más prominente, asimétrico, de un segmento corto, con pérdida de la estratificación de la pared y sin acompañarse de alteración de los tejidos grasos adyacentes ni ascitis |
Junto a Salmonella y Campylobacter produce la mayoría de las gastroenteritis bacterianas autolimitadas. Es frecuente en pacientes jóvenes y simula apendicitis. Un engrosamiento circunferencial del íleon terminal, con adenopatías regionales y apéndice normal, es muy sugerente12. Se puede acompañar de faringitis, artritis y eritema nudoso.
SalmonellaMás frecuente en países desarrollados, siendo más grave en niños e inmunodeprimidos. Se ha descrito un engrosamiento de la mucosa de aspecto plumoso en la ecografía. También afecta al íleon terminal, con posible extensión al colon derecho, de forma continua o parcheada, con adenopatías locorregionales y líquido libre. Excepcionalmente puede complicarse con hemorragia digestiva o perforación. En algunos casos asocia colecistitis alitiásica o esplenomegalia con posible formación de abscesos13.
CampylobacterSuele producir un cuadro autolimitado similar a los previos. En raras ocasiones produce afectación extraintestinal como colecistitis, peritonitis, artritis o miocarditis. Se conoce desde hace tiempo su relación con el síndrome de Guillain Barré14.
AnisakisVer apartado “Estómago”.
ShigellaVer apartado “Colon izquierdo”.
Íleon distal y ciegoTuberculosisLa infección por VIH y el empleo de inmunosupresores han aumentado su incidencia. El abdomen es un lugar frecuente de afectación extrapulmonar. Clínicamente se presenta como un cuadro subagudo inespecífico de dolor abdominal y síndrome constitucional con fiebre, vómitos y pérdida de peso.
Puede afectar a cualquier tramo del tubo digestivo, aunque la localización habitual es la región ileocecal. Produce engrosamiento concéntrico de un segmento corto de pared, a veces multifocal, y ligera estenosis de la luz al inicio, que puede progresar hasta un cuadro obstructivo. Es característico el engrosamiento de la válvula ileocecal y la pared medial del ciego. Aunque infrecuentemente, puede complicarse con perforación o trayectos fistulosos.
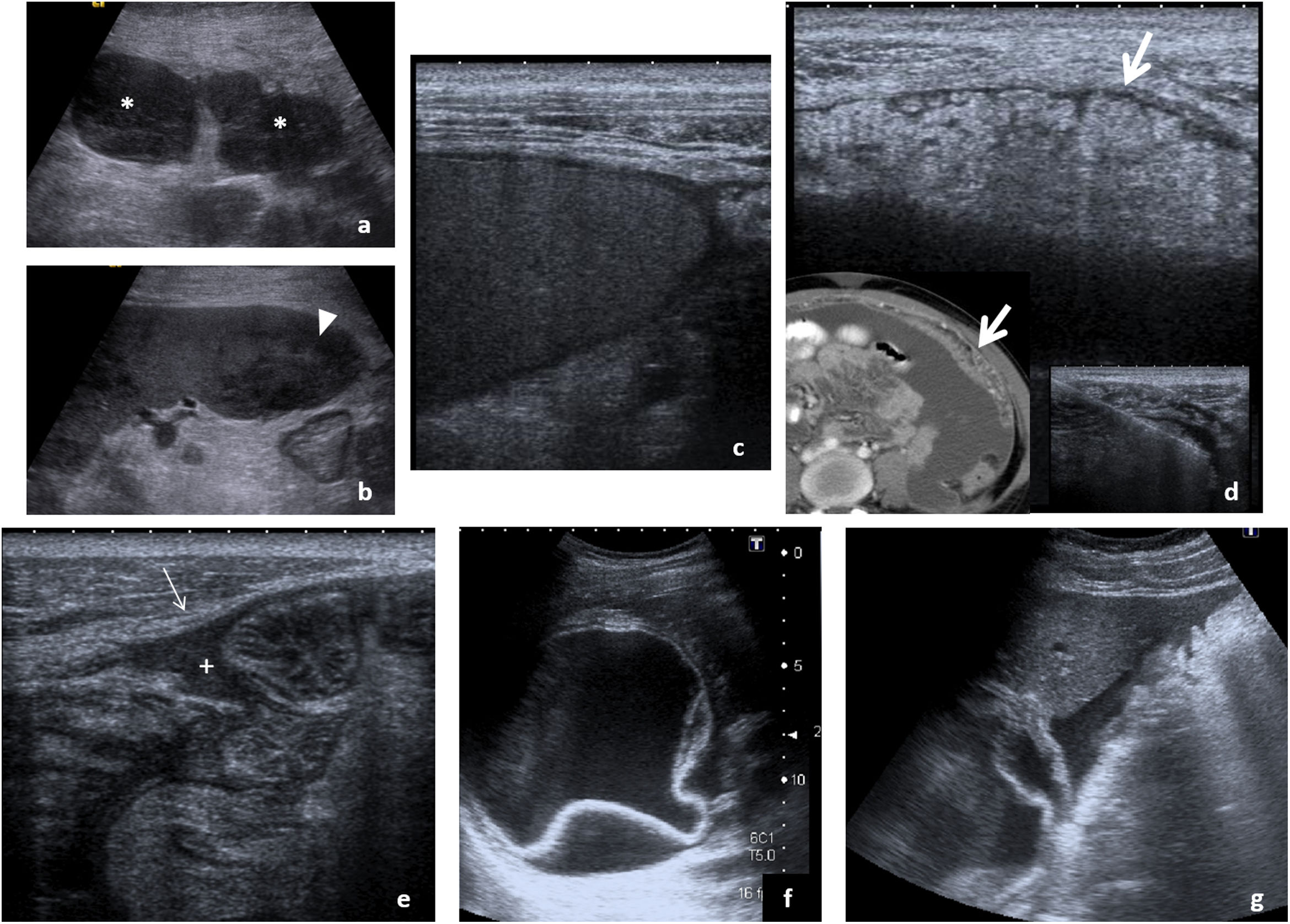
Se acompaña de adenopatías mesentéricas, periportales y paraaórticas superiores, a menudo con centro hipoecoico por necrosis (fig. 3A), y ocasionalmente calcificadas (generalmente no en fase activa). Forman conglomerados menos frecuentemente que otras entidades.
Afectación infecciosa del peritoneo. A-D) Hallazgos característicos de peritonitis tuberculosa en varios pacientes. Adenopatías mesentéricas (A) con centro hipoecoico por presencia de necrosis (*), afectación esplénica (B) con absceso en polo inferior del bazo (cabeza de flecha) y ascitis (C) con punteado ecogénico por material denso. Un dato significativo es el engrosamiento del epiplón mayor (flechas gruesas), que se aprecia con detalle en la ecografía (D), y se correlaciona con la imagen tomográfica mostrada en la esquina inferior izquierda. Plantea el diagnóstico diferencial con infiltración tumoral, por lo que precisa habitualmente de estudio histológico tras la obtención de una muestra que puede ser guiada ecográficamente como se aprecia en la imagen de la esquina inferior derecha. E-G) Peritonitis de otro origen. En el primer caso (E), paciente con cuadro de apendicitis aguda que se acompaña de discreta cantidad de líquido libre entre asas, con punteado ecogénico (+) y engrosamiento lineal del peritoneo parietal (flecha fina) que indica la presencia de peritonitis focal asociada. El segundo caso, peritonitis parasitaria en paciente con quiste hidatídico hepático (F) con membranas plegadas y presencia de líquido perihepático (G) que indica complicación del mismo con rotura y diseminación peritoneal del contenido.
La presencia de microabscesos en hígado y bazo (fig. 3B), la afectación de otros órganos abdominales (suprarrenales, páncreas o aparato genitourinario) y de localizaciones frecuentes fuera del abdomen como pulmón, hueso o sistema nervioso central orientan el diagnóstico6,15–19.
Colon derechoEntamoeba histolyticaEndémica en regiones tropicales y subtropicales y en viajeros o inmigrantes de esos territorios. Suele ser asintomática, pero puede provocar un cuadro invasivo. Afecta principalmente al ciego, respetando el íleon, a diferencia de la tuberculosis o la enfermedad de Crohn. El engrosamiento de la pared puede simular una lesión tumoral (ameboma). También puede verse afectado el recto. Puede coexistir un absceso hepático, generalmente unilocular con fino contenido ecogénico, que orienta el diagnóstico. Son muy infrecuentes otros abscesos en cerebro, corazón y pulmones3,20,21.
Colon izquierdoShigellaGrupo de bacterias gramnegativas muy contagiosas cuyo único reservorio es el ser humano. Provoca un cuadro de disentería en países poco desarrollados, con sangre y moco en las heces, planteando el diagnóstico diferencial con otros microorganismos, como E. coli enterohemorrágica, Salmonella, Yersinia, Campylobacter, amebiasis y Clostridium difficile. Afecta típicamente al colon descendente y sigma, con engrosamiento de la pared y presencia de úlceras mucosas. En ocasiones asienta en íleon distal. Puede asociarse a síndrome hemolítico urémico en niños menores de 5 años y artritis reactiva en adultos22,23.
Recto y sigmaHerpesvirus, gonorrea y clamidia son un grupo de patógenos que causan infección por transmisión sexual y se presentan con síntomas de proctitis (dolor abdominal, diarrea, rectorragia, secreción purulenta y tenesmo). Su principal diagnóstico diferencial es la enfermedad inflamatoria intestinal. Suelen acompañarse de secreción uretral purulenta. La presencia de adenopatía femoral, en ocasiones abscesificada, sugiere linfogranuloma venéreo por Chlamydia, y la de vesículas en la región perianal, herpesvirus24. La ecografía tiene un papel limitado.
PancolitisClostridium difficileSu incidencia y gravedad está aumentando por el empleo de antibióticos de amplio espectro. La presencia de un engrosamiento muy marcado de la pared de todo el colon (puede limitarse a una afectación segmentaria), si bien no es exclusivo y puede no aparecer, orienta el diagnóstico, que se confirma con la detección de toxinas en heces y coprocultivo. Se ha descrito afectación del intestino delgado. Ecográficamente hay un aumento del espesor de la capa submucosa (hiperecogénica), con una muscular (hipoecoica) de espesor normal (fig. 4). Se han descrito imágenes hiperecogénicas en la luz que pueden indicar la presencia de membranas. La afectación pericolónica es desproporcionadamente escasa. Con frecuencia se acompaña de ascitis25. Puede progresar a un cuadro de megacolon tóxico con elevada morbimortalidad.
Afectación infecciosa del colon. A y B) Colitis pseudomembranosa. A) Imágenes de estudio ecográfico en paciente con diarrea sanguinolenta que muestra un colon (c) con marcado engrosamiento de la pared (flechas) y pliegues mucosos internos prominentes e irregulares (cabezas de flecha). Hay ascitis discreta (*). B) Reconstrucción coronal de estudio de tomografía computarizada (TC) en otro paciente con el mismo diagnóstico, donde apreciamos un importante engrosamiento de la pared del colon izquierdo, con predominio de edema en capa submucosa (*) y realce de la mucosa (cabeza de flecha), característicamente en esta patología con un mínimo compromiso del mesenterio adyacente. C y D) Colitis isquémica. Imágenes de ecografía (C) donde se visualiza la pared del colon izquierdo anormalmente engrosada con pérdida de la estratificación normal. En el estudio Doppler no es posible detectar la presencia de flujo en su interior a pesar de emplear el Power color o Doppler potencia, mucho más sensible a la detección de flujo lento. Vemos en la imagen axial del estudio de TC (D), realizado sin contraste por deterioro de la función renal del paciente, el engrosamiento de la pared del colon sigmoide (+), que se acompaña de importante trabeculación de la grasa mesentérica (flechas finas), hallazgos que suelen aparecen en la fase de reperfusión tras una isquemia mesentérica oclusiva o no oclusiva. Figura 4a cortesía del Dr. T. Ripollés (Valencia).
En pacientes inmunodeprimidos suele provocar una colitis difusa, aunque se describen casos de afectación segmentaria del colon o de la región ileocólica, con engrosamiento de la pared y alteración de la grasa pericólica en todos los casos, y la posibilidad de ascitis. No suele acompañarse de adenopatías y en ocasiones asocia colangiopatía. Es necesario un alto grado de sospecha para realizar el diagnóstico (cuerpos de inclusión en biopsia) e iniciar precozmente el tratamiento con antivirales, evitando complicaciones como isquemia o perforación3,26.
Escherichia coliLas cepas enterotoxigénicas, responsables de la diarrea del viajero, ocasionan cuadros más leves. Las enterohemorrágicas, resultado de la ingesta de carne en mal estado y probablemente infradiagnosticadas, pueden producir cuadros graves de disentería en ancianos y niños, como otros patógenos. Provoca una pancolitis, aunque con mayor afectación del colon derecho. Como Shigella, puede desencadenar un síndrome hemolítico urémico22,27.
El diagnóstico diferencial de las infecciones intestinales incluye otros cuadros de abdomen agudo de origen intestinal (apendicitis, diverticulitis, adenitis, etc.), ya tratados en otro artículo de esta serie, y especialmente, otras causas de afectación intestinal difusa de naturaleza inflamatoria, yatrogénica, vascular o tumoral (tabla 2)28–31.
PeritoneoLa peritonitis tuberculosa es la manifestación más frecuente de la tuberculosis abdominal. Clásicamente se describen tres patrones: peritonitis húmeda, la más frecuente (90%), con ascitis de distribución libre o loculada, punteado ecogénico por alta densidad del líquido y engrosamiento peritoneal (fig. 3C); peritonitis seca, con escasa cantidad de líquido y adherencias completas o incompletas; y peritonitis fibrótica, con nódulos y masas mesentéricos y engrosamiento nodular del omento. La ecografía permite explorarlos con detalle y sirve de guía para la biopsia diagnóstica (fig. 3D). Descrita como la gran imitadora, su diagnóstico diferencial incluye la carcinomatosis peritoneal, el linfoma, la enfermedad de Crohn, el mesotelioma, el pseudomixoma peritoneal o la peritonitis piógena.
La peritonitis piógena (fig. 3E) es el resultado de la complicación de una infección abdominal generalmente de origen intestinal y puede derivar en abscesos, que a menudo requieren drenaje percutáneo guiado por ecografía. La peritonitis bacteriana espontánea es una complicación de cirrosis descompensada, a sospechar en caso de ascitis con fiebre o deterioro clínico. Su diagnóstico precisa paracentesis diagnóstica ecoguiada. Cabe mencionar las peritonitis parasitarias, que en nuestro medio suelen deberse a la rotura de un quiste hidatídico hepático (fig. 3F y G)32,33.
Patología neoplásica intestinal y peritonealLa ecografía tiene escaso protagonismo en guías clínicas en la detección y estadificación de neoplasias gastrointestinales y peritoneales. Solo la ecografía transrectal (ETR) se equipara, en algunas, a la resonancia magnética (RM) en la estadificación locorregional del cáncer de recto34. Sin embargo, es la técnica más habitual ante sintomatología inespecífica, suponiendo la oportunidad de detectar e iniciar el estudio de estos tumores, que además pueden ser encontrados incidentalmente35,36. Pese a sus conocidas limitaciones, es inocua, barata, dinámica, interactiva, ofrece gran resolución espacial en áreas accesibles y numerosos recursos técnicos añadidos (compresión gradual, sondas de alta resolución, Doppler, contraste intravenoso u oral, elastografía, acceso transrectal o transvaginal, etc.)2,28,29,37. Toda exploración ecográfica abdominopélvica debe reservar unos minutos al estudio sistemático del tracto gastrointestinal y las estructuras peritoneales. Las posibilidades técnicas de este estudio se detallan en otro artículo de esta serie o se discutirán adelante, sin abordar las de la ecoendoscopia, ajena al radiólogo, limitada generalmente a áreas proximales o distales del tracto gastrointestinal38–40.
Por lo general, la neoplasia gastrointestinal se presenta como masa sólida o engrosamiento mural hipoecogénico marcado (>12 mm), corto (<10cm), asimétrico y con disrupción de la estructura en capas29. Algunos linfomas o tumores incipientes pueden preservar esta estructura, que por otro lado puede verse también interrumpida en afectación isquémica o inflamatoria transmural. El patrón ecográfico, la topografía y el contexto clínico permiten estrechar el diagnóstico diferencial y ocasionalmente aportan información exclusiva. La tabla 3 resume las características más relevantes.
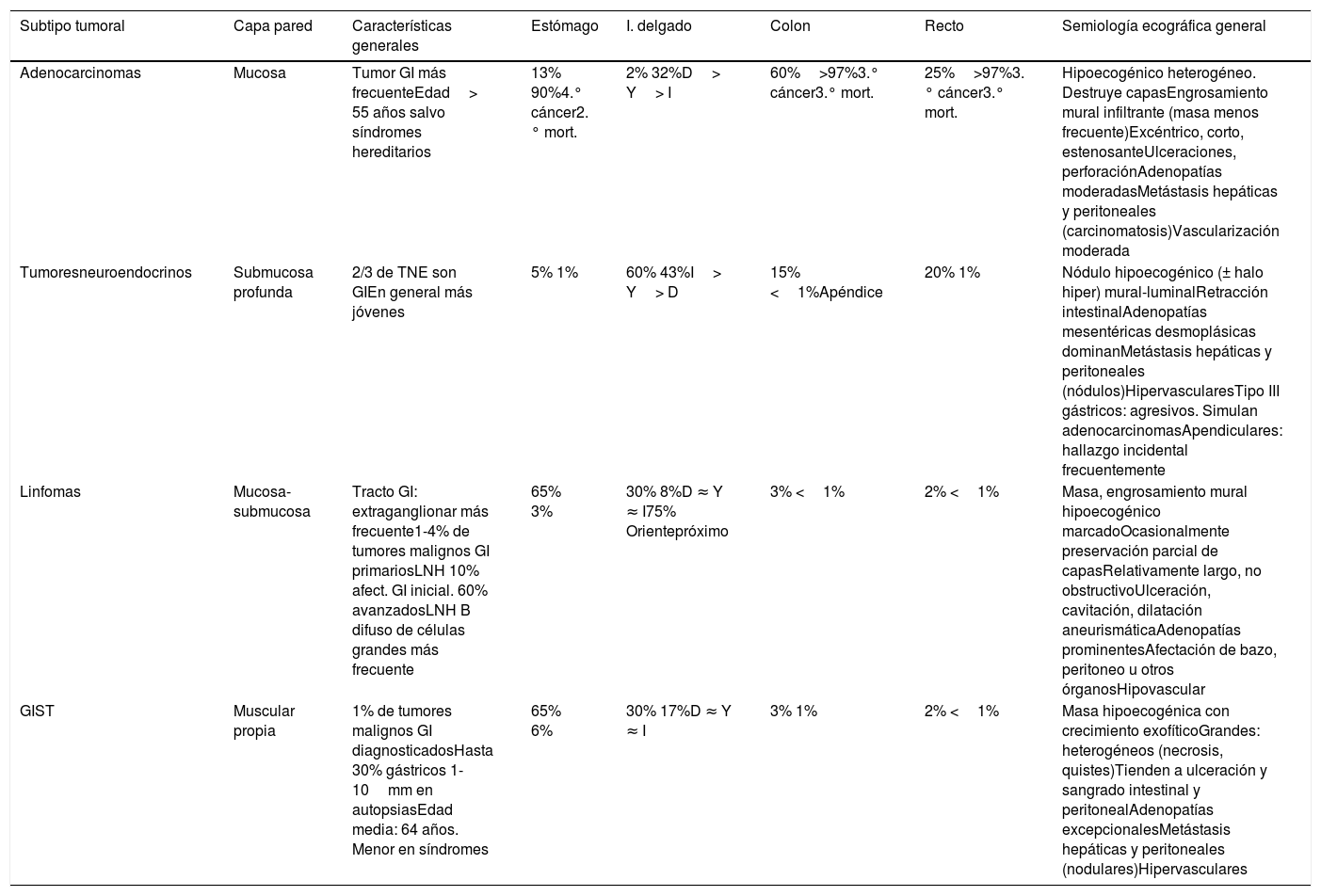
Resumen de las características de los cuatro tipos principales de neoplasias gastrointestinales primarias malignas
| Subtipo tumoral | Capa pared | Características generales | Estómago | I. delgado | Colon | Recto | Semiología ecográfica general |
|---|---|---|---|---|---|---|---|
| Adenocarcinomas | Mucosa | Tumor GI más frecuenteEdad> 55 años salvo síndromes hereditarios | 13% 90%4.° cáncer2.° mort. | 2% 32%D> Y> I | 60%>97%3.° cáncer3.° mort. | 25%>97%3.° cáncer3.° mort. | Hipoecogénico heterogéneo. Destruye capasEngrosamiento mural infiltrante (masa menos frecuente)Excéntrico, corto, estenosanteUlceraciones, perforaciónAdenopatías moderadasMetástasis hepáticas y peritoneales (carcinomatosis)Vascularización moderada |
| Tumoresneuroendocrinos | Submucosa profunda | 2/3 de TNE son GIEn general más jóvenes | 5% 1% | 60% 43%I> Y> D | 15% <1%Apéndice | 20% 1% | Nódulo hipoecogénico (± halo hiper) mural-luminalRetracción intestinalAdenopatías mesentéricas desmoplásicas dominanMetástasis hepáticas y peritoneales (nódulos)HipervascularesTipo III gástricos: agresivos. Simulan adenocarcinomasApendiculares: hallazgo incidental frecuentemente |
| Linfomas | Mucosa-submucosa | Tracto GI: extraganglionar más frecuente1-4% de tumores malignos GI primariosLNH 10% afect. GI inicial. 60% avanzadosLNH B difuso de células grandes más frecuente | 65% 3% | 30% 8%D ≈ Y ≈ I75% Orientepróximo | 3% <1% | 2% <1% | Masa, engrosamiento mural hipoecogénico marcadoOcasionalmente preservación parcial de capasRelativamente largo, no obstructivoUlceración, cavitación, dilatación aneurismáticaAdenopatías prominentesAfectación de bazo, peritoneo u otros órganosHipovascular |
| GIST | Muscular propia | 1% de tumores malignos GI diagnosticadosHasta 30% gástricos 1-10mm en autopsiasEdad media: 64 años. Menor en síndromes | 65% 6% | 30% 17%D ≈ Y ≈ I | 3% 1% | 2% <1% | Masa hipoecogénica con crecimiento exofíticoGrandes: heterogéneos (necrosis, quistes)Tienden a ulceración y sangrado intestinal y peritonealAdenopatías excepcionalesMetástasis hepáticas y peritoneales (nodulares)Hipervasculares |
D: duodeno; I: íleon; GI: gastrointestinal; GIST: tumor del estroma gastrointestinal; LNH: linfoma no Hodgkin; TNE: tumor neuroendocrino; Y: yeyuno.
En las casillas de afectación topográfica, el porcentaje a la izquierda hace referencia a la proporción de tumores de ese subtipo de tumor maligno primario (de entre todos los gastrointestinales) que asienta en esa localización en concreto. El porcentaje a la derecha indica qué proporción de todos los tumores malignos primarios en esa localización representan los de ese subtipo en concreto. Por ejemplo, el 60% de los TNE gastrointestinales asientan en el intestino delgado, donde representan el 43% de todos los tumores malignos primarios. Son cifras aproximadas, promediadas y redondeadas por los autores a partir de diversas fuentes.
Abordaremos las neoplasias gastrointestinales con un patrón nosológico, reservando un capítulo para las del peritoneo y otro para discutir el papel de la ecografía como guía de biopsia percutánea.
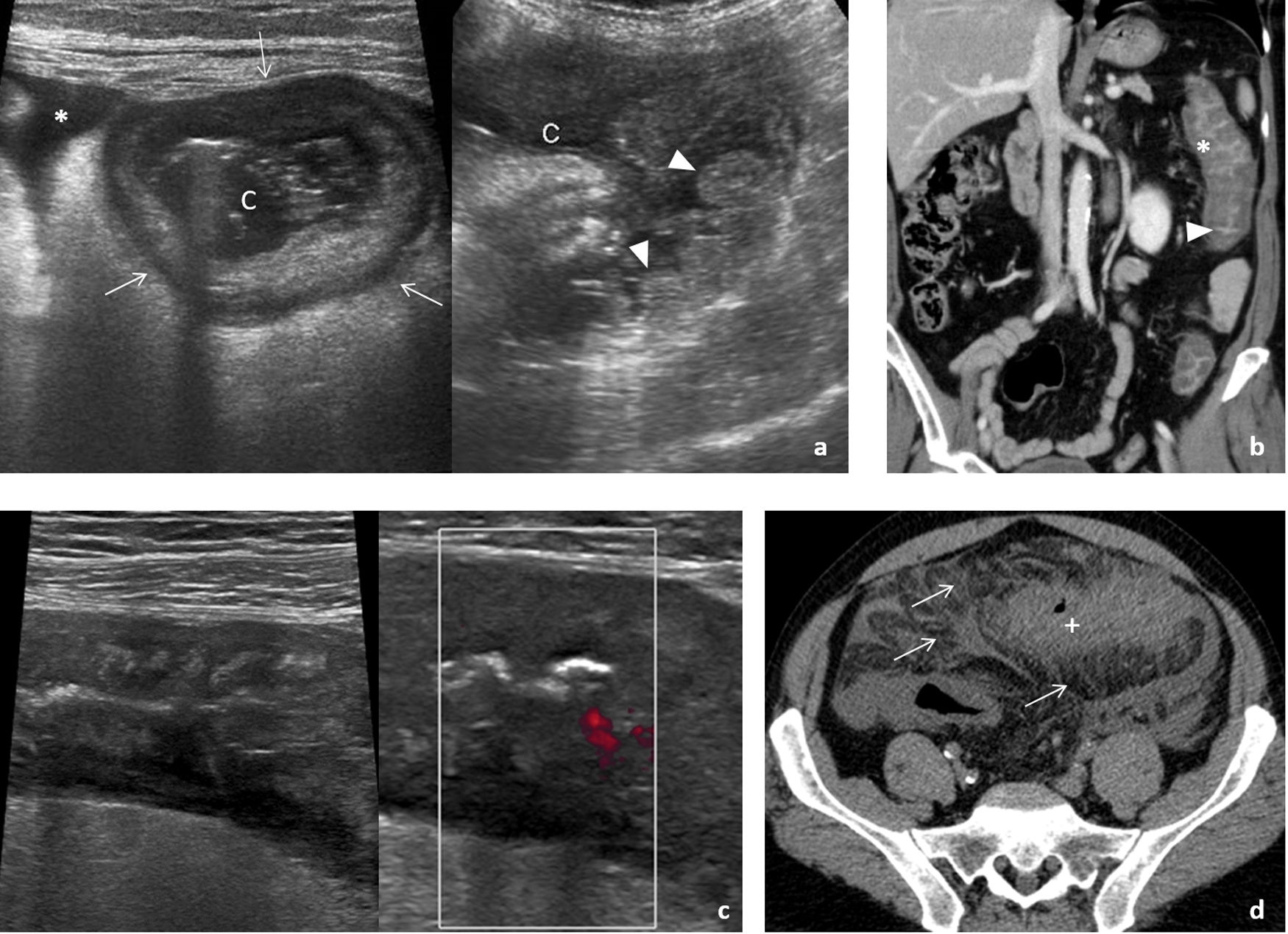
Lesiones polipoideas (fig. 5A-D)Hay evidencia de una secuencia pólipo-cáncer gastrointestinal, con modelos stepwise (sucesión de mutaciones o alteraciones epigenéticas), big bang (episodios masivos en fases iniciales) o de punctuated equilibrium (periodos de gran transformación alternando con fases de estatismo o cambios graduales)41. Se acepta una actitud conservadora para pólipos diminutos (<5 mm) y pequeños (6-9 mm), con riesgo de displasia o cáncer despreciable. Se detecta cáncer en el 1% de pólipos adenomatosos de 1-2cm y en el 50% de mayores de 3 cm. Los pólipos serrados planos, típicos del colon derecho, tienen un comportamiento menos agresivo del que se les atribuía clásicamente.
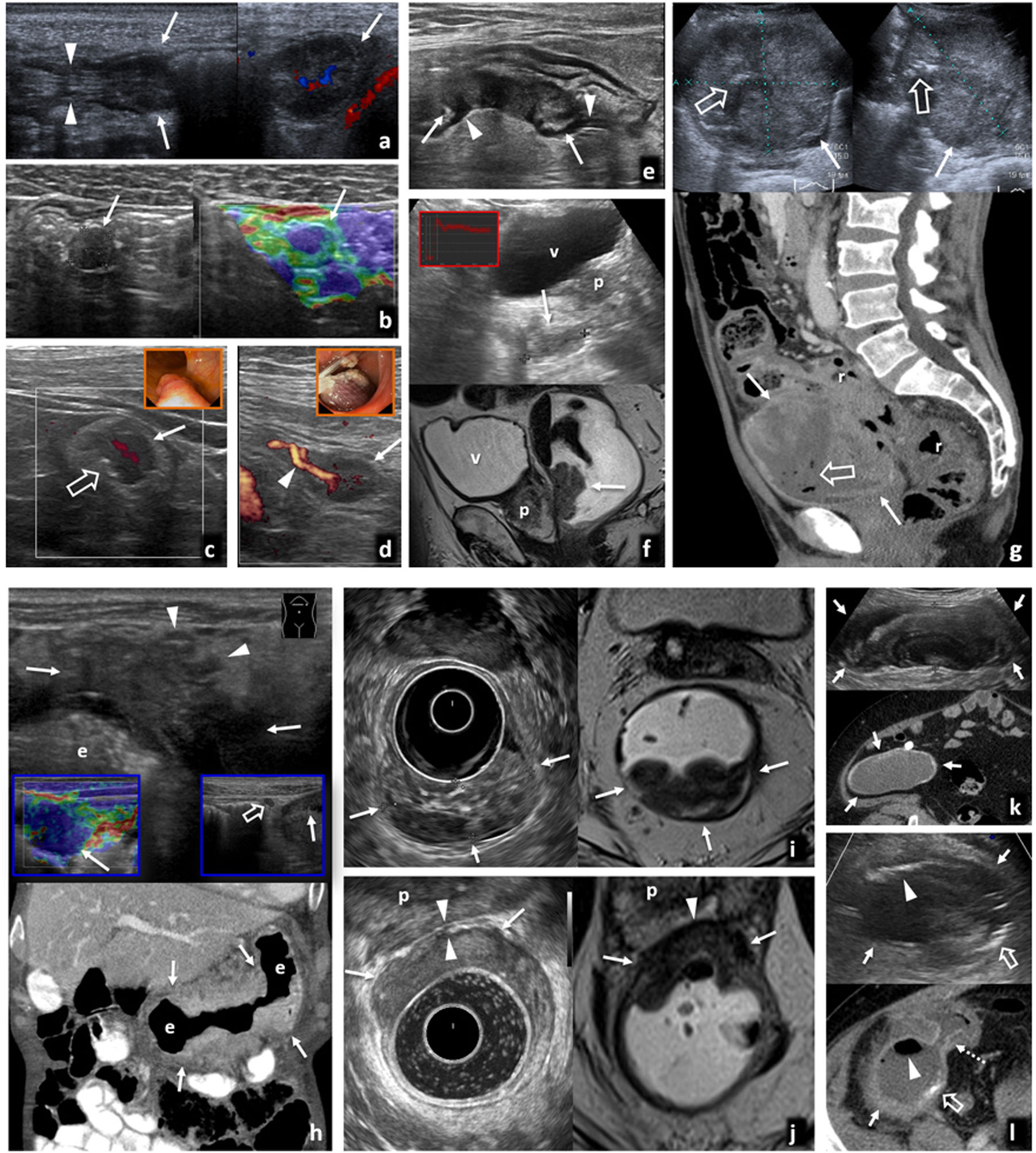
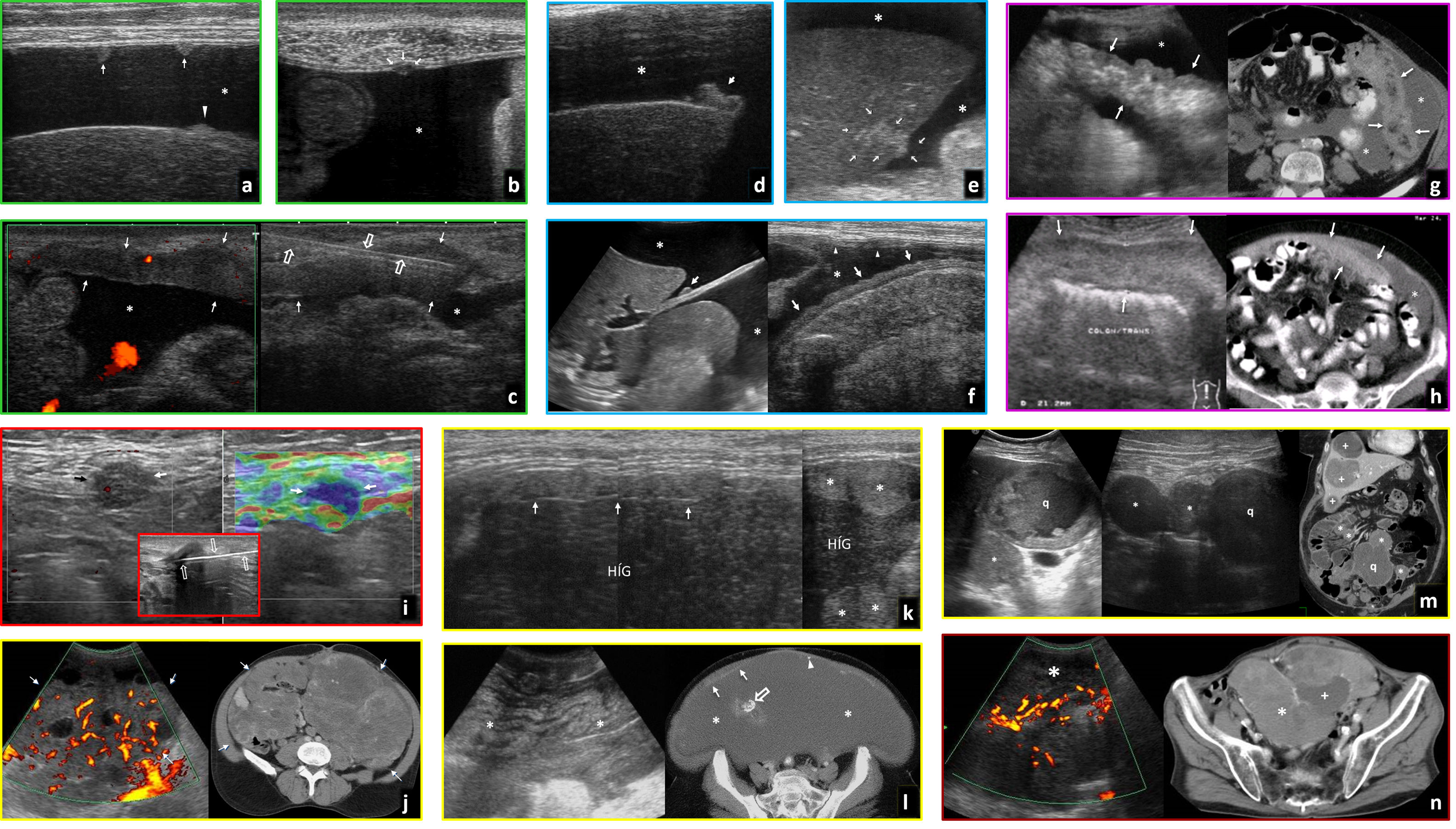
Pólipos y carcinomas. A) Pólipo adenomatoso hipoecogénico de 13 mm (flechas) en la luz del colon transverso, con un pedículo que sigue la estructura en capas de la pared (cabezas de flecha) y flujo demostrado en Doppler (derecha). Hallazgo incidental en varón de 77 años. B) Pólipo adenomatoso hipoecogénico (flechas) en el colon sigmoide, hallazgo incidental en varón de 44 años. La estabilidad de la imagen en el tiempo y la rigidez tisular, con tonos azules en la imagen de elastografía cualitativa de presión o strain (derecha), confirman el hallazgo. C) Carcinoma Hagitt 1 sobre pólipo adenomatoso hipoecogénico de 15 mm (flecha) en la luz del colon izquierdo distal, con un vaso en su interior en Doppler y una pequeña ulceración superficial (flecha hueca). Hallazgo incidental en ecografía por ateromatosis en varón de 67 años. En el recuadro, imagen de colonoscopia previa a resección. D) Carcinoma Hagitt 1 sobre pólipo adenomatoso hipoecogénico de 20 mm (flecha) en la luz del colon sigmoide, con un vaso en su pedículo en Doppler (cabeza de flecha). Hallazgo incidental en estudio por molestias abdominales inespecíficas en mujer de 78 años. En el recuadro, imagen durante la resección endoscópica. E) Adenocarcinoma infiltrante de colon sigmoide T2 N0 M0 en ecografía por anemia en varón pluripatológico de 85 años. Engrosamiento hipoecogénico infiltrante con retracción de la pared posterior del colon (flechas), sin rebasar la capa muscular propia hipoecogénica (cabezas de flecha). La ecografía es más precisa que la tomografía computarizada (TC) (no mostrada) en la estadificación locorregional en este caso, permitiendo un abordaje quirúrgico laparoscópico rápido y limitado en un paciente clínicamente complejo. F) Carcinoma polipoideo en recto inferior, hallazgo ecográfico empleando la vejiga (v) como ventana acústica. Lesión nodular hipoecogénica (flechas) de 33 mm. En el recuadro, curva intensidad/tiempo de ecografía con contraste para confirmar el hallazgo (vídeo 1). p: próstata. Imagen inferior: correlación en resonancia magnética (RM) sagital potenciada en T2 con gel endorrectal para estadificación locorregional. G) Carcinoma de transición colorrectal como masa exofítica ulcerada y necrótica que simula GIST. imagen superior: ecografía, sección transversal (izquierda) y longitudinal (derecha) sobre hipogastrio. Masa hipoecogénica heterogénea (flechas) por necrosis, con focos de gas (flechas huecas) por ulceración. Imagen inferior: TC sagital. La masa contacta con la cara anterior del recto-sigma (r). Se sospechó GIST, pero correspondió a un adenocarcinoma con un patrón infrecuente de presentación. H) Adenocarcinoma gástrico T4a N2 M0. Imagen superior: ecografía por síndrome constitucional en varón de 83 años. Engrosamiento hipoecogénico marcado e irregular de la pared del estómago (e: luz gástrica), con ulceraciones (no mostrado) y clara extensión nodular a la grasa del ligamento gastrocólico (cabezas de flecha). La elastografía (recuadro inferior izquierdo) muestra marcada rigidez tisular. Se ven también adenopatías regionales (flecha hueca en recuadro inferior derecho). Imagen inferior: TC coronal en fase portal. La gran delgadez del paciente hace que la estadificación sea menos precisa que con ecografía. I) Adenocarcinoma rectal T1 sobre pólipo velloso (flechas) en varón de 67 años. La ecografía endorrectal (izquierda) muestra una lesión polipoidea de ecogenicidad intermedia, definiendo con más precisión que la RM (derecha: T2 transversal con gel endorrectal) la indemnidad de la capa muscular propia (hipoecogénica), permitiendo la resección transanal. J) Adenocarcinoma de recto inferior T3a superficial en varón de 72 años. La ecografía endorrectal (izquierda) muestra con precisión un engrosamiento hipoecogénico excéntrico en la cara anterior del recto inferior, que transgrede la capa muscular propia hipoecogénica con nodulaciones superficiales (flechas), confirmando extensión T3 superficial. Se demuestra la preservación de un plano graso (cabezas de flecha) con la próstata (p). La RM transversal T2 (derecha) plantea dudas en este caso desde T2 hasta T4b por infiltración prostática. K) Mucocele apendicular. Imagen superior: hallazgo ecográfico incidental en mujer de 77 años con colecistitis aguda litiásica. Masa ovoidea con estructura interna en capas con ecogenicidades alternantes (patrón “en capas de cebolla” característico) en fosa iliaca derecha (flechas). Imagen inferior: la TC axial muestra finas calcificaciones parietales, pero no es capaz de demostrar la estructura mucinosa de la lesión quística con la precisión de la ecografía. L) Mucocele apendicular sobreinfectado y comunicado con el ciego. Imagen superior: ecografía en varón de 62 años con dolor abdominal y fiebre. Masa quística heterogénea en fosa iliaca derecha (flecha), con focos ecogénicos que representan gas (cabeza de flecha) y calcificaciones parietales (flecha hueca). Imagen inferior: la TC demuestra además la comunicación del mucocele con la luz del ciego (flecha discontinua).
La ecografía permite encontrar pólipos colónicos grandes (>1 cm), evitando o facilitando la detección precoz de cánceres, con especificidad del 94,4%, sensibilidad del 28,6% sin preparación42 y del 91% con hidrocolonosonografía43 en adultos. En niños con síntomas alcanza una sensibilidad del 47% y una especificidad del 100% sin preparación44 y del 95% y 100%, respectivamente, con enema de glicerina45. Son más accesibles en colon izquierdo y sigmoide y menos en recto y ángulo esplénico. También son detectables fuera del colon46,47. Aparecen como lesiones nodulares hipoecogénicas endoluminales persistentes, ocasionalmente con un pedículo que muestra continuidad con las capas de la pared. La detección de pequeños focos quísticos, de vascularización con Doppler o contraste y la elastografía, junto a un estudio cuidadoso, permite diferenciarlos de heces, haustras o Taeniae coli. Se correlacionan con malignidad el tamaño, la infiltración en profundidad en la pared y la ulceración48. Se ha descrito la utilidad de la ecografía laparoscópica con enema de suero en su detección intraoperatoria, con algunas ventajas sobre el tatuaje con tinta china49,50.
Carcinoma (fig. 5E-l, vídeo 1)Cuando no es polipoideo se comporta habitualmente como un engrosamiento parietal hipoecogénico excéntrico o concéntrico asimétrico de un tramo gastrointestinal corto, con límites abruptos y pérdida de la estratificación29,35,36. Raramente aparece como una masa exofítica, simulando un tumor del estroma gastrointestinal (GIST). Es habitual que haya ulceraciones (focos de gas intratumorales), rigidez, estenosis (luz fija y peristaltismo proximal ineficaz) y una afectación ganglionar regional moderada. La experiencia y una exploración cuidadosa (que debe intensificarse si hay alta sospecha o metástasis hepáticas) facilitan la detección en regiones difíciles.
Algunos artículos muestran valores diagnósticos por encima del 80% para carcinomas gástricos y colónicos tomando como referencia la endoscopia51,52, mejores si se excluye el recto. Un estudio mostró en cáncer de colon coincidencia moderada (64%) con el estadio T histológico, que se elevaba al 89% (buena) estableciendo grupos con interés de planificación quirúrgica y pronóstico52. La hidrocolonosonografía alcanza mejores resultados que la TC53, pero ha ido perdiendo interés por mala tolerancia. Autores chinos consiguen buenos resultados en la detección y caracterización de carcinoma y otras lesiones gástricas46,47 empleando una técnica de doble contraste (intravenoso y oral derivado de arroz y soja, de consistencia y ecogenicidad intermedias, con buena transmisión, no disponible en nuestro entorno).
La ETR puede superar a la RM en la definición T1-T2 (seleccionando candidatos a resección endoscópica o transanal), T2-T3 superficial y T3 superficial-profunda (seleccionando candidatos a neoadyuvancia)34. Exige experiencia y es menos útil en T4 y N.
El mucocele apendicular es la acumulación de moco, con ecogenicidades diversas, a veces alternantes (“en capas de cebolla”), en la luz de un apéndice distendido (>15 mm), ocasionalmente con gas (por sobreinfección y/o comunicación con la luz cecal) o calcificación parietal. Una pared irregular o nódulos sólidos deben hacer sospechar un cistoadenocarcinoma subyacente. Su perforación puede llevar a un pseudomixoma peritoneal35,54.
Tumores neuroendocrinos (TNE) (fig. 6, vídeo 2)Los gastrointestinales asientan generalmente en la capa submucosa. La OMS los considera potencialmente malignos, estableciendo tres grados de agresividad según la proliferación celular. Dentro del grupo G3, los tumores con Ki-67 >50 son carcinomas. Pueden aparecer en síndromes genéticos (MEN-1, von-Hippel-Lindau, esclerosis tuberosa y neurofibromatosis-1). Muchos segregan hormonas o aminas que condicionan el cuadro clínico y facilitan la detección analítica (serotonina o derivados, cromogranina-A, gastrina, sinaptofisina, enolasa específica neuronal, etc.) o con procedimientos de medicina nuclear (destacando la PET-TC con 68Ga-DOTATATE por la expresión del receptor SSTR2 en tumores diferenciados, quedando la PET-TC con 18FDG para valorar la actividad metabólica en desdiferenciados)55–57.
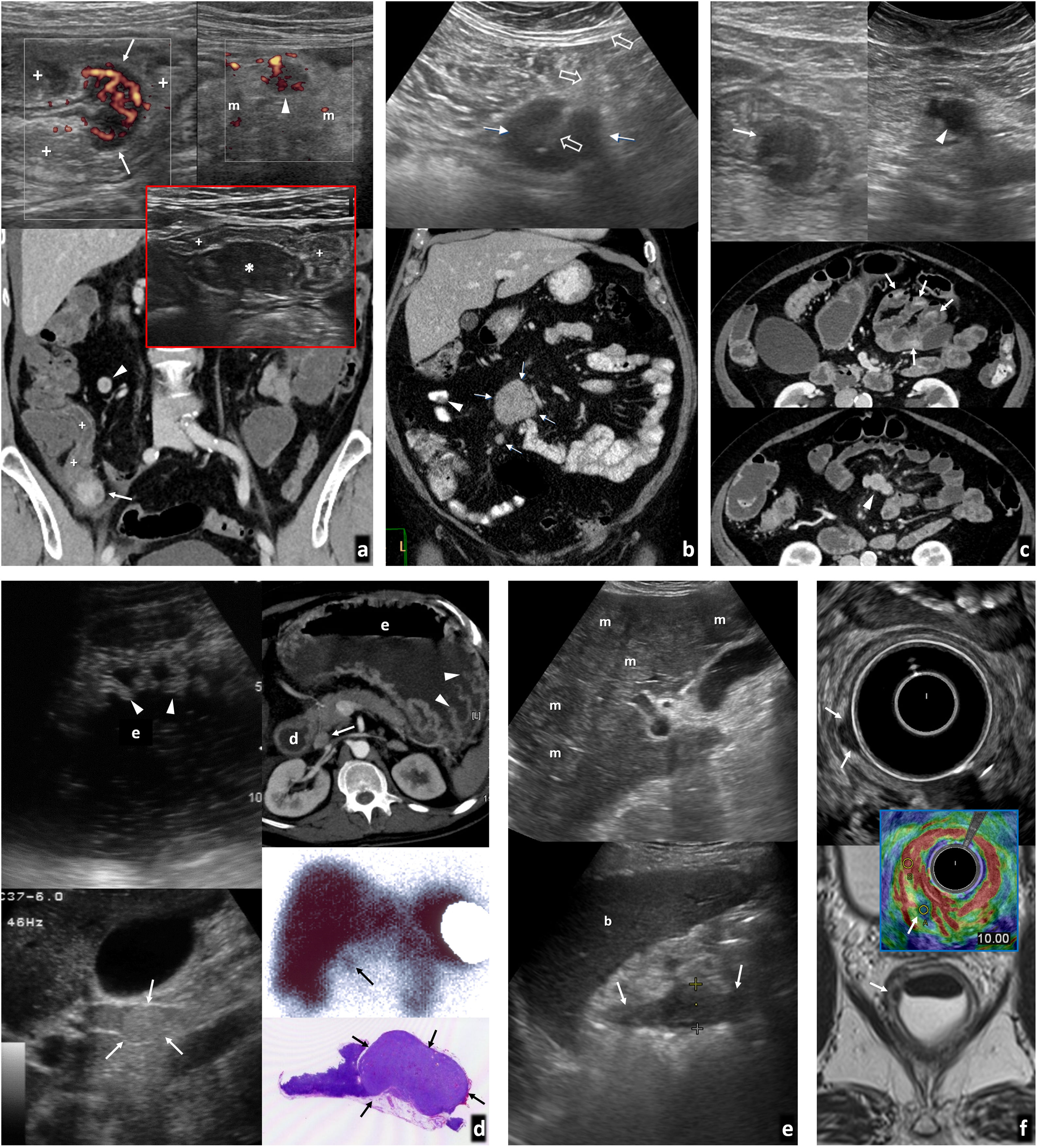
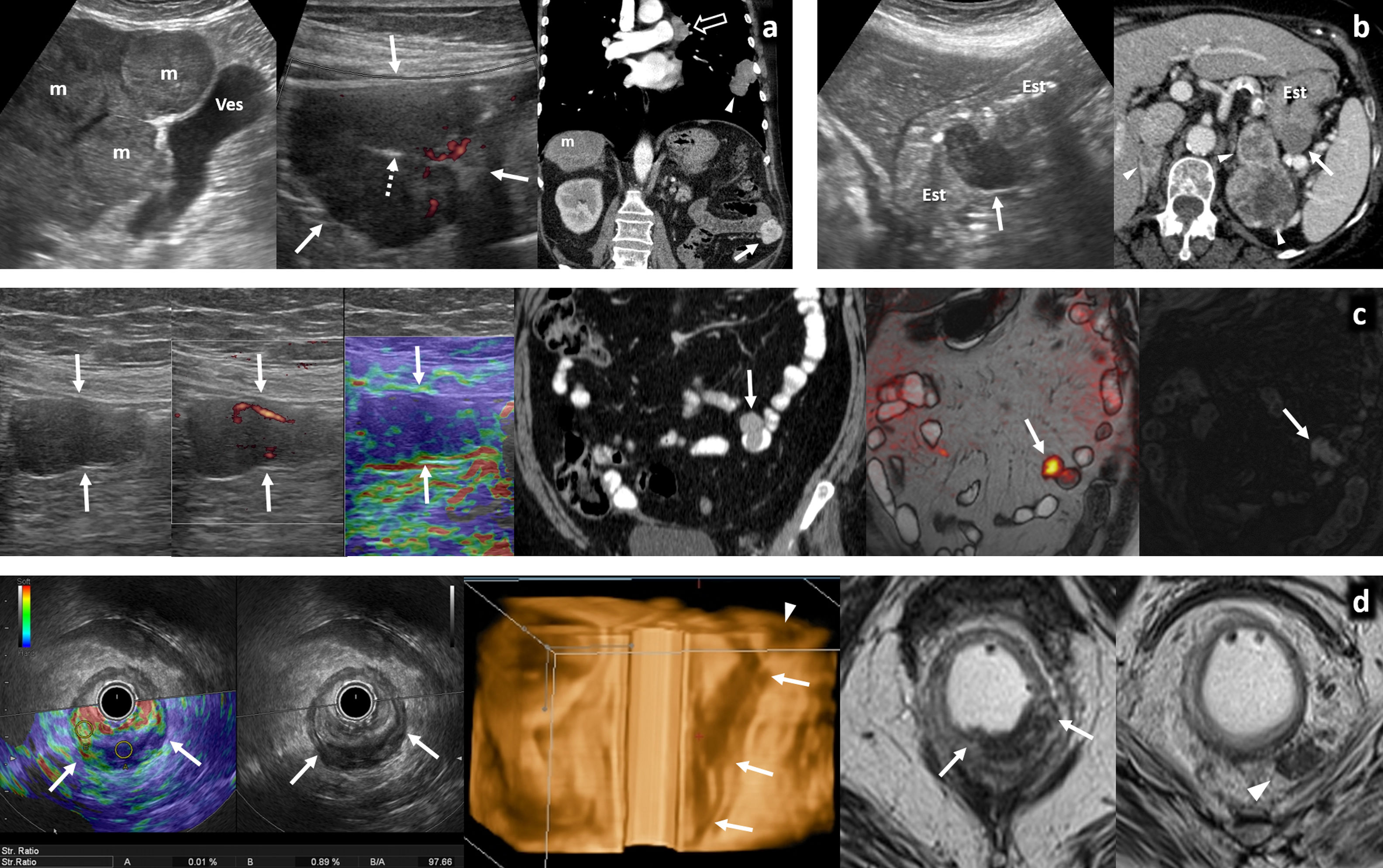
Tumores neuroendocrinos. A) Tumor carcinoide de íleon terminal. Mujer de 62 años con vómitos y dolor abdominal. Antecedente de macroadenoma hipofisario intervenido. Imagen superior: ecografía. Imagen inferior: tomografía computarizada (TC) coronal. Lesión nodular hipoecogénica con abundante vascularización en Doppler y TC (flechas), en el ángulo interno de tramo plegado de íleon distal (+), con peristaltismo ineficaz a tiempo real (vídeo 2). Además, adenopatías hipoecogénicas y vascularizadas (cabezas de flecha) en meso regional tumefacto y ecogénico (m). Se diagnostica MEN-1. En el recuadro: implante endometriósico (*) en íleon terminal (+) en otra paciente, como nódulo hipoecogénico que infiltra la serosa, retrayendo el asa y respetando las capas profundas, que muestra hallazgos similares y con el que hay que establecer diagnóstico diferencial (no vascularizado y sin afectación adenopática en este caso). B) Carcinoide ileal solo manifestado como masa mesentérica. Imagen superior: biopsia percutánea (flechas huecas) guiada ecográficamente de nódulo mesentérico hipoecogénico (flecha), que demostró metástasis ganglionar de tumor neuroendocrino. Imagen inferior: TC coronal con contraste oral e intravenoso. Nódulos adenopáticos mesentéricos (flechas). En la cirugía se identificó un carcinoide milimétrico intestinal primario y retrospectivamente podría corresponder al pequeño defecto de repleción indicado por la cabeza de flecha. C) Carcinoides yeyunales múltiples y metástasis ganglionares mesentéricas. Mujer de 71 años con molestias abdominales inespecíficas. Imágenes superiores: ecografías. Centrales e inferiores: imágenes axiales de entero-TC en dos planos diferentes. Se detectan hasta 5 tumores hipoecogénicos e hipervasculares (uno no mostrado) en tramos plegados de yeyuno (flechas), con un pequeño conglomerado adenopático también hipervascular e hipoecogénico en el meso tributario (cabezas de flecha). D) Síndrome de Zollinger-Ellison por tumor neuroendocrino de tipo II (gastrinoma) de tracto digestivo superior. Varón de 44 años con vómitos, diarrea y shock. Imagen izquierda: ecografía. Imagen derecha superior: TC axial. Abundante líquido en estómago (e), duodeno (d) y yeyuno proximal (no mostrado), con marcado engrosamiento de pliegues gástricos (cabezas de flecha). Medial al duodeno y posterior al páncreas se ve un nódulo hipervascular y levemente ecogénico (flechas) en el seno de una estructura ganglionar. Esta región está dentro del llamado “triángulo del gastrinoma”. Derecha centro: gammagrafía con octeótrida. Se confirma captación por parte del nódulo (flecha). También hay hipergastrininemia. Derecha inferior: pieza quirúrgica del gastrinoma (flechas) en el seno de un ganglio. E) Carcinoma neuroendocrino gástrico de tipo III. Varón de 59 años con síndrome constitucional. La ecografía muestra abundantes metástasis hepáticas (m) y, empleando el bazo (b) como ventana acústica, un tumor infiltrante en la curvatura mayor del estómago. Se sospechó un adenocarcinoma, pero la biopsia endoscópica demostró un carcinoma neuroendocrino. F) Tumor neuroendocrino rectal. Hallazgo en la colonoscopia por test de sangre oculta en heces positivo en varón de 62 años. Imagen superior: ecografía transrectal. Imagen inferior: RM T2 axial. Tumor de 7× 5 mm (flechas) con comportamiento hipoecogénico e hipointenso en T2, situado en la parte profunda de la capa submucosa del recto inferior, con moderada rigidez tisular en elastografía (recuadro central), con strain ratio de 10 con respecto a la pared rectal normal. Se realizó una resección endoscópica transanal.
Los más frecuentes son los carcinoides de íleon distal, donde suponen la neoplasia más habitual. Es un tumor submucoso pequeño (15-35 mm), hipoecogénico o con halo ecogénico35,37,56. La secreción de serotonina hace que pueda provocar obstrucción por retracción intestinal. La endometriosis puede simularlo35. Tiende a extenderse al mesenterio como adenopatías discretas o en forma de masas desmoplásicas hipoecogénicas, con frecuentes calcificaciones, que pueden ser el hallazgo dominante y provocar congestión mesentérica y del intestino tributario35,36,55,56. La ecografía detecta el 13-76,5% de los tumores primarios (26-40% múltiples)55,56. Tanto estos como las metástasis ganglionares o hepáticas realzan intensa y precozmente, a veces periféricamente35,58. La intensidad y el patrón de realce y lavado se han correlacionado con el grado tumoral58.
En duodeno y yeyuno proximal son muy infrecuentes. Pueden darse carcinoides o gastrinomas55,59, en cualquier caso, con adenopatías habituales y comportamiento menos desmoplásico. Los TNE suponen un 1% de las neoplasias gástricas. Los de tipo I (70-80%) son secundarios a gastritis crónica atrófica, no invasivos y pequeños. Los de tipo II (5-6%) son gastrinomas, también no invasivos y pequeños, y pueden producir síndrome de Zollinger-Ellison. Los de tipo III (15-20%) son invasivos y agresivos, simulando adenocarcinoma55,56.
El recto es la segunda localización de TNE gastrointestinales. Son pequeños y localizados, con buen pronóstico56. En ETR aparecen como hipoecogénicos, circunscritos a la submucosa.
Los TNE colónicos son muy raros y agresivos, si excluimos los apendiculares (donde representan el 60% de tumores), hallazgo incidental en pieza de apendicectomía en un 70% de los casos56, en general con buen pronóstico.
Tumores hematológicos (fig. 7)Aunque infrecuentes (1-8%), el tracto gastrointestinal supone el asiento extraganglionar más habitual del linfoma, casi siempre no Hodgkin-B, primario o secundario. El orden de frecuencia de afectación es estómago, intestino delgado (especialmente íleon distal), colon-recto y esófago. Ecográficamente suele presentarse como masa o, más habitualmente, un engrosamiento mural circunferencial hipoecogénico marcado, más homogéneo, largo y menos obstructivo que el carcinoma, en ocasiones preservando relativamente la estructura en capas. Puede ser multifocal, ulcerarse, cavitar y, por destrucción del plexo mioentérico, producir dilatación aneurismática de la luz. Suele acompañarse de adenopatías hipoecogénicas prominentes, y a veces de afectación peritoneal o de otros órganos. Con contraste muestra realce homogéneo, más discreto y tardío que otros tumores36,59,60.
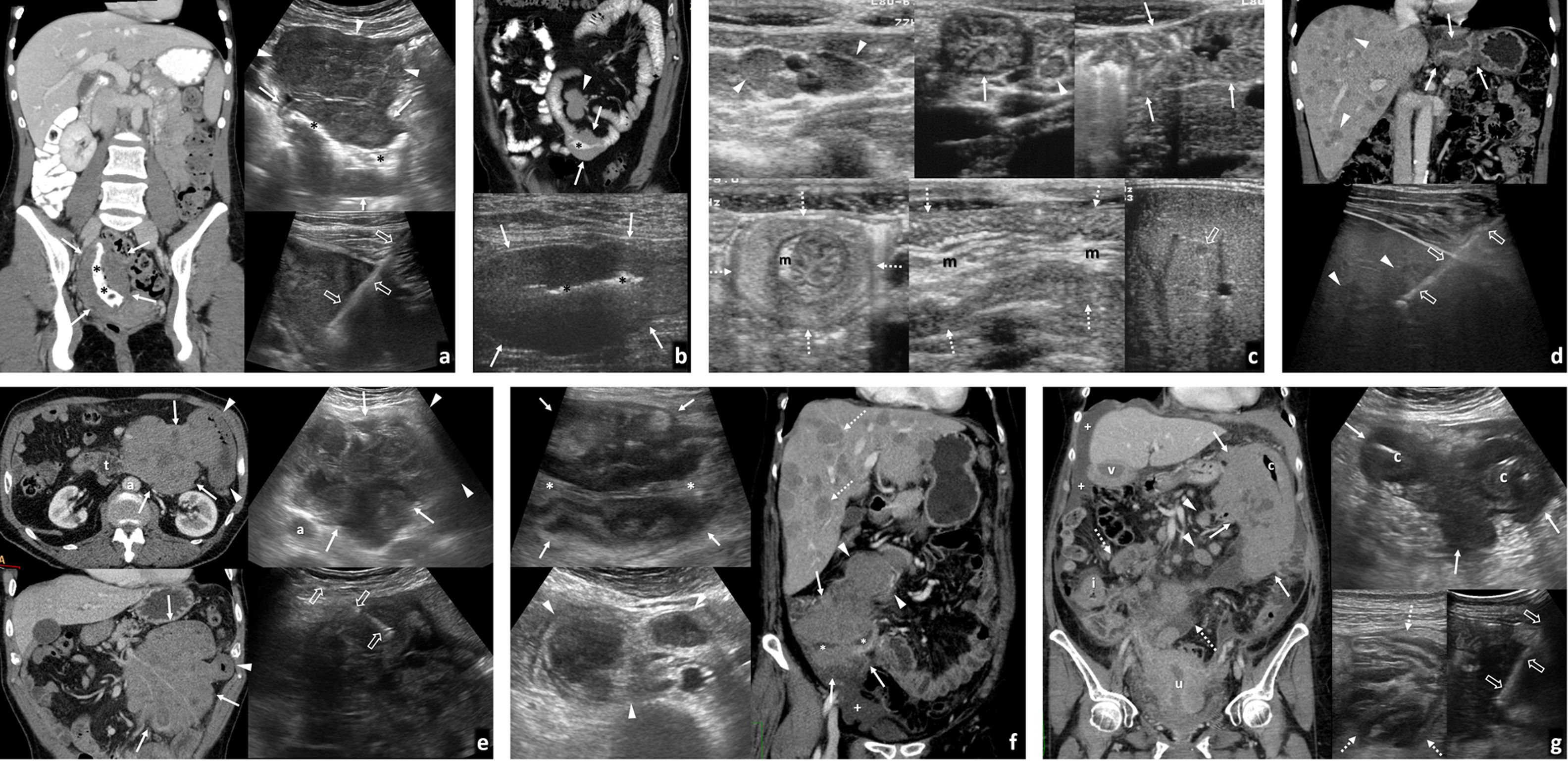
Linfomas gastrointestinales. A) Linfoma difuso de células grandes de íleon terminal. Mujer de 36 años. Imagen izquierda: tomografía computarizada (TC) coronal con contraste oral e intravenoso. Imagen derecha: ecografía. Engrosamiento mural hipoecogénico e hipovascular marcado en un tramo largo de íleon distal (flechas) cuya luz se encuentra dilatada (*). Se acompaña de una masa mesentérica adyacente de ecogenicidad similar (cabezas de flecha), sobre la que se realizó BAG guiada ecográficamente (flechas huecas). B) Linfoma difuso de células grandes de yeyuno distal. Varón de 70 años. Imagen superior: TC coronal con contraste oral e intravenoso. Imagen inferior: ecografía. Engrosamiento mural hipoecogénico e hipovascular marcado en un tramo más corto de yeyuno distal (flechas), también con dilatación aneurismática (*) y una masa mesentérica adenopática acompañante (cabeza de flecha). El diagnóstico se consiguió con la biopsia percutánea del engrosamiento intestinal (no mostrado). C) Enfermedad inmunoproliferativa de intestino delgado (o “linfoma mediterráneo”, subtipo de linfoma extranodal de la zona marginal). Varón de 17 años con diarrea, fiebre y dolor abdominal. La ecografía muestra adenopatías mesentéricas homogéneas (cabezas de flecha), engrosamiento de pliegues de yeyuno proximal (flechas), con una invaginación larga de yeyuno (flechas discontinuas) con mesenterio en su interior (m), así como pequeñas lesiones focales hepáticas hipoecogénicas (flechas huecas). El diagnóstico se obtuvo con la biopsia de dos lesiones focales hepáticas (no mostrado). D) Linfoma T gástrico de alto grado asociado a enteropatía. Varón de 61 años con diagnóstico de enfermedad celiaca. Imagen superior: TC. Imagen inferior: BAG guiada ecográficamente. Engrosamiento circunferencial hipovascular e hipoecogénico (no mostrado) de antro gástrico (flechas), con múltiples lesiones focales hepáticas hipocaptantes (cabezas de flecha) y levemente hipoecogénicas. En la gastroscopia se ve una lesión antral ulcerada, pero las biopsias son repetidamente negativas. El diagnóstico se consigue con la biopsia percutánea de las lesiones hepáticas. E) Linfoma folicular de bajo grado de yeyuno proximal. Varón de 73 años. Imagen izquierda: TC axial (superior) y coronal MIP fino (inferior). Imagen derecha: ecografía, corte transversal (superior) y biopsia percutánea. Engrosamiento mural excéntrico de un tramo de yeyuno proximal (cabezas de flecha) con una gran masa mesentérica (flechas) que se extiende hasta el ángulo de Treitz (t), con escaso efecto de masa sobre los vasos mesentéricos a su través. a: aorta. Ecográficamente se define mejor la heterogeneidad de este conglomerado adenopático, lo que permite dirigir la biopsia percutánea a la parte más sólida de la masa mesentérica (flechas huecas). Persiste en remisión completa tras 3 años de iniciar la quimioterapia. F) Linfoma de Burkitt ileocecal. Mujer de 46 años. Imagen izquierda: ecografía. Imagen derecha: TC coronal. Engrosamiento mural importante, excéntrico, en la región ileocecal (flechas) sin estenosis de la luz (*) y con cierta sensación de preservación de la estructura ecográfica en capas a pesar de la magnitud del engrosamiento. Se acompaña de un conglomerado adenopático mesentérico (cabezas de flecha) que se define con más precisión en la ecografía, así como numerosas lesiones focales hepáticas (flechas discontinuas) y ascitis (+). Persiste en remisión completa tras 4 años de iniciar la quimioterapia. G) Linfoma de células del manto de alto grado con afectación de ángulo esplénico del colon. Mujer de 69 años. Imagen izquierda: TC coronal. Imagen derecha: ecografía. Gran masa que engloba el ángulo esplénico del colon (c) y se extiende hacia su meso (flechas). Se acompaña de afectación de íleon distal (i), vesícula (v) y útero (u) como engrosamiento visceral, así como adenopatías mesentéricas (cabezas de flecha), ascitis (+) y linfomatosis peritoneal (flechas discontinuas). El diagnóstico se obtuvo con biopsia percutánea ecodirigida de la masa del mesocolon (flechas huecas).
El subtipo más frecuente es el difuso de células grandes (40-78%), agresivo y de alto grado. El segundo es el extranodal de la zona marginal (antiguo linfoma MALT), de menor grado, que incluye la enfermedad inmunoproliferativa de intestino delgado o linfoma mediterráneo. Les siguen el de células del manto (5-13%, agresivo), folicular (5-12%, con buen pronóstico), de Burkitt (5%, agresivo, más frecuente en niños e inmunodeprimidos, generalmente como masa ileocecal), linfoma T asociado a enteropatía (3-4%, en la enfermedad celiaca resistente al tratamiento, proximal, con mal pronóstico) y postrasplante (especialmente renal). Otras neoplasias hematológicas pueden afectar al intestino y el mesenterio: mieloma múltiple y plasmocitoma (engrosamiento mural o masa), mastocitosis (engrosamiento mural, hepatoesplenomegalia, adenopatías y lesiones óseas esclerosas), sarcoma mieloide o granulocítico o cloroma (en leucemia mieloide aguda u otras, como masa o engrosamiento mural) y enfermedad de Castleman (enfermedad linfoproliferativa policlonal con adenopatías mesentéricas)60,61.
GIST y otros tumores mesenquimales (fig. 8)El GIST, derivado de la célula intersticial de Cajal, es ampliamente la neoplasia mesenquimal gastrointestinal más frecuente, asentando generalmente en la capa muscular. Aproximadamente el 60% afectan al estómago, el 30% al intestino delgado y el 4% al colon-recto. La edad media al diagnóstico es de 60 años, menor en contextos sindrómicos (síndrome de Carney-Stratakis, tríada de Carney, neurofibromatosis-1) en los que los principios ALARA cobran especial relevancia62.
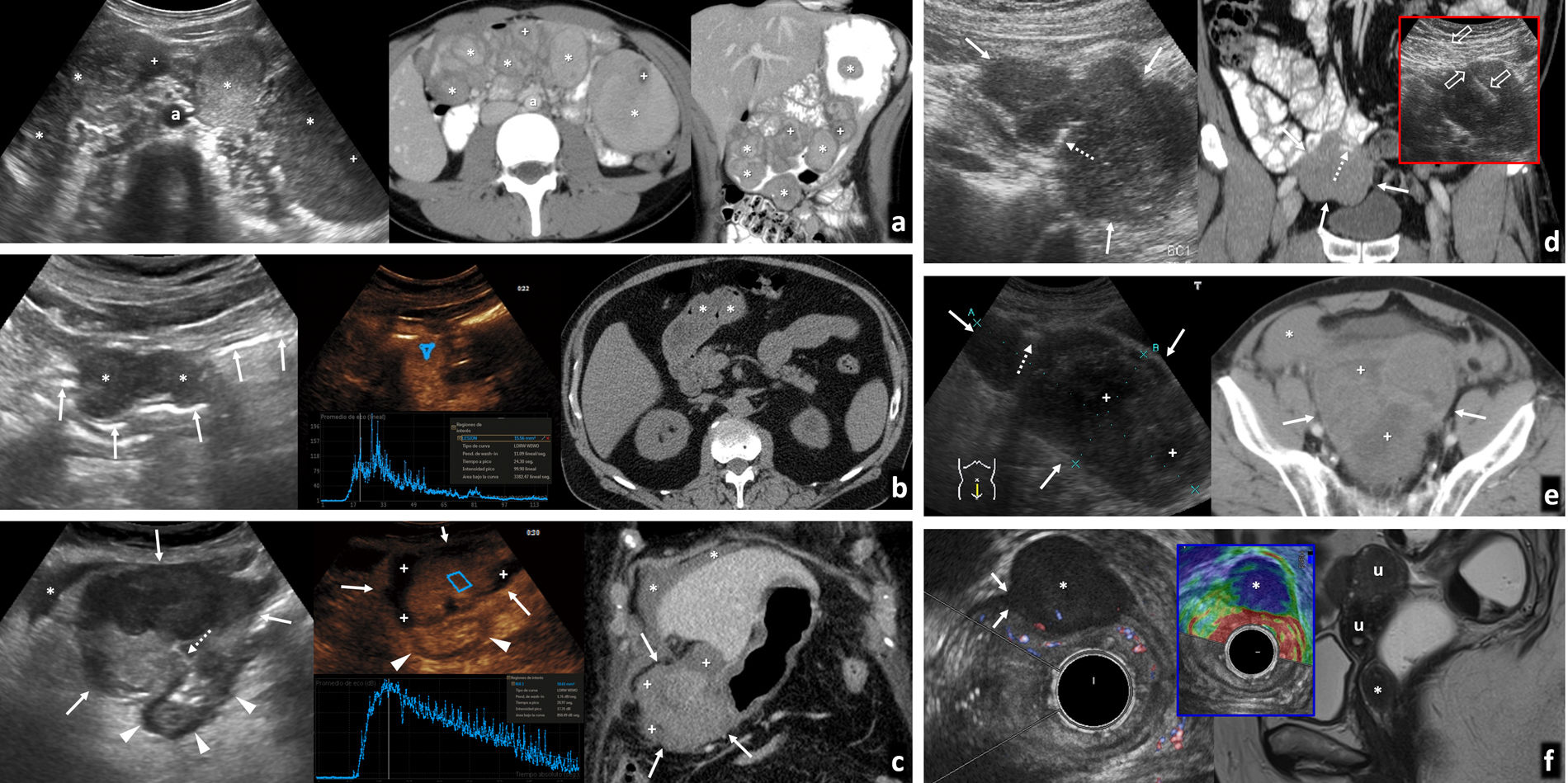
GIST gastrointestinales. A) Múltiples GIST gástricos en el contexto de síndrome de Carney-Stratakis. Se sumaban varios paragangliomas cervicales (no mostrado). Mujer de 20 años. De izquierda a derecha: ecografía (corte transversal en epigastrio), tomografía computarizada (TC) axial con contraste oral e intravenoso en el mismo plano y TC coronal. Hay innumerables nódulos y masas sólidos (*) de ecogenicidades diversas, dependientes de la pared gástrica. En algunos se aprecian focos de degeneración quística o necrótica (+). a: aorta. No hubo respuesta a imatinib y requirió gastrectomía subtotal. No había mutación en c-KIT ni PDGFRA y sí mutación germinal en una subunidad de SDH (habitual en estos casos). Los GIST en síndromes afectan más a mujeres jóvenes y niñas, con subtipo histológico más frecuentemente epitelioide que fusocelular. Frecuentemente aparecen como múltiples tumores gástricos, con adenopatías menos excepcionales y más rara respuesta a imatinib que los esporádicos. B) GIST gástrico pequeño con crecimiento endofítico. Varón de 71 años. De izquierda a derecha: ecografía (corte transversal en epigastrio), ecografía con contraste y TC axial sin contraste (antecedente de reacción adversa grave). Hallazgo ecográfico incidental de tumor lobulado homogéneamente hipoecogénico (*) con crecimiento endofítico en el antro gástrico. Pese a ser un estudio con sonda convexa de baja frecuencia en paciente obeso, se puede apreciar cómo la lesión depende de la capa muscular propia, encontrándose inmediatamente superficial a la capa submucosa ecogénica más proximal. Las flechas señalan a la luz gástrica. En ecografía con contraste la lesión realza de forma rápida y homogénea, con lavado posterior. Ciertos equipos y PACS permiten un análisis cuantitativo. En TC sin contraste la lesión pasa prácticamente desapercibida. C) GIST gástrico con crecimiento exofítico y complicación hemorrágica espontánea. Mujer de 82 años. Dolor abdominal y anemización. De izquierda a derecha: ecografía (corte transversal en hipocondrio derecho), ecografía con contraste y TC coronal con contraste. Masa heterogénea (flechas) con crecimiento exofítico desde el antro gástrico (cabezas de flecha) y una ulceración (flecha discontinua). Líquido peritoneal (*) con finos ecos y denso en TC basal (no mostrado). En ecografía con contraste hay realce intenso y rápido, con lavado tardío. En la periferia de la masa no hay realce (+). En TC corresponde a coágulo centinela. En la cirugía se encontró hemoperitoneo y se resecó un GIST gástrico sangrante. D) GIST ileal ulcerado con crecimiento exofítico. Varón de 66 años con melenas. Imagen izquierda: ecografía. Imagen derecha: TC coronal con contraste oral e intravenoso. Recuadro: biopsia con guía ecográfica (flechas huecas). Masa lobulada de ecogenicidad intermedia creciendo exofíticamente desde íleon proximal (flechas), con ulceración mucosa (flechas discontinuas). E) GIST colónico hemorrágico. Varón de 72 años. Imagen izquierda: ecografía (corte longitudinal en hipogastrio). Imagen derecha: TC axial con contraste. Gran masa heterogénea (flechas), con amplias áreas necróticas (+), una burbuja de gas intralesional por cavitación (flecha discontinua) y hemoperitoneo (*). Dependía del colon sigmoide distal. F) GIST rectal pequeño. Imagen izquierda: ecografía transrectal con Doppler. Imagen derecha: resonancia magnética sagital T2 con gel endorrectal. Recuadro central: elastografía de strain. Lesión nodular homogéneamente hipoecogénica en la cara anterior del recto inferior (*), con alta rigidez tisular en elastografía cualitativa. La ecografía demuestra su dependencia de la capa muscular propia hipoecogénica (flechas). u: útero miomatoso.
Son tumores hipoecogénicos circunscritos, redondeados o lobulados, generalmente con crecimiento exofítico no infiltrante, con frecuentes áreas de degeneración quística, hemorrágica o necrótica (hipo-anecoicas) cuando son grandes. Pueden presentar calcificaciones, ulcerarse y sangrar al intestino o al peritoneo. Tienden a metastatizar al peritoneo (también como tumores redondeados) y el hígado, siendo excepcionales las adenopatías. Diversos sistemas de estadificación pronóstica consideran aspectos radiológicos (tamaño, heterogeneidad, ulceración, localización, intensidad y patrón de realce) y no radiológicos (índice mitótico, subtipo histológico, diferenciación, pleomorfismo, rotura quirúrgica)35,36,63,64.
Las áreas sólidas realzan intensamente con contraste ecográfico, que también permite guiar la biopsia y muestra potencial como marcador pronóstico y en el seguimiento en pacientes tratados con imatinib64,65. El realce intenso y heterogéneo permite además diferenciarlo del leiomioma (mucho más frecuente en el esófago) y otros tumores mesenquimales benignos, que morfológicamente pueden ser semejantes, pero tienden a realzar menos y homogéneamente35,65–67. Es más dudoso si los GIST son significativamente más rígidos que los leiomiomas en elastografía ecoendoscópica66,68. Los lipomas suelen ser hiperecogénicos29. Los tumores mesenquimales malignos no son diferenciables del GIST por imagen.
Metástasis (fig. 9)Las más frecuentes son de melanoma, carcinoma pulmonar y renal29,59. Es discutible la existencia del melanoma intestinal primario69. Se comportan como nódulos submucosos hipoecogénicos a veces múltiples, ocasionalmente con infiltración circunferencial, crecimiento endoluminal o ulceración. Es clave conocer el antecedente oncológico.
Metástasis intestinales. A) Metástasis yeyunal ulcerada de tumor neuroendocrino pulmonar. Varón de 65 años. Síndrome constitucional. De izquierda a derecha: ecografía hepática, ecografía en flanco izquierdo y tomografía computarizada (TC) coronal con contraste. Tumor pulmonar primario (cabeza de flecha), adenopatías mediastínicas (flecha hueca), metástasis hepáticas (m) y metástasis yeyunal hipoecogénica e hipervascular (flechas), con una ulceración (flecha discontinua). B) Metástasis gástrica de carcinoma de células claras renal. Mujer de 72 años. Imagen izquierda: ecografía longitudinal en epigastrio. Imagen derecha: TC axial con contraste. Metástasis hipoecogénica lobulada (flechas) en la pared posterior del cuerpo del estómago (Est). Hay también metástasis adrenales (cabezas de flecha), cardiacas, peritoneales, óseas y de partes blandas (no mostradas). C) Metástasis yeyunal endo- y exofítica de melanoma lentiginoso acral. Mujer de 56 años. De izquierda a derecha: ecografía en vacío izquierdo, eco-Doppler, elastografía de strain, TC coronal con contraste oral e intravenoso, entero-RM fusión difusión-T2 coronal, T1 coronal sin contraste. Metástasis lobulada, con un componente endofítico y otro exofítico en un tramo de yeyuno (flechas). Es hipoecogénica, moderadamente vascularizada, rígida en elastografía, homogénea en TC, con restricción de la difusión y moderadamente hiperintensa en T1 por contenido en melanina. D) Melanoma anorrectal. Mujer de 64 años. De izquierda a derecha: elastografía de strain y ecografía transrectal en recto inferior, reconstrucción 3D de ecografía endorectal, RM T2 axial en un plano más inferior y más superior. Lesión infiltrante en la pared posterior de recto inferior y ano con gran rigidez tisular (strain ratio de 97,66), con asiento en submucosa e infiltración de mucosa y transmural (flechas), así como adenopatías perirrectales (cabezas de flecha). También había invasión de venas extramurales y metástasis hepáticas (no mostradas). No se encontró melanoma cutáneo.
La ecografía es la técnica idónea para detectar ascitis y definirla como exudativa (con ecos, tabiques y loculaciones). Aunque exige experiencia y dedicación, es también extremadamente útil en el estudio de la carcinomatosis y otras formas de afectación neoplásica peritoneal, pudiendo demostrar implantes peritoneales incluso milimétricos y en ausencia de ascitis, engrosamiento más o menos nodular de las superficies peritoneales e infiltración del omento mayor, muy accesible por su situación anatómica, adherido o no al peritoneo parietal32,33. El contraste es más sensible que el Doppler en demostrar vascularización en zonas afectadas. En el omento realzan tanto las zonas ecogénicas como los nódulos hipoecoicos, estos con relleno radial y lavado más rápido. Es útil para diferenciar de tuberculosis (con menor realce) y seleccionar dónde biopsiar70,71.
Neoplasias peritoneales y subperitoneales. Recuadro verde: peritoneo parietal. Recuadro azul: peritoneo visceral. Recuadro morado: epiplón mayor. Recuadro rojo: invasión de pared. Recuadro amarillo: otras estirpes tumorales. Recuadro marrón: tumores mesenquimales subperitoneales. A) Carcinoma de ovario. Implantes muy pequeños en el peritoneo parietal (flechas) en presencia de ascitis (*). Pequeño implante en el peritoneo visceral hepático (cabeza de flecha). B) Carcinoma gástrico. Implante peritoneal muy pequeño (flechas) invadiendo la fascia transversalis y el músculo recto anterior derecho del abdomen (por debajo de la línea arcuata no hay fascia muscular profunda) en presencia de ascitis (*). C) Carcinoma de ovario. Engrosamiento lineal del peritoneo parietal (flechas) y ascitis (*). La ecografía permite guiar la biopsia de la afectación lisa del peritoneo (flechas huecas). D) Carcinoma de vejiga. Implante nodular en el peritoneo visceral hepático, sin invasión parenquimatosa (flecha) y ascitis (*). E) Carcinoma de ovario. Implante nodular en el peritoneo visceral hepático, con invasión parenquimatosa (flechas) y ascitis (*). F) Carcinoma de endometrio. Imagen izquierda: implante nodular milimétrico en el peritoneo visceral que recubre el ligamento falciforme extrahepático (flecha). Ascitis (*). Imagen derecha: engrosamiento liso del peritoneo visceral de un tramo de intestino delgado (flechas) y ascitis (*). Engrosamiento liso de peritoneo parietal (cabezas de flecha). G) Carcinoma de colon. Infiltración estriada epiploica (“omental smudge”). Engrosamiento del peritoneo visceral del omento mayor y estriada dentro de su contenido graso (hipoecogénica e hiperdensa, respectivamente, en relación con la grasa) (flechas) y ascitis (*). H) Carcinoma de ovario. Infiltración difusa epiploica (“omental cake”). Infiltración difusa del ligamento gastrocólico y su continuidad por debajo del colon transverso (delantal de los epiplones) (flechas) y ascitis (*). I) Carcinoma de colon. Implante en peritoneo parietal con invasión directa de la pared (flechas), con ecografía y elastografía cualitativa, sin ascitis. En el recuadro, biopsia percutánea en otro caso similar (flechas huecas). J) Tumor desmoplásico de células redondas pequeñas peritoneal. Grandes masas epiploicas, mesentéricas y peritoneales (flechas), con abundante vascularización en un varón joven. K) Carcinomatosis peritoneal mucinosa por adenocarcinoma gástrico. Manto ecogénico perihepático (flechas) e implantes mucinosos ecogénicos (*) con festoneado del hígado (HÍG). L) Adenomucinosis peritoneal. Ocupación inframesocolónica masiva por material mucinoso complejo (*), de ecogenicidades alternantes y confluyendo a una calcificación central (flecha hueca). La complejidad del material mucinoso queda reflejada mucho mejor en la ecografía que en la tomografía computarizada (TC). Implantes con finas calcificaciones (puntas de flecha) en un peritoneo parietal engrosado (flechas). M) GIST con diseminación peritoneal y hepática. Numerosas lesiones nodulares redondeadas tanto en el hígado (+) como en la cavidad peritoneal (*), las más grandes con cambios quísticos y/o necrohemorrágicos (q). N) GIST de mesosigma. Eco-Doppler y TC. Gran masa pélvica hipervascularizada (*) y con áreas quísticas o necróticas (+).
Los hallazgos en el mesotelioma y carcinoma seroso primario, así como en la linfomatosis peritoneal, son similares con matices. El tumor desmoplásico de células redondas pequeñas afecta con mal pronóstico a varones jóvenes en forma de una o múltiples masas sólidas heterogéneas, con o sin ascitis33.
El pseudomixoma peritoneal es el relleno de la cavidad peritoneal por material mucinoso, casi siempre por rotura de un mucocele apendicular. Ecográficamente se comporta como una ocupación con ecogenicidades diversas, ocasionalmente alternantes, con calcificaciones, nódulos o manto peritoneal ecogénico y festoneado visceral.
Numerosas neoplasias mesenquimales pueden afectar al mesenterio o los epiplones, comportándose como masas sólidas con tendencia a ser mayores, más heterogéneas e infiltrantes en las variantes malignas33.
Ecografía como guía de biopsia percutánea (vídeo 4)Puede requerirse en lesiones de casi cualquier tipo y origen cuando la vía endoscópica fracasa o no es posible, con decisión multidisciplinar de la relación beneficio-riesgo. La guía ecográfica es más barata, versátil, segura, rápida y eficaz que por TC. La compresión gradual desplaza el intestino, acerca y fija las lesiones. Es más rentable la biopsia con aguja gruesa. Con agujas 18F es seguro atravesar (mejor transversalmente) la pared de estómago o intestino delgado, no así la del colon. Es exitosa en más del 90%, con tasas bajas de complicación72–74, también en niños75.
Autoría- 1.
Responsable de la integridad del estudio: MÁCC.
- 2.
Concepción del estudio: MÁCC, JEI.
- 3.
Diseño del estudio: MÁCC, JEI.
- 4.
Obtención de los datos: MÁCC, JEI.
- 5.
Análisis e interpretación de los datos: MÁCC, JEI.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: MÁCC, JEI.
- 8.
Redacción del trabajo: MÁCC, JEI.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MÁCC, JEI.
- 10.
Aprobación de la versión final: MÁCC, JEI.
Los autores declaran no tener ningún conflicto de intereses.