Las drogas constituyen un gran problema sociosanitario. Tradicionalmente, la neuroimagen ha tenido un papel secundario limitado a la detección de eventos vasculares agudos. En la actualidad, el radiólogo ha adquirido gran relevancia en el diagnóstico de las complicaciones neurológicas agudas y crónicas, debido al avance en el conocimiento de la enfermedad y al desarrollo de las técnicas de imagen morfológicas y funcionales. Las principales complicaciones son la patología neurovascular, la infección, los trastornos tóxico-metabólicos y la atrofia cerebral. La sintomatología inespecífica y la negación del consumo hacen que la implicación del radiólogo pueda resultar fundamental en la atención de estos pacientes. La neuroimagen permite detectar alteraciones precoces y plantear el diagnóstico etiológico ante patrones de afectación específicos. Nuestro objetivo es describir el patrón de consumo y el mecanismo fisiopatológico de las drogas con mayor repercusión neurológica, así como ilustrar las complicaciones cerebrales agudas y crónicas mediante técnicas de imagen convencional y funcional.
Recreational drug abuse represents a serious public health problem. Neuroimaging traditionally played a secondary role in this scenario, where it was limited to detecting acute vascular events. However, thanks to advances in knowledge about disease and in morphological and functional imaging techniques, radiologists have now become very important in the diagnosis of acute and chronic neurological complications of recreational drug abuse.
The main complications are neurovascular disease, infection, toxicometabolic disorders, and brain atrophy. The nonspecific symptoms and denial of abuse make the radiologist's involvement fundamental in the management of these patients. Neuroimaging makes it possible to detect early changes and to suggest an etiological diagnosis in cases with specific patterns of involvement.
We aim to describe the pattern of abuse and the pathophysiological mechanisms of the drugs with the greatest neurological repercussions as well as to illustrate the depiction of the acute and chronic cerebral complications on conventional and functional imaging techniques.
La humanidad siempre ha sentido el deseo de satisfacer nuevas sensaciones, alcanzar diferentes estados de conciencia y, en ocasiones, enmascarar la realidad. Las sustancias usadas con este propósito han tenido como principal diana, intencionadamente o no, el sistema nervioso central (SNC). Los patrones de consumo han ido cambiando y las condiciones de uso han mejorado, pero todas tienen efectos deletéreos que ahora podemos ver y cuantificar.
Las formas de presentación de cada sustancia son múltiples y se modifican continuamente, pero las vías de absorción en el cuerpo son limitadas y producen complicaciones que se solapan entre sí. Con frecuencia serán los hallazgos de neuroimagen los que planteen la posibilidad del consumo, e incluso, ante patrones característicos, se podrá sugerir el tipo específico de droga. El papel del radiólogo, por tanto, es cada vez más relevante tanto en la detección de patología urgente como en la visualización de efectos crónicos.
Nuestro objetivo es describir el patrón de consumo y el mecanismo fisiopatológico de las drogas con mayor repercusión neurológica (cocaína, anfetaminas, heroína, alcohol, cannabis y tolueno), así como ilustrar las complicaciones cerebrales agudas y crónicas mediante técnicas de imagen convencional y funcional (tomografía por emisión de positrones [PET], tomografía por emisión de fotón único [SPECT] y perfusión por resonancia magnética [RM]).
CocaínaLa cocaína es el principal alcaloide que se obtiene de la hoja de un arbusto denominado Erithroxylon coca, presente en la zona occidental de América del Sur. Existen dos formas de presentación: la hidroclorada (con apariencia de polvo fino) y la alcaloide (también conocida como crack)1. La vía de administración más popular es la intranasal, que alcanza concentraciones en el SNC en 3-5 minutos. La acción principal de la cocaína se resume en el efecto simpaticomimético debido al bloqueo de la recaptación de catecolaminas1–4. Además, bloquea la recaptación de serotonina y de los transportadores de la dopamina, aumentando sus concentraciones extracelulares, sobre todo en el núcleo accumbens2,5,6.
La adicción que provoca la cocaína se debe a su rápido mecanismo de acción, pues el efecto es prácticamente inmediato tras su administración1. Tras su consumo se experimenta una sensación de euforia o high mediado principalmente por la ocupación de los receptores de dopamina llamados DA-D21,3–5.
Las principales complicaciones cerebrales derivadas del abuso de cocaína son vasculares, principalmente la hemorragia subaracnoidea y la hemorragia intraparenquimatosa; los eventos hemorrágicos son, en conjunto, el doble de frecuentes que los infartos isquémicos1,7,8. No obstante, la forma de la droga y la vía de absorción influyen en el tipo de evento adverso. Cuando la cocaína se fuma en forma de crack es mayor la incidencia de eventos hemorrágicos, mientras que no hay diferencias significativas entre eventos isquémicos y hemorrágicos cuando la droga se esnifa9,10.
Los mecanismos fisiopatológicos implicados en la producción de accidentes cerebrovasculares isquémicos son múltiples y sinérgicos, pero destacan la vasoconstricción o el vasoespasmo2,11 (tabla 1). Este fenómeno puede producir un daño endotelial consistente en la disrupción de la túnica media y fibrosis arteriolar, entre otras alteraciones12. No obstante, destaca el componente significativo de vasculitis, constatado por la existencia de estenosis focales de la luz vascular y el realce de la pared de los vasos en los estudios angiográficos5,13.
Mecanismos implicados en la producción de accidentes cerebrovasculares isquémicos por cocaína
| Mecanismo isquémico | Fenómeno bioquímico |
|---|---|
| Vasoconstricción | Bloqueo de los canales del calcio1,4 Aumento de la serotonina2,5 |
| Fenómenos protrombóticos | Aumento del tromboxano y de la agregación plaquetaria5,9,10 |
| Diátesis procoagulante | Disminución de la antitrombina III y de la proteína C7,8 |
| Aterosclerosis | Inhibición del óxido nítrico en el endotelio11 |
| Vasculitis | Mecanismos paracrinos e inmunitarios activados por impurezas5,9,13 |
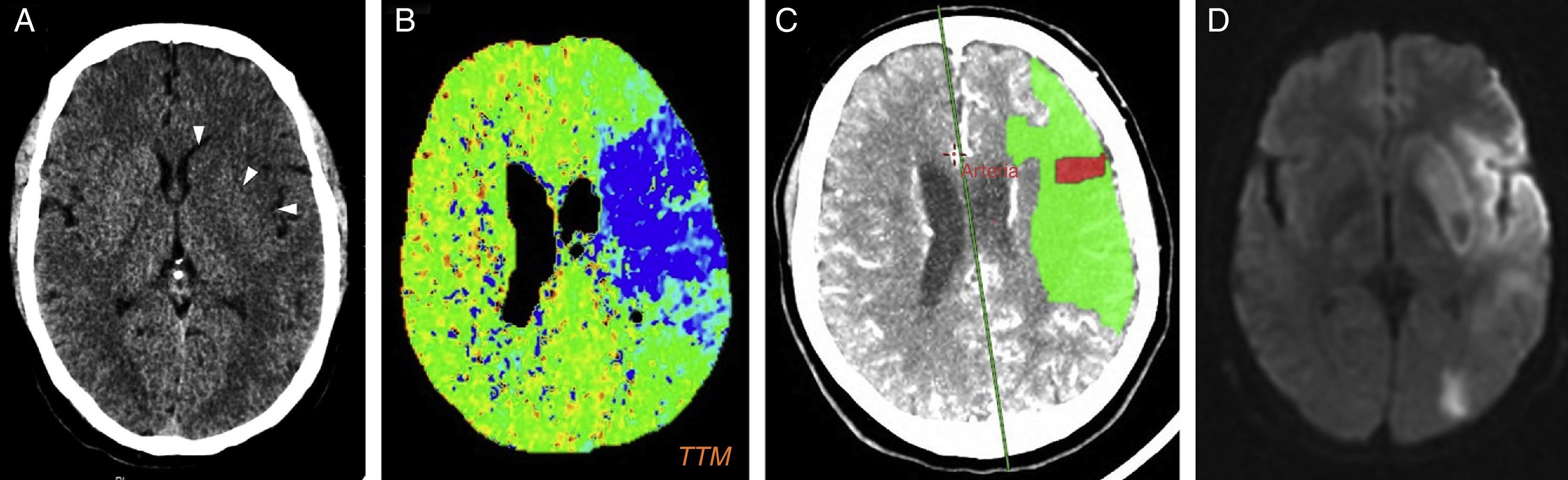
Los infartos isquémicos afectan con frecuencia a los territorios de las arterias cerebrales media (fig. 1) y posterior, a los territorios frontera, a la cápsula interna y al hipocampo, sin que exista un patrón de afectación específico1,5,9. El infarto mesencefálico se ha asociado con el uso simultáneo de cocaína y anfetaminas14. Al no presentar una distribución característica, adquieren especial relevancia los hallazgos concomitantes, como la perforación del tabique nasal, la aterosclerosis acelerada en personas jóvenes sin factores de riesgo cardiovascular (fig. 2) y el vasoespasmo generalizado.
Accidente cerebrovascular isquémico agudo en territorio de la arteria cerebral media izquierda relacionado con el consumo de cocaína. A) La TC sin contraste intravenoso muestra hipodensidad de la cabeza del caudado, del núcleo lenticular y de la ínsula izquierdos (puntas de flecha). B) Mapa paramétrico de tiempo de tránsito medio (TTM) que muestra la extensa área isquémica con TTM alargado (en azul), en su mayor parte correspondiente a tejido salvable (representado en verde en C), y un pequeño core isquémico de tejido no viable con volumen sanguíneo cerebral disminuido (rojo en C). D) Imagen de RM en secuencia de difusión en la que se identifica la restricción del área isquémica en el territorio silviano.
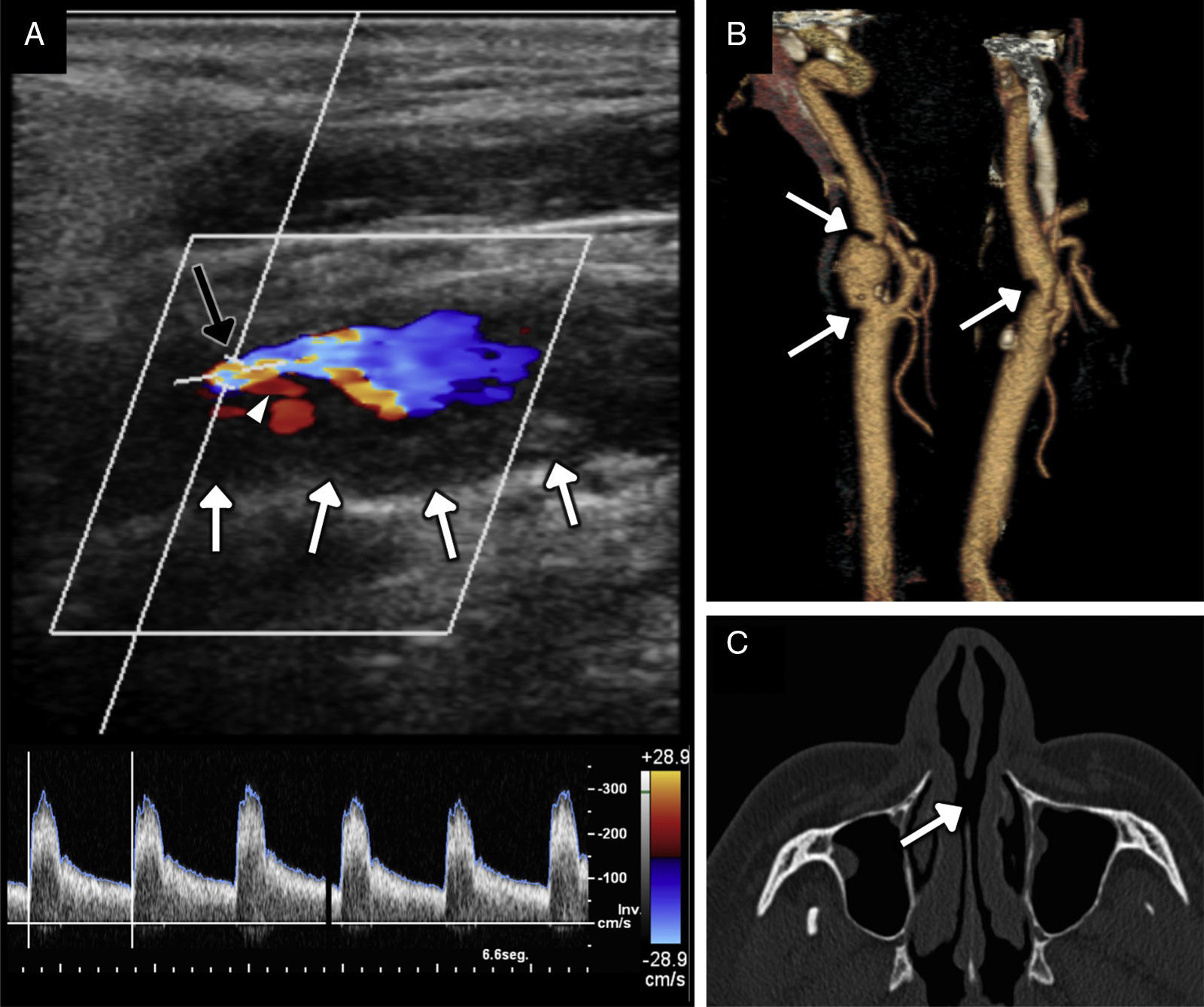
Hombre de 38 años de edad con aterosclerosis acelerada sin factores de riesgo cardiovascular clásicos, consumidor habitual de cocaína. A) Imagen de ecografía Doppler dúplex del segmento cervical de la arteria carótida interna que muestra una placa blanda relativamente homogénea (flechas blancas), de superficie irregular, con ulceración (punta de flecha), que condiciona una estenosis grave de la luz con flujo de alta velocidad turbulento (flecha negra) y velocidad pico sistólica de aproximadamente 300cm/s. B) Reconstrucción volumétrica de TC de ambas arterias carótidas en la que se demuestra la marcada afectación ateroesclerótica bilateral (placas marcadas con flechas). C) Detalle de la imagen transversal del estudio de TC en ventana de hueso en el que se identifica la perforación del tabique nasal (flecha).
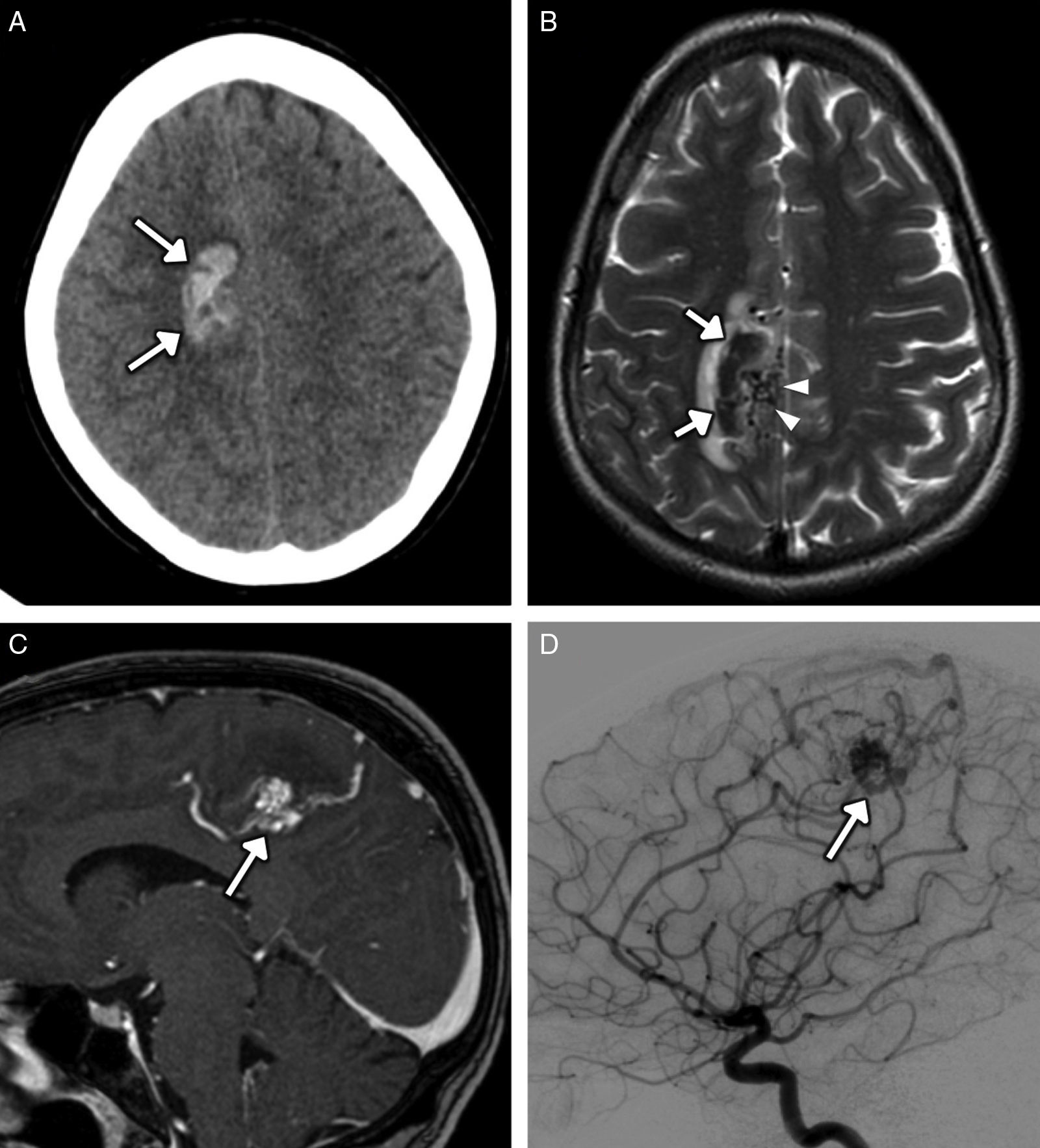
Hasta el 50% de los pacientes con complicaciones hemorrágicas por cocaína presentan patología vascular subyacente, como aneurismas y malformaciones vasculares1. La mayor prevalencia de aneurismas se explica por el aumento mantenido de la presión arterial1,2,15. El mecanismo implicado en la rotura aneurismática y las malformaciones arteriovenosas es el pico sistólico elevado y el aumento de la frecuencia cardiaca tras el consumo agudo4,5 (fig. 3). No es infrecuente el abuso conjunto de cocaína y etanol, lo que aumenta sinérgicamente la probabilidad de hemorragia subaracnoidea10.
Mujer de 33 años de edad que presenta intensa cefalea y hemiparesia izquierda, en cuyo análisis de tóxicos en orina se detectó cocaína. A) Imagen transversal de TC sin contraste intravenoso en la que se observa un hematoma intraparenquimatoso cortico-subcortical frontal parafalciano derecho (flechas). B) Imagen transversal de RM potenciada en T2 en la que se identifica el hematoma marcadamente hipointenso (flechas), edema vasogénico en su borde lateral y, en su borde medial, un nidus de vacíos de flujo tubulares correspondiente a una malformación arteriovenosa (puntas de flecha). C) Imagen sagital de RM potenciada en T1 con contraste intravenoso que muestra el nidus de la malformación (flecha) con drenaje al seno longitudinal superior. D) Imagen sagital de arteriografía con sustracción digital que confirma la malformación arteriovenosa (flecha).
El hematoma intraparenquimatoso suele ser lobar y subcortical, y además existe una mayor incidencia de sangrados en el tronco del encéfalo5,16. Los hematomas son de mayor volumen y tienden a abrirse a los ventrículos con mayor facilidad que en los no usuarios, lo que condiciona un mayor déficit neurológico16. No es infrecuente la transformación hemorrágica de las áreas isquémicas debido al daño de la barrera hematoencefálica y al incremento de la presión arterial7,9.
Los adictos crónicos presentan característicamente atrofia estructural en los lóbulos frontales y en menor medida en los temporales8,9, donde se ha constatado un descenso de la actividad metabólica en estudios de PET con 18-fluorodesoxiglucosa17. Los estudios de perfusión con SPECT con hexametil propileno amino oxima marcada con tecnecio 99 metaestable (99mTc-HMPAO) han demostrado una reducción generalizada del 30% en el flujo sanguíneo cerebral global, a la que se añade una disminución específica del flujo sanguíneo cerebral relativo en la corteza prefrontal, el giro cingulado anterior, los tálamos, los ganglios basales, la corteza occipital y el cerebelo18.
Además del síndrome de abstinencia, muchos usuarios experimentan un deseo intenso de consumo tras el cese del mismo (fase de craving), que puede desencadenarse por múltiples estímulos. En esta compleja fase existe una activación selectiva del sistema límbico en los estudios de perfusión19, hipermetabolismo en el córtex orbitofrontal19,20 e incluso implicación del sistema opioide mu21. Los estudios funcionales basados en el consumo de oxígeno (secuencia BOLD) en usuarios activos objetivan un aumento de la actividad en fase de craving y de dependencia localizado en las regiones límbicas, paralímbicas, el núcleo accumbens, las circunvoluciones frontales y frontoorbitarias inferiores, y el cíngulo anterior22. Esta activación también se ha demostrado durante el deseo del consumo cuando se proyectaban vídeos en los que se mostraba la droga23. En cambio, tras la administración de la sustancia se inactivan estas regiones22.
Anfetaminas y sus derivadosLa anfetamina se sintetizó por primera vez en 1887 y constituyó la primera sustancia de un grupo que comparte propiedades, llamadas en su conjunto de la misma forma. Posteriormente aparecieron la metanfetamina y el MDMA (3,4-metilendioximetanfetamina), comúnmente llamado «éxtasis» o «cristal». Existe un riguroso control legal de los derivados anfetamínicos en estudios de investigación y para el tratamiento de enfermedades (obesidad e hiperactividad). El perfil de consumo del MDMA se relaciona con el ocio nocturno; es la segunda droga ilegal más consumida por los jóvenes después del cannabis24. La vía de administración más frecuente es la oral, en forma de polvo «cristal» o pastillas. Provoca una rápida sensación de euforia y un aumento de la percepción sensorial, por lo que se considera tanto estimulante como alucinógeno8,25.
Las anfetaminas, en su conjunto, aumentan las concentraciones sinápticas de las aminas biológicas (dopamina, noradrenalina y serotonina/5-hidroxitriptamina), siendo la acción principal y más característica del MDMA la rápida liberación de 5-hidroxitriptamina8,11,25. Este neurotransmisor es la amina con mayor efecto vasoconstrictor en el cerebro5.
Aunque el mecanismo bioquímico de las anfetaminas produce isquemia a largo plazo, las complicaciones urgentes más frecuentes son las hemorragias causadas por el aumento de la presión arterial. Al igual que sucede con el consumo de cocaína, el aumento de la presión arterial tras el consumo condiciona un mayor riesgo de rotura de malformaciones arteriovenosas y de aneurismas preexistentes9,26.
La vasoconstricción en la microcirculación cerebral produce en última instancia necrosis del tejido irrigado8,9,26. Las áreas más frecuentemente afectadas por esta isquemia son el globo pálido (como ocurre con la heroína) y la corteza occipital, donde se localiza la mayor concentración de receptores de la 5-hidroxitriptamina (llamados 5HT 2A)8,9; de hecho, el hallazgo más frecuente en las autopsias es la necrosis del globo pálido26 (fig. 12 online). Esta especificidad espacial explica que sea en estas áreas donde se desarrollan las complicaciones estructurales y funcionales.
Otra complicación derivada del aumento de la presión arterial es el síndrome de encefalopatía posterior reversible (fig. 4). Se trata de un trastorno inespecífico de la autorregulación cerebrovascular que presenta predilección por la circulación posterior y las zonas limítrofes corticales. En la tomografía computarizada (TC) los hallazgos pueden ser sutiles, identificando áreas de hipodensidad no confluentes cortico-subcorticales, bilaterales, a menudo localizadas en los lóbulos parietales posteriores y occipitales. La RM es más sensible para su diagnóstico y los hallazgos se detectan de forma precoz, mostrando una alta intensidad de la señal en las secuencias potenciadas en T2/FLAIR.
Mujer de 42 años de edad, consumidora esporádica 3,4-metilendioximetanfetamina (MDMA), que acude al hospital por presentar cefalea, alteración visual y crisis hipertensiva por síndrome de encefalopatía posterior reversible. En el examen toxicológico de orina se detectó 3,4-metilendioximetanfetamina (MDMA). A) Imagen transversal de RM potenciada en T2 que muestra un extenso edema cortico-subcortical bilateral confluente de predominio parieto-occipital posterior (flechas). B) Imagen coronal de RM potenciada en T2-FLAIR en la que se identifica el edema (flechas) y su efecto masa con colapso de surcos (puntas de flecha). La clínica y los hallazgos radiológicos se resolvieron a los pocos días con medidas de soporte y control de la presión arterial.
En relación a los efectos a largo plazo, se ha demostrado atrofia selectiva en la corteza occipital y frontal, el lóbulo temporal izquierdo y tronco del encéfalo en comparación con usuarios que abusan de otras sustancias de forma exclusiva o en conjunto (poliabuso)25. La metanfetamina puede provocar una pérdida de volumen de la sustancia gris que puede ser desde generalizada hasta unilobar25,27,28. En cambio, se ha demostrado un incremento de volumen del estriado (caudado y putamen) en adultos consumidores de metanfetamina durante más de 2 años. El aumento de volumen se debe a mecanismos de respuesta inicial a la neurotoxicidad, sobre todo inflamación. Esta reacción evoluciona posteriormente a atrofia si la dosis neurotóxica sigue aumentando25,29. En niños expuestos a metanfetaminas in utero se produce una pérdida de volumen del estriado inicialmente, al no existir dicha compensación al daño dopaminérgico25,30.
Con la PET se observa un daño selectivo en las neuronas serotoninérgicas y una disminución de sus transportadores31,32. En cuanto a la perfusión medida con SPECT, se ha constatado un descenso del flujo sanguíneo cerebral relativo en el córtex visual, el caudado, el lóbulo parietal superior y la región dorsolateral del lóbulo frontal, relacionado con la vasoconstricción inducida por MDMA31,33. En consonancia con ello, mediante RM se ha objetivado una disminución del volumen sanguíneo cerebral relativo de dicha región dorsolateral del córtex frontal como primera manifestación funcional tras los primeros contactos con MDMA en sujetos jóvenes34.
HeroínaLa heroína o diacetilmorfina es el compuesto ilegal más consumido dentro del grupo de los opiáceos. Se comercializó por primera vez en 1898, buscando un sustito analgésico a la morfina, pero fue retirada al demostrarse la gran dependencia física y psicológica que producía. La apariencia es de un polvo cristalino blanco y fino, aunque puede variar. Existen tres tipos principales: la número dos o base; la número tres, conocida como brown sugar por su aspecto terroso; y la número cuatro o variedad tailandesa, que puede llegar a tener una pureza de hasta el 90%. La vía intravenosa es la forma de administración más eficaz y contundente respecto a su efecto, y fue la más usada hasta la aparición del sida. Actualmente, las vías fumada e inhalada son las más extendidas.
El mecanismo de acción de la heroína está mediado por la activación de tres tipos de receptores: mu, kappa y delta. Los mu son los causantes de la sensación de euforia y del refuerzo positivo, además de la analgesia, la depresión respiratoria y la miosis35,36. Los kappa y los delta contribuyen al efecto analgésico, la sensación de disforia y los efectos psicomiméticos35,36.
El sentimiento nítido y positivo tras los primeros contactos (luna de miel) se produce inicialmente. Al avanzar el estado de intoxicación, los efectos se difuminan. El grado de tolerancia convierte a la droga en un medio de evitar el síndrome de abstinencia y cada vez menos en una fuente de placer.
Entre las complicaciones derivadas del abuso de la heroína destacan la patología isquémica, la leucoencefalopatía tóxica y la atrofia.
La isquemia es la complicación neurovascular más frecuente de los compuestos derivados de los opiodes y la morfina8,11. Los mecanismos fisiopatológicos implicados son el vasoespasmo por contracción del músculo liso, fenómenos de vasculitis y embolias por aditivos37–39. Los territorios vasculares limítrofes son los más vulnerables, pero es el globo pálido la estructura anatómica más frecuentemente afectada (hasta un 5-10% en usuarios crónicos)40. Es habitual la isquemia crónica, representada en la RM como hiperintensidades confluentes en la sustancia blanca periventricular y subcortical. Dicho hallazgo adquiere especial importancia si se trata de pacientes jóvenes sin otros factores de riesgo11,35.
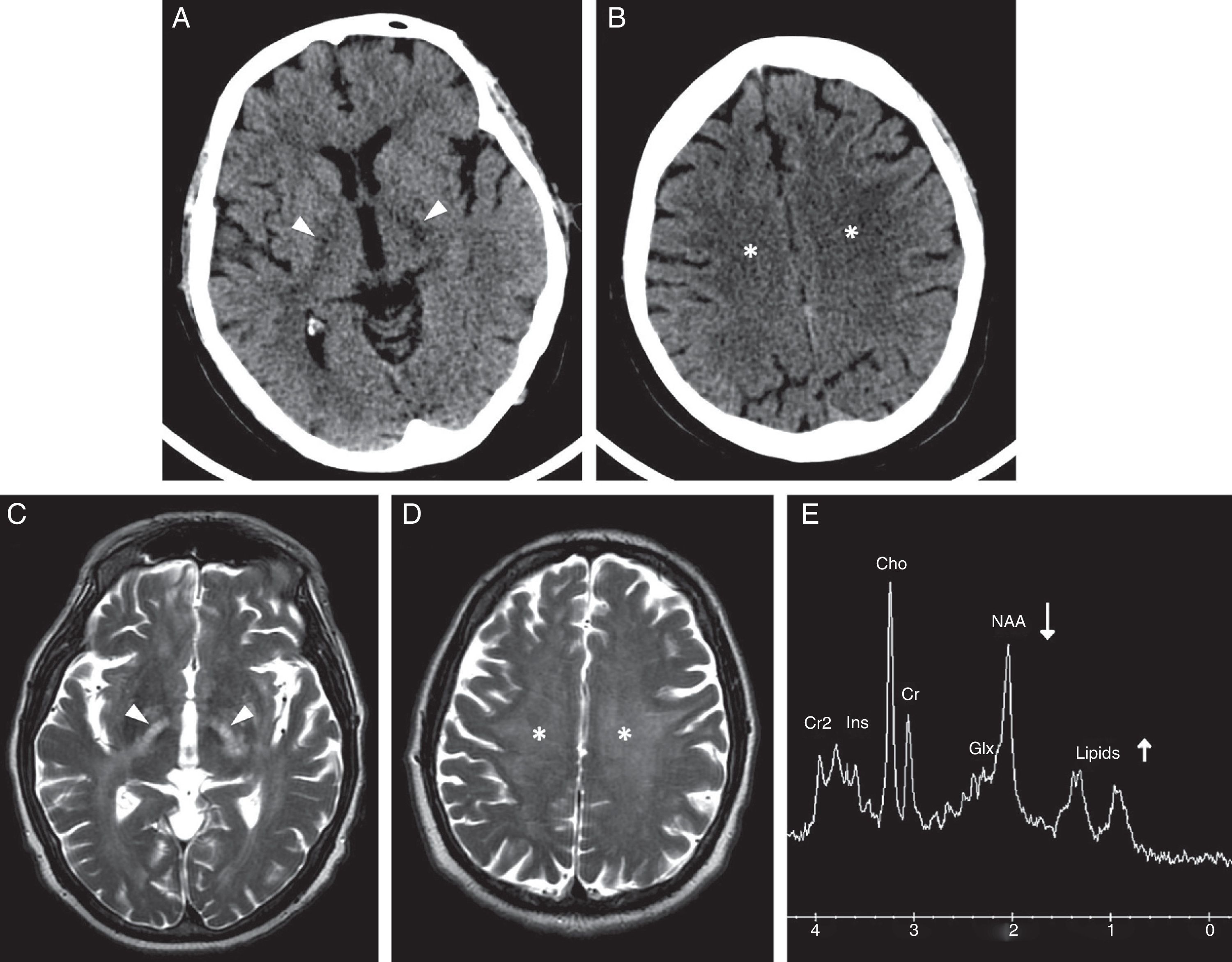
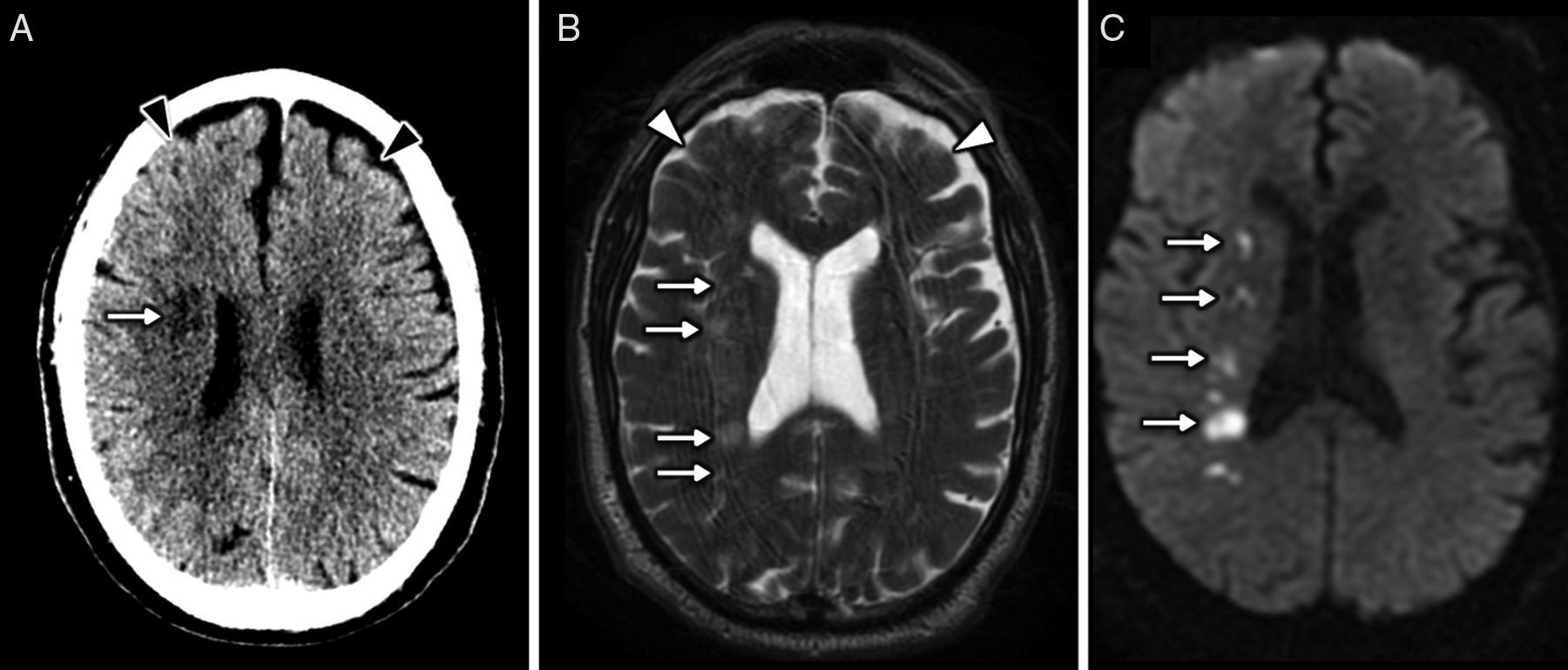
Una complicación específica del adicto a la heroína por vía inhalada es el fenómeno conocido como chasing the dragon. Esta denominación proviene de la forma de inahalar el humo que se desprende al calentar la heroína sobre una llama. Se popularizó como alternativa a la administración intravenosa para evitar el contagio del virus de la inmunodeficiencia humana. La complicación neurológica consiste en una leucoencefalopatía con edema. Probablemente se debe a un mecanismo de toxicidad mitocondrial, desencadenado por impurezas que se activan al calentar el aluminio41. Este cuadro puede presentar signos cerebelosos y extrapiramidales, y en los casos más graves clínica pseudobulbar, espasmos, mutismo hipotónico e incluso el fallecimiento11. Anatomopatológicamente se describe una degeneración espongiforme de los tractos corticoespinales y de la sustancia blanca cerebral y cerebelosa8,41. Las secuencias de RM T2/FLAIR muestran una hiperseñal bilateral y simétrica de la sustancia blanca en estas localizaciones. La afectación cerebelosa y del brazo posterior de la cápsula interna, respetando el brazo anterior, es la más característica42. Estos hallazgos no son exclusivos de la leucopatía por heroína y pueden ser secundarios al abuso de otras drogas. Los hallazgos de espectroscopía complemetan el diagnóstico y pueden aumentar su especificidad; muestran un descenso anormal del pico de N-acetilaspartato, un aumento del lactato y del mioinositol, y estabilidad del pico de lípidos11 (fig. 5). Se ha descrito la resolución de la afectación clínica al cesar el consumo de heroína, pero los hallazgos en la imagen pueden persistir43.
Hombre con leucoencefalopatía de predominio supratentorial relacionada con el consumo de heroína, clásicamente conocida como chasing the dragon. A y B) Imágenes transversales de TC sin contraste intravenoso que muestran la hipodensidad generalizada de la sustancia blanca de las coronas radiadas (asteriscos) con extensión por los tractos corticoespinales en los brazos posteriores de las cápsulas internas (puntas de flecha). C y D) Imágenes transversales de RM potenciadas en T2 en las mismas localizaciones en las que se observa con mayor claridad la afectación de la sustancia blanca con aumento de su señal. E) El estudio de espectroscopía de vóxel único con tiempo de eco corto mostró un descenso del pico de N-acetil aspartato y un leve aumento de los lípidos y del lactato.
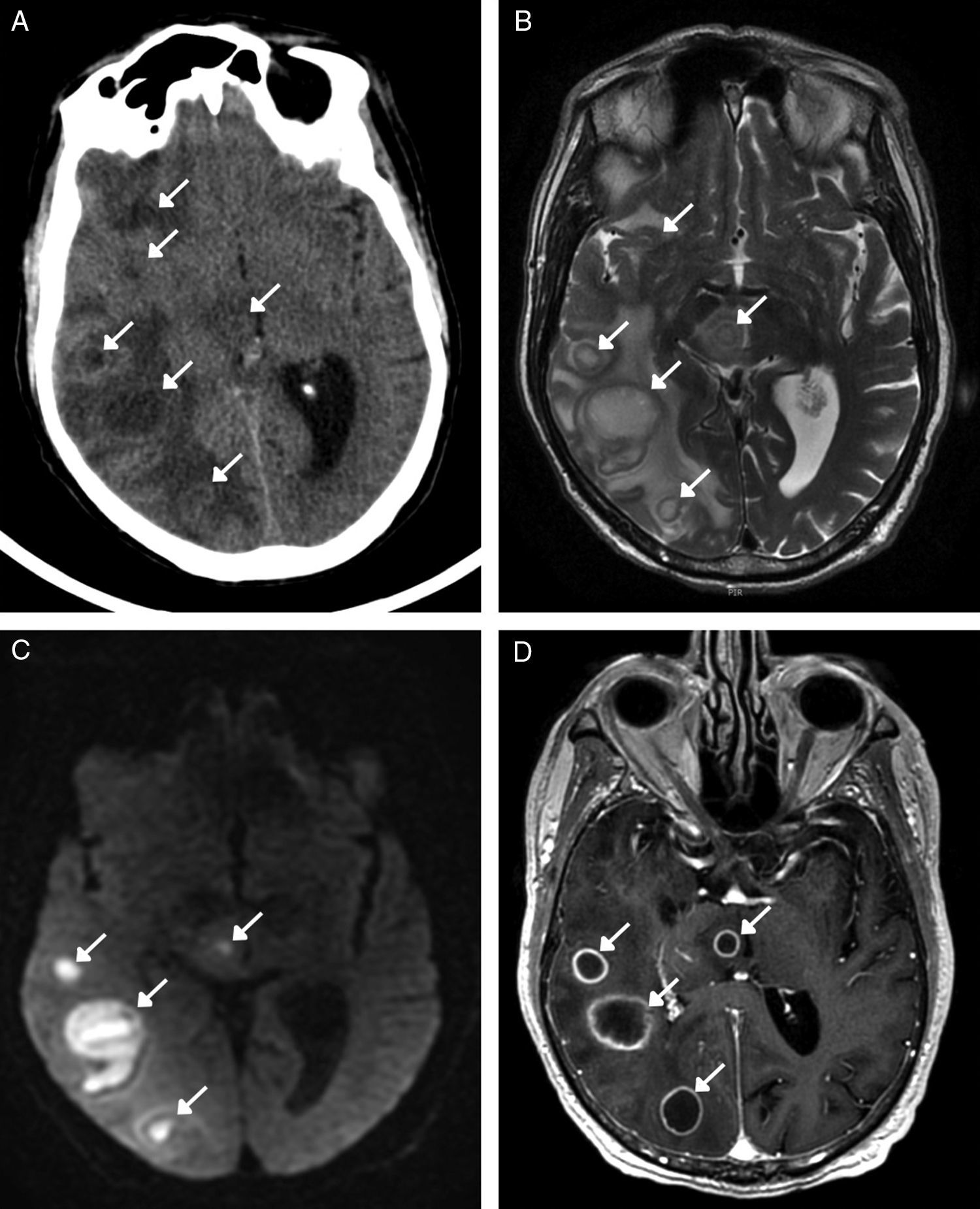
Además de las complicaciones derivadas de la propia sustancia, las impurezas (sustancias lipófilas) usadas en la mezcla y las condiciones no estériles en la administración intravenosa hacen que las infecciones sean relativamente frecuentes y de especial importancia8,11,41. La mitad de los consumidores desarrollan endocarditis, oclusión de pequeño vaso por embólos sépticos y formación de abscesos. En la RM, los abscesos son lesiones redondeadas que tras la administración de contraste se realzan de forma anular, presentan edema vasogénico perilesional y su contenido purulento restringe la difusión (fig. 6). El organismo implicado en la mayoría de los casos es Staphylococcus aureus, que penetra desde la piel a la sangre a través del pinchazo con la aguja44.
Consumidor habitual de heroína por vía intravenosa que acude a urgencias por desorientación. A) TC sin contraste intravenoso en la que se identifican múltiples abscesos supratentoriales subcorticales de predominio derecho y en el mesencéfalo (flechas). B) Imagen transversal de RM potenciada en T2 que confirma los hallazgos y muestra el importante edema vasogénico perilesional. C) En la secuencia de difusión, el contenido de los abscesos presenta restricción por tratarse de material purulento. D) Tras la administración de contraste, los abscesos se realzan de forma anular completa. El microorganismo implicado fue Staphylococcus aureus.
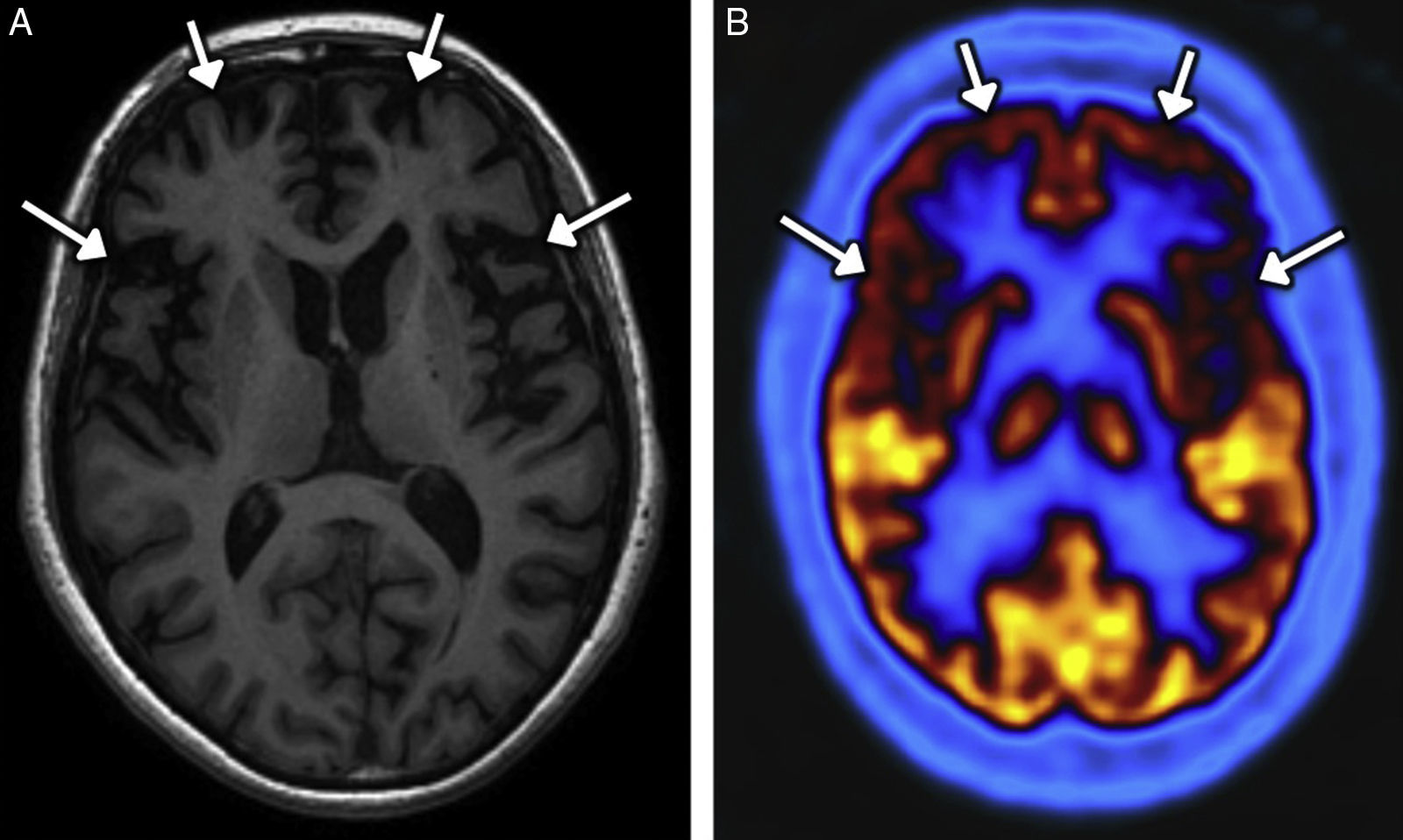
El consumo crónico de heroína conduce a atrofia encefálica, hipometabolismo e hipoperfusión. La pérdida de sustancia gris, constatada por volumetría en la RM, predomina en el córtex bilateral prefontral, los lóbulos temporales y las ínsulas45, con una correlación entre la duración del uso y el grado de atrofia, lo que sugiere un efecto acumulativo46. La sustancia blanca se ha valorado en estudios de imagen mediante tensor de difusión, en los que se ha observado un descenso de la fracción de anisotropía que traduce una disrupción de las fibras en las regiones frontales bilaterales, el giro precentral derecho y el cíngulo izquierdo47. Los estudios en adictos crónicos han constatado una disminución global de la perfusión48 y del metabolismo31,49, con mayor descenso de ambos parámetros en los lóbulos frontales y temporales (fig. 7). Respecto a los efectos agudos, se ha demostrado un descenso de la perfusión cuantificado con ASL (arterial spin labelling) en el córtex cingulado anterior izquierdo, el córtex prefrontal izquierdo y las ínsulas50.
Hombre de 48 años de edad consumidor crónico de heroína que presenta deterioro cognitivo y alteraciones del comportamiento. A) Imagen transversal de RM potenciada en T1 en la que se identifica una importante atrofia frontal bilateral con un gradiente de afectación anteroposterior. Obsérvese la dilatación de los espacios subaracnoideos de las convexidades frontales y de las cisuras de Silvio (flechas). B) Imagen transversal de PET con 18F-fluorodesoxiglucosa en la que se observa hipometabolismo frontal bilateral (flechas) con la misma distribución que la atrofia en la imagen estructural.
El alcohol es una droga legal y socialmente aceptada. Su consumo abusivo y crónico asocia un aumento de la morbimortalidad y reduce la esperanza de vida hasta en 15 años51. Atendiendo al proceso de elaboración, las bebidas alcohólicas se dividen en fermentadas y destiladas. El principal componente del alcohol es el etanol, un depresor del SNC que adormece progresivamente las funciones cerebrales y sensoriales. Se confunde erróneamente con un estimulante porque al inicio de la embriaguez produce desinhibición conductual.
Los mecanismos del daño neurológico son fundamentalmente tres: toxicidad directa, daño mediado por productos derivados (metanol y acetaldehído) y efectos secundarios a cirrosis y déficit nutricional. Los mecanismos de daño directo propuestos son múltiples, pero el desenlace común es una mayor susceptibilidad de los receptores de N-metil-D-aspartato a la excitación y la citotoxicidad del glutamato, la llamada up regulation.
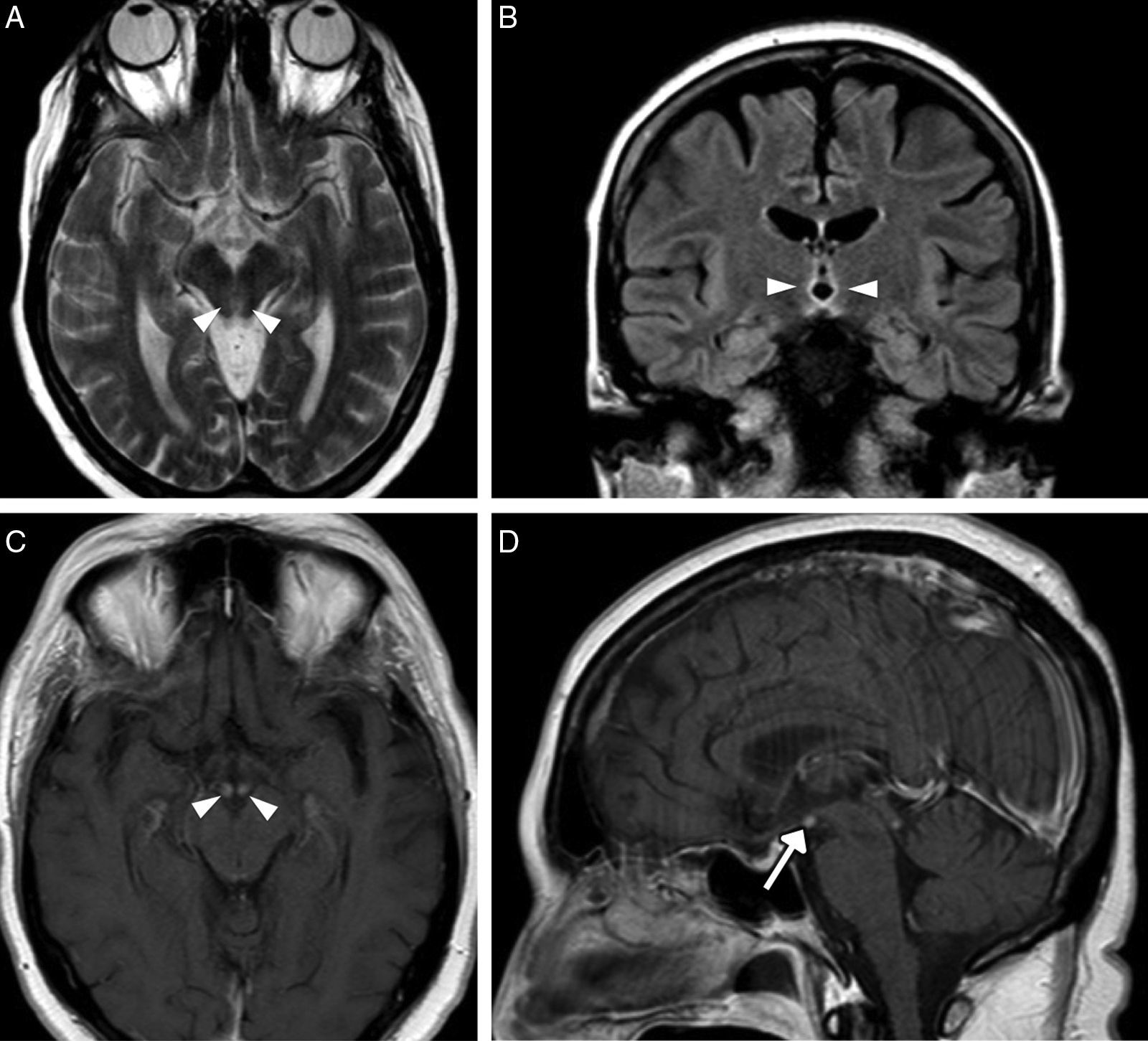
La encefalopatía de Wernicke es una de las complicaciones principales en los alcohólicos crónicos debido al déficit de la coenzima tiamina (vitamina B1). La encefalopatía de Wernicke provoca la tríada clásica de oftalmoplejía, estado confusional y trastorno de la marcha, aunque el cuadro completo solo se manifiesta en un tercio de los enfermos52. El retraso en el diagnóstico y en el tratamiento puede conducir a la psicosis de Korsakoff, caracterizada por alteraciones de memoria y confabulación. Los cambios osmóticos debidos al descenso de tiamina producen edema intracelular y extracelular, de predominio en las áreas cercanas al líquido cefalorraquídeo, donde la barrera hematoencefálica es más permeable. Las lesiones se localizan preferentemente alrededor de tercer ventrículo y en los ventrículos laterales, los núcleos dorsomedial y pulvinar del tálamo, los cuerpos mamilares, y la región pineal y periacueductal52. En los casos más graves también pueden afectarse la sustancia blanca profunda e incluso el córtex. En las regiones afectas, la RM mostrará hiperintensidad en T2/FLAIR8,11, y tras la administración de contraste pueden realzarse por la rotura de la barrera hematoencefálica, siendo patognomónico de esta afección el realce intenso de los cuerpos mamilares en las fases agudas incluso en ausencia de hiperintensidad T251-53 (fig. 8).
Hombre alcohólico crónico con clínica de confusión y ataxia por encefalopatía de Wernicke. A) Imagen transversal de RM potenciada en T2 en la que se identifica hiperintensidad de la señal alrededor del acueducto de Silvio (puntas de flecha). B) Imagen coronal de RM potenciada en T2-FLAIR en la que se identifica hiperintensidad de señal periventricular al tercer ventrículo (puntas de flecha). C y D) Imágenes transversal y sagital de RM con contraste intravenoso que muestran el realce bilateral de los cuerpos mamilares (puntas de flecha y flecha).
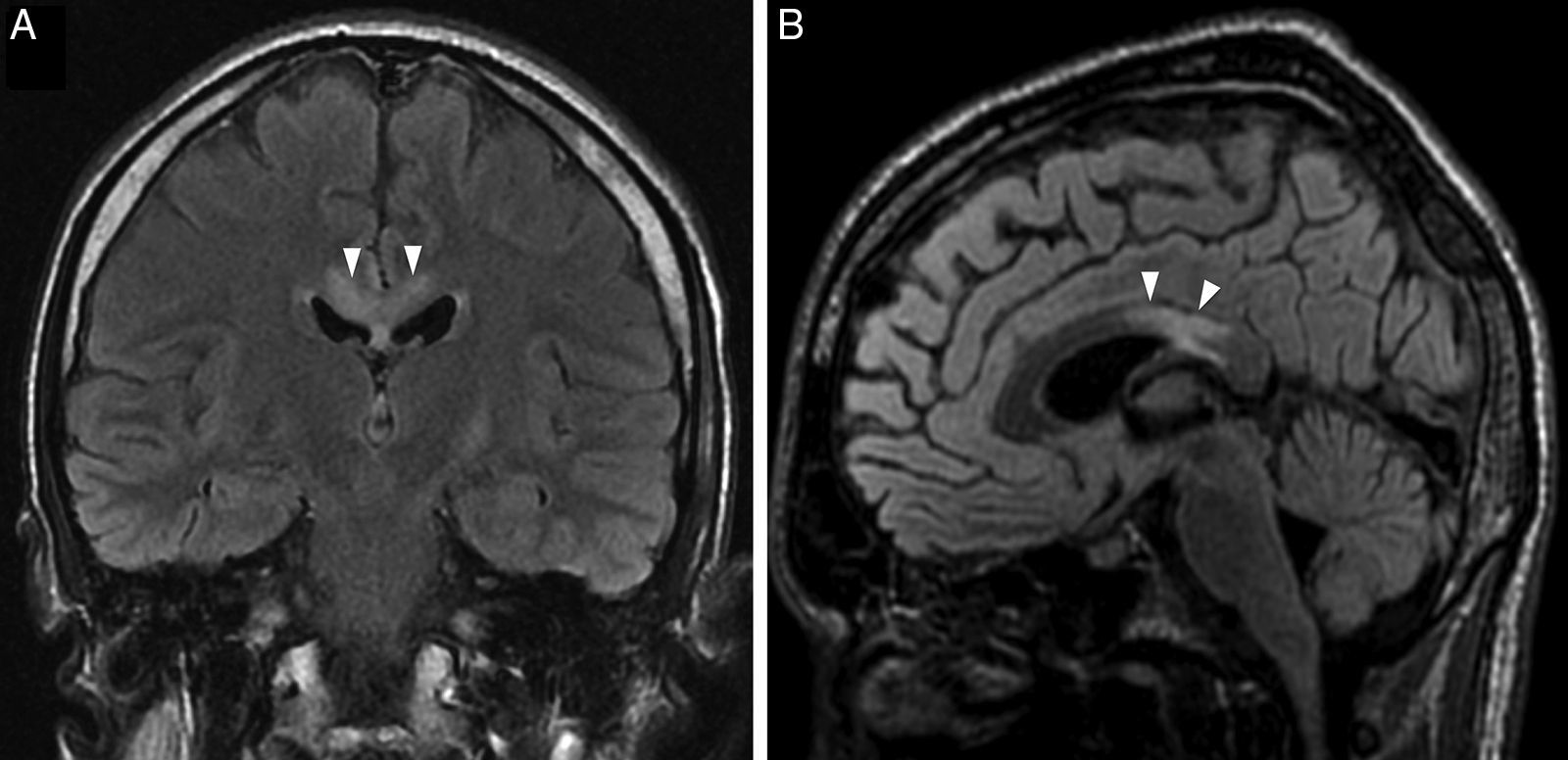
Otra manifestación del abuso crónico del alcohol es la enfermedad de Marchiafava-Bignami, que consiste en la desmielinización y necrosis del cuerpo calloso51,54. Se ha identificado un agente tóxico procedente del vino tinto que, conjuntamente con una deficiencia vitamínica, puede ser el causante del cuadro55. La afectación comienza en el tronco y puede extenderse a la rodilla y en ocasiones al esplenio51,54. La necrosis del cuerpo calloso se produce característicamente en tres capas (necrosis en capas), típica de esta de esta enfermedad. Existen dos subtipos: el A, en el cual existe afectación completa del cuerpo calloso, presenta mayor deterioro de la conciencia y conlleva peor pronóstico; y el B, en el cual la afectación del cuerpo calloso es parcial, presenta menor deterioro de la conciencia y la evolución es más favorable. La imagen por RM es especialmente importante debido a que la clínica es inespecífica. La hiperintensidad en T2/FLAIR sin efecto masa en la región central del cuerpo calloso es la presentación usual (fig. 9); puede realzarse periféricamente tras la administración de contraste en fase aguda55. La sustancia blanca en los hemisferios cerebrales también puede afectarse, hallazgo descrito hasta en un 40% de las necropsias de enfermos con enfermedad de Marchiafava-Bignami. La extensión al córtex, conocida como esclerosis laminar cortical de Morel, consiste en una gliosis de la tercera capa cortical en la región frontal y lateral56. En estudios de PET con FDG se ha corroborado un descenso metabólico en el córtex de asociación frontal y temporo-parieto-occipital, debido a la disrupción de fibras comisurales que alteran esta red de asociación51,57.
Hombre consumidor crónico de vino tinto con enfermedad de Marchiafava-Bignami en fase subaguda. A y B) Imágenes coronal y sagital de RM potenciada en T2-FLAIR que muestran la marcada hiperintensidad de la porción posterior del tronco del cuerpo calloso (puntas de flecha). No presentaba realce tras la administración de contraste.
La encefalopatía hepática crónica se produce por la inadecuada eliminación de compuestos nitrogenados y otras toxinas que se depositan en el parénquima cerebral. Los hallazgos por imagen de esta enfermedad serán prácticamente indetectables en la TC y en las secuencias potenciadas en T2 de la RM. En las secuencias potenciadas en T1 existe una hiperintensidad bilateral y simétrica, correspondiente a un depósito de manganeso, localizada en los ganglios de la base (en particular en los globos pálidos), los hipotálamos, el mesencéfalo y la adenohipófisis51 (fig. 10 online). El estudio con espectroscopía por RM obtenida con tiempo de eco corto es característico en pacientes con encefalopatía hepática crónica, que muestran un marcado descenso del mioinositol y de la colina, y un incremento de los picos de glutamina/glutamato51.
Por último, el alcoholismo crónico se asocia a pérdida neuronal y atrofia, especialmente del córtex frontal superior y motor, y a pérdida de volumen de la sustancia blanca, del puente, del tálamo, de los cuerpos mamilares y del cerebelo, con mayor afectación del vermis superior51. El uso concomitante del alcohol con otras drogas, en particular con cocaína, contribuye a una mayor pérdida de sustancia blanca, debido a la formación de un metabolito vasoactivo de larga duración, el cocaetileno, resultante de la coadministración de las dos sustancias11.
CannabisEl cannabis es la droga ilegal más consumida en todo el mundo58. Se obtiene de la Cannabis sativa, un vegetal dioico. El principal componente psicoactivo es una sustancia liposoluble denominada delta-9-tetrahidrocannabinol. Los productos que se obtienen del cannabis son la marihuana (preparado con hojas secas), el hachís (procedente de la resina) y el aceite de hachís (obtenido mediante destilación en disolventes orgánicos).
Todas las partes de la planta contienen delta-9-tetrahidrocannabinol. La forma más extendida de abuso es la marihuana fumada. La resina se usa en alimentos para ingesta oral; esta forma de administración es la que más intoxicaciones produce, porque el usuario no controla el lapso entre la ingestión y los efectos. El consumo crónico aumenta el riesgo de esquizofrenia y de cambios del comportamiento11.
Tras su consumo se obtiene una sensación de bienestar producida por la activación de los receptores cannabinoides CB1, presentes en la sustancia negra, el hipocampo, el córtex límbico y el cerebelo8,9.
Su amplio uso y el policonsumo son factores que dificultan establecer la conexión directa entre el cannabis y la enfermedad cerebrovascular9,58. Causa hipotensión ortostática, que en personas con escasa reserva sanguínea cerebral puede producir infartos cerebrales, siendo este el mecanismo principal de los accidentes cerebrovasculares isquémicos59 (fig. 11). Además de la hipotensión que actúa como desencadenante existen otras alteraciones vasculares predisponentes; en este sentido, se ha demostrado la presencia de estenosis intracraneales hasta en el 31% de los consumidores de cannabis que han desarrollado accidentes cerebrovasculares isquémicos60. El vasoespasmo, la vasculitis, el desarrollo de arritmias y las concentraciones elevadas de carboxihemoglobina son otros factores que predisponen a eventos cerebrovasculares adversos8,9,61,62. La localización de estos infartos isquémicos no es específica; predominan en los ganglios basales, la sustancia blanca periventricular, el cerebelo y los lóbulos temporales, parietales y occipitales.
Hombre de 38 años consumidor crónico de cannabis que presenta infartos isquémicos hipoperfusivos en el territorio frontera interno derecho. A) Imagen transversal de TC sin contraste intravenoso en la que se visualiza una zona de hipodensidad en la corona radiada derecha (flecha). B) Imagen transversal de RM potenciada en T2 en la cual los infartos son hiperintensos. C) Imagen transversal de RM en secuencia de difusión que muestra la restricción de los infartos y permite valorar la típica distribución lineal en el territorio frontera interno. Obsérvese la atrofia cortical, llamativa en un paciente de mediana edad (flechas).
Los estudios de perfusión con PET y SPECT constatan un incremento del flujo sanguíneo cerebral relativo con el consumo agudo63. Sin embargo, en los usuarios crónicos existe un descenso del flujo sanguíneo cerebral relativo generalizado que puede revertirse con la abstinencia31,58. El metabolismo de la glucosa en usuarios esporádicos está disminuido de forma generalizada excepto en el cerebelo, probablemente por la gran cantidad de receptores cannabinoides en esta área31.
ToluenoEl tolueno o metilbenceno es un hidrocarburo aromático usado en la industria como antidetonante en combustibles, como disolvente para pinturas y como diluyente en adhesivos, entre otros usos. Se utiliza como droga de abuso principalmente entre los adolescentes, debido a su bajo coste y amplia disponibilidad64. Se inhala y es fácilmente absorbido por los pulmones, desde donde difunde rápidamente a los tejidos con alta concentración lipídica, como el sistema nervioso central.
Los efectos agudos incluyen cambios en el comportamiento, euforia, cefalea y ataxia; durante esta fase no suele haber alteraciones estructurales identificables8. El consumo crónico causa lesiones irreversibles debidas al efecto tóxico acumulativo, y puede cursar clínicamente con disfunción cerebelosa, enfermedades psiquiátricas, espasticidad, cambios cognitivos y parkinsonismo secundario. En la RM se identifican lesiones en la sustancia blanca que comienzan en la región periventricular y con el tiempo se extienden a las fibras U; el grado de afectación se relaciona con la gravedad de los déficits neurológicos y del deterioro cognitivo64,65. Causa atrofia de la sustancia gris y blanca, sin un patrón de distribución específico. En estudios morfométricos se ha demostrado una pérdida de sustancia gris en múltiples localizaciones del córtex cerebral, y la pérdida de volumen en la corteza frontal y parietal se asocia con un mayor déficit cognitivo64. Con técnicas de espectroscopía se han encontrado valores bajos de N-acetil aspartato en la sustancia blanca por deterioro de la integridad neuroaxonal, aunque este hallazgo es de carácter inespecífico66. En estudios con SPECT se ha objetivado una alteración de la perfusión en el córtex de los lóbulos frontal, parietal y temporal; la hipoperfusión en la región prefrontal se relaciona con una mayor alteración del comportamiento67.
ConclusiónLas drogas constituyen un grave problema sociosanitario, pues tienen repercusiones importantes sobre el SNC a corto y largo plazo. Las complicaciones agudas principales son la isquemia y la hemorragia, cuya detección precoz y urgencia en el tratamiento son de especial relevancia para el pronóstico del paciente. En ocasiones, los hallazgos por imagen son específicos, como el perfil espectroscópico en la leucoencefalopatía por heroína, la hiperintensidad en T1 en la encefalopatía hepática crónica o la captación de contraste en los cuerpos mamilares en la encefalopatía de Wernicke. En la mayor parte de los casos, en cambio, el diagnóstico surge de la integración de la imagen con el contexto clínico, como el síndrome de encefalopatía posterior reversible en pacientes jóvenes sin otros factores de riesgo cardiovascular o la necrosis del pálido en adictos a la heroína o al MDMA (tabla 2 online). Las técnicas funcionales, como la PET y la perfusión con RM, desempeñan un papel cada vez más importante al demostrar efectos deletéreos que en algunas sustancias presentan especificidad espacial.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsables de la integridad del estudio: AMF y MM.
- 2.
Concepción del artículo: AMF y MM.
- 3.
Diseño del artículo: AMF y MM.
- 4.
Obtención de los datos: AMF y MM.
- 5.
Análisis e interpretación de los datos: No procede.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: AMF y MM.
- 8.
Redacción del trabajo: AMF y MM.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: AMF y MM.
- 10.
Aprobación de la versión final: AMF y MM.
Los autores declaran no tener ningún conflicto de intereses.