Suplemento “Patología Intersticial Pulmonar”
Más datosLas enfermedades inhalatorias son un grupo de entidades secundarias a la aspiración activa de partículas. La mayoría se produce en el ámbito laboral. Se clasifican en enfermedades ocupacionales (neumoconiosis y neumonitis química), neumonitis por hipersensibilidad y enfermedad pulmonar asociada al uso de cigarrillos electrónicos. En muchas ocasiones los hallazgos radiológicos son patrones intersticiales inespecíficos de difícil interpretación. Por lo tanto, es clave una evaluación global correctamente integrada en los equipos multidisciplinares, donde la radiología realizada por profesionales con experiencia desempeña un papel fundamental tanto en el diagnóstico y el manejo, como en las medidas de prevención, con repercusión importante sobre la salud global de los pacientes. Es fundamental tener en cuenta las posibles exposiciones tanto laborales como domésticas de los pacientes.
The term inhalational lung disease comprises a group of entities that develop secondary to the active aspiration of particles. Most are occupational lung diseases. Inhalational lung diseases are classified as occupational diseases (pneumoconiosis and chemical pneumonitis), hypersensitivity pneumonitis, and electronic-cigarette-associated lung diseases. The radiologic findings often consist of nonspecific interstitial patterns that can be difficult to interpret. Therefore, radiologists’ experience and multidisciplinary teamwork are key to ensure correct evaluation. The role of the radiologist is fundamental in preventive measures as well as in diagnosis and management, having an important impact on patients’ overall health. It is crucial to take into account patients’ possible exposure to particles both at work and at home.
Las enfermedades pulmonares inhalatorias se producen por la aspiración activa, a través de la nariz o de la boca, de partículas de diversos tamaños contenidas en el aire inspirado. Generalmente, las partículas con diámetros mayores de 5μm se depositan en el árbol bronquial y son expulsadas mediante el sistema mucociliar; las de menor tamaño alcanzan el espacio alveolar, desde donde se incorporan al intersticio pulmonar, son fagocitadas por los macrófagos y aparece la inflamación1.
La evolución o la gravedad de la enfermedad dependerán de la susceptibilidad individual, la solubilidad y tamaño de las partículas, la concentración en el aire, la duración de la exposición y de sus propiedades fibrogénicas.
Aunque la mayoría de estas exposiciones se producen en el ámbito laboral, también pueden ocurrir en el ámbito doméstico y recreativo.
Las pruebas de imagen junto con una minuciosa historia clínica desempeñan un papel fundamental para el diagnóstico de las enfermedades inhalatorias. A pesar de los avances en imagen, una gran proporción de los hallazgos vistos en estas enfermedades es inespecífico y el diagnóstico diferencial con el resto de las enfermedades intersticiales es complejo2. Un enfoque multidisciplinar con la participación de radiólogos con experiencia es clave en el diagnóstico y el manejo de estas entidades3,4. Estos equipos multidisciplinares favorecen que se puedan aplicar medidas preventivas precoces, con repercusión sobre la salud global y con un importante impacto económico5.
En este trabajo revisamos los distintos tipos de enfermedades inhalatorias: 1) las enfermedades ocupacionales (que incluyen las neumoconiosis y la neumonitis química secundaria a la inhalación de gases irritantes); 2) la neumonitis por hipersensibilidad (NH) (que, aunque en muchos casos está relacionada con exposiciones laborales, también puede tener su origen en exposiciones domésticas), y 3) la enfermedad pulmonar asociada al uso de cigarrillos electrónicos (entidad de reciente aparición).
Enfermedades ocupacionalesExisten múltiples enfermedades pulmonares secundarias a la exposición a polvo inorgánico, agentes biológicos y gases tóxicos en el ámbito laboral. Las enfermedades pulmonares ocupacionales más comunes incluyen el asma ocupacional, la NH, la neumoconiosis, las neumonitis químicas por inhalación de gases tóxicos y los tumores.
Después de los accidentes, la patología pulmonar es la enfermedad profesional más frecuentemente diagnosticada6 y dentro de ellas las neumoconiosis secundarias a la inhalación de polvos inorgánicos son las enfermedades ocupacionales pulmonares más habituales. Es característico el largo periodo de latencia, tras años e incluso décadas, desde la exposición hasta la aparición de la sintomatología o las alteraciones radiológicas.
NeumoconiosisLas neumoconiosis son un grupo de enfermedades causadas por la inhalación y el depósito de polvo inorgánico en los pulmones y las reacciones debidas a su presencia. Las neumoconiosis se pueden subdividir en fibrogénicas (sílice, carbón, talco, amianto), benignas o inertes (hierro, estaño, bario), granulomatosas (berilio) y la neumonía de células gigantes asociada con la inhalación de metales duros (cobalto)2,3.
Las neumoconiosis se diagnostican en base a la historia laboral, la radiografía de tórax y las pruebas de función pulmonar.
La radiografía de tórax es la prueba inicial de imagen y la técnica utilizada en los controles periódicos preventivos que se deben realizar a todos los trabajadores expuestos. Sin embargo, es una técnica poco sensible y específica. La tomografía computarizada (TC) de alta resolución (TCAR) tiene una mayor sensibilidad y especificidad, y caracteriza mejor el patrón de afectación parenquimatosa, la enfermedad de la vía aérea y las anomalías pleurales7-10.
A pesar de estas ventajas, en general, no se usa la TC como modalidad de detección primaria para la neumoconiosis, debido a su mayor coste, menor accesibilidad y mayor dosis de radiación en comparación con la radiografía de tórax. La TC se usa comúnmente como una modalidad de detección secundaria en los trabajadores sintomáticos o cuando la radiografía de tórax es equívoca11–13.
La valoración médico-legal en España se basa fundamentalmente en los criterios radiológicos y no en la limitación funcional. La legislación española obliga, en los trabajadores expuestos, a la realización de radiografías de tórax posteroanterior y lateral periódicas, y con un informe radiológico según la clasificación de la Organización Internacional del Trabajo (International Labour Organization [ILO])14.
Esta clasificación codifica las alteraciones en la radiografía de tórax de las neumoconiosis15 de una forma sencilla y reproducible16. Fue desarrollada originalmente con fines epidemiológicos, pero en la actualidad se utiliza en los exámenes periódicos que se les realizan a los trabajadores expuestos. No define las entidades patológicas ni valora las incapacidades laborales. No conlleva definiciones legales de neumoconiosis ni compensaciones laborales ni económicas. No existen hallazgos radiológicos patognomónicos de neumoconiosis17.
La clasificación de la ILO se divide en 5 apartados:
- 1.
Calidad técnica de la radiografía: 1: buena; 2: aceptable; 3: baja calidad, y 4: inaceptable.
- 2.
Alteraciones parenquimatosas: atendiendo al tamaño, la profusión, la forma y la localización (fig. 1).
Figura 1.Pequeñas opacidades ≤ 10mm. La ILO hace referencia al tamaño y forma de estas lesiones, R, redondeadas e I, irregulares. Se codifican con una letra según su forma y tamaño. También debe indicarse la localización de las lesiones dentro de cada pulmón (superior, intermedia o inferior) y la profusión de las mismas.
(0.06MB). - –
Pequeñas opacidades: se describen según su profusión, campos pulmonares afectados, forma y tamaño.– Grandes opacidades: se definen como opacidades con un diámetro mayor de 10mm. Existen 3 categorías: A (de 10 a 50 m), B (entre 50mm y el campo superior derecho del pulmón) y C (cuando miden más que el campo superior derecho).
- 3.
Alteraciones pleurales.
- 4.
Símbolos: describen hallazgos adicionales codificados (por ejemplo «aa» indica aorta aterosclerótica o «bu» indica la presencia de bullas).
- 5.
Comentarios libres, no incluidos en la lectura anterior.
Se han propuesto sistemas similares a la clasificación ILO para los hallazgos de la TC en las enfermedades profesionales, como la International Classification of HRCT for Occupational and Environmental Respiratory Diseases (ICOERD)9,10,14,18.
SilicosisLa silicosis es una enfermedad fibrótica del pulmón causada por la inhalación de sílice cristalina (SiO2). Por lo general, se requiere una exposición de 10 a 20 años al polvo de sílice para la aparición de las alteraciones radiológicas.
A pesar de que su incidencia ha disminuido, sigue siendo la neumoconiosis más frecuente. Además, han aparecido nuevos materiales, como el cuarzo artificial (compuesto por un 90% de sílice), que han aumentado su incidencia en determinados ámbitos.
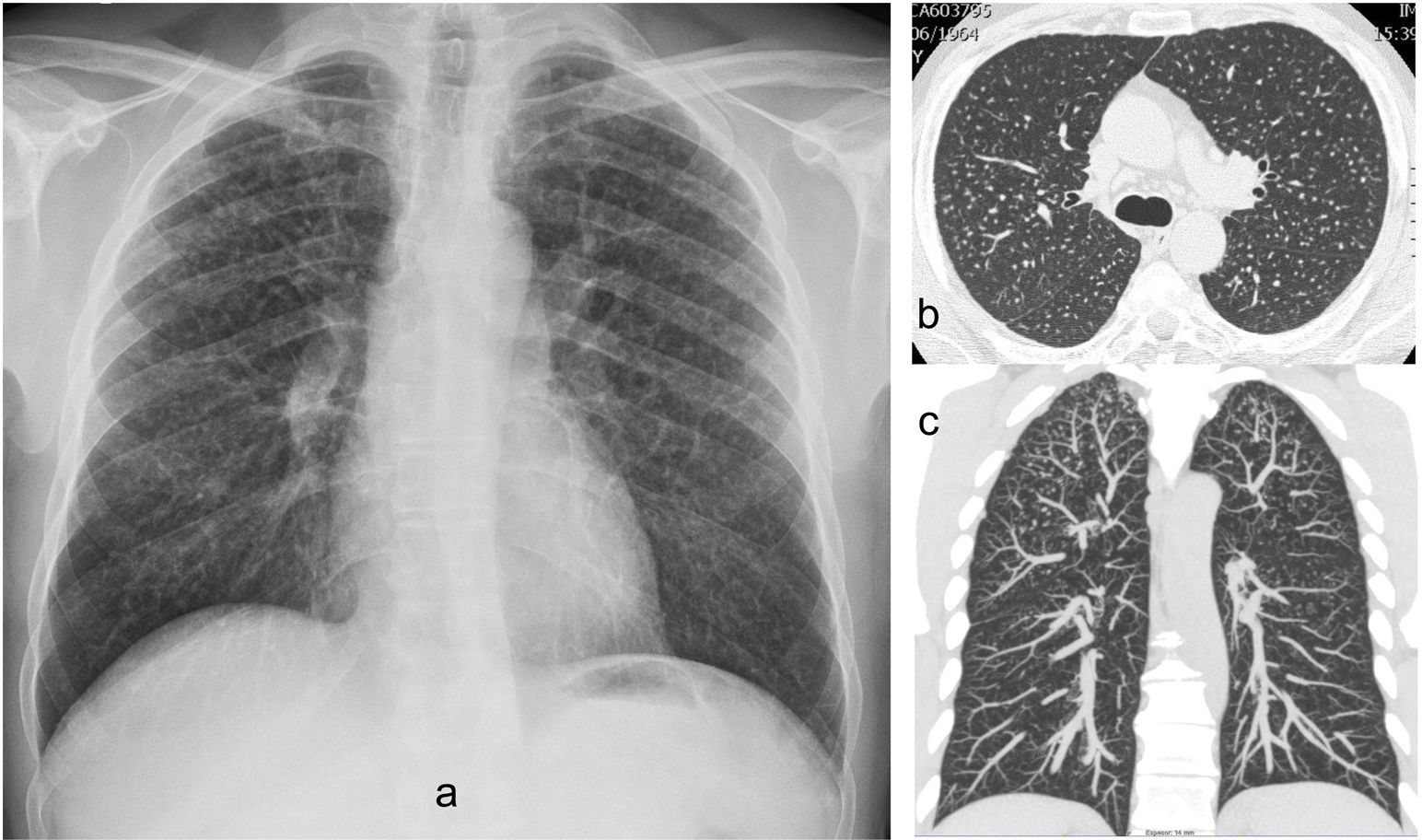
Existen 3 formas de presentación: la aguda, la crónica y la acelerada o rápidamente progresiva. La forma más habitual es la silicosis crónica, que se desarrolla después de años de exposición a niveles relativamente bajos de polvo. La manifestación radiológica clásica de la silicosis crónica en la radiografía de tórax es la presencia de un patrón micronodular difuso y bilateral, con mayor afectación de los lóbulos superiores y de las zonas posteriores del pulmón. En general, los nódulos son redondeados y relativamente bien definidos, y pueden calcificar en el 10-20% de los casos (fig. 2).
Silicosis crónica simple. a) Radiografía de tórax posteroanterior con un patrón micronodular bilateral y difuso con nódulos de bordes bien definidos con una mayor profusión en los campos superiores. b) TCAR con nodulillos centrolobulillares y subpleurales. c) TC con reconstrucción coronal y proyección de máxima intensidad, donde se aprecia el predominio característico de los nódulos en los lóbulos superiores.
Se denomina silicosis simple cuando los nódulos tienen un diámetro de 1-10mm. La silicosis complicada se define cuando existen opacidades con un diámetro mayor de 10mm. Estos conglomerados, denominados masas de fibrosis masiva progresiva (FMP), están formados por la confluencia de nódulos silicóticos. Suelen situarse en la zona media y superior del pulmón de forma bilateral (fig. 3), aunque en ocasiones pueden localizarse en las zonas inferiores e incluso ser unilaterales. Las FMP tienen tendencia a migrar hacia los hilios pulmonares y presentan, típicamente, un borde externo convexo de márgenes bien definidos, que les confiere una morfología que se describe como «en alas de ángel» (fig. 4a). Es habitual la presencia de adenopatías hiliares y mediastínicas, que pueden estar calcificadas, presentando una morfología característica «en cáscara de huevo» (fig. 4a y b); las adenopatías calcificadas pueden presentarse incluso en localizaciones extratorácicas.
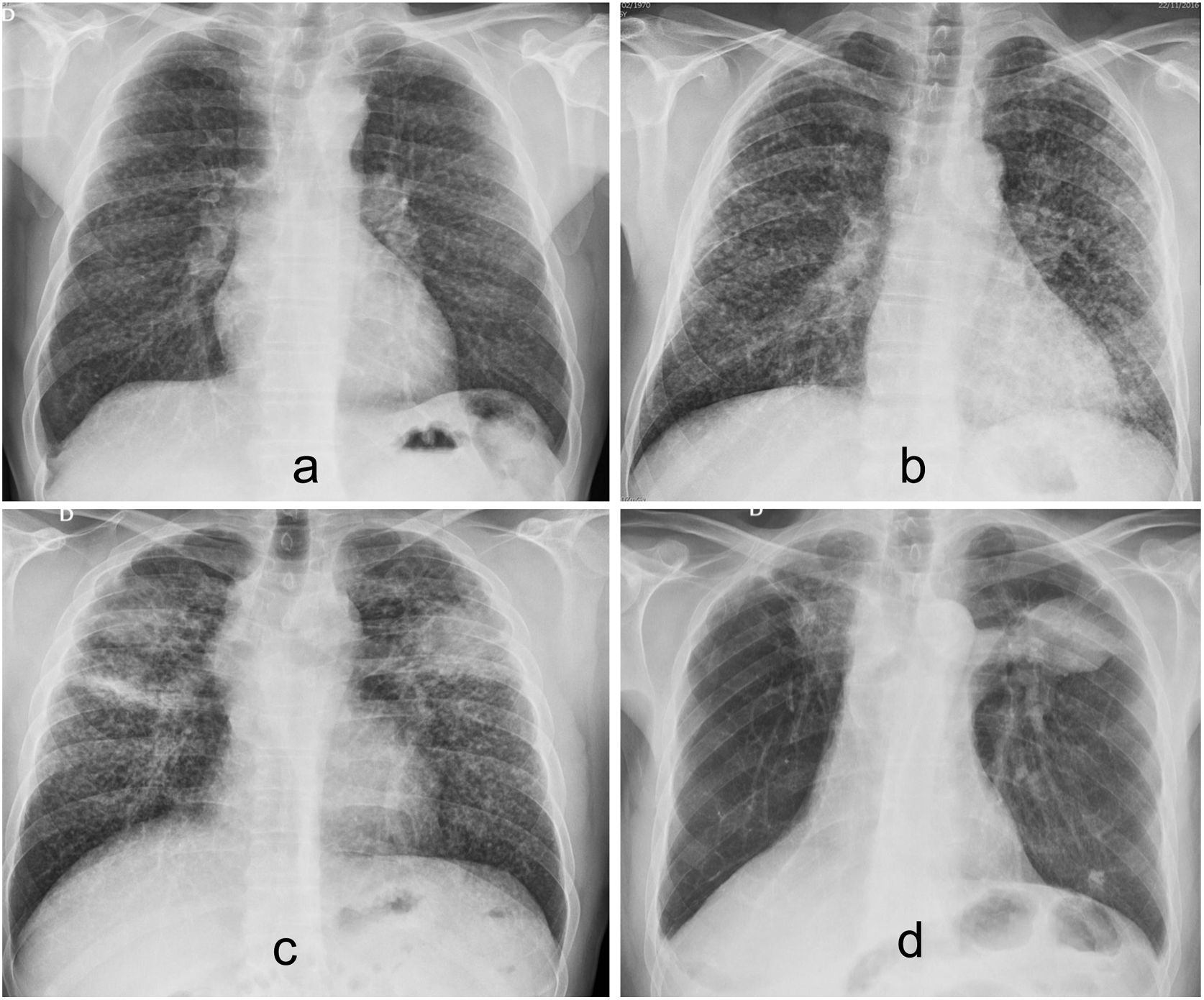
Evolución de la silicosis crónica en radiografías de tórax quinquenales de un mismo paciente. a) Patrón micronodular. b) Conglomeración formando nódulos de mayor tamaño. c) Masas de fibrosis masiva progresiva perihiliares bilaterales. d) Pérdida de volumen y enfisema paracicatricial.
Silicosis complicada. a) Radiografía de tórax posteroanterior: grandes masas de FMP perihiliares con pérdida de volumen de los lóbulos superiores, con morfología en «alas de ángel» (flechas blancas). Adenopatías mediastínicas e hiliares con calcificación «en cáscara de huevo». b) TCAR: calcificaciones en las masas de FMP y ganglionares. c) TCAR: enfisema paracicatricial que dejan los nódulos en su migración hacia las zonas perihiliares (flechas negras).
Los hallazgos característicos de la silicosis en la TCAR consisten en nódulos de pequeño tamaño y contornos bien definidos que pueden calcificarse, con tendencia a situarse en los campos pulmonares superiores y posteriores, con una distribución perilinfática y localización centrolobulillar y subpleural. La confluencia de nódulos subpleurales da lugar a una morfología en forma de seudoplacas. Las masas de FMP presentan una densidad de partes blandas que pueden presentar calcificaciones asociadas o zonas necróticas de menor densidad en su interior y distorsión de la arquitectura broncovascular adyacente, con zonas de enfisema paracicatricial periférico entre las masas de fibrosis y la superficie pleural (fig. 4b y c).
En un 10% de los pacientes con silicosis de larga evolución puede aparecer una neumonía intersticial fibrosante lentamente progresiva, con un patrón típico de neumonía intersticial usual, la llamada fibrosis pulmonar relacionada con el polvo19,20. En pacientes con silicosis complicada puede existir enfermedad pleural caracterizada por engrosamiento y derrame21.
La segunda forma de presentación es la silicosis aguda o silicoproteinosis. Es una manifestación poco frecuente de la enfermedad, con un cuadro agudo y progresivo que se desarrolla meses después de la exposición a concentraciones elevadas de sílice en cortos periodos22. Se da con frecuencia en los operarios que trabajan con chorros de arena23.
En las radiografías se pueden observar consolidaciones perihiliares bilaterales, similares al edema pulmonar o a la proteinosis alveolar. En la TCAR se observa un patrón difuso en vidrio deslustrado o consolidaciones del espacio aéreo, sin presencia de un patrón micronodular24,25.
La tercera forma de presentación es la silicosis acelerada o rápidamente progresiva, que suele aparecer tras 5-10 años de exposición, tiene una rápida progresión y suele asociarse con la exposición a concentraciones elevadas de sílice. Las características radiológicas, clínicas y patológicas son iguales a las de las formas crónicas, aunque predominan los nódulos de mayor tamaño tipo «r» de la clasificación de la ILO y evolucionan a FMP en unos 5 años (fig. 5).
En cuanto al diagnóstico diferencial, los hallazgos radiológicos de la silicosis pueden ser similares a los de la tuberculosis miliar, la linfangitis carcinomatosa, la microlitiasis alveolar, la sarcoidosis, la fibrosis pulmonar idiopática, la hemosiderosis y algunas infecciones respiratorias. En algunos casos el diagnóstico diferencial es difícil, y puede requerir la obtención de una muestra histológica.
No está claramente establecido el papel de la tomografía por emisión de positrones con F-18 fluorodesoxiglucosa (FDG) en la evaluación de las masas de FMP y están descritas intensas captaciones de FDG en las masas fibróticas y en las adenopatías simulando un proceso neoplásico26.
La silicosis predispone a presentar tuberculosis, sobre todo en pacientes con silicosis complicada. Esta asociación común de tuberculosis con silicosis se encuentra en hasta el 25% de los trabajadores. Además, la tuberculosis agrava las manifestaciones de la silicosis. La silicotuberculosis se debe sospechar cuando se observa un aumento considerable de la profusión o del tamaño de las lesiones, cuando se cavitan las masas de FMP o cuando se identifica un patrón en «árbol en brote» (fig. 6).
La sílice ha sido reconocida como agente carcinogénico por la International Agency for Reseach on Cancer en 1997. La asociación con el cáncer de pulmón es mayor en aquellos pacientes con silicosis establecida que en los pacientes únicamente expuestos27. Puede ser difícil diferenciar las masas de FMP de las lesiones neoplásicas y en ocasiones es necesario realizar biopsia percutánea guiada por TC.
La inhalación de sílice también causa enfisema y bronquitis crónica, incluso en ausencia de hábito tabáquico28.
Neumoconiosis de los mineros del carbónLa neumoconiosis del trabajador del carbón (NMC) resulta de la inhalación y el depósito de partículas de polvo de carbón. Además, el polvo de la mina de carbón puede contener altas concentraciones de sílice29.
Su incidencia ha disminuido de forma importante en nuestro país ya que, actualmente, apenas existen minas de carbón en activo en España.
Desde un punto de vista histológico, la NMC y la silicosis son 2 enfermedades diferentes, aunque los hallazgos radiológicos son superponibles4,30.
Las únicas diferencias son que los nódulos de la NMC presentan unos márgenes peor definidos y la calcificación de los ganglios linfáticos es menos frecuente que en la silicosis31.
El síndrome de Caplan es una complicación poco común de la NMC que se presenta simultáneamente con manifestaciones articulares de la artritis reumatoide. En este trastorno, se desarrollan nódulos pulmonares periféricos con la histopatología de los nódulos reumatoides sobre un fondo de opacidades neumoconióticas. Radiológicamente, estos trabajadores desarrollan nódulos y masas periféricos típicamente bilaterales de 5mm a 5cm de tamaño. A diferencia de las masas neumoconióticas, pueden desarrollarse rápidamente en un período de semanas y pueden cavitarse o calcificarse.
AsbestosisEl amianto o asbesto es un silicato de magnesio fibroso natural que se utiliza como aislante térmico. La exposición ocupacional suele producirse con trabajos de aislamiento, siderurgia, frenos, construcción naval y de edificios, y en la industria textil. Se han descrito casos de exposición no ocupacional, entre los miembros del hogar de los trabajadores expuestos al asbesto.
Las manifestaciones clínicas no aparecen habitualmente hasta 20 años después del inicio de la exposición. A pesar de que su uso está prohibido en Europa desde el año 2004, siguen identificándose múltiples casos de patologia asociada al asbesto.
La exposición crónica al amianto puede producir distintas enfermedades, tanto en la pleura como en los pulmones. En la pleura podemos encontrar derrame pleural, placas pleurales, engrosamiento pleural difuso o mesotelioma. Las entidades pulmonares asociadas al amianto son la atelectasia redonda, la asbestosis y el cáncer de pulmón.
La asbestosis es una fibrosis intersticial secundaria a la exposición al asbesto. En la fase inicial de la enfermedad, la radiografía de tórax muestra un patrón intersticial de tipo retículo-nodular y de predominio basal. Dado que, en las formas leves, las lesiones predominan en las porciones pulmonares posterobasales, y para evitar la posible confusión con el edema gravitacional fisiológico, debería realizarse una TCAR con el paciente en decúbito prono.
Los hallazgos en la TCAR incluyen engrosamientos septales subpleurales, inter e intralobulillares, líneas curvilíneas subpleurales, bandas parenquimatosas con morfología en «patas de cuervo», patrón en «panal de abeja» y bronquiectasias por tracción (fig. 7).
Más del 90% de los casos de asbestosis presentan alteraciones pleurales visibles en la TC, lo que resulta útil a la hora de plantear el diagnóstico diferencial entre la asbestosis y otras enfermedades difusas pulmonares.
Neumoconiosis por metales durosLa aleación de metales duros está formada por wolframio y cobalto. Afecta, entre otros, a pulidores de diamantes.
La radiología de tórax puede ser normal o evidenciar un patrón intersticial difuso. En la TC los hallazgos son similares a los observados en la sarcoidosis y en la fibrosis pulmonar idiopática con un patrón retículo-nodular difuso, áreas en vidrio deslustrado, panalización, bronquiectasias por tracción y adenopatías26,28. A diferencia de lo que ocurre en otras neumoconiosis, los hallazgos radiológicos pueden desaparecer lentamente si cesa la exposición.
Neumoconiosis por polvo benigno o inerteEstas neumoconiosis se producen por inhalación de óxido de hierro (siderosis), óxido de estaño (estañosis) o sulfato de bario (baritosis). La exposición a estos polvos inertes no produce efectos nocivos evidentes en la estructura y la función del pulmón; solo se observa una leve reacción estromal32.
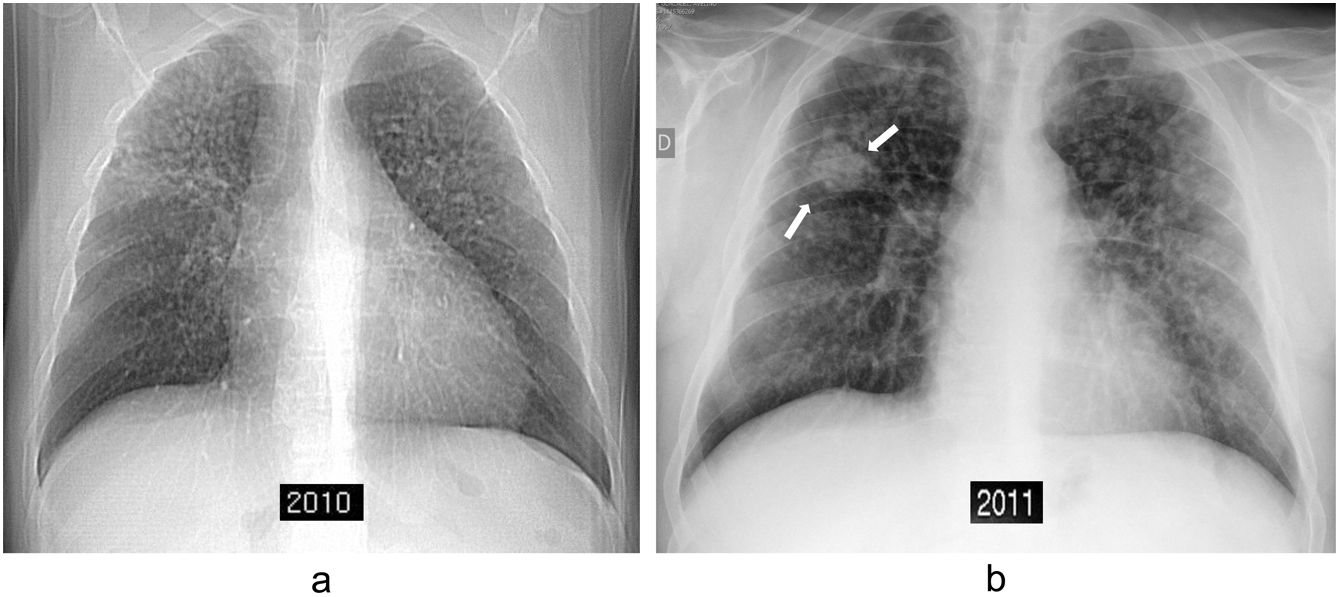
La siderosis, también conocida como pulmón del soldador, se debe a la inhalación de óxido de hierro en forma de humo. Se asocia a bronquitis crónica, neumoconiosis y carcinoma de pulmón. La radiografia de tórax muestra pequeños nódulos en los campos pulmonares medios y zonas perihiliares. Dichas alteraciones desaparecen al cesar la exposición.
En la TCAR se identifican micronódulos de localización centrolobulillar, contornos mal definidos y distribución difusa en los campos pulmonares. En algunos casos, los nódulos adquieren una morfología ramificada («árbol en brote») (fig. 8). Con menos frecuencia se pueden observar áreas en vidrio deslustrado, zonas de panalización o enfisema33,34.
Siderosis. a) Radiografía de tórax posteroanterior: patrón retículo-nodular en los lóbulos superiores y regiones perihiliares. b) TCAR: patrón micronodular de distribución peribroncovascular de predominio en los lóbulos superiores (flechas finas) y nódulos centroacinares en vidrio deslustrado (flechas gruesas).
El berilio se usa en la odontología, la electrónica, la industria nuclear y la industria aeroespacial. La beriliosis es una granulomatosis por hipersensibilidad al polvo inorgánico del berilio mediada por células T. La radiografía de tórax suele ser normal, pero puede presentar un patrón retículo-nodular de predominio en campos medios y superiores (fig. 9 a). En la TCAR los hallazgos son similares a los de la sarcoidosis, con pequeños nódulos parenquimatosos de localización peribroncovascular y en los septos interlobulillares (fig. 9b).
Otros hallazgos menos frecuentes son un patrón en vidrio deslustrado, presencia de panalización y engrosamiento de las paredes bronquiales. También pueden existir adenopatías mediastínicas e hiliares35.
Neumonitis químicaLos gases irritantes se disuelven en el agua de la mucosa de las vías respiratorias condicionando una respuesta inflamatoria, habitualmente secundaria a los radicales ácidos o alcalinos. La exposición a estos gases irritantes afecta predominantemente a la vía aérea causando traqueítis, bronquitis y bronquiolitis. Algunos de estos gases pueden ser tóxicos directamente (p. ej., cianuro, monóxido de carbono, perfluoroisobuteno) o indirectamente por desplazamiento del oxígeno y la consecuente hipoxia (p. ej., metano, monóxido de carbono).
Los hallazgos en la radiografía de tórax consisten en consolidaciones parcheadas o confluyentes secundarias al edema pulmonar (fig. 10).
Neumonitis química por inhalación accidental de monóxido de carbono. a) Radiografía de tórax anteroposterior: consolidaciones pulmonares bilaterales de predominio en las regiones perihiliares y los campos superiores. b) TCAR: patrón en vidrio deslustrado bilateral con afectación de las zonas posteriores, con reticulación y pequeñas consolidaciones pulmonares superpuestas.
La TC se puede utilizar en pacientes que desarrollan los síntomas de manera tardía respecto a la exposición, visualizándose bronquiolitis obliterante con patrón en mosaico con opacidades en vidrio deslustrado, engrosamiento de la pared bronquial y bronquiectasias36.
Neumonitis por hipersensibilidadLa NH, también conocida como alveolitis alérgica extrínseca, es una enfermedad granulomatosa intersticial pulmonar ocasionada por la inhalación de micropartículas orgánicas o inorgánicas16,37 de un tamaño entre 1 y 5μm (tabla 1).
Antígenos relacionados con las neumonitis por hipersensibilidad más comunes
| Tipo de antígeno | Antígeno específico | Enfermedad |
|---|---|---|
| Bacterias | Thermoactinomyces vulgarisStreptomyces thermohygroscopicusThermoactinomyces candidus | Pulmón del cultivador de setasPulmón del granjeroNeumonitis del aire acondicionado |
| Hongos | Penicillun spp.Acremonium strictumAspergillus fumigatus | Suberosis (cortadores de corcho)Pulmón del carpinteroEnfermedad del cuidador de aves |
| Micobacterias | Mycobacterium avium | Pulmón del jacuzzi |
| Proteínas | Inmunoglobulina AAlgodónPlumas de ave | Enfermedad del cuidador de avesBisinosisPulmón del edredón de plumas |
| Productos químicos | IsocianatoMezcla de Burdeos | Pulmón de isocianatoPulmón del rociador de viñedos |
El número de agentes es muy elevado, siendo en la mayoría de los casos material inhalado contaminado con hongos, bacterias y protozoos. También isocianatos de pinturas, espumas y adhesivos. Constantemente se están añadiendo nuevos agentes como causa de neumonitis por hipersensibilidad.
Únicamente un pequeño porcentaje de personas expuestas al antígeno desarrollarán NH (del 5 al 15%)38 y en el 40% de pacientes el antígeno causante es desconocido39.
Es más frecuente en mujeres de mediana edad y en no fumadores, y representa del 1,5 al 13% de las enfermedades pulmonares intersticiales.
Los antígenos inhalados provocan, en individuos susceptibles y previamente sensibilizados, una reacción inflamatoria granulomatosa alveolar y de la vía aérea distal, con linfocitosis alveolar (sobre todo de linfocitos CD8), así como activación de macrófagos alveolares37.
La lista cada vez mayor de antígenos se puede dividir en 3 grandes grupos: agentes microbiológicos, proteínas y agentes químicos.
Clásicamente se distinguen 3 formas de presentación40: aguda, subaguda y crónica.
Los hallazgos clínicos, los radiológicos y los anatomopatológicos pueden superponerse y no guardan relación con el pronóstico de la enfermedad41. Debido a esto se ha propuesto una nueva clasificación en función de la presencia o no de fibrosis, que es el factor determinante del pronóstico16,37:
- -
NH inflamatoria (no fibrótica): se desarrolla en pocas semanas; es reversible en la mayoría de los pacientes y tiene un buen pronóstico.
- -
NH fibrótica: se desarrolla a lo largo de meses; las alteraciones progresan a fibrosis y tiene peor pronóstico.
En general existe una falta de consenso con respecto a los criterios diagnósticos y se requiere de un enfoque multidisciplinario que involucre a clínicos, radiólogos y patólogos16.
Con una historia de exposición antigénica y excluyendo otras enfermedades intersticiales, como la fibrosis pulmonar idiopática o las enfermedades autoinmunes, unos hallazgos radiológicos compatibles son suficientes para hacer el diagnóstico de NH fibrótica16,42, evitando así la necesidad de pruebas invasivas.
El proceso histopatológico consiste en una inflamación de los bronquiolos, del tejido peribronquiolar y de los alvéolos43.
En la NH fibrótica existen cambios fibróticos superpuestos a los hallazgos de la fase inflamatoria44.
La radiografía de tórax tiene una utilidad limitada ya que hasta en el 20% de los pacientes no presenta anomalías45. Cuando existen, los hallazgos más comunes son opacidades en vidrio deslustrado parcheadas o difusas, un patrón nodular o retículo-nodular con relativa preservación de las bases pulmonares. Más raramente pueden observarse consolidaciones alveolares.
En la NH inflamatoria la TC puede ser normal o mostrar pequeños nódulos (< 5mm) de atenuación en vidrio deslustrado, centrolobulillares (fig. 11), o bien nódulos de distribución aleatoria, que incluso pueden simular un patrón miliar y áreas de atrapamiento aéreo de predominio en campos medios y superiores, aunque la afectación también puede ser difusa46.
Neumonitis por hipersensibilidad. a) Radiografía de tórax posteroanterior: tenue patrón micronodular difuso bilateral. b) TCAR: nódulos centrolobulillares en vidrio deslustrado, de bordes mal definidos bilaterales (flechas negras), que alternan con áreas parcheadas de menor atenuación (flechas blancas) que configuran un «patrón en mosaico».
Se debería incluir una TC espiratoria en el protocolo de estudio de estos pacientes para evaluar el atrapamiento aéreo (áreas focales de pulmón cuya atenuación no aumenta con la espiración).
En las imágenes inspiratorias se puede identificar un patrón en mosaico47 (áreas bien delimitadas de atenuación pulmonar variable). Estos hallazgos dan lugar al signo de «cabeza de jabalí», aunque en las guías recientes37 se ha sustituido esta denominación por la de patrón de «3 densidades» (fig. 12a), que consiste en una combinación de opacidades en vidrio deslustrado, áreas hipodensas e hipovascularizadas (secundarias a la obstrucción de la pequeña vía aérea) y áreas de pulmón relativamente respetado con una delimitación geográfica abrupta48,49. Menos frecuentemente pueden aparecer quistes de paredes delgadas, con un diámetro inferior a 15mm50.
Neumonitis por hipersensibilidad inflamatoria (a) y fibrótica (b) de 2 pacientes diferentes. a) TCAR en inspiración: lesiones parcheadas con densidad en vidrio deslustrado junto a otras áreas geográficas de menor atenuación y otras de pulmón normal (patrón de «3 densidades»). b) TCAR: reticulación irregular, bronquiectasias por tracción, patrón en «panal de abeja» y «patrón en mosaico». Tiene una distribución tanto central como periférica.
No hay engrosamiento septal ni distorsión arquitectural. En el mediastino pueden aparecer ganglios aumentados de tamaño.
En la NH fibrótica (fig. 12b) se aprecian reticulaciones irregulares con distorsión de la arquitectura pulmonar, bronquiectasias por tracción y panalización, clásicamente con distribución tanto central como periférica, y predominantemente en campos superiores y medios46,51. Pueden existir pequeños nódulos centrolobulillares, atenuación en mosaico y atrapamiento aéreo48.
El diagnóstico diferencial de la NH inflamatoria es con la bronquiolitis respiratoria, las infecciones atípicas y la hemorragia alveolar, entre otras. En la NH fibrótica el diagnóstico diferencial debe hacerse con la fibrosis pulmonar idiopática y la neumonía intersticial no específica51.
Patología pulmonar asociada al uso de cigarrillos electrónicosEl uso de cigarrillos electrónicos es reciente (2006), con un incremento exponencial en su consumo, especialmente extendido entre jóvenes y adolescentes. Estos dispositivos vaporizan un líquido compuesto por una mezcla de sustancias químicas52, entre las que suelen incluirse nicotina, propilenglicol, glicerina, saborizantes y otros componentes orgánicos. También se pueden usar para administrar tetrahidrocannabinol. Estos productos causan daño vascular, disfunción endotelial y daño pulmonar agudo denominado Electronic Cigarette or Vaping Product Use-associated Lung Injury (EVALI)52,53. El diagnóstico de EVALI es de exclusión y precisa del antecedente de uso de cigarrillos electrónicos en los 90 días anteriores al comienzo de los síntomas, de la presencia de infiltrados pulmonares en la radiografía de tórax o en la TC, la ausencia de infección en la evaluación inicial y no evidencia de otros diagnósticos alternativos. Asocia una clínica con síntomas inespecíficos, similares a los que se presentan en una infección vírica y el pronóstico es peor en pacientes de mayor edad.
Se han descrito varios patrones radiológicos asociados a EVALI, los más representativos y frecuentes son la neumonía organizada y el daño alveolar difuso (DAD), siendo menos habituales la neumonía eosinófila aguda y la hemorragia alveolar52.
En la neumonía organizada en la radiografía de tórax los pacientes presentan opacidades difusas más pronunciadas en zonas centrales (fig. 13a). También se pueden observar líneas B de Kerley. En la TC se aprecian opacidades en vidrio deslustrado difusas, bilaterales y simétricas (fig. 13b), con preservación del espacio subpleural, engrosamiento septal interlobulillar y un patrón en empedrado.
EVALI. a) Radiografía de tórax posteroanterior: múltiples infiltrados alvéolo-intersticiales bilaterales. b) TCAR: opacidades parcheadas en vidrio deslustrado con engrosamiento septal conformando un patrón en empedrado con mayor afectación en campos medios e inferiores. Mínimo derrame pleural izquierdo.
Los pacientes con DAD presentan clínica y radiológicamente un mayor grado de gravedad, requiriendo frecuentemente ventilación invasiva.
Durante la fase aguda del DAD, la radiografía de tórax y la TC pueden mostrar una pérdida de volumen, con consolidaciones de predominio en lóbulos inferiores y áreas en vidrio deslustrado, engrosamiento septal o patrón en empedrado.
ConclusiónLas enfermedades inhalatorias se producen fundamentalmente en el ámbito laboral, aunque también pueden ocurrir en el ámbito doméstico y recreativo. La radiología desempeña un papel determinante en el diagnóstico y el manejo de estas entidades, pero en muchas ocasiones los hallazgos son inespecíficos, por lo que es fundamental el enfoque multidisciplinar para valorar al paciente desde una visión global, teniendo siempre en cuenta sus antecedentes laborales. La participación del radiólogo en los comités multidisciplinares es fundamental al ayudar a realizar un diagnóstico precoz y a mejorar el manejo del paciente y la puesta en práctica de las medidas preventivas adecuadas.
AutoríaTodos los autores han contribuido de manera sustancial en la elaboración de los distintos apartados de este capítulo sobre «Enfermedades inhalatorias pulmonares», revisión bibliográfica, selección de imágenes, la concepción y diseño del trabajo, la elaboración del borrador, la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
- 1.
Responsable de la integridad del estudio:
- 2.
Concepción del estudio:
- 3.
Diseño del estudio:
- 4.
Obtención de los datos:
- 5.
Análisis e interpretación de los datos:
- 6.
Tratamiento estadístico:
- 7.
Búsqueda bibliográfica:
- 8.
Redacción del trabajo:
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes:
- 10.
Aprobación de la versión final:
Los autores declaran no tener ningún conflicto de intereses.