La espectroscopia por resonancia magnética (ERM) es una técnica no invasiva basada en el fenómeno de resonancia magnética nuclear (RMN), que valora las características bioquímicas de los tejidos. De esta manera, proporciona información metabólica, complementaria a la información anatómica obtenida con los estudios convencionales, y ofrece al radiólogo la posibilidad de trabajar con un tipo de información de la que no disponía anteriormente. Ello conlleva ventajas y desventajas. La principal ventaja es que disponer de información adicional puede ayudar, en determinadas circunstancias, a acotar el diagnóstico, máxime teniendo en cuenta que aborda el problema desde un punto de vista totalmente diferente (metabólico frente a morfológico). La principal desventaja es que se trata de un tipo de información con la que los radiólogos no estamos habituados a trabajar. Extraer información de gráficos complejos y analizarla pensando en términos de bioquímica y metabolismo puede resultar «farragoso». No obstante, el radiólogo es un componente imprescindible en el equipo que ha de trabajar en el terreno de la espectroscopia, por ser el responsable último de su aplicación en el diagnóstico. Es por ello que debemos esforzarnos en obtener unos conocimientos básicos de la técnica que nos permitan desenvolver satisfactoriamente nuestro papel en este terreno.
BASES FÍSICAS
El fenómeno de la RMN se basa en la propiedad que presentan ciertos núcleos atómicos para absorber selectivamente la energía de radiofrecuencia cuando se someten a un campo magnético. Este exceso energético es liberado por los núcleos mediante un proceso de relajación nuclear. La frecuencia de resonancia de este proceso se denomina frecuencia de precesión (fp ), y es directamente proporcional al valor del campo magnético efectivo (B) que percibe el núcleo, según viene definido por la ley de Larmor (tabla 1):
fp= γ×B/2π
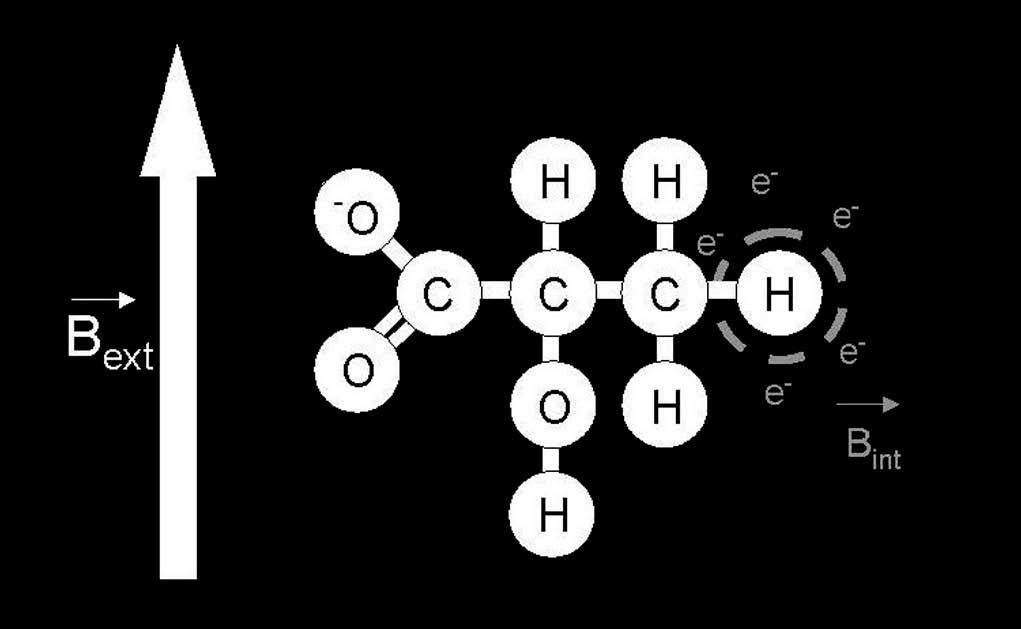
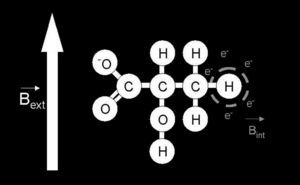
En la fórmula de la ley de Larmor, γes la constante giromagnética, constante y característica para cada núcleo. El campo magnético (B) viene determinado por un B externo (Bext ), constituido por el B producido por el imán y un B interno (Bint ), que está inducido por cargas en movimiento que forman parte de las diferentes moléculas (fig. 1). El B int siempre se opone al B ext , por lo que ejerce un efecto de pantalla. Su efecto es que el núcleo perciba un B inferior al B ext (B = B ext – B int ). Es proporcional al ext a través de una constante que recibe el nombre de constante de apantallamiento (σ) (B int = σ×B ext ).
TABLA 1 PRINCIPALES FÓRMULAS IMPLICADAS EN LAS BASES FÍSICAS DE LA ESPECTROSCOPIA POR RESONANCIA MAGNÉTICA (ERM)
Dado que γes constante y que el Bext también lo será para cada experimento, la fp dependerá, en último término, de la σ. Esta constante no depende únicamente del núcleo considerado, sino que será característica para la estructura molecular de su entorno metabólico. Así, la fp que percibimos será característica de cada compuesto, y la ERM proporcionará la posibilidad de detectar los compuestos que hay en una determinada muestra a partir de la valoración del espectro.
Con mucho, el núcleo más utilizado en el estudio del cerebro ha sido el protón, y se habla de espectroscopía por resonancia magnética de protón (ERM 1 H).
En una gráfica del dominio de frecuencias, la posición del pico nos identificará el compuesto, y el área bajo la gráfica será proporcional a su concentración. Cabe decir que la frecuencia de precesión de los protones no se representa como unidad de frecuencia (en Hz), sino en partes por millón (ppm). Este valor se obtiene de calcular el desplazamiento químico (δ) del radical en cuestión respecto de un compuesto de referencia según la fórmula:
δ=(fpA – fpR )/fpR
Donde fpA es la fdel metabolito a estudio (A) y fpR es la f del metabolito de referencia (R). En el caso de la ERM 1 H este metabolito de referencia es el 3-trimetilsilil[2,2,3,3-2 H] propionato sódico (TSP).
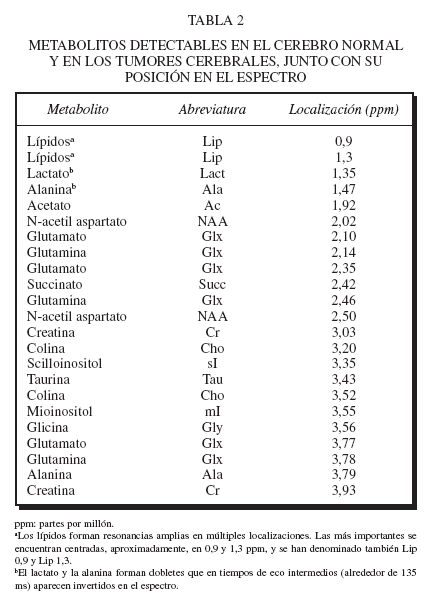
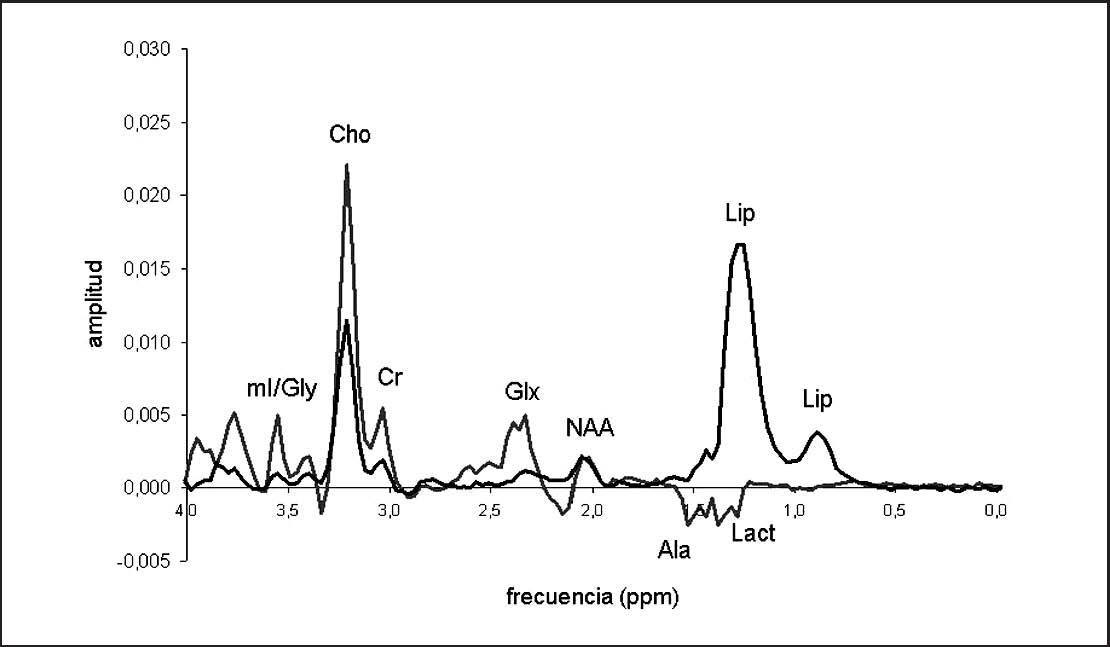
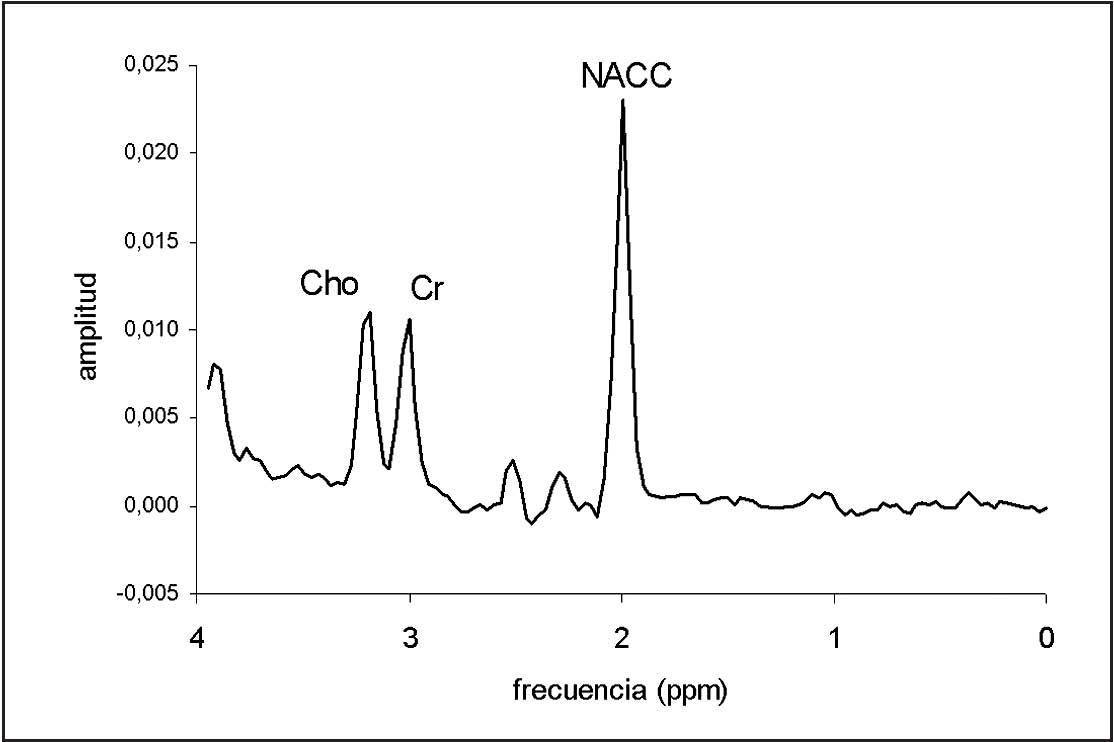
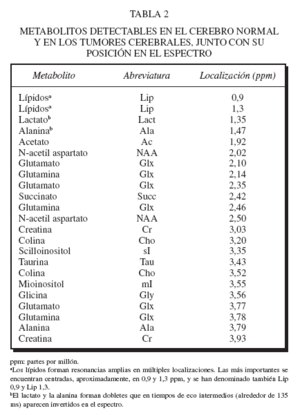
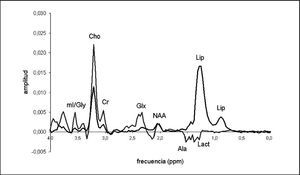
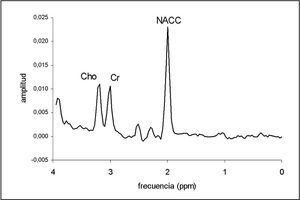
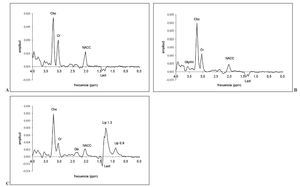
Una vez obtenido y procesado, se puede extrapolar cada resonancia en el espectro (según su localización) con un metabolito en el tejido, y la cantidad de este compuesto se puede valorar en relación con el área de la resonancia. La tabla 2 muestra la localización de los compuestos más relevantes en ppm. La figura 2 muestra dos espectros simulados que ilustran la localización de los metabolitos detectados con mayor frecuencia en tumores cerebrales.
Fig. 1.—Campo magnético externo (B ext ) y campo magnético interno int ) tomando como ejemplo la molécula de lactato. El B ext está generado por el imán de la máquina de resonancia, mientras que el B int se encuentra inducido por la presencia de una nube electrónica que rodea el protón y apantalla el B ext .
TABLA 2 METABOLITOS DETECTABLES EN EL CEREBRO NORMAL Y EN LOS TUMORES CEREBRALES, JUNTO CON SU POSICIÓN EN EL ESPECTRO
BASES BIOQUÍMICAS
A continuación se describe la información que aportan los diferentes metabolitos que se pueden observar en un espectro de protón:
—N-acetil aspartato (NAA) y otros compuestos N-acetilados (NACC). Su resonancia se encuentra centrada en 2,02 ppm y es la más intensa que se observa en la ERM 1 H del parénquima sano. Diversos estudios sugieren que estos compuestos están presentes de manera específica en la neurona del cerebro de personas adultas y que, por tanto, sería un marcador específico neuro-nal 1-3 . Se ha descrito disminución de NAA en enfermedades que presentan pérdida de neuronas o axones (demencia, placas antiguas de esclerosis múltiple, isquemia, esclerosis mesial, tumores).—Creatina y fosfocreatina. Presentan una resonancia principal en 3,03 ppm y una segunda resonancia en 3,90 ppm. Son compuestos relacionados con la capacidad energética del cerebro. Se ha sugerido como marcador de los sistemas dependientes de energía en las células del sistema nervioso central (SNC). Se considera la resonancia con menor variabilidad del cerebro. No obstante, disminuye en tumores cerebrales, ya sea por existencia de un bajo nivel energético o, en el caso de tumores secundarios, por originarse de células que no contienen este compuesto 4-7 .
—Derivados de la colina. Esta resonancia aparece en 3,20 ppm. Presenta contribuciones de diferentes metabolitos, como la colina libre, la fosforilcolina, la glicerofosforilcolina y la fosfatidilcolina. Refleja metabolismo de turnover celular y está aumentada en procesos que producen hipercelularidad. La explicación más habitual al incremento de este compuesto es la presencia de productos de degradación de la mielina por destrucción de ésta. Se han correlacionado los valores de colina in vivo con el potencial de proliferación tumoral, determinado por el análisis inmunohistoquímico de biopsias utilizando Ki-67 para gliomas 8,9 y meningiomas 10 .
Fig. 2.—Espectros simulados que muestran la localización de las principales resonancias que se pueden encontrar en el estudio de tumores cerebrales.
—Lactato. Se detecta en 1,35 ppm y proporciona información sobre el grado de metabolismo aerobio-anaerobio de la región. En condiciones normales no se detecta en el parénquima cerebral. Su presencia indica que la respiración oxidativa normal está alterada y que los carbohidratos están siendo catabolizados por la vía anaerobia. Esta situación se da en lesiones altamente celulares y metabólicas que han crecido por encima de lo que su aporte vascular les permite. Las situaciones de hipoxia originan, de manera prácticamente instantánea, incremento de lactato por activación de la vía anaerobia de degradación de la glucosa. También se encuentra en lesiones quísticas o necróticas. Está aumentado en lesiones de alto grado, pero su correlación con el grado tumoral11 o con el metabolismo tumoral valorado por tomografía de emisión de positrones (PET)12 no es buena.
—Mioinositol. Produce su señal predominante a 3,56 ppm. Es un azúcar que forma parte de un tipo de lípidos, fosfatidilinositol, y también de un grupo de mensajeros, los inositol polifosfatos. También se le da un papel como osmolito y se ha sugerido como marcador de astrocitos. Se encuentra aumentado en astrocitomas de bajo grado y disminuido o ausente en tumores no gliales.
—Glicina. Origina una señal en 3,56 ppm que se superpone a la señal del mioinositol. Se ha descrito aumentada en glioblastomas multiformes.
—Glutamina y glutamato. Originan una serie de señales en las regiones 2,2-2,4 y 3,6-3,8 que se valoran mejor a tiempo de eco (TE) corto. Son difíciles de separar a un campo magnético de 1,5 T. Diversos estudios sugieren que se considere a la gluta-mina-glutamato como marcador glial. No obstante, la presencia de glutamina-glutamato aumentada es un prominente hallazgo de los meningiomas 13,14 .
—Lípidos. Originan dos resonancias principales en 0,9 ppm (lipido 0,9) y 1,3 ppm (lípido 1,3) relativamente anchas, que se deben a los grupos metil y metileno, respectivamente, de la cadena de ácidos grasos. Pueden originar otras señales menores entre 2-2,5 y 5-6 ppm. Su identificación en el espectro se ha relacionado con la presencia de necrosis 15 y se proponen como criterio de malignidad, sobre todo si aparecen en espectros registrados con un TE largo. —Alanina. Es un aminoácido no esencial que resuena en 1,45 ppm y que se ha detectado en grandes cantidades en meningiomas.
—Taurina, scilloinositol, glucosa. Estos metabolitos resuenan en el área comprendida entre 3,3 y 3,45 ppm, y su diferenciación es difícil. La taurina es un aminoácido implicado en la neurotransmisión, la osmorregulación y el crecimiento. Se ha detectado en cantidades elevadas en el meduloblastoma. El scilloinositol es un isómero del inositol. Su resonancia presenta menos intensidad que el isómero más común (mioinositol). La glucosa es una de las principales fuentes de energía; hasta el momento, se le ha encontrado escasa utilidad.
ESPECTROSCOPIA POR RESONANCIA MAGNÉTICA DE PROTÓN EN EL DIAGNÓSTICO DE TUMORES CEREBRALES
Uno de los campos en que la información aportada por la ERM 1 H puede ser de mayor impacto es en el diagnóstico prequirúrgico de los tumores cerebrales1,4,8,13,14,16-21 . En la actualidad, se pueden realizar estudios ERM con una duración aceptable en la mayoría de máquinas de RM de 1,5 T. Esto da al radiólogo la oportunidad de realizar los estudios de imagen por resonancia magnética (IRM) y ERM en una única sesión, evaluando en el mismo procedimiento la información que suministran ambas técnicas.
Interés de la espectroscopia por resonancia magnética de protón en el diagnóstico de tumores cerebralesPara un tratamiento óptimo de los pacientes con tumor cerebral, es necesario disponer de un diagnóstico lo más exacto posible. La IRM puede proporcionar un diagnóstico inicial de las masas cerebrales con una exactitud diagnóstica de entre el 30 y el 90%, dependiendo del tipo de tumor22,23 . La anatomía patológica (AP) sigue siendo considerada el «patrón de oro» para determinar el diagnóstico definitivo, por lo que sigue siendo necesaria la biopsia del tumor. No obstante, la mortalidad descrita en la realización de biopsias es del 1,7%24 . En un estudio de 550 pacientes a los que se practicó biopsia estereotáctica, Yu et al22 encontraron que un 8% presentaba procesos inflamatorios o abscesos, un 2,2% presentaba otro tipo de lesiones no tumorales, un 3,4% fueron biopsias no diagnósticas y un 8% presentaron complicaciones. Un método no invasivo, como la ERM, que permita predecir con mayor exactitud el tipo de lesiones, podría evitar biopsias en procesos no tumorales o tumores poco accesibles que serían tributarios de radioquimioterapia más que de resección quirúrgica.
Hay patrones de espectroscopia que se han demostrado característicos de determinados tipos tumorales, y diferentes técnicas estadísticas se han mostrado capaces de relacionar estos patrones de ERM 1 H con sus grupos tumorales5,25-30 . A continuación se describen las características de ERM 1 H para cada grupo tumoral.
Diferenciación de parénquima cerebral normal frente a tumorLa ERM puede distinguir con buena fiabilidad entre parénquima cerebral normal (fig. 3) y tumores cerebrales1,31-33 . Las principales características descritas en los tumores cerebrales son: descenso de NACC34 , descenso de creatina, aumento de colina, aumento de gli-cina/mioinositol34 , presencia de lactato, aumento de glutamina-glu-tamato35 y presencia de resonancia de lípidos en diferentes propor-16,34,36-42 . El descenso de NACC expresaría la reducción o ausencia de neuronas y axones en la mayoría de tumores, más marcada en tumores extraaxiales. La disminución de creatina es un hallazgo inconstante en tumores, que se ha asociado a un estatus de baja energía, o al origen de tumores metastásicos en células que no contienen creatina. La elevación de colina es un hallazgo muy prevalente en tumores. Se ha justificado por la proliferación de las membranas celulares. El lactato aparecería a partir de su acumulación en áreas quísticas y necróticas, o a partir de sobreproducción en tumores con un alto ratio de glucólisis y activación de la vía anaerobia. Los lípidos se han asociado a áreas de necrosis.
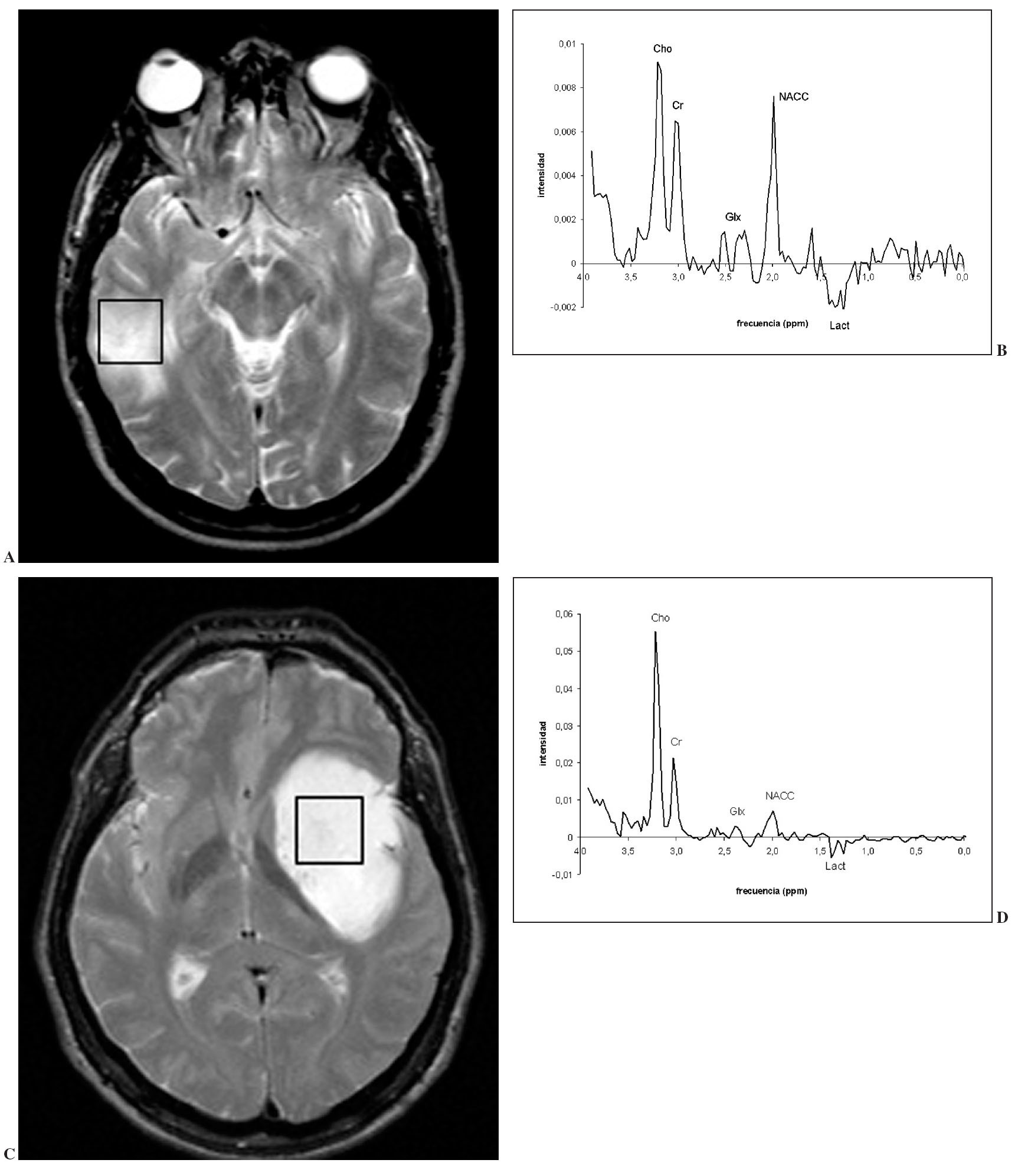
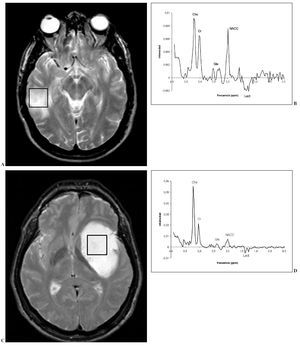
Un aspecto de mayor dificultad es la distinción entre tumor y proceso patológico no tumoral (procesos inflamatorios-infeccio-sos, infarto subagudo, esclerosis múltiple). La figura 4 muestra dos lesiones de aspecto tumoral en que la ERM 1 H aportó información útil para su diferenciación.
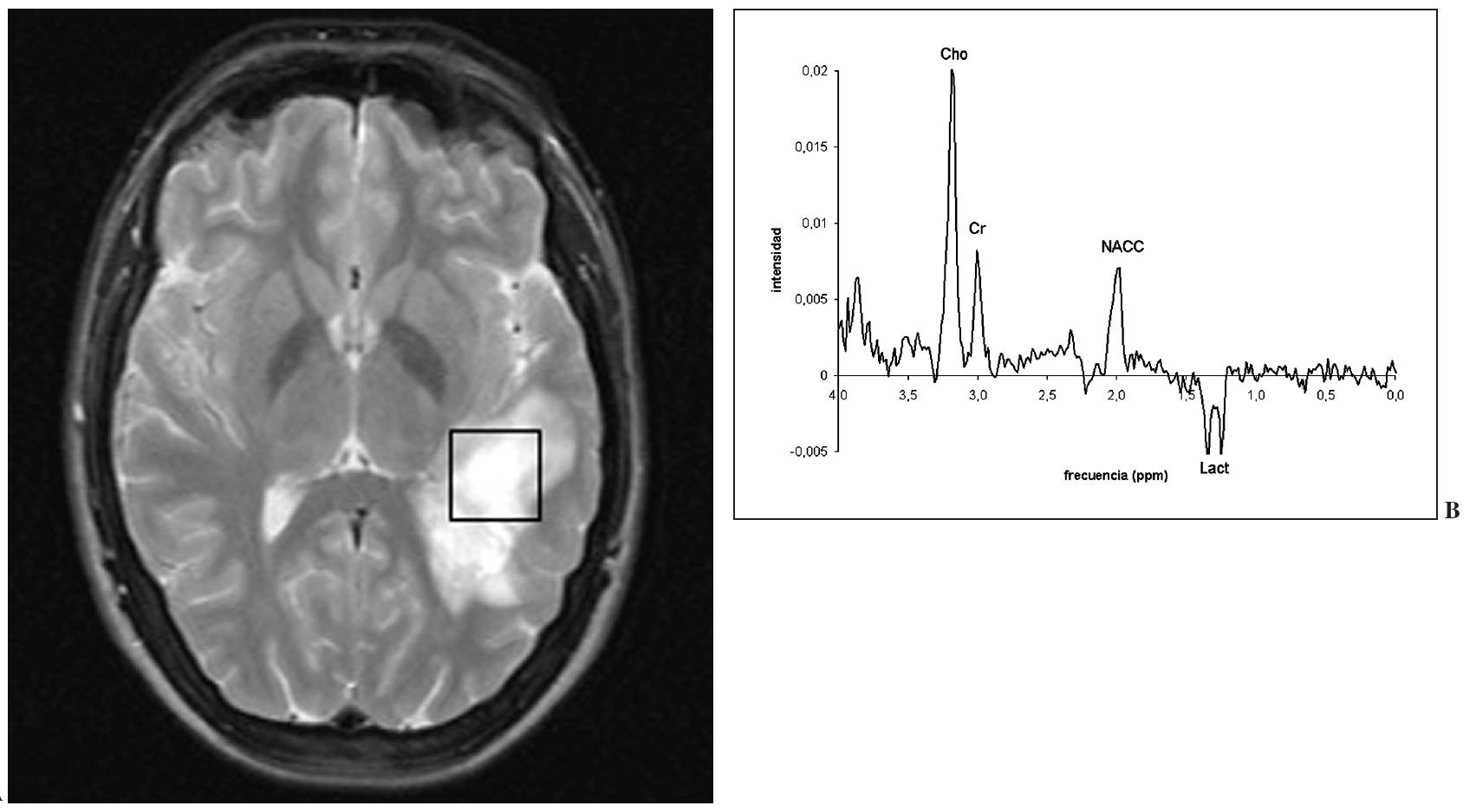
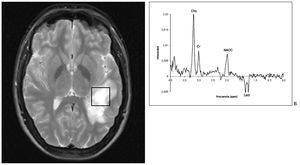
De todos modos, el papel de estos metabolitos en el diagnóstico de una lesión como tumoral debe valorarse con cautela. En un estudio con 241 pacientes con sospecha de neoplasia, 6 tuvieron un patrón de ERM 1 H tumoral, aunque la AP mostró astrogliosis reactiva43 . A pesar de que los cambios espectroscópicos asociados a gliosis son una moderada elevación de glicina/mioinositol y colina, con moderada reducción de NACC, una gliosis reactiva severa puede llevar a cambios más marcados, que se pueden confundir con un tumor de bajo grado34,44 . Más allá de la semana de evolución, y mediante ERM, algunas lesiones isquémicas se pueden confundir con tumores6 . Un tercer motivo de falso positivo pueden ser algunas formas seudotumorales de esclerosis múlti-45-47 . La figura 5 muestra un ejemplo de falso positivo para tumor de la ERM 1 H en una placa desmielinizante aguda.
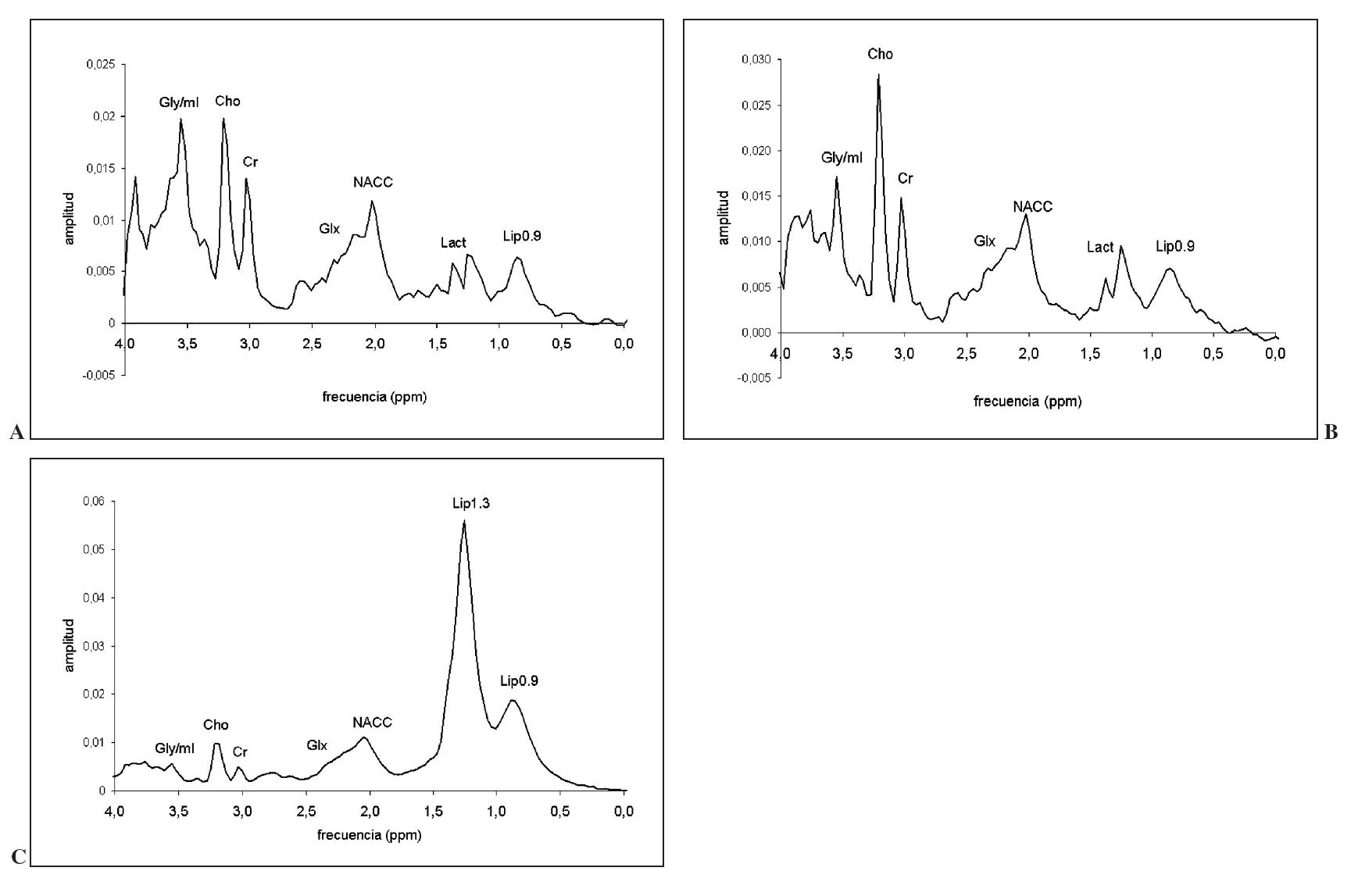
Tumores gliales. Diferenciación del grado tumoralLos hallazgos descritos en los astrocitomas incluyen una reducción del valor de NACC, una moderada reducción de los valores de creatina y una elevación de colina11,31,48 (figs. 6 y 7). Múltiples estudios han analizado la capacidad de la ERM 1 H para distinguir entre diferentes grados tumorales en astrocitomas y han propuesto diferentes marcadores:
— Es un hecho constatado un aumento de la colina con el gra-do tumoral. En múltiples trabajos se ha afirmado una correlación directa entre el área de colina y el grado tumoral en tumores as-4,5,16,32,36,49-52 . No obstante, este incremento lineal con el grado no es un hallazgo constante. Existe consenso en que los valores de colina en el astrocitoma anaplásico son mayores que en el astrocitoma de bajo grado, pero diversos estudios han encontrado valores de colina menores en el glioblastoma que en el astrocitoma anaplásico5,13,35,49,53,54 . Este hecho puede deberse a un predominio en el voxel de áreas necróticas sobre áreas celulares proliferativas. Esto explicaría también la variabilidad presente entre estudios, dependiendo de la estrategia utilizada para posicionar el voxel sobre el tumor, y cierta discordancia entre estudios practicados in vitro e in vivo , dado que los primeros sólo consideran áreas de tumor viable no necrótico.
Fig. 3.—Patrón de ERM 1 H del parénquima cerebral normal. La figura muestra un registro de ERM 1 H (TE, 136 ms; TR, 2000 ms) obtenido de la sustancia blanca parietal izquierda en un voluntario sano. Compárese con el patrón tumoral mostrado en la figura 2.
—También se ha señalado la presencia de lactato como indicador de alto grado tumoral1,11,17,31-33,49,50,55-58 . La justificación del aumento de lactato con el grado tumoral sería que el aumento de la actividad metabólica desplazaría el metabolismo celular hacia la vía anaerobia, provocando depósito de lactato. No obstante, se ha demostrado gran variabilidad en este metabolito11,13 que se justifica porque su presencia no depende únicamente de su producción por parte de las células, sino de la capacidad de lavado de éste. De este modo, se acumularía en áreas quísticas o con mala llegada del árbol vascular49 .
—Los lípidos se han relacionado con áreas de necrosis y, por tanto, se encontrarían en tumores de alto grado tumoral 15,36,49 . Se han descrito en diferentes proporciones en astrocitomas anaplásicos, dependiendo de los estudios, pero las mayores cantidades se encontrarán en los glioblastomas.
—La resonancia centrada en 3,55 ppm tiene un interés cre-ciente en el estudio de tumores gliales. Se ha descrito un descenso del mioinositol con el grado tumoral 5,35,59,60 , mientras que estudios in vitro han detectado un aumento de la cantidad de glicina en el glioblastoma 35,61 .
Meningiomas
Los meningiomas constituyen un grupo de tumores en los que se han descrito diferentes hallazgos característicos (fig. 8):
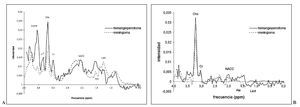
— Dado que los meningiomas se originan fuera del parénqui-ma neuronal, no deberían contener NAA31 ; sin embargo, en la práctica clínica es frecuente observar resonancia en 2,02 ppm en el espectro, que en teoría debería corresponder a NAA. Diferentes argumentos se han aportado para explicar este hecho. En primer lugar, se atribuyó a contaminación de tejido no meningiomatoso, por mal posicionamiento del voxel o su mala delimitación11 . Esta explicación en muchos casos no es factible. En la actualidad esta resonancia se atribuye a otros compuestos NACC, diferentes de NAA62 . De todos modos, es prevalente una marcada reducción del pico centrado en 2,02 ppm (NACC) en meningiomas.
—En meningiomas, la señal de colina está marcadamente au-mentada. Existe también una marcada reducción en la señal de creatina, hecho que se ha confirmado en estudios realizados in vitro63 .
—El lactato y la alanina también pueden estar elevados en algunos meningiomas. De momento no hay explicación para este
Fig. 4.—Dos imágenes de aspecto tumoral (A y C) y espectros respectivos obtenidos a tiempo de eco (TE) de 136 ms (B y D). En el primer espectro (B) se aprecia discreta reducción de la resonancia de NACC con mínimo aumento de la ratio colina/creatina. Este patrón no permite sugerir un origen tumoral. En el segundo, el caso del espectro (D) es más claramente tumoral, con marcada reducción de NACC y marcado aumento de la ratio colina/creatina. En el primer caso la anatomía patológica no detectó tumor, y la evolución de las imágenes confirmó una lesión seudotumoral. En el segundo caso el estudio histológico confirmó la presencia de un astrocitoma de bajo grado.
(D) es más claramente tumoral, con marcada reducción de NACC y marcado aumento de la ratio colina/creatina. En el primer caso la anatomía patológica no detectó tumor, y la evolución de las imágenes confirmó una lesión seudotumoral. En el segundo caso el estudio histológico confirmó la presencia de un astrocitoma de bajo grado.
— Se ha detectado también un aumento de glutamina-gluta-mato en extractos de meningioma53 . Este dato se ha mostrado de utilidad para diferenciar in vitro entre meningioma y astrocitoma35 . Un hallazgo referido recientemente como característico de meningiomas ha sido una elevación de glutatión en resonancias alrededor de 2,36, 2,9, 3,4 y 3,78 ppm65 .
Estos hallazgos se han demostrado de gran utilidad en el diagnóstico de meningiomas13 , especialmente en los casos en que el aspecto radiológico de estos tumores es atípico14 .
Fig. 5.—Falso positivo de la ERM para tumor de bajo grado en un caso de esclerosis múltiple. La figura (A) muestra una lesión focal temporal izquierda de aspecto tumoral en la secuencia potenciada en T2. El espectro (B) obtenido con tiempo de eco (TE) de 136 ms muestra un significativo aumento de las ratios colina/creatina y colina/NACC que sugiere una tumoración de bajo grado. El diagnóstico definitivo fue esclerosis múltiple.
Metástasis
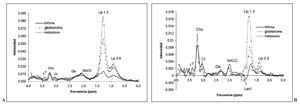
En presencia de una lesión única es clínicamente importante distinguir entre tumor cerebral primario y secundario. Esta diferenciación es frecuentemente difícil (si no imposible) sin histología. La mayoría de las metástasis muestran moderada a marcada reducción de NACC, reducción de creatina y valores elevados de colina (fig. 9). Estos hallazgos son idénticos a los de algunos astrocitomas. Frecuentemente, las metástasis pueden contener lípidos y lactato, al igual que ocurre con los tumores gliales de alto grado, que se atribuyen a la presencia de áreas de necrosis intratumoral11,55,66-68 . El estudio de los patrones espectrales basado en el origen del tumor primario no ha detectado diferencias suficientemente significativas18 . Diferentes hallazgos se han propuesto para diferenciar entre metástasis y glioblastoma por diferentes grupos, sin que ninguno se haya confirmado hasta la fecha: aumento de glutaminaglutamato en metástasis69 , aumento de la relación lípido 1.3/ lípido 0.9 en metástasis5 , o ausencia de creatina en metástasis7 .
Tumores neuroectodérmicos primitivosLos tumores neuroectodérmicos primitivos (TNEP) son más frecuentes en niños. Estos tumores muestran incrementos de colina superiores a los encontrados en astrocitomas y ependimomas70 . Se han detectado también patrones característicos de mioinositol, taurina, glutamina-glutamato, de interpretación incierta35,71 . También se ha detectado presencia de alanina, aunque en cantidad inferior a la de los meningiomas, pero algo superior que en el resto de tumores (fig. 10). Estos hallazgos han demostrado utilidad en el diagnóstico de los TNEP72 .
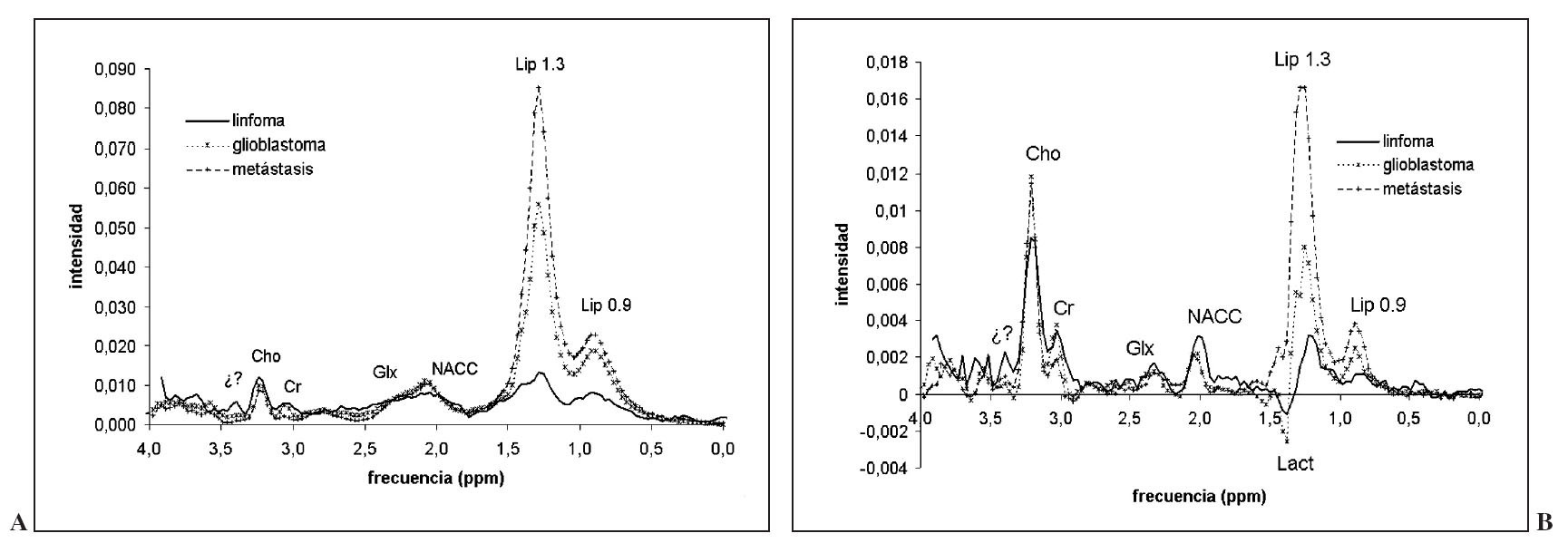
LinfomasLa ERM 1 H en estos tumores muestra una marcada elevación de colina y una significativa reducción de creatina y NACC56 (fig. 11). Algunos estudios refieren también una marcada elevación de lípidos, pero éste no es un hecho prevalente.
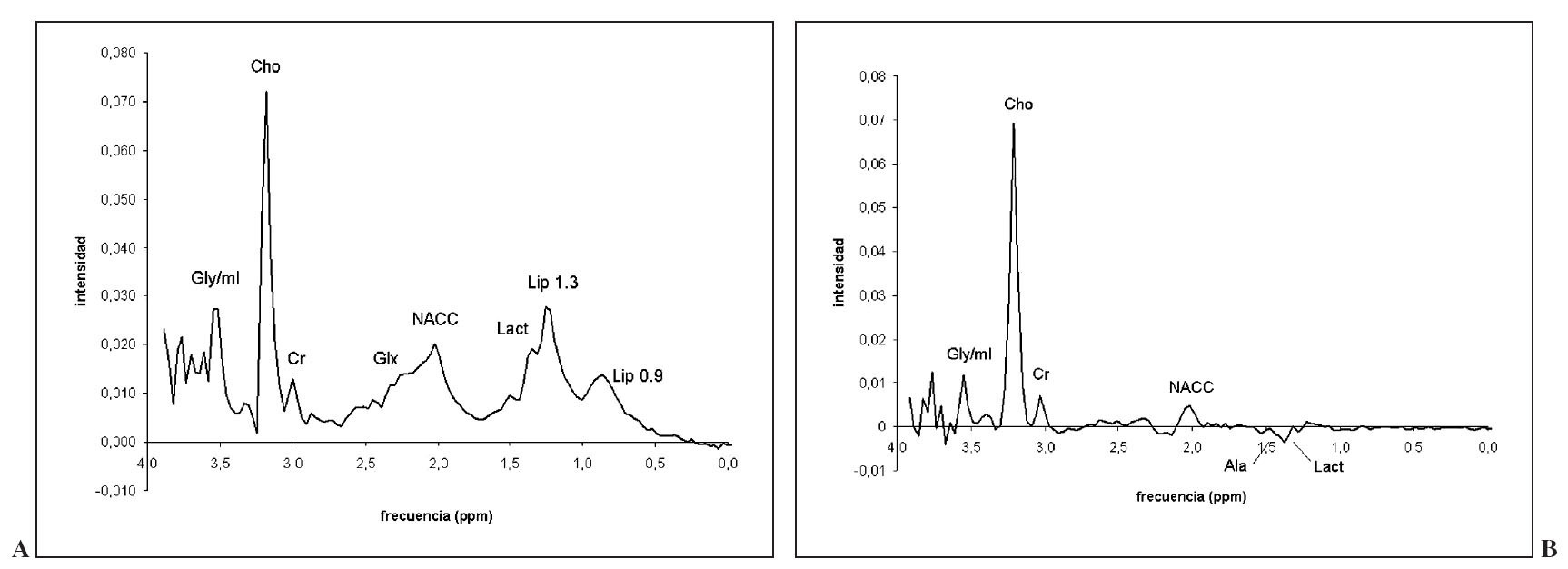
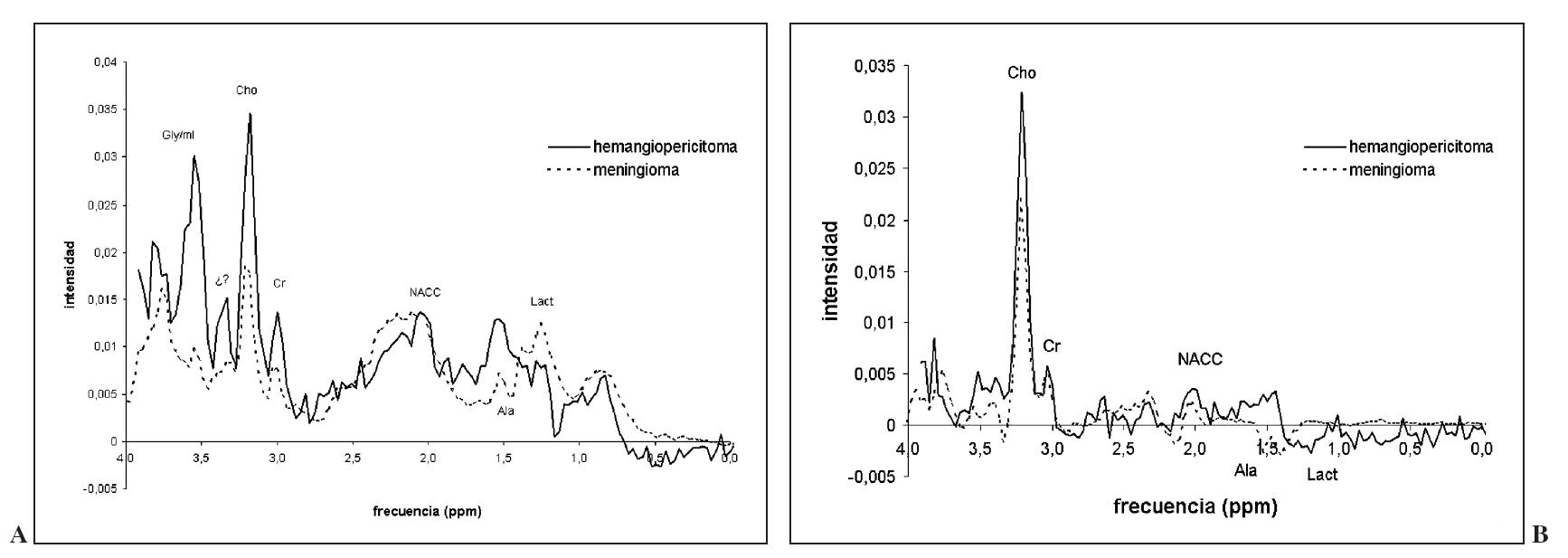
HemangiopericitomasLos hemangiopericitomas son tumores extraaxiales derivados de los hemangiopericitos, cuyo diagnóstico diferencial por imagen con el meningioma es dificultoso. No obstante, es interesante establecer este diagnóstico diferencial antes de la cirugía, dado que el hemangiopericitoma es más agresivo, presenta mayor ratio de recurrencia y está más vascularizado. El tratamiento no puede ser diferido y en algunos casos se plantea una posible embolización prequirúrgica. Se ha descrito la presencia de mioinositol a 3,55 ppm como característico de este tipo de tumores, principalmente de cara al diagnóstico diferencial con el meningioma, dado que este metabolito es muy escaso en meningiomas y abundante en hemangiopericitomas73 (fig. 12).
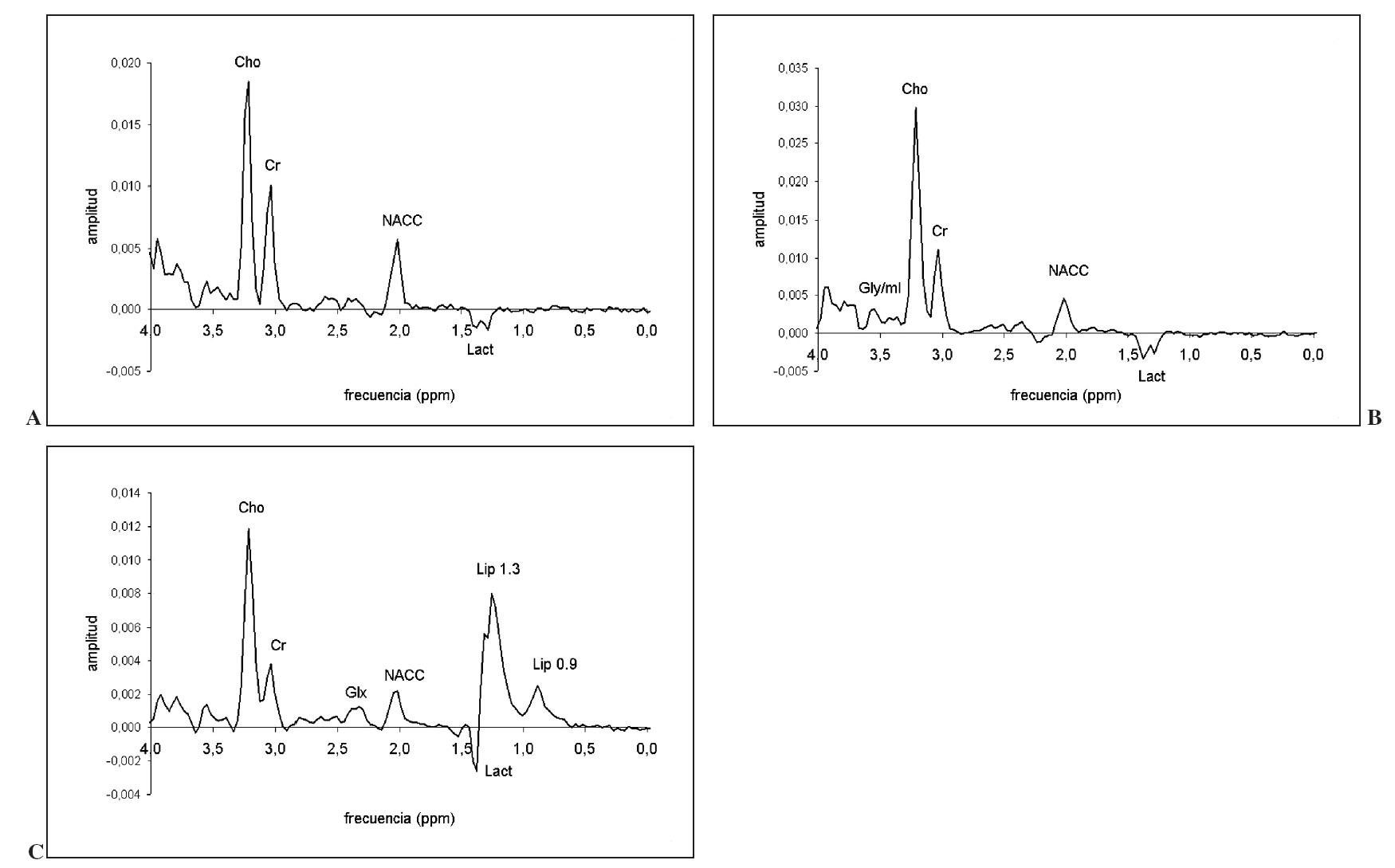
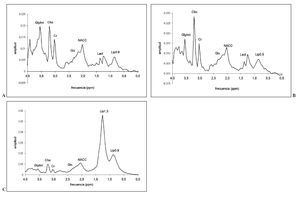
Fig. 6.—Registro promedio a tiempo de eco (TE) corto (TE = 30-32 ms) a partir de 12 astrocitomas de bajo grado (A), 16 astrocitomas anaplásicos (B) y 54 glioblastomas (C).
Fig. 7.—Registro promedio a tiempo de eco (TE) largo (TE = 136 ms) a partir de 12 astrocitomas de bajo grado (A), 16 astrocitomas anaplásicos (B) y 54 glioblastomas (C).
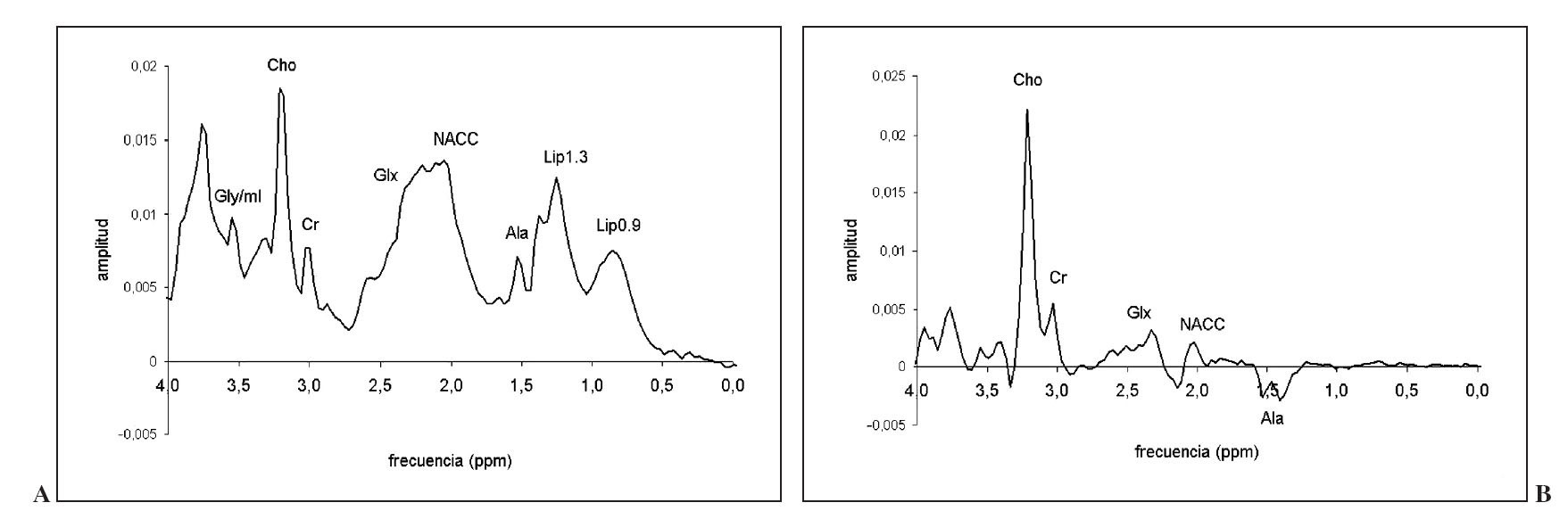
Fig. 8.—Espectro promedio de meningioma (n = 37) a tiempo de eco (TE) corto (A) y TE largo (B). Destaca la presencia de resonancia de alanina con abundante cantidad de glutamina-glutamato, marcado aumento de la ratio colina/creatina y una resonancia a 3,8 ppm que puede tener componente tanto de glutamina-glutamato como de alanina.
Fig. 9.—Espectro promedio obtenido a partir de 32 metástasis a tiempo de eco (TE) corto (A) y TE largo (B). Destaca la presencia de abundante cantidad de lípidos en las posiciones de 0,9 y 1,3 ppm.
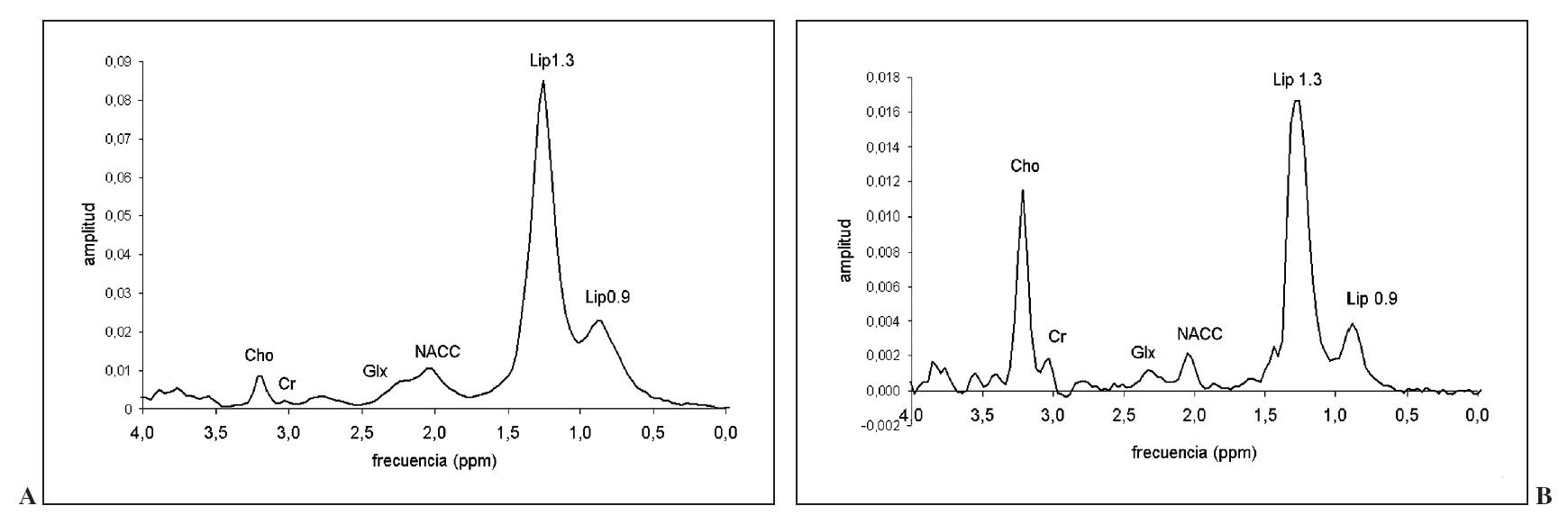
Fig. 10.—Espectro promedio obtenido a partir de 12 tumores neuroectodérmicos primitivos (TNEP) a tiempo de eco (TE) corto (A) y TE largo (B). Destaca un aumento muy marcado de colina, superior al del resto de tipos tumorales, presencia de glicina/mioinositol y trazas de alanina.
Fig. 11.—Espectro promedio obtenido a partir de 12 linfomas a tiempo de eco (TE) corto (A) y TE largo (B). Se muestran superpuestos los principales grupos del diagnóstico diferencial: glioblastoma y metástasis. Destaca menor lípidos con colina y creatina similares y una resonancia no identificada (?) a 3,4 ppm.
Fig. 12.—Espectro de un hemangiopericitoma a tiempo de eco (TE) corto (A) y TE largo (B). Se muestra superpuesto el espectro promedio de meningioma, como principal grupo a diferenciar. Destaca la ausencia de alanina, prominente glicina/mioinositol TE corto y una resonancia no identificada a 3,4 ppm (?).
Neurocitomas centrales
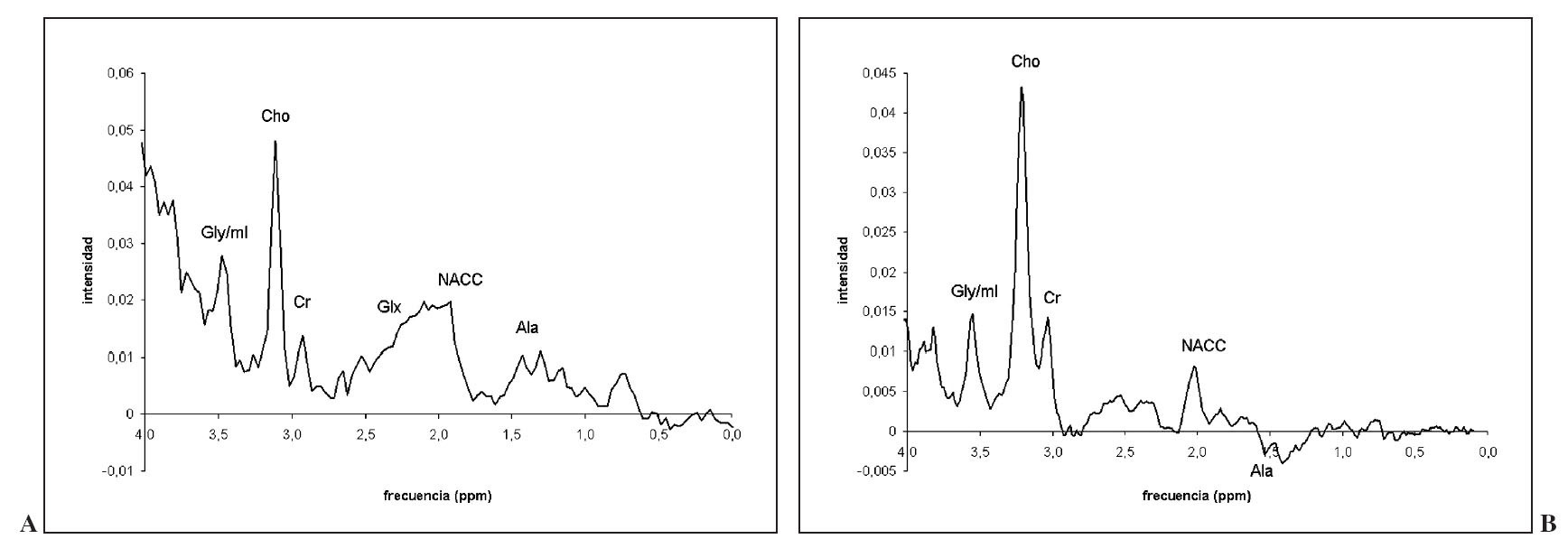
Los estudios publicados sobre el patrón espectroscópico de los neurocitomas describen en estos tumores un marcado aumento de colina junto con presencia de resonancia de glicina y NACC bajas, pero presentes (fig. 13). La resonancia de glicina podría desempeñar cierto papel en la identificación de estos tumores.
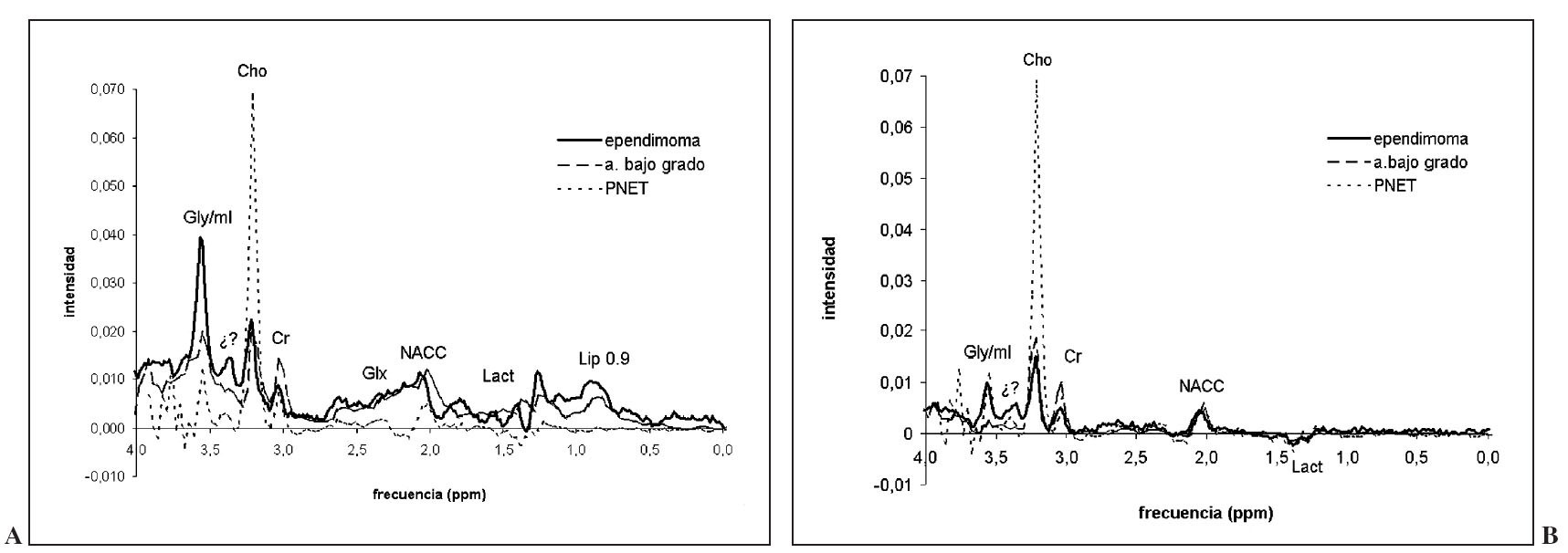
EpendimomasLos ependimomas muestran un patrón espectral similar al descrito en el resto de tumores, con aumento de colina, descenso de NACC, lactato en diferentes cantidades y presencia de glicina/mioinositol15,70 . Por el grupo de edad al que afectan y por su localización, el diagnóstico diferencial que se plantea con mayor frecuencia en estos tumores es con astrocitomas de bajo grado y meduloblastomas (fig. 14).
Fig. 13.—Espectro de un neurocitoma a tiempo de eco (TE) corto (A) y TE largo (B). Destaca un marcado aumento de colina con doblete de alanina y prominente resonancia de glicina/mioinositol.
Fig. 14.—Espectro promedio de ependimoma (n = 2) a tiempo de eco (TE) corto (A) y TE largo (B). Destaca un pico muy prominente de glicina/ mioinositol y un pico no identificado a 3,4 ppm.
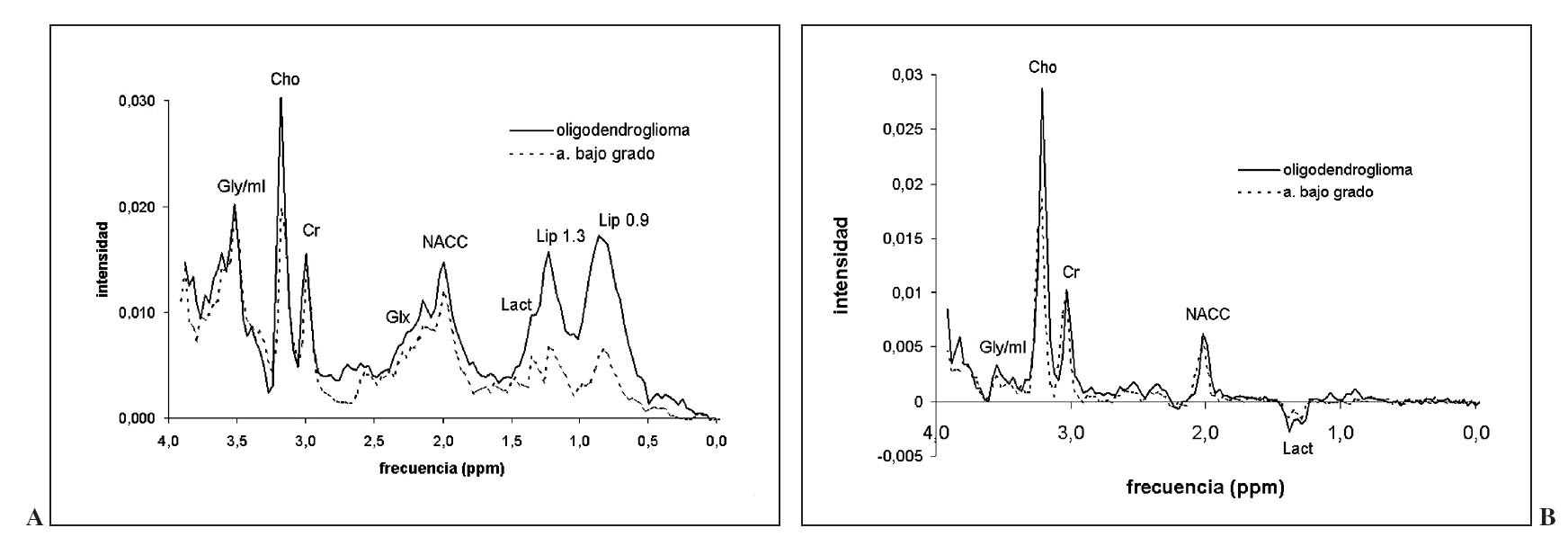
Fig. 15.—Espectro promedio obtenido de 6 oligodendrogliomas a tiempo de eco (TE) corto (A) y TE largo (B). Se muestra superpuesto el espectro promedio de astrocitoma de bajo grado, como principal grupo a diferenciar. Se aprecia mayores valores de colina en ambos TE, y de lípidos a TE corto en oligodendroglioma.
ligodendrogliomas
El patrón espectroscópico de los oligodendrogliomas es muy similar al de los astrocitomas de bajo grado (fig. 15). Un trabajo detectó que la diferencia más significativa entre oligodendrogliomas y astrocitomas de bajo grado se encontraba en la resonancia de glutamina-glutamato, menor en astrocitomas de bajo grado que en oligodendrogliomas.
RESUMENLos tumores presentan patrones radiológicos propios que los caracterizan bioquímicamente. A grandes rasgos, y como datos claramente establecidos, se puede decir que los tumores de más alto grado (glioblastoma y metástasis) se caracterizan por la presencia de lípidos, que el meningioma presenta valores de alanina superiores al resto de tumores, y que los valores de colina son superiores en astrocitomas anaplásicos que en astrocitomas de bajo grado, y en meningiomas que en los otros grupos. De todos modos, hay que destacar que existe una significativa superposición de patrones entre grupos, máxime cuando se trata de tumores poco comunes. Ello hace que, para obtener resultados mejorados, haya que recurrir a una cuantificación precisa y métodos más o menos sofisticados de reconocimiento de patrones.
Correspondencia:
CARLES MAJÓS. Institut de Diagnòstic per la Imatge (IDI). Hospital Duran i Reynals. CSU de Bellvitge. 08907 L’Hospitalet de Llobregat. Barcelona. España. cmajos@csub.scs.es