Las técnicas de perfusión por resonancia magnética (PRM) permiten la valoración de la microvasculatura cerebral mediante los cambios de señal debidos al paso intravascular de un trazador. La técnica más empleada se basa en la susceptibilidad magnética del gadolinio en secuencias T2* y los parámetros más comúnmente valorados son: el volumen sanguíneo cerebral, el flujo sanguíneo cerebral y el tiempo de tránsito medio. En los estudios de PRM deben considerarse diversos aspectos técnicos como la secuencia empleada, la dosis o la velocidad de inyección del contraste. También debe valorarse la existencia de fuentes de error como las debidas a la fuga de contraste por alteración en la permeabilidad de la barrera hematoencefálica. Las aplicaciones clínicas más extendidas de la PRM incluyen la determinación del grado de agresividad de gliomas, la diferenciación de algunos tipos histológicos tumorales o de lesiones pseudotumorales y la valoración del área de penumbra en la isquemia aguda.
Perfusion MRI makes it possible to evaluate the cerebral microvasculature through changes in signal due to a tracer passing through blood vessels. The most commonly used technique is based on the magnetic susceptibility of gadolinium in T2*-weighted sequences, and the most commonly evaluated parameters are cerebral blood volume, cerebral blood flow, and mean transit time. Diverse technical aspects, like the sequence used, and the dose and speed of contrast material injection, must be taken into account in perfusion MRI studies. It is also essential to consider possible sources of error like contrast material leaks due to changes in the permeability of the blood-brain barrier. The most widely used clinical applications of perfusion MRI include the determination of the degree of aggressiveness of gliomas, the differentiation of some histological types of tumors or pseudotumors, and the evaluation of the penumbral area in acute ischemia.
En el sentido más estricto, la perfusión cerebral se define como el estado estacionario de liberación de nutrientes y oxígeno por vía sanguínea por unidad de volumen o masa y se mide típicamente en mililitros de sangre por 100g de tejido por minuto1. Sin embargo, en la imagen de perfusión por RM (PRM) este concepto se ha ampliado1 para incluir múltiples parámetros microcirculatorios tisulares, como el volumen sanguíneo cerebral (VSC), el flujo sanguíneo cerebral (FSC), el tiempo de tránsito medio (TTM), el tiempo al pico (TP), o el tiempo máximo (Tmáx).
Consideraciones técnicasModalidades de perfusión por resonacia magnética. Imagen de susceptibilidad magnética dinámica ponderada en T2*Existen tres técnicas principales para realizar estudios de PRM: imagen de susceptibilidad magnética ponderada en T2*, perfusión dinámica ponderada en T1 y técnicas Arterial Spin Labelling2. Todos estos métodos se basan en los cambios de señal que acompañan el paso de trazador por el sistema cerebrovascular1, que puede ser endógeno (agua) o exógeno (quelatos de gadolinio).
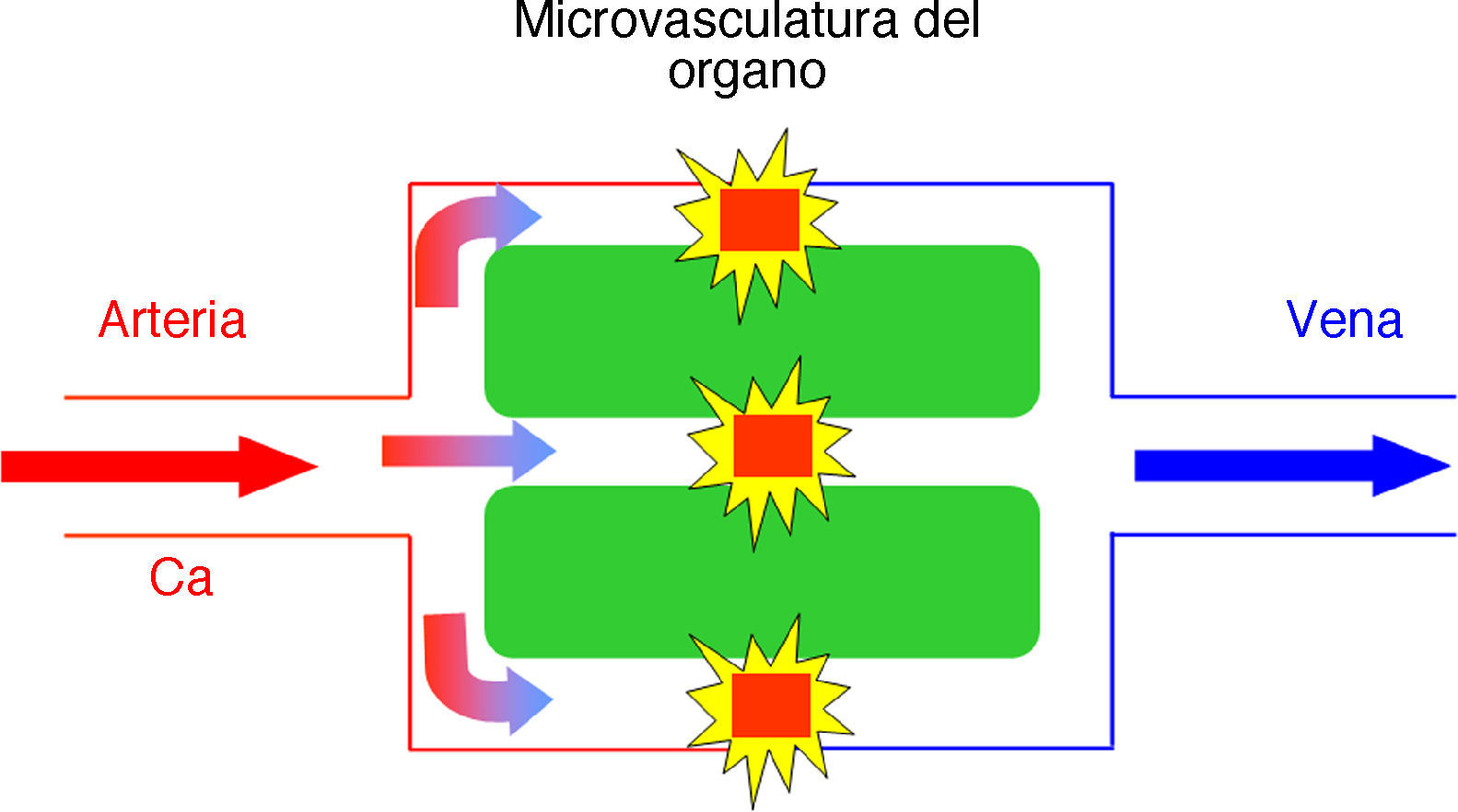
La técnica más utilizada es la imagen de susceptibilidad magnética ponderada en T2* y se basa en la propiedad paramagnética de los contrastes de gadolinio a su paso por el sistema cerebrovascular que producen una caída de señal T2 y, fundamentalmente, T2* debido al cambio de la susceptibilidad magnética local (fig. 1)1,3.
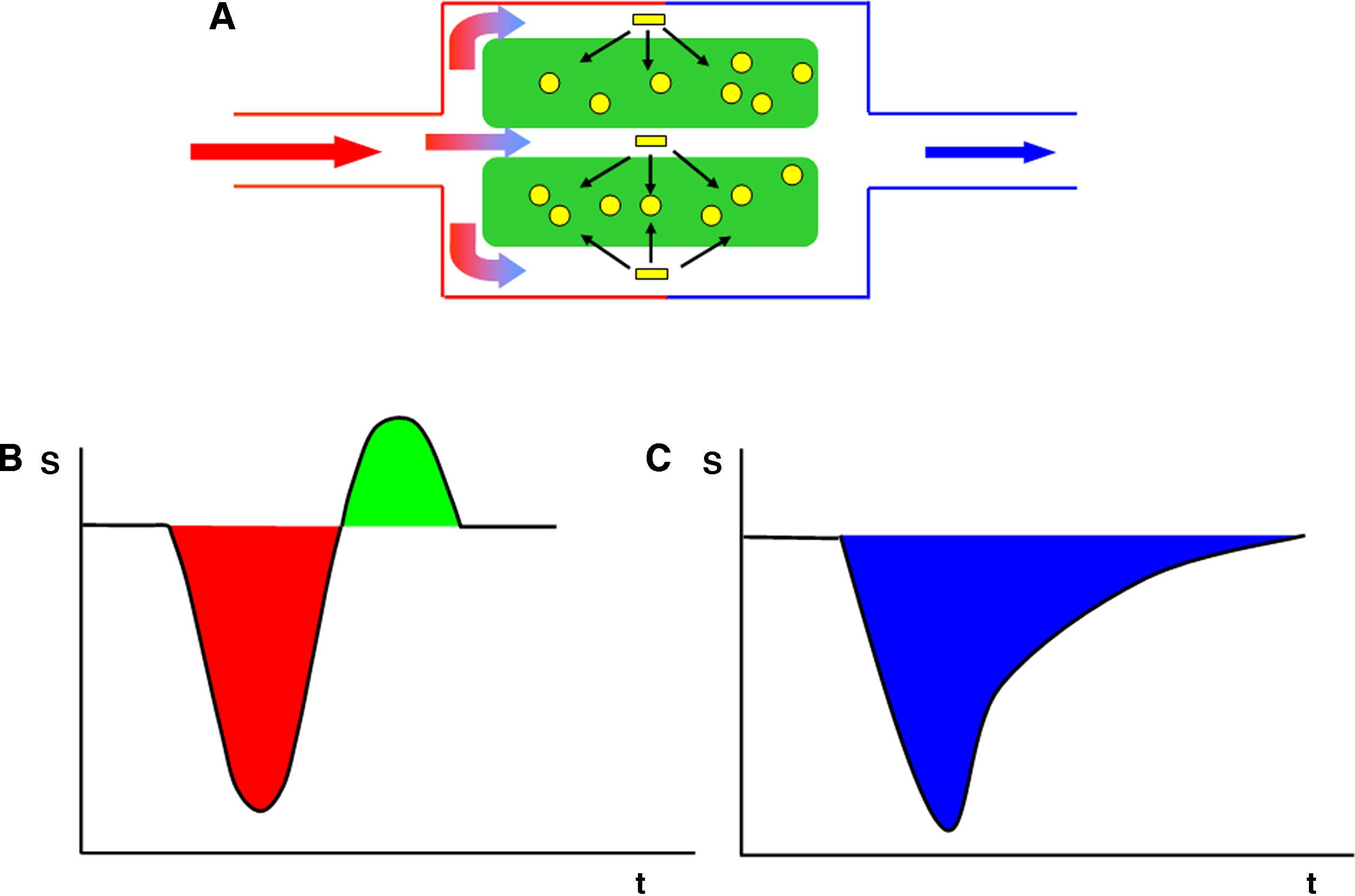
En el modelo cinético para la perfusión por susceptibilidad magnética T2* el trazador (contraste de gadolinio) alcanza el parénquima cerebral en una concentración descrita por la función arterial de entrada Ca(t) y se dispersa a través de la microvasculatura. El agente paramagnético dentro de estos vasos provoca campos magnéticos locales en el tejido circundante que ocasiona un desfase de las moléculas de agua y una pérdida de la señal en las secuencias potenciadas en T2*. Este modelo asume que no hay fuga de contraste.
El quelato de gadolinio intravenoso constituye un trazador no difusible desde el lecho vascular al parénquima cerebral1. Este confinamiento en el espacio vascular ocasiona que el efecto dominante sea el de susceptibilidad magnética. Así pues, el agente paramagnético se comporta como una serie de cilindros magnetizados que producen una influencia en el tejido circundante alterando los campos magnéticos locales4. Si el campo magnético fuera perfectamente homogéneo, todas las moléculas de agua precesarían a la misma frecuencia; sin embargo, cuando el agente paramagnético de gadolinio altera el campo magnético, las moléculas de agua en el tejido circundante precesan a distintas frecuencias4.
Se ha demostrado que existe una relación lineal entre la concentración del agente de contraste y el porcentaje de cambio de señal T23. De esta forma, la concentración de contraste es proporcional a los cambios en la constante de relajación [ΔR2*], según la ecuación, ΔR2* (t)={-ln[S(t)/S0]}/TE} donde S(t) es la intensidad de señal en un tiempo t, S0 es la intensidad de señal precontraste, TE es el tiempo de eco y ΔR2* es el cambio en la constante R2, que se asume proporcional a la concentración del agente de contraste en el tejido1, siempre que no exista recirculación o fuga del agente de contraste4. Por tanto, del acortamiento de T2* durante el paso del bolo de gadolinio puede derivarse una curva de concentración de contraste en tejido-tiempo, sobre la que se pueden calcular diferentes parámetros.
Secuencias empleadas en la imagen de susceptibilidad magnética dinámica ponderada en T2*Las secuencias utilizadas deben poseer una adecuada resolución temporal, de forma que las imágenes de una serie dinámica se obtengan en un tiempo próximo a un segundo1. Intervalos mayores proporcionan mediciones menos exactas mediante las curvas de intensidad-tiempo. Por ello, la mayoría de los estudios utilizan secuencias de imagen eco-planar (EPI), capaces de generar aproximadamente 10 imágenes de resonancia magnética (RM) por segundo en cada serie, lo que las hace ideales para imágenes rápidas dinámicas1.
La utilización de secuencias eco de gradiente (EG) o de eco de espín (SE) para la adquisición de los datos de la perfusión, dependerá de muchos factores como la relación señal-ruido, la dosis de contraste o el tamaño de los vasos que se desea valorar5. Las secuencias EG presentan como ventajas una mejor relación señal-ruido, mayor cambio de señal en función de la concentración del agente de contraste y un comportamiento lineal a grandes concentraciones5. Estas secuencias proporcionan información para todos los tamaños de los vasos, aunque presentan una mayor sensibilidad para macrovasos, así pues, los cambios de señal aumentan con el diámetro del vaso hasta alcanzar una meseta y permanecen independientes del diámetro del mismo para valores superiores a 3-4μm6.
Por otra parte, las secuencias SE son especialmente sensibles para la valoración de vasos capilares de muy pequeño tamaño con un pico de cambio de señal para vasos de 1-2μm6. Algunos estudios han apuntado a la superioridad de las secuencias EG para la valoración mediante perfusión por RM de los tumores cerebrales6,7. Sugahara et al.6 evidenciaron que las ratios máximas de VSC relativo (rVSC) en los gliomas de alto grado eran mayores con la secuencia EPI-EG que con EPI-SE. En este sentido, la mayoría de los estudios publicados para determinar el grado preoperatorio de los tumores cerebrales utilizaron secuencias T2* EG8–15.
Otro de los aspectos a considerar es el tipo de contraste utilizado. En la actualidad se dispone de contrastes basados en gadolinio que, por sus propiedades, están especialmente indicados para los estudios de perfusión. Frente al contraste convencional 0,5mol/L, el gadobutrol 1,0mol/L (Gd-BT-DO3A; Gadovist® Bayer-Schering AG, Berlín, Alemania) presenta una formulación con una concentración dos veces mayor. De esta forma, puede administrarse la misma cantidad de gadolinio con una menor cantidad de volumen del bolo de contraste que con el contraste convencional. Esto permite obtener con el gadobutrol una geometría más adecuada del bolo de contraste, con un pico más afilado y un aumento más rápido de la concentración de gadolinio en sangre en el primer paso16. Otro contraste también especialmente útil en la PRM es el gadobenato de dimeglumina (Gd-BOPTA; MultiHance®; Bracco Imaging SpA, Milán, Italia). Este agente de contraste presenta unos valores de relajatividad T1 y T2 en sangre dos veces superior, debido a la débil y transitoria interacción del quelato Gd-BOPTA con las proteínas séricas17. Una dosis estándar tanto de gadobenato de dimeglumina como de gadobutrol permite un descenso de señal similar, de aproximadamente 30%, pero sustancialmente mayor que la caída de señal obtenida con los agentes de contraste convencionales17. Tanto con el gadobenato de dimeglumina como con el gadobutrol pueden obtenerse mapas de alta calidad para la cuantificación del VSC y del FSC, pero sin demostrarse diferencias significativas entre los mismos17.
Aunque existen estudios que han empleado dosis de 0,3mmol/kg o superiores de Gadobutrol para la realización de estudios de PRM16, Essig et al.17 demostraron que la utilización de dosis de 0,2mmol/kg, frente a 0,1mmol/kg, tanto de gadobutrol como de gadobenato de dimeglumina, generaba imágenes de mejor calidad, pero sin que esta mejoría repercutiera en un beneficio clínico.
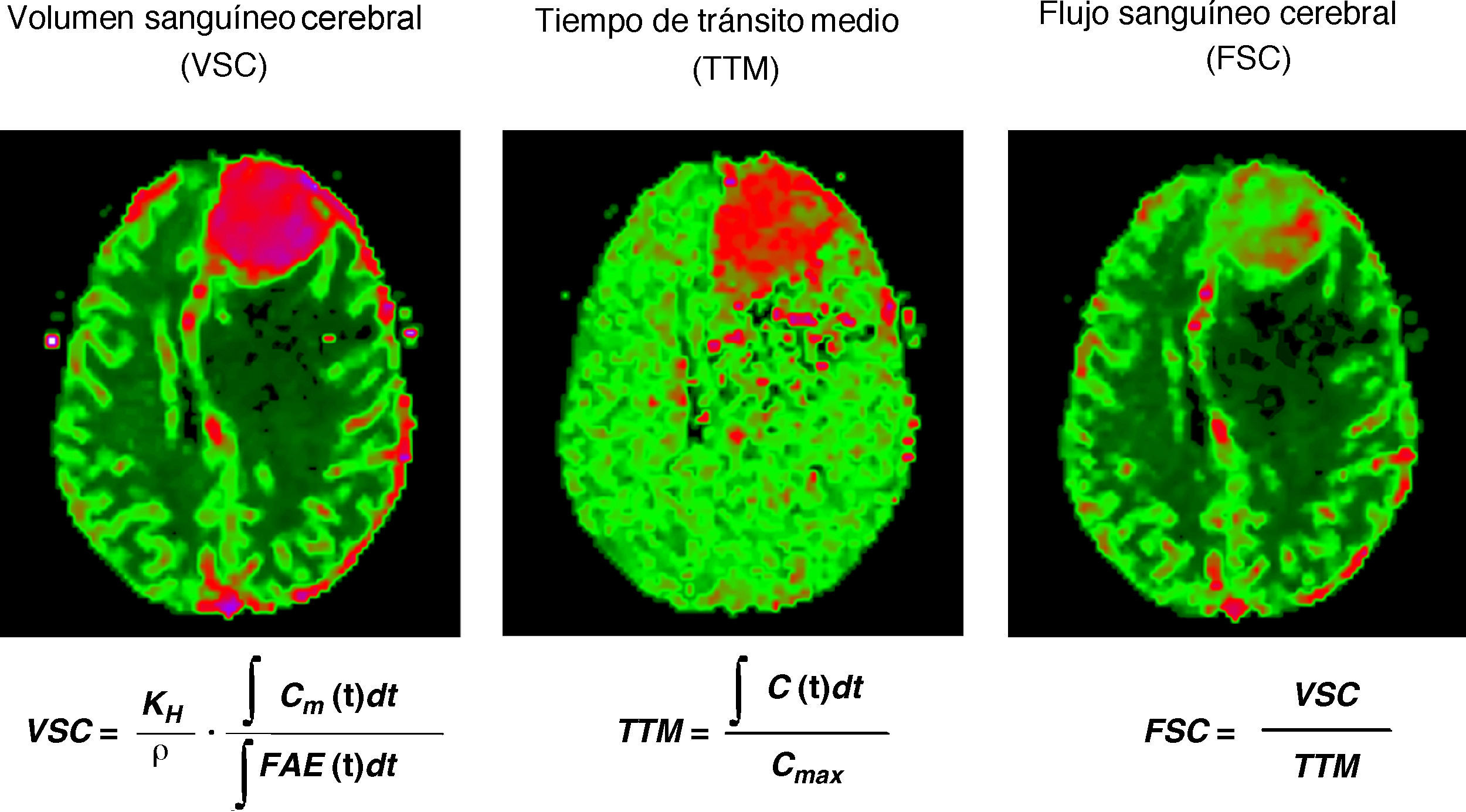
Parámetros calculados mediante la perfusión por resonancia magnética: VSC, FSC, TTM, TP y TmáxEl VSC se define como el volumen total de sangre que contiene una determinada zona del cerebro y se mide en mililitros de sangre por 100 gramos de tejido cerebral (ml/100g)2. El FSC es definido como el volumen de sangre atravesando una determinada zona cerebral por unidad de tiempo, medido en mililitros de sangre por 100 gramos de tejido por minuto (ml/100g/min)2. El TTM representa el tiempo medio que emplea la sangre desde la entrada arterial hasta la salida venosa, medida en segundos2. Estos parámetros se relacionan entre sí a través de la fórmula TTM=VSC/FSC (fig. 2).
Ejemplo de obtención de mapas paramétricos de color del volumen sanguíneo cerebral (VSC), tiempo de tránsito medio (TTM) y flujo sanguíneo cerebral (FSC) a partir de la convolución de la función arterial de entrada (FAE). Los valores obtenidos de cada parámetro son absolutos y la escala de color se ajusta a estos resultados (en rojo-valores superiores y en verde-valores inferiores).
Para el cálculo del FSC y del TTM es necesario el conocimiento de la función arterial de entrada (FAE) (fig. 3). Esta función representa la concentración de agente de contraste en el aporte arterial que irriga un tejido, en función del tiempo4. Así pues, conociendo la FAE y mediante un algoritmo de convolución pueden crearse mapas cerebrales de FSC y de TTM2. En el caso del VSC los cálculos pueden simplificarse de forma que puede determinarse el rVSC calculando el área bajo la curva de concentración-tiempo obtenida a partir de la curva intensidad-tiempo para cada vóxel2,5. El rVSC es una medida «relativa» y por tanto no es necesaria la FAE para su determinación2,4,5. Sin embargo, este cálculo es cuantitativamente menos exacto debido a que se obvian circunstancias que varían entre los pacientes (por ejemplo, la arquitectura vascular subyacente), factores fisiológicos (como el gasto cardiaco) o aspectos de la adquisición por RM (por ejemplo, las condiciones de inyección del contraste)5.
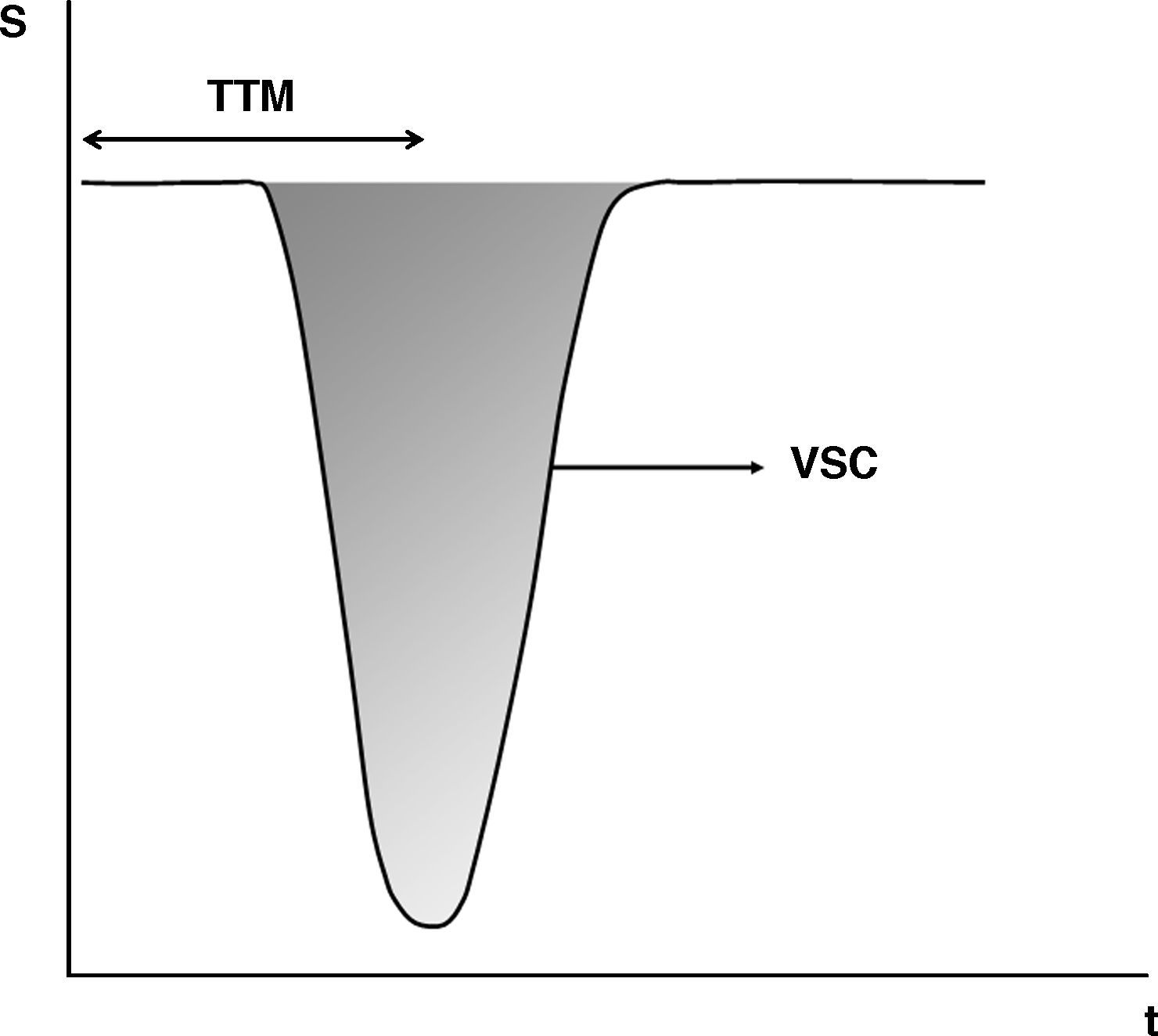
Forma de cálculo de los valores de los parámetros de perfusión a partir de la curva de caída de señal (S) con respecto al tiempo (t) en las imágenes dinámicas T2*. El área bajo la curva representa el volumen sanguíneo cerebral (VSC). El tiempo de tránsito medio (TTM) es aquel transcurrido desde la inyección del trazador hasta que se alcanza la anchura media de la curva. El flujo sanguíneo cerebral (FSC) se define como el cociente entre VSC y el TTM. Mediante este método no es necesario el cálculo de la función arterial de entrada, pero los valores obtenidos son relativos con respecto a un área de referencia.
Para simplificar la comparación entre diferentes pacientes, los valores de rVSC se normalizan con respecto al tejido contralateral2,8, generalmente con la sustancia blanca del lado contralateral sano3,6,8,13,18–23. Otros autores utilizan como región de referencia una zona homóloga del lado sano contralateral1,24. Es excepcional utilizar la sustancia gris para este proceso15.
A pesar de que los mapas de VSC son buenos indicadores de las regiones hipervasculares, los valores calculados píxel a píxel poseen una pobre relación señal-ruido. Por ello, es preferible calcular los VSC definiendo regiones de interés (ROI) en las zonas de máximo valor de este parámetro1.
El TP equivale al tiempo que transcurre desde el inicio de la inyección del trazador hasta que se obtiene el máximo cambio de señal. Su cálculo puede efectuarse mediante la curva señal/tiempo obtenida con la imagen de susceptibilidad magnética sin necesidad del conocimiento de la FAE25. El Tmáx constituye una estimación del TP tras una convolución con la FAE26.
Dificultades y artefactosIncluso utilizando un protocolo óptimo de adquisición de la PRM, existen factores de confusión potenciales en la interpretación de los mapas de perfusión. Una de las fuentes de error es un bajo gasto cardiaco o una baja velocidad de inyección5. En estos casos, debido a una insuficiente concentración del agente de contraste, no se induce el cambio de señal necesario para generar unos mapas de perfusión adecuados.
Cuando se valora la velocidad de inyección del contraste, hay que considerar que tasas inferiores a 3ml/s ocasionan una subestimación de los valores de VSC, mientras que valores superiores a 5ml/s no muestran beneficios para la determinación de este parámetro27. La mayoría de los artículos publicados emplean tasas de inyección entre 3-5ml/s 6,8,11,12,14,23,24,28–32 siendo el límite de velocidad empleado de 6ml/s9,20,33.
Otro artefacto potencial es resultado de la disrupción de la barrera hematoencefálica (BHE). La PRM ponderada en T2* asume que el contraste permanece en la vasculatura. Una vez que esta premisa no es válida, tampoco lo es la relación lineal asumida entre la concentración del contraste y la caída de señal5.
Por otra parte, cuando aumenta la permeabilidad de la BHE aparecen los efectos de fuga tanto T1 como T2 o T2* como fuente de error en la cuantificación de los parámetros de perfusión 34 (fig. 4). El efecto de fuga T1 es debido a que los contrastes de gadolinio tienen efecto T1 adicional al efecto T2*. El efecto no esperado T1 está provocado por extravasación del material de contraste y se identifica como un aumento de señal por encima de la línea basal tras la caída inicial33 (fig. 5). El área por encima de la línea de base es interpretada por el algoritmo como volumen sanguíneo negativo y se sustrae del área por debajo de la línea de base causada por la señal T2*2 lo que provoca una subestimación del VSC2,5,33.
A) En aquellas afecciones en las que hay una alteración en la permeabilidad de la barrera hematoencefálica se produce un paso del contraste desde la microvasculatura al intersticio. B) Debido a este fenómeno se puede producir un efecto de fuga T1 que se traduce en un aumento de la señal (S) después del período de disminución. C) También puede existir un efecto T2 que ocasiona una caída de señal añadida a la que existe por la llegada del bolo del trazador al parénquima de forma que se sobrestima el valor del volumen sanguíneo cerebral.
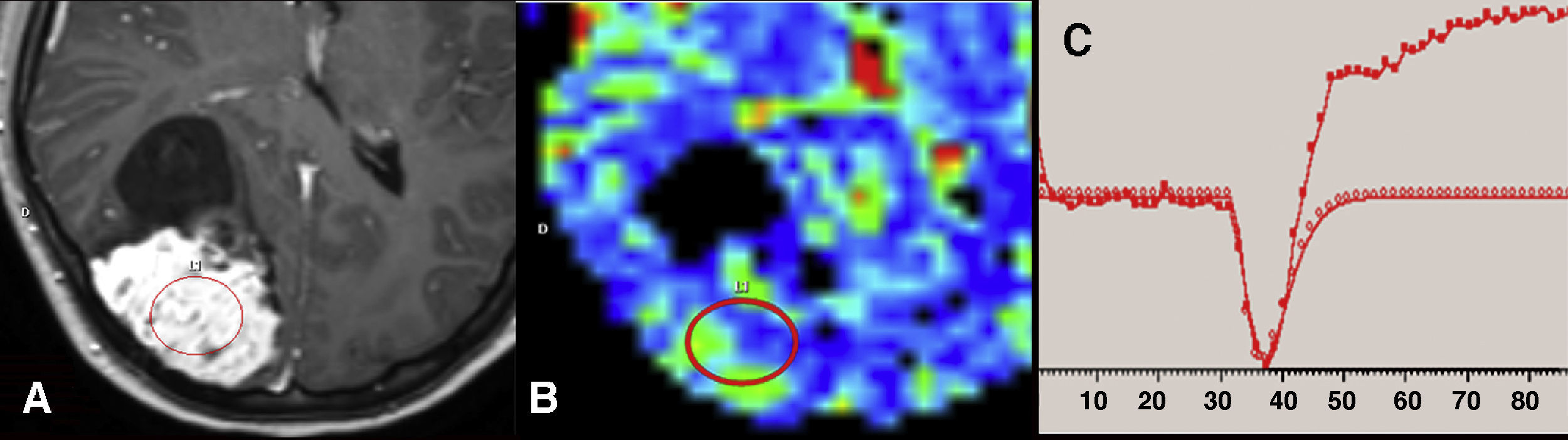
Ejemplo de efecto de fuga T1 en el estudio de perfusión por resonancia magnética (RM) debido a la susceptibilidad magnética del contraste. A) Imagen axial de RM ponderada en T1 con gadolinio que muestra un meningioma parietal derecho con intenso realce del componente sólido. B) Se identifica un aumento moderado del volumen sanguíneo cerebral en el mapa paramétrico de color. C) La curva de perfusión muestra un aumento de señal por encima de la línea basal tras la caída inicial, debida al efecto T1 del gadolinio por la extravasación del mismo al intersticio.
En el caso de fuga T2, se producirá una caída de señal de forma adicional y posterior a la ocasionada por la llegada al parénquima cerebral del bolo de contraste (fig. 6). En este caso existirá una sobrestimación de los valores de VSC34.
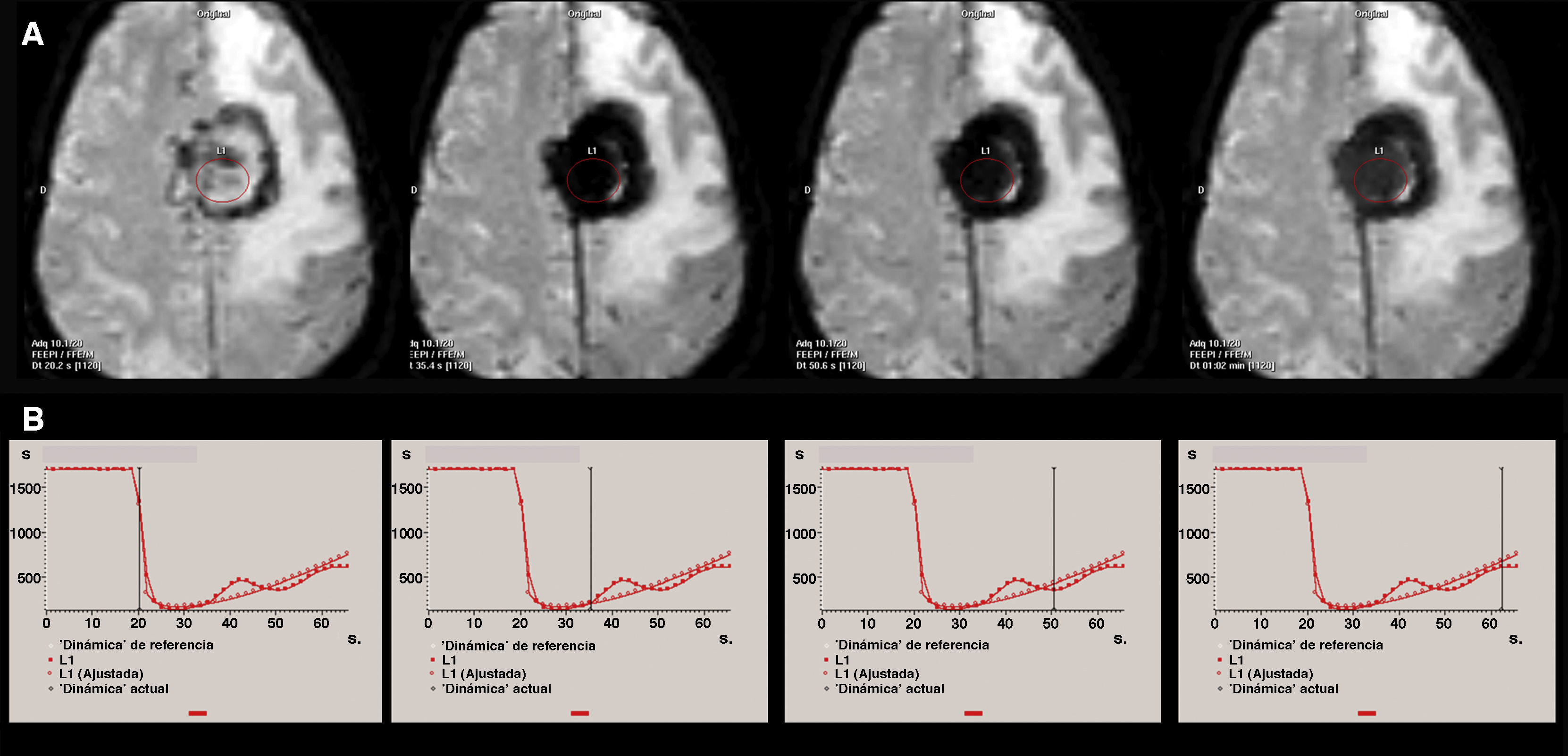
Ejemplo de efecto de fuga T2 en los estudios de perfusión por resonancia magnética (RM) debido a la susceptibilidad magnética del contraste en un paciente diagnosticado de meningioma parasagital frontal izquierdo. A) Las imágenes axiales de perfusión por RM EPI potenciadas en T2* representan el mismo plano axial en sucesivas imágenes dinámicas. B) Curva de perfusión con el indicador de la imagen dinámica correspondiente. Debido al efecto T2 por fuga de contraste se identifica una prolongación de la caída de señal en la neoplasia tras el primer paso del contraste por la microvasculatura cerebral. Este efecto se traduce en las imágenes EPI T2* por una marcada hipointensidad de la tumoración en todos las imágenes dinámicas obtenidas tras la llegada del contraste.
Las técnicas de ajuste a una función gamma sólo solucionan parcialmente este efecto indeseable T1 o T233. Por tanto, se han propuesto otros métodos para minimizar estas fuentes de error34. Uno de ellos, que evitaría el efecto de fuga T1, consiste en la utilización de agentes de contraste con disprosio, que tienen un efecto T2* más potente pero con un efecto T1 casi inexistente2,35. Sin embargo, este tipo de contraste es de difícil acceso.
La utilización de contrastes con doble concentración, como es el caso de gadobutrol 1,0mol/L, permiten un menor volumen de contraste frente al contraste estándar 0,5mol/L. De esta forma también será menor la cantidad de contraste extravasado por alteración en la permeabilidad de la BHE.
Otra forma de minimizar esta fuente de error consiste en aumentar el tiempo de repetición (TR), lo que disminuye el efecto T1. Sin embargo, como contrapartida, aumentaría la duración de la secuencia y disminuiría la resolución temporal si se mantienen otros parámetros de la secuencia como el número de series dinámicas o la cantidad de cortes en cada serie2. La reducción del ángulo flip también permite disminuir los efectos de fuga T1, pero este método disminuye la relación señal-ruido de la imagen obtenida por PRM34. Otro intento de compensar el efecto de la fuga de contraste es mediante la inyección de pequeñas dosis de gadolinio (0,25-0,5mmol/kg) 5-10 minutos antes de la administración intravenosa del bolo, con objeto de presaturar el intersticio y así elevar la línea de base antes de la adquisición inicial2,5. Este método es muy útil para disminuir los efectos T134, pero puede ser poco práctico en la realidad clínica2. Una solución interesante consiste en la obtención de un estudio dinámico de perfusión T1 previo a la obtención de las imágenes de susceptibilidad magnética T2*. De esta manera se logra minimizar el efecto T1 de fuga y, al mismo tiempo, se puede obtener información sobre la permeabilidad de la BHE (con el estudio dinámico T1) además del resto de parámetros de perfusión calculados con las imágenes dinámicas T2*36.
Otra alternativa es la de intentar corregir el efecto T1 mediante distintos procedimientos matemáticos o métodos de postprocesado2,5,33–35.
Un problema en la cuantificación de los parámetros de perfusión lo constituye la falta de estandarización tanto en la adquisición como en el postprocesado de los datos34. En este apartado se incluyen los distintos algoritmos de convolución empleados con los software convencionales proporcionados por las casas comerciales37. Esta limitación dificulta la comparación de los datos obtenidos intra o intersujetos.
Por otra parte, un aspecto esencial en el cálculo de los valores absolutos de FSC es la determinación de una estructura vascular adecuada para la valoración de la FAE. Lo más apropiado sería un vaso sanguíneo cerebral de gran tamaño y paralelo al campo magnético principal para evitar fenómenos de volumen parcial5. Además, deberían evitarse aquellos vasos cerebrales que presenten zonas de estenosis u oclusión.
Los mapas paramétricos de color que comúnmente se emplean para el análisis visual y la colocación de las ROIs son poco precisos, lo que incrementa el error de muestreo inherente a este tipo de análisis38, y su valoración dependen de aspectos como el nivel o ancho de ventana o la escala de color utilizada.
Por último, la PRM mediante técnicas de susceptibilidad magnética exige la administración de gadolinio con el consiguiente riesgo de fibrosis nefrogénica sistémica en pacientes con insuficiencia renal. Esta complicación es menos previsible con quelatos cíclicos que aquellos con estructura lineal debido a que estos últimos presentan una estabilidad cinética menor y, por tanto, es más probable la liberación de la molécula de gadolinio del quelato39.
Aplicaciones clínicas de la perfusión por resonancia magnéticaAplicación en tumores. GeneralidadesEl principio básico de PRM en la imagen oncológica es el aumento de las demandas metabólicas debido al rápido crecimiento celular y al aumento del recambio celular2. La hipoxia e hipoglucemia que se producen estimulan la actividad angiogénica a través de la producción de citoquinas40. Como consecuencia, estos tumores presentan una mayor proporción de vasos inmaduros y, por tanto, un incremento patológico de su permeabilidad36. Esta neoangiogénesis puede cuantificarse mediante la PRM.
Sin embargo, el aumento de la vascularización tumoral no indica necesariamente malignidad, siendo la principal excepción los tumores extraaxiales (papilomas del plexo coroideo, neurinomas o meningiomas)1,2,36,41. Un ejemplo de lesión intraaxial benigna con elevada vascularización lo constituyen los hemangioblastomas que muestran unos valores de VSC muy elevados41, a pesar de tratarse de una tumoración grado I de la Organización Mundial de la Salud (OMS). Esto es debido a las características histológicas de este tipo de tumores formados por abundantes capilares42,43.
También es importante reseñar que las zonas de mayor perfusión no se correlacionan necesariamente con las áreas de realce en la imagen por RM en secuencias potenciadas en T11,3,8. Las zonas de captación en las secuencias T1 indican áreas de alteración en la permeabilidad de la BHE.
Determinación del grado tumoral en los gliomasLa gradación de los tumores cerebrales es de gran importancia puesto que, en la mayoría de los casos, los tumores de alto grado (grado III y IV de la OMS y las metástasis) necesitan de tratamiento complementario mediante quimioterapia y radioterapia tras la cirugía mientras que en las neoplasias de bajo grado (grado I y II) es más controvertida la utilización de tratamientos adicionales tras la resección quirúrgica44,45. El grado tumoral también se relaciona con el pronóstico de la enfermedad puesto que el tiempo de supervivencia es significativamente menor en los tumores de alto grado46–49.
La mayoría de los artículos publicados acerca de la determinación del grado tumoral se basan en gliomas. Los valores de VSC son significativamente superiores en los tumores de alto grado (fig. 7). Mediante puntos de corte de rVSC que varían desde 1,16 a 3,9 se obtiene unas sensibilidades y especificidades en la determinación del grado tumoral que varían entre 100-72,5% y 96,8-55%, respectivamente9,11,18,23,24,28,31,50,51.
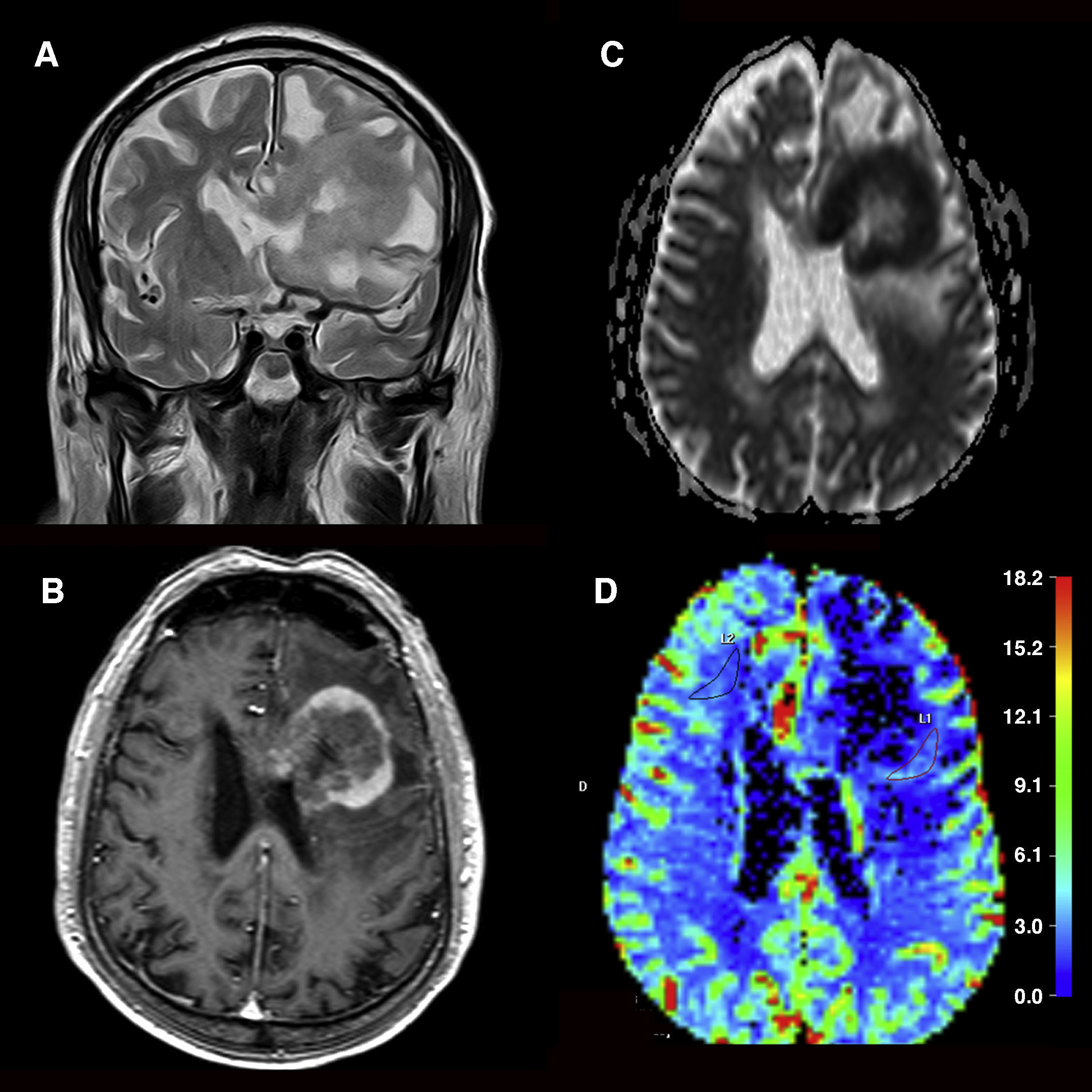
Determinación del grado de agresividad en los gliomas. Astrocitoma de bajo grado (A, B y C) localizado en la circunvolución postcentral izquierda. A) El tumor muestra una hiperintensidad en la secuencia T2 con ausencia de edema o necrosis. B) No se identifica realce tras la administración de gadolinio en la secuencia T1.C) El mapa paramétrico de color identifica unos valores de volumen sanguíneo cerebral similares a los de la sustancia blanca contralateral. Astrocitoma de alto grado (D, E y F) frontal bilateral con afectación transcallosa. D) En la imagen coronal ponderada en T2 se identifican signos de agresividad (edema, necrosis y heterogeneidad) de la tumoración. E) Tras la administración de contraste la neoplasia muestra zonas de realce «en anillo» en la secuencia T1 F) El mapa de volumen sanguíneo cerebral determina un incremento de este parámetro en la zona de captación.
Los oligodendrogliomas representan un caso especial, puesto que poseen unos valores elevados de VSC independientemente del grado de agresividad, de tal forma que una proporción de los oligodendrogliomas de bajo grado muestra unos valores elevados, superiores a los de los astrocitomas difusos de bajo grado10,28,44,52. Esto es debido a que los oligodendrogliomas presentan una densa red de vasos capilares, incluidos los de bajo grado44,53.
Diferenciación del tipo histológico tumoralLos hallazgos obtenidos mediante los estudios de perfusión cerebral pueden proporcionar una información útil para la diferenciación de determinados tipos histológicos tumorales.
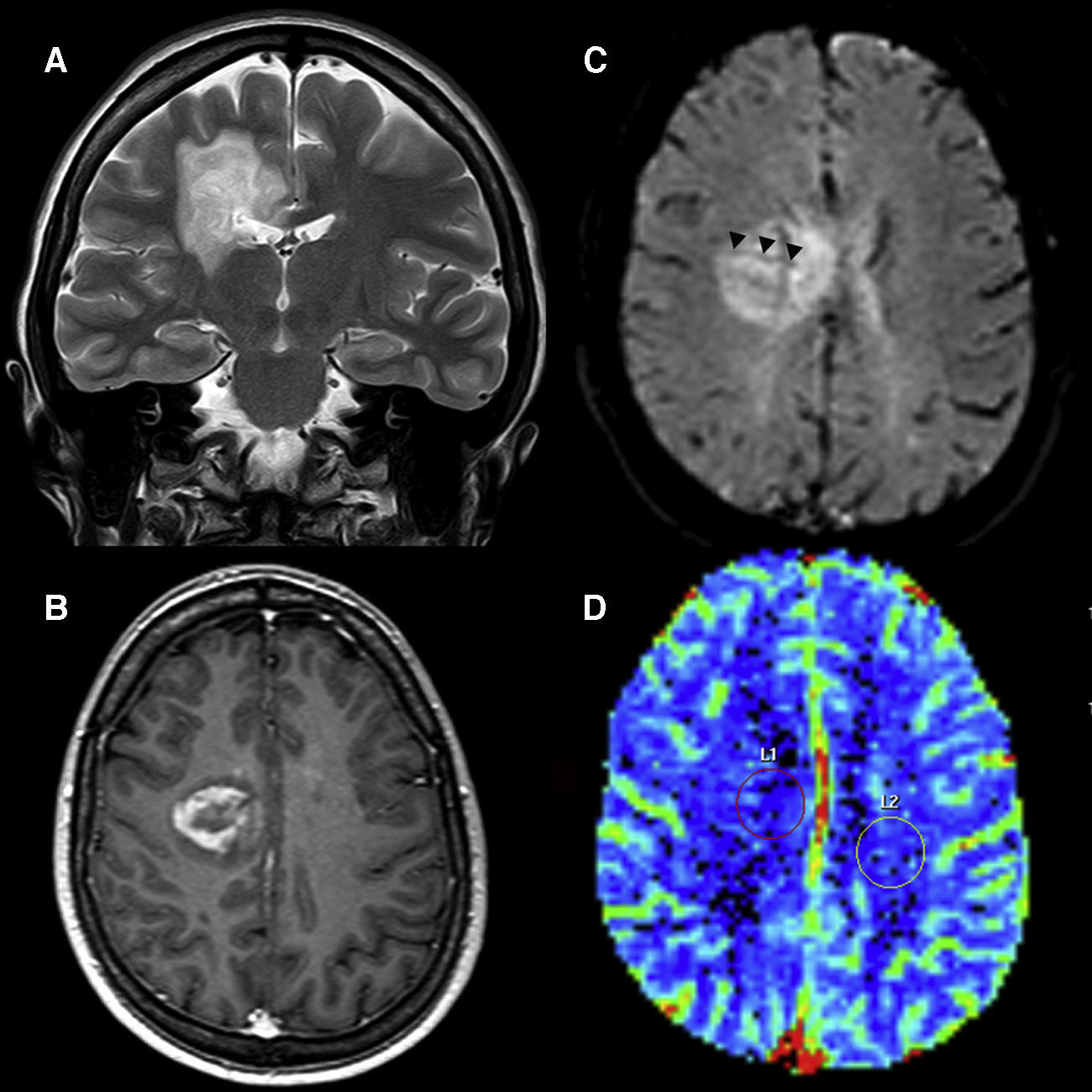
Los linfomas representan neoplasias que presentan una relativa disminución de los valores de VSC a pesar de la agresividad histológica, lo que puede ser útil para distinguirlos de otras neoplasias21,41,54–56 (fig. 8). Esto se explica porque presentan un patrón de infiltración angiocéntrica donde las células tumorales forman capas concéntricas perivasculares sin que la neovascularización sea un hallazgo prominente42. No obstante, los valores de rVSC pueden estar elevados en más de un 23,1-25% de casos54,56.
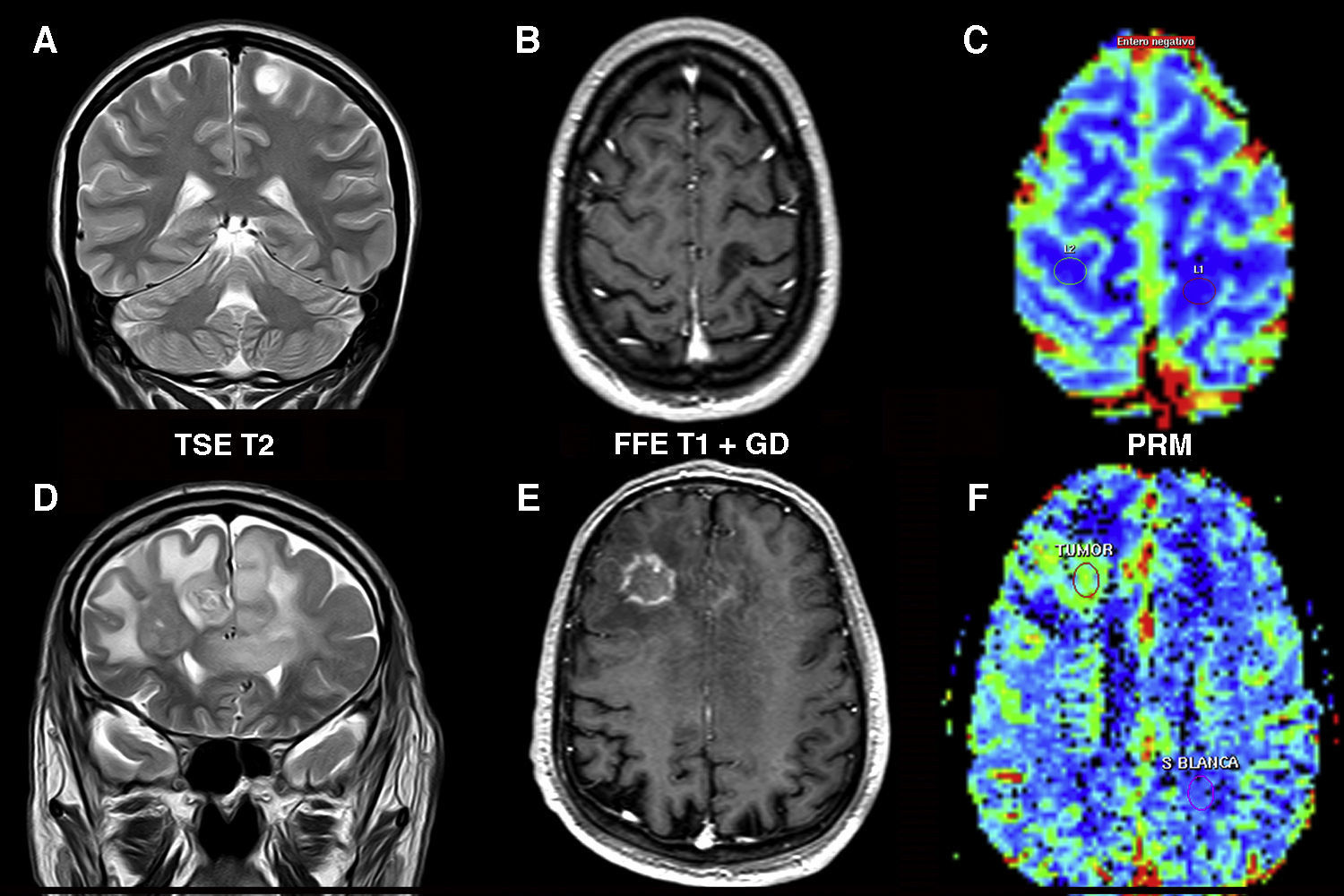
Linfoma cerebral. A) En la imagen ponderada en T2 se observa una tumoración periventricular izquierda de señal intermedia, con un área necrótica central y edema asociado. Existe afectación del cuerpo calloso. B) Tras la inyección de gadolinio se identifica una captación periférica del tumor en secuencias T1. C) Se visualiza una marcada disminución de los valores de los coeficientes aparentes de difusión, característica de este tipo de tumores. D) En los mapas de color los valores de volumen sanguíneo cerebral del tumor son similares o mínimamente superiores con respecto a los de la sustancia blanca contralateral.
Los estudios de perfusión también han sido utilizados para la diferenciación entre metástasis cerebrales y tumores gliales de alto grado. Algunos autores no identifican diferencias en los valores de VSC en la zona sólida tumoral11,57,58. Esto es debido a que los tumores metastásicos se expanden por el sistema nervioso central por vía hematógena e inducen una neovascularización. Estos capilares neoformados son similares a los de los gliomas malignos con uniones celulares comunicantes, membranas fenestradas y uniones endoteliales abiertas59. Bulakbasi et al. 9, por el contrario, encontraron unos valores de rVSC tumorales mayores en las metástasis que en los gliomas de alto grado, pero sin poder determinarse un punto de corte para su diferenciación. Kremer et al.55 demostraron sólo diferencias significativas entre gliomas y el grupo de metástasis de origen renal o por melanoma, debido posiblemente a que se trata de lesiones extremadamente vascularizadas. Sin embargo, debido al pequeño número de casos no se pudieron establecer conclusiones.
Por otra parte, se han encontrado diferencias significativas en los valores de VSC en el edema peritumoral dado que estos valores se encuentran significativamente elevados en los gliomas con respecto a las metástasis60. Se considera que en las metástasis cerebrales, el edema vasogénico acompañante está constituido por una fuga de agua de los capilares y las células tumorales no están presentes fuera de la masa neoplásica. Este líquido que migra desde el sistema vascular destruye la microcirculación y disminuye el flujo sanguíneo cerebral. Sin embargo, en los gliomas las células tumorales están presentes en el edema peritumoral. Por tanto, en esta zona la vascularización está relativamente preservada60.
Diferenciación con lesiones no neoplásicas: lesiones tumefactivas desmielinizantesLas técnicas de PRM pueden proporcionar una información esencial para la diferenciación de lesiones que presentan hallazgos de imagen convencional por RM que simulan lesiones tumorales.
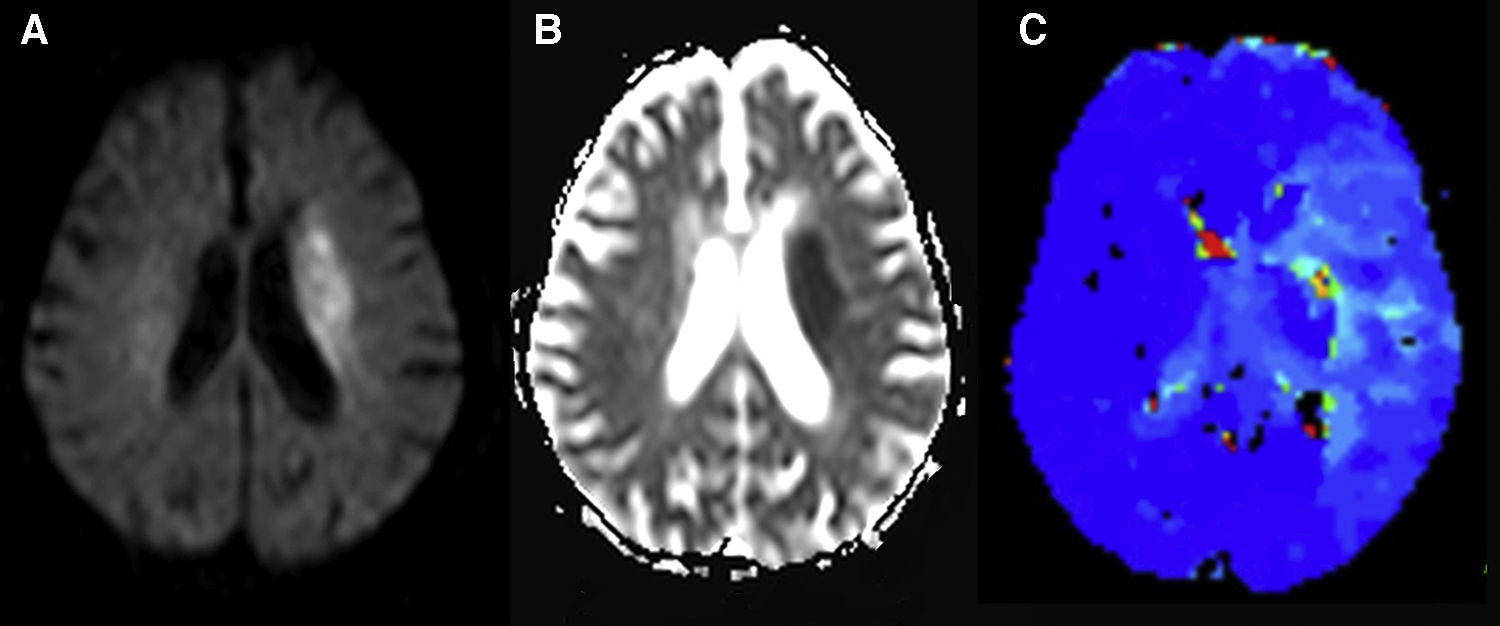
Así pues, las lesiones tumefactivas desmielinizantes (LTM) constituyen lesiones que muestran un efecto de masa, zonas de realce y necrosis/quistes de forma similar a las neoplasias agresivas61. Sin embargo, Cha et al.61 han demostrado que en las LTM los valores de rVSC son inferiores, de forma significativa, a los encontrados en los gliomas de alto grado o, incluso, en los linfomas. En la serie publicada por estos autores en ningún caso se superó el valor rVSC de 2. Estos resultados se justifican por la ausencia de una marcada angiogénesis en los especímenes histológicos62. Además, estos autores han identificado como hallazgo diferenciador en las LTM estructuras vasculares en las imágenes dinámicas potenciadas en T2*, que presumiblemente corresponden a venas, que atraviesan las lesiones en su recorrido hacia el margen de ambos ventrículos laterales (fig. 9).
Lesión tumefactiva desmielinizante. A) Lesión periventricular hiperintensa en secuencias potenciadas en T2 con edema asociado y extensión al cuerpo calloso. B) Se identifica un realce periférico incompleto en su margen medial en la secuencia T1 con contraste iv. C) En la imagen dinámica EPI T2 adquirida durante el primer paso del contraste por la microvasculatura cerebral se identifican estructuras lineales (puntas de flecha) que atraviesan la lesión con un recorrido hacia la pared del ventrículo lateral y que corresponden presumiblemente a venas subependimarias. D) En el mapa paramétrico de color, el volumen sanguíneo cerebral en la lesión es similar al encontrado en el centro semioval izquierdo.
Los recientes avances en el tratamiento del infarto cerebral agudo, tanto por procedimientos mecánicos como por fibrinólisis farmacológica han permitido obtener buenos resultados (escala modificada de Rankin ≤ 2) en el 25 al 45% de los pacientes tratados con una incidencia de hemorragia cerebral del 6 al 11%26. Por tanto, a pesar de que la probabilidad de un buen resultado aumenta con el tratamiento, la mayoría de los pacientes permanecen discapacitados a pesar de la terapéutica recibida. Se han publicado los resultados de varios ensayos63–66 que pretenden prolongar la indicación del tratamiento fibrinolítico intravenoso más allá del umbral establecido de 4,5 horas desde el inicio de la clínica67. En el caso de la terapia mediante trombectomía mecánica no se necesita de una ventana rigurosa de tiempo pero la decisión se realiza de forma individualizada y basada en la estimación del tejido potencialmente salvable68.
Estos hechos indican la necesidad de seleccionar mediante técnicas de imagen a aquellos pacientes que puedan beneficiarse del tratamiento precoz del infarto agudo cerebral con la mayor probabilidad de un buen resultado clínico y con el menor riesgo de hemorragia sintomática cerebral con independencia del tiempo transcurrido desde el inicio del evento isquémico. Para este fin se ha introducido el concepto de penumbra isquémica como aquella zona del cerebro funcionalmente afectada pero potencialmente viable que, normalmente, rodea una zona de infarto cerebral reciente69. La duración de la penumbra en los humanos todavía no es conocida con exactitud, pero con técnicas PET se ha demostrado su presencia más allá de las 24-48 horas69. No obstante, el área de penumbra se reduce drásticamente con el tiempo de evolución del infarto de forma que, más allá de las 6 horas, permanece menos del 20% de la penumbra70.
La forma más aceptada para la determinación de la penumbra isquémica es mediante la diferencia de volumen que existe entre la zona de disminución de los valores de los coeficientes aparentes de difusión (ADC) determinados mediante técnicas de difusión por RM (DRM), que representa el núcleo o centro del infarto, y la zona de hipoperfusión, más extensa, valorada mediante la PRM69. Esta diferencia de volúmenes es conocida comúnmente con el término inglés de mismatch («desacoplamiento») entre las anomalías de perfusión y difusión (fig. 10). No obstante, Parsons et al.71 consideraron que la respuesta al tratamiento fibrinolítico y la evolución del infarto depende más de los volúmenes, por separado, de PRM y DRM que de la extensión del mismatch perfusión-difusión.
Penumbra isquémica. A) Se identifica una zona de hiperintensidad en la imagen ponderada en difusión que se corresponde a un área de disminución de los valores de los coeficientes aparentes de difusión (B) localizada en la corona radiada izquierda y que representa teóricamente la zona de edema citotóxico y de infarto irreversible. C) En el mapa paramétrico de color se identifica una región de hipoperfusión con aumento del tiempo de tránsito medio en el hemisferio izquierdo que supera el área de restricción de la difusión (Imágenes cedidas por el Dr. Sebastià Remollo Friedemann del Hospital Universitario Doctor Josep Trueta. Gerona).
Generalmente, se estima que las alteraciones en la DRM representa la zona de edema citotóxico y de infarto irreversible26. No obstante, en algunos casos las anomalías de difusión pueden ser recuperables26,68.
Por otra parte, las anomalías de la PRM en el infarto cerebral agudo tienden a sobreestimar el área de penumbra puesto que representan tanto zonas de isquemia como también de oligoemia benigna que no presentan riesgo de evolución a lesión isquémica26.
Sin embargo, todavía no está establecido el parámetro y el umbral correspondiente que permita diferenciar el tejido infartado y de penumbra de la oligoemia68. Los parámetros más utilizados en la literatura son el TP, el TTM o el Tmáx26,72. El análisis de estos parámetros puede realizarse mediante valoración visual64,65,73 o con el empleo de valores cuantitativos umbrales que varían de 4-6s en el caso del TP o el TTP72 o de un Tmáx de ≥ 2s de retraso63,66 para determinar el área de penumbra. Sin embargo, algunos autores consideran que el umbral establecido de Tmáx ≥ 2 s utilizado en la mayoría de los estudios clínicos sobreestima el volumen del tejido en penumbra y, por ello, establecen valores de corte más restrictivos de Tmáx ≥ 6-8 s74 para distinguir el área de infarto irreversible de la penumbra o de ≥ 4 s para diferenciar la zona de penumbra de la oligoemia75.
Los resultados de varios ensayos clínicos que analizaron la terapia trombolítica más allá de las tres horas desde el inicio de la clínica de un infarto agudo cerebral sugieren que la presencia de un mismatch difusión/perfusión constituye un predictor de una respuesta terapéutica favorable más importante que la duración de la clínica63,65,66,73. En estos artículos, el concepto de mismatch se definió como una lesión evidenciada por PRM de, al menos, un 120% superior al volumen establecido por DRM63–66,73.
ConclusiónLas técnicas de PRM proporcionan una información funcional y complementaria a las técnicas convencionales de RM sobre la microvasculatura cerebral. El VSC es un parámetro que puede ser útil para la determinación del grado tumoral en los gliomas, para la diferenciación de éstos con otros tipos tumorales como los linfomas o las metástasis o para el diagnóstico de las LTMs. Asimismo, la PRM permite determinar la existencia de áreas de penumbra, potencialmente salvables, en pacientes con infarto isquémico cerebral agudo como zonas de mismatch.
No obstante, en la realización e interpretación de los estudios de PRM deben considerarse varios aspectos técnicos, como por ejemplo, la modalidad de perfusión y secuencia utilizada, tipo de contraste o la velocidad de inyección del mismo y las limitaciones existentes en este tipo de estudios: presencia artefactos de susceptibilidad magnética, cuantificación relativa y no absoluta del VSC en la mayoría de los casos o los problemas derivados de la fuga de contraste por alteración en la permeabilidad de la BHE.
Un conocimiento de las indicaciones y limitaciones de las técnicas de PRM permitirá su incorporación rutinaria en los protocolos de estudio por RM.
Autoría- 1.
Responsable de la integridad del estudio: JAGV
- 2.
Concepción del estudio: JAGV
- 3.
Diseño del estudio: JAGV, PFG, JMMP, MD
- 4.
Obtención de los datos: No procede debido al tipo de artículo.
- 5.
Análisis e interpretación de los datos: No procede debido al tipo de artículo.
- 6.
Tratamiento estadístico: No procede debido al tipo de artículo.
- 7.
Búsqueda bibliográfica: JAGV
- 8.
Redacción del trabajo: JAGV
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: PFG, JMMP, MD.
- 10.
Aprobación de la versión final: JAGV, PFG, JMMP, MD
Los autores declaran no tener ningún conflicto de intereses.