Las fístulas arteriovenosas durales medulares se producen por una comunicación directa entre los sistemas arterial y venoso de la médula espinal, ocasionando hipertensión en el último con disfunción del drenaje medular. Se trata de una patología rara, con etiología desconocida y una clínica inespecífica que suele provocar retraso en el diagnóstico. A menudo los radiólogos son los primeros que orientan el cuadro hacia un diagnóstico adecuado. Mediante resonancia magnética (RM) o angiografía por RM se pueden ver hallazgos característicos, pudiendo incluso localizar el lugar de la fístula en un porcentaje elevado de los casos, aunque la patología debe confirmarse mediante angiografía medular. Existen dos modalidades de tratamiento: terapia endovascular y quirúrgica. El tratamiento endovascular ha mejorado en los últimos años y presenta las ventajas de un abordaje menos invasivo, por lo que suele elegirse como terapia primaria. En este artículo revisamos las principales características clínicas, el diagnóstico por la imagen y el tratamiento de esta patología.
Spinal dural arteriovenous fistulas are produced by direct communication between the arterial and venous systems of the spinal cord, causing hypertension in the latter with spinal cord dysfunction. It is a rare pathology with unknown etiology and non-specific clinical symptoms that usually results in a delayed diagnosis. Often radiologists are the first to guide the disease towards an adequate diagnosis. Characteristic findings can be seen through MR or MR angiography, and may even locate the fistula in a high percentage of cases, although the pathology must be confirmed by spinal angiography. There are two treatment modalities: endovascular and surgical therapy. Endovascular treatment has improved in recent years with the advantages of a less invasive approach and is therefore usually chosen as primary therapy. In this article we review the main clinical manifestations, imaging findings and treatment of this pathology.
Las fístulas arteriovenosas durales medulares (FAVDM) representan una comunicación directa entre el sistema arterial que irriga a la médula espinal y el sistema venoso de drenaje, cuya consecuencia es un aumento de flujo venoso con exceso de presión que dificulta el drenaje medular normal. A pesar de ser la malformación vascular medular más frecuente1, las FAVDM son entidades raras y todavía infradiagnosticadas que, si no se tratan adecuadamente y de forma temprana, conducen a una morbilidad importante con afectación progresiva de la médula espinal. Los síntomas que producen son inespecíficos, siendo a menudo el radiólogo el primer médico en sugerir este diagnóstico tras un estudio mediante resonancia magnética (RM). Una vez hecha esta, para confirmar la enfermedad y poder planificar la estrategia terapéutica, la angiografía medular continúa siendo el método de referencia. Existen dos modalidades de tratamiento: endovascular y quirúrgico, cada uno con sus ventajas y limitaciones.
El objetivo de este artículo es describir las características clínicas de las FAVDM y sus hallazgos en RM y angiografía medular, así como describir las posibilidades terapéuticas con especial énfasis en el tratamiento endovascular.
ClasificaciónExisten distintos tipos de clasificaciones de la patología arteriovenosa medular, siendo las más extendidas las basadas en criterios hemodinámicos, que las dividen principalmente en dos categorías2,3: 1) fístulas arteriovenosas (FAV) medulares, con una derivación directa entre la arteria y la vena, y 2) malformaciones arteriovenosas, con la presencia de un nido (una red de vasos anormales) interpuesto entre la arteria y la vena. Las telangiectasias capilares y los hemangiomas cavernosos no están incluidos en esta clasificación porque son malformaciones vasculares sin comunicación arteriovenosa. Según su hemodinámica y asiento topográfico, se obtiene una forma práctica de clasificación (tabla 1).
Clasificación topográfica de las lesiones arteriovenosas medulares3
| Malformaciones arteriovenosas (MAV): | |
|---|---|
| 1. | MAV intramedular (también conocida como tipo II o MAV tipo glomus). |
| 2. | MAV pial. |
| 3. | MAV epidural. |
| 4. | MAV intramedular y extramedular (también conocida como tipo III, intradural-extradural, MAV juvenil o MAV metamérica). |
| Fístulas arteriovenosas (FAV): | |
| 1. | FAV pial (también conocida como tipo IV, FAV del cordón medular, FAV ventral intradural o FAV perimedular). Se subdividen en: |
| a) Pequeñas. | |
| b) Grandes. | |
| c) Gigantes. | |
| 2. | FAV dural (también conocida como tipo I o FAV dorsal intradural). |
| 3. | FAV epidural (también conocida como FAV extradural). |
Ha habido consenso en atribuir el primer informe clínico y patológico de lo que es más probable que represente una FAVDM a la descripción que hicieron Foix y Alajouanine en 19264. Ellos describieron por primera vez la clínica y luego los resultados de la autopsia de dos jóvenes con una mielopatía ascendente, que murieron 11 y 33 meses después de la aparición de una paraparesia ascendente5. El examen post mortem fue muy similar en los dos pacientes y la médula espinal inferior mostraba necrosis extensa, aunque lo más llamativo fue que los cambios en los vasos sanguíneos eran muy notables, visualizando vasos extramedulares ensanchados (debido a la hipertrofia de la íntima y las capas musculares), dilatados y tortuosos, con una luz vascular aumentada en lugar de disminuida, lo cual no era concordante con la necrosis medular por isquemia. Con estos hallazgos supusieron que las alteraciones vasculares habían precedido a los cambios necróticos.
Por ello, se ha utilizado el epónimo de síndrome de Foix y Alajouanine para designar la patología con una clínica sugestiva de ser una FAVDM, hasta que se describió su fisiopatología.
EtiologíaLa etiología sigue siendo desconocida4,6,7. El inicio de las manifestaciones en la edad media de la vida sugiere que se trata de una patología adquirida, en contraste con las fístulas piales o las malformaciones arteriovenosas, las cuales se asume que son anomalías congénitas. Algunas teorías apuntan a un origen traumático, sin embargo parece poco probable por lo que se desprende de algunos estudios como el de Jellema et al.4, en el que solo el 4% de los pacientes con FAVDM tenían algún antecedente traumático. Esto viene apoyado por el hecho de que, a pesar de que la columna cervical es la parte más móvil de la columna vertebral, las fístulas arteriovenosas en esta localización son raras. No se ha encontrado asociación entre las FAVDM y factores protrombóticos8, a diferencia de lo que sucede en las FAV durales cerebrales.
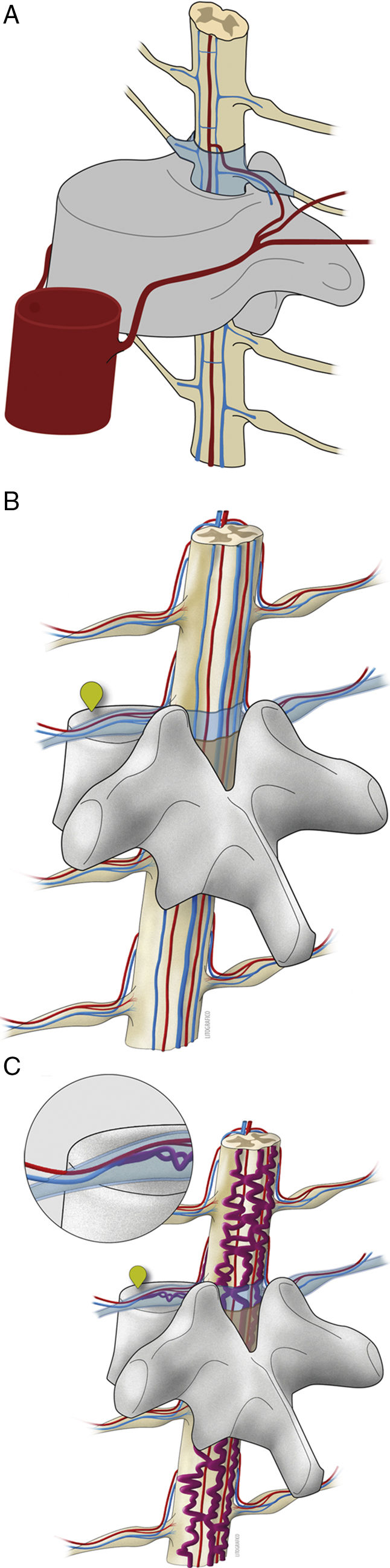
FisiopatologíaLa fístula o derivación arteriovenosa se produce en el espesor de la duramadre, en concreto en su superficie interna9, estableciéndose comunicaciones directas entre una o varias arterias radiculomeníngeas y una vena radiculomedular cuando esta última pasa a través de la duramadre en la región adyacente a la raíz nerviosa dorsal en el foramen intervertebral (fig. 1).
Las imágenes A y B representan de forma esquemática la irrigación arterial y el drenaje venoso normales de la médula en el segmento dorsal. Con el marcador de las figuras B y C se indica el típico lugar de asiento de las fístulas en el espesor de la duramadre, permitiendo la derivación sanguínea desde arterias meníngeas hacia una vena radiculomedular, con la consiguiente hipertensión venosa congestiva representada en la figura C.
El aumento de presión ocasionado por la derivación sanguínea desde un sistema arterial de alta presión a otro venoso de baja presión a través de la fístula hace que el sistema venoso se «arterialice», induciendo que las paredes de las venas intradurales se vuelvan gruesas y tortuosas debido a que tienen que soportar mayor presión10. En mediciones intraoperatorias directas de la presión vascular de la fístula se ha encontrado que puede llegar a ser tan alta como el 70-80% de la presión arterial sistólica11.
La hipertensión venosa crónica origina un estancamiento de sangre que dificulta la perfusión y el drenaje venoso medular, conduciendo a edema e isquemia progresivos de la médula espinal que se traducen en hipoxia crónica, necrosis y mielopatía progresiva12.
A medida que el cuadro progresa, el edema congestivo puede extenderse en dirección craneocaudal a lo largo de la médula espinal. Esto podría explicar por qué los primeros síntomas de la mielopatía a veces reflejan la disfunción del cono medular, a pesar de que la fístula se encuentra en una localización remota13.
EpidemiologíaA pesar de ser la anomalía vascular medular más frecuente, con una proporción de aproximadamente el 70% de todas las malformaciones vasculares medulares, las FAVDM son raras. Una estimación del principal centro de referencia en Alemania para enfermedades vasculares espinales arrojó una incidencia de 5-10 casos/millón de habitantes/año en la población general14. Sin embargo, la enfermedad parece estar infradiagnosticada15.
Las FAVDM se presentan con más frecuencia en hombres de edad avanzada. Un metaanálisis4 de las series con más de cinco pacientes concluyó que los hombres se ven afectados cinco veces más que las mujeres, y que la edad media en el momento del diagnóstico está en torno a los 55-60 años. Los pacientes menores de 30 años constituían menos del 1% de los casos de FAVDM.
La mayoría de las fístulas son lesiones únicas y se encuentran en la región dorsolumbar, entre T6 y L2 se diagnostica el 80% de todas ellas. Las lesiones sacras ocurren en aproximadamente el 4% de los pacientes, mientras que las lesiones cervicales altas se producen en el 2%. Las FAVDM cervicales bajas (por debajo de C2 y por encima de T1) son muy raras16. En aproximadamente el 2% de los pacientes hay FAVDM dobles de la columna vertebral17 o bien una asociación de una FAVDM con una derivación arteriovenosa pial medular18, elevando la posibilidad de una posible relación etiológica.
ClínicaLos síntomas iniciales son inespecíficos. Los pacientes presentan alteraciones motoras con debilidad de una o ambas extremidades inferiores, ocasionando alteraciones de la marcha y dificultad para subir escaleras. Son muy frecuentes las alteraciones sensitivas como entumecimiento, parestesias o disminución de la sensibilidad en uno o varios territorios19, así como dolor radicular que puede afectar a ambas extremidades inferiores o inicialmente solo a una de ellas, siendo también posible el dolor de espalda sin distribución radicular13. Estos síntomas neurológicos sufren un empeoramiento progresivo con el tiempo, y con frecuencia son ascendentes.
En casos raros, si la FAVDM se sitúa en el agujero magno con reflujo hacia un seno intracraneal, puede presentarse como una hemorragia subaracnoidea intracraneal20.
Normalmente, ya en fases avanzadas de la enfermedad se produce afectación intestinal y vesical, manifestándose como incontinencia o bien como retención urinaria o intestinal, siendo la disfunción eréctil un hallazgo frecuente en esta fase.
La clínica inespecífica puede confundirse con condiciones más prevalentes como la estenosis de canal, discopatías, artralgias degenerativas o patología vascular periférica, lo cual puede conducir a un retraso en el diagnóstico o incluso a una cirugía inadecuada. La mayoría de los pacientes muestran una combinación de dificultad para la marcha, trastornos sensoriales, alteraciones de la micción y de la defecación, así como disfunción sexual en el momento del diagnóstico21,22. Por ello es posible que los pacientes con FAVDM visiten a otros profesionales antes que a un neurólogo, como pueden ser traumatólogos (dolor), urólogos (retención urinaria) o incluso psicólogos (por la disfunción eréctil). Normalmente los déficits se han descrito como de progresión lenta, pero un comienzo agudo de la enfermedad y un desarrollo progresivo interrumpido por remisiones intermedias también son posibles.
DiagnósticoLa RM es la prueba fundamental para orientar el diagnóstico. Probablemente debido a la clínica inespecífica y la escasa incidencia de la patología, se ha establecido una media de entre 12 y 44 meses para realizar el diagnóstico4 desde el comienzo de los síntomas, siendo a menudo los radiólogos los primeros médicos en sugerir esta afección.
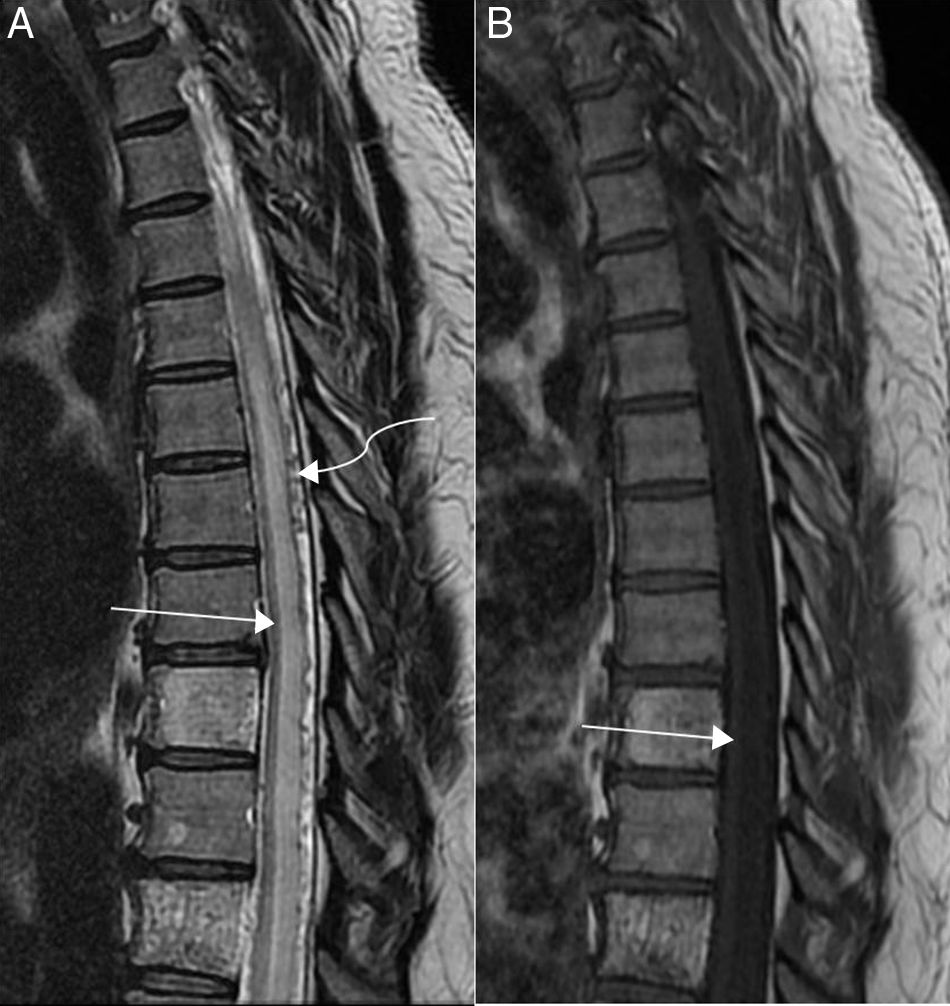
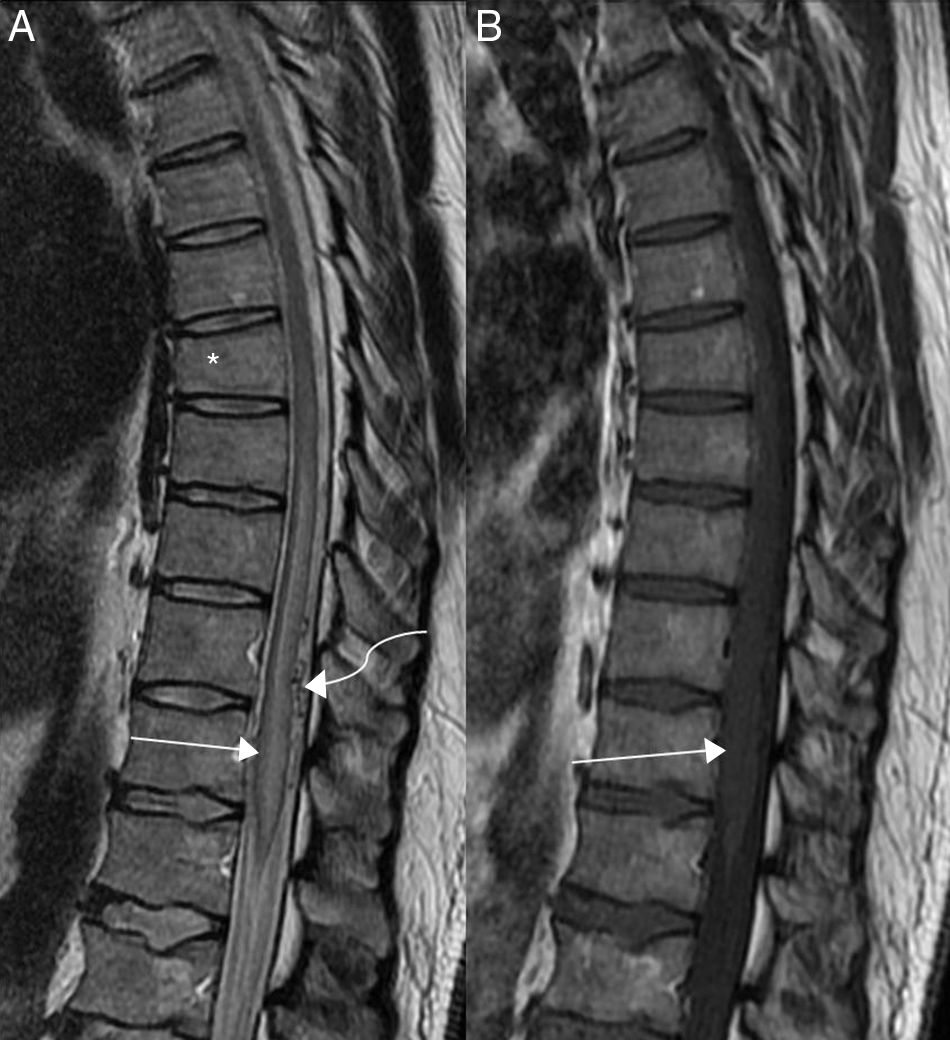
Los hallazgos en la RM reflejan la fisiopatología de la hipertensión venosa, identificando un ensanchamiento de la médula (sobre todo en la región torácica inferior y en el cono medular) como consecuencia del edema, el cual se visualizará en la RM como hiperintensidad de la señal de la imagen en las secuencias potenciadas en T2 e hipointensidad en las secuencias potenciadas en T1 (figs. 2 y 3), afectando tanto a la sustancia gris como a la sustancia blanca de múltiples segmentos de la médula23. Además, normalmente podremos identificar las venas congestivas intradurales dilatadas y con trayecto serpiginoso, que aparecerán en la imagen por RM como vacíos de señal en las secuencias potenciadas en T2, frecuentemente más marcadas en localización dorsal a la médula aunque también pueden verse ventrales a la misma, por lo general abarcando más de tres segmentos vertebrales24. Un estudio reciente incluso señala que puede predecirse el lugar de la fístula con RM convencional en los dos niveles vertebrales donde se encuentren los vacíos de señal de los acúmulos de vasos más ingurgitados25, pero hay que tener en cuenta que si hay un edema medular importante las venas pueden ser comprimidas por el efecto de masa y no ser detectables. La falta de hiperintensidad de la señal en T2 en la médula en casos de FAVDM es rara, aunque se han publicado casos13,26.
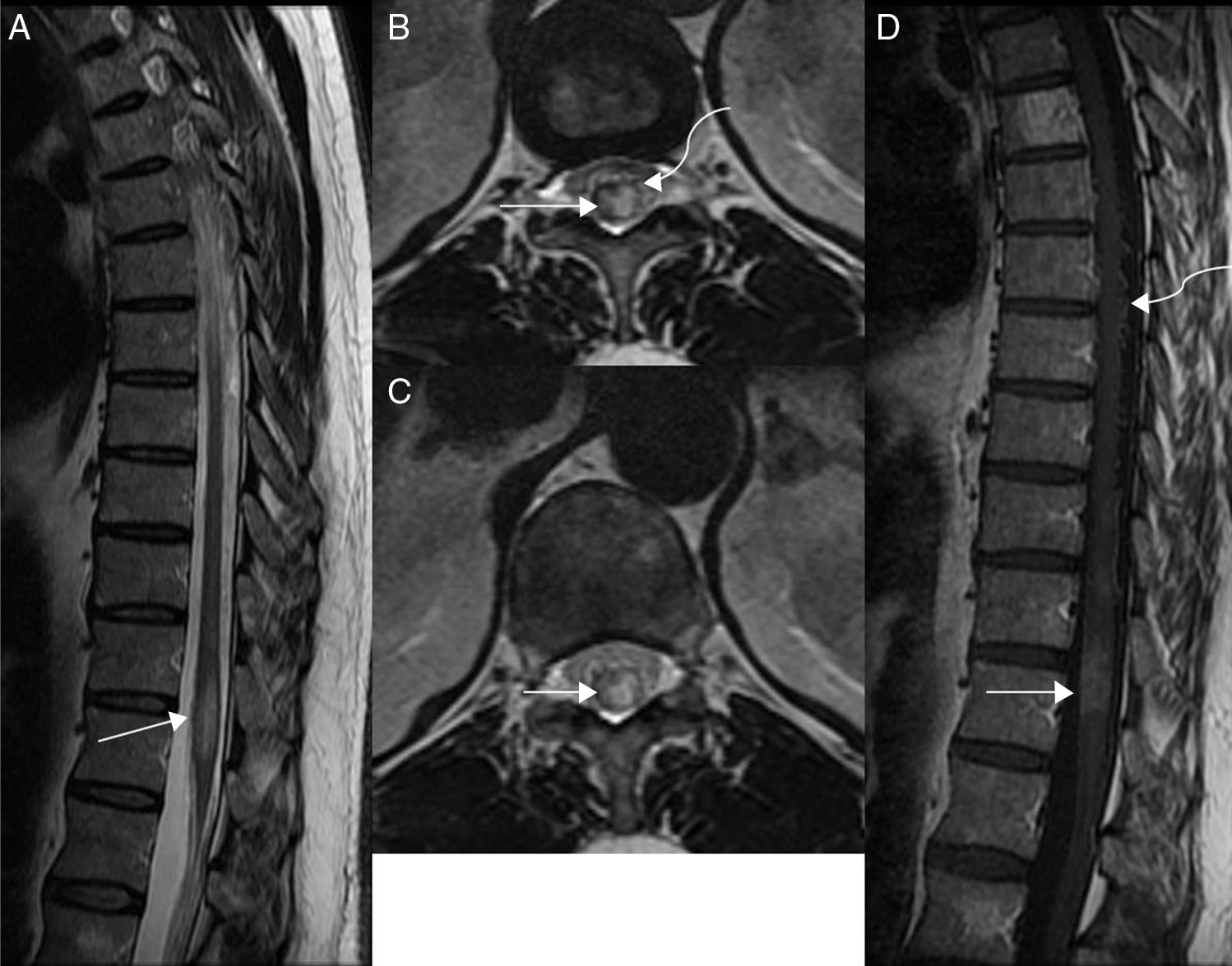
Varón de 46 años con varios episodios de lumbalgia que acudió a urgencias por paraparesia de extremidad inferior derecha (fuerza 3/5) de varios meses de evolución con empeoramiento progresivo. A) En la imagen sagital potenciada en T2 del segmento dorsal se aprecia un engrosamiento difuso del cordón con edema centromedular (flecha recta), representado por hiperintensidad de la señal desde D4 que llegaba hasta el cono medular (no visualizado en esta imagen). Se identifican pequeños vacíos de señal en localización dorsal a la médula (flecha curva), producidos por las venas congestivas por hipertensión. B) Imagen sagital potenciada en T1 en la que se observa un ensanchamiento del cordón medular, hipointenso en la región central (flecha). En esta secuencia apenas son visibles las venas congestivas dorsales a la médula. Además, se observan hemangiomas típicos sin signos de agresividad.
Varón de 40 años con lumbociatalgia izquierda de varios meses que evolucionó a paraparesia simétrica. A) Imagen sagital potenciada en T2 de columna dorsolumbar en la que se identifica un aumento de la intensidad de la señal en la región centromedular desde el nivel D9 hasta el cono medular (flecha recta), y dorsales a él vacíos de señal de aspecto tortuoso (flecha curva), características sugestivas de la presencia de una fístula arteriovenosa dural medular que se confirmó mediante angiografía medular. Acuñamiento anterior de cuerpo vertebral D8 (asterisco) de aspecto antiguo. B) Imagen sagital potenciada en T1 de columna dorsolumbar en la que se observa un marcado ensanchamiento del cono medular (flecha).
Es muy poco probable que, si no se identifican estas características mediante RM, la clínica que presente el paciente se deba a una FAVDM.
A pesar de que se ha descrito que no hay una clara correlación entre la localización y la extensión de la hiperseñal en T2 con el grado de afectación clínica que presentan los pacientes27, estudios recientes sugieren que a mayor extensión craneocaudal de las venas dilatadas intratecales que drenan la FAVDM28 o del edema medular29, mayor será el deterioro neurológico.
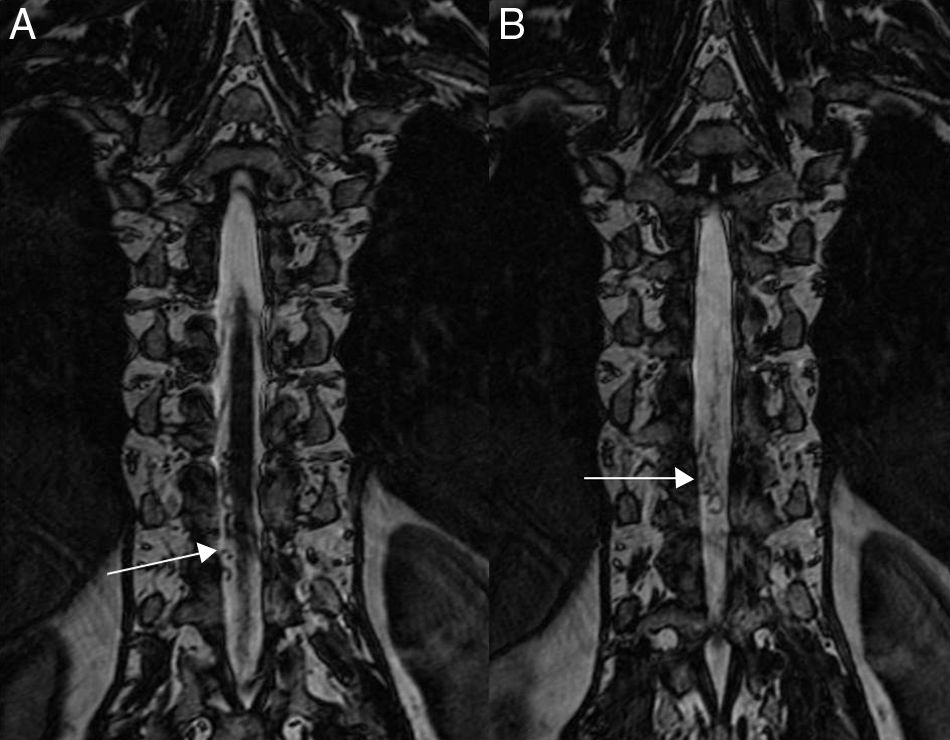
Si existe una fuerte sospecha clínica y la RM inicial sin contraste no es concluyente, pueden utilizarse secuencias mielográficas (con diferente nombre según el fabricante, por ejemplo PC-FIESTA, 3D-CISS, 3D SPACE, etc.)23,30, que están fuertemente potenciadas en T2 y ayudan a visualizar los vacíos de señal (fig. 4), pudiendo incluso localizar el lugar de la fístula en un alto porcentaje de los casos. Son secuencias volumétricas, con alta relación señal-ruido, buena resolución espacial y no dependientes del gasto cardiaco.
Varón de 40 años con lumbalgia de varios meses de evolución, parestesias en ambas extremidades inferiores y recientemente alteraciones en el control de los esfínteres. Reformateos coronales de secuencia FIESTA (Fast Imaging Employing Steady State Acquisition) posteriores al cordón medular sin administración de contraste, donde se observa el aspecto tortuoso de las venas congestivas (flechas) con un largo trayecto caudo-craneal. Se sugirió el origen de la fístula en el nivel D10 derecho, lo cual se comprobó posteriormente mediante angiografía.
En caso de que se decida la administración de contraste, su presencia servirá para visualizar el realce dentro del cordón medular por rotura de la barrera hematomedular, así como para aumentar la visibilidad de los plexos venosos perimedulares y las venas con trayecto serpiginoso (fig. 5), que podrían ser enmascaradas por artefactos de pulsación o de flujo en las secuencias T2 sagitales, o bien por la compresión ocasionada por el edema medular.
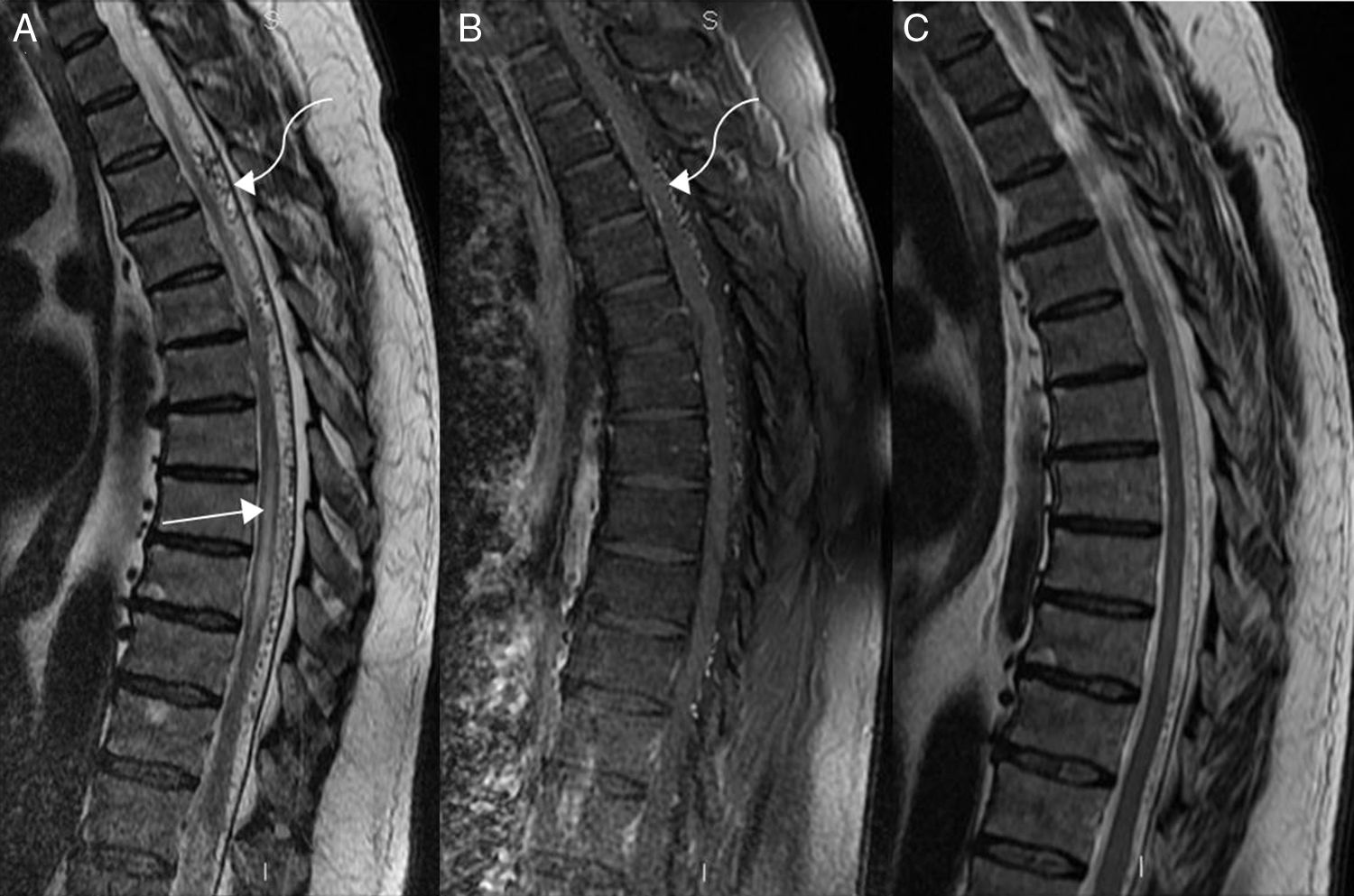
Varón de 58 años con paraparesia bilateral y alteraciones en el control de los esfínteres. A) Imagen sagital potenciada en T2 en la que se aprecia una mielopatía con hiperintensidad de la señal (flecha) por edema y ensanchamiento del cono medular. B y C) Imágenes axiales potenciadas en T2 a nivel del cono medular en las que se observa hiperintensidad de señal con predominio centromedular (flechas rectas). Pequeños vacíos de señal perimedulares ocasionados por las venas congestivas (flecha curva). D) Imagen sagital potenciada en T1 tras la administración de gadolinio, en la que se delimita un tenue realce del cono medular (flecha recta) con mejor visualización de las venas hipertensivas (flecha curva).
Si con la RM convencional y las secuencias mielográficas no se consigue identificar el nivel de la fístula, la angiografía por RM (angio-RM) es una prueba de gran utilidad (figs. 6 y 7). Debido a que el nivel segmentario de la hiperintensidad en T2, el realce tras administrar contraste y el ensanchamiento de la médula no son predictores del nivel segmentario de la fístula, la angio-RM en ocasiones puede conseguir determinar el lugar de la FAVDM24,31,32, traduciéndose en una cateterización selectiva guiada hacia esa localización en la angiografía medular33. Se han referido unas tasas de éxito en la detección de FAVDM mediante angio-RM mayores del 75%31,32,34,35, lo cual podría reducir en torno al 50% la dosis de radiación y la administración de contraste en las angiografías medulares confirmatorias, de forma que la angio-RM no obvia su realización, pero sí la facilita.
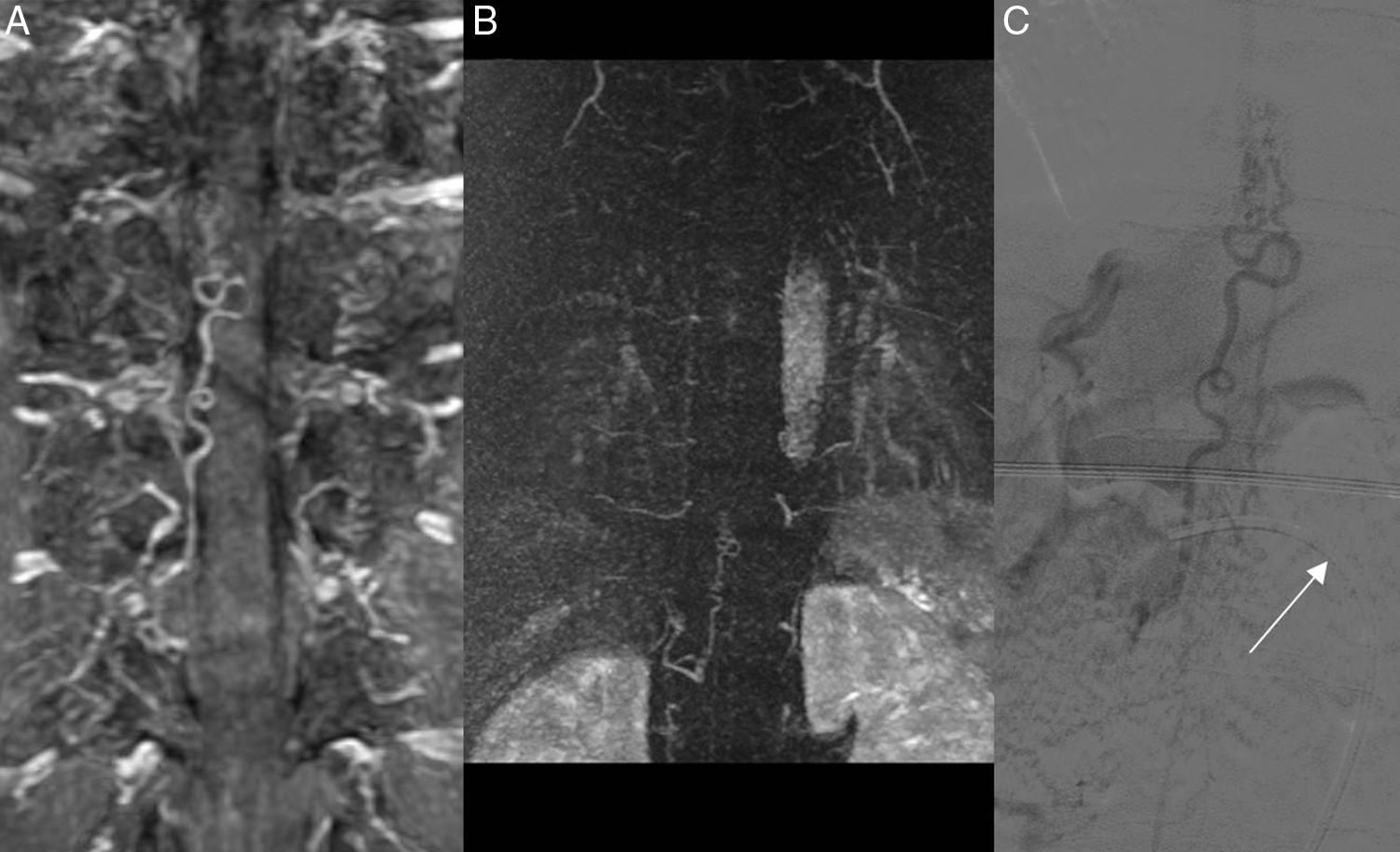
Varón de 52 años con parestesias en la extremidad inferior derecha y pérdida de fuerza de varios meses de evolución, sin clínica de esfínteres. Planos coronales de angio-RM en proyección de máxima intensidad (A) y con resolución temporal de cinética de contraste (TRICKS en inglés) (B). Se observan las venas congestivas y se identifica el origen de la fístula en el nivel D10 derecho, lo que se confirmó posteriormente en la angiografía medular (C), en la que se aprecia una perfecta correlación de la alteración vascular. La flecha señala el catéter por donde se introduce el contraste, situado en la arteria intercostal D10 derecha.
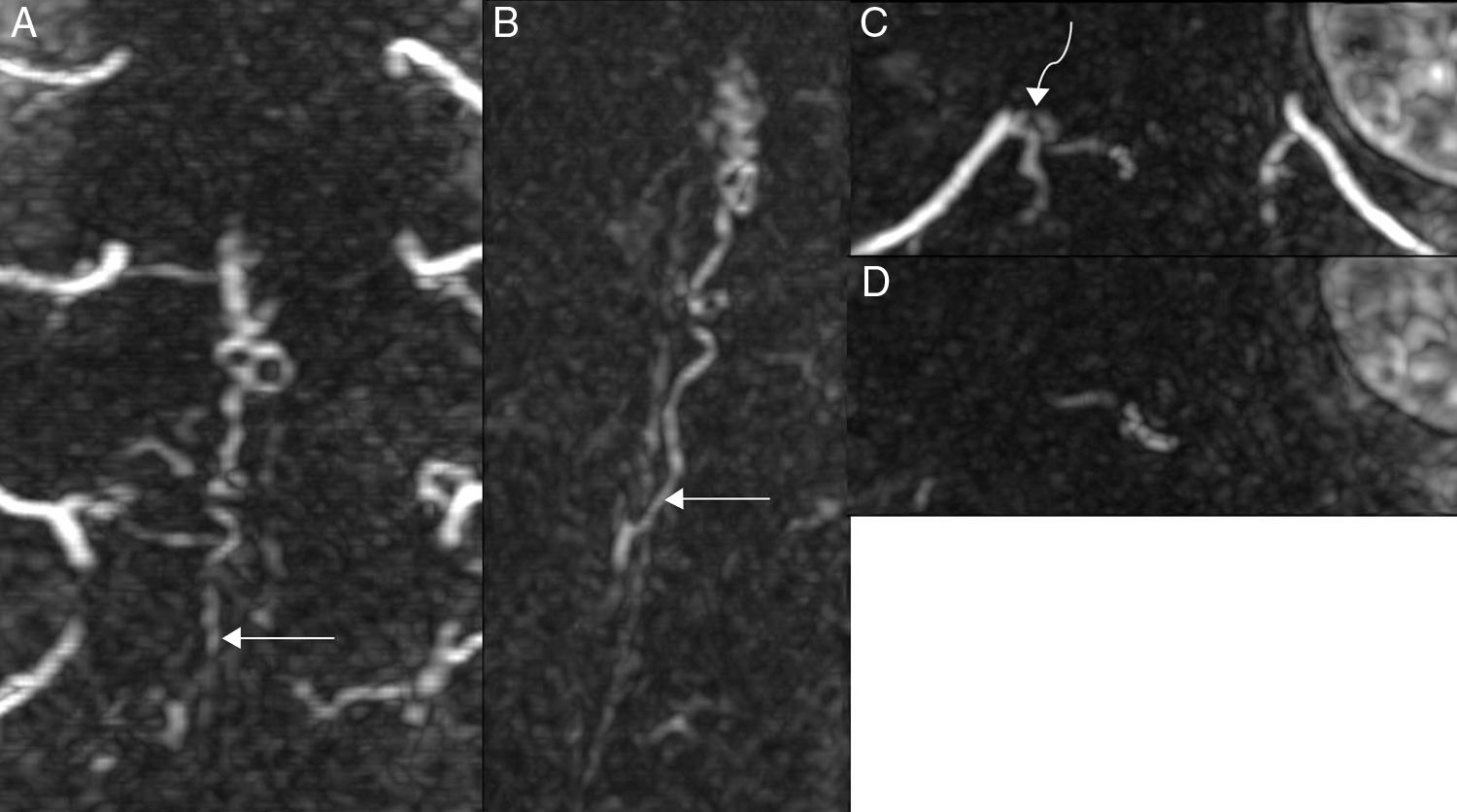
Reformateos coronal (A), coronal oblicuo (B) y axiales (C y D) de angio-RM en máxima intensidad de proyección del mismo paciente de la figura 6, en los que se observa una vena de drenaje (flechas rectas) desde los vasos perimedulares dirigiéndose hacia el punto fistuloso (flecha curva) situado en la rama dorsal de la arteria intercostal D10 derecha.
Fundamentalmente hay dos tipos de técnicas de angio-RM para tratar de definir y localizar las malformaciones vasculares medulares: secuencias 3D de primer paso y secuencias multifase de resolución temporal. Las primeras consisten en una primera adquisición de una secuencia sin contraste y a continuación, tras comprobar el completo realce de la aorta descendente, de forma manual o automática adquirir una fase arterial y otra venosa de una secuencia tridimensional rápida con codificación de fase elíptica centrada, insertando un retardo de 4 segundos para permitir una adecuada perfusión y el llenado de la fístula32. Tras un posprocesado con reformateo multiplanar se examinarán las imágenes en máxima intensidad de proyección. Siguiendo a la arteria intercostal o radiculomeníngea es posible identificar el lugar de la fístula como un segmento corto y borroso de realce que conecta la vena radiculomedular con la arteria nutricia34, pero debemos tener en cuenta que al ser una comunicación microvascular en muchos casos no se podrá observar y habrá que inferir su presencia, normalmente como un vacío de señal de escasos milímetros entre la arteria de derivación y la vena de drenaje. Las ventajas de estas secuencias son su mayor resolución espacial para identificar la fístula y que permiten visualizar la arteria de Adamkievicz. Las desventajas son que requieren mayor cantidad de contraste y un posprocesado laborioso.
En segundo lugar, están las técnicas de angio-RM multifase con alta resolución temporal (con diferente nombre según el fabricante: TWIST, TRICKS, 4D-TRAK, etc.). Son secuencias dinámicas con buena resolución espacial que permiten evaluar la cinética del contraste en arterias y venas, adquiriendo primero una secuencia sin contraste seguida de varias con contraste durante un tiempo determinado, generando así volúmenes con y sin sustracción e imágenes en máxima intensidad de proyección que pueden verse en modo cine36. Se observa en tiempo real cómo discurre el bolo de contraste para así poder identificar la fístula, con hallazgos similares a los descritos en las secuencias de paso único y añadiendo la posibilidad de visualizar un llenado precoz de la vena radicular de drenaje. Las ventajas son que necesitan menor cantidad de contraste, no requieren un seguimiento exacto del bolo y su posprocesado es más sencillo. Sus desventajas son que pueden no detectar patología de muy bajo flujo si no se da una resolución temporal suficiente, y que no identifican la arteria de Adamkievicz debido a su menor resolución espacial, con el riesgo de que si la fístula irriga a esta arteria existiría riesgo de compromiso vascular medular durante la terapia, siendo necesario localizarla en la angiografía medular confirmatoria.
En un estudio muy reciente se concluye que ambas modalidades de angio-RM son comparables para diagnosticar y localizar las FAVDM, con un excelente acuerdo interobservador37.
En los pacientes en quienes no es posible realizar una RM (claustrofóbicos, con marcapasos y desfibriladores implantables u otros dispositivos no compatibles con la RM) podría hacerse una angiografía por tomografía computarizada38–40, buscando vasos perimedulares dilatados y tratando de localizar la fístula, con los inconvenientes de sus menores tasas de detección, radiación asociada y necesidad de contraste yodado (con los consiguientes posibles problemas de alergia y nefropatía inducida).
La angiografía selectiva medular es el método de referencia para confirmar las FAVDM4,19,41. Se realiza con neuroleptoanalgesia o anestesia general según el paciente, y mediante técnica de Seldinger en abordaje femoral se procede a un cateterismo selectivo arterial. Los hallazgos típicos en el angiograma de la médula de una FAVDM son una rama de la arteria segmentaria dirigida medialmente hacia el sitio de entrada de la raíz nerviosa, fistulizando con una vena radicular en el espesor de la duramadre, pudiendo identificar el relleno temprano de contraste de la vena radicular en fase arterial y la posterior opacificación por vía retrógrada de un plexo venoso perimedular tortuoso y distendido7,12,42 (fig. 8) debido al exceso de presión. La circulación venosa se encuentra muy enlentecida.
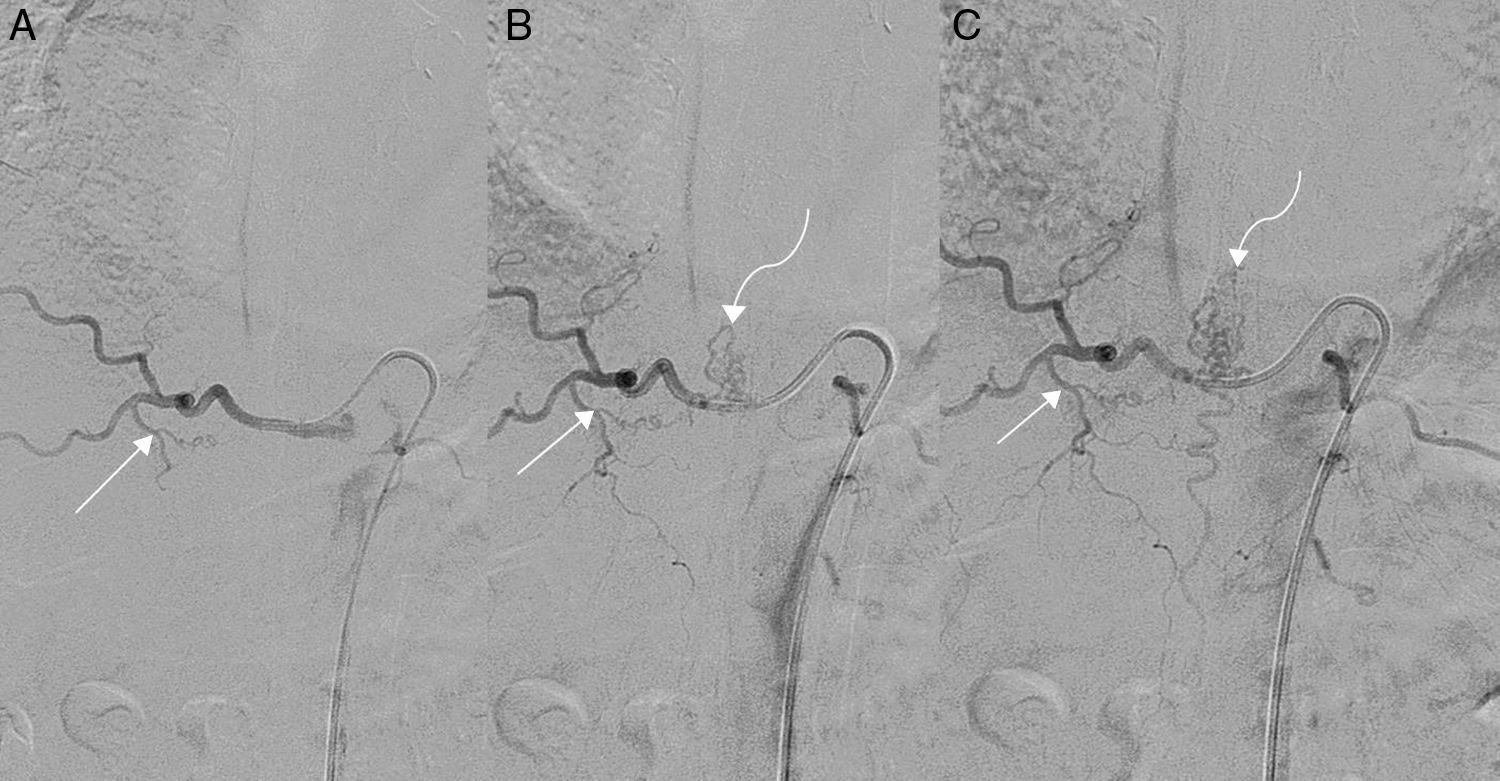
Varón de 55 años con clínica de parestesias y debilidad en ambas extremidades inferiores así como alteración en el control de esfínteres. A, B y C) Angiografías de sustracción digital con cateterización de la arteria D10 derecha, apreciando la arteria aferente (flechas rectas) que se dirige hacia el punto fistuloso y el relleno progresivo de las venas congestivas perimedulares (flechas curvas) en fases cada vez más tardías.
Si el angiograma se lleva a cabo en la fase venosa tardía, la descompresión de las venas radiculares en el sistema venoso epidural puede identificarse por lo general a cierta distancia desde el nivel de la fístula28.
TratamientoHay dos opciones en el tratamiento de las FAVDM: terapia endovascular y/o intervención quirúrgica. La finalidad del tratamiento es ocluir la zona de derivación sanguínea anómala (punto fistuloso), incluyendo la parte más distal de la arteria junto a la zona proximal de la vena de drenaje21,43,44. Una oclusión arterial únicamente proximal conduciría a una mejoría transitoria de los síntomas, pero debido a la abundante colateralización de la duramadre, la fístula tendría tendencia a recurrir en los siguientes meses7.
Los estudios publicados coinciden en que los síntomas con mayor probabilidad de mejora son los motores, con escaso éxito en el resto de la sintomatología (entumecimiento, parestesias, dolor y problemas esfinterianos).
En las últimas décadas, las mejoras en la técnica endovascular, los microcatéteres de acceso y los agentes embolizantes han aumentado la capacidad de tratar definitivamente la mayoría de las FAVDM, traduciéndose en estancias más cortas en el hospital y un inicio más temprano de la rehabilitación, con una morbilidad mínima del procedimiento. Además, en casos seleccionados podría realizarse el diagnóstico y el tratamiento en un mismo acto.
Los avances descritos han llevado a que en la mayoría de instituciones se intente inicialmente la embolización por vía endovascular y se reserve la intervención quirúrgica para los casos refractarios o para aquellos que no pueden ser embolizados21,43–47. Las cifras de éxito del tratamiento endovascular van del 25% al 90%, aunque en los últimos años se refiere entre un 70% y un 90%44, con unas tasas de recurrencia actuales del 15% al 30%21,43,44, dependiendo en parte del agente embolizante y del uso de microcatéteres de rigidez variable. El éxito de la técnica se cree que es dependiente de la oclusión completa del punto fistuloso y de la vena proximal de drenaje, lo cual requiere que el microcatéter esté lo más cerca posible de la comunicación arteriovenosa, debido a que si la embolización fuese demasiado proximal permitiría el desarrollo de colaterales, con altos índices de recidiva21,43.
La terapia endovascular no es posible en todos los pacientes. Debe evitarse en caso de que la arteria que alimenta la fístula irrigue a la arteria espinal anterior (la embolización implicaría un alto riesgo de isquemia de la médula espinal), así como si las dificultades técnicas impiden la introducción del microcatéter lo suficientemente cerca de la fístula4,43. En estos casos, por la persistencia de la fístula después de la embolización, sería necesaria la cirugía44,45.
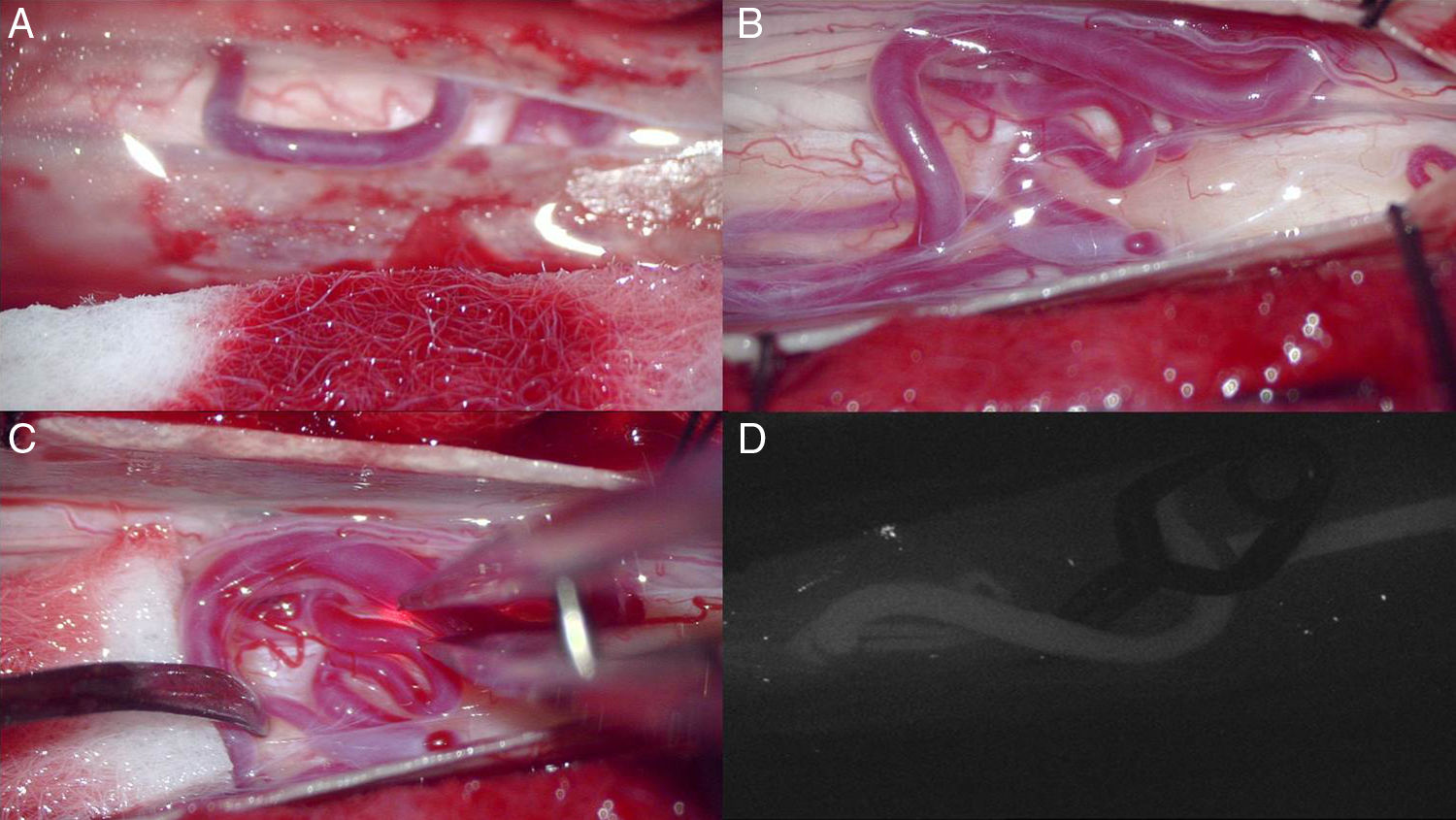
El tratamiento quirúrgico consiste en realizar una hemilaminectomía a nivel del pedículo vertebral donde se encuentre la fístula, seguida de la apertura de la duramadre y la localización de la vena de drenaje radicular, para proceder a su electrocoagulación o bien a su ligadura48 (fig. 9), con el fin de interrumpir el flujo a través de la misma y con ello la congestión venosa causante de la sintomatología. Durante el acto quirúrgico se observa un cambio de coloración en la citada vena, modificando su tinte arterializado por otro más acorde con su condición venosa. Se ha referido entre un 95% y un 98% de éxito en el procedimiento1,48.
A-C) Fotografías intraoperatorias tras laminectomía y apertura de la duramadre en las que se observan las venas congestivas perimedulares posteriores a la médula espinal y al neurocirujano localizando la vena de drenaje. D) Fotografía de videoangiografía intraoperatoria con verde de indocianina, técnica mediante la cual puede confirmarse la oclusión del sitio de la fístula en tiempo real. (Cortesía Dr. Lorente, Servicio de Neurocirugía del H.U. Miguel Servet, Zaragoza.).
Hay pocas complicaciones asociadas con la cirugía, siendo las principales la potencial inestabilidad de la columna después de una laminectomía, la cual se intenta limitar con abordajes cada vez menos invasivos, así como el desarrollo de un pseudomeningocele, cuyo riesgo puede ser minimizado con un meticuloso cierre dural, del músculo y de la piel.
La mayoría de las series quirúrgicas con al menos 12 meses de seguimiento demuestran una mejora o bien una estabilización de los síntomas después del tratamiento; no obstante, el estudio publicado con mayor número de pacientes refiere un empeoramiento transitorio del 15% y permanente del 6%48.
Para el control tras el tratamiento se realizará seguimiento clínico, de forma que si no hay un empeoramiento de la sintomatología ni recurrencia pueden realizarse controles mediante RM49, pero si se sospecha recidiva o desarrollo de colaterales será necesaria la angiografía medular. Los hallazgos esperados tras la oclusión exitosa de la fístula son una reducción en el tamaño de los vasos congestivos perimedulares y una disminución del ensanchamiento medular, así como del realce tras la administración de contraste23 (figs. 10 y 11). No obstante, hay que tener en cuenta que la hiperintensidad medular en las secuencias potenciadas en T2, el realce tras la administración de contraste o un ligero ensanchamiento medular pueden persistir incluso meses después de un tratamiento exitoso, sin que esto tenga correlación con los resultados clínicos50.
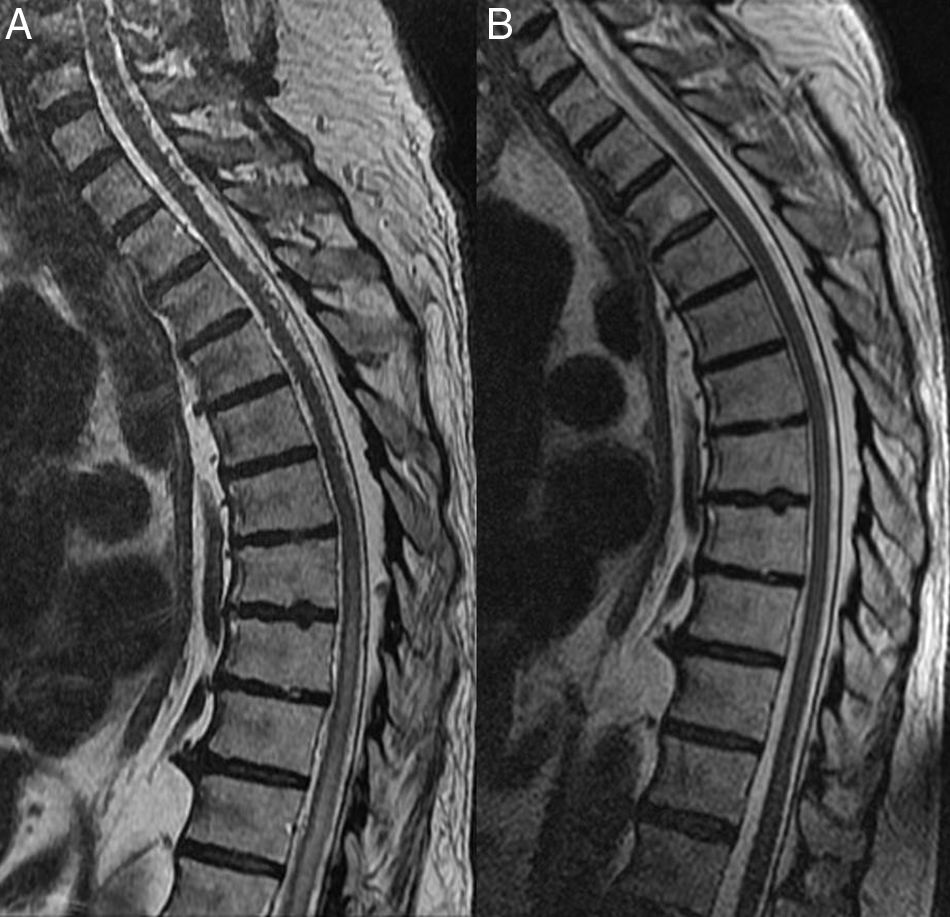
Varón de 55 años con dolor lumbar irradiado a la extremidad inferior izquierda y pérdida de fuerza en dicho miembro. A y B) Imágenes sagitales de secuencia potenciada en T2 (A) y en T1 tras la administración de gadolinio (B), en las que se observan un área de mielopatía dorsal (flecha recta) y prominentes vasos congestivos perimedulares con un largo trayecto posterior al cordón medular. En el control realizado 3 meses después de la embolización (C), en la secuencia potenciada en T2 apenas se identifica el área de mielopatía, y los vasos congestivos son aún visibles, pero mucho menos prominentes. La evolución clínica del paciente estaba siendo satisfactoria, con mejoría de la afectación motora y del dolor.
Varón de 70 años con intervención quirúrgica previa de estenosis de canal que presentaba paresia de pierna derecha y disestesias en la región del periné meses después de la intervención. En las imágenes sagitales de la secuencia de RM potenciada en T2 antes (A) y después (B) del tratamiento endovascular vemos cómo la extensa mielopatía del segmento dorsal bajo ha mejorado de manera ostensible, con desaparición de las venas congestivas perimedulares en la RM de control realizada 3 meses tras la embolización.
Después de la oclusión completa de la fístula, la progresión de la enfermedad puede detenerse en la mayoría de los casos51. El pronóstico a largo plazo depende de una serie de variables como el tiempo de evolución52, el grado de afectación, la situación funcional previa del paciente y la comorbilidad que presente, así como la localización de la fístula53,54 (si asienta sobre la región dorsal baja, el pronóstico es más favorable respecto a los otros segmentos raquídeos).
Los resultados clínicos tras el tratamiento son similares, ya sea por vía endovascular o mediante cirugía, pero el porcentaje de recidivas es mayor si la técnica elegida es la embolización55, aunque debe tenerse en cuenta que la tasa de éxitos con un único procedimiento endovascular es cada vez mayor. Existe consenso en señalar que la mejoría clínica más importante se produce en la afectación motora y de la marcha, en las cuales mejoran en torno a un 80% de los pacientes1,21,46,48,54,56, mientras que solo un tercio muestran una mejora de sus alteraciones sensoriales. La impotencia y las alteraciones de esfínteres rara vez son reversibles, y el dolor puede persistir a pesar del tratamiento. En casos raros de FAVDM con mucho tiempo de evolución, los pacientes pueden experimentar un empeoramiento a pesar de la oclusión completa53. Aun así, un deterioro de los síntomas después de una mejoría inicial debería aumentar la sospecha de recanalización de la fístula o de una derivación secundaria.
Lo que es evidente es que la falta de tratamiento desemboca en un empeoramiento progresivo con una mayor hipoxia y más isquemia medular, con el consiguiente incremento de la afectación motora, sensitiva y de esfínteres57. La mayoría de los pacientes no tratados padecerán una discapacidad grave dentro de los 3 años de la aparición de debilidad en las piernas, y la mielopatía progresiva causada por la hipertensión venosa empeorará progresivamente, sin posibilidad de mejoría sin tratamiento. Por todo ello, se considera a las FAVDM una afección poco frecuente, con un curso progresivo, que deben ser tratadas de manera precoz.
ConclusionesLas FAVDM representan un reto diagnóstico debido a su baja prevalencia y a unas manifestaciones clínicas no específicas. La RM es la herramienta fundamental para orientar el cuadro, visualizando edema medular, vasos perimedulares dilatados y realce en el cordón medular tras la administración de contraste. El diagnóstico debe confirmarse mediante angiografía medular, preferiblemente precedida de un estudio selectivo con secuencias mielográficas o angio-RM para tratar de determinar el nivel de la fístula.
La tendencia actual es elegir el tratamiento endovascular como primera opción, reservando la cirugía para aquellos casos en los que este no es posible o ha sido fallida la embolización, aunque la elección del tratamiento debe ser individualizada en cada caso. La afectación es progresiva, por lo que un diagnóstico y un tratamiento precoces pueden favorecer el pronóstico de los pacientes con mejora o estabilización de la afectación motora y en menor medida del dolor y la afectación sensitiva, teniendo escasa repercusión en el control de los esfínteres si este tipo de afectación ha llegado a producirse.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsables de la integridad del estudio: JIG y RMG.
- 2.
Concepción del estudio: JIG y RMG.
- 3.
Diseño del estudio: JIG y RMG.
- 4.
Obtención de los datos: JIG y RMG.
- 5.
Análisis e interpretación de los datos: JIG y RMG.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: JIG y RMG.
- 8.
Redacción del trabajo: JIG y RMG.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JIG y RMG.
- 10.
Aprobación de la versión final: JIG y RMG.
Los autores declaran no tener ningún conflicto de intereses.
Al resto de los miembros de las secciones de neurorradiología intervencionista (Dra. Barrena y Dr. Guelbenzu) y diagnóstica (Dras. Bernal, Cózar, Seral y Vela, Dr. Marín), así como al Dr. Mayayo, por su inestimable ayuda. Todos han participado en el diagnóstico o en el tratamiento de los casos aquí presentados. A José Luis del Campo por sus magníficas ilustraciones.