El objetivo de este artículo es describir los hallazgos en imagen de los tumores mucinosos de abdomen y pelvis que, por su composición, comparten características radiológicas independientemente del órgano de origen. Debido al alto contenido hídrico del moco, generalmente muestran un aspecto similar al agua en la ecografía, la tomografía computarizada y la resonancia magnética. Otra característica común de los tumores productores de mucina es la frecuente presencia de calcificaciones. La rotura de estas lesiones con acumulación de material mucinoso en la cavidad peritoneal da lugar al pseudomixoma peritoneal. La importancia de la identificación de las neoplasias mucinosas radica en el diferente manejo, pronóstico y evolución clínica con respecto a las no mucinosas; en función de su localización anatómica y las características de imagen, la actitud varía desde el seguimiento a la cirugía radical en combinación con quimio y/o radioterapia.
This article aims to describe the imaging findings for mucinous tumors of the abdomen and pelvis, which have a similar appearance on imaging tests regardless of the organ in which they develop. Due to the high water content of mucus, the appearance of these tumors is generally similar to that of water on ultrasonography, computed tomography, and magnetic resonance imaging. Another common feature of mucin-producing tumors is that calcifications are often present. The rupture of these lesions and accumulation of mucinous material in the peritoneal cavity gives rise to pseudomyxoma peritonei. It is important to identify mucinous tumors because they have a different prognosis and clinical course than non-mucinous tumors and require different management. Depending on their anatomic location and their imaging characteristics, the treatment approach varies from follow-up to radical surgery together with chemotherapy or radiotherapy or both.
En la región abdominopélvica, las células epiteliales del tracto digestivo y urogenital expresan mucinas. Las mucinas son una familia de glucoproteínas formadas por oligosacáridos unidos a un núcleo proteico con capacidad para formar geles, por lo que son un componente clave en las secreciones mucosas, cumpliendo funciones relacionadas con la lubricación, protección inmunológica o señalización celular.
Muchos tumores, especialmente adenocarcinomas, producen cantidades variables de mucina por desregulación de la expresión de la proteína del núcleo. En estos casos, las mucinas contribuyen a la carcinogénesis e invasión tumoral1.
Debido al alto contenido hídrico del moco (95%), la mucina generalmente muestra un aspecto similar al agua en la ecografía, la tomografía computarizada (TC) y la resonancia magnética (RM). Sin embargo, el aspecto radiológico de las neoplasias productoras de mucina varía dependiendo del órgano y de la densidad o contenido proteináceo de la mucina: cuando es densa y proteinácea, tiende a ser ecogénica en ecografía, hiperdensa en TC, hiperintensa en secuencias T1 (ST1) e hipointensa en secuencias T2 (ST2) de RM1. Otra característica común de estos tumores es la frecuente presencia de calcificaciones, posiblemente por la similitud de la mucina con una glicoproteína presente en el cartílago de crecimiento2.
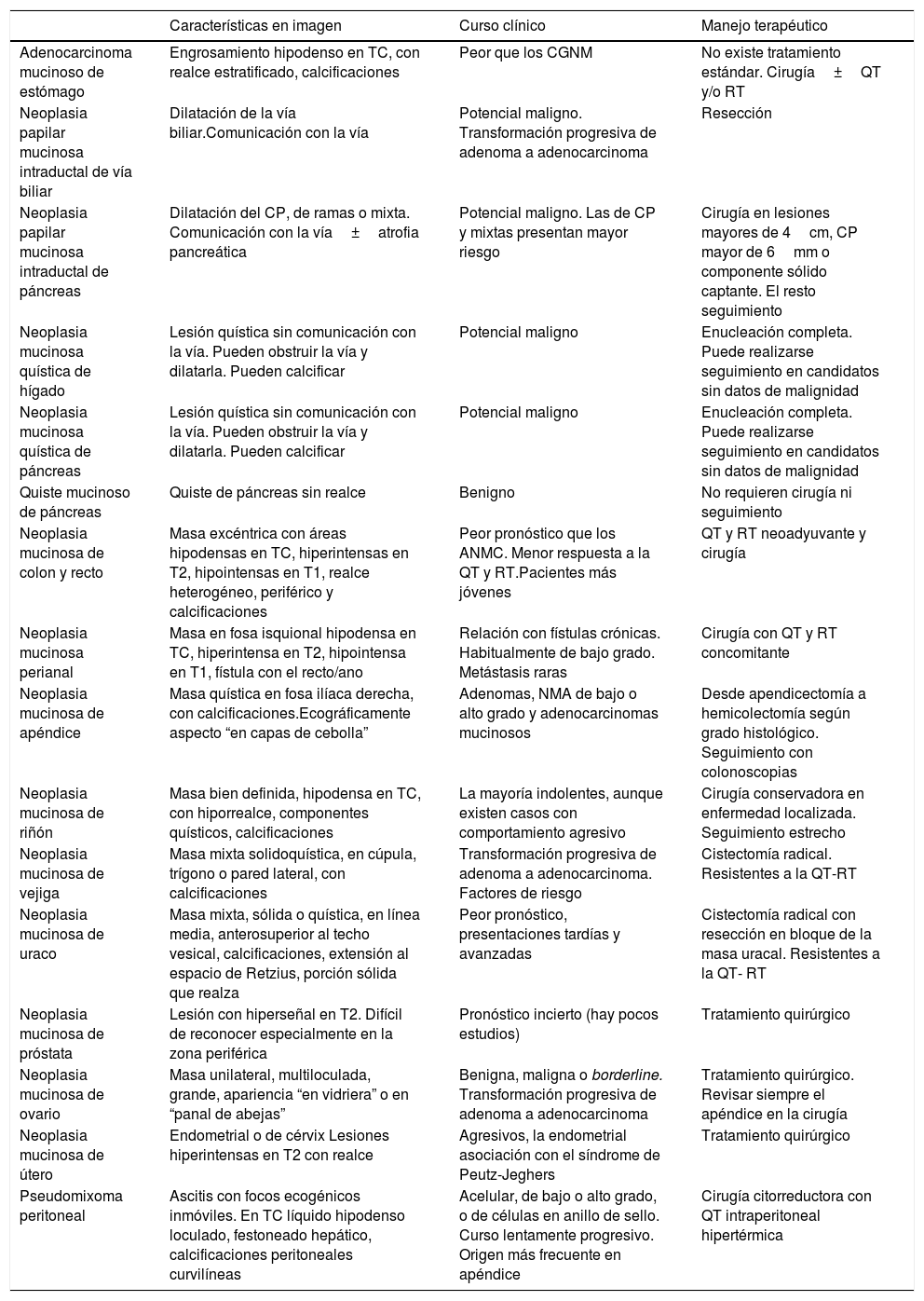
Según sus características morfológicas, las neoplasias productoras de mucina pueden clasificarse en neoplasias quísticas con epitelio productor de mucina: neoplasia quística mucinosa pancreática (NQM-P), biliar (NQM-B), ovárica (NMO) y apendicular (NMA); tumores compuestos por más de un 50% de mucina extracelular: adenocarcinoma mucinoso gástrico (AMG), colorrectal (AMC), perianal (AMP), uracal, de cérvix; tumores con alto contenido intracelular de mucina: carcinoma gástrico de células en anillo de sello (CGCAS), colónico, pancreático, vesical; y neoplasias papilares con acúmulo de mucina intraductal: biliar (NPMI-B), pancreática (NPMI-P) y de vesícula1. El objetivo de este artículo es describir, por órganos, los hallazgos radiológicos característicos de las neoplasias mucinosas abdominopélvicas que nos permiten sugerir su diagnóstico con vistas al diferente pronóstico, manejo y evolución clínica (tabla 1). Así, los adenocarcinomas mucinosos gástricos y colorrectales tienen peor pronóstico en comparación con los no mucinosos, posiblemente por su mayor tendencia a la recurrencia y a las presentaciones tardías3,4; el tratamiento es quirúrgico con o sin quimiorradioterapia. En hígado y páncreas, el tratamiento suele ser quirúrgico, aunque el manejo es controvertido dado su distinto potencial maligno5. En el riñón, el pronóstico suele ser favorable y recomendarse cirugía conservadora, a diferencia del tratamiento agresivo de los tumores mucinosos de vejiga y uraco que son resistentes a la quimiorradioterapia6,7. En ovario y apéndice, el tratamiento principal es quirúrgico y varía en función del grado histológico tumoral.
Neoplasias mucinosas de abdomen y pelvis
| Características en imagen | Curso clínico | Manejo terapéutico | |
|---|---|---|---|
| Adenocarcinoma mucinoso de estómago | Engrosamiento hipodenso en TC, con realce estratificado, calcificaciones | Peor que los CGNM | No existe tratamiento estándar. Cirugía±QT y/o RT |
| Neoplasia papilar mucinosa intraductal de vía biliar | Dilatación de la vía biliar.Comunicación con la vía | Potencial maligno. Transformación progresiva de adenoma a adenocarcinoma | Resección |
| Neoplasia papilar mucinosa intraductal de páncreas | Dilatación del CP, de ramas o mixta. Comunicación con la vía±atrofia pancreática | Potencial maligno. Las de CP y mixtas presentan mayor riesgo | Cirugía en lesiones mayores de 4cm, CP mayor de 6mm o componente sólido captante. El resto seguimiento |
| Neoplasia mucinosa quística de hígado | Lesión quística sin comunicación con la vía. Pueden obstruir la vía y dilatarla. Pueden calcificar | Potencial maligno | Enucleación completa. Puede realizarse seguimiento en candidatos sin datos de malignidad |
| Neoplasia mucinosa quística de páncreas | Lesión quística sin comunicación con la vía. Pueden obstruir la vía y dilatarla. Pueden calcificar | Potencial maligno | Enucleación completa. Puede realizarse seguimiento en candidatos sin datos de malignidad |
| Quiste mucinoso de páncreas | Quiste de páncreas sin realce | Benigno | No requieren cirugía ni seguimiento |
| Neoplasia mucinosa de colon y recto | Masa excéntrica con áreas hipodensas en TC, hiperintensas en T2, hipointensas en T1, realce heterogéneo, periférico y calcificaciones | Peor pronóstico que los ANMC. Menor respuesta a la QT y RT.Pacientes más jóvenes | QT y RT neoadyuvante y cirugía |
| Neoplasia mucinosa perianal | Masa en fosa isquional hipodensa en TC, hiperintensa en T2, hipointensa en T1, fístula con el recto/ano | Relación con fístulas crónicas. Habitualmente de bajo grado. Metástasis raras | Cirugía con QT y RT concomitante |
| Neoplasia mucinosa de apéndice | Masa quística en fosa ilíaca derecha, con calcificaciones.Ecográficamente aspecto “en capas de cebolla” | Adenomas, NMA de bajo o alto grado y adenocarcinomas mucinosos | Desde apendicectomía a hemicolectomía según grado histológico. Seguimiento con colonoscopias |
| Neoplasia mucinosa de riñón | Masa bien definida, hipodensa en TC, con hiporrealce, componentes quísticos, calcificaciones | La mayoría indolentes, aunque existen casos con comportamiento agresivo | Cirugía conservadora en enfermedad localizada. Seguimiento estrecho |
| Neoplasia mucinosa de vejiga | Masa mixta solidoquística, en cúpula, trígono o pared lateral, con calcificaciones | Transformación progresiva de adenoma a adenocarcinoma. Factores de riesgo | Cistectomía radical. Resistentes a la QT-RT |
| Neoplasia mucinosa de uraco | Masa mixta, sólida o quística, en línea media, anterosuperior al techo vesical, calcificaciones, extensión al espacio de Retzius, porción sólida que realza | Peor pronóstico, presentaciones tardías y avanzadas | Cistectomía radical con resección en bloque de la masa uracal. Resistentes a la QT- RT |
| Neoplasia mucinosa de próstata | Lesión con hiperseñal en T2. Difícil de reconocer especialmente en la zona periférica | Pronóstico incierto (hay pocos estudios) | Tratamiento quirúrgico |
| Neoplasia mucinosa de ovario | Masa unilateral, multiloculada, grande, apariencia “en vidriera” o en “panal de abejas” | Benigna, maligna o borderline. Transformación progresiva de adenoma a adenocarcinoma | Tratamiento quirúrgico. Revisar siempre el apéndice en la cirugía |
| Neoplasia mucinosa de útero | Endometrial o de cérvix Lesiones hiperintensas en T2 con realce | Agresivos, la endometrial asociación con el síndrome de Peutz-Jeghers | Tratamiento quirúrgico |
| Pseudomixoma peritoneal | Ascitis con focos ecogénicos inmóviles. En TC líquido hipodenso loculado, festoneado hepático, calcificaciones peritoneales curvilíneas | Acelular, de bajo o alto grado, o de células en anillo de sello. Curso lentamente progresivo. Origen más frecuente en apéndice | Cirugía citorreductora con QT intraperitoneal hipertérmica |
ANMC: adenocarcinoma no mucinoso; CP: conducto principal; NMA: neoplasia mucinosa apendicular; QT: quimoterapia; RT: radioterapia; TC: tomografía computarizada.
El adenocarcinoma gástrico es la neoplasia primaria más frecuente de estómago (95%). La Organización Mundial de la Salud (OMS) lo clasifica en cuatro tipos: papilar, tubular, mucinoso y de células en anillo de sello4,8. El AMG es un subtipo raro (2,4-4,9%)2 que predomina en hombres, en el tercio inferior del estómago. Se cree que surge como un adenocarcinoma típico que se vuelve mucinoso con la progresión tumoral8. Por motivos desconocidos, los AMG suelen diagnosticarse en etapas más avanzadas, y en comparación con los adenocarcinomas no mucinosos gástricos (ANMG) presentan peores tasas de supervivencia. Esto se relaciona con mayor frecuencia de invasión serosa y linfática, y no con el contenido mucinoso en sí mismo4.
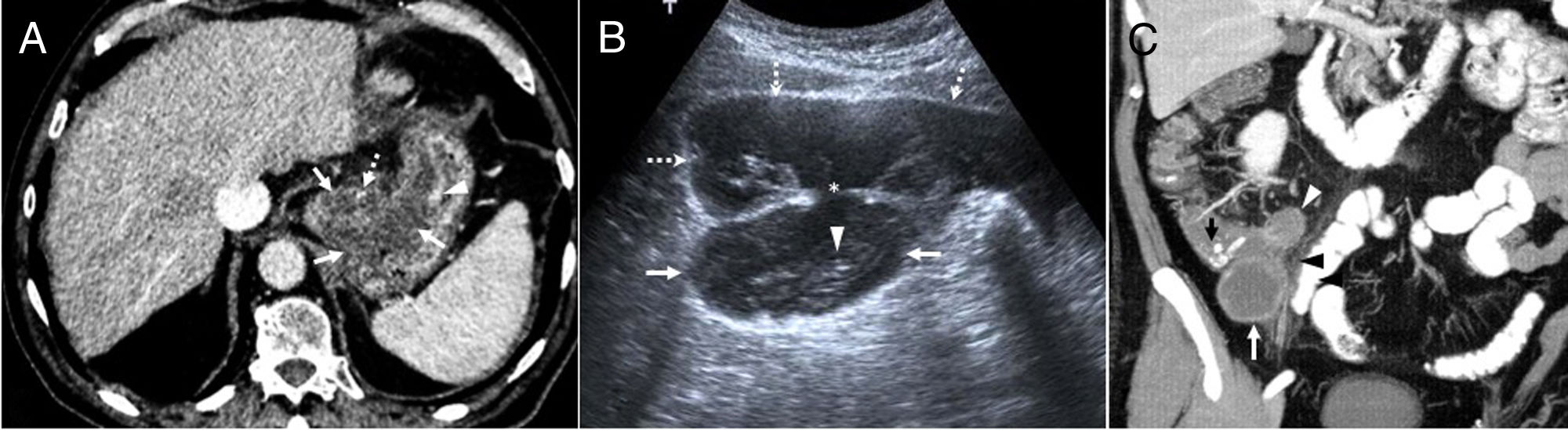
En el AMG, como en otros tumores de estirpe mucosa, especialmente de recto, las biopsias frecuentemente no permiten confirmar su naturaleza mucinosa dado que no llegan a la submucosa. La TC con adecuada distensión luminal gástrica mediante contraste oral neutro o negativo9, además de ser la herramienta principal en la valoración de la extensión local, permite sugerir el diagnóstico de AMG. Los AMG suelen mostrar un grosor mural aumentado por acúmulo de mucina extracelular en la capa submucosa10. Frente al realce homogéneo de los ANMG por la infiltración tumoral de todas las capas de la pared, los AMG muestran un patrón de realce estratificado característico, por la hipodensidad de la submucosa y captación de la mucosa suprayacente y de las células malignas que revisten la mucina4,9 (fig. 1 A). Finalmente, la TC es muy sensible en la detección de las calcificaciones típicas (33%) en las capas media y externa de los AMG, que son extremadamente raras en los ANMG2,4,8,9.
A) Adenocarcinoma mucinoso gástrico poco diferenciado en varón de 80 años. Imagen axial de tomografía computarizada (TC) con contraste intravenoso que muestra un engrosamiento hipodenso de la pared gástrica en fundus y curvatura menor (flechas) con una pequeña calcificación (flecha punteada) y realce de la mucosa (cabeza de flecha). Tras quimiorradioterapia con mala respuesta, se produjo progresión tumoral con aparición de carcinomatosis peritoneal y el fallecimiento. B) Mucocele apendicular con pseudomixoma peritoneal en varón de 54 años. Imagen de ecografía que muestra una lesión ovalada (flechas) con focos ecogénicos lineales “en capas de cebolla” (cabeza de flecha) compatible con mucocele. El mucocele está en continuidad (asterisco) con líquido libre que muestra focos ecogénicos inmóviles en relación con ascitis mucinosa o pseudomixoma (flechas punteadas). Se realizó hemicolectomía derecha, peritonectomía y omentectomía. Tras 10 años, el paciente permanece asintomático, sin signos de recidiva. C) Neoplasia mucinosa del apéndice. Reconstrucción coronal MIP de TC con contraste oral e intravenoso. Se observa una lesión lobulada en la fosa ilíaca derecha (flecha blanca), hipodensa, con realce periférico y calibre mayor de 15mm, con calcificaciones (flecha negra), compatible con un mucocele apendicular. Asocia una pequeña colección (cabeza de flecha blanca) e hiperdensidad de la grasa adyacente en relación con cambios inflamatorios (cabeza de flecha negra) por apendicitis aguda asociada. Se trataba de un varón de 75 años con apendicitis aguda gangrenosa y neoplasia mucinosa de bajo grado que invadía la totalidad de la pared hasta el tejido adiposo del meso. Se realizó hemicolectomía derecha y actualmente está asintomático.
El CGCAS es una variante (35-45%) con abundante mucina intracelular que se caracteriza por engrosamiento difuso de la pared y obliteración de los pliegues gástricos (linitis plástica). Este subtipo histológico también puede encontrarse en otros órganos como el colon (0,1-2,4%), donde habitualmente la presentación clínica es tardía y asocia alta agresividad1. No hay diferencias en el tratamiento entre los distintos tipos de carcinoma gástrico11.
ApéndiceLas NMA son un subtipo de neoplasia epitelial más frecuente en mujeres en la quinta década de la vida.
La OMS las clasifica según criterios histológicos en adenomas, NMA de bajo o alto grado y adenocarcinomas mucinosos12. La rotura de cualquiera de ellas puede originar un pseudomixoma peritoneal12–14.
Clásicamente se presentan como mucoceles, es decir, como masas quísticas ovaladas en la fosa ilíaca derecha, con capas concéntricas ecogénicas en ecografía que les dan apariencia en “capas de cebolla”, hipodensas y homogéneas en TC e hiperintensas en las ST2 (fig. 1 B). El 50% muestra calcificaciones murales periféricas.
La forma, densidad, grosor mural, septos internos, calcificaciones murales o líquido libre no son útiles para diferenciar los subtipos histológicos de NMA. Sugiere adenocarcinoma la presencia de irregularidad o nodularidad mural y los depósitos periapendiculares13–15.
Las NMA pueden coincidir con apendicitis aguda y no son excepcionales como hallazgo histológico incidental. Deben sospecharse ante un apéndice con calibre superior a 15mm o con calcificaciones murales (fig. 1C).
Existe una asociación entre las NMA y los tumores colorrectales, por lo que se recomienda seguimiento con colonoscopias periódicas15.
El tratamiento, según el grado histológico del tumor y la presencia de pseudomixoma peritoneal, varía desde apendicectomía con o sin hemicolectomía a cirugía citorreductora con quimioterapia intraperitoneal hipertérmica (CCQIH)13,15.
Colon y rectoEl AMC es un subtipo de adenocarcinoma raro (5-20%), más frecuente en colon proximal. La edad media de presentación, 42 años, es menor que en el adenocarcinoma no mucinoso (ANMC). La tasa de supervivencia y pronóstico son peores, por mayor incidencia de adenopatías, invasión venosa, linfática, recurrencia local, metástasis y estadios más avanzados en el momento del diagnóstico16–19. Este comportamiento más agresivo podría explicarse por la capacidad de la mucina para separar las fibras musculares, aumentar la presión en la pared intestinal, depositarse en la grasa perirrectal y diseminarse hacia la cavidad peritoneal y los vasos linfáticos. También por la menor respuesta a la quimiorradioterapia preoperatoria, probablemente por disminución del transporte del fármaco en el lecho microvascular tumoral reducido por la mucina extracelular20–22. Como los tumores mucinosos de otras localizaciones, los AMC muestran áreas hipodensas en TC, realce heterogéneo, periférico y presencia de calcificaciones intratumorales, generalmente pequeñas y puntiformes. En comparación con los ANMC condicionan mayor engrosamiento mural, son más excéntricos y tienen mayor tendencia a la diseminación e infiltración, como refleja la presencia frecuente de depósitos de mucina extratumorales en la grasa adyacente16,22 (fig. 2). La RM puede ser superior a la TC –incluso a la biopsia18– en el diagnóstico de los AMC por su capacidad para detectar la mucina y diferenciarla de los componentes fibrosos del tumor, ambos hipodensos en TC. Sin embargo, tiene limitaciones para determinar el límite entre los depósitos mucinosos tumorales y la grasa mesorrectal a la que frecuentemente infiltran, ya que ambos muestran hiperseñal en las ST2. Para ello, puede ser útil una ST1 en la que el tumor es hipointenso respecto a la grasa17,20,21,23. En los ANMC la quimiorradioterapia induce cambios coloides que traducen respuesta tumoral17. En cambio, en los AMC suelen persistir lagos coloides tras el tratamiento que dificultan la estimación del grado de respuesta –dado que pueden perdurar células tumorales en el seno de los mismos– y la diferenciación de la recidiva de otras lesiones con contenido líquido como quistes, colecciones o tumores necróticos. El tratamiento estándar del AMC es la cirugía, generalmente agresiva, con márgenes amplios y disección linfática, precedida de quimiorradioterapia en casos de cáncer de recto localmente avanzado16,19.
A-C) Mujer de 70 años con adenocarcinoma mucinoso de colon proximal de bajo grado (moderadamente diferenciado). Corte axial (A) de tomografía computarizada (TC) con contraste oral y endovenoso en el que se observa una masa en la cara posterior del colon derecho (flechas), de predominio hipodenso, con leve realce periférico y heterogéneo, excéntrica, que causa engrosamiento mural y sobrepasa ligeramente, en algunas zonas, la muscular. Imagen coronal T2 (B) de resonancia magnética (RM) en la que se observa la masa lobulada (flechas), hiperintensa, con una estructura interna reticular, hipointensa. Imagen coronal T1 (C) con saturación grasa y contraste intravenoso que muestra una masa hipointensa, con septos internos y componentes sólidos que realzan (flechas). Tras la cirugía, con márgenes de resección libres y ganglios negativos, la paciente permanece asintomática y en seguimiento. D y E) Mujer de 77 años con adenocarcinoma mucinoso de recto bien diferenciado que infiltra el tejido adiposo perirrectal. Imagen axial (D) de TC que muestra un engrosamiento hipodenso circunferencial del recto (flecha blanca) con una calcificación en la mucosa (flecha negra) e invasión del mesorrecto (flecha punteada). La misma lesión (E) en secuencia sagital T2 de RM muestra áreas hiperintensas (flecha blanca) y una estructura interna reticular hipointensa (flecha negra). Tras quimiorradioterapia y amputación rectal, la paciente permanece libre de enfermedad.
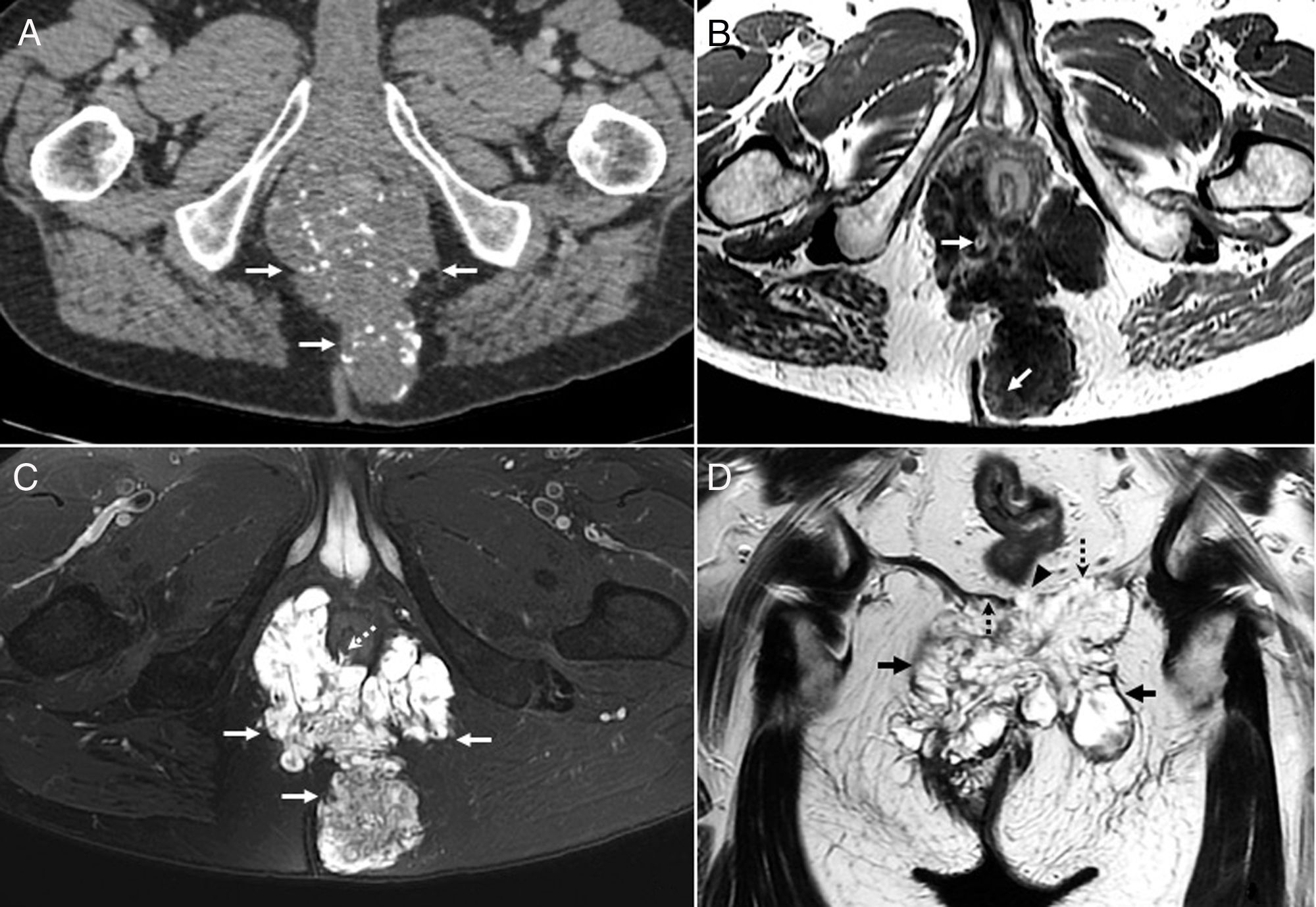
El AMP es una entidad rara que puede originarse de novo o más frecuentemente como complicación de una fístula crónica24; raramente de abscesos, sífilis o diabetes25. La teoría principal es que los cambios inflamatorios crónicos inducen una regeneración epitelial que provoca la transformación maligna. Habitualmente son lesiones de bajo grado y las metástasis raras26. El diagnóstico suele ser tardío por su lento crecimiento y los síntomas inespecíficos, salvo los relacionados con la fístula crónica. Por tanto, en pacientes con fístulas perianales de larga evolución (de 2 a 10 años) debe descartarse malignidad mediante biopsia y RM. Las biopsias a menudo ofrecen resultados equívocos porque las muestras superficiales de los orificios fistulosos externos pueden revelar únicamente reacción inflamatoria y por la escasez de células tumorales en los lagos mucosos27. Las ST2 muestran una masa hiperintensa que puede tener calcificaciones. El realce de estructuras periféricas, la presencia de lagos de mucina sin cápsula fibrosa que reflejan invasión tumoral y un patrón de realce interno heterogéneo e irregular (fig. 3) son útiles para distinguir el AMP de abscesos o fístulas complicadas. No obstante, las zonas de inflamación activa en un absceso o fístula pueden realzar, por lo que es recomendable realizar la RM una vez resuelto el proceso agudo26,27. La presencia de una fístula que conecta el ano con la masa permite distinguir el AMP de una transformación maligna de un teratoma, un hamartoma quístico retrorrectal o un quiste dermoide27. La combinación de quimiorradioterapia con una cirugía agresiva, generalmente amputación abdominoperineal, puede mejorar la supervivencia24,26.
Adenocarcinoma mucinoso perianal y perirrectal bien diferenciado en estadio localmente avanzado en varón de 68 años con fístula de años de evolución. A) Estudio de tomografía computarizada (TC) con contraste en el que se observa una masa hipodensa de gran tamaño (flechas) en la fosa isquioanal con numerosas calcificaciones puntiformes y groseras. B) Imagen axial T1 con contraste intravenoso. La masa es hipointensa e infiltra la grasa de las fosas isquioanales, con focos irregulares internos de realce de contraste lineales y nodulares (flechas). C) La secuencia axial T2 con saturación grasa muestra la alta señal de la lesión (flechas) correspondiente a la mucina contenida en una estructura interna sólida irregular o reticular, similar a una malla, hipointensa, formada por células malignas y vasos. Se observa una solución de continuidad o fístula con los esfínteres (flecha punteada). D) Imagen coronal T2 en la que se observa la masa (flechas), infiltración de los elevadores del ano (flechas punteadas) y un lago de mucina sin cápsula fibrosa (cabeza de flecha) que refleja invasividad. El paciente recibió quimiorradioterapia neoadyuvante que dio lugar a disminución del volumen tumoral y expulsión de material mucinoso por los distintos trayectos fistulosos. Posteriormente se realizó amputación extraelevadora isquioanal y resección de coxis distal que estaba afectado por contigüidad. Dos años después no muestra signos de recidiva tumoral.
El concepto de “enfermedades biliares y sus análogas pancreáticas” ha sido propuesto recientemente para referirse a un grupo de lesiones biliares y pancreáticas con características clínicas, histopatológicas y radiológicas similares posiblemente debido a un origen embriológico común. Así, el adenocarcinoma ductal pancreático, la NPMI-P y la NQM-P se consideran los análogos pancreáticos del colangiocarcinoma extrahepático, la NPMI-B y la NQM-B respectivamente28–31.
Neoplasia papilar mucinosa intraductalLa NPMI-B y la NPMI-P se caracterizan por la proliferación papilar o exofítica del epitelio biliar o pancreático, respectivamente, hacia la luz ductal, sin estroma ovárico subepitelial, y la producción de una cantidad excesiva de mucina que obstaculiza el flujo biliar o pancreático originando la característica radiológica principal de las NPMI: la dilatación y comunicación con la vía32–38. El tumor no suele identificarse por su pequeño tamaño, aunque ocasionalmente los nódulos tumorales causan defectos de repleción que, a diferencia de los causados por la mucina que ocupa los ductos, realzan con los distintos contrastes radiológicos39 y restringen la difusión. Las NPMI son lesiones con potencial maligno que se extienden superficialmente por la mucosa y pueden transformarse gradualmente de adenomas en adenocarcinomas infiltrantes o invasivos29–40.
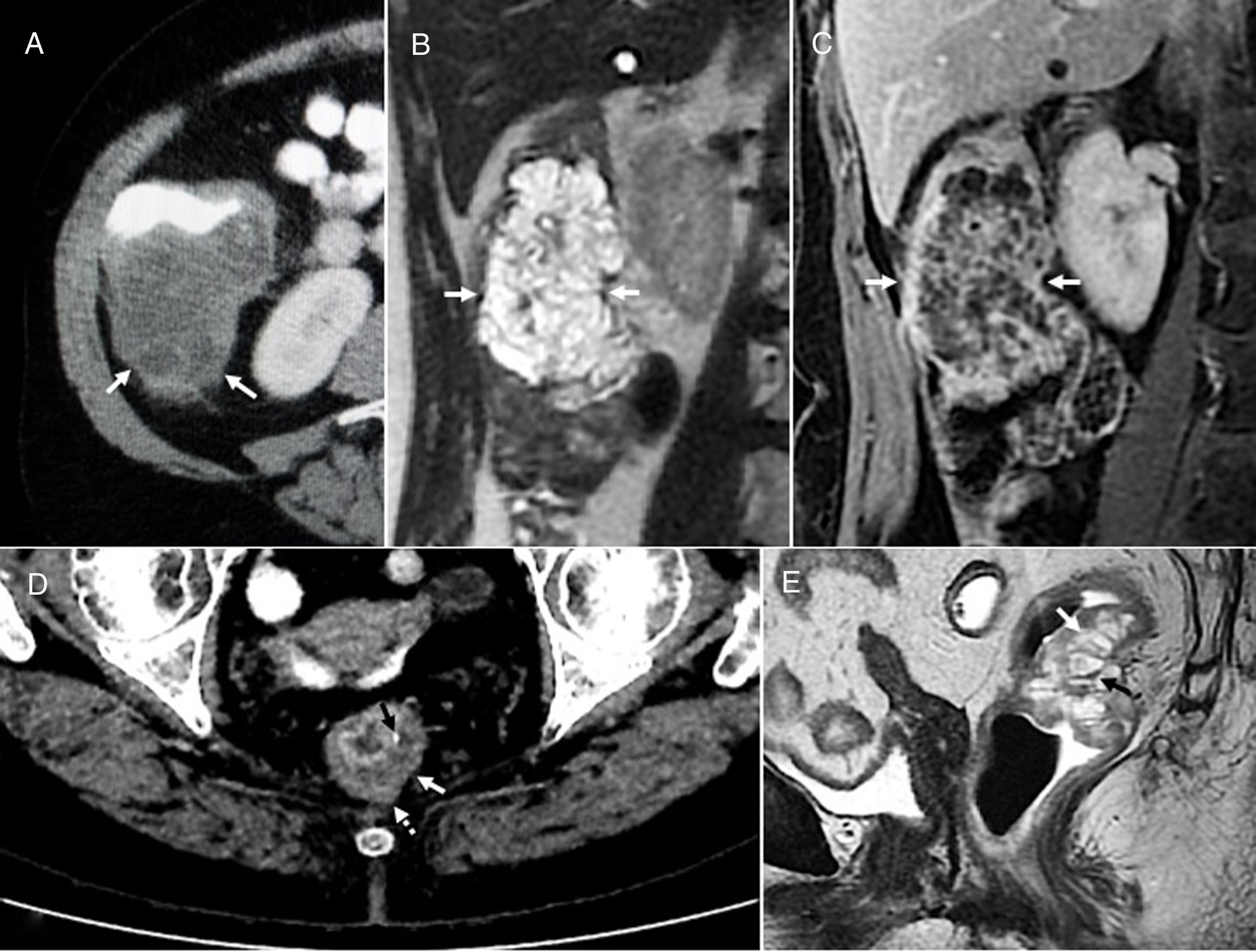
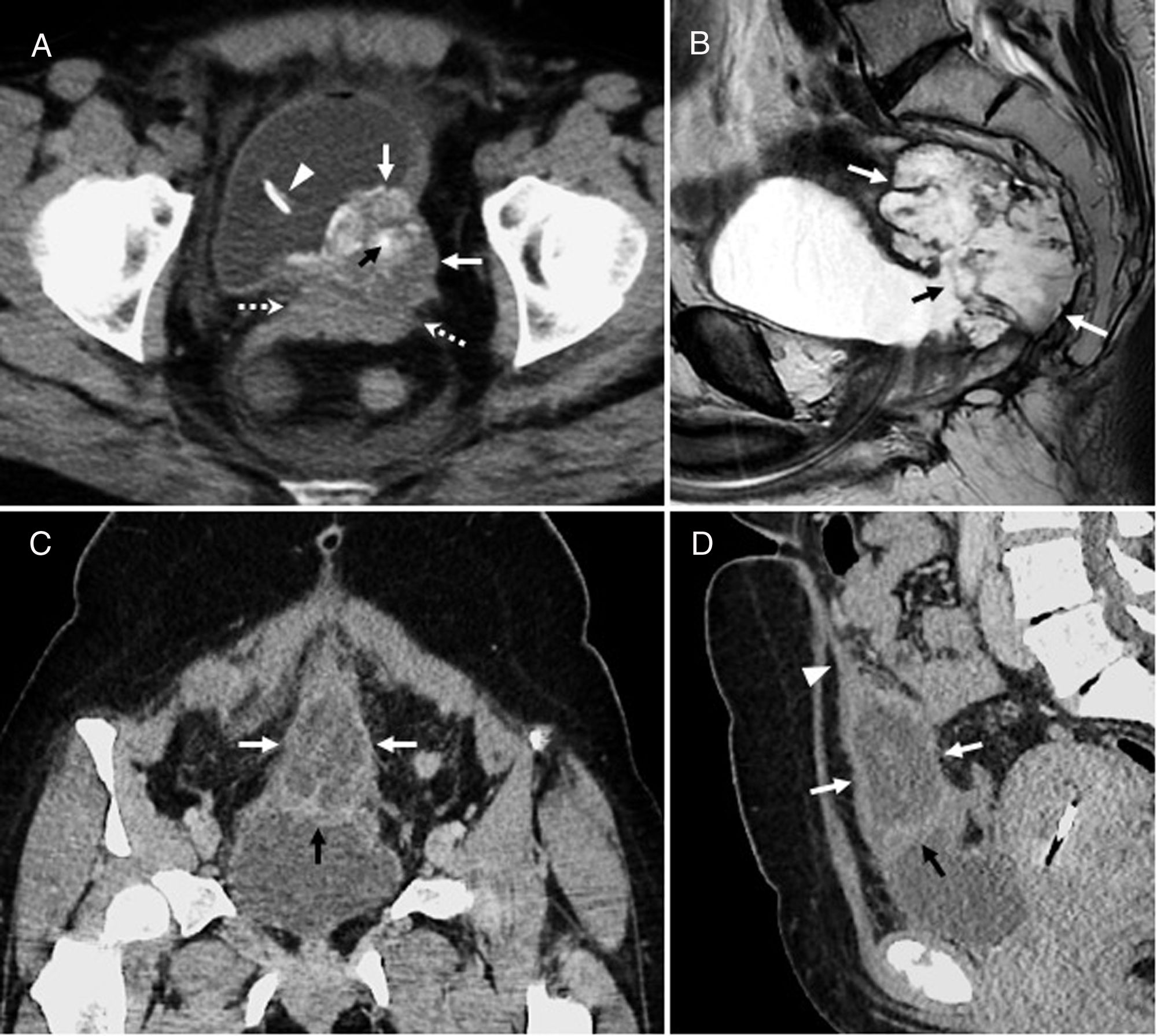
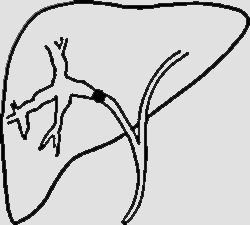
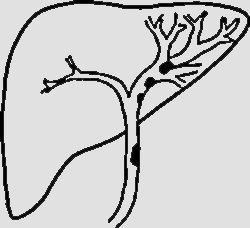
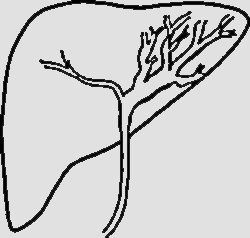
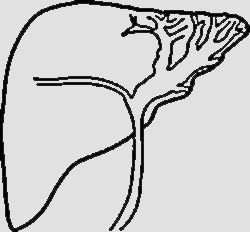
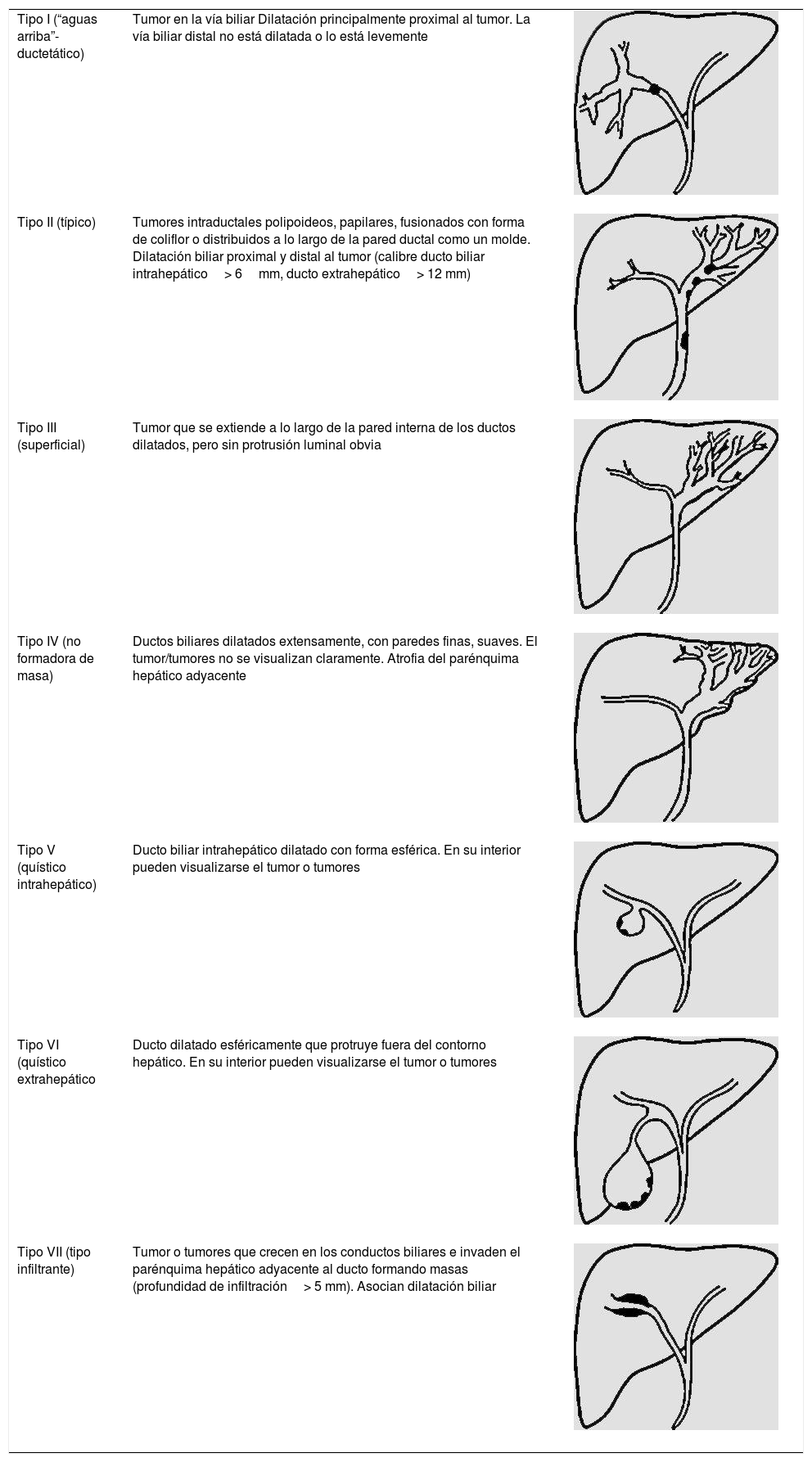
NPMI-BExisten numerosas clasificaciones radiológicas de la NPMI-B15,24,27,30. La descrita recientemente por Shihong Ying et al.33 incluye hasta 7 tipos (tabla 2) y por primera vez establece diferencias morfológicas y pronósticas entre un subtipo no productor de mucina que suele manifestarse como dilatación proximal de la vía (tipo I), y las NPMI-B, que globalmente tienen mejor pronóstico y en general muestran dilatación difusa o variantes quísticas (tipos II-VII) (fig. 4). Individualmente, el tipo infiltrante (VII) tiene el peor pronóstico, sea o no productor de mucina. El diagnóstico diferencial de las NPMI-B se realiza con el colangiocarcinoma intrahepático, metástasis intrabiliares, otras lesiones quísticas y con colangitis piógena recurrente con cálculos que condiciona obstrucción biliar intermitente incompleta y posibles defectos de repleción intraluminales30.
Clasificación morfológica de las neoplasias mucinosas papilares intraductales de la vía biliar
| Tipo I (“aguas arriba”-ductetático) | Tumor en la vía biliar Dilatación principalmente proximal al tumor. La vía biliar distal no está dilatada o lo está levemente | |
| Tipo II (típico) | Tumores intraductales polipoideos, papilares, fusionados con forma de coliflor o distribuidos a lo largo de la pared ductal como un molde. Dilatación biliar proximal y distal al tumor (calibre ducto biliar intrahepático> 6mm, ducto extrahepático> 12 mm) | |
| Tipo III (superficial) | Tumor que se extiende a lo largo de la pared interna de los ductos dilatados, pero sin protrusión luminal obvia | |
| Tipo IV (no formadora de masa) | Ductos biliares dilatados extensamente, con paredes finas, suaves. El tumor/tumores no se visualizan claramente. Atrofia del parénquima hepático adyacente | |
| Tipo V (quístico intrahepático) | Ducto biliar intrahepático dilatado con forma esférica. En su interior pueden visualizarse el tumor o tumores | |
| Tipo VI (quístico extrahepático | Ducto dilatado esféricamente que protruye fuera del contorno hepático. En su interior pueden visualizarse el tumor o tumores | |
| Tipo VII (tipo infiltrante) | Tumor o tumores que crecen en los conductos biliares e invaden el parénquima hepático adyacente al ducto formando masas (profundidad de infiltración> 5 mm). Asocian dilatación biliar |
Neoplasia papilar mucinosa intraductal de vía biliar. Varón de 68 años con lesión compatible radiológicamente con neoplasia papilar con acúmulo de mucina intraductal biliar (NPMI-B). A) Imagen coronal de tomografía computarizada con contraste intravenoso en la que se observa una lesión hipodensa, de aspecto quístico, lobulada (flechas), con calcificaciones lineales periféricas (cabezas de flecha). B) Imagen axial T2 en la que se confirma que la lesión quística lobulada (flecha) se comunica (cabeza de flecha) con radicales biliares dilatados arrosariados (flechas punteadas) y que, por tanto, se trata de una dilatación focal de la vía biliar, hallazgos radiológicamente compatibles con una variante quística de NPMI-B. C) Reconstrucción coronal MIP de secuencia T2 3D en la que se observa la lesión quística lobulada (flecha) asociada a dilatación arrosariada de la vía biliar intrahepática izquierda (flechas punteadas) y en menor medida de la derecha (cabeza de flecha). La flecha curva señala el colédoco, que es de calibre dentro de límites normales. D) Imagen axial T2 con supresión grasa que demuestra la comunicación (cabeza de flecha) de la formación quística (flecha) con la vía biliar proximal (“aguas arriba”) (flecha punteada). E) Imagen axial T1 con contraste y saturación grasa en la que se observa que la dilatación focal quística de mayor tamaño (flecha) y la vía biliar (flechas punteadas) carecen de nódulos sólidos murales captantes. Tras 6 años de seguimiento por la lesión focal quística de mayor tamaño que se visualiza en las imágenes, apareció la dilatación difusa de la vía biliar intrahepática y se hizo visible la comunicación de la lesión con la vía por lo que finalmente se etiquetó de variante quística de neoplasia papilar con acúmulo de mucina intraductal pancreática (NPMI-P). El paciente permanece asintomático sin tratamiento, con una leve elevación de las enzimas hepáticas.
La resección curativa es el tratamiento electivo de las NPMI-B dado el riesgo de invasividad y de obstrucción biliar.
NPMI-PLas NPMI-P afectan a pacientes de 60 a 80 años, con ligero predominio masculino. Se clasifican en distintas categorías con relevancia clínica por su distinto pronóstico5,37–42:
- •
De conducto principal (CP). Tienen el mayor riesgo de malignidad. Muestran dilatación difusa o segmentaria del CP y su diagnóstico diferencial con la pancreatitis crónica es especialmente difícil cuando presenta calcificaciones.
- •
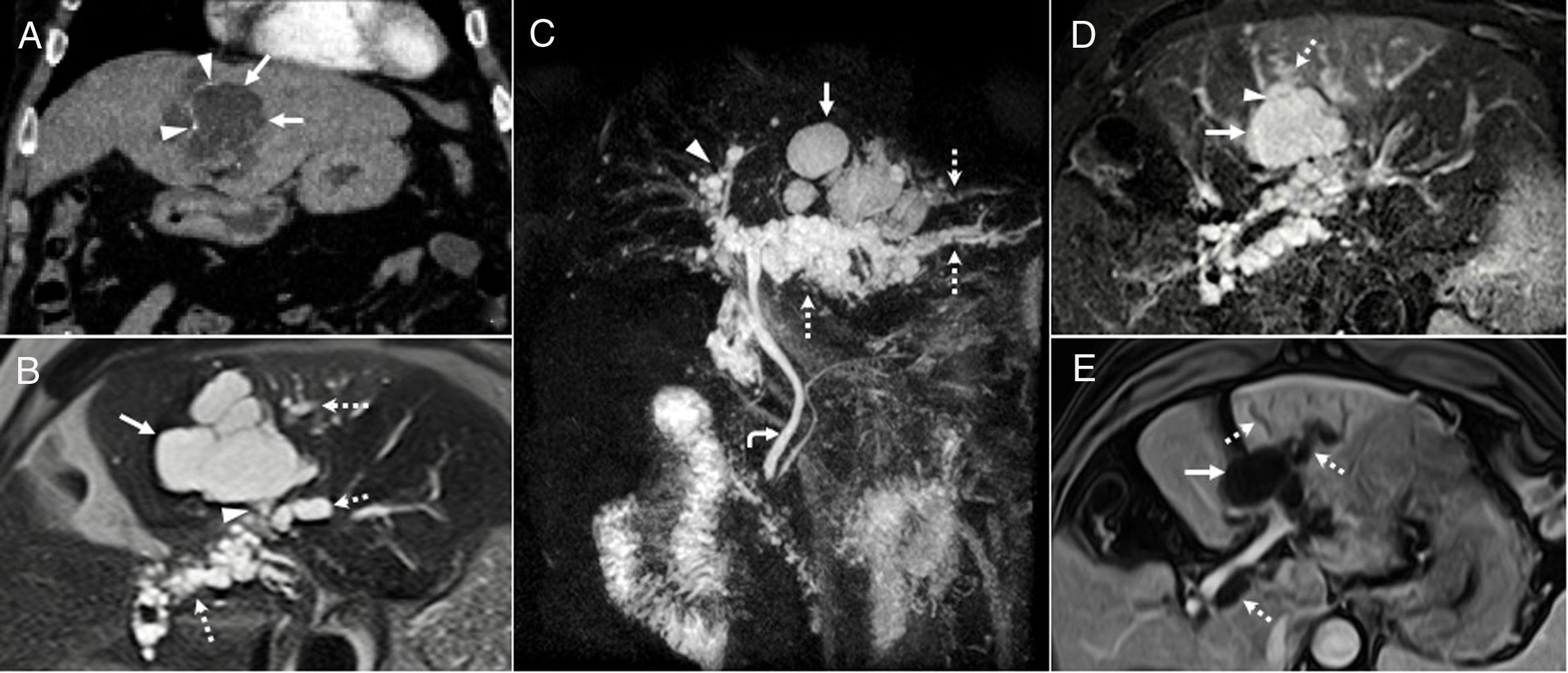
De rama. Aparecen como una lesión lobulada redonda, ovalada uni- o multilocular, más frecuente en el proceso uncinado (fig. 5 A). El diagnóstico diferencial incluye seudoquiste, neoplasia quística serosa (NQS) oligoquística y tumor neuroendocrino quístico.
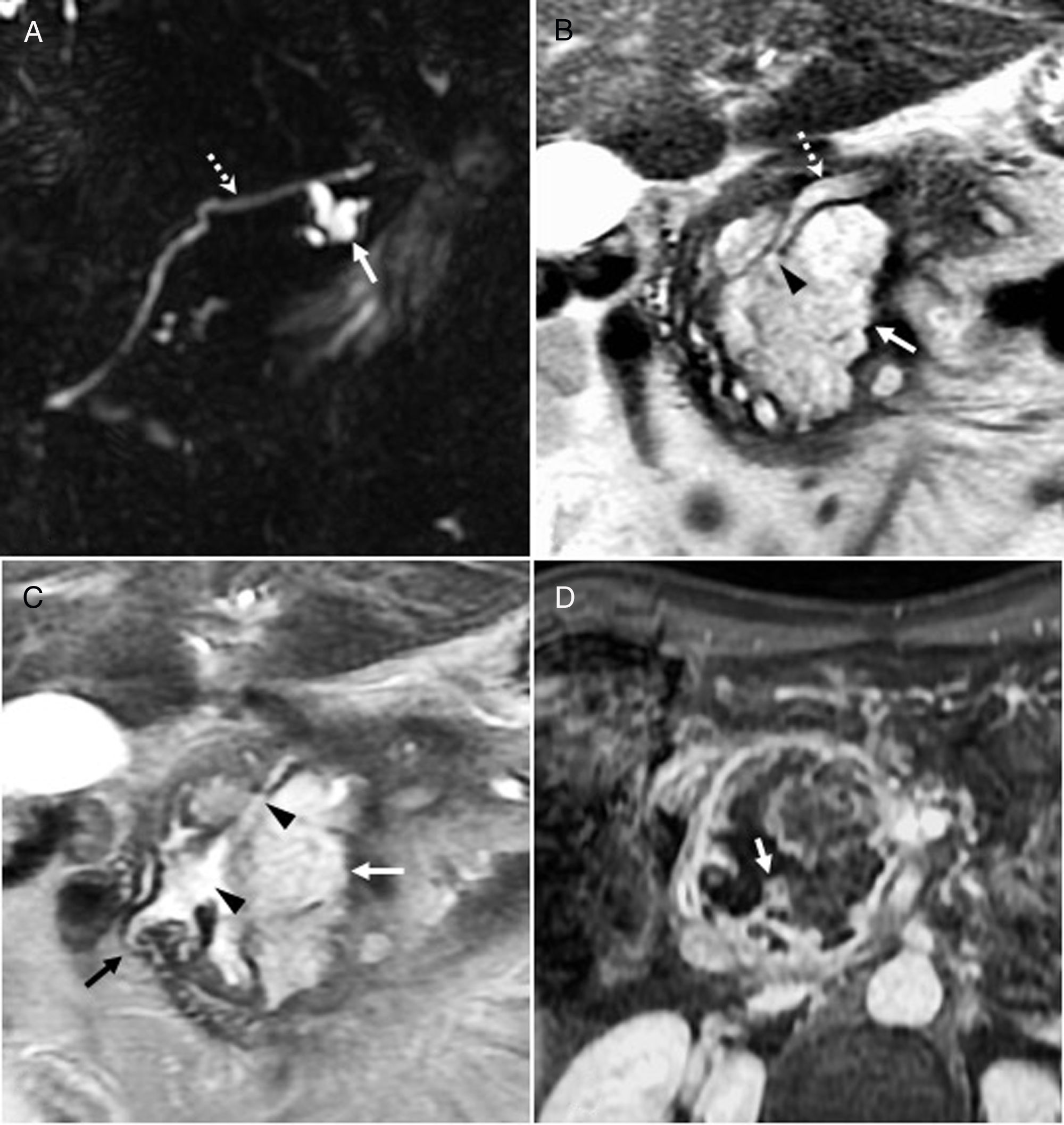
Figura 5.Neoplasias papilares mucinosas intraductales de páncreas. A) Mujer de 76 años con neoplasia papilar mucinosa intraductal de rama. Imagen colangiográfica T2 en la que se observa una lesión quística lobulada (flecha) en comunicación con el conducto de Wirsung (flecha punteada). La lesión permanece estable en los controles realizados a lo largo de varios años. B-D) Neoplasia papilar mucinosa intraductal de tipo mixto, de conducto principal y de rama. Imagen coronal T2 (B) en la que se observa la dilatación del conducto principal (flecha punteada) y una lesión quística de gran tamaño (flecha) en comunicación con la vía (cabeza de flecha). Imagen coronal T2 (C) en la que se observa la masa quística (flecha blanca) en comunicación con la vía (cabezas de flecha) y la protrusión de la papila hacia el duodeno (flecha negra). Imagen axial T1 (D) con contraste y supresión grasa en la que se observa realce periférico y heterogéneo de la lesión (flecha). Se trata de un paciente de 58 años con carcinoma papilar mucinoso intraductal de tipo mixto irresecable por infiltración de la vena porta y arteria hepática. Tras tratamiento quimiorradioterápico se produjo una disminución significativa del volumen tumoral y atrofia difusa del resto del páncreas. Cinco años después, la masa permanece estable y el paciente asintomático salvo episodios puntuales de anorexia.
(0.31MB). - •
Mixto. Afectan al CP y a sus ramas. Pueden ser difusas y aparecer en cuerpo o cola. El diagnóstico diferencial y pronóstico son similares a los de CP (fig. 5 B-D). Suelen asociar atrofia pancreática focal o difusa y el abultamiento de la papila duodenal es una característica muy específica.
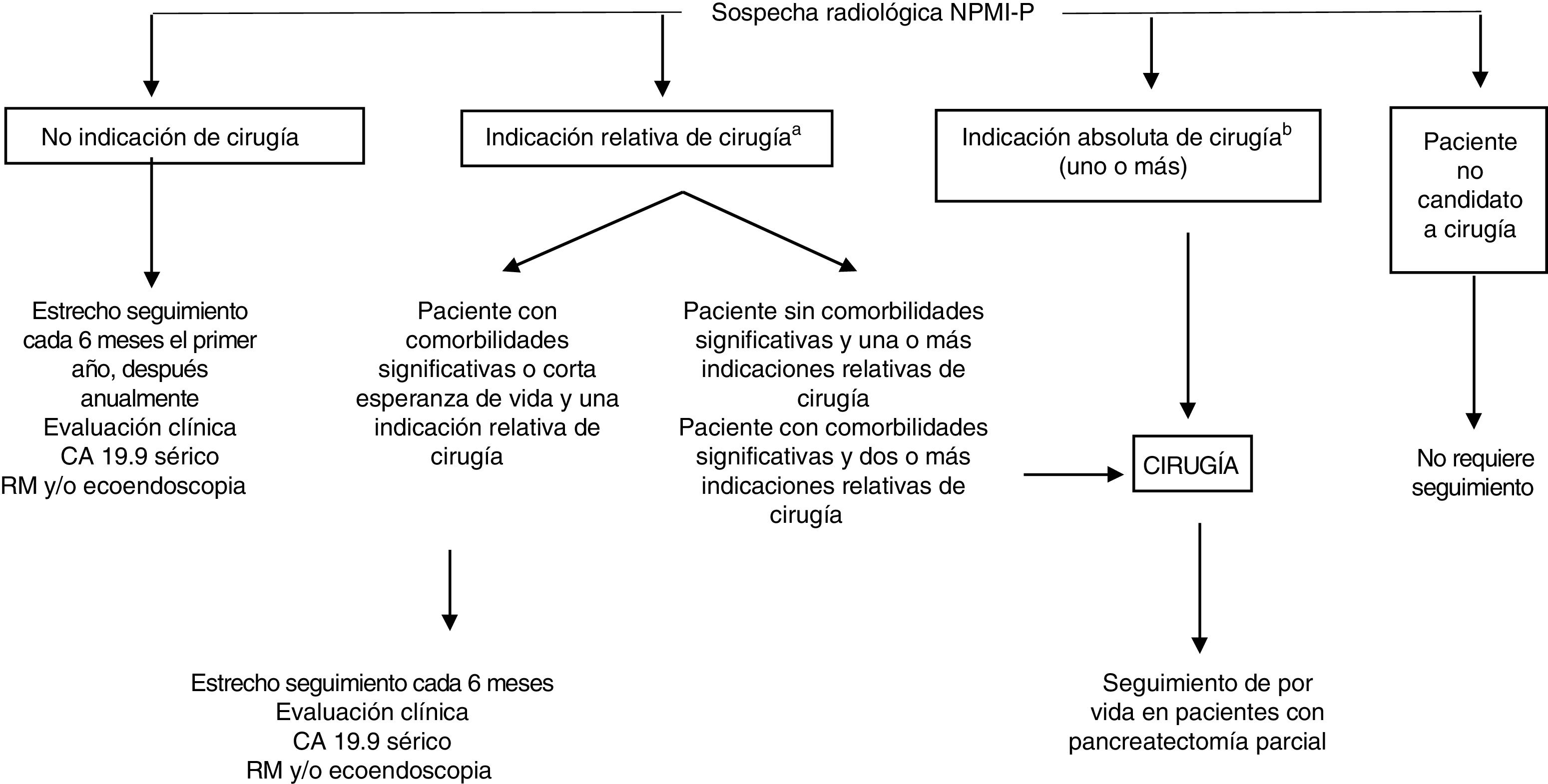
El manejo terapéutico de las NPMI-P es controvertido. El consenso de expertos europeos de 2018 aconseja cirugía cuando la lesión muestra datos sospechosos de malignidad43 (fig. 6). De lo contrario, se recomienda seguimiento.
Manejo de las lesiones sospechosas de neoplasia papilar mucinosa intraductal de páncreas (NPMI-P) (guía del grupo europeo de estudio de tumores quísticos de páncreas de 2018).
aIndicaciones relativas: crecimiento ≥ 5 mm/año, CA19.9 sérico> 37 U/ml, CP=5-9,9mm, quiste> 40mm, aparición de diabetes mellitus, pancreatitis aguda, nódulo mural captante<5mm.
bIndicaciones absolutas: citología+para malignidad o displasia alto grado, masa sólida, ictericia, nódulo mural captante ≥ 5mm, CP ≥ 10mm.
La NQM-B y la NQM-P son neoplasias quísticas que surgen del epitelio productor de mucina biliar y pancreático, respectivamente, asociado a estroma subepitelial de tipo ovárico, dato necesario para establecer el diagnóstico. Ambas ocurren casi exclusivamente en mujeres de mediana edad, generalmente asintomáticas, aunque lesiones grandes pueden crear efecto de masa y causar dolor abdominal, obstrucción biliar, náuseas y anorexia28,32,35,36,44. A diferencia de la NPMI-B, la NQM-B y la NQM-P no comunican con los conductos biliares ni pancreáticos ni asocian dilatación de la vía, aunque la mucina secretada está contenida y puede producir dilatación distal por efecto masa28,38,43,45. Se presentan como masas uni- o multiloculares, con comportamiento quístico en ST1 y ST2, aunque pueden mostrar hiperseñal en ST1 si el contenido es hemorrágico o proteináceo28,39,41, con una cápsula fibrosa gruesa que puede calcificar (fig. 7). La presencia de tabiques internos, nódulos murales hipercaptantes que restringen la difusión, tamaño superior a 4cm, calcificaciones en cáscara de huevo, edad mayor de 55 años o crecimiento de más de 3mm al año debe hacer sospechar transformación maligna41,46 (fig. 8). El diagnóstico diferencial de la NQM-B se establece con variantes quísticas de la NPMI-B intrahepática, con quistes simples o solitarios e hidatídicos. El de la NQM-P incluye seudoquiste pancreático, quistes mucinosos no neoplásicos (QMNN) y NQS en cuerpo y cola pancreáticos, donde la NQM-P se localiza casi exclusivamente35. La NQM-B y la NQM-P se consideran lesiones con potencial maligno, por lo que el tratamiento de elección es la enucleación completa, en cuyo caso el pronóstico es excelente. No obstante, en pacientes no candidatos a cirugía, se recomienda seguimiento radiológico, preferiblemente por RM, especialmente cuando no existen datos de malignidad5,44–48.
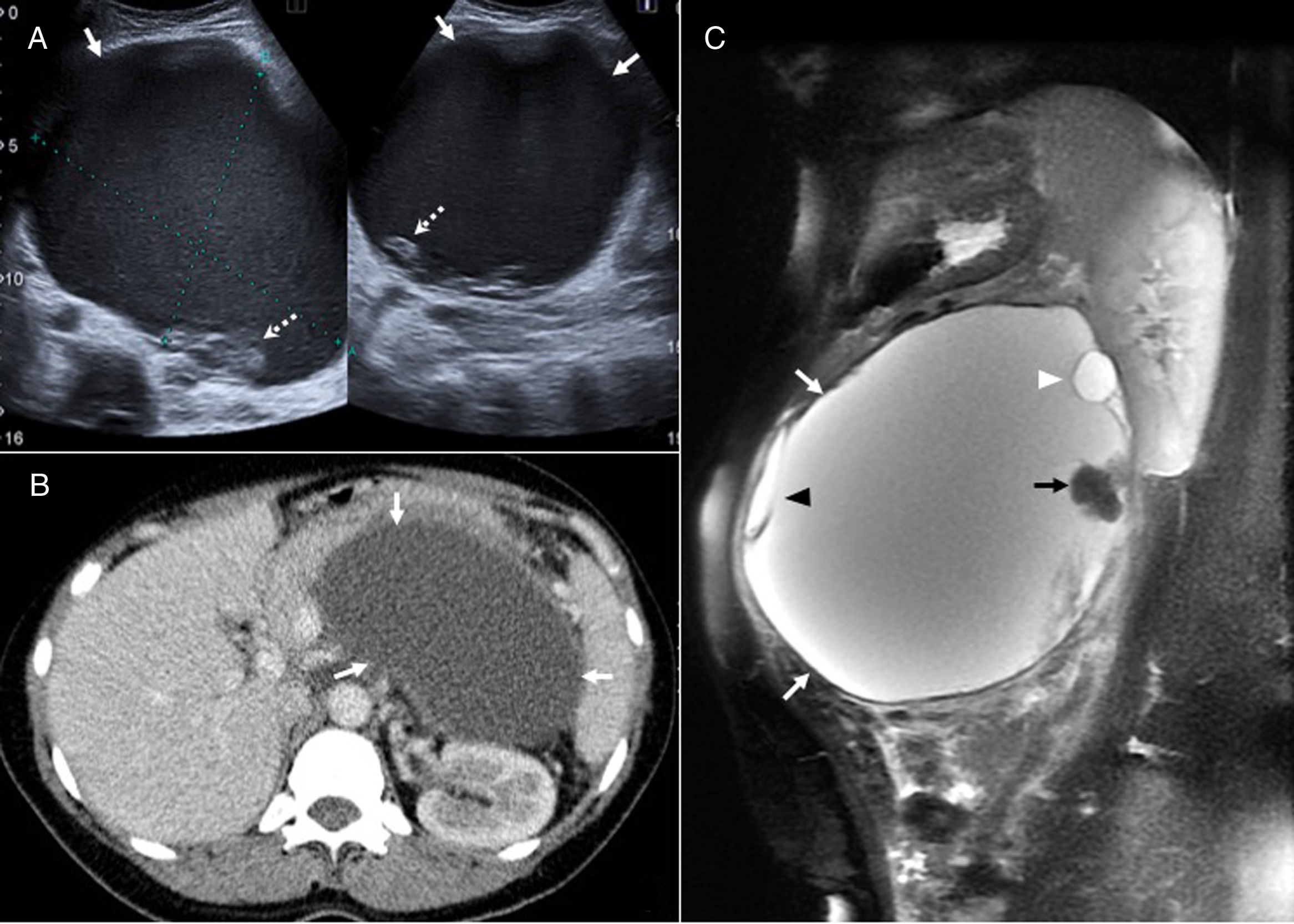
Neoplasia quística mucinosa biliar en mujer de 33 años. A. Imagen sagital de ecografía que muestra una lesión quística hepática lobulada bien definida (flechas). B) La tomografía computarizada con contraste intravenoso pone de manifiesto una lesión hipodensa con una calcificación periférica (flecha). C) Secuencia coronal T2 que muestra la naturaleza quística de la lesión, parcialmente septada (flecha negra), con una pared relativamente gruesa (flecha blanca). D) En la secuencia T1 sin contraste, la lesión (flecha negra) muestra una leve hiperseñal interna que puede estar en relación con mucina proteinácea o contenido hemorrágico (flecha blanca). E) Imagen axial de difusión (b=600) que muestra hiperseñal de la lesión por efecto T2 (flecha). Se realizó punción aspirativa con aguja fina de la lesión que demostró la presencia de material mucoide y células mucosecretoras, por lo que la paciente fue sometida a cirugía donde se realizó exéresis lesional completa. Tras 4 años de controles no se ha producido recidiva.
Neoplasia quística mucinosa de páncreas en mujer de 40 años. A) Imagen ecográfica en la que se observa una lesión quística (flechas) con focos ecogénicos en su interior y con componentes sólidos murales (flechas punteadas). B) La tomografía computarizada con contraste intravenoso muestra una lesión hipodensa (flechas) con efecto masa sobre las estructuras adyacentes que por su gran tamaño no puede determinarse de qué estructura depende. C) Secuencia sagital T2 con saturación grasa que confirma una lesión quística de paredes gruesas (flechas blancas), con algún lóculo (cabeza de flecha blanca), algún septo (cabeza de flecha negra) y nódulos murales sólidos (flecha negra). La anatomía patológica confirmó que se trataba de un carcinoma mucinoso quístico de páncreas no invasivo con necrosis y abscesificación. A pesar del tratamiento quirúrgico (esplenopancreatectomía distal) y quimioterápico aparecieron metástasis hepáticas, carcinomatosis peritoneal, implantes mesentéricos, intestinales y en músculos rectos anteriores del abdomen. La paciente falleció a los 20 meses del diagnóstico.
Los QMNN son lesiones benignas raras que pueden sugerirse en circunstancias limitadas (paciente masculino con quiste en la cabeza pancreática, sin realce). No obstante, el diagnóstico preoperatorio de QMNN, NQS macroquística, NQM-P o NPMI-P de rama puede ser imposible. En estos casos puede realizarse seguimiento, si la lesión es menor de 4cm49, o análisis del líquido intraquístico mediante punción aspirativa con aguja fina. Esta técnica, que no se usa rutinariamente por el escaso rendimiento secundario a la baja celularidad de las muestras, solo si cambia el manejo clínico43,46 puede sugerir NQM cuando los niveles de antígeno carcinoembrionario (CEA) sean superiores a 800 ng/ml, sin distinguir grado de invasividad, y permite excluir seudoquistes si la concentración de amilasa es mayor de 250 U46.
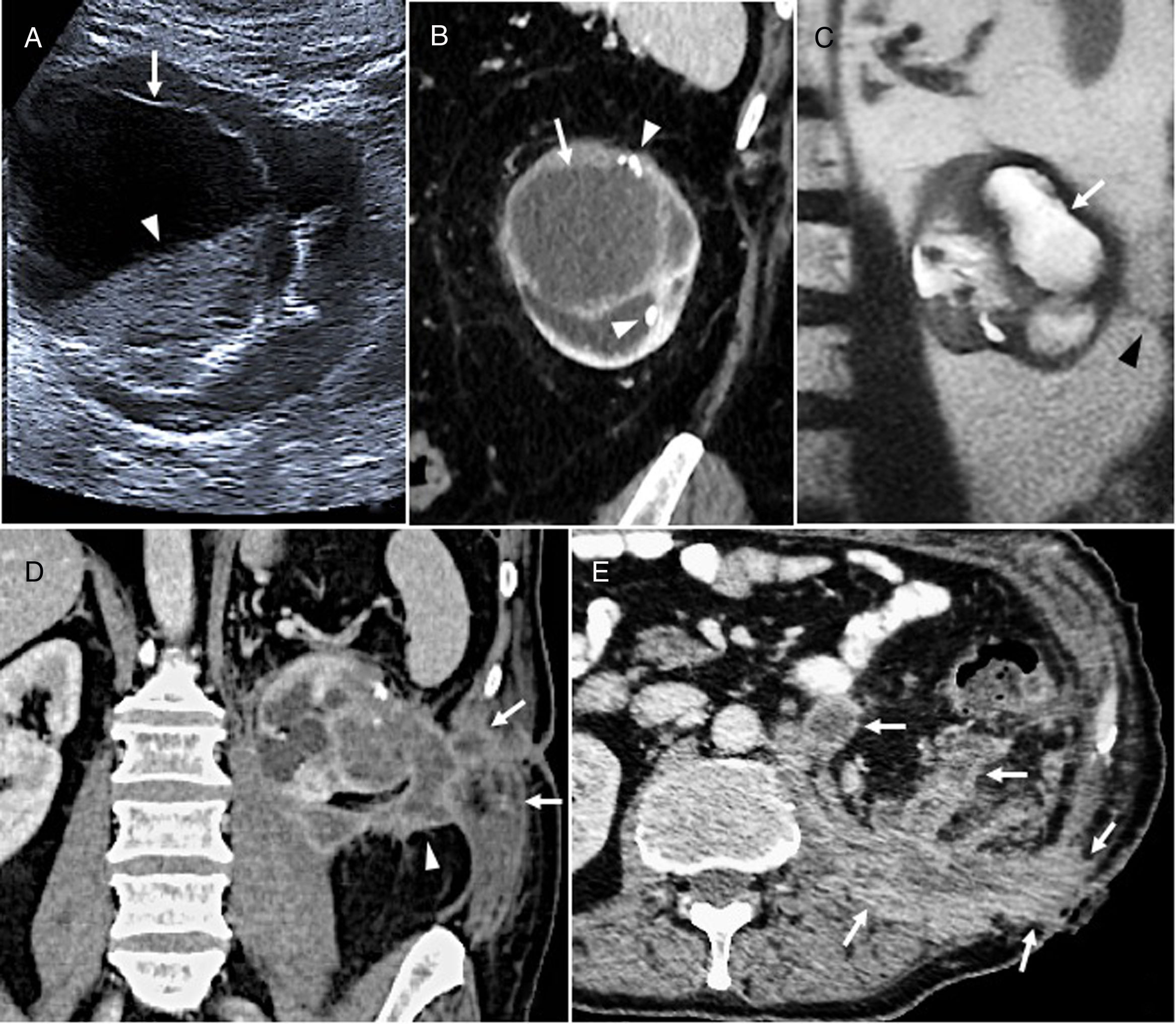
RiñónEl carcinoma mucinoso de células tubulares y fusiformes del riñón (CMCTF) es una neoplasia rara reconocida por la OMS en 2004 como un subtipo de carcinoma epidermoide. Es más frecuente en mujeres y la edad de presentación es variable50–54. La mayoría son asintomáticos, con curso indolente, pero se han publicado casos con metástasis, comportamiento agresivo o diferenciación sarcomatosa, por lo que la OMS dejó de considerarlo una lesión de bajo grado en la clasificación de 201655. Histológicamente se caracteriza por túbulos revestidos de células cuboidales y fascículos de células fusiformes separadas por un estroma de mucina52–56. Son masas bien definidas, de tamaño variable, exofíticas o parenquimatosas, con crecimiento expansivo. Son hipodensas en el estudio basal, generalmente homogéneas, aunque pueden mostrar hemorragia intralesional, calcificaciones y componentes quísticos50,53. En las ST2 varían de hipo- a hiperintensas en función del contenido mucinoso. No contienen grasa y restringen la difusión50,53. Muestran realce de contraste homogéneo o heterogéneo dependiendo del tamaño, pero siempre leve, lento, progresivo y menor que la corteza en todas las fases, con realce máximo en la fase nefrográfica54 (fig. 9). Dado el pronóstico favorable, se suele recomendar cirugía conservadora en los casos de enfermedad localizada. Como pueden metastatizar incluso años después de una cirugía exitosa, es necesario un seguimiento estrecho15,51.
Carcinoma mucinoso de células tubulares y fusiformes del riñón. Varón de 71 años en seguimiento durante 6 años por lesión quística renal (Bosniak IIF-III). A) Imagen de ecografía en la que se observa una lesión quística compleja, con una pared gruesa hiperecogénica (flecha), con calcificaciones y aparición de un nivel en su interior (cabeza de flecha). B) Imagen coronal de tomografía computarizada (TC) con contraste intravenoso que confirma la presencia de una lesión intrarrenal, hipodensa (flecha), con calcificaciones puntiformes y lineales en la pared de la lesión (cabezas de flecha). C) Imagen coronal T2 de resonancia magnética tras una primera intervención quirúrgica que confirma una lesión quística con paredes gruesas hipointensas (flecha). La cabeza de flecha señala un tracto fibroso posquirúrgico. D) Imagen coronal de TC con contraste tras cirugía conservadora que dio lugar a siembra tumoral con implantes en la pared lumbar (flechas) y retroperitoneo (cabeza de flecha) E) Tras cirugía de rescate con nefrectomía, la TC muestra mayor diseminación con implantes en el psoas, retroperitoneo, pared muscular y tejido celular subcutáneo (flechas). A pesar del tratamiento quimioterápico concomitante, hubo progresión de la enfermedad con aparición de metástasis hepáticas. Además, los implantes tumorales se sobreinfectaron y el paciente no llegó a ser dado de alta hospitalaria ya que falleció por sepsis a las pocas semanas de la última intervención y 10 meses después de la primera. Aunque estos tumores habitualmente tienen un pronóstico favorable, la anatomía patológica confirmó un carcinoma renal mucinoso de células fusiformes con un componente fibroso maligno con un Ki67 del 40%.
El adenocarcinoma mucinoso de vejiga es un subtipo infrecuente de tumor vesical (2%) que se presenta con hematuria, síntomas irritativos o mucosuria3,57. Una hipótesis sobre su origen es la presencia de restos del uraco, que se considera factor de riesgo. Otras explicaciones serían la presencia de glándulas embrionarias vestigiales en el epitelio transicional o bien una transformación metaplásica de la mucosa vesical por irritación crónica. Así, la extrofia vesical y la cistitis glandular también son factores de riesgo57,58. Radiológicamente aparecen como masas solidoquísticas, en cúpula, trígono o pared lateral, con calcificaciones habitualmente periféricas. En ocasiones se presenta el dilema diagnóstico de si la lesión es primaria (fig. 10 A) o metastásica (mucho más frecuente), ya que la vejiga puede ser infiltrada por tumores originados en colon, recto o próstata (fig. 10 B).
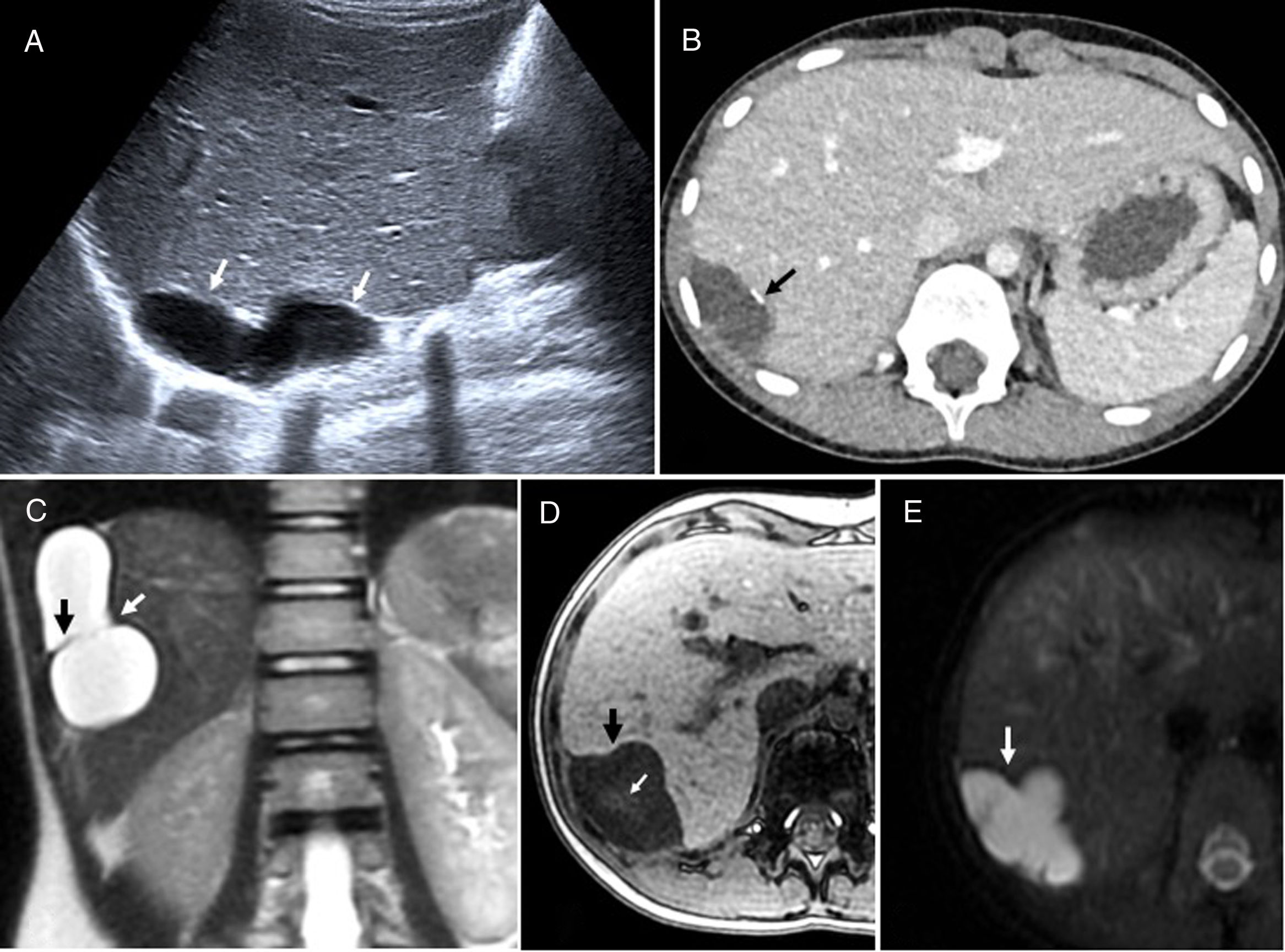
A) Neoplasia mucinosa de vejiga en mujer de 68 años. Imagen axial de tomografía computarizada (TC) con contraste que pone de manifiesto una masa heterogénea (flechas blancas), con zonas hipodensas, parcialmente calcificada (flecha negra) y áreas de realce de contraste en la pared posterior de la vejiga, sin plano de clivaje con la cúpula vaginal (flechas punteadas blancas). La cabeza de flecha señala el vástago de una sonda vesical. Se realizó cistectomía, histerectomía, colpectomía y reconstrucción tipo Bricker. La anatomía patológica reveló extensión perineural, vascular, ganglionar y afectación del margen quirúrgico del uréter izquierdo, por lo que se decidió iniciar quimioterapia adyuvante. B) Adenocarcinoma mucinoso de recto bien diferenciado, de bajo grado, en paciente masculino de 77 años. Imagen sagital T2 que muestra infiltración de la pared posterior de la vejiga en todo su espesor (flecha negra) por una lesión hiperintensa, con septos internos irregulares hipointensos, compatible con neoplasia mucinosa de recto (flechas blancas). En esta región puede ser difícil determinar el origen de la lesión. Se realizó amputación abdominoperineal y cistectomía radical con quimiorradioterapia posterior. El paciente no muestra signos de recidiva. C y D) Adenocarcinoma mucinoso de uraco en mujer de 47 años. Imagen coronal de TC (C) con contraste que muestra una masa quística heterogénea, hipodensa, con realce irregular de predominio periférico (flechas blancas), en la línea media, que infiltra el techo de la vejiga (flecha negra). La imagen sagital del TC (D) muestra la lesión (flechas blancas) infiltrando el techo vesical (flecha negra) en continuidad con restos del uraco (cabeza de flecha). Ante la sospecha de quiste de uraco sobreinfectado o endometriosis se realizó punción aspirativa con aguja fina de la lesión por vía supravesical. El resultado fue la presencia de material mucoide asociado a escasos grupos tridimensionales de células epiteliales atípicas. La paciente fue sometida a cistectomía parcial con resección de la masa y radioterapia y se encuentra en seguimiento.
El carcinoma de uraco se presenta con hematuria, mucosuria o masa palpable suprapúbica. Por su localización extravesical puede ser clínicamente silente, lo que deriva en presentaciones tardías y avanzadas y, por tanto, en peor pronóstico57,58. Al contrario de la mayoría de tumores vesicales, que son uroteliales, la mayoría de los uracales son adenocarcinomas, posiblemente por su origen en restos embrionarios de células entéricas cloacales. Aparecen como una masa mixta, sólida o quística, anterosuperior a la cúpula vesical, en línea media, con extensión al espacio de Retzius3,57,58 (fig. 10C y D). En TC, la mayoría muestra componentes hipodensos correspondientes a la mucina. Como otros adenocarcinomas mucinosos, pueden mostrar calcificaciones periféricas, que en este caso se consideran prácticamente patognomónicas. En las ST2 se observan áreas de hiperseñal de mucina. La porción sólida del tumor es isointensa en T1 y, a diferencia de colecciones o necrosis, realza con contraste intravenoso3,7,57. Los adenocarcinomas de vejiga y uraco son resistentes a la quimiorradioterapia, por lo que el tratamiento de elección es quirúrgico59,60: cistectomía radical para los tumores vesicales, con resección en bloque de la masa uracal, fascia rectal posterior, peritoneo y pared abdominal en el caso de los uracales.
PróstataLos adenocarcinomas mucinosos de próstata suponen el 0,4% de los adenocarcinomas prostáticos y tienen un pronóstico similar o, en algunos casos, mejor que el adenocarcinoma de próstata convencional61. Presentan hiperseñal en ST2 y pueden no mostrar un coeficiente de difusión aparente (CDA) bajo, por lo que no son útiles los estándares del PI-RADS para su detección62.
El diagnóstico diferencial se establece con hiperplasias quísticas, abscesos y cistoadenomas.
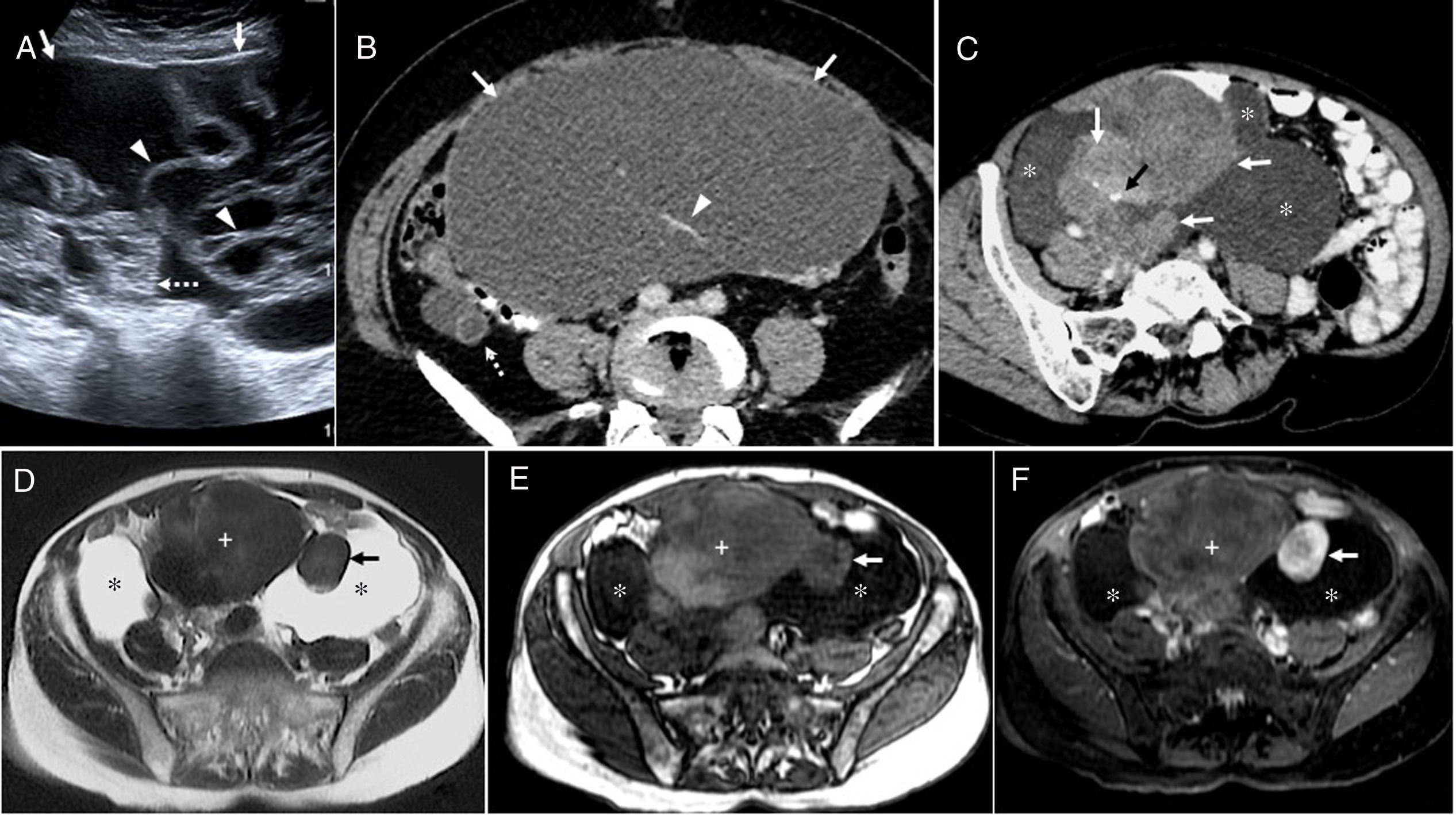
OvarioLas NMO pueden ser primarias o bien metástasis de un adenocarcinoma mucinoso, generalmente de origen gastrointestinal63. Las NMO, con origen en el epitelio mucosecretor, son ligeramente menos frecuentes que las neoplasias serosas ováricas (NSO), en el 80% de los casos son benignas (cistoadenomas) y se presentan entre los 30 y 50 años. El resto son malignas (cistoadenocarcinomas) o borderline, con edades de presentación más tardías. Como en otras localizaciones, se cree que hay una transformación progresiva de adenoma a adenocarcinoma64.
Generalmente se presentan como masas unilaterales, multiloculadas y de gran tamaño (mayores de 10cm) que pueden romperse provocando un pseudomixoma peritoneal. Las loculaciones pueden mostrar distinta señal en RM según su contenido hemorrágico, proteico o mucinoso, lo que les confiere una apariencia “en vidriera”61,62,64. Además, cuando son de muy pequeño tamaño y están agrupados pueden ofrecer un aspecto en “panal de abejas”63,64 (fig. 11).
Neoplasias mucinosas de ovario. A) Imagen de ecografía abdominopélvica en paciente de 61 años con un cistoadenocarcinoma mucinoso de ovario tipo intestinal que se resecó. Lesión quística compleja en pelvis (flechas), con nódulos sólidos (flecha punteada) y septos irregulares (cabezas de flecha) (imagen “en panal de abejas”). B) Corte axial de tomografía computarizada con contraste oral e intravenoso en una paciente de 67 años que muestra una masa voluminosa hipodensa (flechas) con septos que captan (cabeza de flecha) en relación con neoplasia mucinosa de ovario borderline intestinal de bajo potencial maligno sincrónica con un tumor mucinoso de bajo grado del apéndice (flecha punteada). Tras la cirugía, que transcurrió sin complicaciones, la paciente evolucionó satisfactoriamente. C-F) Mujer de 53 años con diagnóstico anatomopatológico de cistoadenocarcinoma mucinoso de ovario moderadamente diferenciado de tipo mixto, endocervical e intestinal. Imagen oblicua de TC (C) con contraste oral e intravenoso que pone de manifiesto una lesión de gran tamaño, multiloculada, con calcificaciones (flecha negra) y áreas quísticas (asteriscos) y zonas de realce heterogéneo (flechas blancas). Cortes axiales T2 (D), T1 (E) y T1 con saturación grasa y contraste intravenoso (F) que muestran una lesión mixta con múltiples lóculos de diferente intensidad de señal (aspecto “en vidriera”), quísticos (asteriscos) y sólidos con realce de contraste intenso (flechas) y leve (signo+). Tras cirugía radical y quimioterapia la paciente permanece libre de enfermedad.
Las NMO benignas se caracterizan por la ausencia de septos o porciones sólidas. Las NMO borderline pueden asociar alguna pequeña proyección papilar, con curvas de realce tipo 2 (meseta) en los estudios dinámicos, e hiposeñal y valores altos de CDA del componente sólido en difusión. Sospecharemos malignidad cuando la lesión muestre septos gruesos mayores de 3mm, componentes sólidos captantes, curvas tipo 3 (lavado)63–66 y el componente sólido muestre hiperseñal en difusión y valores bajos de CDA. Se considera un valor óptimo de CDA para diferenciar las NMO malignas de las borderline de 1.039×10-3mm2/s67.
Las NMO se asocian clásicamente con el tumor de Brenner y viceversa. Además, en las cirugías de NMO se recomienda evaluar el apéndice y extirparlo cuando tenga un aspecto anormal, ya que existe una asociación entre NMO y NMA68 (fig. 11 B).
El diagnóstico diferencial se establece con las neoplasias serosas que suelen ser más pequeñas, uniloculares, bilaterales y con señal homogénea; también con las metástasis, generalmente bilaterales y de menor tamaño. Si se concluye que la lesión ovárica es secundaria, debe buscarse el tumor primario y el tratamiento inicial es la quimioterapia. En cambio, en caso de NMO, debe descartarse carcinomatosis con TC y el tratamiento comienza con cirugía pélvica63,68.
ÚteroUna minoría de los adenocarcinomas de endometrio muestra diferenciación mucinosa de forma predominante y, en estos casos, la mucina puede ser visible macroscópicamente.
El adenoma maligno es una variante rara y agresiva de adenocarcinoma de cérvix asociada al síndrome de Peutz-Jeghers. Típicamente es una lesión multiquística, isointensa o hiperintensa en ST1 e hiperintensa en ST2. Muestra un componente sólido de tamaño variable que realza y permite diferenciarlo de los quistes de Naboth3.
Pseudomixoma peritonealEl PP es una entidad clínica rara caracterizada por la acumulación de material mucinoso en la cavidad peritoneal debida a la rotura de tumores productores de mucina, benignos o malignos, generalmente apendiculares69. Incluso cuando coexisten una neoplasia ovárica con un PP, el origen más frecuente de este es apendicular. Histológicamente puede ser acelular, de bajo o alto grado y de células en anillo de sello70.
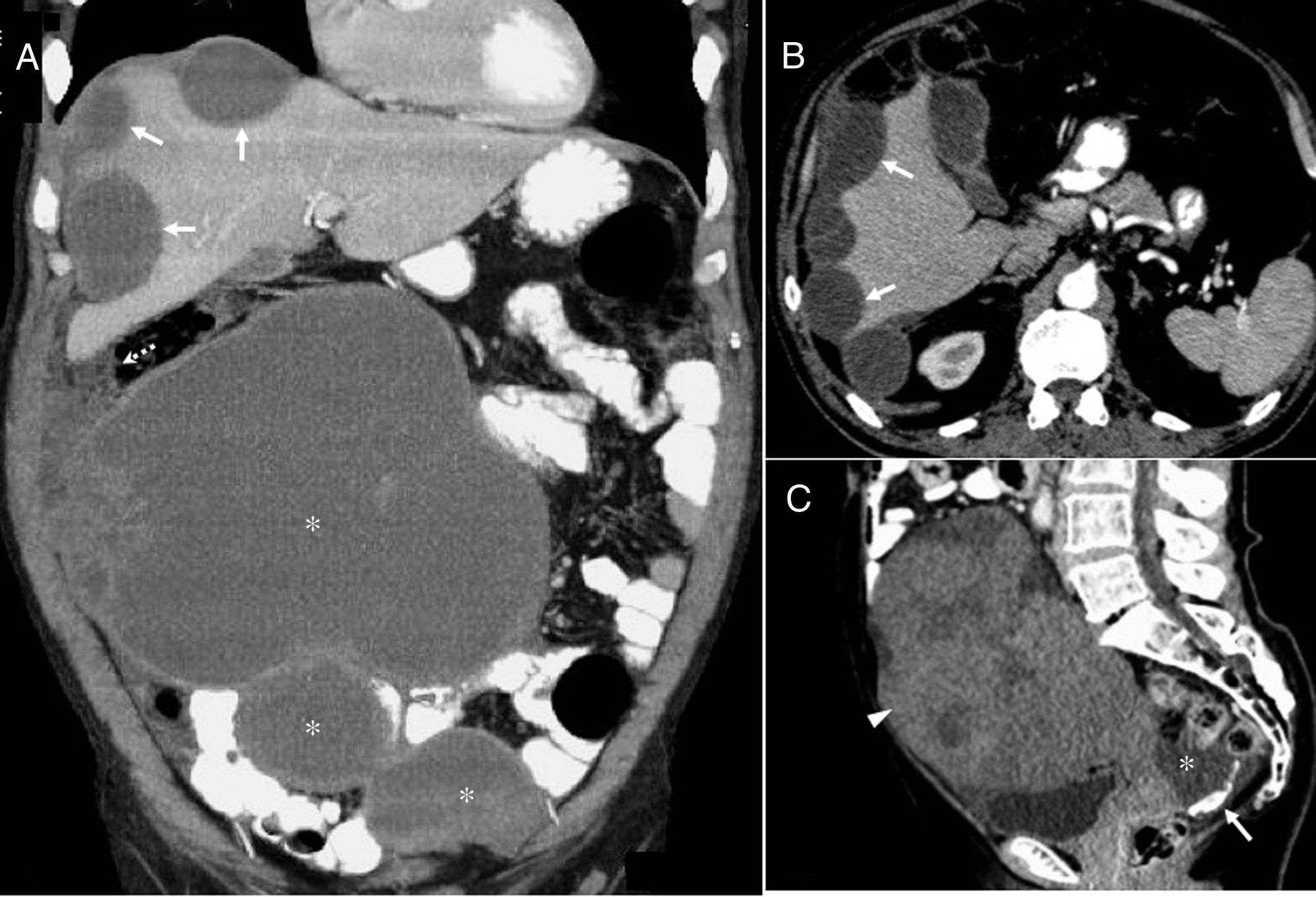
Tiene un curso lentamente progresivo y la presentación clínica más habitual es dolor abdominal, distensión o pérdida de peso. Debido al aumento de la presión intraabdominal son frecuentes la aparición de hernias y la obstrucción intestinal. Ecográficamente aparece como masas ecogénicas avasculares o ascitis con focos ecogénicos inmóviles (a diferencia de la ascitis purulenta o el hemoperitoneo) (fig. 1 B). En la TC, los depósitos de mucina aparecen como líquido hipodenso, a menudo loculado, principalmente en zonas declives como las gotieras y el fondo de saco rectovesical y en zonas de absorción del líquido peritoneal como el epiplón y el diafragma derecho. En cambio, están preservadas las superficies peritoneales del intestino y el mesenterio, posiblemente por su peristaltismo. Las calcificaciones peritoneales curvilíneas son frecuentes70,71. En RM tiene señal variable, generalmente baja en ST1 y alta en ST2, aunque puede mostrar hiperseñal en T1 e hiposeñal en T2 si la mucina es espesa. A diferencia de los líquidos serosos, la ascitis mucinosa condiciona efecto masa sobre el hígado y vísceras huecas que causa un festoneado característico, principalmente hepático, que puede permitir diferenciarla de ascitis de distinta naturaleza como la carcinomatosis peritoneal72 (fig. 12).
Pseudomixoma peritoneal. A y B) Paciente masculino de 66 años con adenocarcinoma mucinoso de apéndice y seudomixoma peritoneal. Imagen coronal de tomografía computarizada (TC) (A) con contraste oral e intravenoso que muestra lesiones hipodensas, quísticas, loculadas, compatibles con implantes capsulares hepáticos (flechas) y peritoneales de gran tamaño (asteriscos). Además, se observa la afectación del omento (flecha punteada). Imagen axial de TC (B) con contraste oral e intravenoso que muestra el festoneado hepático típico (flechas) producido por el pseudomixoma peritoneal. Ante la afectación masiva se desestimó cualquier tipo de intervención quirúrgica y se inició quimioterapia. El paciente falleció a los 25 meses del diagnóstico. C) Mujer de 81 años. Imagen sagital de TC con contraste en la que se observa una masa heterogénea, con tenue realce difuso, correspondiente a un adenocarcinoma mucinoso de ovario (cabeza de flecha). En el fondo de saco de Douglas se observa líquido libre (asterisco) con calcificaciones lineales curvilíneas típicas del pseudomixoma peritoneal (flecha). La anatomía patológica reveló carcinoma mucinoso de ovario bien diferenciado grado 1 de la OMS con depósitos tumorales mucinosos en peritoneo, mesenterio, epiplón y células mucinosas atípicas en líquido ascítico. Se realizó histerectomía, doble anexectomía, apendicectomía, omentectomía y peritonectomías. Posteriormente y tras un año con tratamiento quimioterápico la paciente falleció.
El tratamiento curativo para el pseudomixoma peritoneal es la CCQIH, que presenta una alta morbimortalidad73, por lo que el verdadero reto diagnóstico es seleccionar adecuadamente a los candidatos quirúrgicos. Bouquot et al. publicaron un sistema de puntuación radiológico preoperatorio, basado en los hallazgos de TC, que evalúa la extensión de la enfermedad y predice la resecabilidad74. Sugieren que la afectación perihepática se asocia con una cirugía citorreductora incompleta y, por tanto, con peor pronóstico. Se recomienda control evolutivo70. En caso de recidiva es posible realizar un segundo procedimiento terapéutico70,71.
ConclusionesLos tumores abdominopélvicos productores de mucina comparten características radiológicas que permiten su identificación, pero difieren en pronóstico y evolución clínica. Mientras que en algunas localizaciones como el hígado, el páncreas o el riñón muestran cursos variables, a veces indolentes, en otras como el colon, el recto, el estómago, la vejiga o el uraco suelen ser agresivos. La radiología es útil para el seguimiento y para sugerir su diagnóstico, ya que el rendimiento de las biopsias y citologías en las lesiones mucinosas suele ser bajo. No obstante, el estudio histológico final es el que determina el manejo terapéutico en la mayoría de las ocasiones.
Autoría- 1.
Responsable de la integridad del estudio: LRR.
- 2.
Concepción del estudio: LRR.
- 3.
Diseño del estudio: LRR.
- 4.
Obtención de los datos: LRR, NFG, DJTS, RGI, TBDS.
- 5.
Análisis e interpretación de los datos: LRR, NFG, DJTS, RGI, TBDS.
- 6.
Tratamiento estadístico: NA.
- 7.
Búsqueda bibliográfica: LRR, NFG, DJTS.
- 8.
Redacción del trabajo: LRR, NFG.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: LRR, NFG, DJTS, RGI, TBDS.
- 10.
Aprobación de la versión final: LRR, NFG, DJTS, RGI, TBDS.
Los autores declaran no tener ningún conflicto de intereses.