Los estudios de neuroimagen tienen un papel fundamental en la evaluación y diagnóstico de la epilepsia. Los avances tecnológicos que se han producido en las técnicas de neuroimagen permiten en la actualidad obtener información no solo estructural, sino también funcional. La fisiopatología de la epilepsia consiste en un aumento anómalo de la actividad cerebral que puede llegar a apreciarse mediante técnicas de neuroimagen, como por ejemplo la RM funcional (RMf), la tomografía por emisión de positrones (PET) y la tomografía por emisión de fotón simple (SPECT). En pacientes con epilepsia farmacorresistente, la cirugía tiene como objetivo principal el control de las crisis, y por tanto mejorar la calidad de vida. La RMf juega un papel cada vez más relevante en la valoración prequirúrgica de estos pacientes, evaluando la localización de áreas funcionales que deben evitar lesionarse durante el acto quirúrgico.
Neuroimaging studies play a fundamental role in the diagnosis and evaluation of epilepsy. Technological advances in neuroimaging techniques have made it possible to obtain functional as well as structural information. The pathophysiology of epilepsy consists of an abnormal increase in cerebral activity that can be appreciated on neuroimaging techniques like functional magnetic resonance imaging (fMRI), PET, and SPECT. In patients with epilepsy that is refractory to drug therapy, the main aim of surgery is to control seizures and thus to improve the quality of life. In the preoperative workup of these patients, fMRI has an increasingly important role, evaluating the location of functional areas that must be safeguarded during surgery.
Los pacientes con epilepsia farmacorresistente pueden beneficiarse de la cirugía, siempre y cuando se pueda localizar el origen de la generación de las crisis. Las técnicas de neuroimagen tienen un papel muy importante en la localización de este foco epileptogénico, sobre todo mediante estudios estructurales de alta definición que permiten localizar en casi el 90% de los pacientes con epilepsia del lóbulo temporal el foco epileptógeno1. Sin embargo, los resultados no son tan buenos cuando se trata de pacientes con epilepsia de origen extratemporal1.
El objetivo de la cirugía en la epilepsia es la resección completa o la desconexión completa del área epileptogénica, la cual se define como el área de córtex indispensable para la generación de crisis convulsivas clínicas, y al mismo tiempo preservar el córtex elocuente2, ya que el objetivo final es mejorar la calidad de vida de los pacientes.
Aunque el estudio estructural por resonancia magnética (RM) sigue siendo la principal herramienta diagnóstica de imagen en la epilepsia farmacorresistente, los estudios de neuroimagen funcional tienen cada vez más importancia, sobre todo para la localización de las áreas elocuentes que se pueden ver afectadas durante la cirugía y para la evaluación de los cambios funcionales que se suceden, ya que en ocasiones permiten localizar áreas epileptogénicas sin traducción estructural.
La RM funcional (RMf) es una técnica no invasiva que va ganando cada vez más adeptos en la evaluación prequirúrgica de la epilepsia, ya que de forma indirecta permite localizar las áreas elocuentes relacionadas con el foco epileptogénico. La resección del hipocampo es el procedimiento quirúrgico más utilizado en pacientes con epilepsia parcial farmacorresistente, por eso es imprescindible conocer, previamente a la cirugía, la dominancia hemisférica del lenguaje y de la memoria.
Algunas técnicas como la SPECT ictal o la RMf ictal aportan información de los cambios que se generan durante la crisis, mientras que otros como la PET obtienen información de la fase denominada interictal.
El objetivo de esta revisión es ofrecer una actualización de las nuevas aplicaciones de los estudios de neuroimagen funcional en epilepsia. Nos centraremos en los estudios de RMf para el mapeo, dominancia del lenguaje y evaluación de la memoria, en la RMf ictal y en el papel de las exploraciones funcionales de medicina nuclear (tomografía por emisión de positrones [PET] y tomografía por emisión de fotón simple [SPECT]) en los pacientes epilépticos.
Resonancia magnética funcionalLa técnica de RMf actualmente más empleada es la técnica BOLD que utiliza los cambios de señal que se producen en el torrente venoso ocasionados por un exceso de deoxihemoglobina, tras el aumento de la perfusión acaecido durante la activación cerebral. Los cambios de señal producidos durante la actividad cerebral son muy sutiles y por eso es recomendable utilizar un equipo de RM de alto campo magnético. En la práctica clínica, la mayoría de los estudios de RMf se pueden realizar en equipos de 1.5T, aunque es preferible adquirirlo en equipos de 3T, si se dispone del mismo. En equipos de 3T, la señal BOLD aumenta un 4-5% en relación con uno de 1.5T, y aunque se incrementan los artefactos de susceptibilidad intrínsecos al alto campo magnético, estos pueden reducirse usando imágenes de alta resolución reduciendo los tiempos de adquisición con técnicas de imagen en paralelo3.
Para realizar un estudio de RMf deben tenerse en consideración dos factores importantes. El primero es el diseño del experimento. Normalmente se utiliza un diseño de bloques, aunque varios autores sugieren que el diseño relacionado con eventos obtiene mejores resultados en los estudios de RMf para valorar la memoria4. En el diseño de paradigmas cognitivos, como los del lenguaje o la memoria, es importante basarse en estudios neuropsicológicos previamente validados. El segundo factor importante es el análisis de las imágenes obtenidas. Los cambios de señal que se producen entre el período de activación y reposo son pequeños y deben ser diferenciados de las variaciones de la señal que no sean debidas a procesos de activación cerebral como, por ejemplo, el ruido de la imagen. Por lo tanto, es necesario procesar estadísticamente los datos obtenidos para poder determinar si los cambios de señal observados tienen un patrón similar a los cambios hemodinámicos esperables durante la activación cerebral.
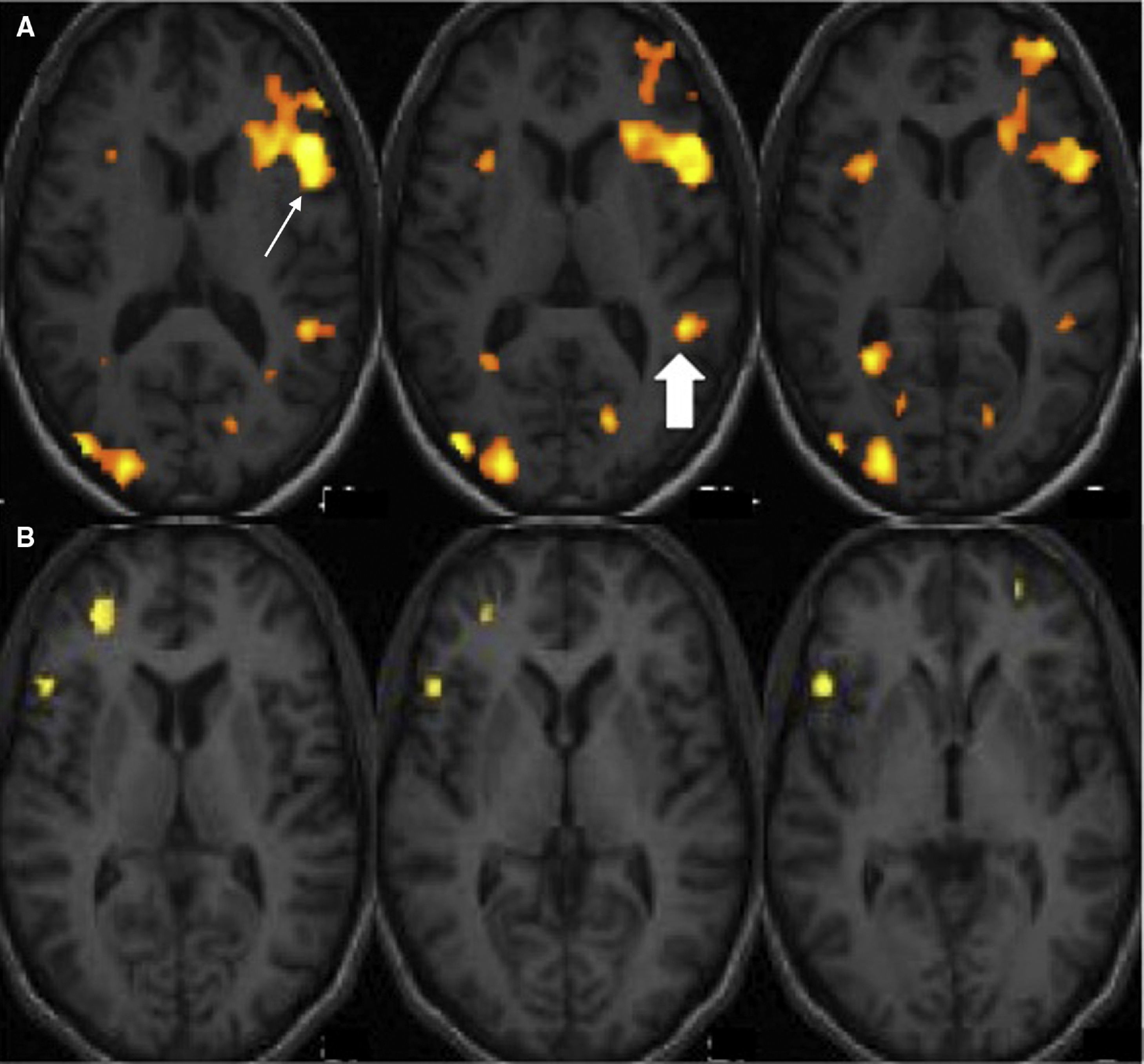
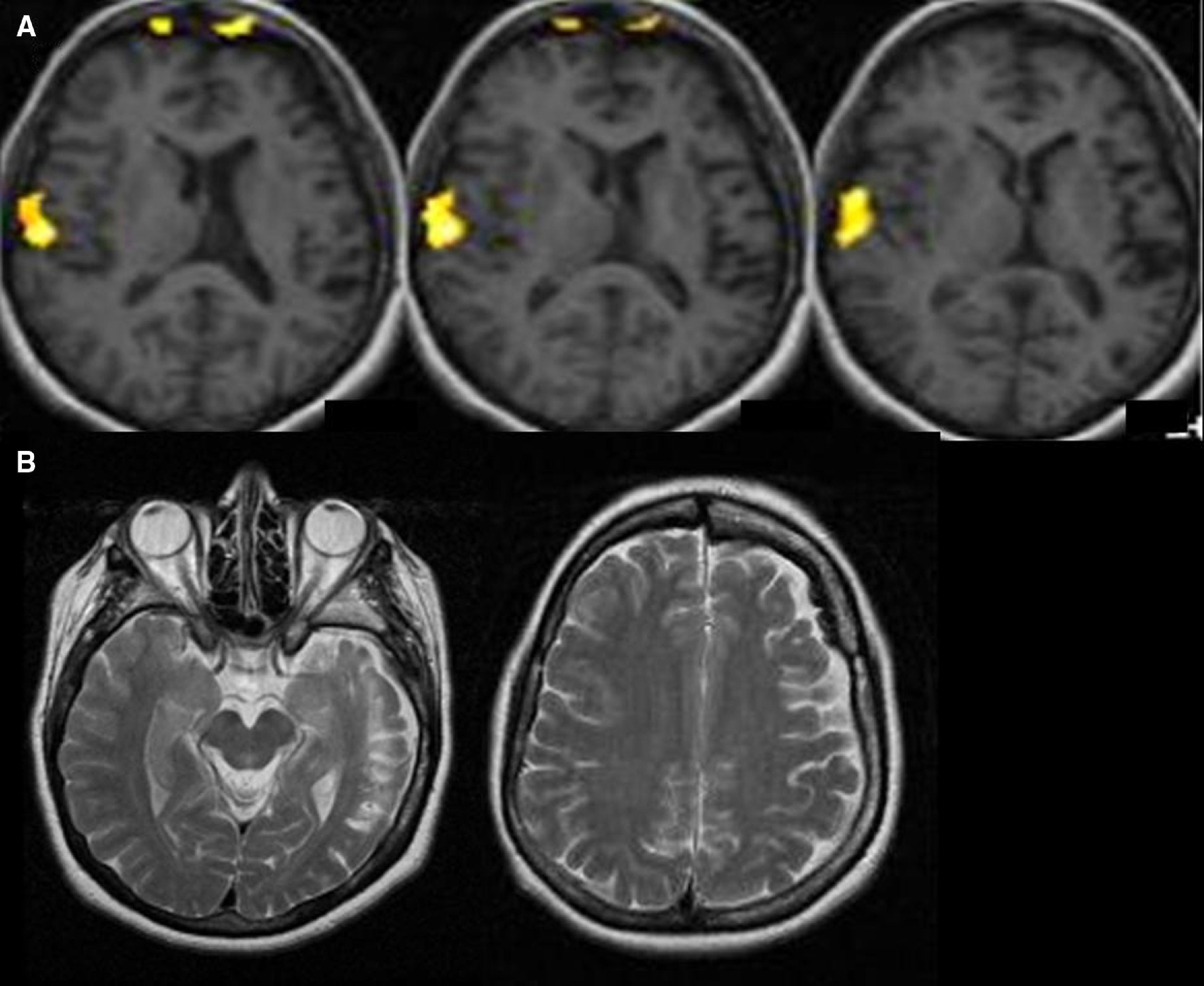
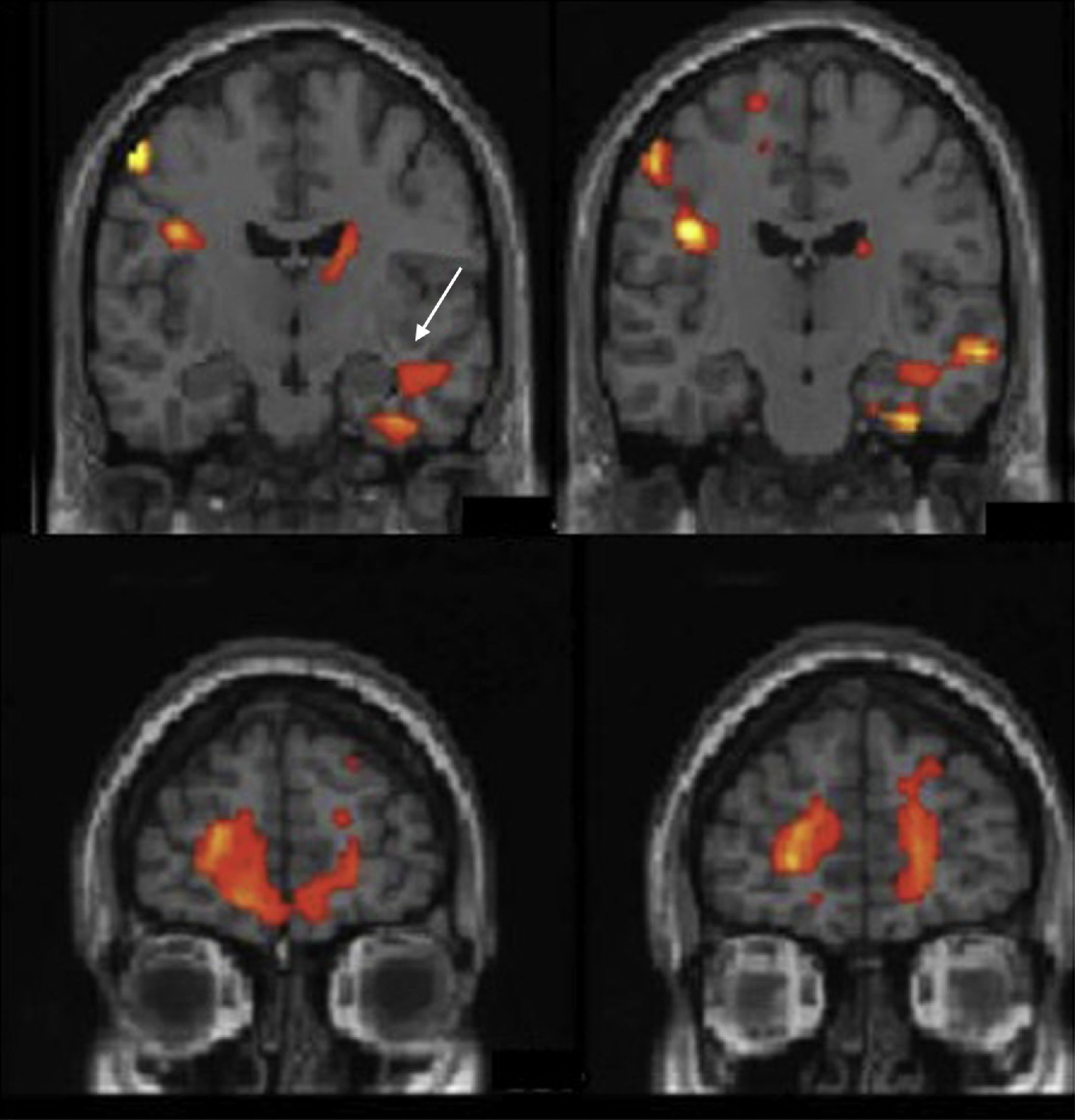
Resonancia magnética funcional para la lateralización y el mapeo del lenguajeLa indicación clínica más frecuente de la RMf en la epilepsia es la determinación de la dominancia hemisférica del lenguaje. La resección de la porción anterior del lóbulo temporal junto con estructuras mesiales como el hipocampo es la cirugía más común en la epilepsia farmacorresistente. Esta intervención puede causar déficit específicos del lenguaje como la disnomia y/o de la memoria como la amnesia, dependiendo de la dominancia hemisférica del lenguaje. La función de la memoria verbal se produce en el hipocampo dominante para el lenguaje. En pacientes que tienen poca reserva funcional de memoria debido a la cronicidad de la epilepsia, la resección del hipocampo dominante para el lenguaje aumenta el riesgo de amnesia. Se ha demostrado que existe un aumento de pacientes zurdos o con lateralización atípica del lenguaje en la población epiléptica5–7, (fig. 1). Por esto, es muy importante determinar la dominancia hemisférica para el lenguaje en estos pacientes, sobre todo si se les va a realizar cirugía en el teórico hemisferio dominante (en la mayoría de la población, el izquierdo). Además, en pacientes pediátricos que han sufrido lesiones hemisféricas, como infartos cerebrales o encefalitis, pueden reorganizarse o transferirse funciones al hemisferio sano, por lo que es de vital importancia conocer la localización del hemisferio dominante si se quiere realizar una hemisferectomía funcional (desconectar un hemisferio del contralateral)8,9 (fig. 2). Es interesante destacar que algunos autores han descrito casos de pacientes epilépticos en los que el área de Broca se sitúa en un hemisferio y el área de Wernicke en el contralateral, lo que se denomina disociación interhemisférica entre las regiones frontales y temporales y que indicaría una transferencia incompleta del lenguaje10,11.
RM funcional del lenguaje con paradigma de generación de palabras. Cortes axiales estructurales fusionados con los mapas de activación en la región fronto-temporal. A) Sujeto diestro. Se obtiene activación en la circunvolución frontal inferior izquierda (área de Broca) (flecha) y temporal posterior izquierda (área de Wernicke) (flecha rellena), demostrando dominancia hemisférica izquierda para el lenguaje. B) Sujeto zurdo. Se obtiene activación en la circunvolución frontal inferior derecha y córtex dorso-lateral derecho, demostrando dominancia hemisférica derecha para el lenguaje.
A) RM funcional del lenguaje con un paradigma de comprensión auditiva. Cortes axiales estructurales, fusionados con los mapas de activación en la región fronto-temporal, en un paciente epiléptico que presentó una meningitis a los tres años de edad. Se obtiene una activación de la región temporal posterior derecha demostrando una dominancia hemisférica derecha. B) Cortes axiales estructurales potenciados en T2 donde se aprecia la atrofia cortical del hemisferio izquierdo y la alteración de señal del lóbulo temporal izquierdo.
Hasta hace poco, el test de Wada, también llamado de amobarbital intracarotídeo, ha sido la técnica de elección para la determinación del hemisferio dominante para el lenguaje. En este test se anestesia localmente un hemisferio cerebral, mediante la administración intracarotídea de amobarbital, comprobándose entonces qué funciones cognitivas están afectas. Es pues una técnica invasiva y sus resultados pueden cuestionarse, sobre todo porque es imposible determinar si el hemisferio teóricamente no anestesiado puede verse contaminado por la circulación colateral entre la circulación anterior y posterior.
La técnica de elección para localizar las áreas primarias del lenguaje es el mapeo cortical intraoperatorio o tras la colocación de electrodos intracraneales. Sin embargo, esta es una técnica muy agresiva y solo se utiliza en casos en que la resección quirúrgica esté muy cerca de las teóricas áreas relacionadas con el lenguaje2.
En los últimos años ha aumentado el interés hacia los estudios de RMf para evaluar el lenguaje, con la intención de reemplazar técnicas más invasivas. Existen varios trabajos que han comparado el test de Wada con la RMf de lenguaje y han demostrado que existe una correlación muy buena entre ambas técnicas12–17.
Benke et al.12 publicaron una serie de 68 pacientes con epilepsia crónica intratable del lóbulo temporal estudiados con el test de Wada y RMf utilizando un paradigma de decisión semántica para determinar la lateralización del lenguaje y encontraron una muy buena congruencia entre las dos técnicas en los pacientes con epilepsia del lóbulo temporal derecho (89,3%), mientras que la congruencia fue razonablemente buena en los pacientes con epilepsia del lóbulo temporal izquierdo (72,5%).
Todos estos hallazgos apoyan la utilidad clínica de la RMf para el estudio de la lateralización del lenguaje y relegan el uso de técnicas más invasivas, como el test de Wada, a casos en que exista discordancia entre la clínica, la neuropsicología y los hallazgos de la RMf.
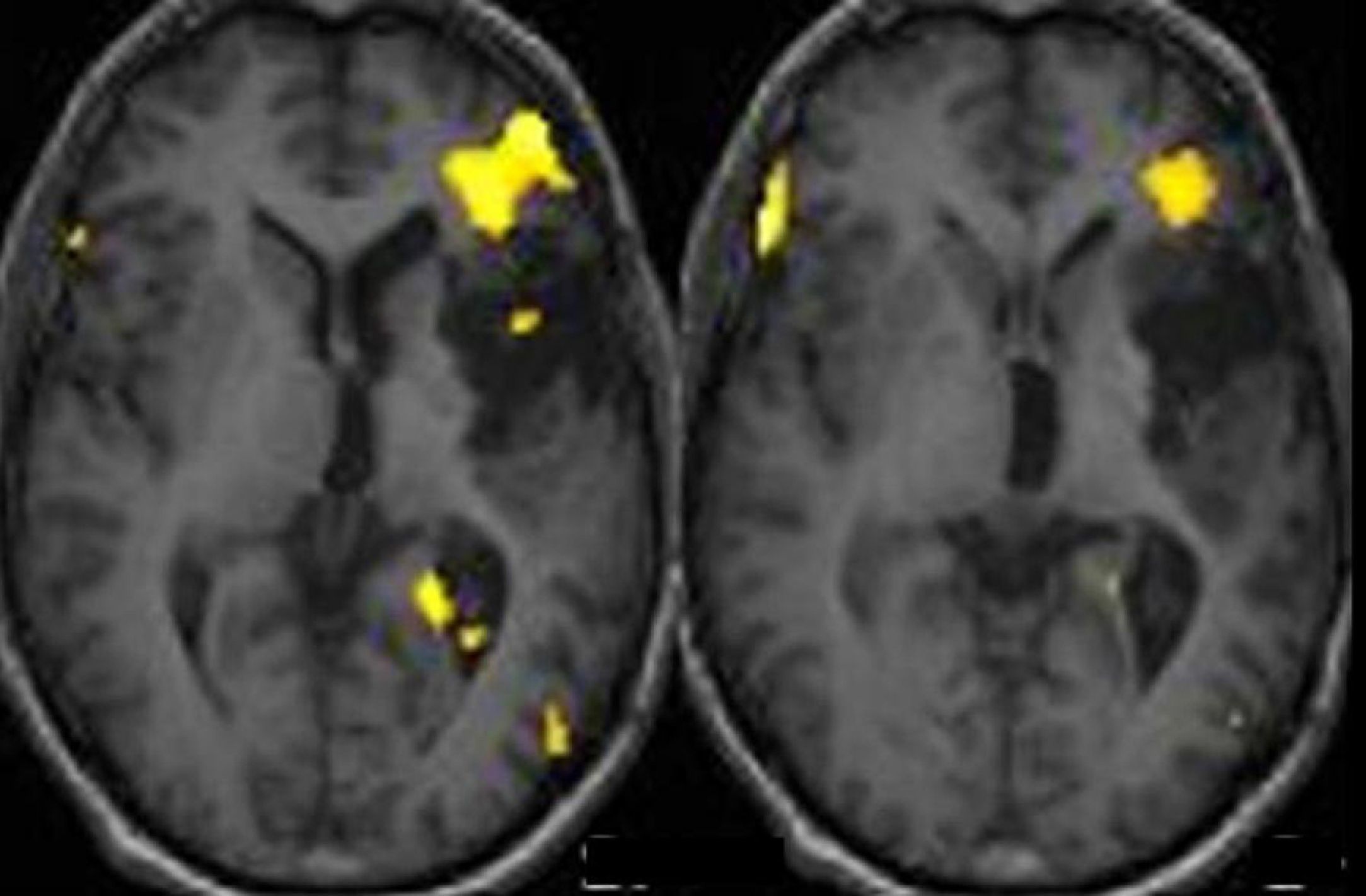
Los estudios de RMf también se han utilizado para situar anatómicamente las áreas elocuentes del lenguaje. La localización exacta de las regiones que controlan la función del lenguaje varía considerablemente entre sujetos y debe determinarse previamente a la cirugía (fig. 3). La correlación entre estudios de RMf y mapeo cortical del área primaria motora ha sido demostrada en varios trabajos18–21. Sin embargo, existen pocos estudios de correlación entre la RMf y el mapeo intraoperatorio para la localización de las áreas relacionadas con el lenguaje. Roux et al.22 demostraron únicamente correlación entre las RMf y las áreas motoras relacionadas con el lenguaje. Sin embargo, más recientemente, en un estudio retrospectivo Petrovich et al.23, encontraron una buena relación entre la RMf y el mapeo cortical intraoperatorio en la circunvolución frontal inferior, sobre todo si en el estudio de RMf se realiza una tarea de fluidez verbal vocalizando las palabras.
RM funcional del lenguaje con un paradigma de generación de palabras en un paciente epiléptico con un astrocitoma insular izquierdo parcialmente resecado. Cortes axiales estructurales fusionados con los mapas de activación en la región fronto-temporal. Se observa una activación en la región frontal inferior izquierda adyacente a la tumoración.
Es importante recordar que en los pacientes epilépticos existe una alta incidencia de localización atípica de las áreas del lenguaje, sobre todo si la epilepsia se inicia durante la niñez5,6,24. Así pues, para la planificación de la cirugía en pacientes epilépticos que afecten las áreas elocuentes para el lenguaje, la RMf puede ayudar a localizar dichas áreas corticales, aunque sigue siendo imprescindible utilizar técnicas invasivas como el mapeo intraoperatorio o la estimulación cortical con electrodos invasivos, para prevenir déficits del lenguaje en estos pacientes.
Resonancia magnética funcional para la evaluación de la memoriaEvaluar la función de la memoria es imprescindible en los pacientes con epilepsia del lóbulo temporal. Es sabido que la esclerosis mesial puede producir un déficit de memoria visual o verbal dependiendo del hemisferio dominante para el lenguaje25.
La técnica estándar para estimar la lateralización de la memoria es la evaluación neuropsicológica, y la utilización de pruebas invasivas, como el test de Wada, queda relegada únicamente a los casos de alto riesgo de amnesia postoperatoria.
Existe un gran interés en la evaluación de la RMf como técnica de evaluación de la memoria, no solo en pacientes epilépticos, sino también en otras afecciones, como en las demencias.
La RMf para evaluar la memoria constituye todo un reto, existiendo algunas consideraciones que deben tenerse en cuenta respecto a esta técnica. La localización anatómica de los hipocampos, cerca del hueso y del aire de los senos paranasales, incrementa los artefactos de susceptibilidad magnética, sobre todo con las secuencias utilizadas para la RMf, lo que puede enmascarar la activación en esta localización26,27. Este artefacto puede reducirse parcialmente con las técnicas de adquisición en paralelo.
El procesamiento de la memoria implica una compleja función cognitiva. Por eso, un paradigma que active las áreas relacionadas con la memoria es mucho más complejo de crear que aquellos dedicados al estudio del lenguaje. En la ejecución de la memoria están involucrados varios componentes, como la codificación y la evocación de la información a memorizar. Además, dependiendo del tipo de material presentado (visual o verbal), las áreas cerebrales involucradas cambian (en la memoria visual está implicado el hemisferio no dominante y en la memoria verbal el hemisferio dominante para el lenguaje). Además, en esta función se hallan implicadas otras áreas cerebrales, como las regiones prefrontales, relacionadas con funciones de atención28.
En la literatura existe una amplio número de experimentos de RMf para la evaluación de la memoria que utilizan diferentes estímulos incluyendo palabras, objetos, caras, escenas o rutas, diferentes funciones de memoria (codificación y evocación) y tipo de diseño (en bloque o relacionado con evento). La mayoría de estos estudios muestran activaciones en el córtex prefrontal y en las estructuras temporales mesiales. La parte posterior del hipocampo, y las circunvoluciones parahipocampales y fusiforme son las estructuras temporales mesiales que muestran más activación29. La ausencia de activación de la cabeza del hipocampo podría explicarse por los artefactos de susceptibilidad tan frecuentes en esta zona intracraneal27.
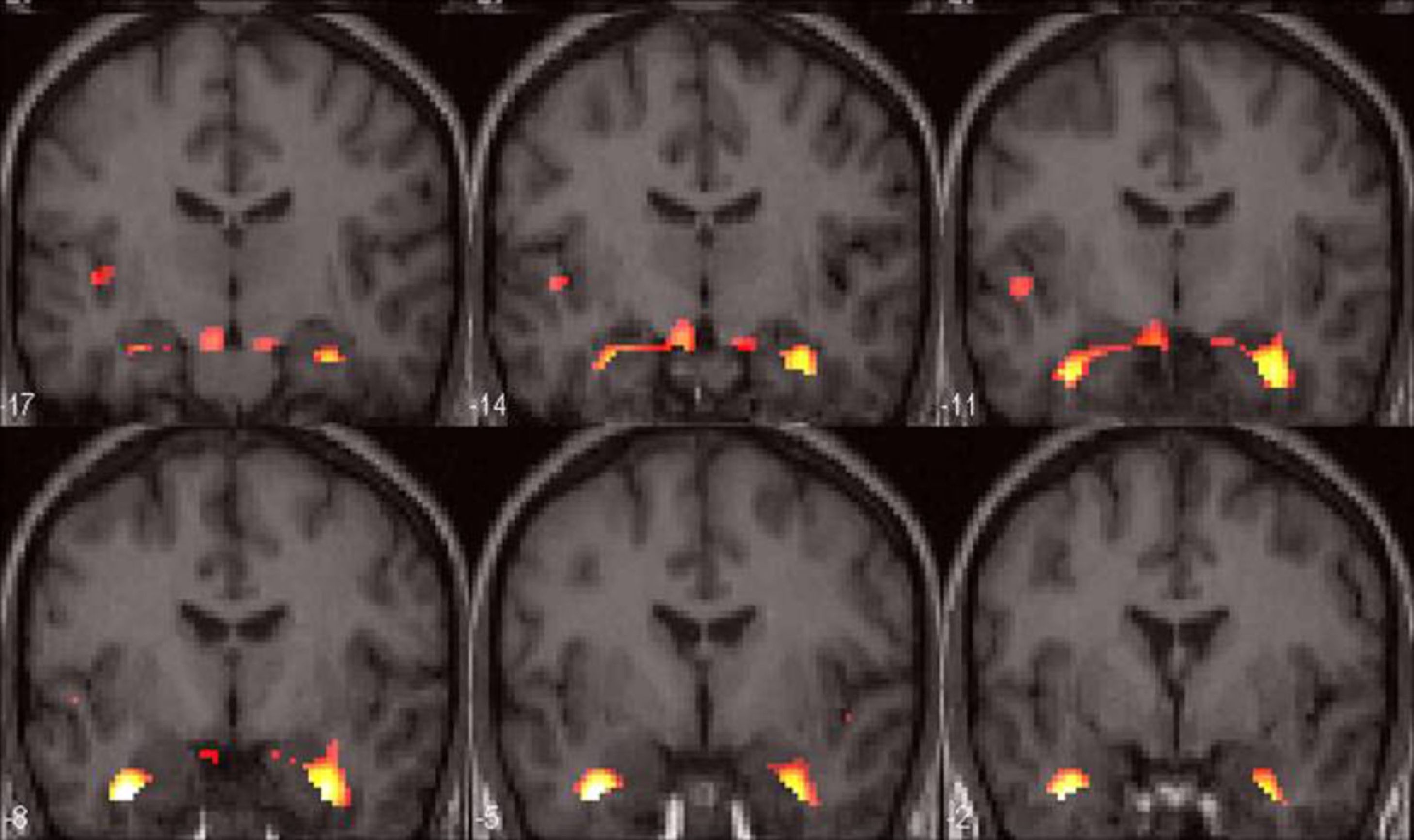
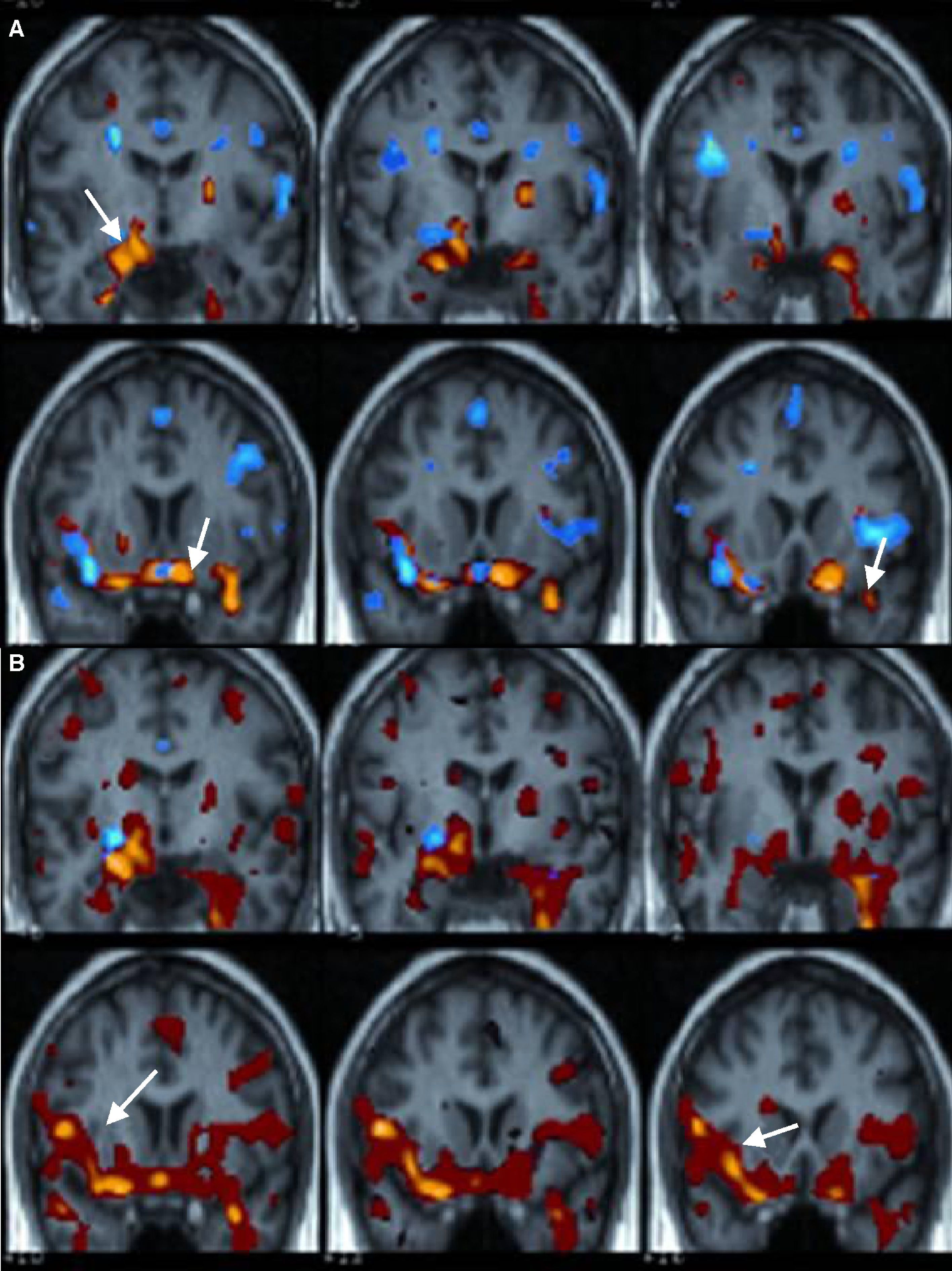
Aunque algunos autores han descrito una lateralización en la activación en los procesos de memoria según el material presentado28,30, la activación bilateral de ambos hipocampos es el hallazgo más frecuente cuando se utilizan tareas de codificación o evocación29,31,32 (fig. 4).
RM funcional de memoria con un paradigma de evocación (recordar un listado de palabras). Estudio grupal en sujetos controles. Cortes coronales estructurales fusionados con el mapa de activación que demuestran una activación bilateral de ambas estructuras mesiales temporales (hipocampo, amígdala y polo anterior temporal).
Este patrón de activación bilateral de las estructuras temporales mesiales podría indicar que durante las tareas de procesamiento de la memoria se utilizan tanto estrategias visuales como verbales.
Otro dato a tener en cuenta es que la mayoría de estos resultados obtenidos con los paradigmas de memoria con RMf, están basados en estudios grupales y, por lo tanto, no tienen una traslación a la práctica clínica, ya que para que un paradigma de memoria sea efectivo como herramienta diagnóstica o predictiva debe ser robusto, no solo a nivel grupal, sino también a nivel individual. A pesar de ello, algunos autores han empezado a utilizar la RMf para la evaluación de la memoria en pacientes con epilepsia refractaria del lóbulo temporal. Existen pocos trabajos que comparen los resultados de la RMf de memoria con los obtenidos con el test de Wada, aunque muestran resultados esperanzadores25,32,33. También se han realizado varios estudios comparando la activación obtenida con RMf para la evaluación de memoria entre pacientes con epilepsia del lóbulo temporal y controles. Mientras que los controles suelen mostrar activación bilateral de las estructuras temporales mesiales, en los pacientes con esclerosis mesial la activación suele ser más unilateral y en el hipocampo no afecto32,34–37 (fig. 5).
RM funcional de memoria con un paradigma de evocación. Estudio grupal en pacientes con epilepsia temporal derecha. Cortes coronales estructurales fusionados con el mapa de activación que demuestran una activación unilateral en estructuras mesiales temporales izquierdas (flecha), así como una activación bilateral del córtex prefrontal aunque de mayor predominio derecho.
Existen muy pocos trabajos que hayan investigado el papel de la RMf de memoria para predecir los déficits de memoria posquirúrgicos después de la resección del lóbulo temporal, si bien los resultados obtenidos son esperanzadores35,38,39. Recientemente, algunos autores han demostrado que estudios de RMf para el lenguaje, sobre todo los de comprensión semántica, que son más fáciles de reproducir, podrían ser capaces de predecir los déficits de memoria posquirúrgicos. El uso de estos paradigmas menos complejos, tanto en la adquisición como en el análisis, permitiría realizar estos estudios con mucha más facilidad. Sin embargo es necesario disponer de más información para poder establecer conclusiones40,41.
Así pues, el papel de la RMf de memoria en la evaluación prequirúrgica de la epilepsia del lóbulo temporal sigue siendo incierto. Evidentemente ésta técnica es más barata, no invasiva y mucho más accesible que el test de Wada. No obstante, por todo lo expuesto anteriormente, esta técnica aún no está validada como herramienta diagnóstica en la práctica clínica.
Resonancia magnética funcional ictal para la localización del foco epileptogénicoEn los últimos años, han aparecido varios trabajos que utilizan la RMf en pacientes epilépticos con el objeto de determinar la localización y la extensión del córtex involucrado en la generación de las crisis epilépticas40,42–45.
El contraste BOLD utilizado en la RMf refleja los cambios hemodinámicos relacionados con la actividad cerebral. Así pues, durante la generación de crisis epilépticas, donde se produce un exceso de actividad cerebral, la señal BOLD también debe verse alterada, mostrando las áreas afectadas. Se ha demostrado que segundos antes del inicio de los cambios eléctricos, se produce una disminución de la señal BOLD en zonas lejanas del área epileptogénica, seguida de un incremento muy significativo de la misma en el origen ictal que coincide con los cambios eléctricos. Estos incrementos de la señal BOLD se extienden hacia otras áreas del cerebro, permitiendo observar el patrón de propagación de las crisis46.
Sin embargo, la ejecución de esta técnica es compleja. Los artefactos en la imagen que se generan por el movimiento del paciente durante la generación de la crisis, impiden la viabilidad de la misma. Solo los pacientes con crisis parciales, preferentemente no motoras son candidatos para esta técnica. Además, se debe realizar un registro electroencefalográfico (EEG) durante la adquisición de la RMf para así correlacionar los datos funcionales con la actividad eléctrica cerebral. Los equipos de registro del EEG deben ser compatibles con la RM y sus resultados tratarse a posteriori mediante filtros, ya que el campo magnético interfiere notablemente sobre el registro obtenido. Por último, el diseño y el análisis estadístico para valorar las imágenes estudiadas son complejos45,46.
Los trabajos publicados utilizando esta técnica son en general casos aislados o de series pequeñas. Todos ellos describen cambios de señal focales que coinciden con las lesiones estructurales47–49.
En nuestro centro estamos realizando esta técnica obteniendo buenos resultados (fig. 6); sin embargo la complejidad de la misma augura que será muy difícil incorporarla en la práctica clínica.
RM funcional ictal. Paciente con crisis epilépticas de inicio temporal mesial derecho. Cortes coronales estructurales fusionados con mapa de activación (azul- disminución de la activación; rojo-activación). A) En el momento del inicio de la alteración electroencefalográfica se aprecia una activación temporal mesial bilateral (flechas) (posible propagación rápida al hemisferio cerebral izquierdo). B) A los tres segundos del inicio de la crisis se aprecia extensión de la propagación hacia la ínsula derecha (flechas) y marcada activación temporal de predominio derecho.
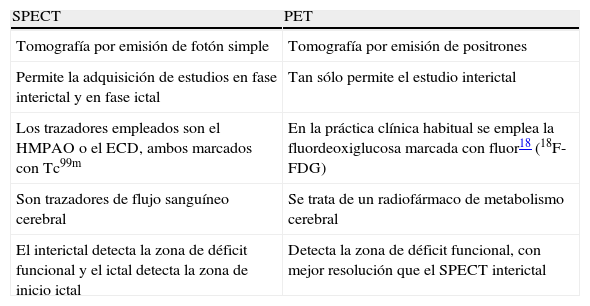
Las exploraciones de medicina nuclear que han demostrado utilidad en la localización de la zona epileptógena (ZE) son la tomografía por emisión de positrones (PET) y la tomografía por emisión de fotón simple (SPECT). Sus principales particularidades y diferencias se detallan en la tabla 1.
Características de la SPECT y la PET
| SPECT | PET |
| Tomografía por emisión de fotón simple | Tomografía por emisión de positrones |
| Permite la adquisición de estudios en fase interictal y en fase ictal | Tan sólo permite el estudio interictal |
| Los trazadores empleados son el HMPAO o el ECD, ambos marcados con Tc99m | En la práctica clínica habitual se emplea la fluordeoxiglucosa marcada con fluor18 (18F-FDG) |
| Son trazadores de flujo sanguíneo cerebral | Se trata de un radiofármaco de metabolismo cerebral |
| El interictal detecta la zona de déficit funcional y el ictal detecta la zona de inicio ictal | Detecta la zona de déficit funcional, con mejor resolución que el SPECT interictal |
ECD: dímero de etilcisteina; HMPAO: hexametilpropilenamino oxima; PET: tomografía por emisión de positrones; SPECT: tomografía por emisión de fotón simple; Tc99m: tecnecio 99.
La SPECT cerebral de perfusión es una exploración funcional cerebral en la que se emplean trazadores con capacidad de atravesar la barrera hematoencefálica y fijarse dentro de la célula cerebral de forma proporcional al flujo sanguíneo cerebral. Estos trazadores son el hexametilpropilenamino oxima (HMPAO) o el dímero de etilcisteina (ECD), ambos marcados con tecnecio-99m (99mTc). En pacientes con crisis parciales complejas (CPC), en función de la localización de la epilepsia (temporal mesial o neocortical) y del momento en que se inyecta el trazador de perfusión (ictal o postictal), la SPECT cerebral presenta diferentes patrones de captación y de distribución del trazador.
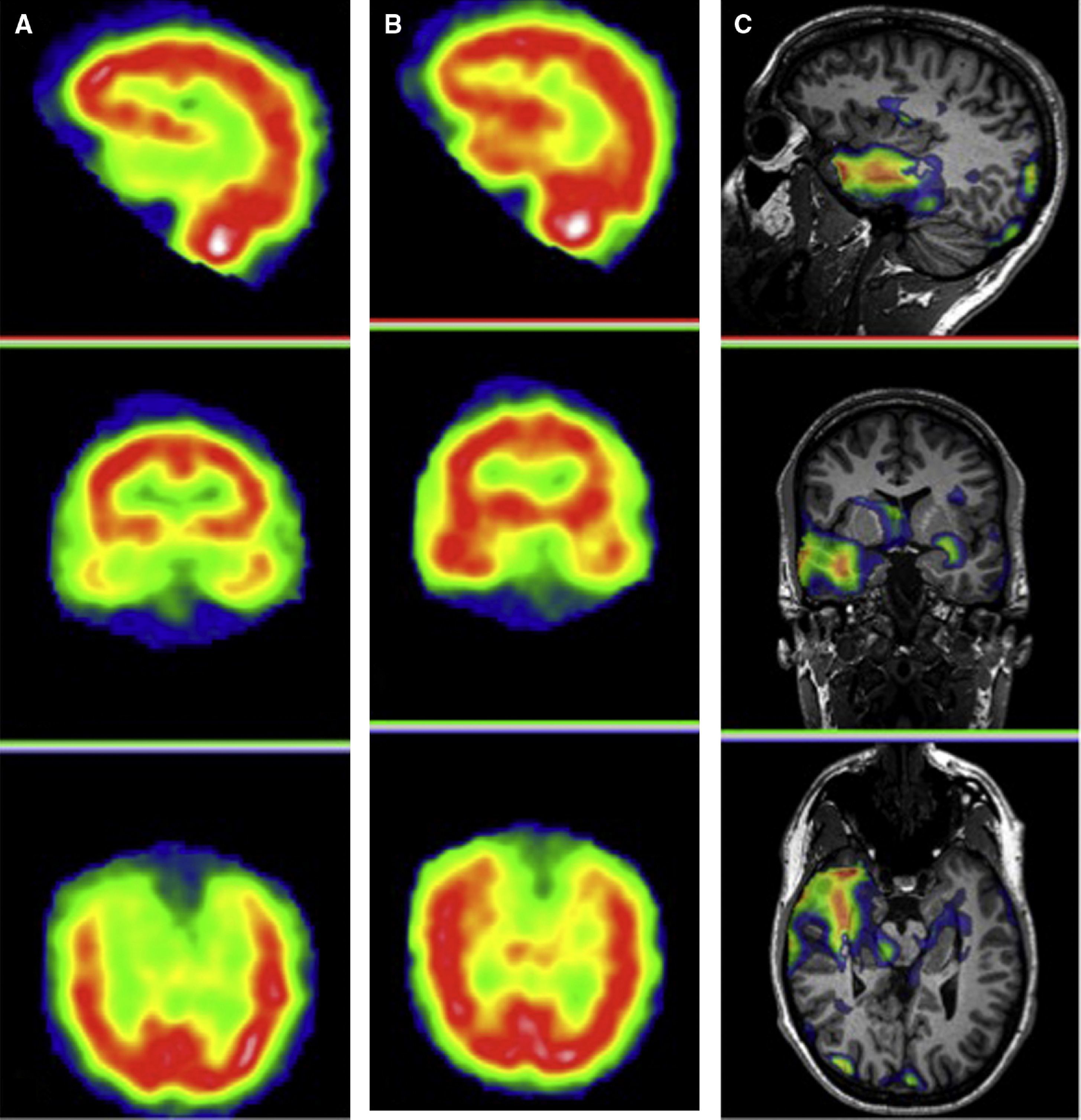
Tomografía por emisión de fotón simple cerebral en la epilepsia mesial temporalSe habla de SPECT interictal cuando la inyección del trazador se realiza con el paciente en condiciones basales, en reposo y estando libre de crisis durante un período de tiempo superior a 24 horas. En la SPECT interictal la ZE aparece como un área focal hipoactiva, que traduce su menor perfusión. En la epilepsia del lóbulo temporal, la SPECT interictal muestra una menor perfusión en la región temporal (fig. 7A), que suele localizarse en la zona mesial del asta anterior del lóbulo temporal.
A) Cortes sagitales, coronales y axiales de SPECT cerebral interictal de un paciente con crisis parciales complejas del lóbulo temporal derecho. La SPECT muestra una disminución de la perfusión en la región temporal anteromesial derecha. B) Cortes sagitales, coronales y axiales de una SPECT cerebral del mismo paciente, al que se le inyectó el trazador durante una crisis parcial compleja localizada en el lóbulo temporal derecho. La SPECT cerebral muestra un aumento de perfusión en el lóbulo temporal derecho, coincidiendo con la zona epileptógena. C) Imágenes de fusión de la substracción de la SPECT ictal e interictal corregistrado sobre la RM del mismo paciente, que muestra un aumento de perfusión en el polo anterior del lóbulo temporal derecho, de predominio en territorio mesial.
En la literatura, la sensibilidad de la SPECT interictal para lateralizar la ZE en las CPC del lóbulo temporal es muy variable (35-80%), con un valor medio del 50%. En nuestra experiencia50, la sensibilidad de la SPECT cerebral interictal para localizar el origen de las CPC del lóbulo temporal es del 68%.
En la SPECT ictal, la inyección del trazador se lleva a cabo durante la crisis epiléptica y las imágenes gammagráficas pueden adquirirse hasta dos horas después, una vez solucionada la misma. La comparación de la perfusión cerebral entre ambos SPECTs cerebrales (ictal e interictal), realizados al mismo paciente en dos situaciones diferentes, puede ayudar a localizar la región epileptógena con una sensibilidad diagnóstica superior al 90% en pacientes con crisis del lóbulo temporal51. En estas condiciones, la SPECT cerebral muestra un aumento de la captación del radiofármaco en la región epileptógena, como consecuencia de un aumento del flujo sanguíneo regional cerebral durante las crisis (fig. 7B).
Con frecuencia, la inyección del trazador se retrasa unos segundos, de forma que se realiza una vez que ha finalizado la actividad ictal. La SPECT obtenida bajo estas condiciones se conoce como SPECT postictal y suele localizar la ZE temporal como una hipercaptación focal de trazador en el córtex temporal mesial y una hipocaptación temporal lateral difusa. A medida que aumenta el tiempo entre el final de la crisis y la inyección, la zona de hiperperfusión disminuye, mientas que la zona de hipoperfusión aumenta hasta abarcar prácticamente todo el lóbulo temporal. La sensibilidad de detección de la ZE del SPECT postictal es de un 75% en la epilepsia del lóbulo temporal51.
Tomografía por emisión de fotón simple cerebral en la epilepsia neocorticalEn la epilepsia neocortical que incluye la epilepsia de origen extratemporal o temporal extralímbica, la precisión diagnóstica de la SPECT, tanto interictal como ictal, disminuye de forma significativa. La sensibilidad del SPECT interictal para localizar áreas hipoactivas en la ZE es del 15 al 30%, por lo que no parece una exploración indicada en esta situación clínica. Su única aplicación en la epilepsia neocortical es para realizar el análisis comparativo de imágenes interictal/ictal.
En la epilepsia extratemporal, la SPECT ictal es la técnica de diagnóstico por la imagen con un rendimiento más elevado en la localización de la ZE, ya que su sensibilidad se sitúa por encima del 75% en casi todas las series publicadas52. Al igual que en la epilepsia temporal, la SPECT ictal en la epilepsia neocortical detecta un aumento focal de perfusión en la ZE.
Sin embargo, debido a la brevedad de las crisis extratemporales, es difícil obtener una SPECT ictal y, en la mayoría de casos, se realiza SPECT postictal, la cual tiene una escasa utilidad en la epilepsia extratemporal, ya que su sensibilidad disminuye al 20-50%51.
Para optimizar al máximo los resultados quirúrgicos se ha implantado en los últimos años la metodología de fusión de imágenes de SPECT y RM denominada SISCOM (Subtraction Ictal Spect Co-registered to Magnetic Resonance Imaging), con el objeto de mejorar la rentabilidad diagnóstica de ambas exploraciones. La imagen SISCOM combina la información morfológica de la RM y la funcional de la SPECT, ya que se obtiene de la fusión de la imagen diferencia entre la SPECT ictal y la SPECT interictal sobre la RM del propio paciente. La metodología del SISCOM mejora la localización de la ZE y proporciona una precisa localización anatómica de la ZE (fig. 7C)53.
Las principales indicaciones clínicas del SISCOM son las epilepsias sin lesiones estructurales evidenciadas por RM, ya sean neocorticales o temporales, las lesiones epileptogénicas extensas o múltiples como la esclerosis mesial bilateral o displasias corticales bilaterales, las epilepsias en las que existen discordancia entre exploraciones (vídeo-EEG y RM) y las que se presentan en pacientes con recidiva de sus crisis tras la cirugía.
En general, en todos los casos en que se plantee la colocación de electrodos subdurales, el SISCOM puede aportar información localizadora de la zona a estudiar, mejorando el rendimiento de esta técnica invasiva. El papel del SISCOM en los pacientes con malformaciones del desarrollo cortical también es fundamental, ya que está demostrado que no toda la zona displásica es epileptogénica, pudiendo el SISCOM ayudar a planificar la zona de resección quirúrgica54–56. O’Brien et al.57 demostraron que la SPECT ictal con SISCOM localizaba la ZE en 19 de 22 pacientes con displasias (86%) y de los 10 casos incluidos con RM normal, el SISCOM localizaba la ZE en 8.
La tomografía por emisión de positronesLa tomografía por emisión de positrones (PET) con fluordeoxiglucosa marcada con fluor18 (18F-FDG) se fundamenta en que la distribución intracerebral de glucosa es equivalente al metabolismo cerebral. Esta técnica se emplea en la evaluación prequirúrgica de la epilepsia como estudio interictal, ya que la lenta captación cerebral de glucosa y el corto período de semidesintegración del flúor18 dificultan la obtención de estudios ictales. La PET interictal detecta una disminución focal de captación de glucosa, que se describe como un hipometabolismo, que refleja un déficit funcional cerebral focal asociado a la ZE. Su principal ventaja respecto a la SPECT interictal es una mejor resolución espacial con una mayor sensibilidad diagnóstica para localizar la ZE.
Tomografía por emisión de positrones cerebral en la epilepsia mesial temporalLa sensibilidad de la PET en la epilepsia mesial temporal oscila entre el 80 y el 90% y puede demostrar hipometabolismo focal temporal en pacientes sin evidencia de esclerosis mesial en la RM58. El hipometabolismo temporal anterior detectado en la PET en pacientes con esclerosis mesial temporal suele ser más extenso que la propia lesión de la RM. Esto puede deberse a que la región hipometabólica detectada con la PET incluye, además de la zona lesional detectada por la RM, la zona funcional deficitaria o de déficit funcional.
La PET está especialmente indicada en aquellos casos con sospecha de epilepsia mesial temporal, con vídeo-EEG y RM discordantes o en los casos con RM sin alteraciones estructurales.
Tomografía por emisión de positrones cerebral en la epilepsia neocorticalPor su mayor dificultad diagnóstica, el papel de la PET en la epilepsia neocortical parece más relevante. Los hallazgos de la PET con 18F-FDG parecen especialmente útiles en pacientes con lesiones muy sutiles o mal definidas en la RM, como ocurre en las malformaciones del desarrollo cortical (MDC) o en los pacientes con estudios de RM normales o no localizadores. La sensibilidad de la RM en las displasias corticales oscila entre el 30 y el 80%, mientras que la de la PET varía entre el 70 y el 90%55. En los pacientes con MDC, el hipometabolismo observado en la PET puede revelar una displasia cortical focal más extensa que la detectada en la RM. En otros casos, la PET ayuda a confirmar una lesión dudosa o muy sutil en la RM, o incluso puede demostrar una displasia en pacientes con RM normal.
Pese a ello, la experiencia de la PET en la epilepsia extratemporal es aún escasa y la mayoría de trabajos se centran en pacientes con epilepsia infantil. El éxito de la PET en la epilepsia infantil se debe al mayor porcentaje de epilepsia neocortical (superior al 50%) o a la mayor proporción de displasias corticales, donde la RM tiene un menor rendimiento diagnóstico.
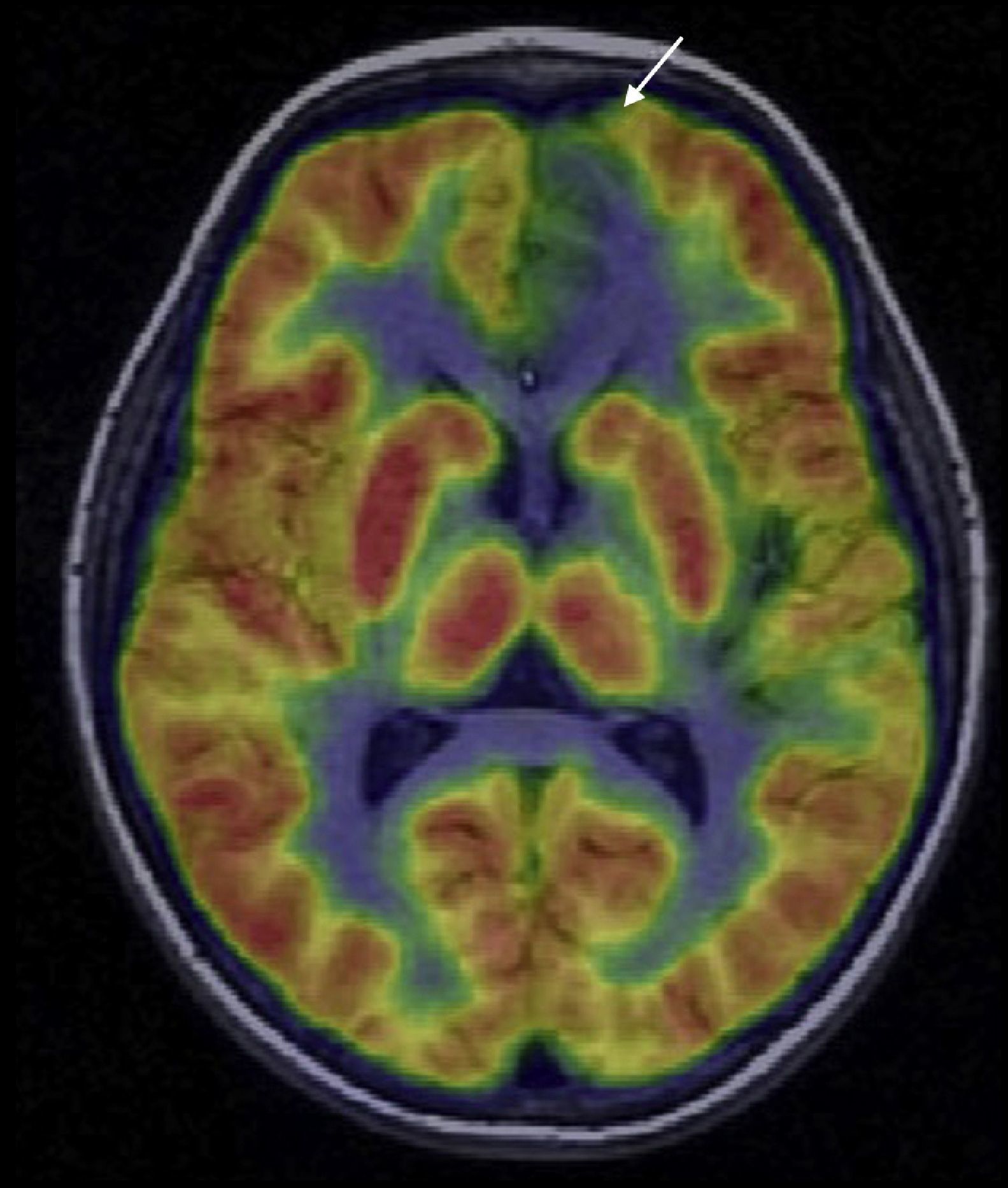
Un trabajo reciente de Salamon et al.59 ha demostrado que una variante metodológica de la PET, que consiste en evaluar sus imágenes tomográficas con escala de color y superponerlas mediante corregistro a la RM del paciente, mejora significativamente la capacidad diagnóstica de la PET en las displasias corticales. Con esta variante metodológica (fig. 8) la sensibilidad de la PET en las displasias corticales puede llegar al 70-90%. Este corregistro PET/RM consigue localizar una lesión hipometabólica en el 33% de pacientes con hallazgos de EEG y RM discordantes o negativos. Por todo ello, en pacientes con epilepsia extratemporal y RM normal o con una lesión dudosa, la PET o el corregistro PET/RM puede, además de mejorar el rendimiento diagnóstico de la RM, ayudar a delimitar con mayor precisión los bordes o la extensión de la resección quirúrgica y así evitar resecciones incompletas de la ZE60.
ConclusiónEL principal objetivo de los estudios de neuroimagen, tanto estructural como funcional (PET, SPECT, RMf ictal), es intentar localizar la zona epileptogénica para poder plantear una opción quirúrgica que logre mejorar la calidad de vida de estos pacientes. En la epilepsia temporal, tanto los estudios estructurales por RM como las técnicas de neuroimagen funcional como la PET y la SPECT tienen un alto rendimiento diagnóstico. Es en la epilepsia extratemporal sin lesión estructural donde las técnicas de neuroimagen funcional van a tener un papel fundamental, ya que pueden aportar información localizadora de la zona epileptogénica.
Se ha demostrado que la RMf del lenguaje es una herramienta eficaz para determinar la dominancia hemisférica del lenguaje y aunque aún no existe evidencia científica de la utilidad de la RMf para determinar la reserva cognitiva de memoria, esta técnica acabará convirtiéndose en una herramienta de manejo clínico en los pacientes con epilepsia farmacorresistente.
Autoría- 1.
Responsable de la integridad del estudio: NB
- 2.
Concepción del estudio: NB, XS
- 3.
Búsqueda bibliográfica: NB, XS
- 4.
Redacción del trabajo: NB, XS
- 5.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: NB, XS
- 6.
Aprobación de la versión final: NB, XS
Los autores declaran no tener ningún conflicto de intereses.