Nefropatía inducida por contraste (NIC) es el deterioro agudo de la función renal tras la administración intravascular de contraste yodado. Nuestros objetivos son estimar la incidencia de NIC y analizar la evolucion de distintos biomarcadores de funcion renal, en pacientes tras una tomografía computarizada (TC) con contraste yodado intravenoso (CIV) y premedicación (hidratación oral y N-acetilcisteína).
Material y métodosEstudio observacional prospectivo. Fueron seleccionados 112 pacientes, con una TC con CIV programada y enfermedad renal crónica (ERC) con un filtrado glomerular (FG) entre 30 y 60ml/min/1,73 m2. Se obtuvieron datos demográficos, dosis del CIV, diabetes mellitus, hipertensión arterial y hemoglobina sérica. Se midió la creatinina sérica y el FG posterior a la premedicación y a la TC. Se utilizaron medias, desviaciones estándar y porcentajes, así como las pruebas de Wilcoxon y Mann-Whitney para determinar diferencias significativas, y la de Pearson para análisis de correlación.
ResultadosIncidencia de insuficiencia renal aguda: 0,9%; intervalo de confianza (IC) 95%: 0,36 a 1,4. Media de la diferencia de creatinina pre- y post-TC: 0,04 (IC: 0,002 a 0,09), p < 0,004. Media de la diferencia de FG pre- y post-TC: -3,06 (IC: -4,66 a -1,47), p < 0,001.
ConclusionesLa incidencia de NIC en pacientes con ERC y FG entre 30 y 60ml/min/1,73 m2 es baja. Los pacientes que recibieron premedicación y la mínima dosis de CIV presentaron mejoría en los biomarcadores de función renal analizados.
The term contrast-induced nephropathy is used to describe acute deterioration of renal function after the intravenous administration of iodinated contrast material. We aimed to estimate the incidence of contrast-induced nephropathy and to analyze the evolution of different biomarkers of renal function in patients who underwent computed tomography with intravenous contrast administration after premedication with oral hydration and N-acetylcysteine.
Material and methodsThis prospective observational study included 112 patients with chronic renal failure (glomerular filtration rate (GFR) 30 mL—60 mL/min/1.73 m2) scheduled for computed tomography with intravenous iodinated contrast material. We recorded demographic variables, dose of contrast material, diabetes mellitus, hypertension, and serum hemoglobin. We measured serum creatinine and GFR after premedication and after the CT examination. We summarized variables as means, standard deviations, and percentages. We used the Wilcoxon and Mann-Whitney tests to compare pre- and post-CT values and Pearson's r to analyze correlations.
ResultsIncidence acute kidney injury: 0.9%; 95%CI: 0.36—1.4. Mean difference between pre- and post-CT creatinine: 0.04; 95%CI: 0.002—0.09, p < 0.004. Mean difference between pre- and post-CT GFR: -3.06; 95%CI: -4.66— -1,47), p < 0.001.
ConclusionsThe incidence of contrast-induced nephropathy in patients with chronic renal failure and GFR 30 mL—60 mL/min/1.73 m2 is low. The biomarkers of renal function analyzed improve in patients who receive premedication and the minimum dose of contrast material.
Se entiende por nefropatía inducida por contraste (NIC) el deterioro agudo de la función renal que ocurre entre el segundo y quinto días tras la administración de un medio de contraste yodado intravascular (CIVa)1,2. Algunas sociedades, como el American College of Radiology (ACR), son más restrictivas y consideran que la NIC es tan solo un subgrupo de las insuficiencias renales que suceden tras la administración de CIVa, en las que el agente etiológico es el propio CIVa y en ausencia de otra causa que lo explique3.
Se puede establecer el diagnóstico de NIC por un aumento absoluto en las cifras de creatinina de 0,3mg/dl o por un incremento de estas mayor del 50% sobre la cifra de creatinina basal4.
Su aparición se ha relacionado con factores de riesgo del paciente (enfermedad renal crónica, diabetes mellitus, edad avanzada, anemia, hipotensión, hipovolemia, obesidad e isquemia crítica tisular, entre otros) y del procedimiento (introducción de grandes volúmenes de contraste, alta concentración, alta osmolaridad, vía de administración, etc.)1,2,5–7.
Aunque se ha dudado de la existencia de la NIC, existen estudios que afirman que se trata de una entidad real pero menos frecuente de lo que se pensaba inicialmente1,2,8,9. Pese a ello, parece razonable utilizar medidas profilácticas para minimizar el riesgo de sufrir NIC, así como encontrar grupos de pacientes con mayor riesgo de desarrollar esta complicación. Esto toma mayor importancia si tenemos en cuenta el aumento de procedimientos con contraste radiológico, especialmente en pacientes que necesiten de múltiples estudios de control por su patología de base y/o que presentan mayor fragilidad y morbilidad1,2.
Las mejores medidas preventivas son la correcta valoración del paciente y una buena comunicación entre médicos peticionarios y radiólogos, a fin de seleccionar la prueba más adecuada para un determinado paciente10,11. Adicionalmente, se han propuesto medidas profilácticas para pacientes de riesgo; la expansión de volumen es la más aceptada, sin que exista consenso sobre con qué agente realizarla o sobre la utilidad de la N-acetilcisteína como complemento12–16.
El objetivo de este estudio observacional es definir la incidencia de NIC en nuestro centro de trabajo, tras la realización de una tomografía computarizada (TC) con contraste yodado intravenoso (CIV) programada, en una muestra de pacientes con patologías crónicas y daño renal moderado, así como analizar la evolución global de los parámetros analíticos de función renal y su variación respecto a diferentes factores de riesgo.
Materiales y métodosPacientesSe seleccionaron 112 pacientes consecutivos citados para la realización de una TC en nuestro centro, entre el 1 de julio y 30 de noviembre de 2018, para seguimiento de una patología crónica con datos analíticos de enfermedad renal crónica en los últimos 3 meses y con al menos un resultado estimado de filtrado glomerular (FG) < 60ml/min/1,73 m2 según la fórmula Modification of Diet in Renal Disease (MDRD-4)17, quienes aceptaron formar parte del estudio y firmaron el consentimiento informado. Se excluyeron los pacientes menores de 18 años, ingresados o aquellos con un FG estimado<30ml/min/1,73 m2.
MetodologíaEstudio de cohortes prospectivo, que comprendió varias fases:
- 1.
Revisión de pacientes y generación de peticiones analíticas. Tres días antes de la prueba, se obtuvo el listado de pacientes citados para la realización de una TC con CIV en nuestro centro y se seleccionaron las peticiones. En dichos pacientes, se comprobó la existencia de una analítica realizada en nuestro centro en los 3 meses previos, con resultado de FG > 30 y <60 ml/min/1,73m2. En estos casos se contactó con el paciente para informarle sobre el estudio y, una vez mostrada su conformidad para formar parte del mismo, recomendar la aplicación de medidas profilácticas establecidas en acuerdo con el servicio de Nefrología de nuestro hospital (hidratación con 2 litros de agua al día y 600mg cada 12 horas de N-acetilcisteína durante los 2 días previos a la prueba).
- 2.
El día de la prueba se completaron los datos del paciente sobre los factores de riesgo establecidos:
- a.
Diagnóstico de hipertensión arterial.
- b.
Dosis y tipo de contraste.
- c.
Diagnóstico de diabetes mellitus.
- d.
Hemoglobina sérica (Hb).
- e.
Edad, sexo y raza.
- a.
- 3.
Tras la prueba, al paciente se le entregó una solicitud de analítica con la indicación de acudir a la sala de extracciones 2-5 días después de la prueba.
- 4.
El día de la analítica de control, los pacientes acudieron a la sala de extracciones, se realizaron la analítica, se revisaron los resultados en el laboratorio y se valoró la variación en las cifras de creatinina y de FG respecto a la basal para el diagnóstico de NIC. Se estableció el diagnóstico de NIC, por un incremento absoluto en las cifras de creatinina de 0,3 mg/dl o un incremento de esta mayor del 50% sobre la cifra de creatinina basal. En los pacientes revisados en los que se presumía la existencia de NIC se notificó a su médico responsable para un correcto tratamiento y seguimiento.
Los datos se procesaron informáticamente mediante una base de datos en formato Microsoft Excel, que más tarde fue importada para su tratamiento estadístico en el programa Statistical package for the social sciences (SPSS) version 23.
Para la descripción de variables cuantitativas continuas se utilizó la media junto con la desviación estándar. Las variables cualitativas se describieron mediante frecuencias absolutas y frecuencias relativas expresadas en porcentaje.
Se escogieron pruebas estadísticas para muestras de distribución no paramétricas, debido al pequeño tamaño muestral y a la dificultad para asegurar una distribucion normal. Se consideraron diferencias estadísticamente significativas aquellas que presentaron una probabilidad de error menor del 5% (p < 0,05).
Las comparaciones entre variables cuantitativas continuas (media de la creatinina sérica y del FG antes y después de la TC con CIV, así como la media de sus diferencias), de forma pareada, se realizaron mediante la prueba de Wilcoxon para datos pareados. Esta permitió estimar la magnitud de la variación global de los parámetros analíticos de función renal tras la TC con CIV.
Las comparaciones entre variables cuantitativas continuas, entre los grupos independientes (estratificación interna por sexo, diabetes mellitus e hipertensión arterial), se realizó principalmente mediante la prueba de la U de Mann-Whitney. Esta permitió estimar la magnitud de la variación de la media de las diferencias entre las cifras de creatinina sérica y del FG, antes y después del TC con CIV, en relación con la estratificación interna.
Para el análisis de correlación entre variables cuantitativas continuas (edad, dosis y hemoglobina sérica) se utilizó el coeficiente de correlación de Pearson.
ResultadosEn total, aceptaron participar en el estudio 112 pacientes. Posteriormente, 3 fueron excluidos por no haberse realizado el control analítico tras la TC. Las variables demográficas y clínicas que componen esta muestra vienen resumidas en la tabla 1.
Variables demográficas y clínicas de los pacientes
| Edad media | 74,47 ± 8,88 años (rango 47-94) |
| Sexo | 66 hombres (60,60%)43 mujeres (39,40%) |
| Raza | 107 caucásicos (98,20%)1 Árabe (0,90%)1 Afrodescendiente (0,90%) |
| Hipertensión arterial | 53 hipertensos (48,60%)56 no hipertensos (51,40%) |
| Diabetes mellitus | 17 diabéticos (16,60%)92 no diabéticos (84,40%) |
| Indicación | 95 por seguimiento oncológico (87,15%)10 por patología vascular (9,17%)4 por patología urológica (3,67%) |
En relación con los contrastes yodados, Ioversol (Optiray®) 300 mg fue el más utilizado, en el 97,26% de los casos. Solo se administró Iomeprol (Iomeron®) de 300 mg en el 1,82% y de 400 mg en el 0,92% de los casos. Se emplearon volúmenes entre 120 y 125 ml, con una media de 121,90 ± 4,70ml (rango 80-125) y un flujo de 2 ml/s.
Entre los pacientes incluidos, solo se presentó 1 caso de insuficiencia renal aguda (IRA), incidencia del 0,91% con un intervalo de confianza (IC) al 95% de 0,36 al 1,40. Este mostró un aumento de creatinina sérica desde un basal de 1,84 a 3,07 mg/dl y un descenso de las cifras de FG de 35 a 18 ml/min/1,73 m2, 3 días después de la TC. En este paciente no se encontraron factores de riesgo, como la diabetes mellitus o la hipertensión arterial. No obstante, dado que la IRA ocurrió de manera concomitante a una infección aguda, se indicó su ingreso hospitalario. La función renal se normalizó al cabo de una semana (creatinina sérica: 1,57 mg/dl y FG: 43,30 ml/min/1,73 m2). Los demás pacientes no presentaron clínica infecciosa intercurrente, ni ingresos hospitalarios por otra causa.
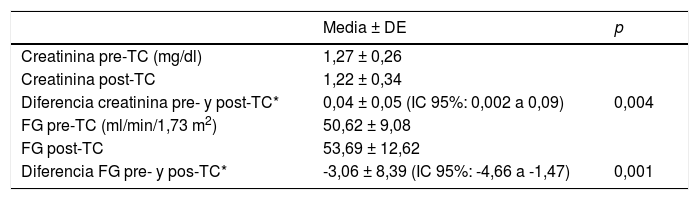
La magnitud de la evolución de los parámetros analíticos de función renal estudiados se muestra en la tabla 2.
Evolución global de parámetros analíticos de función renal
| Media ± DE | p | |
|---|---|---|
| Creatinina pre-TC (mg/dl) | 1,27 ± 0,26 | |
| Creatinina post-TC | 1,22 ± 0,34 | |
| Diferencia creatinina pre- y post-TC* | 0,04 ± 0,05 (IC 95%: 0,002 a 0,09) | 0,004 |
| FG pre-TC (ml/min/1,73 m2) | 50,62 ± 9,08 | |
| FG post-TC | 53,69 ± 12,62 | |
| Diferencia FG pre- y pos-TC* | -3,06 ± 8,39 (IC 95%: -4,66 a -1,47) | 0,001 |
FG: filtrado glomerular; IC: intervalo de confianza; p: significación estadística (prueba de Wilcoxon para datos pareados); TC: tomografía computarizada.
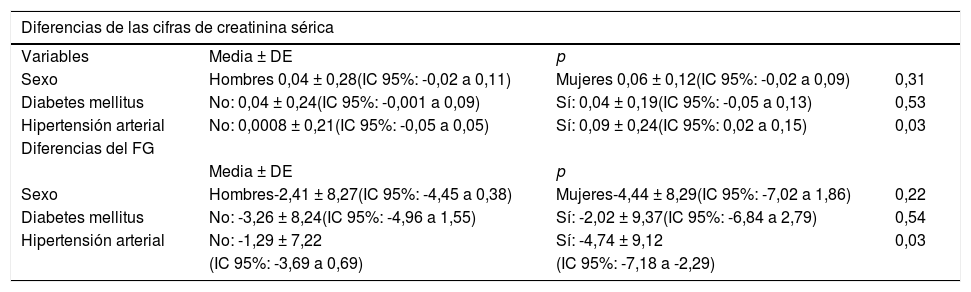
Así mismo, se estimó la variación de la media de las diferencias entre las cifras de creatinina sérica y del FG, antes y después de la TC con CIV, en relación con la estratificación interna por factores de riesgo: sexo, diabetes mellitus e hipertensión arterial (tabla 3). En las variables raza y tipo de contraste, no se halló potencia estadística para demostrar diferencias significativas, debido al pequeño tamaño muestral de los grupos.
Variación de la media de las diferencias de creatinina sérica y del filtrado glomerular, antes y después de la TC con contraste intravenoso, en relación con los factores de riesgo
| Diferencias de las cifras de creatinina sérica | |||
|---|---|---|---|
| Variables | Media ± DE | p | |
| Sexo | Hombres 0,04 ± 0,28(IC 95%: -0,02 a 0,11) | Mujeres 0,06 ± 0,12(IC 95%: -0,02 a 0,09) | 0,31 |
| Diabetes mellitus | No: 0,04 ± 0,24(IC 95%: -0,001 a 0,09) | Sí: 0,04 ± 0,19(IC 95%: -0,05 a 0,13) | 0,53 |
| Hipertensión arterial | No: 0,0008 ± 0,21(IC 95%: -0,05 a 0,05) | Sí: 0,09 ± 0,24(IC 95%: 0,02 a 0,15) | 0,03 |
| Diferencias del FG | |||
| Media ± DE | p | ||
| Sexo | Hombres-2,41 ± 8,27(IC 95%: -4,45 a 0,38) | Mujeres-4,44 ± 8,29(IC 95%: -7,02 a 1,86) | 0,22 |
| Diabetes mellitus | No: -3,26 ± 8,24(IC 95%: -4,96 a 1,55) | Sí: -2,02 ± 9,37(IC 95%: -6,84 a 2,79) | 0,54 |
| Hipertensión arterial | No: -1,29 ± 7,22 | Sí: -4,74 ± 9,12 | 0,03 |
| (IC 95%: -3,69 a 0,69) | (IC 95%: -7,18 a -2,29) | ||
CIV: contraste intravenoso; FG: filtrado glomerular; IC: intervalo de confianza; p: significación estadística (prueba de la U de Mann-Whitney); TC: tomografía computarizada.
Por último, en cuanto a la correlación entre las diferencias de creatinina sérica y del FG, antes y después de la TC con CIV y las variables cuantitativas incluidas: edad, dosis de contraste y hemoglobina sérica, se encontró una correlación con una magnitud despreciable, estadísticamente no significativa (tabla 4).
Correlación entre las diferencias de creatinina sérica y del filtrado glomerular, antes y después de la TC con contraste intravenoso y las variables cuantitativas incluidas
| Variables | Diferencia de las cifras de creatinina sérica | Diferencia del FG | ||
|---|---|---|---|---|
| R | p | R | p | |
| Edad | 0,04 | 0,64 | 0,004 | 0,96 |
| Dosis | 0,14 | 0,12 | -0,17 | 0,06 |
| Hemoglobina sérica | -0,10 | 0,28 | 0,10 | 0,29 |
CIV: contraste intravenoso; FG: filtrado glomerular; p: significación estadística (coeficiente de correlación de Pearson), R: índice de correlación; TC: tomografía computarizada.
La baja incidencia de NIC como causa de IRA iatrogénica es esperable según la literatura científica. Esta oscila entre el 0,6% y el 2,3%, usualmente en pacientes con patología cardiaca concomitante. No obstante, existen estudios que no han encontrado diferencias significativas en la incidencia de NIC o en las cifras de creatinina sérica entre los pacientes que recibieron o no CIV, incluso en aquellos con alto riesgo1,18,19.
De hecho, según nuestros resultados, tras la realización de la TC con CIV existe una mejoría global en los parámetros analíticos de función renal. La media de la diferencia entre la creatinina sérica previa y posterior a la TC con CIV fue de 0,04 (IC: 0,002 a 0,09) y la del FG fue de -3,06 (IC: -4,66 a -1,47), ambos estadísticamente significativos. Este dato también ha sido obtenido por otros autores en sus respectivos estudios20,21. Ferrer et al. encontraron que no solo la realización de una TC con CIV no está asociada al desarrollo de IRA, sino que es un factor protector para su aparición. Una posible explicación a este hecho sería la hidratación que supone la propia administración del volumen de contraste, su efecto diurético osmótico, y la consiguiente hidratación posterior21.
En nuestro estudio, únicamente fue detectado un caso de IRA. Este episodio coincidió con un cuadro infeccioso intercurrente que requirió ingreso hospitalario, con normalización de la función renal al cabo de una semana de tratamiento del foco infeccioso. Dado que no toda variación en la creatinina sérica tras la administración de CIV es dependiente de la misma y que la sepsis puede afectar significativamente a la función renal, podríamos considerar, incluso, que estas circunstancias implican la ausencia real de NIC en nuestra población de estudio. Entre otras condiciones que pueden afectar a la función renal de pacientes hospitalizados están la administración de medicamentos nefrotóxicos, glomerulonefritis, hemólisis, rabdomiólisis, bajo gasto cardiaco, uropatía obstructiva aguda, cirugías, quemaduras y la obstrucción intestinal8.
Es así como Hong et al. analizaron de forma retrospectiva la función renal en 820 pacientes con enfermedad oncológica activa, antes y después de que se les realizara una TC con CIV. Sus resultados concluyeron que la incidencia de NIC era significativa, del 8%, y que se explicaba, en parte, por la mayor fragilidad y los efectos adversos de la medicación de estos pacientes22,23. Fukushima et al. estudiaron de forma retrospectiva a una cohorte de 216 pacientes con un FG menor de 60 ml/min/1,73 m2 a quienes se les realizó una TC con CIV. Entre las variables analizadas se encontraban la enfermedad renal crónica, la diabetes mellitus, el volumen de CIV administrado, la hidratación previa, una fracción de eyección del ventrículo izquierdo (FEVI) menor del 60% y la necesidad de ingreso en una unidad de críticos (UCI). Únicamente se encontró una asociación significativa entre el desarrollo de NIC y el ingreso a una UCI o una FEVI menor del 60%24.
Por otro lado, entre las condiciones crónicas que afectan a los pacientes estudiados de forma ambulatoria destaca la diabetes mellitus, que ha sido considerada clásicamente un factor de riesgo de desarrollo de NIC25. En nuestro trabajo, los pacientes con antecedentes de diabetes mellitus no presentaron variaciones significativas en sus cifras de creatinina sérica o filtrado glomerular tras la realización de la TC con CIV, lo que va en consonancia con otros estudios recientes en los que no encontraron asociación significativa22,24.
La hipertensión arterial ha sido considerada un factor de riesgo para el desarrollo de NIC independiente de la diabetes mellitus. Se han encontrado diferencias significativas en cuanto a la incidencia de NIC en pacientes hipertensos respecto a los no hipertensos (41,6% vs. 14,7%, p = 0,044)23. En nuestro estudio, si bien existen diferencias significativas entre la media de las diferencias de la creatinina y del FG, en pacientes hipertensos respecto a los no hipertensos, los primeros mostraron una mejoría en los indicadores de función renal analizados tras una TC con administración de CIV.
La administración de agentes de alta osmolaridad, un volumen de contraste mayor de 350 ml o más de 4 ml/kg, o repetir la administración de CIV antes de las 72 horas tras la administración de CIV se asocian a un incremento en el riesgo de NIC26. El uso de moléculas no iónicas con baja osmolaridad que tienen un mejor perfil nefrotóxico como el Ioversol (Optiray®), y el uso de un volumen de contraste menor de 140ml en todos los casos, es un argumento más que justifica la baja incidencia de NIC en nuestra muestra26,27.
La expansión de volumen (oral o intravenosa), previa a la administración de contraste radiológico y/o el empleo de N-acetilcisteína han sido las recomendaciones tradicionales para disminuir el riesgo de desarrollo de NIC28,29. La principal acción preventiva consiste en la expansión de volumen con soluciones isotónicas previa a la administración de CIVa, fundamentalmente en los procedimientos intervencionistas. Se cree que este efecto es debido a un incremento en el flujo sanguíneo renal que induce aumento en la diuresis, dilución del CIVa en los túbulos renales, supresión del eje renina-angiotensina-aldosterona y menor inhibición de la producción de vasodilatadores endógenos13,28–30. La tasa de infusión y el volumen ideal son desconocidos. Sin embargo, las guías actuales de la ACR recomiendan el uso de solución salina isotónica a una tasa de infusión de 100 ml por hora durante 6 a 12 horas antes y de 4 a 12 horas después de una angiografía3. La hidratación oral también se ha utilizado, pero con menor efectividad demostrada13,30,31. En nuestro estudio, observamos una media de la diferencia entre el FG previo y el posterior a la administración de CIV negativa, de -3,06 (IC: -4,66 a -1,47), lo que denota una mejoría de la función renal. Esta mejoría podría explicarse, no solo por la hidratación que supone la propia administración del volumen de contraste y su efecto diurético, sino también por la hidratación oral recibida como medida preventiva. Recientemente, en un estudio prospectivo, aleatorizado y de no inferioridad, se comparó la incidencia de NIC tras la administración de CIV, entre los pacientes con un FG entre 30 y 60 ml/min/1,73 m2 que no recibieron hidratación intravenosa y los que sí la recibieron. La diferencia en la incidencia de NIC entre estos dos grupos fue de -0,10% (IC 95% -2,25 a 2,06; p = 0,47), la cual no superó el límite de no inferioridad de 2,1%. Por lo tanto, el no administrar hidratación intravenosa fue no inferior en la prevención de NIC. Adicionalmente, la no utilización de esta profilaxis redujo costos y evitó complicaciones asociadas como la insuficiencia cardíaca congestiva, la hiponatremia y las arritmias cardiacas, presentes hasta en el 5,5% de los pacientes en este estudio32.
Por otro lado, el uso de N-acetilcisteína para reducir la incidencia de NIC ha sido controvertido. Algunos estudios y metanálisis muestran resultados contradictorios acerca de si este agente reduce o no la incidencia de IRA33–35. Existe evidencia que indica que la N-acetilcisteína reduce la creatinina sérica en sujetos sanos sin alterar las cifras de cistatina C, que es el mejor marcador del FG. Esto eleva la sospecha de que la N-acetilcisteína simplemente reduce las cifras de creatinina sin una prevención real de la IRA. Actualmente, no existe suficiente evidencia de su eficacia y no se recomienda como sustituto de una adecuada selección de pacientes y expansión de volumen33. En un estudio aleatorizado reciente se comparó el uso de bicarbonato sódico intravenoso al 1,26%, cloruro de sodio intravenoso al 0,9% con N-acetilcisteína oral 1.200mg dos veces al día durante 5 días o placebo, en pacientes a los que se les iba a realizar una angiografía y tenían alto riesgo de complicaciones renales (pacientes con diabetes mellitus o enfermedad renal crónica en estadio III y IV). En el grupo de la N-acetilcisteína, 114 de 2.495 (4,6%) pacientes presentaron necesidad de diálisis, fallecieron o desarrollaron NIC posterior al procedimiento, con un riesgo relativo de 1,02 (IC 95%: 0,78 a 1,33; p = 0,88). No hallaron diferencias significativas entre los diferentes grupos respecto a la disminución en el desarrollo de NIC36.
Desde nuestro conocimiento, existen pocos estudios prospectivos que hayan utilizado la expansión de volumen con hidratación oral y N-acetilcisteína como acción preventiva en pacientes con alto riesgo de desarrollar NIC, población para la cual han sido escritas las guías. Así mismo, la mayoría de los estudios se han realizado con una población con condiciones específicas, mientras que el nuestro está compuesto por una población estudiada de forma ambulatoria que requiere de controles frecuentes y por lo tanto va a necesitar múltiples TC con administracion de CIV en el seguimiento de su patologia de base. Sin embargo, dado que se realizo un estudio observacional siguiendo los protocolos de nuestra institucion, con la limitación de no tener un grupo control, no es posible conocer la incidencia de NIC en pacientes estudiados de forma ambulatoria con alto riesgo de desarrollarla sin la administracion de la premedicacion.
En conclusión, nuestro estudio apoya que la incidencia de NIC en pacientes estudiados de forma ambulatoria, de alto riesgo, con una FG entre 30 ml/min/1,73 m2 y 60 ml/min/1,73 m2, es baja. En nuestra muestra de pacientes, a los que se les administró la mínima dosis de CIV yodado no iónico de baja osmolaridad, hidratación oral y N-acetilcisteína, se observó una mejoría global de los parámetros analíticos de la función renal. No obstante, pretendemos realizar un estudio prospectivo, aleatorizado y controlado con las mismas características y mayor tamaño muestral, para comparar la incidencia en pacientes no premedicados.
Autoría- 1.
Responsable de la integridad del estudio: ABL, JIR, FGM, BM, RGR y CMH.
- 2.
Concepción del estudio: ABL, JIR, RGR y CMH.
- 3.
Diseño del estudio: ABL, JIR, RGR, JDS y CMH.
- 4.
Obtención de los datos: ABL, JIR, FGM y BM.
- 5.
Análisis e interpretación de los datos: ABL, JIR, FGM, JDS y RGR.
- 6.
Tratamiento estadístico: RGR.
- 7.
Búsqueda bibliográfica: ABL, JIR, FGM, BM y RGR.
- 8.
Redacción del trabajo: ABL, JIR y FGM.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: RGR, JDS y CMH.
- 10.
Aprobación de la versión final: ABL JIR, FGM, BM, RGR, JDS y CMH.
Los autores declaran no tener ningún conflicto de intereses. El estudio fue aprobado por el Comité Ético de Investigación Clínica de Segovia.
Al personal de enfermería por su dedicación en la toma de constantes y antecedentes personales del paciente, y al personal de laboratorio por el análisis de las muestras y la rapidez en el contacto con el médico responsable del paciente en los casos que sufrieron alteraciones analíticas.