En este artículo se exponen las diferentes técnicas básicas de intervencionismo no vascular en el abdomen con las cuales todo radiólogo general debería estar familiarizado. Para ello se describen las indicaciones y las vías de abordaje de los diferentes procedimientos: punciones, biopsias, drenajes de colecciones, colecistostomías y nefrostomías. Además, se valoran las ventajas y los inconvenientes de las diferentes técnicas de imagen para el guiado: ecografía, tomografía computarizada y fluoroscopia; así como las posibles complicaciones de los procedimientos descritos. Además, se pone de manifiesto la importancia del seguimiento clínico del paciente y de los cuidados de los catéteres.
This article describes the different basic nonvascular interventional techniques in the abdomen that all general radiologists should be familiar with. It explains the indications and approaches for the different procedures (punctures, biopsies, drainage of collections, cholecystostomies, and nephrostomies). It also discusses the advantages and disadvantages of the different imaging techniques that can be used to guide these procedures (ultrasound, CT, and fluoroscopy) as well as the possible complications that can develop from each procedure. Finally, it shows the importance of following up patients clinically and of taking care of catheters.
La radiología intervencionista comprende una amplia variedad de procedimientos diagnósticos y terapéuticos mínimamente invasivos guiados por la imagen. En este capítulo se exponen técnicas intervencionistas no vasculares guiadas por métodos de imagen, como son la toma de muestras para diagnóstico (anatomía patológica, microbiología, bioquímica), la colocación de drenajes, la nefrostomía y la colecistostomía, que podrían ser realizadas por radiólogos generales. Otros procedimientos intervencionistas no vasculares, como son los tratamientos de ablación de tumores, quedan fuera del ámbito de este artículo.
Estas técnicas comparten aspectos comunes, como rutas de acceso y posibles contraindicaciones y complicaciones en función de la localización de las lesiones.
Evaluación antes del procedimientoIndicaciónAntes de realizar cualquiera de los procedimientos que aquí se describen hay que valorar su correcta indicación, considerando que el riesgo del mismo sea asumible en función de la información o del resultado terapéutico que esperamos obtener1. Para ello se revisan detalladamente la historia clínica del paciente y las pruebas de imagen previas de las que se disponga (ecografía, tomografía computarizada [TC], resonancia magnética [RM] o tomografía por emisión de positrones [PET-TC]). Esto permite determinar la ruta más segura de acceso y la técnica de imagen con la cual guiarse1, dependiendo de la posible naturaleza de la lesión, su localización y las relaciones con otras estructuras. Para los procedimientos diagnósticos se valora si es posible tipificar la lesión basándose en la imagen, sin necesidad de biopsia, y cuál es la lesión más favorable para la punción en caso de que sean múltiples. Se delimitan las zonas más rentables para obtener la muestra dentro de la propia lesión, pudiendo diferenciar áreas necróticas, y en el caso de la RM-difusión se determinan las que presentan mayor densidad celular2. Con la PET-TC se toman las muestras de las zonas con mayor actividad metabólica, minimizando el error de biopsiar áreas con necrosis o fibrosis, que muestran menor o nula captación de 18-fluorodesoxiglucosa (FDG) y que son frecuentes en neoplasias de gran tamaño. No obstante, hay que tener en cuenta que la captación no es específica de las neoplasias y que algunas de estas muestran escaso realce con FDG3.
Estado de coagulaciónLa complicación más temida es la hemorragia, por lo que hay que comprobar el estado de coagulación del paciente y los posibles factores de riesgo, como insuficiencia renal o enfermedad neoplásica4. Hay controversia en la literatura, y muchos centros tienen sus propios protocolos basados en su experiencia con las complicaciones5. La diversidad de procedimientos contribuye a la falta de uniformidad en el manejo de la coagulación, y hay que tener en cuenta el órgano diana, el calibre del dispositivo y la comorbilidad del paciente. En general, se considera que las biopsias de órganos sólidos abdominales, el drenaje de colecciones y la colecistostomía tienen riesgo moderado de sangrado. La biopsia renal y la nefrostomía se consideran procedimientos con mayor riesgo6.
Los límites de corte propuestos serían: International Normalized Ratio (INR) <1,6, tiempo de tromboplastina parcial activada (TTPA) <25-35 segundos, y plaquetas>50.000/μl. El tratamiento anticoagulante o antiagregante debe suspenderse durante un tiempo variable en función del fármaco en concreto y del riesgo de sangrado del procedimiento. En situaciones urgentes o cuando la suspensión del tratamiento pueda tener consecuencias graves para el paciente (coronariopatía, accidente cerebrovascular, arteriopatía periférica) pueden excederse dichos límites, asumiendo cierto aumento del riesgo de sangrado, de acuerdo con el paciente y el médico de referencia1,5,7,8. El ácido acetilsalicílico sólo necesita ser retirado en intervenciones sobre el riñón6,8. Atwell et al.9 no encontraron un aumento significativo del índice de sangrado en una serie de 15.181 biopsias percutáneas de distintos órganos.
Se aceptan los resultados obtenidos hasta 3 meses antes5, salvo en pacientes en tratamiento anticoagulante o antiagregante o con riesgo de diátesis hemorrágica (alteraciones conocidas de la coagulación, tratamiento quimioterápico, hepatopatía, nefropatía, síndromes de malabsorción, malnutrición).
Las alteraciones del INR o la trombocitopenia pueden corregirse con transfusión de plasma o de plaquetas, respectivamente, pero el uso de transfusiones no está exento de complicaciones, por lo que debe ser individualizado1,4,7.
La hipertensión arterial es otro factor de riesgo de hemorragia, fundamentalmente en el intervencionismo sobre el riñón, pero no tanto cuando se actúa sobre otros órganos10,11.
Consentimiento informadoEs necesario que el paciente otorgue y firme su consentimiento tras ser debidamente informado de manera individualizada, precisa y comprensible, sobre la indicación, los beneficios que se esperan obtener, la técnica y las posibles alternativas y complicaciones, y aclaradas las posibles dudas que plantee. La información debería ser ofrecida por el médico que realizará la prueba5,12. La Sección de Radiología Vascular e Intervencionista (SERVEI), englobada en la Sociedad Española de Radiología Médica (SERAM), proporciona modelos de estos consentimientos para diversos procedimientos, que están disponibles en su página web (www.seram.es)13.
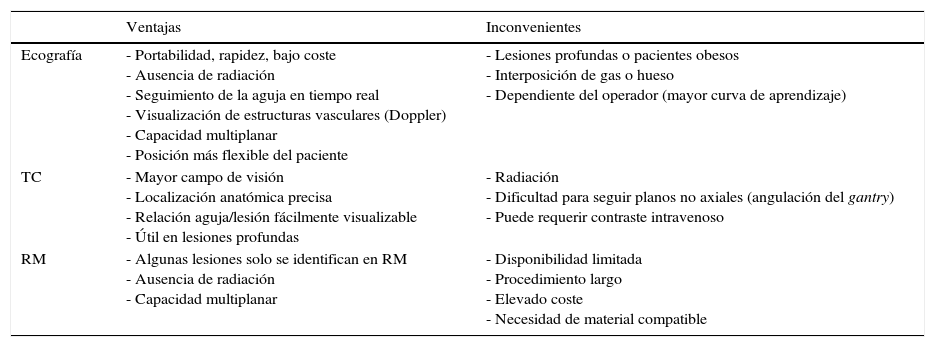
Técnicas de imagenNo hay una única técnica que sea la idónea de forma generalizada. Las más empleadas son la ecografía y la TC; en menor medida la fluoroscopia, salvo para la nefrostomía; y excepcionalmente la RM, que tiene como inconvenientes su alto coste, el largo tiempo de exploración y la necesidad de material compatible1. Debe seleccionarse el método adecuado para cada caso. Si la lesión es identificable y accesible tanto por ecografía como por TC, la elección depende de la preferencia del radiólogo y de la disponibilidad de la técnica. Las principales ventajas y desventajas de estas pruebas se recogen en la tabla 1.
- •
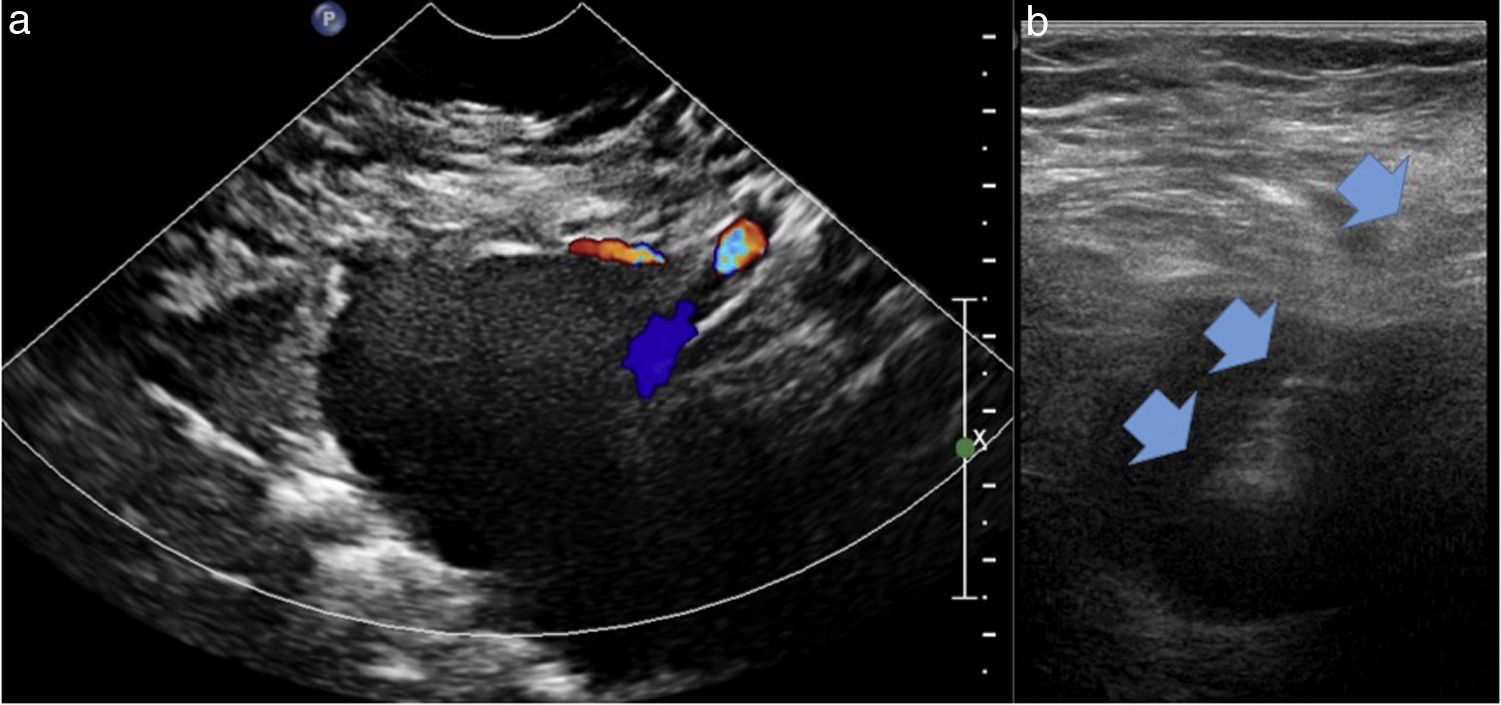
Ecografía: es el método más comúnmente utilizado1,14 y permite incluso realizar el procedimiento a pie de cama del paciente. La posibilidad de ver la posición de la aguja en tiempo real es especialmente útil en lesiones que cambian de posición con los movimientos respiratorios, o que son de pequeño tamaño o adyacentes a estructuras críticas, como vasos sanguíneos importantes, fácilmente identificables aplicando Doppler color (fig. 1). La obtención de imágenes en cualquier plano permite seguir rutas de acceso oblicuas desde la piel a la lesión, evitando estructuras que no deben o no pueden atravesarse. Además, la sonda ecográfica permite ejercer compresión, disminuyendo la distancia entre la lesión y la piel, y desplazando posibles estructuras interpuestas, como las asas intestinales15. Los procedimientos guiados por ecografía pueden hacerse con técnica de manos libres o bajo guía adaptada al transductor ecográfico, que permite dirigir la aguja a la lesión a partir de un ángulo preseleccionado respecto del transductor (fig. 2). El método de manos libres tiene la ventaja de una mayor flexibilidad en el punto de entrada, permite hacer ligeras rectificaciones en el trayecto durante la punción y es más económico, pero es dependiente del operador14. A veces existen factores técnicos que pueden impedir su éxito y es necesario recurrir a la guía con TC. El obstáculo principal es la mala ventana acústica, influida por la dificultad del paciente para colaborar, la interposición de hueso o gas, la localización profunda o la obesidad, o la presencia de gas dentro de la propia lesión16.
Figura 2.Biopsia de lesión hepática con ultrasonido. a) Lesión en segmento IV hepático (flecha curva). Las líneas de puntos corresponden a la guía adaptada al transductor, haciendo que la lesión coincida con una de ellas. b) las flechas indican la aguja de punción alineada en el trayecto marcado por la guía.
(0.12MB). - •
TC: muestra fácilmente la relación espacial entre la punta de la aguja y la lesión. Permite visualizar lesiones profundas y en pacientes obesos, y su relación con otros órganos o vasos. Es más complicado seguir rutas no axiales, aunque ocasionalmente puede resolverse con angulación del gantry16. Uno de los inconvenientes de la TC es la radiación, cuya dosis puede reducirse acortando la extensión creanocaudal y disminuyendo el kilovoltaje y el miliamperaje. Si se asocia fluoroscopia, muy útil cuando se trata de lesiones que cambian de posición, es preferible hacer uso intermitente de ella en lugar de continuo17,18. Se obtiene una hélice sin contraste intravenoso limitada a la región donde se encuentra la lesión colocando previamente marcadores radioopacos sobre la piel del paciente que coincidan con la zona de interés. Esto, junto con la luz láser del gantry, permite trazar las coordenadas que definan la ruta de acceso más corta y segura. Para la visualización de algunas lesiones puede ser necesaria la administración de contraste intravenoso. Cuando se emplea como guía para drenaje de colecciones, sobre todo en la pelvis, la administración de contraste oral o rectal ayuda a diferenciar asas intestinales de posibles abscesos. Actualmente existen sistemas de fusión de imágenes y navegación que permiten guiar la punción, con un método de imagen diferente de aquel en el que se detecta la lesión, mediante la fusión de imágenes de varias técnicas en tiempo real durante el procedimiento. Su uso está poco extendido y serían especialmente útiles en lesiones que sólo se identifican en ciertas modalidades o fases (PET-TC, RM, fase arterial de la TC) o que son de difícil acceso15,19.
Métodos de imagen
| Ventajas | Inconvenientes | |
|---|---|---|
| Ecografía | - Portabilidad, rapidez, bajo coste - Ausencia de radiación - Seguimiento de la aguja en tiempo real - Visualización de estructuras vasculares (Doppler) - Capacidad multiplanar - Posición más flexible del paciente | - Lesiones profundas o pacientes obesos - Interposición de gas o hueso - Dependiente del operador (mayor curva de aprendizaje) |
| TC | - Mayor campo de visión - Localización anatómica precisa - Relación aguja/lesión fácilmente visualizable - Útil en lesiones profundas | - Radiación - Dificultad para seguir planos no axiales (angulación del gantry) - Puede requerir contraste intravenoso |
| RM | - Algunas lesiones solo se identifican en RM - Ausencia de radiación - Capacidad multiplanar | - Disponibilidad limitada - Procedimiento largo - Elevado coste - Necesidad de material compatible |
El posicionamiento correcto influye en el éxito del procedimiento. Se basa en la localización y el trayecto previsto para acceder a la lesión. Puede ser en decúbito supino, prono, lateral u oblicuo. En la región superior del abdomen, siempre que sea posible se prefiere el abordaje subcostal para disminuir el riesgo de neumotórax o de lesión de vasos intercostales.
Asepsia, analgesia, anestesia y sedaciónLa mayoría de los procedimientos pueden realizarse empleando únicamente anestesia local, aunque también es frecuente que se emplee la sedación consciente1,5,20.
Una vez elegido el punto de entrada, se limpia la piel con clorhexidina o povidona iodada y se colocan paños estériles alrededor. En el caso de la ecografía, el transductor puede limpiarse con la misma solución o introducirse en una funda estéril.
La lidocaína, a una concentración del 1% o 2%, es el anestésico local usado con más frecuencia, aunque existen otros fármacos (mepivacaína, bupivacaína...). Su efecto anestésico comienza en 1-2 minutos y se prolonga durante 30-60 minutos. El volumen de la dosis máxima recomendada en adultos es de 30ml o 15ml para las concentraciones del 1% y el 2%, respectivamente. Existen otros fámacos semejantes, pero cuyas dosis, tiempo de respuesta y duración son diferentes21.
La lidocaína se inyecta produciendo un habón en la piel y profundizando hasta el borde del órgano diana. Durante este proceso hay que aspirar con la jeringuilla según avanzamos para descartar la inyección intravascular inadvertida del anestésico5. Si se ha de atravesar el peritoneo, se deposita parte del fármaco en su superficie, ya que el dolor al pasar a su través podría dar lugar a una reacción vasovagal que habría que tratar con atropina5.
La inyección del anestésico origina dolor local, que puede atenuarse con su calentamiento e inyección lenta, entre otros métodos. La alcalinización con bicarbonato sódico en una proporción 1:10 (bicarbonato sódico:lidocaína) también puede aminorar el dolor al disminuir la acidez del producto. Si se emplea bupivacaína, la proporción varía (1:35) para evitar que el compuesto precipite21.
Rara vez aparecen efectos adversos sistémicos con los anestésicos locales, y ocurren en caso de dosis excesivas o de inyección intravascular5,21.
Los procedimientos dolorosos, o en pacientes poco colaboradores, se realizan bajo sedación consciente, con ayuno previo de 6 horas. Para ello se emplean:
- •
Benzodiacepinas (midazolam, lorazepam, diazepam), que poseen propiedades ansiolíticas y amnésicas. La más utilizada es el midazolam intravenoso o intramuscular, por su rapidez de acción y su vida media corta (1-4 horas).
- •
Narcóticos (opiáceos: fentanilo, meperidina, morfina), que son potentes analgésicos. El fentanilo es un opiáceo sintético de acción rápida, con menos efectos secundarios que la morfina y 50-100 veces más potente. Una pauta sería la inyección intravenosa de 25-100μg de fentanilo combinada con 1-2mg de midazolam20. Es necesario monitorizar el ritmo cardiaco, la presión arterial y la saturación de oxígeno21.
En algunas situaciones con adultos poco colaboradores o procedimientos complejos, y casi siempre en niños, se requiere sedación profunda o anestesia general con la colaboración del servicio de anestesia.
Punción percutánea guiada por imagenConsiste en la obtención de material de un órgano o de una lesión concreta para su análisis histológico, citológico, microbiológico o bioquímico, mediante la introducción de una aguja en su interior con el apoyo de una técnica de imagen radiológica, con finalidad diagnóstica22. Es un método seguro de obtener una muestra para la valoración de múltiples procesos patológicos, menos invasivo que la biopsia quirúrgica, con alta rentabilidad diagnóstica y bajo índice de complicaciones, por lo que se ha convertido en la alternativa inicial para la mayoría de las biopsias1,22. Desempeña un papel cada vez más importante en la evaluación de la respuesta a los tratamientos oncológicos con terapias dirigidas23. Incluye dos técnicas: la punción-aspiración con aguja fina (PAAF) y la biopsia con aguja gruesa (BAG).
Las indicaciones y contraindicaciones generales se muestran en la tabla 2.
Indicaciones y contraindicaciones generales
| Indicaciones | Contraindicaciones |
|---|---|
| - Diagnóstico de enfermedades difusas o lesiones focales del órgano - Estadiaje de neoplasia conocida - Análisis genético y de biomarcadores - Monitorizar respuesta al tratamiento - Diagnóstico y posible tratamiento de una infección | - No visualización de la lesión o falta de acceso seguro - La información esperable no es relevante o puede obtenerse por medios menos agresivos - Coagulopatía incorregible - Afectación respiratoria grave o inestabilidad hemodinámica - Paciente no colaborador (valorar anestesia) |
La selección de la aguja depende del tipo de lesión y del órgano diana, del riesgo estimado de sangrado y de la técnica que se vaya a emplear, así como de las preferencias del radiólogo. Puede ser una aguja de pequeño calibre (20-25 G) en la PAAF, para obtener un aspirado celular para análisis citológico, o líquido para estudio microbiológico o bioquímico. Las agujas de mayor calibre (14-18 G) se utilizan para la BAG y permiten obtener cilindros tisulares para análisis histológico14. Pueden ser de disparo semiautomático o automático. La diferencia entre ambas es que en la semiautomática hay que situar la punta de la aguja dentro de la lesión, pues en el disparo sólo avanza la cánula externa cortante, y en la automática la punta se sitúa en el borde de la lesión según el avance previsto del estilete. tabla 3
Características de la punción-aspiración con aguja fina (PAAF) y de la biopsia con aguja gruesa (BAG)
| PAAF | BAG |
|---|---|
| - Aguja 20-25 G - Aspirado celular o de fluido - Bloque celular - Menos traumática - Mayor numero de «insuficiente» - Mayor dependencia del explorador - Muestras en seco, alcohol o medio líquido - Rapidez: citólogo presencial | - Aguja 14-18 G - Cilindro tisular - Mayor muestra: inmunohistoquímica, diagnóstico molecular - Mayor rentabilidad diagnóstica - Muestras en formol o en fresco |
A su vez pueden ser:
- •
Agujas de corte lateral o trucut: constan de una cánula externa con un estilete central que lleva una cámara en su porción distal. El estilete penetra en la lesión y, posteriormente, la cánula externa avanza cortando el tejido y dejando un fragmento en la cámara de la aguja central.
- •
Agujas de corte frontal: el estilete central no tiene cámara, sino que la cánula externa avanza dejando atrás dicho estilete y cortando un fragmento de tejido que queda en su interior. Permiten obtener especímenes más gruesos que las de corte lateral con diámetros de aguja similares14.
Las agujas gruesas proporcionan muestras de mayor tamaño, con preservación de la arquitectura tisular, que puede ser importante para realizar técnicas inmunohistoquímicas y determinar el subtipo en algunos tumores. Las ventajas de la aguja fina son su menor potencial hemorrágico y que se acorta el tiempo para el análisis inicial de la muestra.
El rendimiento diagnóstico de ambas técnicas depende del tipo órgano y del tamaño, localización y naturaleza de la lesión22. Puede aumentar cuando se combinan ambas técnicas, ya que la citología tiene altas sensibilidad y especificidad, pero la muestra puede ser insuficiente, aunque no hay acuerdo unánime24,25. Idealmente debería contarse con la presencia de un citopatólogo para disminuir el porcentaje de muestras citológicas inadecuadas25.
Técnica- •
Toma de la muestra:
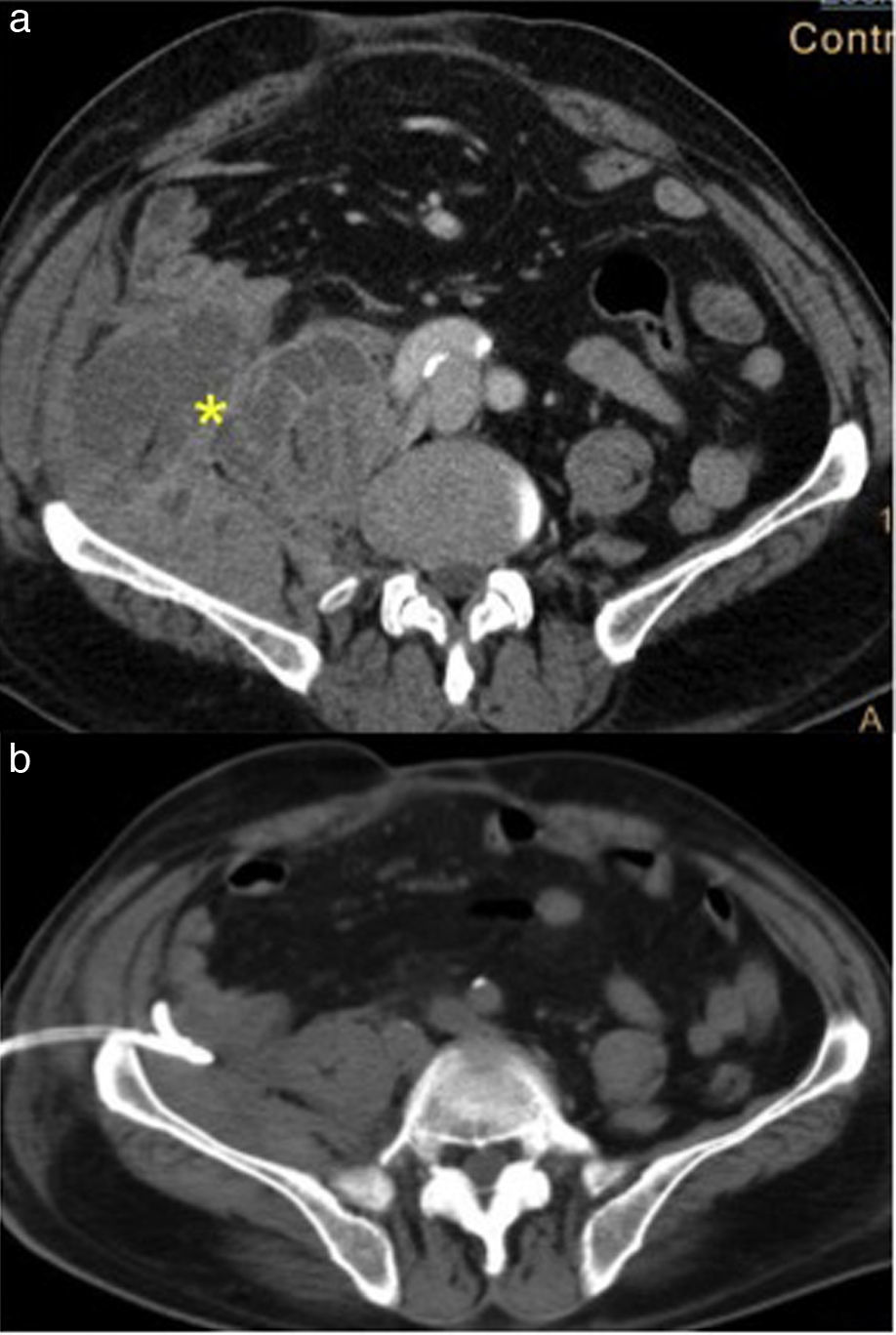
Siempre que sea posible, se elige la ruta más corta y directa, evitando incidir sobre órganos no implicados, aunque cuando no hay alternativa se puede acceder a la lesión pasando por otros órganos, tanto sólidos como por el tubo digestivo, sobre todo el estómago para acceder al páncreas. El colon debe respetarse. También puede ser inevitable atravesar la pleura en lesiones de la cúpula hepática, el polo superior renal o las glándulas suprarrenales15. A través del hígado se puede acceder a lesiones en la glándula suprarrenal derecha, el polo superior renal y la cabeza del páncreas.
En caso de requerir varias muestras es deseable la técnica coaxial para minimizar el número de punciones capsulares del órgano en cuestión. Además, ofrece la posibilidad de embolizar el trayecto de punción con esponja de gelatina o dejar la aguja un tiempo para que coagule el tracto, y disminuir potencialmente el riesgo de siembra tumoral. No obstante, aunque con la técnica coaxial el índice de complicaciones es ligeramente menor, la diferencia no es significativa26. La aguja coaxial se avanza hasta el borde de la lesión y a continuación se retira el estilete interno y se introduce la aguja de biopsia. El proceso se repite hasta la obtención de una muestra que se considere adecuada.
En lesiones grandes es preferible tomar la muestra tangencialmente de la periferia, ya que la necrosis es más frecuente en el centro, dando lugar a material no viable5.
En la PAAF, cuando la aguja alcanza el interior de la lesión se retira el mandril y la muestra se obtiene con un movimiento de vaivén, imprimiendo simultáneamente cierto grado de rotación. El proceso se detiene cuando se aprecia la muestra o aparece sangre en el cono de la aguja. Puede hacerse con o sin aspiración, por capilaridad. La aspiración puede ser manual o mediante pistola. Permite obtener la muestra más rápido, y a veces es imprescindible, pero también introduce más sangre, lo que puede dificultar o imposibilitar el análisis citológico1,5. La aspiración debe detenerse antes de retirar la aguja para evitar la contaminación del material.
- •
Manejo de la muestra:
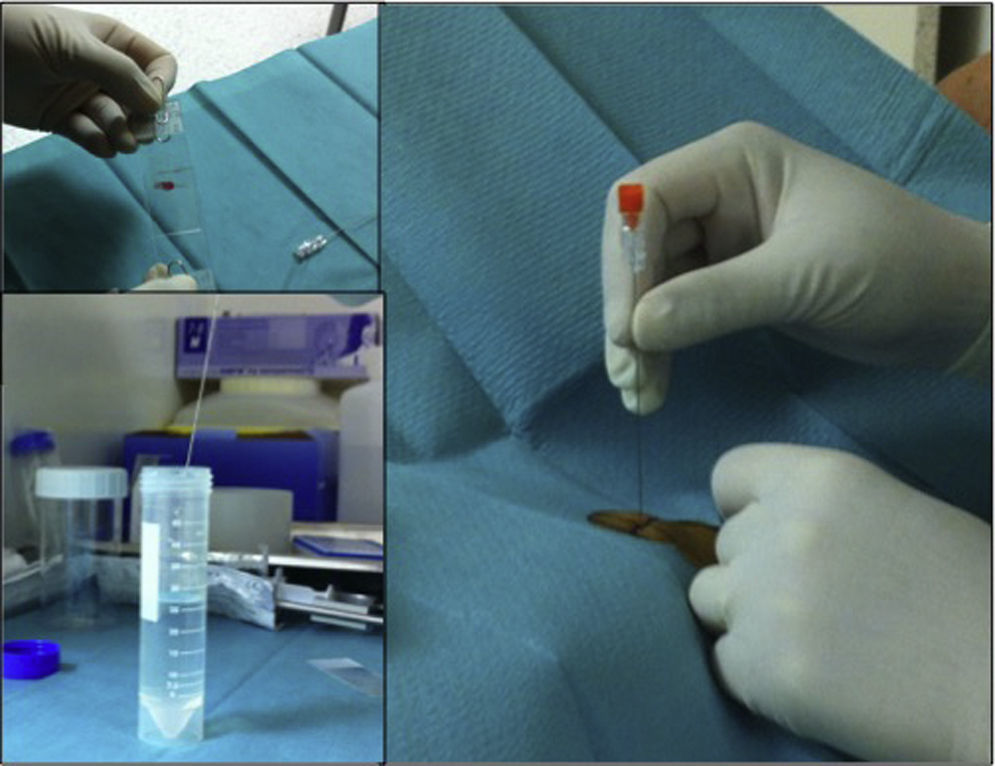
Las muestras obtenidas por PAAF se extienden inmediatamente en portas de cristal y se envían, tanto en fresco como fijadas en alcohol o introducidas en solución salina fisiológica. Lo ideal es consensuarlo con los citólogos a quienes se les van a entregar. Tras la extensión en el porta puede lavarse la aguja para aprovechar cualquier residuo en su interior mediante el estudio de citología en medio líquido. Puede obtenerse un coágulo que se procesa en formol, como una microbiopsia para estudio histológico (bloque celular) (fig. 3), aumentando el rendimiento diagnóstico27.
Los cilindros tisulares se introducen en formol al 10% o en solución salina, según preferencia del patólogo. En nuestro centro se envían en formol, salvo las muestras obtenidas para caracterizar la enfermedad difusa del parénquima renal, que se mandan en fresco. Hay que intentar conseguir al menos dos o tres buenos cilindros ante la necesidad actual de realizar una mayor cantidad de pruebas, como inmunohistoquímica y diagnóstico molecular, debido a los avances en los tratamientos oncológicos que permiten ofrecer terapias específicamente dirigidas a determinados subtipos histológicos de tumores1,5,28.
ComplicacionesEn general se trata de procedimientos bastante seguros, con pocas complicaciones mayores si la técnica es adecuada.
Las complicaciones pueden ser de dos tipos: genéricas y específicas de órgano. Estas últimas se asocian más frecuentemente a la intervención sobre un órgano concreto. Las complicaciones genéricas son comunes a todas las biopsias y la principal es el sangrado, aunque también la infección, la perforación de víscera hueca y la lesión no intencionada de algún órgano22.
- •
Hemorragia: se considera grave cuando requiere transfusión de sangre o algún tipo de intervención (embolización, cirugía). Es infrecuente, con una incidencia del 0,1-8,3%. El riesgo aumenta con el calibre de la aguja y la vascularización de la lesión y el órgano donde asienta22, así como en pacientes con pocas plaquetas o un INR más alto9. Aunque la mayoría ocurren durante el procedimiento o en las primeras horas posteriores, también puede aparecer de forma tardía9,29. Hay que comprimir adecuadamente la zona de punción y conviene que el paciente permanezca en reposo, si es posible acostado sobre el punto de punción, y vigilarlo directamente durante al menos la primera media hora tras el procedimiento, con acceso rápido a técnicas de imagen que permitan descartar complicaciones agudas14.
- •
Diseminación tumoral: la siembra en el trayecto de la aguja es excepcional, aunque continúa siendo motivo de preocupación en el caso del hepatocarcinoma y no tanto en el carcinoma renal1. El riesgo de siembra se reduce evitando atravesar compartimentos anatómicos intactos.
- •
Neumotórax: en procedimientos sobre el abdomen superior.
- •
Lesión de órganos sólidos: puede ser del órgano diana o de otro cercano que se encuentre en el trayecto de la aguja.
- •
Crisis hipertensiva: antes de biopsiar una lesión en la glándula suprarrenal hay que excluir la posibilidad de feocromocitoma mediante pruebas bioquímicas, como puede ser la determinación de catecolaminas y metanefrinas fraccionadas en orina de 24 horas en caso de baja sospecha clínica y radiológica. Si la sospecha es alta, se valoran las metanefrinas fraccionadas en plasma30.
- •
Pancreatitis: por punción inadvertida de parénquima pancreático sano.
- •
Infección y perforación de víscera hueca: muy raras.
Aunque no todos los autores emplean la misma pauta1,5,20, el paciente debe permanecer bajo vigilancia clínica, que puede ser en régimen de hospital de día, al menos durante 2 horas tras una biopsia hepática y 6 horas si ha sido una biopsia renal. Posteriormente se le da el alta, siempre que el paciente disponga de un acompañante que pueda llevarlo al hospital en caso de deterioro hasta el día siguiente. Si aparecen síntomas o signos que sugieran una complicación, como aumento de dolor, mareo o hipotensión, se realiza una ecografía o una TC20.
Consideraciones específicas por órganos- •
Hígado:
Es el órgano sobre el que más biopsias se practican (fig. 4) y la guía suele ser ecográfica. La biopsia hepática puede realizarse aleatoriamente en el órgano para la caracterización de una hepatopatía difusa, o de manera dirigida en una lesión ocupante de espacio. El rendimiento diagnóstico varía entre el 79% y el 99%5,20. Las lesiones situadas cerca de la cúpula hepática añaden dificultades técnicas para su visualización y abordaje. La colaboración del paciente con inspiración profunda y apnea, y la posición en decúbito lateral, pueden ayudar a solventar estas dificultades1.
Si existen múltiples lesiones con similares características, se elegirá la que presente mejor visualización y más fácil acceso, siempre intentando atravesar una porción de parénquima normal antes de alcanzar la lesión, preferiblemente 3-4cm para minimizar el riesgo de sangrado y de siembra tumoral (1,5,20).
El índice de complicaciones es bajo (0,5% en alguna serie)9.
La siembra neoplásica en el trayecto cobra especial importancia en el caso del hepatocarcinoma, en el cual la incidencia de siembra posbiopsia varía entre el 0% y el 11% en diferentes series, con una media del 2,29%31. Por tanto, en el paciente cirrótico con lesiones que cumplen los criterios diagnósticos de hepatocarcinoma por TC o RM no debería realizarse biopsia1.
La presencia de ascitis no contraindica la biopsia hepática, aunque añade dificultad a la técnica. Hay estudios que no muestran diferencias significativas en el índice de complicaciones entre pacientes con o sin ascitis32. Para la valoración de la enfermedad hepática difusa, al igual que cuando existe coagulopatía, puede recurrirse a la biopsia transyugular, pero las lesiones focales suelen necesitar un abordaje percutáneo1. En caso de ascitis masiva puede realizarse su drenaje antes de la punción para facilitar el acceso a la lesión1.
- •
Bazo:
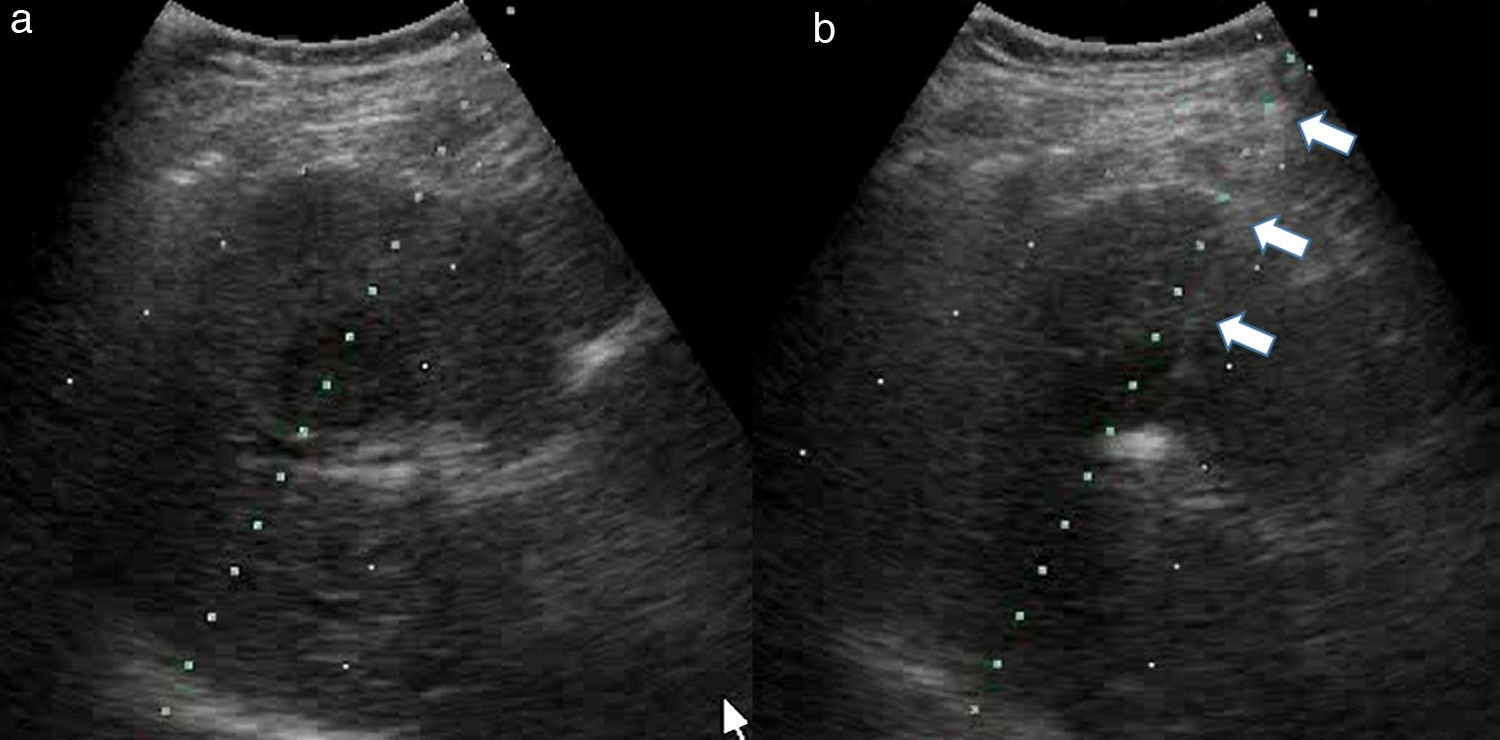
La indicación más frecuente de punción diagnóstica en el bazo es una lesión focal en un paciente con una neoplasia conocida extraesplénica, o con un linfoma, sin lesiones biopsiables en otras localizaciones20 (fig. 5). Es una localización infrecuente de metástasis y muy rara vez el único foco metastásico33,34.
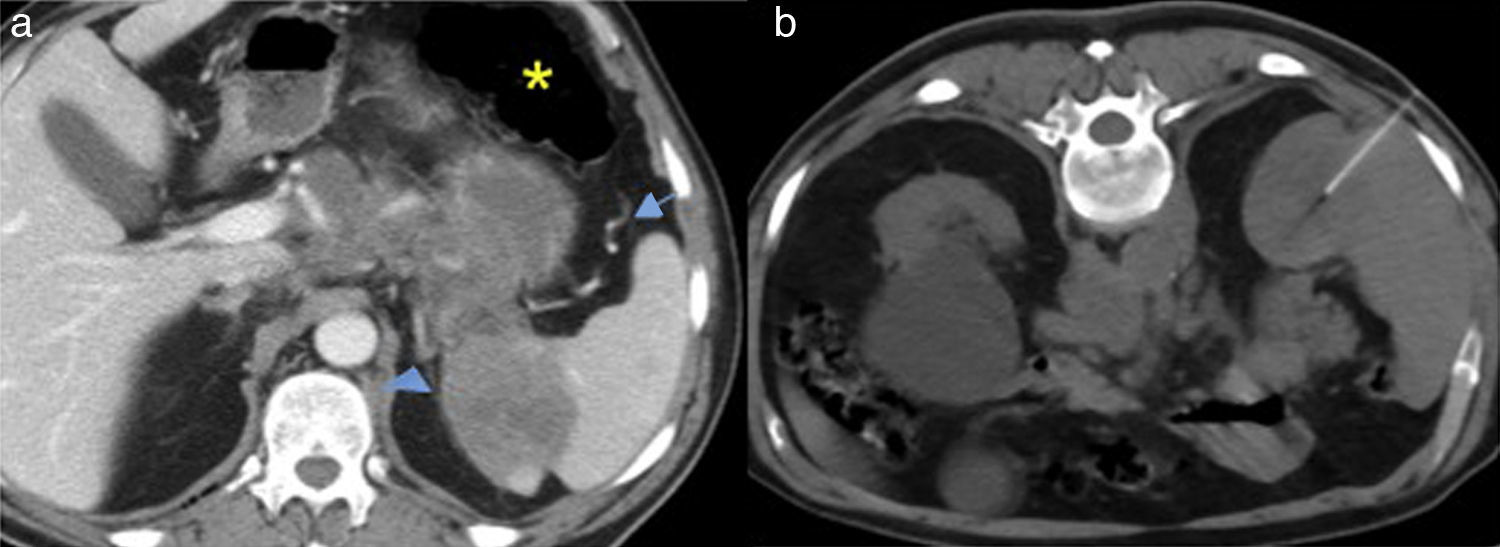
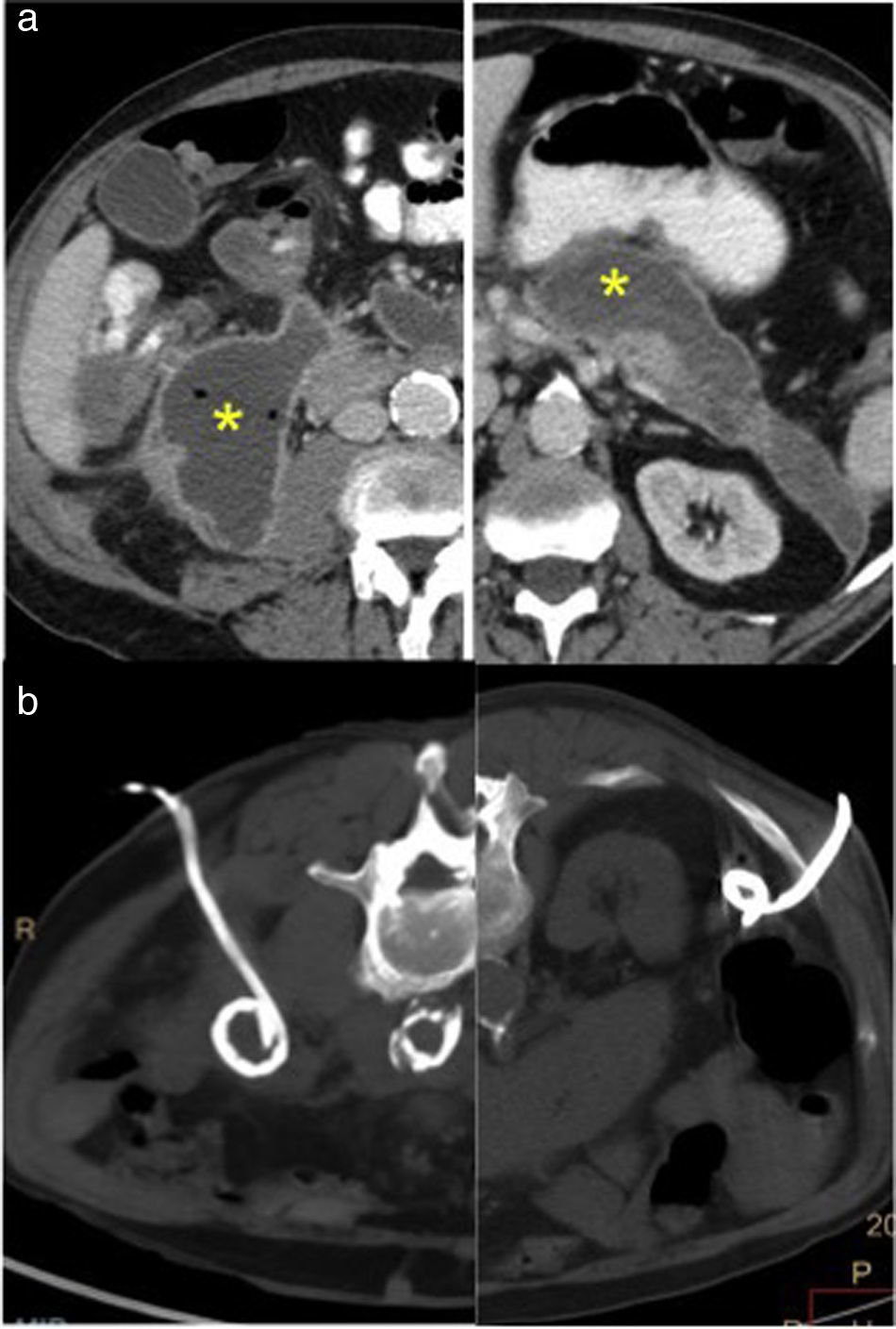
Figura 5.Punción del bazo. a) Tomografía computarizada (TC) con contraste intravenoso: gran masa hipoatenuante que afecta al páncreas y al bazo. El acceso al componente pancreático está limitado por la interposición del colon (asterisco), vasos prominentes anterolateralmente (flecha) y la glándula suprarrenal posteriormente (punta de flecha). b) Se realizó punción esplénica guiada por TC, con resultado anatomopatológico de linfoma no Hodgkin de tipo B.
(0.1MB).Si hay múltiples lesiones, la elección de una periférica, lejos del hilio, disminuye el volumen de parénquima normal que se atraviesa y el riesgo de sangrado. No obstante, es preferible atravesar una pequeña porción de parénquima para ayudar al taponamiento del sangrado34.
El hecho de realizar sólo PAAF (p. ej., en caso de coagulopatía) aumenta la seguridad del procedimiento, pero disminuye la fiabilidad diagnóstica. Ello es particularmente importante en el caso del linfoma, dada la dificultad para diagnosticar los múltiples subtipos que tienen distintos requerimientos terapéuticos34.
La hemorragia es la complicación más seria, y es más frecuente que en otros órganos. No obstante, la biopsia diagnóstica, o el drenaje en caso de absceso, son menos invasivos que la esplenectomía y permiten conservar el órgano. La presencia de un pequeño sangrado subcapsular o peritoneal asintomático es una complicación menor, pero puede producirse una hemorragia grave que requiera esplenectomía o embolización urgente. Otras complicaciones importantes, aunque menos frecuentes, son neumotórax, derrame pleural y lesiones del colon o del riñón33,34. La posición en decúbito lateral izquierdo comprime y desplaza cranealmente el pulmón, y disminuye la movilidad del diafragma, disminuyendo el riesgo de puncionar el parénquima pulmonar o la pleura. Esto tiene mayor importancia en el caso del drenaje, por el riesgo de empiema34.
Los pacientes deben ser observados, con control de sus constantes vitales, durante al menos 3 horas tras la biopsia y 24 horas si es un drenaje.
- •
Riñón:
La biopsia se realiza con el paciente en prono o decúbito lateral, preferiblemente con abordaje subcostal para evitar puncionar la pleura o los vasos intercostales.
Para la biopsia renal «no focal» suelen emplearse agujas de calibre 16-18 G y se avanza de forma oblicua en la corteza renal cerca del polo inferior5. Hay que evitar la médula o el seno renal, y las muestras se envían de inmediato en fresco. La hipertensión arterial añade riesgo de hemorragia.
Cada vez hay más indicaciones para la tipificación prequirúrgica de lesiones renales, únicas o múltiples, que pueden detectarse de manera incidental, con el objeto de definir el manejo a seguir en función de su histología y marco clínico, dado que el 20-50% de lesiones de pequeño tamaño son benignas y muchos de los nódulos malignos de pequeño tamaño tienen una evolución muy lenta1. La sensibilidad y la especificidad de la biopsia guiada por la imagen son del 97,7% y el 100%35.
Drenaje percutáneo de abscesos y colecciones líquidasConsiste en evacuar el contenido de una colección líquida en el interior del cuerpo mediante aspiración con aguja o introduciendo un pequeño catéter a través de una mínima incisión en la piel.
Es el tratamiento estándar en los pacientes con abscesos abdominales que no tengan otra indicación para cirugía14. La posibilidad del drenaje y su eficacia dependen de la capacidad de acceder a la colección y de la consistencia de su contenido (sangre, pus espeso…). Hay que tener en cuenta otros posibles procedimientos, como pueden ser los endoscópicos, que pueden ser preferibles es algunos casos36.
Finalidad- •
Diagnóstica: se extrae una muestra del líquido para estudio microbiológico, bioquímico o citopatológico. Basta con la aspiración simple.
- •
Terapéutica: además de tomar muestras del fluido para el diagnóstico, según el cuadro clínico del paciente se pretende la resolución de una infección o el alivio de síntomas por compresión. En este caso la intención es el vaciamiento de la colección y evitar su recidiva. Puede ser un tratamiento definitivo o paliativo para mejorar la situación clínica del enfermo, con posterior cirugía programada36.
- •
Aspiración simple: suele realizarse con aguja de calibre 18-20 G. Suele ser suficiente en colecciones de pequeño tamaño y superficiales.
- •
Catéter de drenaje: es preferible en colecciones de mayor tamaño y profundidad, siempre que sea posible37. Antes de introducir el catéter se realiza punción con aguja y se aspira una pequeña cantidad para confirmar el contenido fluido de la lesión y valorar su consistencia, lo que informa sobre el calibre del catéter a elegir. Aspirar demasiado contenido puede dificultar la inserción posterior del catéter al disminuir el volumen de la lesión. En colecciones muy fluidas se emplean calibres finos (7-8 F). Si el contenido es espeso o necrótico (fig. 6) puede ser necesario un calibre superior a 12 F38. Los catéteres pueden colocarse mediante técnica de Seldinger o por punción con trócar. En la primera se punciona la colección con una aguja, por la que se introduce una guía metálica de consistencia suficiente para permitir la progresión del catéter. A continuación se retira la aguja y se dilata el tracto con dilatadores de calibre progresivo, colocando finalmente el catéter. Para la técnica con trócar el catéter viene montado sobre una cánula metálica rígida y hueca, por cuyo interior se introduce un estilete metálico. Se penetra por punción directa sobre la piel y al llegar a la colección se retira el estilete y se desliza el catéter sobre la cánula metálica, dejando el extremo con todos los agujeros dentro de la colección14. El método es más sencillo, pero conlleva un mayor riesgo de lesionar vísceras. Puede hacerse con técnica tándem, colocando inicialmente una aguja fina y a continuación el catéter en paralelo, adyacente a dicha aguja.
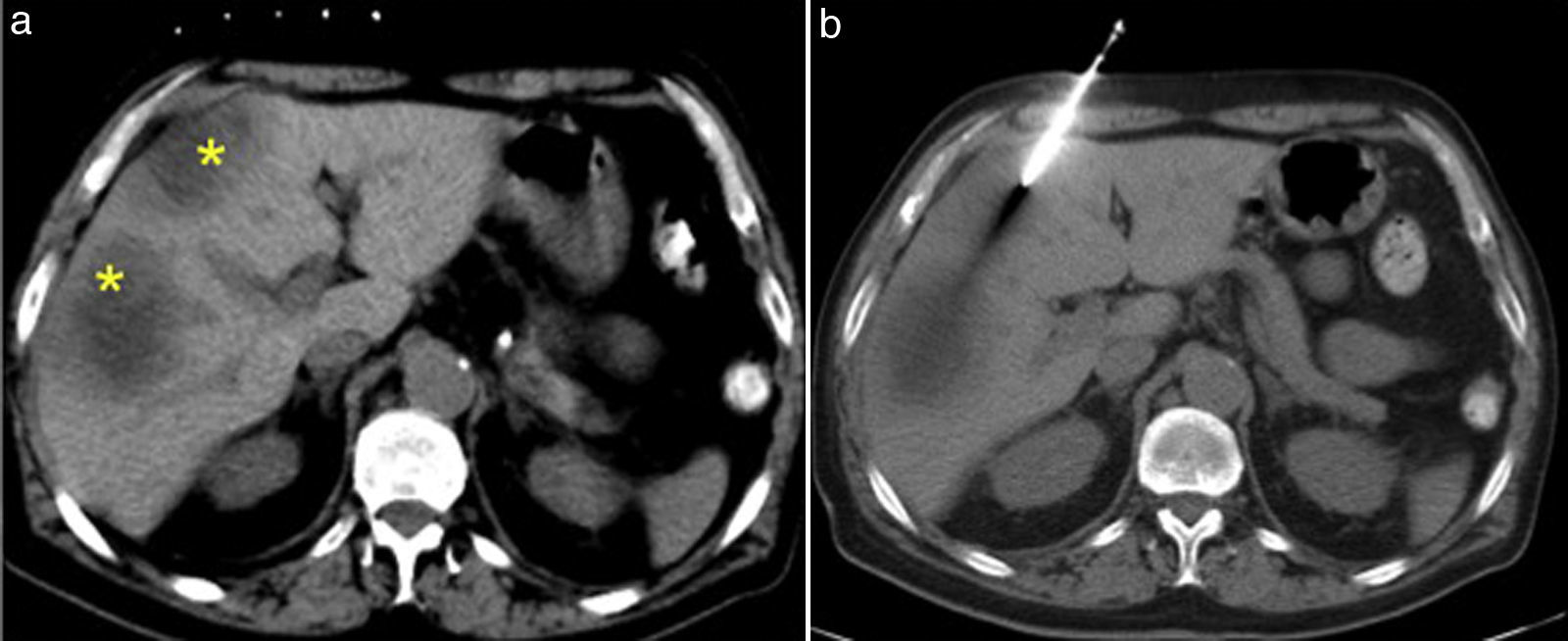
Figura 6.Hematoma retroperitoneal infectado tras hemicolectomía derecha. a) Tomografía computarizada (TC) con contraste intravenoso que muestra una colección tabicada de gran tamaño que afecta al músculo psoas-ilíaco derecho (asterisco). Requiere un catéter de gran calibre y a veces la inyección de fibrinolíticos. b) Control a los 7 días, con resolución de la colección tras el drenaje con un catéter de calibre 14 F.
(0.15MB).
Los catéteres más empleados tienen un extremo distal con forma de cola de cerdo (pigtail), con orificios múltiples situados en la cara interna de la curva para prevenir su bloqueo cuando se aproximan las paredes de la colección al disminuir su tamaño. Con frecuencia contienen un hilo interno de retención para evitar que se desalojen, aunque también existen catéteres con otros mecanismos, como sonda de Foley, o Malecot, en el cual el extremo distal se expande en forma de seta. Los orificios del catéter deben quedar por completo dentro de la colección para evitar la contaminación de órganos o espacios vecinos.
El catéter se fija a la piel con adhesivo o sutura, y se conecta a una bolsa o colector que recoge el material, bien por gravedad o por aspiración continua.
Si existen tabiques o esfacelos que impiden la resolución de la colección, puede inyectarse urocinasa para fluidificarla39.
En colecciones estériles persistentes o recidivantes, como quistes, linfoceles o seromas, el objetivo puede ser esclerosar la cavidad, para lo cual, tras evacuar el líquido, pueden inyectarse a través del catéter sustancias esclerosantes40.
Control tras el procedimientoDebe hacerse un control periódico para comprobar la correcta localización y permeabilidad del catéter, controlar el débito y detectar posibles complicaciones14. Los lavados diarios con solución salina pueden evitar su obstrucción. El sistema se mantiene varios días, sobre todo si el contenido es purulento o el paciente está séptico. Los criterios para la retirada del catéter en una colección infectada son la ausencia de datos clínicos y analíticos de infección y un débito menor de 10 cc diarios durante al menos 3 días consecutivos14. Si el débito es escaso y persisten las alteraciones clínicas, hay que excluir una obstrucción del catéter y realizar una exploración radiológica para comprobar la localización correcta, la presencia de tabiques o nuevas colecciones. El drenaje también puede ser inadecuado por contenido muy espeso, fugas pericatéter o rotura del catéter. Estos problemas pueden solventarse con lavado, colocación de un nuevo catéter (que puede ser de calibre más grueso) o instilación de agentes fibrinolíticos en la cavidad36. El débito alto prolongado hace sospechar una fístula entre la colección y el tubo digestivo, el conducto pancreático, la vía biliar o la vía urinaria, y puede ser necesario mantener el catéter varias semanas. También es necesario el drenaje prolongado, e incluso de por vida, en caso de tumores abscesificados36 (fig. 7).
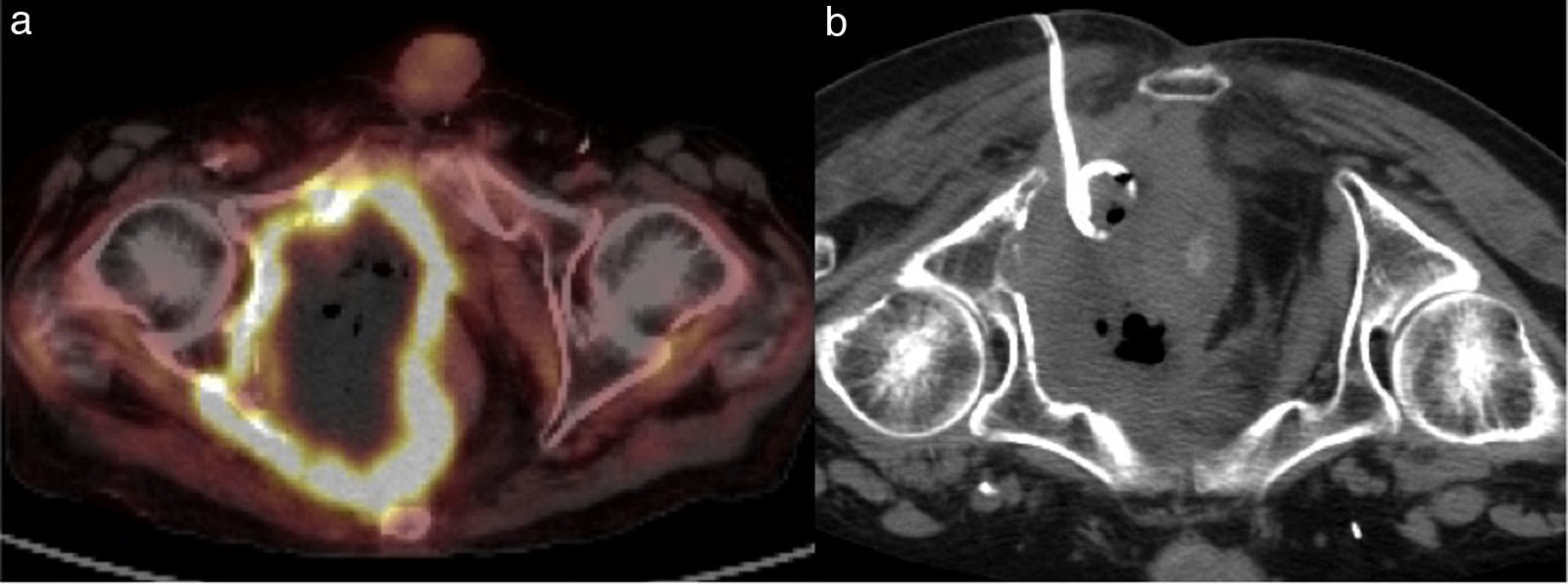
Carcinoma urotelial necrosado y abscesificado. a) Tomografía por emisión de positrones: marcada actividad metabólica en los bordes de masa pélvica sin actividad en el interior, donde se aprecian burbujas de gas. En la punción con aguja se aspira pus y se inserta un catéter de drenaje por vía transglútea, con entrada algo más lateral de lo habitual. b) Tomografía computarizada sin contraste intravenoso: catéter situado en el componente fluido de la lesión. En este caso se mantiene el catéter de forma indefinida.
En ocasiones, las colecciones parecen inaccesibles al drenaje percutáneo. Es más frecuente en la pelvis, donde se interponen numerosas estructuras (hueso, vasos sanguíneos importantes, nervios, intestino y vejiga)41. A veces se considera necesario aspirar estos abscesos atravesando el intestino delgado con una aguja de calibre 20 G, sin colocar catéter37.
En ocasiones no es posible acceder sin pasar por algún órgano. El estómago y el hígado pueden atravesarse para tratar colecciones epigástricas si no hay otra opción, aunque puede ser preferible el drenaje a través de ecoendoscopia42. Si se pasa por el hígado, la coagulación debe ser normal y el trayecto intrahepático lo más corto posible, evitando los vasos importantes y los conductos biliares dilatados.
También se acepta atravesar la vagina o el recto en el drenaje transcavitario en caso de colecciones pélvicas, pero no la vejiga ni otros tramos intestinales distintos del propio recto cuando el abordaje es transrectal.
Existen órganos que no deben atravesarse: páncreas, bazo, vesícula biliar, diafragma, intestino, vejiga, útero, ovarios y próstata. Los abscesos que afectan a algunos de esos órganos pueden drenarse percutáneamente, pero no deben cruzarse para llegar a colecciones más profundas. Hay que evitar los vasos sanguíneos, sobre todo las arterias. La punción de arterias epigástricas o intercostales puede originar hemorragias importantes37.
- •
Colecciones pélvicas profundas:
Existen rutas de acceso específicas (transglútea, transvaginal, transrectal o transperineal) y es preciso un estudio anatómico detallado para planificar la mejor vía posible. Si se trata de una colección potencialmente estéril, se prefiere la vía transabdominal o transglútea siempre que sea posible para evitar contaminar la colección37.
- –
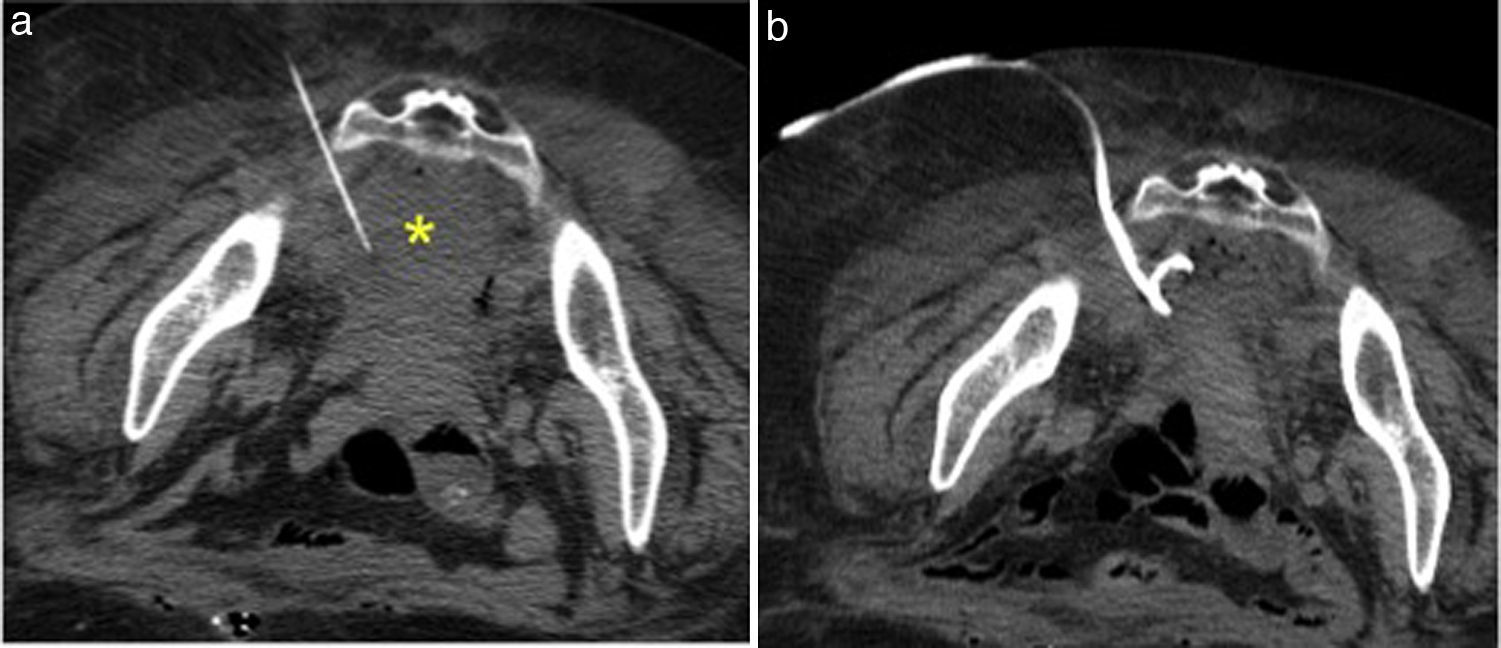
Abordaje transglúteo: es preciso situar al paciente en decúbito prono, y si no es posible (cirugía abdominal reciente, ostomía, obesidad, dificultad respiratoria) se colocará en decúbito lateral u oblicuo. Se accede a través del agujero ciático. Hay que identificar los vasos ilíacos y sus ramas principales (arterias glúteas superiores e inferiores, pudendas internas), y el nervio ciático. El trayecto idóneo para evitar lesionar estas estructuras es lo más medial posible, adyacente al sacro, y caudal al músculo piriforme (fig. 8). A este nivel el nervio ciático se sitúa más lateralmente y los vasos glúteos cranealmente. La punción del músculo piriforme suele ser más dolorosa. También hay que evitar la punción del recto. El dolor es la complicación más frecuente (20%), secundario a irritación del nervio ciático. La hemorragia por punción de ramas de las arterias glúteas es infrecuente.
Figura 8.Acceso transglúteo. Tomografía computarizada sin contraste intravenoso: absceso presacro postoperatorio (asterisco). a) Punción con aguja de 22 G que confirma la presencia de pus. Se introduce la aguja adyacente al sacro para evitar una lesión vascular o nerviosa. b) El catéter sigue el mismo trayecto.
(0.13MB). - –
Abordaje transcavitario (rectal o vaginal): en lesiones pélvicas profundas adyacentes al recto o a la cúpula vaginal pueden realizarse los procedimientos con guía ecográfica a través de ellos. Existen guías especiales que se acoplan a la sonda endocavitaria y facilitan el montaje de las agujas sobre la sonda. También se han descrito métodos para acoplar directamente los catéteres al transductor, permitiendo la punción directa. La vía transrectal se emplea a menudo en niños para drenar abscesos pélvicos profundos, de forma segura y con tasa de éxito de hasta el 100%37,43. En la vía transvaginal hay que tener especial cuidado para no lesionar la vejiga. El abordaje puede ser transvaginal con control por ecografía transabdominal. La complicación más frecuente es el dolor, sobre todo en el acceso transvaginal. También es más difícil el mantenimiento del catéter en la situación correcta, por lo que suele suturarse a la cara interna del muslo.
- –
- •
Colecciones subfrénicas:
Son difíciles de abordar cuando no son grandes por la proximidad del hígado o el bazo, el colon y la pleura. Para evitar complicaciones pleurales (neumotórax, derrame o empiema pleural), la vía de abordaje debería ser subcostal y lo más anterior posible, aunque se requiera angulación craneal. Las colecciones subfrénicas izquierdas postesplenectomía suponen un riesgo añadido por recolocación de tubo digestivo hacia el lecho quirúrgico. Suele preferirse como guía la ecografía, aunque también puede hacerse con TC angulando el gantry. No siempre puede evitarse el espacio pleural, pero nunca debe atravesarse el parénquima pulmonar33,37.
- •
Colecciones pancreáticas:
Las principales estructuras a evitar son el intestino y los vasos mesentéricos y retroperitoneales. Suele emplearse la TC como guía.
En la pancreatitis aguda podemos encontrar distintos tipos de colecciones, debidas al derrame de fluido pancreático, con un manejo diferenciado. Las colecciones agudas ocurren en el periodo inicial y la mayoría se resuelven espontáneamente. No necesitan punción percutánea salvo para toma de muestra con aguja fina si se sospecha infección. Se recomienda tomar muestras de distintos sitios de la colección44.
Los pseudoquistes representan una colección de fluido pancreático rodeado de una cápsula fibrosa y ocurren tras un periodo de aproximadamente 4 semanas. Más de la mitad se resuelven de manera espontánea y suelen ser estériles. El drenaje se emplea cuando el tamaño supera los 5cm o son sintomáticos. Comunican con un ducto pancreático, por lo que la aspiración simple no es eficaz y suelen recidivar. La duración del drenaje suele ser larga, a veces de meses, hasta el cierre de la fístula.
La necrosis pancreática no implica necesariamente sobreinfección, aunque es frecuente. El drenaje en la necrosis estéril es controvertido por el riesgo de infección. Algunos autores lo recomiendan, y también en las colecciones agudas, basándose en que la presencia de líquido pancreático alrededor de la glándula favorece la inflamación y la necrosis, retrasando la recuperación38. La necrosis infectada ocurre en las primeras 2-3 semanas y puede documentarse aspirando una muestra para microbiología. Se sospecha por la presencia de gas en el retroperitoneo o el saco menor en la TC. Suele ser indicación de cirugía, siendo el drenaje un procedimiento puente en pacientes muy inestables como para someterse a desbridamiento quirúrgico inmediato, aunque un tercio de los pacientes pueden ser tratados sólo con drenaje percutáneo (fig. 9).
La mayoría de las veces el acceso es por vía retroperitoneal, a través de los espacios pararrenales anteriores. Si ello no es posible, puede accederse por vía transperitoneal (transhepática, transgástrica o ligamentos gastrocólico y gastroesplénico). Se toma una muestra del fluido para bioquímica (concentración de amilasa) y microbiología. Con frecuencia se requieren catéteres de gran calibre y a veces múltiples para extraer detritus necróticos. Posteriormente es necesario controlar la permeabilidad del catéter mediante lavados diarios repetidos con solución salina fisiológica y revisiones periódicas con TC para valorar cambios en el tamaño de la cavidad, el correcto posicionamiento y la necesidad de introducir nuevos catéteres (nuevas colecciones, loculación).
Colecistostomía percutáneaEs un procedimiento mínimamente invasivo que consiste en la colocación percutánea de un catéter de drenaje en la luz vesicular para descompresión y drenaje.
El tratamiento estándar para la colecistitis aguda es la colecistectomía (laparoscópica o mediante laparotomía), con antibioticoterapia asociada, pero en pacientes graves con alto riesgo quirúrgico la mortalidad es alta (5-30%), por lo que la colecistectomía urgente no siempre está indicada45. En estos pacientes, la colecistostomía produce una mejoría clínica y analítica en 24-72 horas en más del 90% de los casos46.
Indicaciones- •
Colecistitis aguda litiásica o alitiásica, en pacientes con alto riesgo quirúrgico (ASA II-IV)45.
- •
Colecistitis aguda grave (grado III según las Guías de Tokio)45–47.
- •
No está indicada como procedimiento de drenaje biliar, salvo tras el fracaso del drenaje biliar percutáneo o endoscópico y siempre que la obstrucción sea distal a la salida del cístico.
- •
Alteración de la coagulación no corregible.
- •
Tumor de vesícula (porque puede diseminarse por el tracto de acceso).
Es preferible la guía ecográfica, aunque también puede utilizarse la guía mediante TC o fluoroscopia. La elección de la modalidad de imagen dependerá de la habilidad y las preferencias del médico responsable, así como de la disponibilidad en cada centro.
Puede hacerse bajo técnica de punción con trócar, que es de preferencia ya que es más rápida y se realiza en un solo paso, con lo que se evita la fuga de bilis purulenta durante el procedimiento, o mediante técnica de Seldinger.
Siempre que se pueda debe usarse la vía de entrada más corta posible, ya sea transhepática o transperitoneal, sin interposición de asas ni pulmón, y huyendo del hilio hepático.
La interposición de parénquima hepático proporciona una mejor sujeción del catéter y evita la importante complicación de su desalojo, que obliga a iniciar un nuevo procedimiento. Además, impide la fuga de bilis al peritoneo. La vía transperitoneal directa evita el pequeño índice de complicaciones hemorrágicas del tracto transhepático, y es preferible en pacientes con enfermedad hepática o coagulopatía.
Es muy importante que, durante el avance del catéter o de la aguja, el paciente mantenga una respiración superficial regular, o mejor aún, si es posible, hacerlo en apnea. Resulta muy conveniente que el catéter de drenaje vaya provisto de un hilo de retención. El catéter debe tener un recubrimiento hidrófilo para un mejor avance, sin necesidad de predilatación del tracto y evitar la angulación de la guía y la desviación fuera del lecho vesicular.
Con la aguja o el catéter ya en la ubicación correcta, es conveniente aspirar toda la cantidad posible de bilis. Una pequeña cantidad se envía para cultivo y antibiograma. Si la bilis es muy espesa se diluye con solución salina, sin aumentar la distensión vesicular. Se conecta a bolsa de drenaje sin aplicar aspiración. Se cuantifican la cantidad y las características del drenaje, y se vigila el funcionamiento del catéter.
Cuando exista mejoría clínica del paciente se realizará una colangiografía a través del catéter para demostrar la presencia de cálculos en el cístico y la vía biliar extrahepática e intrahepática.
Si la patología del paciente es una colecistitis aguda alitiásica (<5% de los casos) y no existe litiasis asociada del resto del árbol biliar, y hay permeabilidad del cístico, tras la mejoría clínica y analítica puede retirarse el catéter de colecistostomía, una vez que ha madurado el tracto (2-3 semanas)48.
Si se demuestra litiasis en la vía biliar extrahepática se programa extracción endoscópica mediante colangiopancreatografía retrógrada endoscópica (CPRE), previa a la retirada del catéter de colecistostomía.
En pacientes con colecistitis aguda litiásica con alto riesgo quirúrgico, descartados para cirugía, la retirada del catéter es una opción desaconsejable debido al alto riesgo de recurrencia de la colecistitis49.
ComplicacionesLa incidencia de complicaciones graves es de alrededor del 3%47, incluyendo la hemobilia y el neumotórax en el caso de la vía transhepática, y la fuga de bilis si se usa la vía transperitoneal, con desarrollo de una posible peritonitis biliar cuando la bilis esté infectada45.
Nefrostomía percutáneaEs un procedimiento habitual, frecuente en radiología intervencionista, que consiste en la colocación de un catéter de drenaje en el interior del sistema excretor renal.
Es un procedimiento seguro, ya que el riñón es un órgano relativamente superficial, situado en el retroperitoneo, casi sin estructuras vitales interpuestas y bien visible mediante ecografía, que identifica y diferencia a la perfección el sistema excretor del parénquima renal y de otros órganos de vecindad.
La nefrostomía percutánea compite con el drenaje endoscópico, con las ventajas sobre él de que no necesita sobrepasar la causa de la obstrucción, sino que con un catéter de nefrostomía externo alojado en la pelvis renal se soluciona la obstrucción y el riñón reinicia de forma rápida su funcionamiento. Esto conlleva un mayor porcentaje de éxitos. Tiene el inconveniente de que precisa una coagulación normal. Aparte de competir, muchas veces son procedimientos complementarios y la elección entre ellos depende de la disponibilidad y la experiencia de cada hospital.
La nefrostomía consigue buenos resultados en el 95-100% de los casos, con un pequeño índice de complicaciones.
En pacientes con sospecha de infección urinaria o pionefrosis, o en caso de enfermedad valvular o válvula protésica, es necesario tratamiento antibiótico, al igual que ocurre en pacientes con cálculos de estruvita por estar asociados a infección.
IndicacionesTodas ellas son válidas tanto para riñón nativo como para trasplante renal:
- •
Obstrucción del trato urinario superior, bien de causa maligna o benigna, sea intrínseca o extrínseca.
- •
Tratamiento de fístula urinaria.
- •
Vía de entrada para otros procedimientos diagnósticos y terapéuticos sobre el uréter: catéter de drenaje interno-externo, doble J percutáneo, dilatación ureteral, colocación de stent metálico, extracción de litiasis…
- •
Alteración de la coagulación irreversible.
- •
Alteración psíquica importante que imposibilita para el cuidado higiénico del catéter.
- •
Posición del paciente: decúbito prono o en prono oblicuo con el lado a puncionar levantado 30-45°. En decúbito prono disminuye la oxigenación al disminuir el movimiento diafragmático, por lo que el paciente debe estar monitorizado para controlar la saturación de O2. Muchos pacientes con laparotomía reciente, obesos con enfermedad pulmonar obstructiva crónica (EPOC) o embarazadas no soportan el decúbito prono. En estos casos puede realizarse la nefrostomía con el paciente en decúbito lateral, en decúbito supino oblicuo o en posición sentada. En los pacientes que no pueden ser desplazados se realiza la punción en la propia cama con guía ecográfica en oblicuo supino, con el lado a puncionar levantado 25°.
- •
Acceso al sistema excretor: se entra por vía posterolateral a nivel de la línea axilar posterior, a lo largo del plano avascular de Brodel, o plano de separación de la rama dorsal y ventral de la arteria renal, que es donde existe menos vascularización y los vasos son de muy pequeño tamaño. La punción, en principio, debe ser subcostal, y atravesar el parénquima renal antes de entrar en un cáliz posterior, preferentemente en el grupo calicial medio, en posición yuxtapapilar mejor que transpapilar, para permitir una buena manipulación posterior hacia el uréter50. Debe evitarse la punción directa de la pelvis renal y la colocación posterior del catéter por dicha vía, por el alto riesgo de daño vascular.
- •
Procedimiento:
Puede realizarse bajo ecografía o fluoroscopia combinada con ecografía. La punción guiada por ecografía es preferible por su menor morbilidad y ausencia de radiación, y es obligatoria en embarazadas, niños y alérgicos al contraste yodado. Permite elegir el sitio óptimo de punción y el trayecto. De esta forma puede visualizarse la aguja en todo su trayecto y confirmar su entrada en el parénquima renal y el acceso al sistema excretor.
Se realiza la punción con la aguja Chiba 22 G del set de micropunción, y una vez comprobada su adecuada localización se introduce el conjunto dilatador e introductor por medio de una microguía de 0,018 pulgadas. Se retiran la microguía y el dilatador, y a través del introductor, bien colocado en la pelvis renal, se introduce una guía extrarrígida de 0,035 pulgadas con la precaución de que la parte rígida quede alojada en la curvatura de la pelvis. A continuación puede predilatarse el tracto mediante dilatadores fasciales y colocar el catéter de drenaje elegido.
Si existe una dilatación marcada del sistema excretor, es mejor pinchar directamente bajo control ecográfico con una aguja de 18-19 G con luz para guía extrarrígida de 0,035 pulgadas51, siendo preferible utilizar el set de micropunción si la dilatación es mínima, se trata de un niño o no se tiene suficiente experiencia.
Se recoge una muestra de orina para citología o para análisis bacteriológico, o para ambos.
Hay que evitar la sobredistensión del sistema excretor para evitar la bacteriemia, y con la menor opacidad posible del contraste que permita la visualización adecuada del trayecto de la microguía dentro del sistema excretor. Una vez que el catéter de nefrostomía está correctamente alojado en la pelvis renal hay que tirar del hilo de retención para fijar la forma pigtail de la punta.
Si existen coágulos o pus espeso se lava con solución salina sin distender y se aspira varias veces, para conseguir una rápida permeabilidad del catéter.
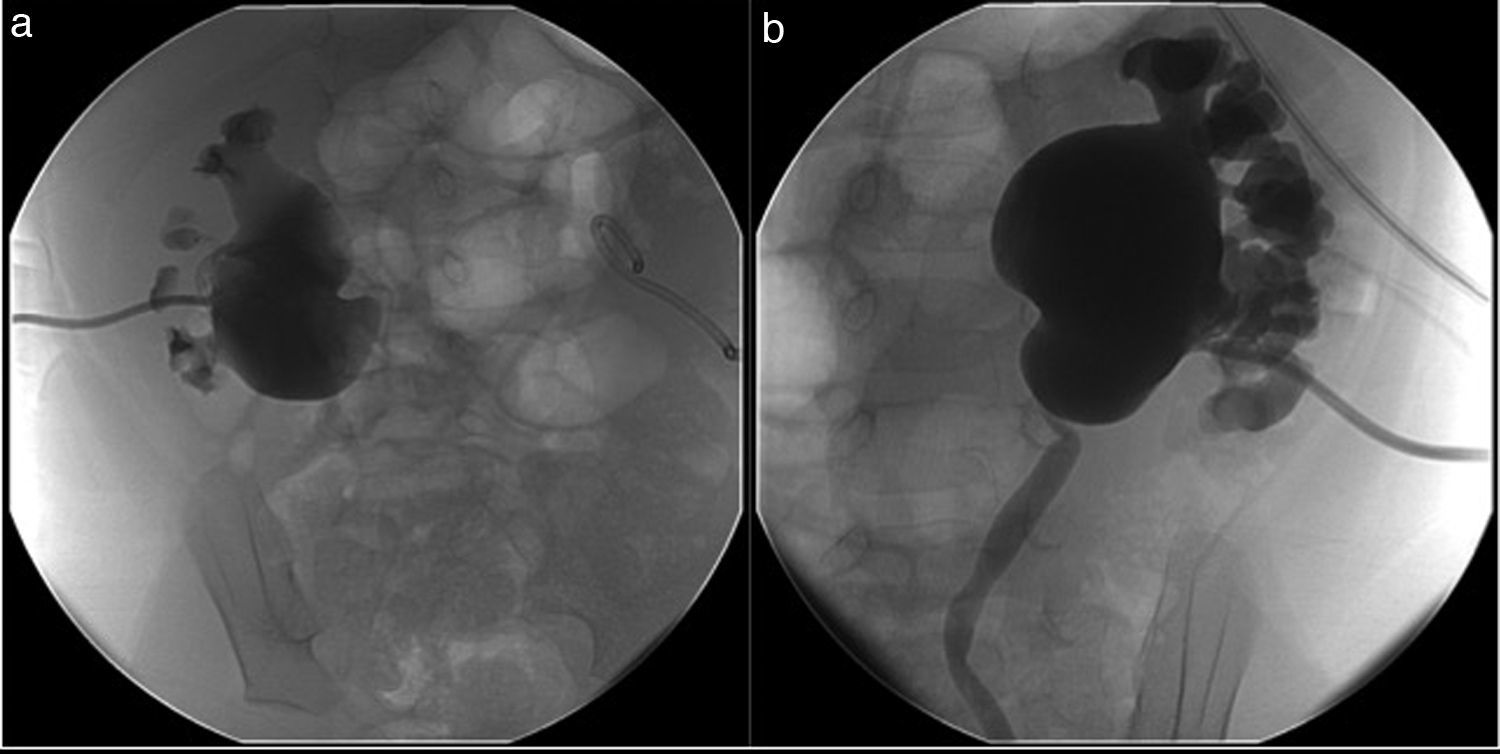
Debe realizarse una pielografía a través del catéter (fig. 10) para determinar la causa de la obstrucción y planificar otras opciones terapéuticas. Por último, hay que conectar el catéter a una bolsa de drenaje en circuito cerrado y que drene por gravedad.
Cuidados tras el procedimiento- •
Continuar la analgesia, tratamiento antitérmico si presenta fiebre y profilaxis antibiótica al menos 24 horas.
- •
Controlar el drenaje de orina y el funcionamiento del catéter.
Si no hay complicaciones y la evolución clínica es adecuada y el catéter funciona correctamente, el paciente puede ser dado de alta a las 24-48 horas con instrucciones para el correcto manejo del catéter y qué hacer en caso de mal funcionamiento. Es muy importante hacerle consciente de la importancia de una buena hidratación, ya que aumentar el volumen de orina alarga el tiempo de permeabilidad del catéter.
El recambio de un catéter de nefrostomía, la mayoría de las veces, es un procedimiento fácil y rápido que se realiza de forma ambulatoria. Cuando el catéter está obstruido, primero se intentará su desobstrucción con solución salina cargada en jeringas de tamaño decreciente hasta llegar a 1ml si es necesario. Si no se consigue así, puede introducirse una guía en J o curva con la intención de que salga por un agujero lateral del pigtail, y a continuación cambiar el catéter a su través. La salida completa del catéter de nefrostomía requiere una solución en 24-48 horas como máximo, ya que si el tracto no está maduro se cierra rápidamente y obliga a una nueva punción. Si el tracto no está cerrado se opacifica con contraste yodado por la vaina plástica de un abocath de 18-20 G y se intenta la cateterización con una guía flexible hidrófila. El catéter debe cambiarse cada 6 meses, o mejor cuando surjan problemas que indiquen su recambio.
ComplicacionesLas complicaciones más graves son la hemorragia masiva, que muchas veces requiere arteriografía con embolización supraselectiva del punto sangrante, y complicaciones infecciosas que pueden ocasionar sepsis que requieran tratamiento urgente.
Las complicaciones menores más importantes son neumotórax (1%), hematuria macroscópica que se resuelve espontáneamente en 24-48 horas y problemas relacionados con el catéter.
ConclusionesLos radiólogos deben familiarizarse con las técnicas mínimamente invasivas guiadas por la imagen que permiten el diagnóstico y el tratamiento de numerosos procesos, sustituyendo en muchos casos a la cirugía abierta, en general sin necesidad de anestesia general y con un bajo índice de complicaciones si la indicación es correcta y la técnica es cuidadosa. Suelen realizarse en ámbito ambulatorio o con mínima estancia hospitalaria, y cada vez son más demandadas por médicos de otras especialidades.
Conflicto de interesesLas autoras declaran no tener ningu¿n conflicto de intereses.
A la Dra.Gallego Herrero y al Dr. García-Hidalgo Castilla.