El síndrome de la columna operada fallida es la persistencia o la reaparición de dolor tras el tratamiento quirúrgico de la columna. Bajo este término se engloban diversas causas tanto mecánicas como no mecánicas. Las técnicas de imagen son herramientas imprescindibles para el control postquirúrgico y para la valoración de las potenciales complicaciones responsables del fracaso de la cirugía.
El objetivo de esta revisión es por una parte que el radiólogo se familiarice con los cambios postquirúrgicos normales y por otra parte que pueda identificar los hallazgos radiológicos patológicos que están traduciendo un síndrome de la columna operada fallida. Para eso es necesario conocer el tipo de cirugía que se ha realizado en cada caso y el tiempo transcurrido desde la intervención.
En las técnicas de fusión de la columna vertebral se debe evaluar el grado de fusión ósea, el material de instrumentación (tanto su posición como su integridad), el hueso sobre el que asienta, la interfase entre el implante y el hueso y los segmentos vertebrales que se encuentran adyacentes a la columna instrumentada.
En las técnicas descompresivas es importante reconocer qué cambios son los esperables en un paciente operado y saber distinguirlos de la fibrosis peridural y de la recidiva herniaria.
También se deben conocer los datos radiológicos de infección postquirúrgica.
Se revisarán otras complicaciones, como la aracnoiditis, las colecciones líquidas postquirúrgicas y las alteraciones de los tejidos blandos adyacentes al lecho quirúrgico.
Failed back surgery syndrome is the persistence or reappearance of pain after surgery on the spine. This term encompasses both mechanical and nonmechanical causes. Imaging techniques are essential in postoperative follow-up and in the evaluation of potential complications responsible for failed back surgery syndrome.
This review aims to familiarize radiologists with normal postoperative changes and to help them identify the pathological imaging findings that reflect failed back surgery syndrome. To interpret the imaging findings, it is necessary to know the type of surgery performed in each case and the time elapsed since the intervention.
In techniques used to fuse the vertebrae, it is essential to evaluate the degree of bone fusion, the material used (both its position and its integrity), the bone over which it lies, the interface between the implant and bone, and the vertebral segments that are adjacent to metal implants.
In decompressive techniques it is important to know what changes can be expected after the intervention and to be able to distinguish them from peridural fibrosis and the recurrence of a hernia.
It is also crucial to know the imaging findings for postoperative infections. Other complications are also reviewed, including arachnoiditis, postoperative fluid collections, and changes in the soft tissues adjacent to the surgical site.
El dolor de espalda y radicular es un problema muy prevalente como consecuencia de los hábitos de vida actuales. Se estima que afecta hasta a un 80% de la población1, y es una importante causa de discapacidad y de pérdida de productividad, que genera importantes costes.
Generalmente se trata de episodios de dolor de origen mecánico, que se solucionan de manera conservadora en un período inferior a 12 semanas, pero en un 5% de los casos2 pueden precisar tratamiento quirúrgico. Tras la intervención hay una mejoría de los síntomas, aunque en un 10-40% de los casos el dolor puede persistir o reaparecer en un breve lapso de tiempo3; es el denominado síndrome de la columna operada fallida, bajo el cual se engloban diversas causas tanto mecánicas como no mecánicas.
Las técnicas de imagen se han convertido en herramientas imprescindibles para el control posquirúrgico y la valoración de las potenciales complicaciones responsables del fracaso de la cirugía lumbar, por lo que el radiólogo debe estar familiarizado con los diversos abordajes, técnicas y dispositivos utilizados en la cirugía espinal.
La cirugía de columna puede dividirse en tres categorías principales4:
- 1.
Los procedimientos de fusión, que son los que se realizan para proporcionar estabilidad o corregir una deformidad.
- 2.
Los procedimientos descompresivos, que incluyen la discectomía, la laminotomía, la laminectomía y la facetectomía.
- 3.
Los procedimientos de escisión de una lesión, como la extirpación de un tumor, desbridamiento de una infección o drenaje de abscesos.
A continuación se desarrollan las complicaciones más frecuentes de las técnicas de fusión y de las técnicas descompresivas, así como complicaciones generales de las cirugías de columna.
Fusión y estabilización vertebralHay determinadas patologías de la columna vertebral (tales como deformidades, traumatismos, cambios inflamatorios o degenerativos, malformaciones o tumores) que pueden debilitar las uniones vertebrales y/o alterar la mecánica y la estabilidad de la columna, lo que puede ocasionar una carga inapropiada del peso con sobrecarga de las articulaciones, y ser causa de cuadros dolorosos importantes. Dado que no existen sustitutos para ligamentos o articulaciones, lo que se puede hacer en estos casos es fijar las vértebras entre sí (son las cirugías de fusión). La fusión es una técnica quirúrgica en la que una o más vértebras se unen, «se fusionan», de modo que ya no se produce movimiento entre ellas5,6.
Hay muchos métodos para conseguir esta fusión y todos implican el siguiente proceso: a) utilizar un injerto óseo en un segmento de la columna vertebral; b) que se establezca una respuesta biológica que haga que el injerto crezca entre los dos elementos vertebrales para crear una fusión ósea, y c) obtener una fusión ósea que detenga el movimiento en ese segmento, lo que se traduce en que un nuevo hueso fijo reemplaza una articulación móvil.
Con este fin se utilizan varios tipos de injertos óseos (autoinjertos o aloinjertos) y también pueden emplearse factores estimulantes, como por ejemplo la proteína morfogenética ósea, para estimular la fusión ósea7. En los últimos años se han empezado a publicar artículos relacionados con las complicaciones asociadas al uso de esta proteína8.
Estos procedimientos de fusión espinal no sueldan las vértebras inmediatamente durante la cirugía. Antiguamente la estabilización necesaria para que se produjera la fusión se lograba con soportes o con reposo en cama7; con posterioridad, para mejorar los malos resultados quirúrgicos se diseñó la fusión instrumentada, que consiste en la utilización de diferentes tipos de implantes (de titanio, de acero inoxidable o no metálicos) que proporcionan una inmovilización inmediata en el segmento que se quiere fusionar, con lo que aumenta, teóricamente, la probabilidad de éxito de fusión8. Por este motivo, además del injerto óseo se pueden usar distintos tipos de dispositivos que mantienen unidas las vértebras entre sí para que se produzca una unidad sólida.
Un concepto esencial es que la instrumentación no reemplaza la fusión ósea fisiológica, solo proporciona una inmovilidad segmentaria durante el periodo en el que se produce la verdadera fusión ósea, y no está diseñada para proporcionar la inmovilidad segmentaria más allá de este período8.
Aunque en el mercado hay múltiples dispositivos y en el artículo de Ha et al.6 aparecen bien esquematizados, básicamente y de forma muy simplificada se puede resumir que la instrumentación para conseguir una fusión consiste en espaciadores intersomáticos, tornillos transpediculares, barras de fijación y placas9.
Los dispositivos intersomáticos aumentan la altura del espacio que hay entre dos cuerpos vertebrales; de esta forma se incrementa el tamaño del foramen de conjunción mediante la separación de los pedículos y el área del canal por la tracción de los ligamentos hipertrofiados9. En el mercado los hay de diferentes materiales y morfologías, pero básicamente consisten en un dispositivo poroso hueco (por eso a veces se les denomina cajas, cajetines o jaulas) dentro del cual se coloca injerto óseo para que se produzca una fusión desde un cuerpo vertebral a través del dispositivo hasta el siguiente cuerpo vertebral. El espaciador está correctamente colocado cuando su parte más posterior se encuentra 2mm por delante del borde posterior de los cuerpos vertebrales adyacentes10.
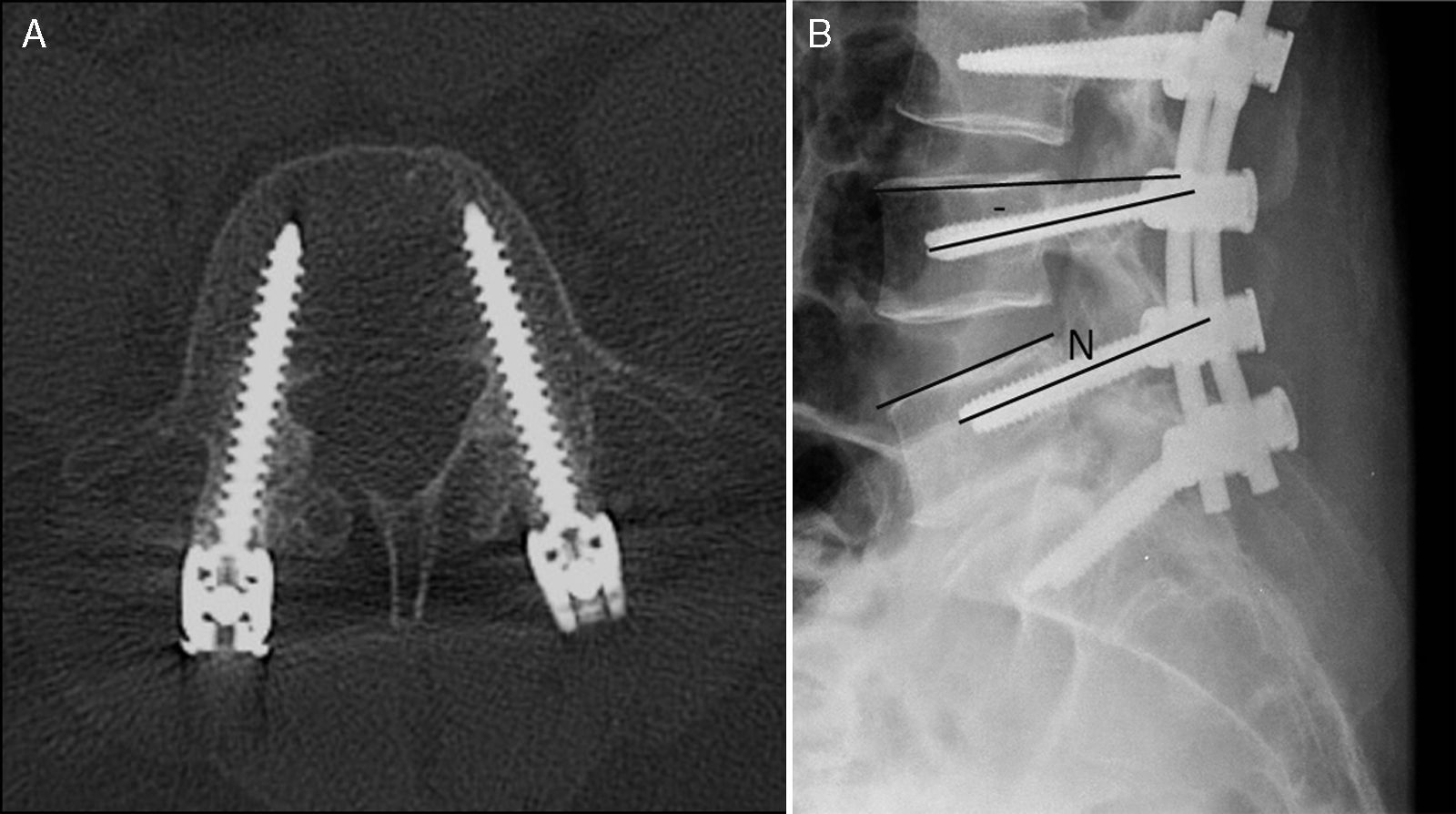
Los tornillos transpediculares son unos tornillos que generalmente se colocan en varios segmentos vertebrales y dos barras que los anclan. En el plano axial, el tornillo tiene que atravesar la parte central del pedículo y dirigirse anteromedialmente sin llegar a atravesar la cortical anterior del cuerpo vertebral. En el plano sagital su posición óptima es paralela a la placa terminal4 (fig. 1).
Posición normal de los tornillos transpediculares. A) En el plano axial, los tornillos atraviesan el pedículo y se dirigen anteromedialmente sin atravesar la cortical anterior. B) En el plano sagital, los tornillos tienen que ser paralelos al platillo; si se dirigen inferiormente es una disposición negativa (–), y si lo hacen superiormente es una disposición positiva (+).
Las placas de fijación pueden ser anteriores (se colocan en la cara anterior de los cuerpos vertebrales y se fijan con tornillos a través de la placa en los cuerpos vertebrales superior e inferior al segmento fusionado) o posteriores (se colocan posteriormente a ambos lados de la columna y se anclan mediante tornillos a la masa lateral o pilar articular).
Otra forma de fijación es la fusión posterolateral, que consiste en la colocación de injerto óseo para que se formen puentes óseos entre las apófisis transversas. Esto permitirá que el hueso de la apófisis transversa de una vértebra se fusione con la apófisis transversa de la vértebra siguiente.
Técnicas de imagenEn los controles de las fusiones espinales se deben evaluar siempre los estudios de imagen prequirúrgicos4. Las radiografías basales son esenciales para la evaluación de la posición del implante y del injerto óseo y sirven como punto de partida para su control en los estudios evolutivos. Las radiografías son coste-efectivas y accesibles, lo que combinado con su capacidad para obtener información posicional con dosis relativamente bajas de radiación, en comparación con la de la tomografía computarizada (TC), las convierte en una herramienta indispensable para la evaluación de la columna vertebral posoperatoria11.
En la actualidad, la TC con reconstrucciones multiplanares se considera la técnica de elección para obtener imágenes de detalle óseo, para la valoración de la formación ósea y de la posición del implante a pesar de los artefactos provocados por el material metálico. La resonancia magnética (RM) tiene un papel más limitado en la evaluación de la fusión11.
Hallazgos radiológicos normalesLa evaluación inicial de la columna vertebral debe incluir una descripción detallada del tipo de instrumentación y su posición exacta dentro de la columna vertebral4.
La fusión radiológicamente sólida se produce de manera característica de 6 a 9 meses después de la cirugía. Ray12 define seis criterios para verificar una fusión sólida radiográficamente (tabla 1).
Criterios de Ray de fusión espinal12
| 1. Menos de 3 grados de variación intervertebral en la radiografía lateral en flexión y extensión |
| 2. Ausencia de áreas radiolucentes alrededor de los implantes |
| 3. Mínima pérdida de altura discal |
| 4. Ausencia de fractura vertebral o de los injertos |
| 5. Ausencia de cambios escleróticos alrededor de los injertos o en las vértebras adyacentes |
| 6. Formación de hueso visible en o alrededor del injerto |
En los implantes o espaciadores intersomáticos la formación de puentes óseos trabeculares es un marcador de fusión9. Los puentes óseos a menudo se forman primero fuera del implante intersomático. La trabeculación ósea central discontinua en el interior del espaciador intersomático o la mala alineación de estas trabeculaciones sugieren movimiento, retardo en la unión y posible formación de seudoartrosis temprana. La ausencia de trabeculación ósea madura cruzando el espacio intersomático a los 24 meses traduce un fallo de la fusión4,9.
La fusión posterolateral comienza como un conglomerado de fragmentos óseos que se colocan entre las apófisis transversas y adyacentes a las articulaciones facetarias; con el tiempo, los fragmentos de hueso empiezan a fusionarse en un puente óseo sólido entre las facetas y las apófisis transversas. Si esto no se produce en un plazo de 24 meses o si se observa una discontinuidad en los puentes óseos, significa que se ha producido un fallo o una fusión incompleta9.
Complicaciones de las técnicas de fusiónComplicaciones relacionadas con la instrumentaciónDebe valorarse la integridad del material quirúrgico, su posición (si es similar a la posición posquirúrgica o si se ha movilizado) y fracturas óseas8.
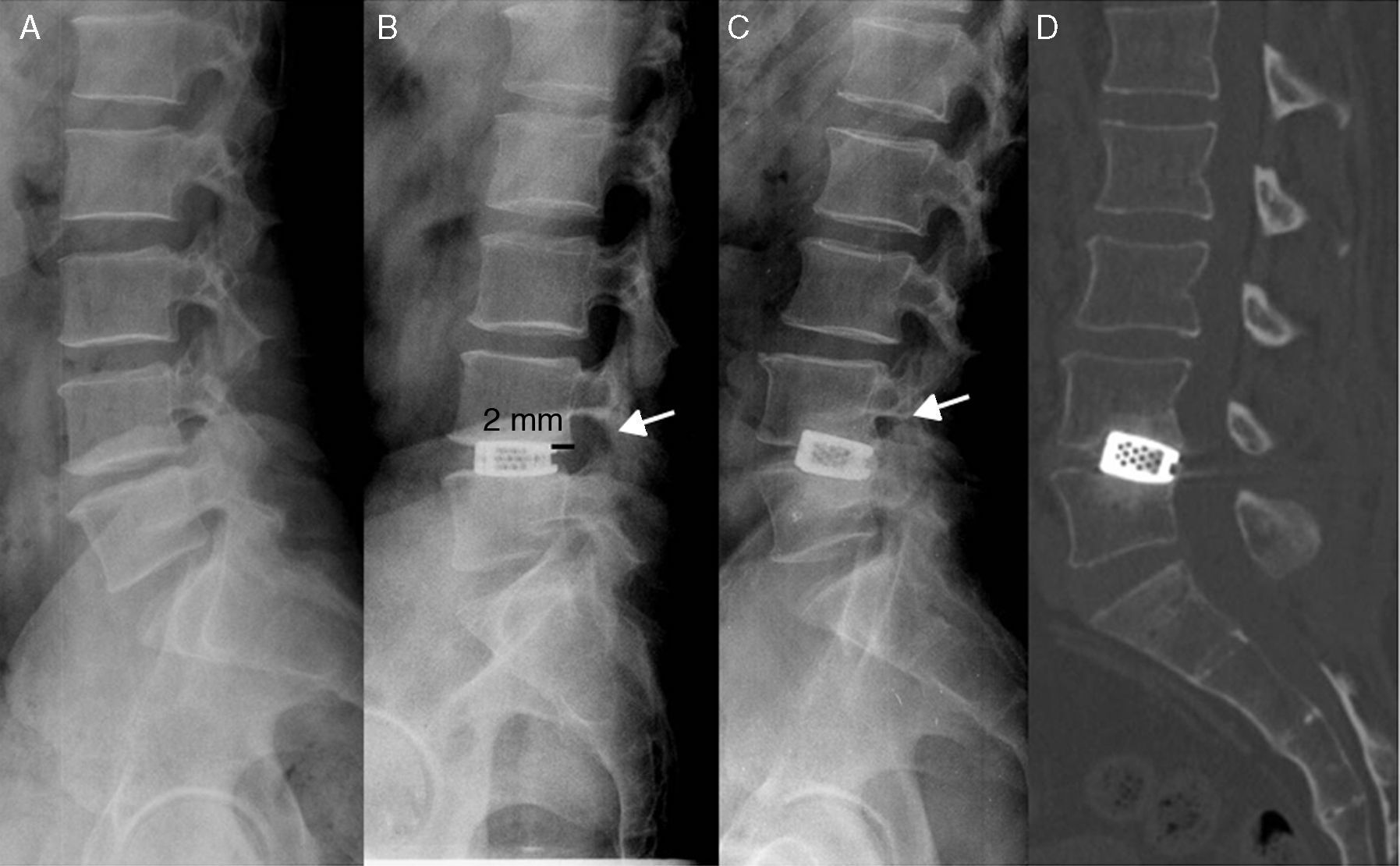
Complicaciones de los implantes intersomáticosEl hundimiento es la migración de la caja de fusión intersomática a través de la placa terminal ósea (mayor de 3mm), lo que produce la pérdida de altura entre los cuerpos, establecida quirúrgicamente, y de forma secundaria el estrechamiento del foramen (fig. 2), que a su vez puede producir síntomas radiculares4.
A) Radiografía prequirúrgica. B) Radiografía en el posquirúrgico inmediato, donde se ha colocado un implante intersomático, que debe estar colocado al menos a 2mm del muro posterior. Obsérvese cómo ha aumentado de tamaño el foramen de conjunción (flecha). C) Un año después el paciente comienza de nuevo con clínica radicular, y en la radiografía se evidencia un hundimiento del implante en los platillos (mayor de 3mm), con disminución nuevamente del tamaño del foramen de conjunción (flecha). D) En la TC no se identifican puentes óseos.
En el pasado, el hundimiento era más difícil de detectar con los espaciadores de acero inoxidable que producían mucho artefacto y, además, debido a su rigidez eran más propensos a provocar hundimientos; estos espaciadores han sido reemplazados por otros de titanio bioactivo y por implantes sintéticos, que tienen unas propiedades biomecánicas más similares a las de la cortical del hueso y generan poco artefacto en las imágenes9.
Complicaciones de los tornillos transpedicularesLas principales complicaciones incluyen la malposición, la osteólisis rodeando al tornillo, la rotura del tornillo o la fractura del hueso sobre el que asienta.
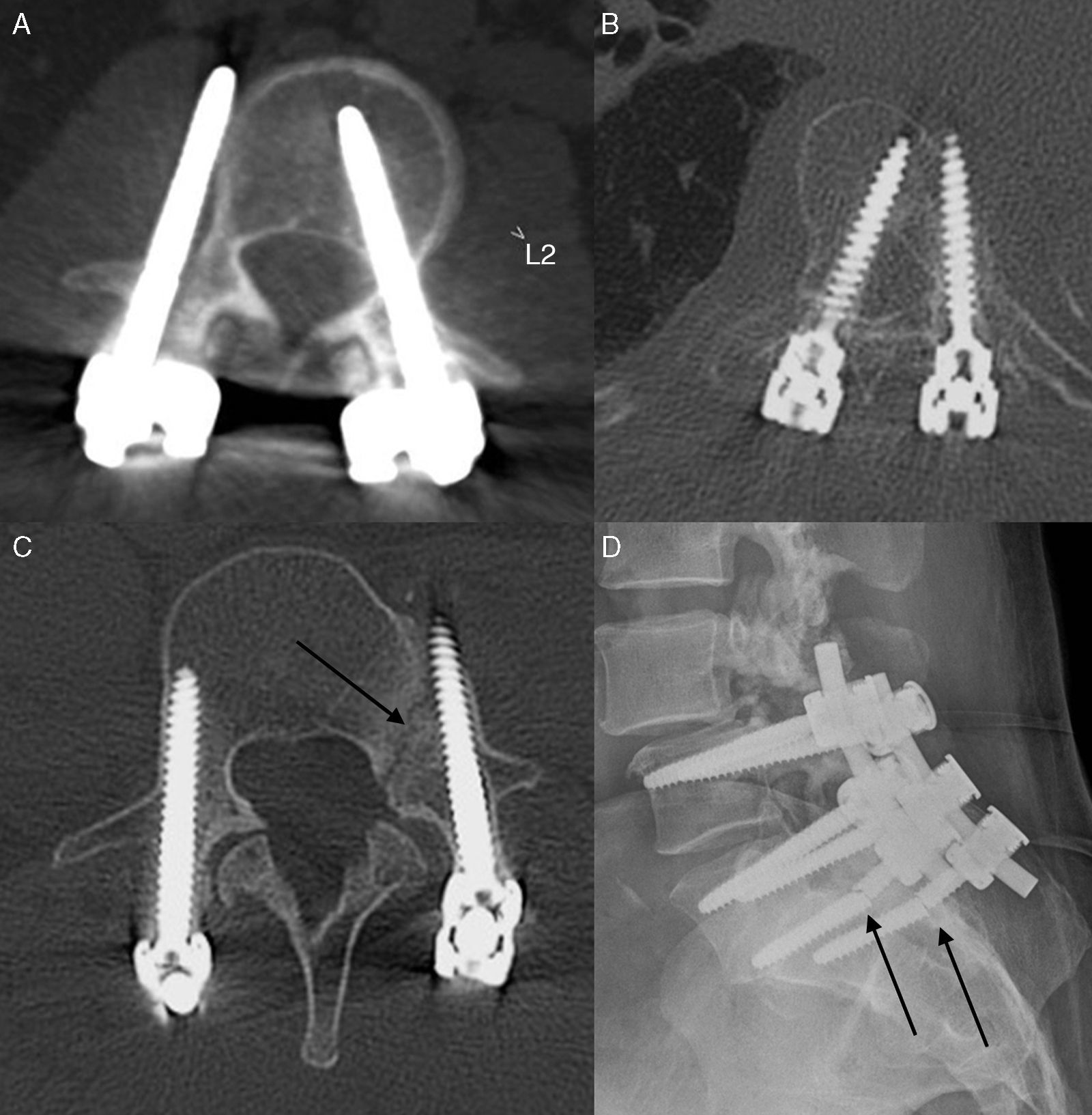
La más frecuente es la malposición del tornillo (fig. 3). La desviación medial del tornillo puede conducir a la interrupción de la cortical medial del pedículo e irritar la raíz nerviosa, que ocurre en el 1% de los casos11,13. La desviación lateral es especialmente importante en la columna cervical, donde el tornillo puede atravesar el agujero transverso y potencialmente comprometer la arteria vertebral. La colocación incorrecta también puede producir que los tornillos atraviesen la cortical anterior del cuerpo vertebral y llegar a contactar con los tejidos blandos adyacentes e incluso con la aorta4.
En los controles evolutivos no debe haber nunca un halo radiolucente mayor de 2mm o cambios quísticos adyacentes al material de instrumentación9. Esta radiolucencia puede traducir reacción a la proteína morfogenética ósea, infección o movimiento de la instrumentación en la interfase hueso-implante, y refleja una osteólisis que permite cierto grado de movimiento del implante en el hueso, lo que conduce a un ciclo de retroalimentación positiva con resorción progresiva y aumento del movimiento (fig. 3), que eventualmente lleva al fracaso completo del implante con rotura del tornillo.
Estos hallazgos pueden ser sutiles y pueden ser mal interpretados como artefacto del endurecimiento del haz. Existen estrategias que pueden disminuir el artefacto metálico para mejorar la detección de estas radiolucencias9: a) estrategias durante la adquisición: aumentar el kilovoltaje y/o el miliamperaje, colimar bien el estudio y adquirir cortes finos y b) estrategias de reconstrucción: reconstruir con espesores de cortes gruesos y con valores de kernel bajos11.
También es posible disminuir significativamente los artefactos metálicos mediante las reconstrucciones monoenergéticas de TC con energía dual14.
La rotura de los implantes generalmente se produce por fatiga del metal producida por estrés repetitivo de los movimientos espinales11.
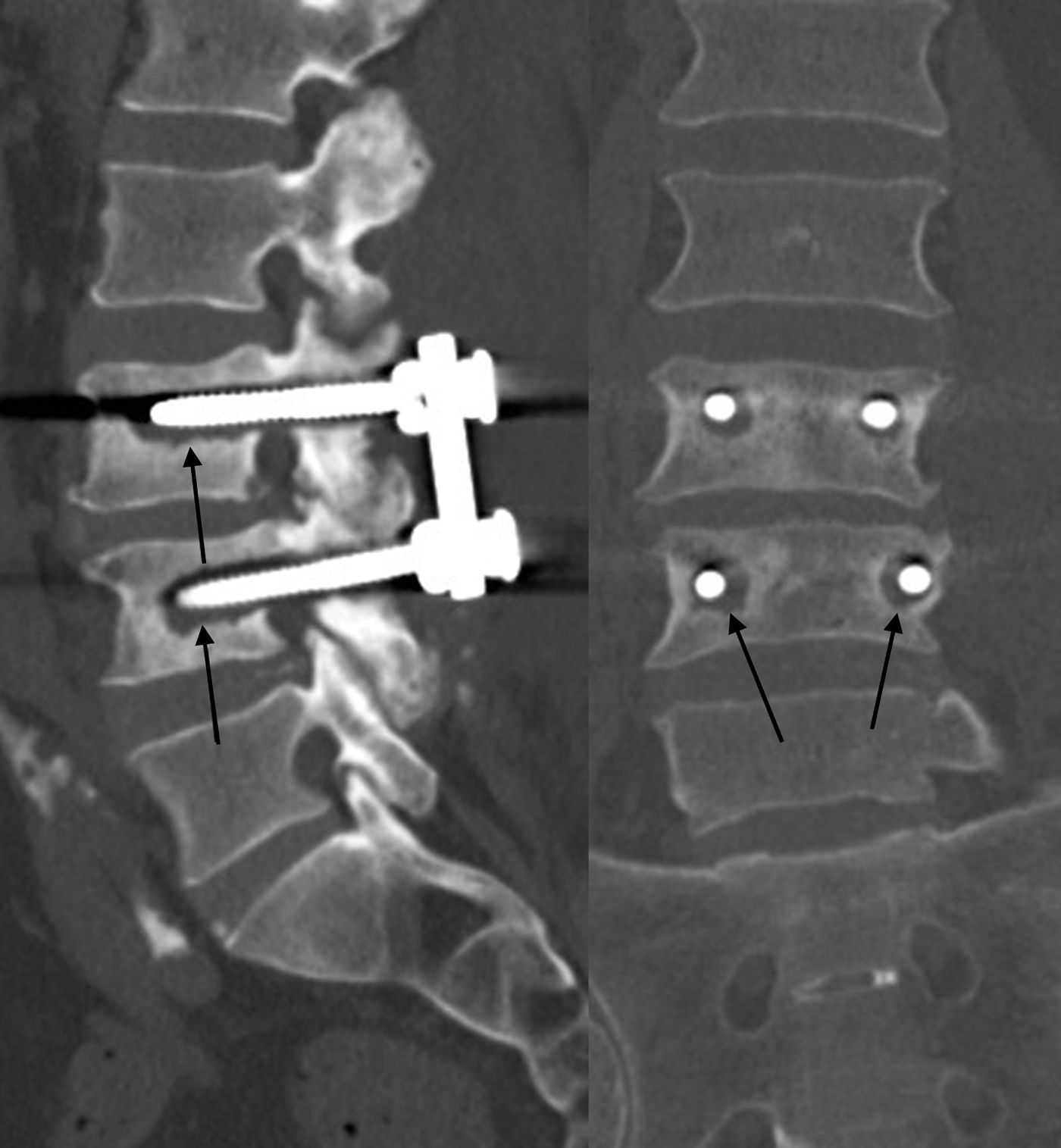
Además, se puede producir una fractura del hueso sobre el que asienta el tornillo; se puede fracturar el pedículo durante la cirugía o también se puede fracturar el hueso sobre el que asienta el tornillo si su malposición supone una alteración de la biomecánica que se traduzca en una reacción o incluso en una fractura de estrés (fig. 4).
A) El tornillo transpedicular derecho está desplazado lateralmente, lo cual puede lesionar la raíz. B) El tornillo derecho está desplazado medialmente, y eso puede rasgar la dura y lesionar la médula; el izquierdo sobrepasa la cortical anterior, contacta con los tejidos blandos anteriores y podría lesionarlos. C) Fractura del pedículo izquierdo en un tornillo mal posicionado, ya que está lateralizado y atravesando la cortical anterior. D) Rotura de los tornillos transpediculares.
Las posibles complicaciones que pueden aparecer son las siguientes: que la placa o que los tornillos estén mal posicionados, introduciéndose bien en el espacio discal bien en la apófisis transversa (lo que puede afectar a la arteria vertebral) o que los tornillos penetren más de lo debido, lo que puede causar una lesión en la parte posterior (la duramadre, la médula o la raíz nerviosa)4.
Complicaciones de la proteína morfogenética óseaEn los últimos años se han empezado a publicar artículos relacionados con las complicaciones asociadas al uso de la proteína morfogenética ósea15.
Enfermedad del segmento adyacenteDespués de la fusión espinal, los segmentos de la columna vertebral craneal y caudal a la columna fusionada tienen un mayor riesgo de degeneración acelerada debido a un cambio en la carga que soporta el peso que pasa de los segmentos fusionados a las vértebras4. Es la denominada enfermedad del segmento adyacente, que es más común en la columna lumbar y con mayor frecuencia craneal a la fusión, ya que la columna superior hace palanca contra el segmento fusionado.
Cirugías descompresivasTécnicas de imagenLa radiografía simple y la TC sin contraste únicamente son útiles para valorar el grado de laminectomía o discectomía. La TC con contraste intravenoso podría ayudar a diferenciar fibrosis posquirúrgica de recidiva herniaria.
Sin embargo, la RM, con contrate intravenoso y sin él, es la técnica de elección para su diagnóstico, por su gran resolución espacial y de contraste.
Hallazgos radiológicos normalesEs normal después de una laminectomía ver una disrupción de los márgenes de los músculos paraespinales y edema de partes blandas adyacentes, así como una protrusión del saco tecal por el defecto óseo, que desaparecerá progresivamente4.
Además, en el periodo inicial (primeras 6 semanas), los cambios tras la discectomía pueden simular una recidiva herniaria o un resto discal, ya que se produce una disrupción del anillo fibroso y edema en el espacio epidural anterior, que irán disminuyendo con el tiempo (6 meses)4.
También puede observarse realce de los platillos vertebrales y edema en un 19% de los pacientes entre los 6-18 meses siguientes8 o realce de las raíces nerviosas lumbares durante las primeras 6 semanas hasta en un 20% de los pacientes, porcentaje que se reduce al 2% a los 6 meses en los pacientes asintomáticos16.
Complicaciones de las cirugías descompresivasFibrosis periduralEs la formación de tejido cicatricial en el espacio epidural tras la cirugía, que puede condicionar irritación, compresión y tracción sobre las estructuras nerviosas adyacentes16.
Como se ha comentado antes, en el posoperatorio inmediato puede aparecer, hasta en un 80% de los pacientes, una masa de partes blandas con efecto de masa, que muestra un aspecto similar a la hernia discal prequirúrgica, pero con el paso del tiempo se hace menos prominente, y puede o no convertirse en fibrosis epidural.
Aunque la fibrosis epidural está presente hasta en el 24% de los pacientes con síndrome de la cirugía fallida, la relación entre la fibrosis epidural y el dolor persistente radicular es controvertida. Hay estudios que han demostrado que los pacientes con extensa fibrosis epidural tienen 3,2 veces mayor probabilidad de desarrollar dolor radicular recurrente, aunque no está del todo claro porque por otra parte existen otros estudios que no demuestran esa asociación16.
Cuando la fibrosis posquirúrgica está establecida no existe tratamiento clínico ni quirúrgico efectivo. Por ello, existe una gran preocupación por la búsqueda de diferentes técnicas que eviten su formación; se ha usado para ello grasa autóloga, materiales sintéticos como el politetrafluoroetileno, antiinflamatorios no esteroideos y mitomicina16.
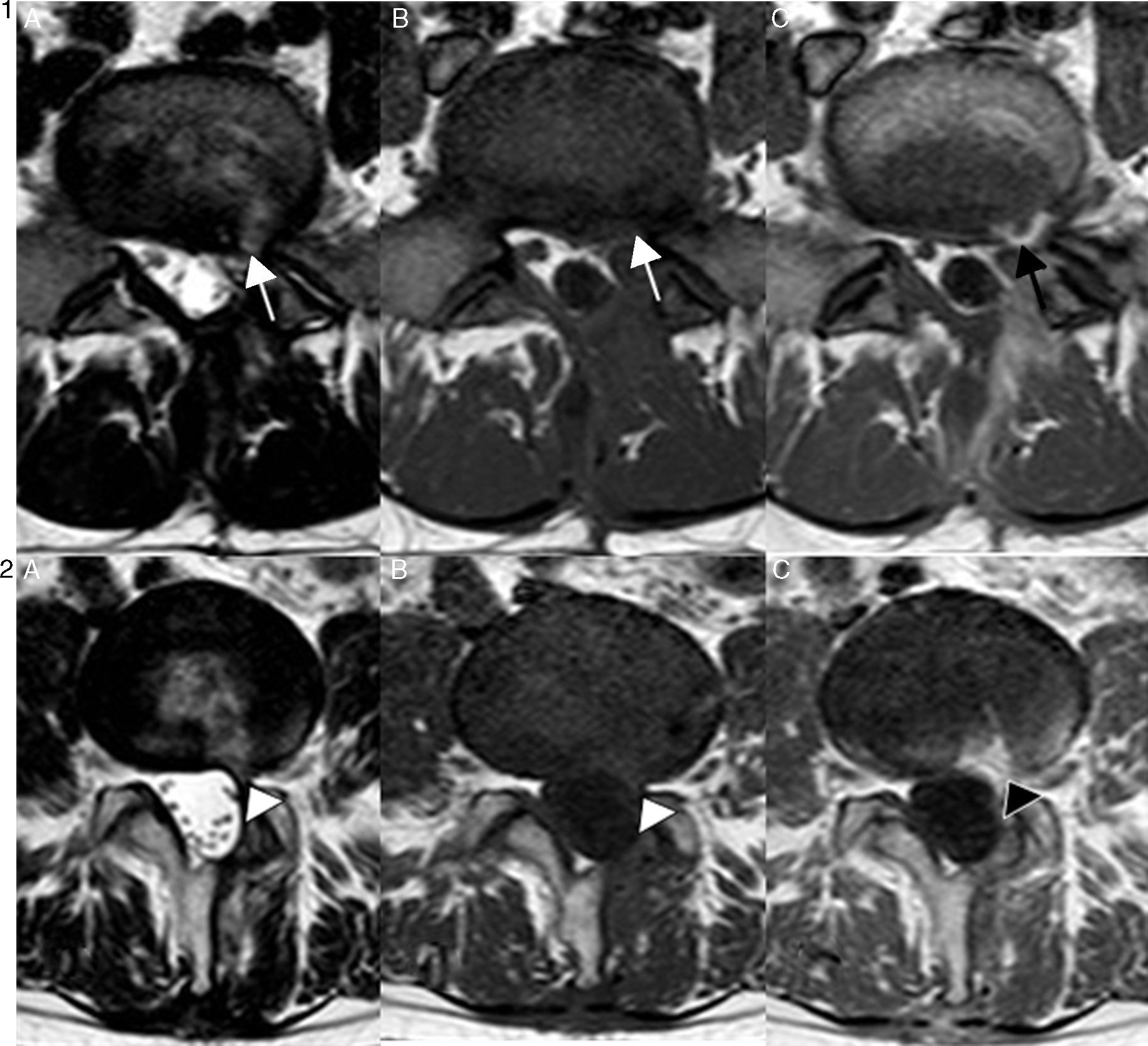
El diagnóstico diferencial de la fibrosis epidural se lleva a cabo con la recurrencia de la hernia discal (fig. 5). En la TC, la fibrosis muestra una densidad menor, entre 50 y 75 unidades Hounsfield (UH), mientras que la recidiva presenta entre 90 y 120 UH. La técnica de elección para su correcto diagnóstico es la RM con contraste, con una sensibilidad del 96%, que aumenta si se realizan secuencias T1 con saturación grasa, visualizando una masa de partes blandas infiltrativa en el espacio epidural anterior, isointensa en secuencias T1 y variable en T2, con realce difuso y homogéneo tras la administración de contraste, que puede asociar un engrosamiento de la raíz nerviosa adyacente. La recidiva herniaria, sin embargo, presenta un realce precoz periférico y central tardío8.
Recidiva herniaria (1) y fibrosis posquirúrgica (2) en pacientes con hemilaminectomía izquierda y discectomía en L5-S1 y L4-L5, respectivamente. Secuencias T2 axial (A), secuencias T1 axial sin y con contraste (B y C). En ambos pacientes se aprecia una masa de partes blandas que oblitera el espacio epidural anterior en localización paracentral izquierda (flechas y punta de flecha blanca). El diagnóstico diferencial se basa en la secuencia con contraste, donde se aprecia un realce periférico en el caso de la recidiva herniaria (flecha negra) y un realce difuso en la fibrosis posquirúrgica (punta de flecha negra).
Existen diferentes métodos para cuantificar el grado de fibrosis usando las imágenes de RM. El más conocido es el de Ross et al.17, que divide el canal espinal en cuatro cuadrantes, calcula el porcentaje que hay en cada uno de ellos y establece un valor final conjunto del grado de fibrosis, aunque recientemente se han descrito modificaciones al mismo, que tienen mayor precisión18.
Hernia discal recurrenteLa recidiva herniaria es la complicación más frecuente tras la discectomía y justifica la recidiva del dolor lumbar en un 7-12% de los casos8.
Se define como la presencia de una hernia discal en el mismo nivel donde asentaba antes de la cirugía, y puede ser ipsilateral o contralateral a la previamente diagnosticada. Desde el punto de vista clínico se presenta como dolor lumbar y/o del miembro inferior, que aparece nuevamente tras un intervalo libre de dolor.
Aunque el diagnóstico puede hacerse con TC sin y con contraste, la precisión de la RM sin y con contraste es mayor (71% y 79% frente a 96% y 100%). Por ello, la técnica de elección para su diagnóstico es la RM con contraste con supresión grasa11.
La recidiva herniaria se presenta como una masa de partes blandas en el espacio epidural anterior, isointensa en T1 e hiperintensa en T2, que presenta un realce periférico por el tejido de granulación o dilatación del plexo epidural adyacente. Hay que tener en cuenta que puede aparecer realce difuso en fases tardías (20-30min tras la inyección de contraste) por difusión del contraste al disco desde la cicatriz o tejido de granulación adyacente.
Complicaciones comunes a los distintos tipos de cirugía de columnaInfección posquirúrgicaLa infección posquirúrgica de la columna engloba a la osteomielitis vertebral, la discitis y el absceso epidural19. La incidencia es del 1% tras discectomía, pero el riesgo aumenta hasta el 0,7-12% si existe instrumentación o factores predisponentes (diabetes mellitus, fallo renal, estados de inmunodepresión o adictos a drogas por vía parenteral)16; Staphylococcus aureus es el agente etiológico más frecuentemente implicado20.
Puede ocurrir en el posoperatorio inmediato o ser una complicación tardía, que aparece principalmente en columnas instrumentadas. Cuando sucede en el posoperatorio inmediato suele ser por contaminación directa, mientras que la infección tardía suele ser secundaria a diseminación hematógena.
El diagnóstico de la infección posquirúrgica se basa en la combinación de hallazgos clínicos, de laboratorio y radiológicos. Generalmente, los síntomas son inespecíficos, con dolor y limitación del movimiento, y en la analítica se produce un aumento de la proteína C reactiva21.
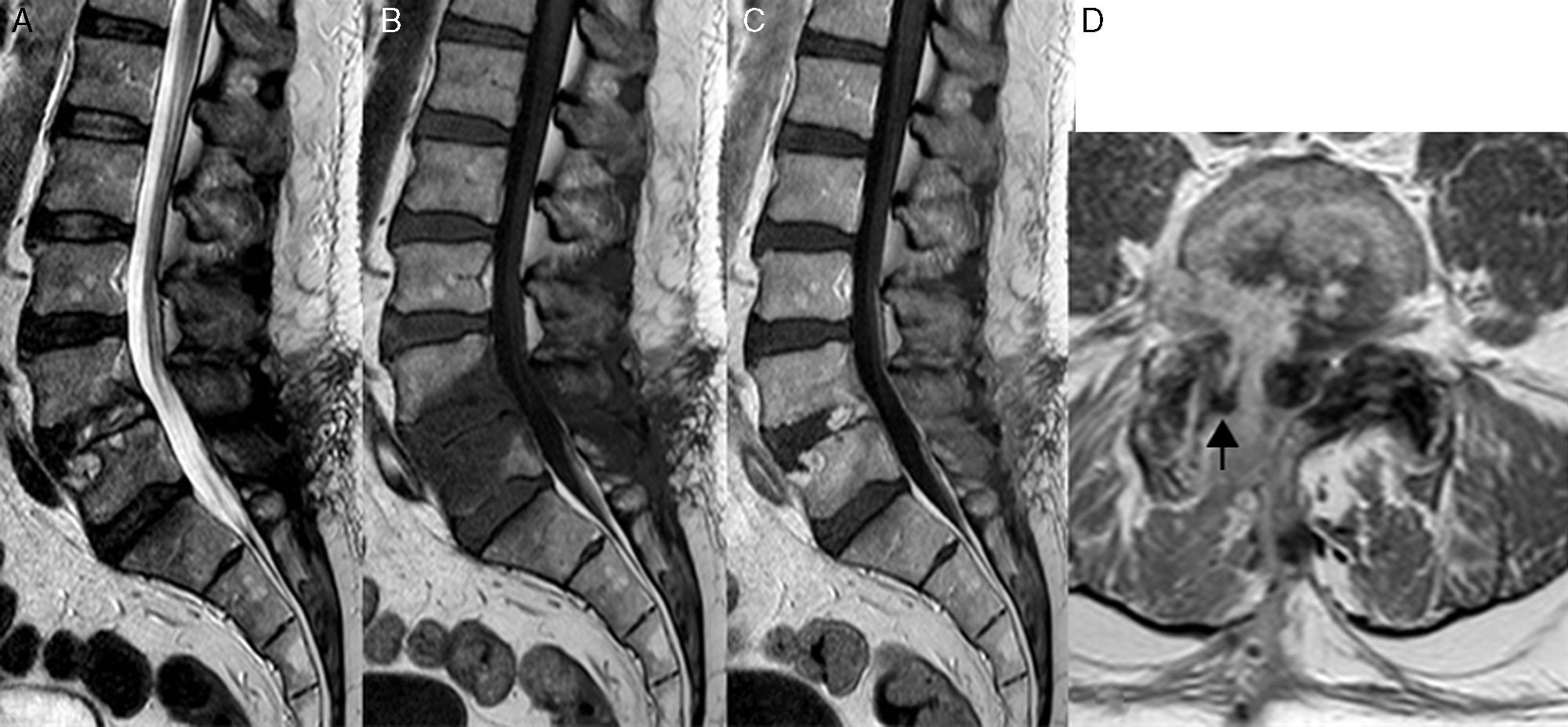
Los signos clásicos sugestivos de discitis/osteomielitis en la radiografía y en la TC incluyen la pérdida de altura del espacio intervertebral, erosiones de los platillos vertebrales adyacentes y destrucción del cuerpo vertebral, que se aprecia en estadios tardíos. Por ello, el estudio de elección para valorar la infección es la RM22, donde se puede apreciar la irregularidad y/o erosión de los platillos vertebrales con hiposeñal en secuencias T1 e hiperseñal en secuencias T2 (especialmente útil con saturación grasa) y STIR del espacio intervertebral y de los cuerpos vertebrales adyacentes, con realce de los mismos tras la administración de contraste, ya desde las fases iniciales (fig. 6). Sin embargo, esta hiperseñal del disco y de los platillos en secuencias T2 y el realce con contraste, también puede verse, secundaria a cambios posquirúrgicos, en pacientes asintomáticos; por tanto, hay que tener en cuenta que, en general, el realce periférico del remanente discal sin realce de los platillos vertebrales es sugestivo de infección, mientras que el realce lineal paralelo a los platillos vertebrales suele ser un cambio posquirúrgico. Además, en los pacientes con infección existe restricción a la difusión del disco intervertebral y de los platillos intervertebrales. El diagnóstico diferencial no siempre es fácil, por lo que es importante correlacionarlo con la clínica y hallazgos de laboratorio y, en casos dudosos, puede ser necesario aspiración percutánea o biopsia16.
Espondilodiscitis L4-L5 con pequeño absceso en la articulación facetaria derecha. Las secuencias T2 (A) y T1 sin y con contraste (B y C), plano sagital, muestran erosión e irregularidad del platillo vertebral superior de L5 y captación del disco, en su parte posterior, y de los cuerpos vertebrales L4 y L5. En el plano axial, en la secuencia T1 con contraste (D) se visualiza un realce difuso en el espacio epidural anterior y foraminal derecho, y pequeño absceso en la articulación facetaría derecha con realce periférico (flecha).
El absceso epidural se presenta como una colección hipointensa en secuencias T1 e hiperintensa en secuencias T2 con realce en anillo y que restringe en la secuencia de difusión. Cuando existe un absceso epidural o paraespinal es altamente sugestivo de espondilodiscitis8.
AracnoiditisAparece en un 6-16% de los pacientes operados y su etiología es controvertida. Influyen el propio procedimiento quirúrgico, la circulación intratecal, la infección posquirúrgica, el uso previo de contraste mielográfico o anestésicos intraespinales, y el uso de agentes quimioterápicos y antiinflamatorios16.
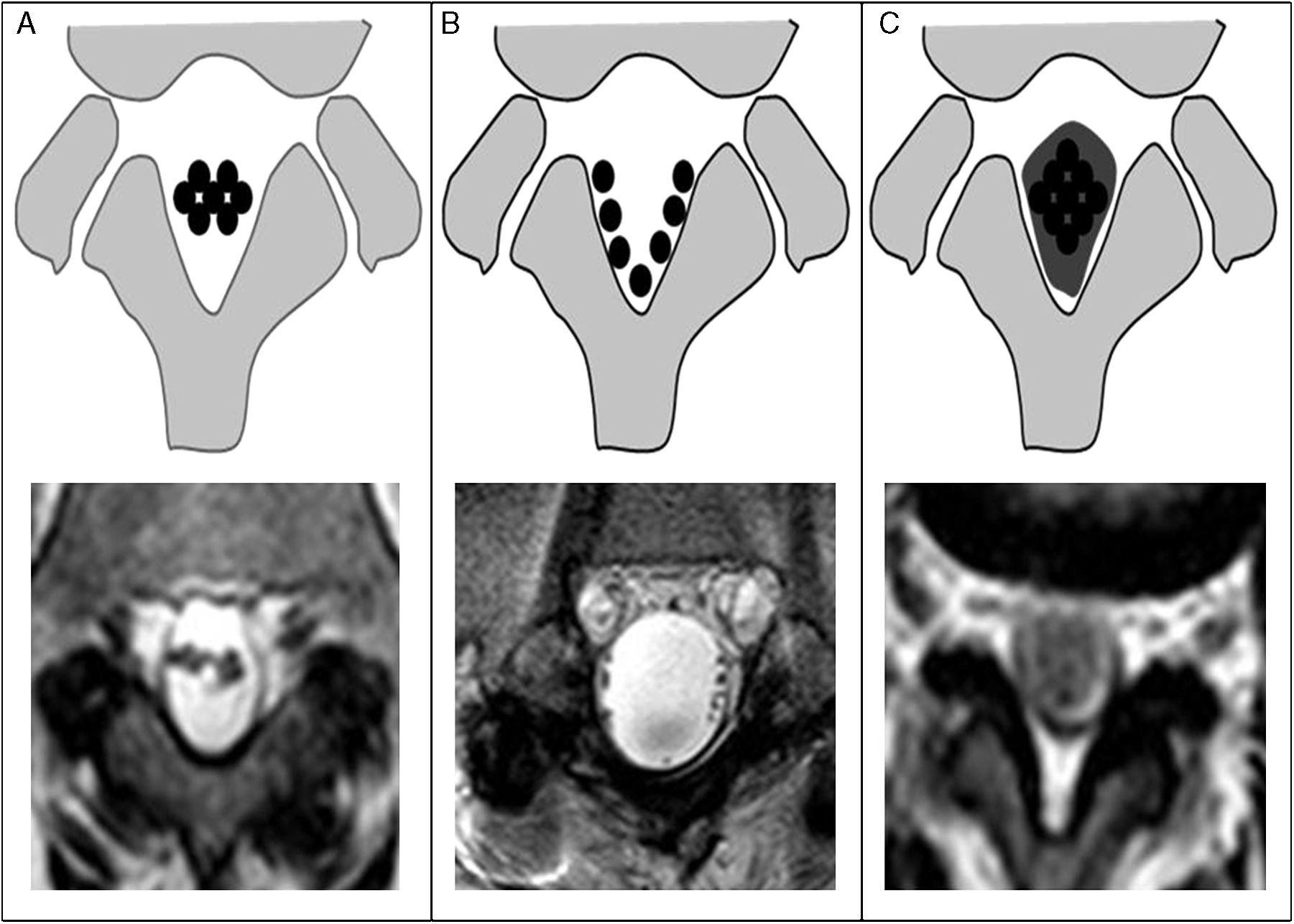
La técnica de elección para su estudio es la RM, y la mejor secuencia para caracterizarla es la T2 FSE axial. Hay tres patrones de presentación (fig. 7):
- •
Tipo 1: conglomerado central de raíces nerviosas, lo que sugiere una afectación leve.
- •
Tipo 2: se conoce como el signo del «saco vacío», ya que las raíces se sitúan en la periferia del saco tecal y corresponde con una afectación moderada, y
- •
Tipo 3: se observa una masa de atenuación intermedia que oblitera el espacio subaracnoideo por debajo del cono medular, lo que representa la afectación más grave8.
Esquema con sus respectivos ejemplos en RM de los tres tipos de aracnoiditis: tipo 1 (A): conglomerado central de las raíces nerviosas; tipo 2 (B): raíces nerviosas adheridas a la periferia dando aspecto de «saco vacío»; tipo 3 (C): conglomerado de partes blandas que oblitera el espacio subaracnoideo.
Pero hay que tener en cuenta que también puede verse un conglomerado central reversible de las raíces de la cola de caballo tras laminectomías lumbares. Matsui et al.23 encontraron adherencias de la cola de caballo en RM, en el posoperatorio inmediato, que se resolvían espontáneamente entre 1 y 6 semanas después la cirugía.
El patrón de realce de la aracnoiditis tras la administración de contraste intravenoso es variable: ausencia de captación, realce mínimo o fuerte.
Complicaciones de los tejidos blandosEn todos los tipos de cirugía de columna es importante evaluar los tejidos blandos del campo quirúrgico. En la columna cervical, un abordaje anterior se asocia con riesgo de lesiones en el esófago, la tráquea, los pulmones y las arterias carótidas. Del mismo modo, el uso de un enfoque anterior en la columna torácica o lumbar puede comprometer la aorta, la vena cava inferior, y estructuras abdominales o pélvicas4.
La instrumentación también puede desprenderse, retirarse y afectar a las estructuras y tejidos blandos adyacentes. Posteriormente, puede conducir a la ulceración crónica de los tejidos blandos y a subsiguientes infecciones4.
El material quirúrgico textil accidentalmente olvidado en la herida quirúrgica puede convertirse en un textiloma. Este material suele contener un marcador radiopaco fácilmente reconocible mediante radiografía y TC. En estudios de RM, este marcador no es valorable, ya que se trata de un filamento de sulfato bárico, que no es paramagnético. En las secuencias T2, estas lesiones son hipointensas con reacción periférica de cuerpo extraño y, tras la administración de contraste, presentan captación del tejido inflamatorio periférico8.
Colecciones líquidas posquirúrgicasLas colecciones líquidas posquirúrgicas se corresponden con hematomas, seudomeningoceles y seromas posquirúrgicos4.
El seudomeningocele es una complicación posquirúrgica secundaria a una dehiscencia dural iatrogénica. Consiste en un seudoquiste, sin revestimiento meníngeo, que afecta al 0,19-2% de los pacientes tras una laminectomía lumbar. Su tamaño puede variar desde 1cm hasta 10cm. Cuando son pequeños pueden regresar espontáneamente, mientras que los de gran tamaño suelen requerir cirugía para cerrarlos y pueden asociar cefalea por hipotensión intracraneal. En la RM se comportan como una lesión quística, isointensa con el líquido cefalorraquídeo (LCR) en todas las secuencias de pulso. En T2 puede identificarse la comunicación con el saco tecal como un área de menor intensidad de señal condicionada por el artefacto de flujo debido al movimiento del LCR a su través. Tras la administración de contraste es posible observar un realce periférico fino, y si el realce es mayor debe descartarse que el seudomeningocele se encuentre infectado. Si es grande y presenta extensión subcutánea, puede ser necesario ampliar la ventana en la RM para evitar el artefacto y la mala homogeneidad que produce la antena de superficie8.
ConclusionesLa evaluación de la columna vertebral posoperatoria es una tarea compleja que requiere un enfoque detallado por el radiólogo y generalmente que combine diferentes técnicas radiológicas conociendo la clínica, el tiempo transcurrido desde la cirugía e incluso en algunas ocasiones la técnica quirúrgica.
En las técnicas de fusión de la columna vertebral hay que evaluar el grado de fusión ósea, el material de instrumentación (tanto su posición como su integridad), el hueso sobre el que asienta, la interfase entre el implante y el hueso y los segmentos vertebrales que se encuentran adyacentes a la columna instrumentada. Las radiografías seriadas son de gran utilidad, y en caso de ser necesario, la TC es la técnica de elección para la valoración de la formación ósea y de la posición del implante.
Un gran reto diagnóstico es diferenciar la fibrosis posquirúrgica de la recidiva herniaria. Las técnicas de imagen como la RM o la TC son muy útiles, aunque muchas veces el diagnóstico diferencial es difícil, especialmente con TC pese a la inyección de contraste intravenoso.
Finalmente, hay que descartar la infección, a pesar de no ser una complicación frecuente, ya que su diagnóstico precoz es decisivo para su adecuado manejo. Puede ser diagnosticada, en la mayor parte de los pacientes, en el estudio de RM.
Autoría- 1.
Responsable de la integridad del estudio: ES, RP y NS.
- 2.
Concepción del estudio: ES, RP y NS.
- 3.
Diseño del estudio: ES, RP y NS.
- 4.
Obtención de los datos: ES, RP y NS.
- 5.
Análisis e interpretación de los datos: ES, RP y NS.
- 6.
Tratamiento estadístico: NA.
- 7.
Búsqueda bibliográfica: ES, RP y NS.
- 8.
Redacción del trabajo: ES, RP y NS.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ES, RP y NS.
- 10.
Aprobación de la versión final: ES, RP y NS.
Las autoras declaran no tener ningún conflicto de intereses relacionados con este artículo.