A pesar de que el diagnóstico inicial de la enfermedad pleuro-pulmonar y el seguimiento habitual de los pacientes se hace con una radiografía simple de tórax, y que el estándar de referencia para estudiar la enfermedad torácica es la tomografía computarizada, diversos estudios han establecido la utilidad de la ecografía torácica para diagnosticar distintas enfermedades pleuro-pulmonares como el derrame pleural y la consolidación pulmonar, entre otras.
En este artículo mostramos los diferentes patrones ecográficos de la enfermedad pleuro-pulmonar, técnica cuya accesibilidad adquiere gran importancia en pacientes críticos (UCI, reanimación), porque evita trasladar al enfermo, no es invasiva y es fácilmente repetible. Por otro lado, permite visualizar directamente la enfermedad pleuro-pulmonar, hecho necesario para los procedimientos intervencionistas torácicos.
Although the initial diagnosis and follow-up of pleuropulmonary disease are normally done with plain chest films and the gold standard for chest disease is computed tomography, diverse studies have established the usefulness of chest ultrasonography in the diagnosis of different pleuropulmonary diseases like pleural effusion and lung consolidation, among others.
In this article, we show the different ultrasonographic patterns for pleuropulmonary disease. The availability of ultrasonography in different areas (ICU, recovery areas) makes this technique especially important for critical patients because it obviates the need to transfer the patient. Moreover, ultrasonography is noninvasive and easy to repeat. On the other hand, it enables the direct visualization of pleuropulmonary disease that is necessary for interventional procedures.
El diagnóstico de la enfermedad pulmonar se hace rutinariamente con la radiografía de tórax y la tomografía computarizada (TC). Pero la ecografía torácica, constituye también una herramienta útil. Sin ser más sensible o específica que la TC, presenta ventajas como la accesibilidad, portabilidad, bajo coste, inocuidad, o el estudio en tiempo real. Estas características la convierten en una técnica diagnóstica a considerar en determinadas situaciones como la valoración de la enfermedad periférica pulmonar, la pleural y la de la pared torácica. Además, constituye una guía para procedimientos intervencionistas (toracocentesis diagnóstica o evacuadora, drenaje de abscesos, biopsia)1, indicación en la que, por escapar de nuestro objetivo, no nos extenderemos.
En este artículo describiremos los distintos patrones ecográficos pleuro-pulmonares, tanto el patrón normal como los artefactos, que sirven de base para detectar anomalías, y, así, explicar lo que caracteriza a las distintas afecciones dependiendo de que el compartimento afectado sea la pleura, el pulmón o la pared torácica.
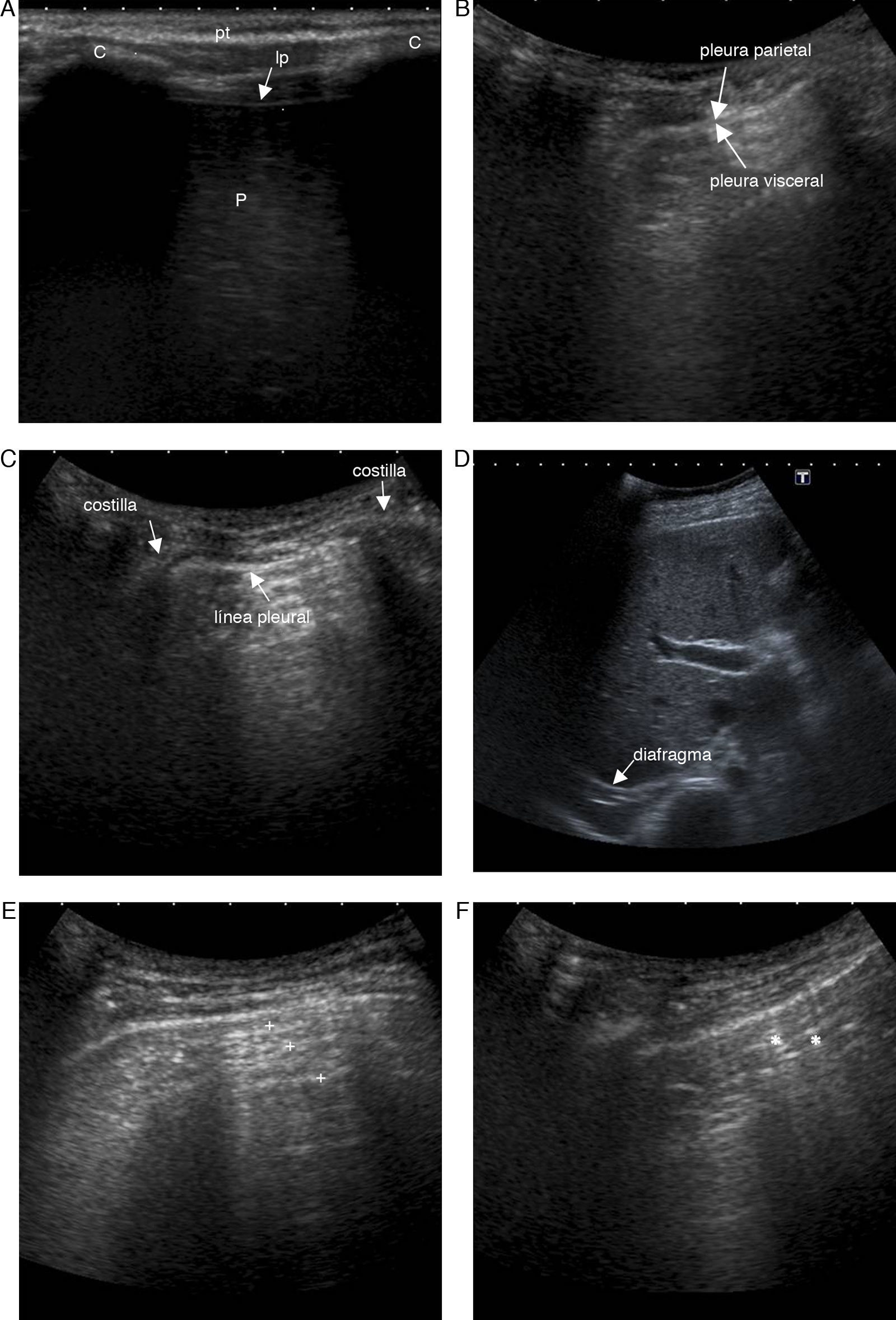
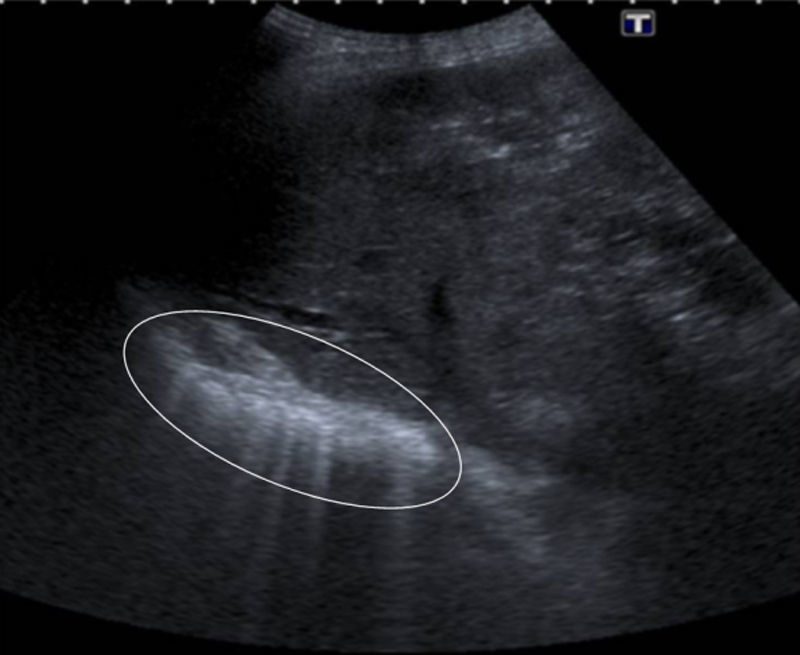
Anatomía normalLa pared torácica se ve como una serie de capas de tejidos blandos. Las más superficiales, ecogénicas, corresponden a la piel, y las inmediatamente inferiores, hipoecoicas, al tejido celular subcutáneo y los músculos intercostales2,3. Con la sonda ecográfica en posición longitudinal se observan las costillas, que se ven como unas estructuras curvilíneas ecogénicas con sombra acústica posterior, y, entre ellas, aproximadamente a 0,5cm por debajo de la línea costal, la línea pleural, que es una banda ecogénica, de hasta 2mm de grosor (fig. 1). Durante los movimientos respiratorios, esta línea tiene un movimiento ondulante hacia delante y atrás respecto a la pared torácica, que representa el movimiento de la pleura visceral contra la parietal, conocido como el signo de «deslizamiento pulmonar» («lung sliding»)2,4–9 o «signo del planeo» («gliding sign»)10,11. Con un abordaje adecuado es posible distinguir la pleura parietal de la visceral (fig. 1)2.
Mujer de 30 años asintomática. A y D) Imágenes ecográficas a distintas escalas mostrando las distintas estructuras anatómicas; c: costilla; lp: línea pleural; P: pulmón; pt: pared torácica. B) Distinción pleura parietal-pleura visceral. C) Signo del murciélago. E y F) Artefactos de reverberación (+) y en cola de cometa (*).
El primer signo que considerar al empezar el estudio es el «signo del murciélago» o «bat sign», formado en el corte longitudinal por las costillas superior e inferior y la línea pleural (fig. 1)5,12.
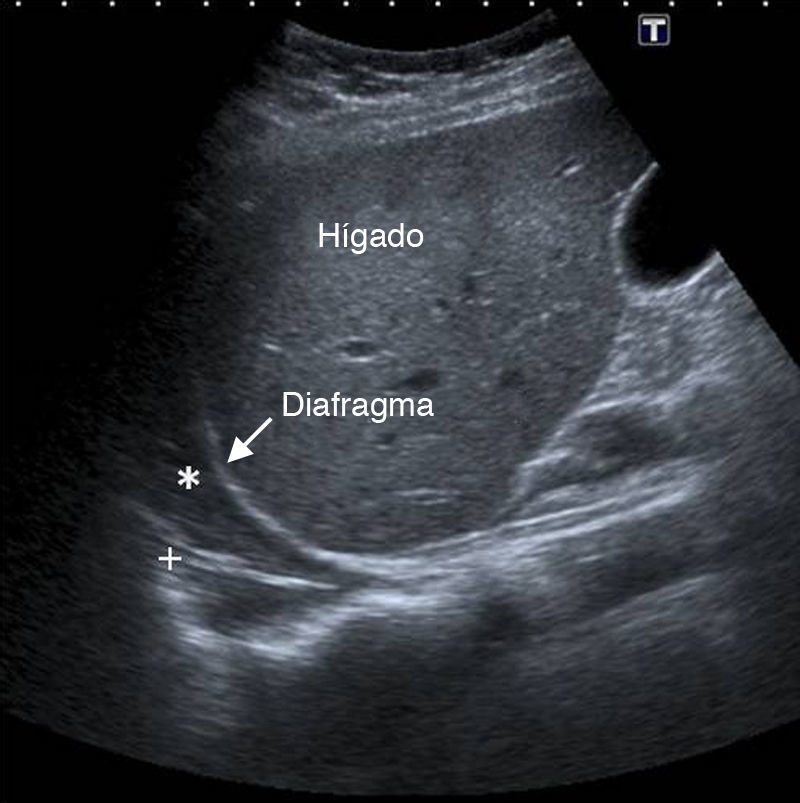
En los espacios intercostales inferiores se observa el diafragma como una línea ecogénica de 1mm de espesor sobre el hígado y el bazo, que se mueve normalmente en dirección cráneo-caudal durante la inspiración (fig. 1)2.
El hecho de que los ultrasonidos sean atenuados por el aire, y, a su vez, se reflejen por la gran diferencia de impedancia acústica en la interfase pleura-pulmón, hace que el parénquima pulmonar normal no sea visible por debajo de la pleura2. La diferencia de impedancia acústica da lugar a 2 artefactos característicos:
- 1.
Artefacto de reverberación o «líneas A». Se trata de una imagen horizontal formada por líneas hiperecogénicas, paralelas equidistantes, situadas por debajo de la línea pleural, a una distancia múltiplo de la existente entre el transductor y la línea pleural, que representan la reverberación del sonido sobre esta (fig. 1)4–6,8,10.El patrón pulmonar normal se basa en el signo del deslizamiento pulmonar y la presencia de líneas A5,13.
- 2.
Artefacto en cola de cometa o «líneas B». Es una imagen vertical originada en la superficie pleural y que se extiende por el parénquima pulmonar hasta el fondo de la pantalla. La imagen atraviesa y borra las líneas A. Se debe a la reflexión del haz de ultrasonidos al encontrar un área intersticial engrosada, por la gran diferencia de impedancia acústica entre el aire y el agua existente en los septos interlobulillares engrosados por edema o fibrosis (fig. 1)2,4–8,10,12.
En el pulmón normal, se pueden visualizar 2-3 líneas B separadas a una distancia de aproximadamente 7mm, localizadas en los últimos espacios intercostales por encima del diafragma2,13.
Debe recordarse que: los hallazgos ecográficos en el pulmón normal son el signo del «deslizamiento pulmonar», la línea pleural, y las líneas A y B.
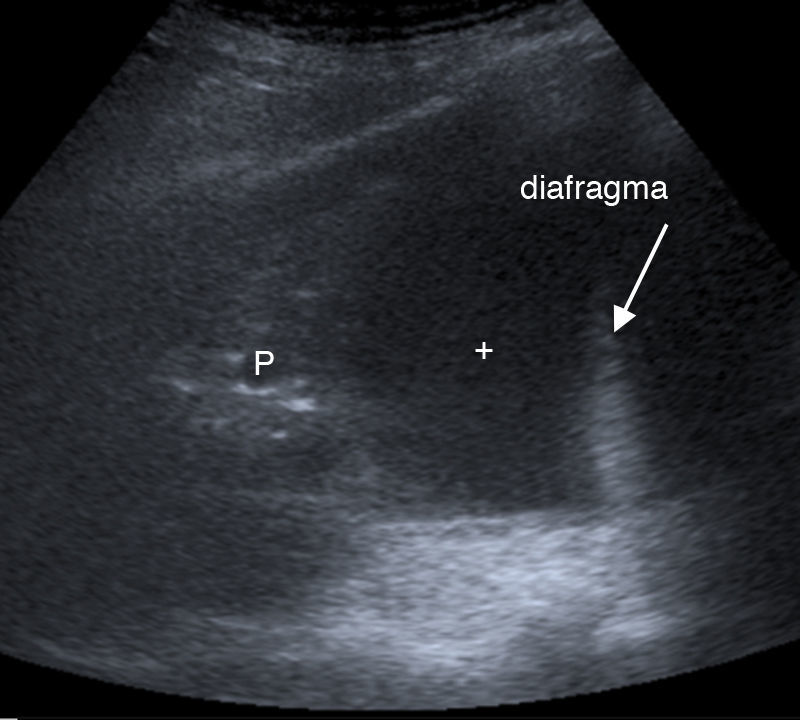
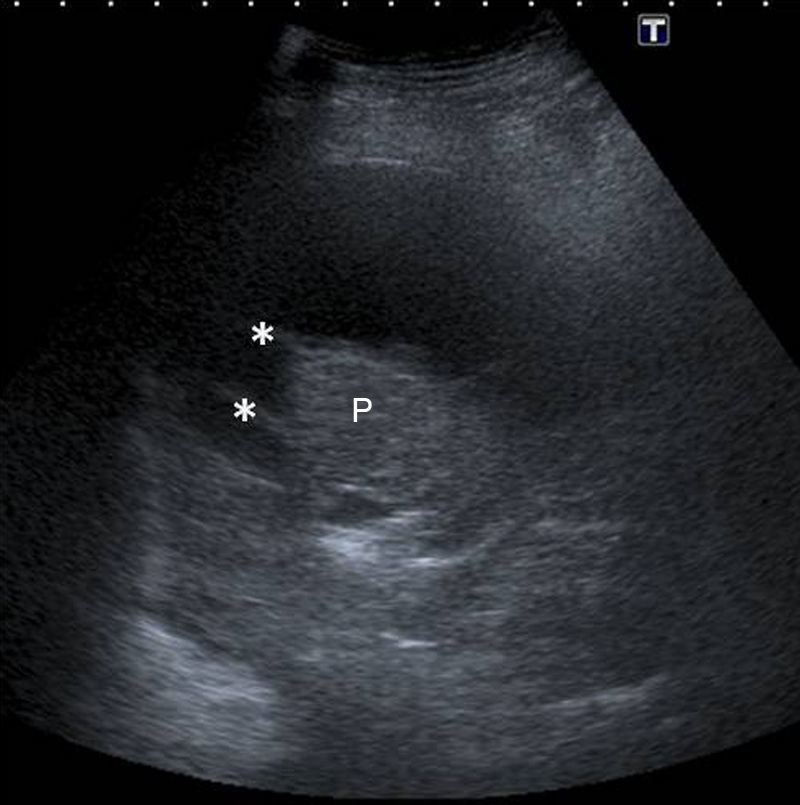
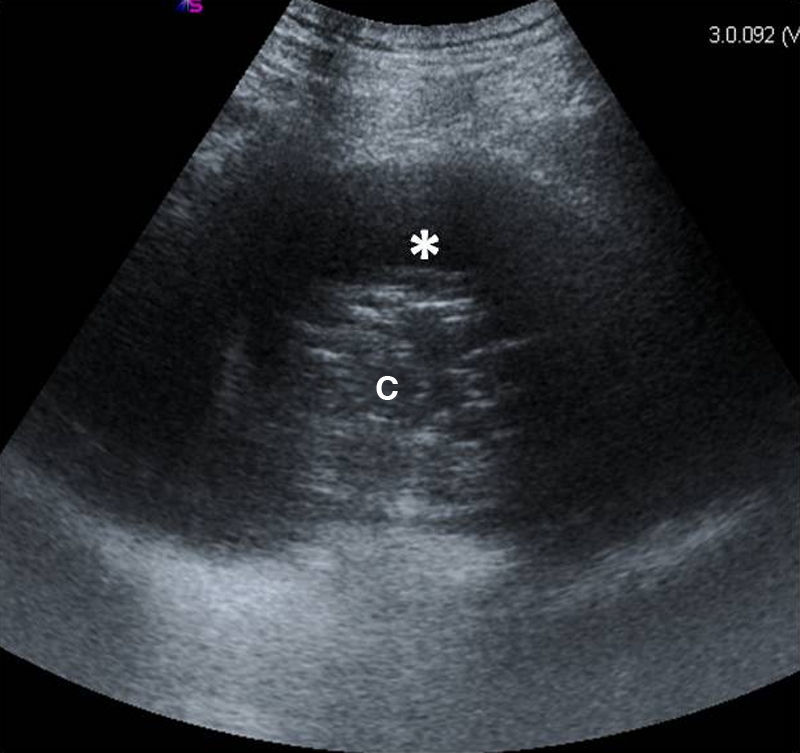
Enfermedad pleuralDerrame pleuralSe caracteriza por la desaparición del signo de deslizamiento pulmonar, está localizado en áreas declives del tórax y, se visualiza como una cámara, generalmente anecoica, limitada inferiormente por el diafragma, en la superficie por la pleura parietal (siempre localizada en la línea pleural) y, en la profundidad, por la pleura visceral (fig. 2). El movimiento de la pleura visceral puede dar lugar al signo del sinusoide (movimiento hacia el transductor de la pleura visceral con la inspiración)5,10,14 o su variación, el signo de la medusa (atelectasia completa del lóbulo pulmonar, que flota sobre un derrame pleural masivo)10,14.
La imagen ecográfica, dependiendo de la causa, naturaleza y cronicidad15,16, puede ser anecoica, compleja (ecos internos) pero sin septos, compleja y con septos, u homogéneamente ecogénica.
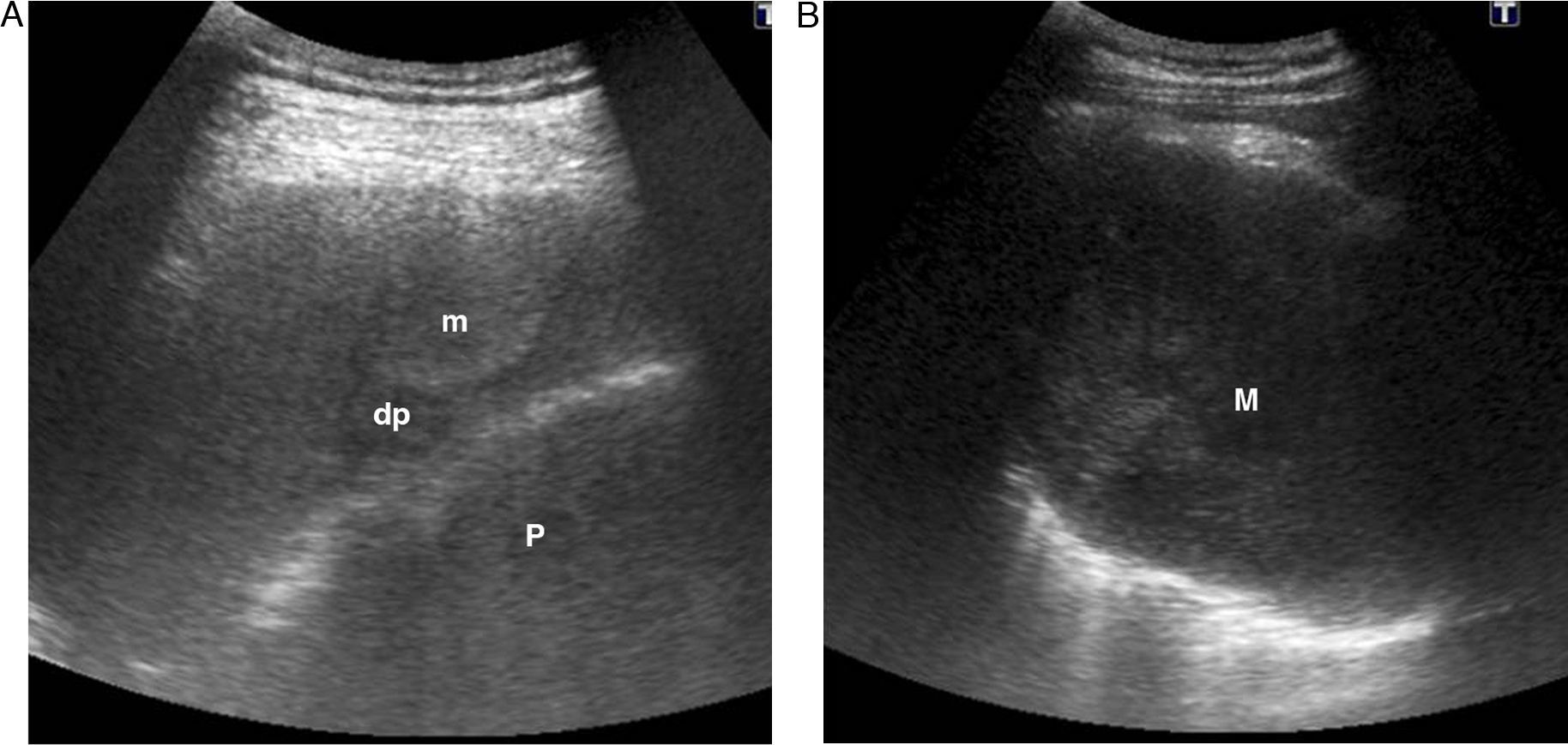
Según su etiología, puede tratarse de un trasudado (anecoico) (fig. 3), exudado (ecos internos, septado, ecogénico, más rara vez anecoico), hemotórax (ecos o septos internos móviles, signo del plancton10,14) (fig. 4), quilotórax, empiema (ecos internos (fig. 5), altamente sugestivo de malignidad si aparece engrosamiento pleural nodular)2,5,17 (figs. 6 y 7), que puede presentar el signo del remolino («swirling pattern»). Este signo consiste en el movimiento de los ecos internos en forma de espiral con la respiración y el latido cardíaco y, aunque inespecífico para malignidad, es un buen marcador de derrame pleural maligno en pacientes con enfermedad tumoral subyacente16,17.
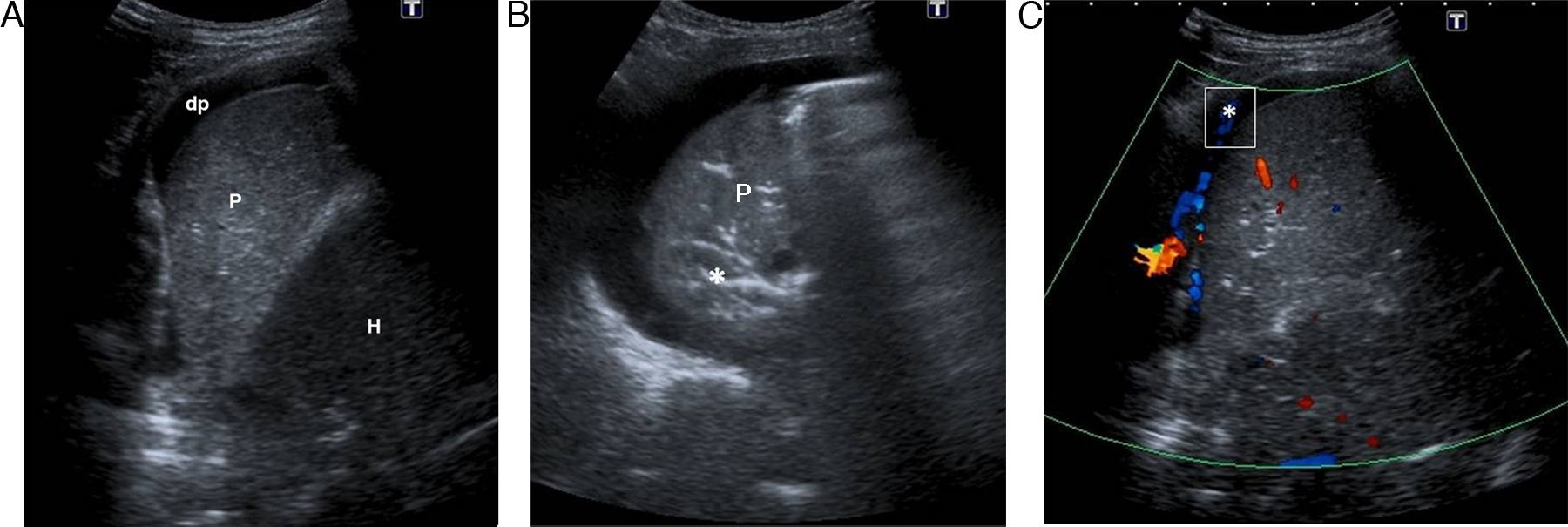
Varón de 56 años con carcinoma epidermoide de pulmón. A) Derrame pleural metastásico (dp) y nódulos sólidos en la pleura parietal con que corresponden a metástasis pleurales (m). Pulmón (P). B) Masa pulmonar (M) heterogénea, de bordes bien definidos, con refuerzo acústico posterior, que parece respetar la pared torácica.
Se visualizan como una banda hipoecoica gruesa superficial a la interfase pleura-pulmón (fig. 8). En la pleuritis se observa una interrupción de la línea pleural con engrosamiento irregular de la pleura visceral. Las bandas pleurales son engrosamientos hipoecoicos con una amplia sombra acústica posterior si están calcificados.
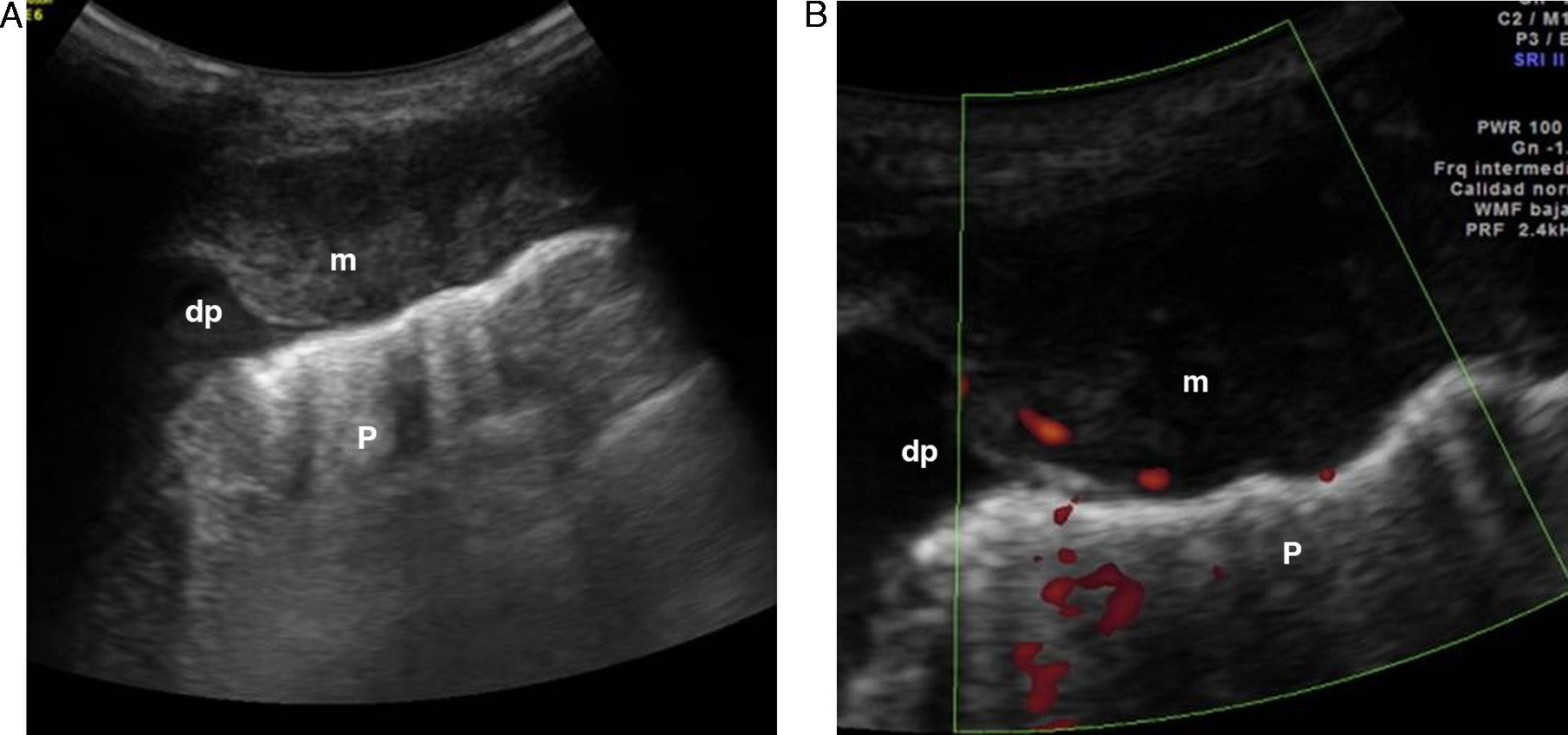
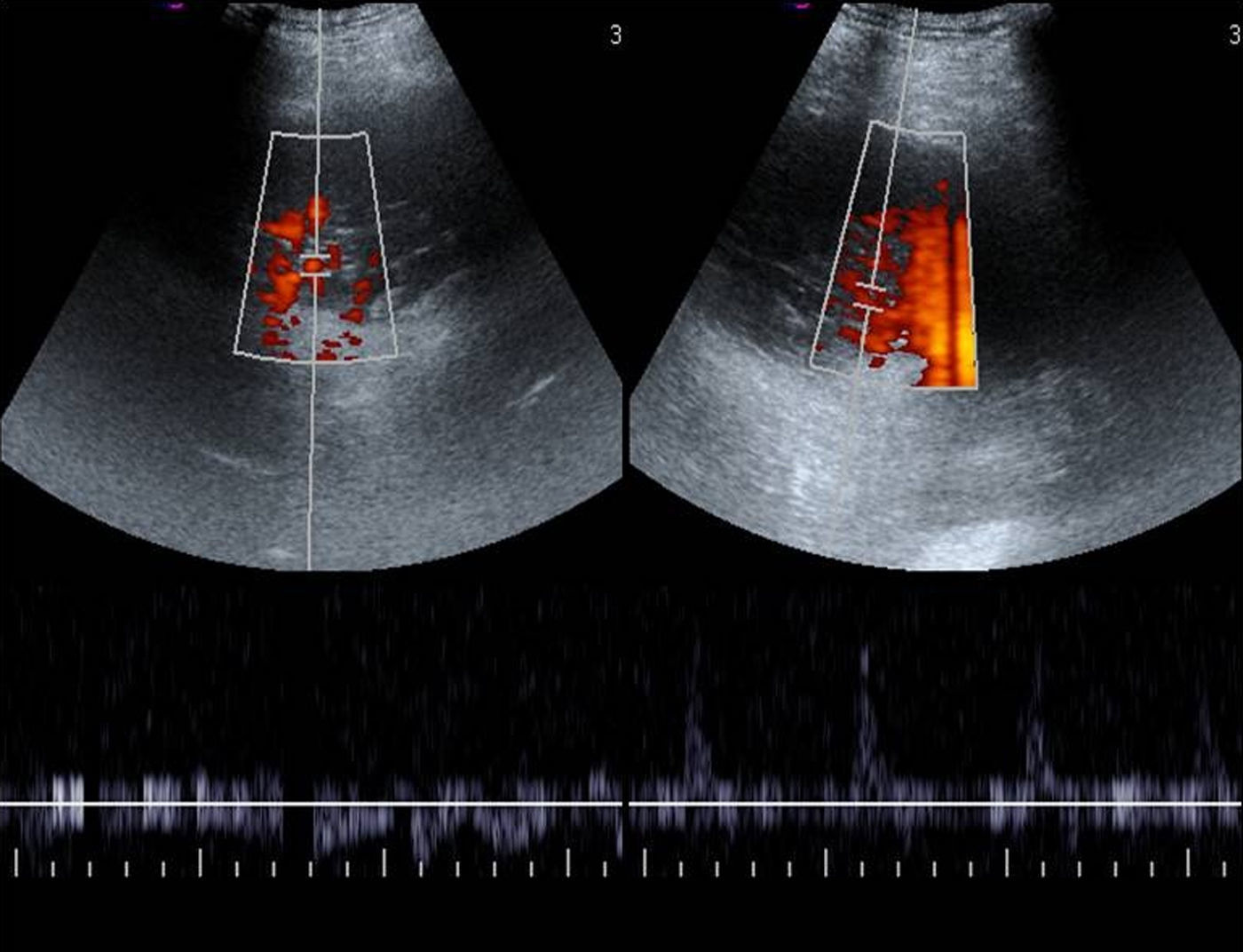
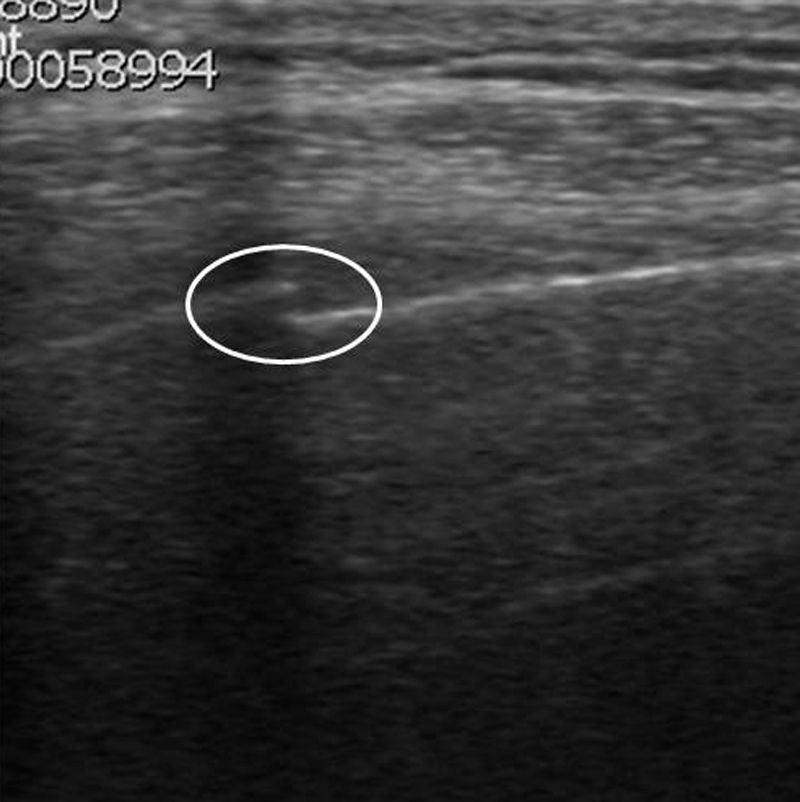
El diagnóstico diferencial con el derrame pleural cuando es escaso se basa en que este es una cámara pleural que cambia de forma con la respiración, puede presentar ecos o septos móviles internos, y el signo del color líquido («fluid color sign»), que consiste en una señal Doppler-color en el interior de la colección líquida consecuencia de la transmisión de los movimientos respiratorios o cardíacos (fig. 9)2,11,17. En el engrosamiento pleural es característica la ausencia del «fluid color sign».
Varón de 12 años con fiebre. A) Pulmón (P) discretamente hiperecogénico con respecto al parénquima hepático (H), en un paciente con neumonía lobar inferior derecha y derrame pleural asociado (dp). La homogeneidad del parénquima nos muestra que se trata de una neumonía no complicada. B) Obsérvese las imágenes lineales ramificadas hiperecogénicas en el interior del pulmón consolidado con que corresponden a un broncograma aéreo (*). C) El signo del color líquido (*) se muestra como consecuencia del movimiento respiratorio de la colección líquida.
Debe recordarse que: el derrame pleural de escasa cuantía, a diferencia del engrosamiento pleural, cambia de morfología con la respiración, puede presentar ecos o septos móviles internos y signo del color líquido.
Masas pleurales2,17- •
Benignas: lipoma, schwannoma, condroma, tumor fibroso localizado benigno. Se trata de lesiones bien delimitadas y moderadamente ecogénicas, que pueden presentar un discreto derrame pleural.
- •
Malignas: mesotelioma, linfoma y metástasis. El mesotelioma se observa como un engrosamiento pleural irregular, a veces nodular, con un importante derrame pleural. Los depósitos subpleurales linfomatosos son infiltrados hipoecoicos en forma de cuña, que pueden confundirse con el infarto pulmonar. Las metástasis, generalmente con un derrame pleural, son nódulos sólidos en el espacio pleural, más frecuentes en la pleura parietal (figs. 6 y 7).
El estudio Doppler-color y pulsado en las masas pleurales malignas muestra vasos irregulares y tortuosos, con flujo de baja resistencia por neovascularización (fig. 7).
NeumotóraxLocalizado en áreas no dependientes torácicas, los signos característicos son la ausencia de deslizamiento pulmonar6,9, artefactos de reverberación exagerados, ausencia de líneas B, ampliación de la línea pleural a una banda, y «lung point» muy específico de neumotórax, que representa la transición entre el aire del neumotórax y el del parénquima pulmonar normal5–8,10,12,17.
Debe recordarse que: son característicos de neumotórax la desaparición del deslizamiento pulmonar y las líneas B, los artefactos de reverberación exagerados, la ampliación de la línea pleural a una banda y el «lung point».
Cuando disminuye el deslizamiento pulmonar habría que descartar posibles falsos positivos como EPOC por hiperinsuflación, antecedentes de pleurodesis, afectación pleural por exposición al asbesto o un síndrome de distress respiratorio agudo (SDRA)2,4,14,17.
Limitaciones para valorar dichos signos son el enfisema subcutáneo14 o las placas pleurales calcificadas (aire y calcio dan artefactos acústicos, que limitan la visualización de la interfase pleura-pulmón)2,17.
HidroneumotóraxEs característico el signo de la cortina («curtain sign»), que consiste en líneas A por la existencia de aire pleural en el interior del derrame, que oscurecen el derrame subyacente durante la inspiración2,17.
Enfermedad pulmonar- 1.
La consolidación pulmonar se observa como una estructura tisular difusamente hipoecoica (iso/hipoecoica al hígado), limitada por la línea pulmonar (o línea pleural cuando no hay derrame) y, en la profundidad, por un borde irregular en conexión con el pulmón aireado6. Tiene forma de cuña, permite la transmisión acústica y su tamaño no varía con los movimientos respiratorios. Puede tratarse de una neumonía, atelectasia, contusión, infarto o tumor6.
- a)
Neumonía. Generalmente en el interior de la consolidación se observa un broncograma aéreo ecográfico constituido por imágenes lineales ramificadas hiperecogénicas formadas por ecos puntiformes (fig. 9). El broncograma puede moverse más de 1mm hacia la periferia durante la inspiración (signo del broncograma aéreo móvil), lo que la distingue de la atelectasia2,5,10,12,14,18,19.Debe recordarse que: ante una consolidación con broncograma aéreo móvil debemos pensar en una neumonía.
- b)
Atelectasia. Cuando es obstructiva se observa un derrame pleural escaso, una consolidación hipoecogénica, broncograma líquido (imágenes lineales ramificadas anecoicas, que orientan hacia obstrucción central como causa de la consolidación; el estudio ecográfico puede distinguir la lesión central obstructiva hipoecoica del pulmón consolidado periférico ecogénico) y, ausencia de reventilación en inspiración5,11,14,17. Cuando es pasiva, el derrame pleural es moderado y, la consolidación tiene forma de cuña, márgenes irregulares con parénquima aireado y reventilación parcial durante la inspiración (fig. 10)5,14,17.
- c)
Absceso pulmonar. Es una imagen nodular/ovalada de bordes bien/mal definidos, paredes gruesas, irregulares y ecogénicas, una cavidad central hipoecogénica y, contenido anecoico, con ecos y septos internos, ecos por gas o un nivel hidroaéreo en la cavidad2,5,14.
- d)
Neoplasia. Solo son valorables las neoplasias en contacto con la pleura. Generalmente es una masa hipoecoica de bordes bien definidos, que suele presentar refuerzo acústico posterior (fig. 6). La ecografía valora la invasión de la pared torácica y, el Doppler, la neovascularización y el flujo de baja resistencia14,17.
- e)
Infarto pulmonar. Es una imagen hipoecoica con forma de cuña y base pleural, de bordes bien definidos. En la fase inicial no se observa broncograma aéreo, lo que permite distinguirlo de la neumonía14,17.
- f)
Contusión. Hay una pérdida del movimiento pleural, múltiples líneas B (enfermedad pulmonar intersticial) y, una lesión parenquimatosa periférica constituida por imágenes hipoecoicas subpleurales de las que pueden emerger líneas B. Esta lesión representa una condensación alveolar y/o disrupción del parénquima pulmonar7.
- a)
- 2.
En el tromboembolismo pulmonar, la ecografía constituye un método adicional para el diagnóstico que puede ser útil en pacientes a los que, por problemas de movilización, no se les puede hacer una TC torácica (fig. 11). Es característica una mayoría de líneas A en la pared torácica anterolateral sin líneas B. El patrón es muy sugestivo de tromboembolismo pulmonar en un paciente con disnea súbita, sin antecedentes de enfermedad pulmonar crónica6,14,20,21.
- 3.
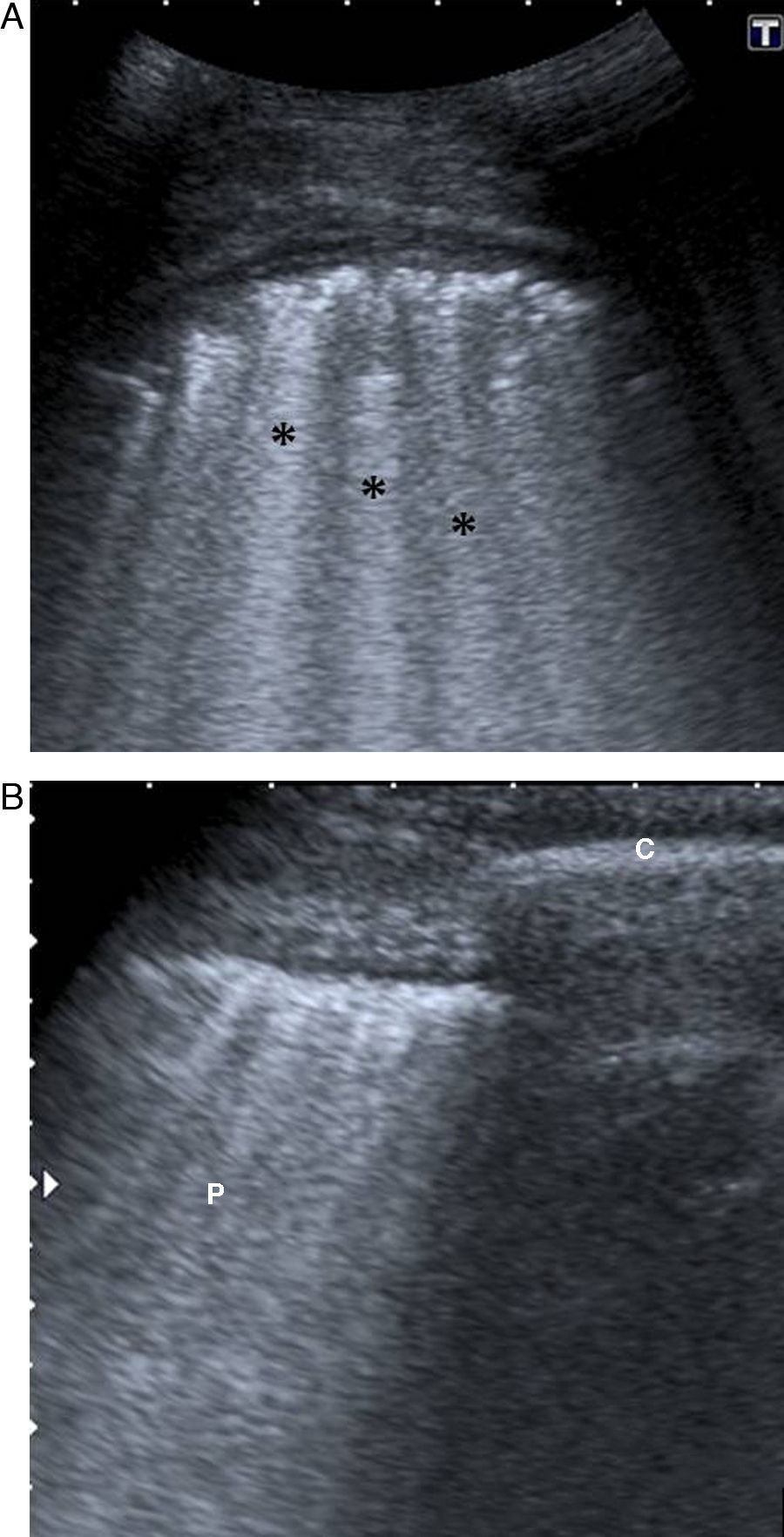
En la enfermedad pulmonar intersticial hay un aumento de líneas B en la superficie pleural, que pasan a denominarse patrón B o cohetes («rockets»). Cuanto mayor es la pérdida de aireación pulmonar, mayor es el número de líneas B, y su intensidad se incrementa con los movimientos respiratorios5,7,8,10,14,17,22.
La separación entre líneas B orienta el diagnóstico. Así, líneas B separadas entre sí 7mm o más, sugieren un engrosamiento de septos interlobulillares por edema intersticial o fibrosis intersticial difusa. Sin embargo, una separación menor o igual a 3mm sugiere áreas en vidrio deslustrado por edema alveolar o SDRA (fig. 12)4,7,8,10.
Varón de 67 años con enfisema pulmonar. A y B) Afectación intersticial con engrosamiento de los septos interlobulillares por edema agudo de pulmón. Se observan importantes artefactos en cola de cometa (*) difusos, que se originan en la línea pleural, bien definidos y que predominan sobre los artefactos de reverberación. Además, están sincronizados con el deslizamiento pulmonar. Pulmón (P); arco costal (c).
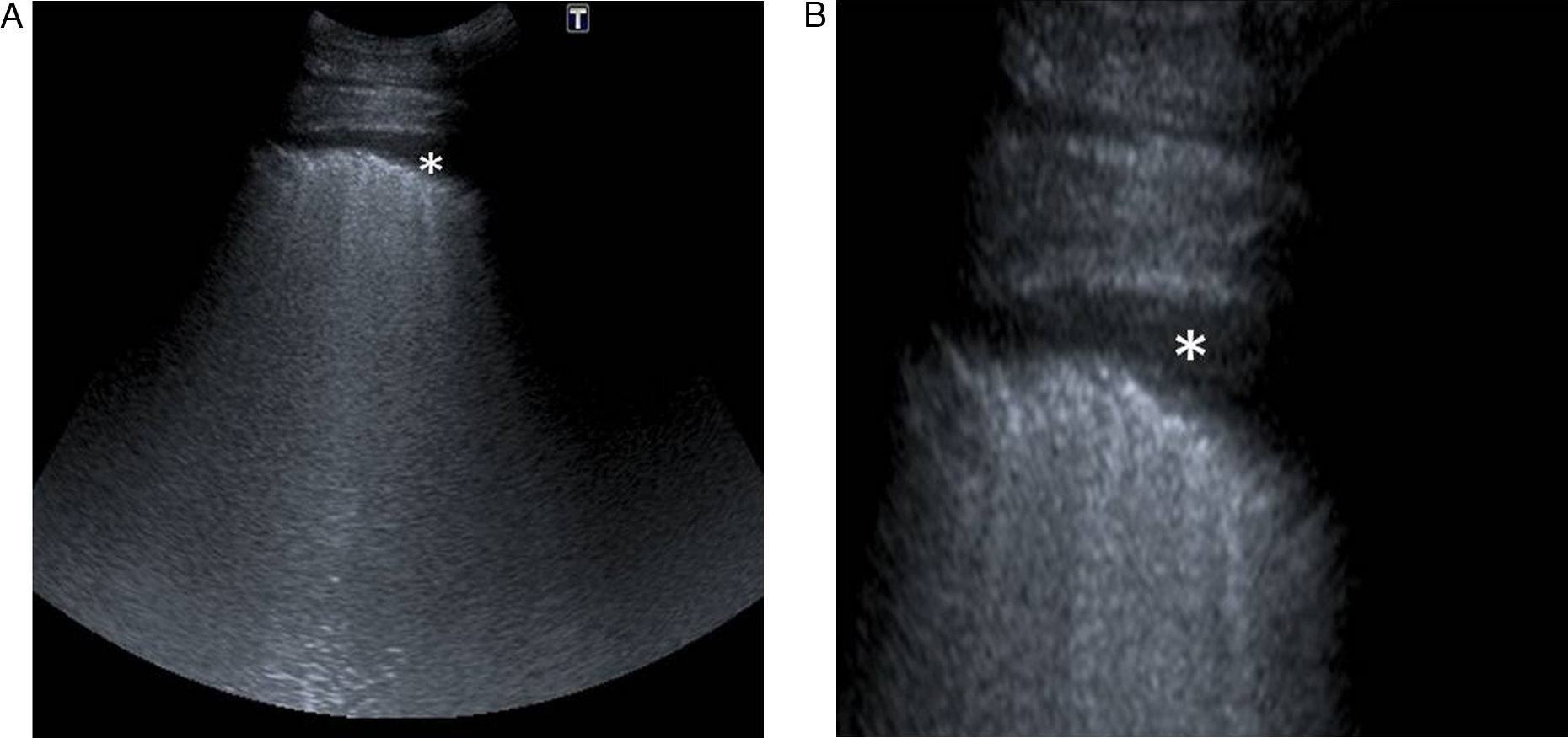
El signo del «diafragma espiculado» o «en rayos de sol» muestra la imagen del diafragma del cual parten numerosas líneas B, lo que nos hace sospechar la existencia de enfermedad intersticial en la base pulmonar (fig. 13)23.
Debe recordarse que: ante la presencia del signo del «diafragma espiculado» o «en rayos de sol» debemos sospechar de enfermedad intersticial en la base pulmonar.
Pared torácicaLa ecografía permite estudiar masas en la pared torácica3, adenopatías axilares y supraclaviculares y, detectar fracturas y metástasis costales (fig. 14). En las fracturas costales no desplazadas, se observan reverberaciones posteriores al punto de fractura (signo de la chimenea o «chimney phenomenon»). Además, permite detectar complicaciones asociadas a la fractura costal17.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Autorías- 1.
Responsable de la integridad del estudio: MPGG.
- 2.
Concepción del estudio: MPGG y PGB.
- 3.
Diseño del estudio: MPGG y PGB.
- 4.
Obtención de los datos: MPGG, PGB, DPB y MSP.
- 5.
Análisis e interpretación de los datos: MPGG, PGB, DPB y MSP.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: MPGG, PGB y DPB.
- 8.
Redacción del trabajo: MPGG y PGB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MPGG, PGB, DPB y MSP
- 10.
Aprobación de la versión final: MPGG, PGB, DPB y MSP.
Los autores declaran no tener ningún conflicto de intereses.