La patología benigna anorrectal comprende una amplio grupo de procesos de muy diversos orígenes, congénitos o adquiridos, inflamatorios o tumorales. Sin embargo, ha recibido en la bibliografía científica menor atención que el estudio de la patología tumoral maligna. Presentamos una revisión basada en imágenes de la patología benigna anorrectal más frecuente. En esta primera parte realizamos un recuerdo anatómico y una breve descripción de las peculiaridades del protocolo de alta resolución que empleamos con la RM de 3.0 T. Después describimos los principales tumores benignos anorrectales y lesiones quísticas del desarrollo junto con sus principales diagnósticos diferenciales y las anomalías congénitas y adquiridas del complejo esfinteriano anorrectal.
Benign anorectal disease comprises a broad group of processes with very diverse origins; these processes may be congenital or acquired as well as inflammatory or tumor related. However, benign anorectal disease has received less attention in the scientific literature than malignant disease. We present an image-based review of the most common benign diseases of the anus and rectum. In this first part, we review the anatomy of the region and provide a brief description of the peculiarities of the high resolution protocol that we use with 3.0 T MRI. We go on to describe the most common benign anorectal tumors and developmental cystic lesions, together with their differential diagnoses, as well as congenital and acquired anomalies of the anorectal sphincter complex.
La región anorrectal (AR) es, dentro del tracto gastrointestinal, donde la RM obtiene mejores resultados, especialmente cuando estudia la patología tumoral. La RM de 3.0 T, por su mayor resolución espacial, tisular y capacidad multiplanar, también tiene un papel central en numerosos procesos benignos. El diagnóstico correcto de algunas de estas entidades es crucial y puede alterar considerablemente el manejo del paciente.
El objetivo de esta revisión es dar a conocer nuestro protocolo de alta resolución con RM de 3.0 T y hacer un breve recordatorio anatómico y de los procesos benignos más relevantes de la región AR.
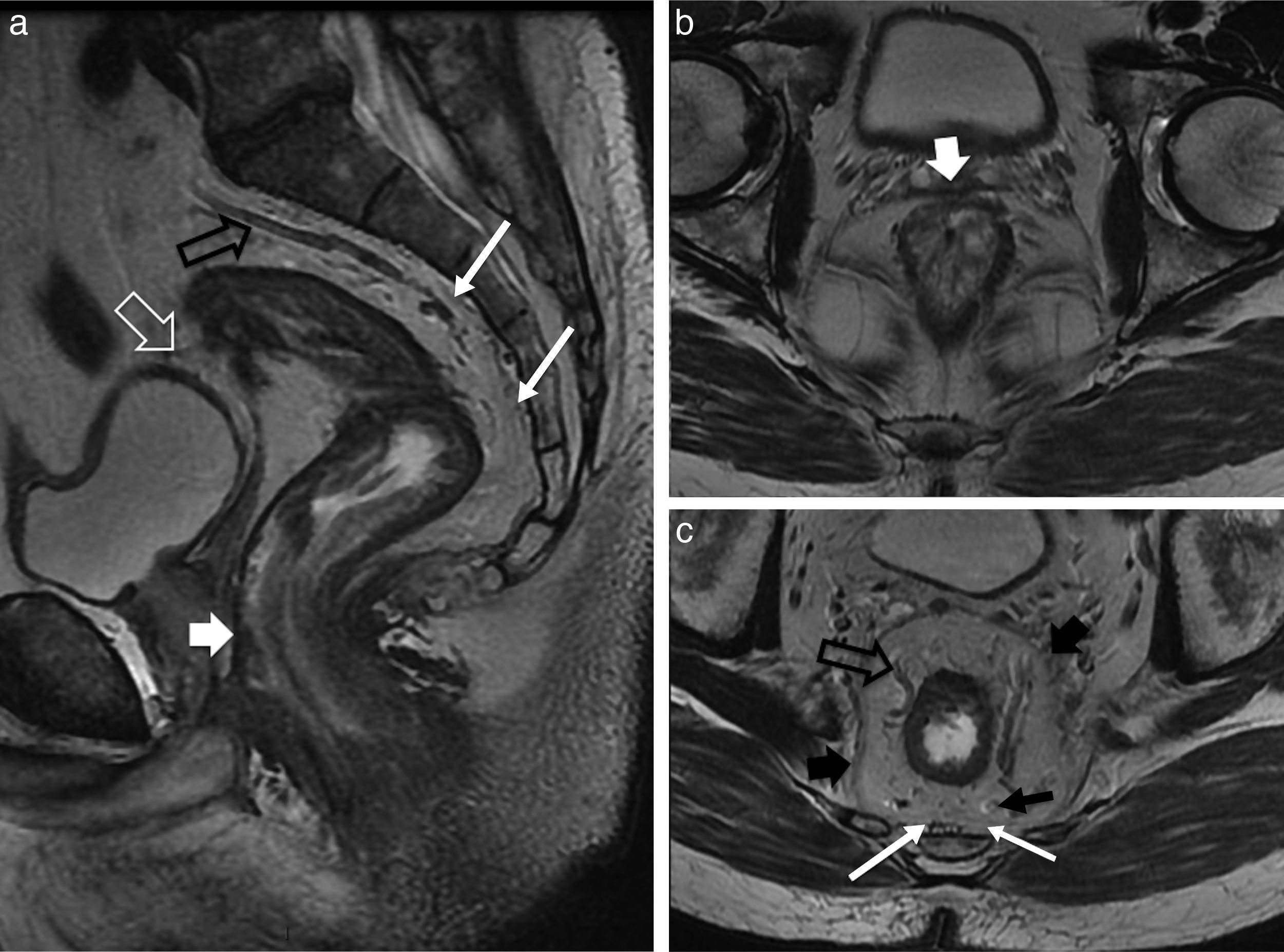
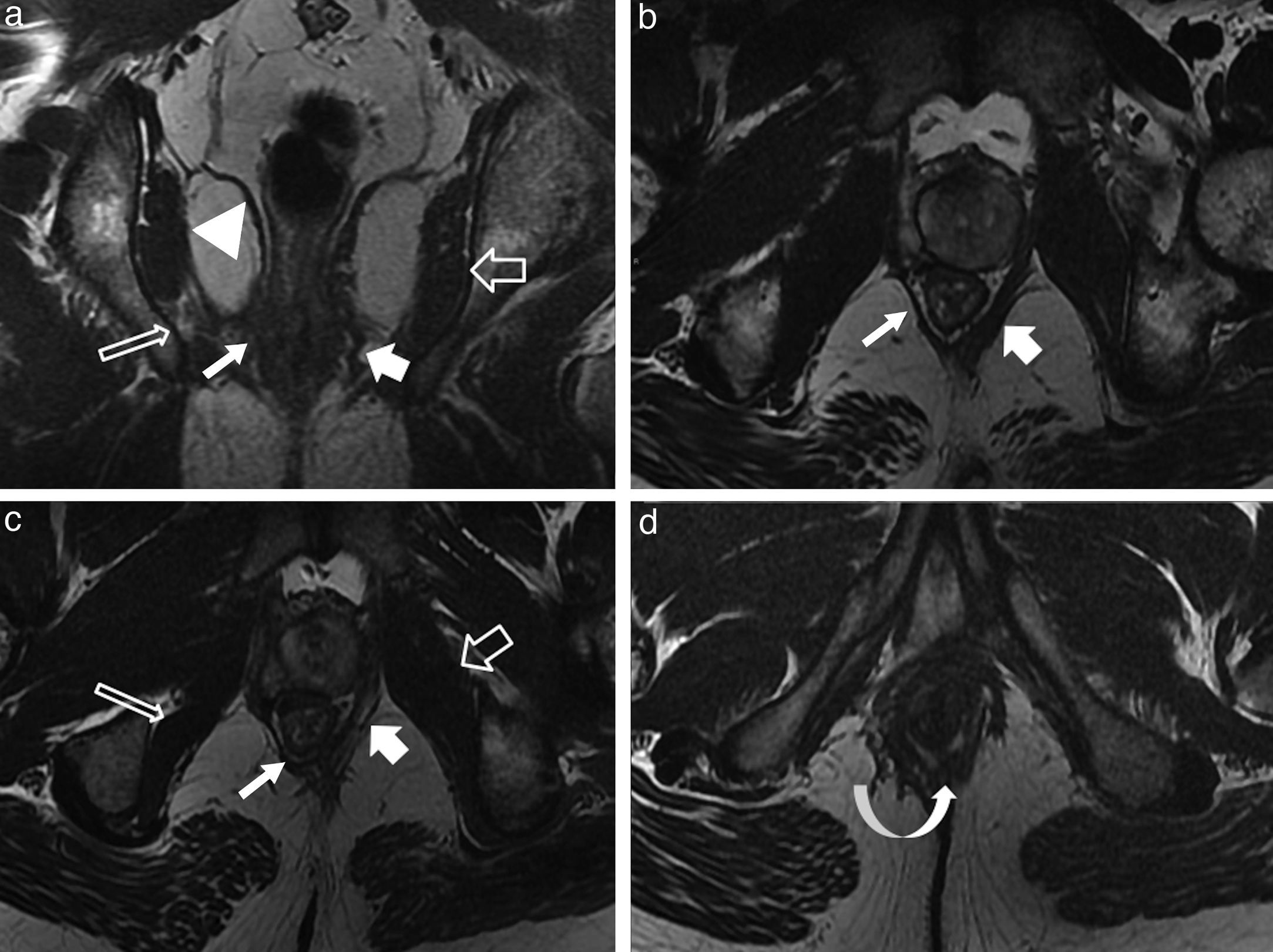
Recuerdo anatómico del complejo esfinteriano anorrectal y perirrectalEl conducto anal está constituido por estructuras musculares tubuliformes parcialmente superpuestas, los esfínteres interno y externo, separados por un espacio interesfinteriano, casi virtual, de gran importancia para clasificar las fístulas (fig. 1).
Anatomía del conducto anal. Imágenes ponderadas en T2, en el conducto anal superior en los planos axial (a) y coronal (b). c y d) Gráficos esquemáticos del complejo esfinteriano. EE: esfínter externo (flecha negra fina); EI: esfínter interno (flechas blancas finas); MEA: músculos elevadores del ano (flechas blancas discontinuas); MPR: músculos puborrectales (flechas blancas curvas); Flechas negras gruesas: espacios isquioanales; Flechas blancas gruesas: espacios isquiorrectales. Existe una comunicación libre entre estos espacios (línea discontinua negra en d). Sobre el elevador del ano se localizan los espacios supraelevadores. Espacio interesfinteriano señalado con flechas blancas huecas en a y b y mediante una flecha discontinua negra en c.
El esfínter interno, involuntario (músculo liso concéntrico), es responsable de aproximadamente el 85% del tono muscular en reposo1. El esfínter externo, voluntario (músculo estriado), se opone activamente a la defecación junto con los músculos puborrectal y elevador del ano. Estos refuerzos actúan como estructuras de sostén del conducto anal.
Debe recordarse que: el músculo elevador del ano es el componente principal del diafragma pélvico y un marcador anatómico muy importante en la patología fistulosa y tumoral. El músculo delimita externamente la transición AR2. Tiene forma de embudo y se inserta medial e inferior al músculo puborrectal, craneal y lateral al músculo obturador interno y posterior al cóccix.
El límite mucoso del AR lo forma la línea pectínea o dentada (transición irregular entre los epitelios escamoso y estratificado), a unos 2cm de la apertura anal. En ella se localizan las glándulas intramurales en las criptas o recesos anales, origen, cuando se abscesifican, de gran parte de las fístulas2.
Cranealmente al elevador del ano están los espacios supraelevadores y caudalmente las fosas isquiorrectales, que comunican libremente con las fosas isquioanales y el periné.
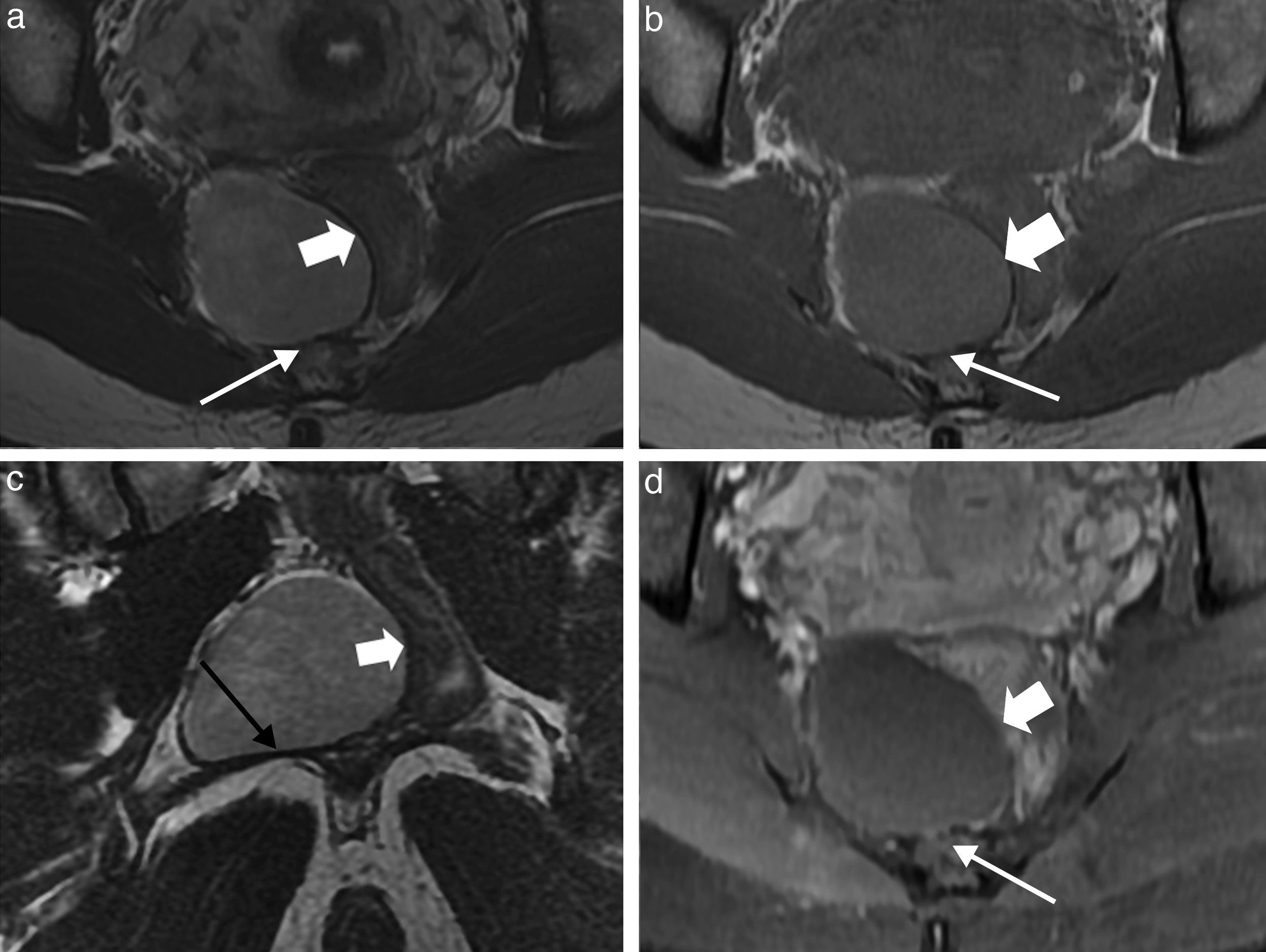
El recto se divide arbitrariamente en 3 segmentos (inferior, medio y superior) englobado por el espacio tubuliforme graso mesorrectal (rico en vasos linfáticos y venosos hemorroidales), a su vez rodeado por la fascia mesorrectal (fig. 2), marcador anatómico esencial en la valoración prequirúrgica tumoral primaria rectal (margen de resección circunferencial). El recto superior se localiza parcialmente intraperitoneal superando cranealmente la reflexión peritoneal.
Anatomía perirrectal. a) Imagen sagital ponderadas en T2; b y c) Imágenes axiales ponderada en T2. Flecha blanca hueca señala la reflexión peritoneal. Flechas blancas finas: fascia del espacio presacro o retrorrectal. Flechas negras gruesas: fascia mesorrectal. Flechas blancas gruesas: refuerzo anterior de la fascia mesorrectal en el varón denominado fascia de Denonvilliers. Flechas negras huecas: venas hemorroidales superiores en el espacio mesorrectal. Flecha negra fina: ganglio linfático.
Anteriormente limita con el espacio rectovaginal en las mujeres, casi virtual, que puede ser asiento de afección inflamatoria fistulosa o endometriósica. En el varón existe un refuerzo anterior de la fascia mesorrectal (fascia de Denonvilliers), que separa el mesorrecto de la próstata periférica y las glándulas seminales. Posteriormente se encuentra el espacio presacro. Los límites de este espacio, también virtual, son la reflexión peritoneal pélvica superiormente, los ligamentos sacros, uréteres y vasos ilíacos lateralmente, y el elevador del ano y la musculatura coccígea caudalmente. Puede ser origen de multitud de diversas estirpes tumorales, puesto que es un área compleja de fusión de múltiples elementos embrionarios (óseo, nervioso, intestino primitivo).
Protocolo de resonancia magnética 3.0 T para el estudio del recto y el canal analEl protocolo de imagen depende de la sospecha clínica y de los hallazgos de imagen, con variaciones según cada caso (tabla 1). No requiere de enemas ni drogas antiperistálticas. El uso de gel estéril vaginal y/o rectal es controvertido y debe individualizarse. La distensión vaginal mejora la valoración de la endometriosis del tabique rectovaginal y los fondos de saco vaginales. La distensión rectal puede ser de ayuda para las fístulas rectovaginales y pequeñas lesiones polipoideas.
Debe recordarse que: el empleo de RM 3.0 T tiene ventajas respecto a la RM 1,5T por su mayor resolución espacial y menor duración, que reduce, en consecuencia, los artefactos de movimiento. Esta ventaja es especialmente evidente en la pelvis donde el movimiento está restringido por las estructuras óseas, y los artefactos por susceptibilidad magnética y por efecto dieléctrico son menos problemáticos3,4. Es importante evitar los artefactos de onda estacionaria o de conductividad ocasionados por el movimiento de la orina en la vejiga, que pueden causar una importante pérdida de señal.
Protocolo de RM 3.0 T de alta resolución para la valoración de recto y canal anal
| Secuencia | Matriz | FOV | TR/TE | NEX | Grosor/gap |
| FRFSE sag T2 | 320×256 | 20cm | 2200/115 | 13 | 4/0,5mm |
| FRFSE ax T2 | 320×256 | 18cm | 5780/115 | 3 | 3/0,4mm |
| FRFSE cor T2 | 320×256 | 20cm | 2200/115 | 3 | 4/0,4mm |
| SE/EPI DWIb=0, 600,1000 | 128×128 | 30cm | 6000/60 | 10 | 5/0,0mm |
| FSE T1 | 300×192 | 20cm | 700/6,7 | 1 | 4/0,4mm |
| M3D LAVA | 320×192 | 30cm | 5,1/2,3TI=5,0 | 0,75 | 3,8/1,9 ov |
GE 3.0T Signa DST. Antena de superficie phased array de 8 canales. Tiempo aproximado de exploración de 25-30min.
ax: plano axial; cor: plano coronal; DWI: secuencia ponderada en difusión; EPI: imagen eco planar; FOV: campo de exploración; FRFSE: secuencia Fast Relaxation Fast Spin Echo; FSE: secuencia spin eco rápida; Gap: decalaje; LAVA: Liver Acquisition with Volume Acceleration; M3D: secuencia tridimensional; NEX: número de adquisiciones; ov: superposición; sag: plano sagital; SE: secuencia spin eco; TE: tiempo de eco; TI: tiempo de inversión; TR: tiempo de repetición de pulso.
Las secuencias de alta resolución facilitan el análisis morfológico de las lesiones, su localización y extensión. Se realizan cortes de 3mm, contiguos, sin espacio intercalado, con FOV lo más ajustado posible (16-20cm) y matriz de 320×256, para conseguir una resolución en plano de aproximadamente 0,6×0,6×3mm, con un volumen de píxel de 1,3 mm3. Las antenas de superficie multicanal phased-array consiguen una buena señal y mayor superficie de exploración.
En general utilizamos secuencias T2 axial perpendicular al eje mayor del segmento AR que se estudia, y secuencias sagital y coronal paralelas al eje mayor. Individualizaremos el estudio dinámico T1 tras la administración de contraste intravenoso para mejorar la detección de lesiones, caracterizarlas y descartar complicaciones inflamatorias. Para valorar fístulas, las secuencias ponderadas en T2 con supresión grasa aumentan el grado de confianza diagnóstica2. En pacientes con sospecha de endometriosis debe completarse el estudio con secuencias T1 con supresión grasa. En nuestra experiencia, la secuencia de difusión detecta y localiza mejor las lesiones pequeñas. Además, el cálculo del coeficiente de difusión aparente puede demostrar la evolución del grado de necrosis y la presencia de abscesos, pero puede verse afectado por la hemosiderina o artefactos posquirúrgicos y debe ser valorada conjuntamente con las secuencias convencionales.
Revisión de la patología benigna del recto y del canal analLesiones quísticas del desarrollo, masas quísticas ginecológicas y tumores benignosLesiones quísticas del desarrolloSon las lesiones quísticas retrorrectales más frecuentes en adultos y suelen presentarse en mujeres de mediana edad5,6. Generalmente son quistes de pared fina, uni o multiloculados, hipointensos en T1 e hiperintensos en T2.
De acuerdo a su origen histológico se clasifican en quistes epidermoides, dermoides, entéricos (hamartomas quísticos retrorrectales y quistes de duplicación) y neuroentéricos6.
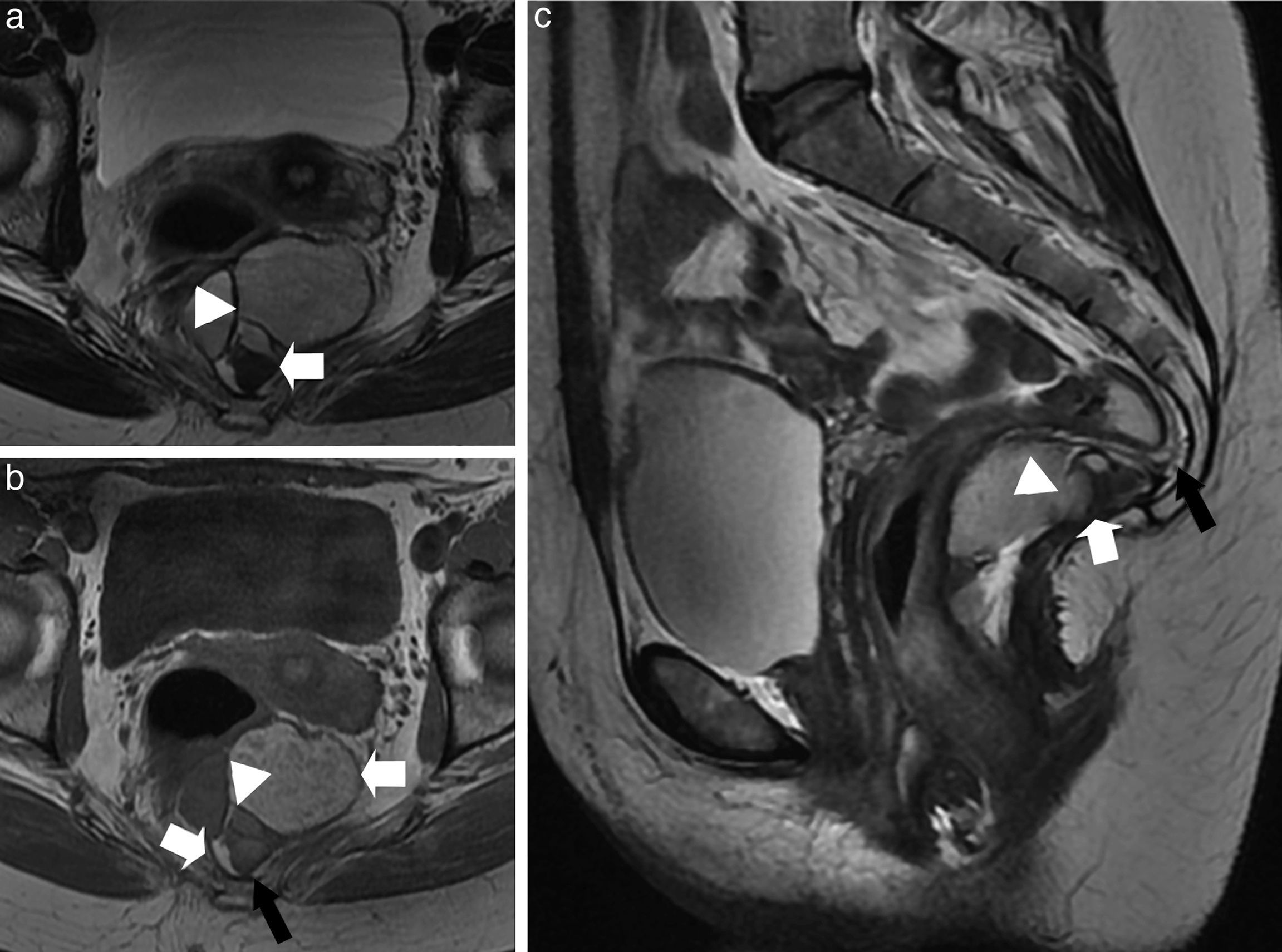
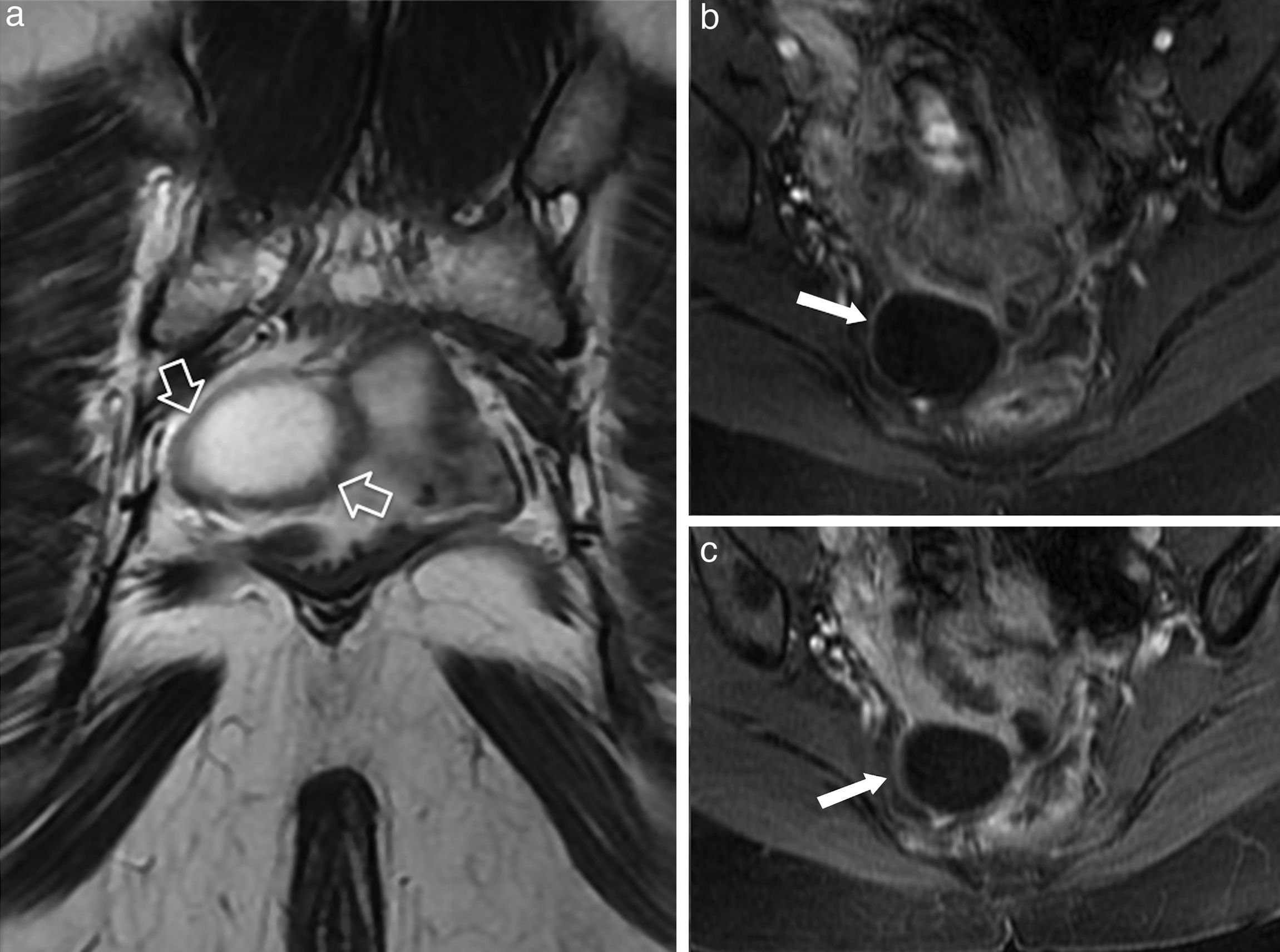
El «quiste epidermoide» es una lesión unilocular benigna, de líquido habitualmente claro, recubierto de epitelio escamoso estratificado (fig. 3). Los «quistes dermoides» presentan tejido cutáneo, folículos pilosos o dientes rudimentarios. Suele tener un contenido graso (hiperintenso en T1) o heterogéneo. Los «quistes entéricos» están recubiertos parcial o totalmente por mucosa intestinal. Los «hamartomas quísticos» (quistes secretores de mucina) pueden ser uni o multiloculados7. El contenido mucinoso les confiere ocasionalmente una leve hiperintensidad en T1. Su tratamiento es la exéresis completa para evitar la recidiva (fig. 4). Los «quistes de duplicación rectales» son raros (4% de los quistes del tracto gastrointestinal). Tienen un recubrimiento mucoso similar al recto (aunque puede contener mucosa gástrica, duodenal o incluso tejido pancreático, que les hace proclives a sangrar)8 y capas musculares que permiten su diagnóstico por RM (fig. 5). Los «quistes neuroentéricos» difieren de los entéricos por tener una lámina propia y capa mucosa madura de origen endodérmico.
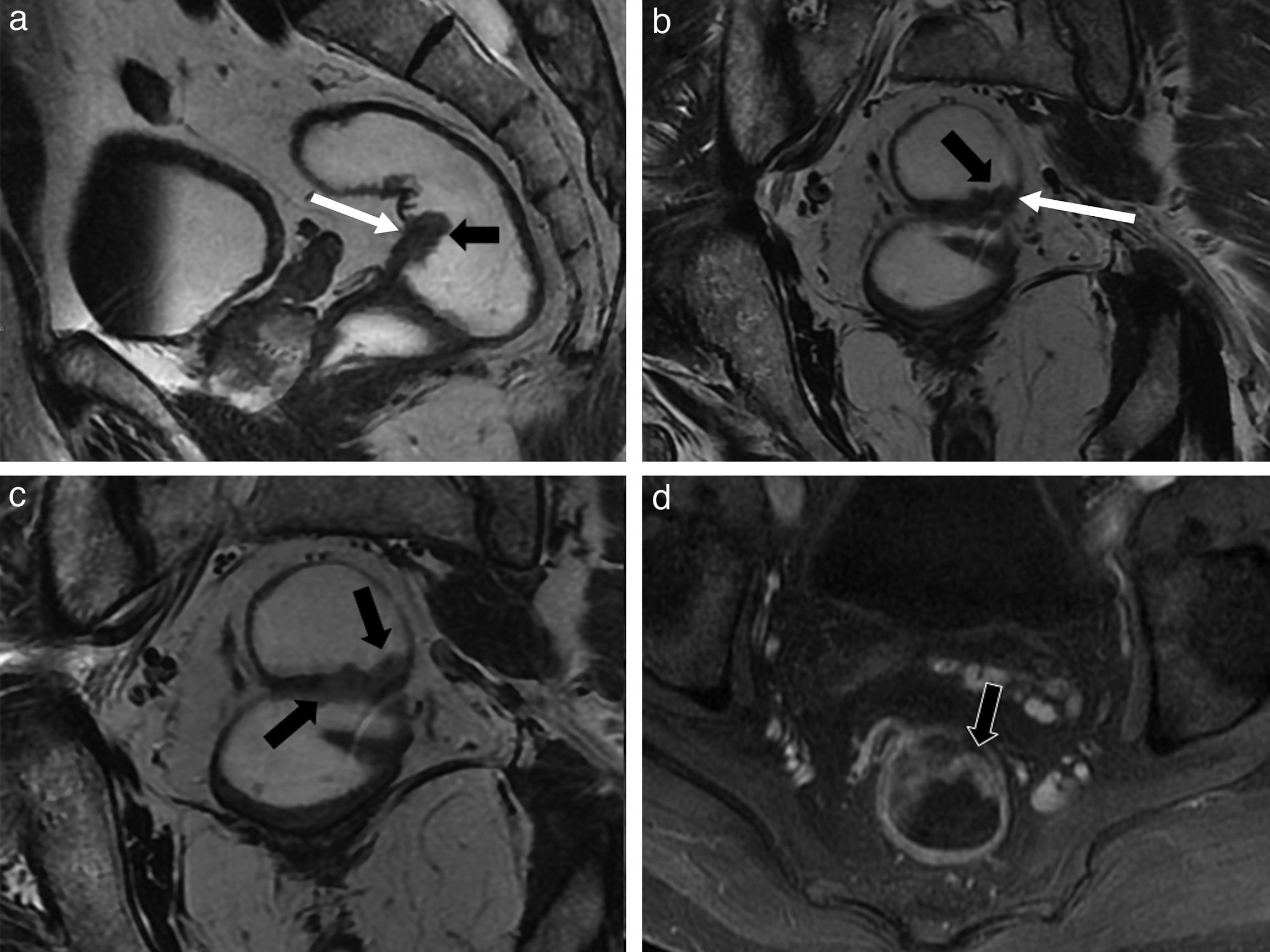
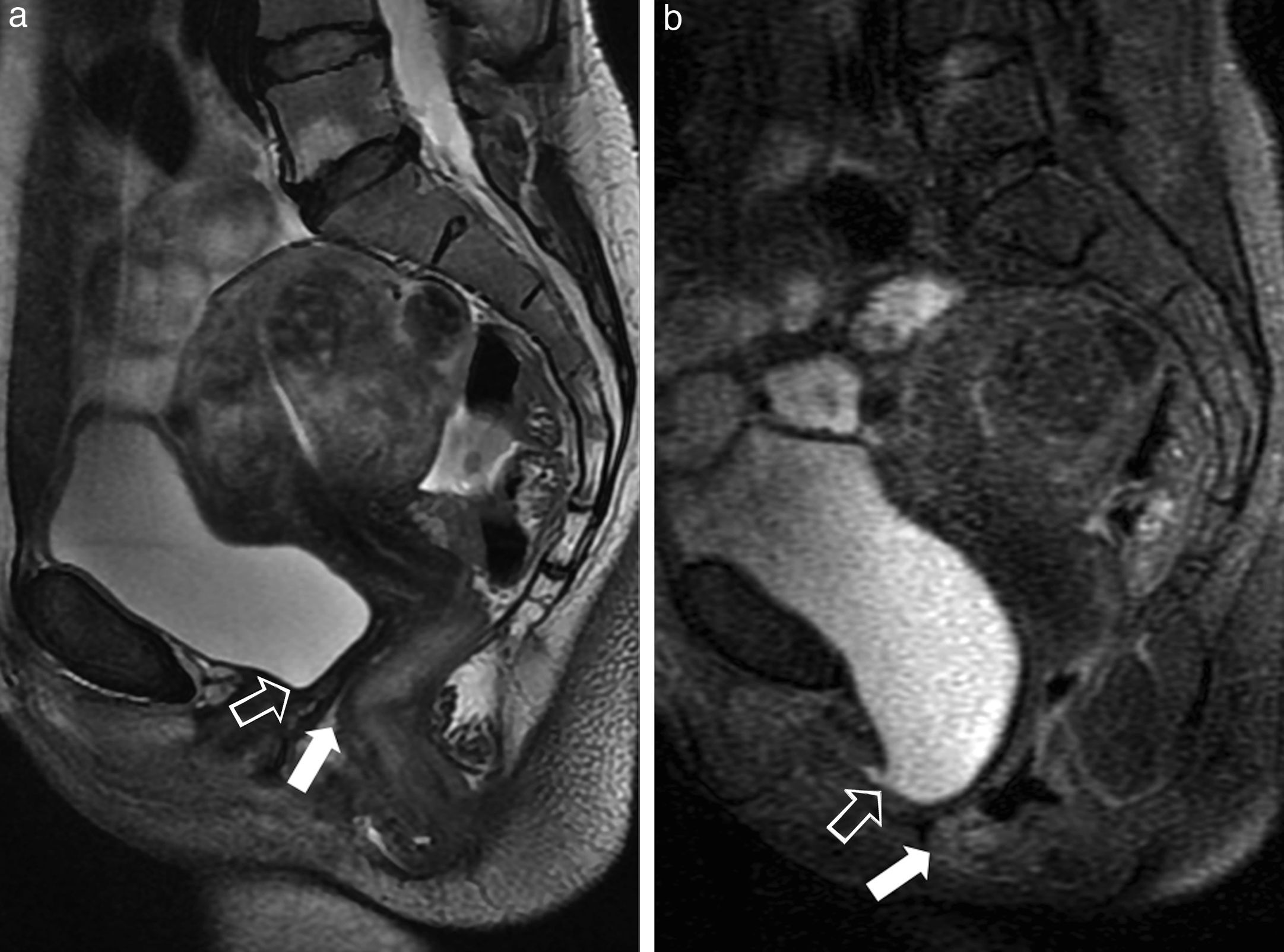
Quiste epidermoide retrorrectal. Imágenes en plano axial (a) ponderada en T2; b) Ponderada en T1; y d) Ponderada en T1 con supresión grasa y tras inyectar de contraste intravenoso. c) Imagen coronal ponderada en T2. Imagen quística unilocular retrorrectal de pared fina en una mujer joven con dificultades en la defecación. El quiste depende del espacio presacro (las flechas blancas finas señalan la línea media del espacio presacro) y desplaza y comprime la pared lateral derecha del recto (flechas blancas gruesas). Además, la lesión se apoya sobre el músculo elevador del ano derecho (flecha negra). En este caso el quiste demuestra una moderada hipointensidad en las secuencias ponderadas en T2, y es levemente hiperintenso en las ponderadas en T1, probablemente por un contenido mucinoide o proteináceo denso, o una complicación hemorrágica interna, lo que no es infrecuente.
Hamartoma quístico retrorrectal. a) Imagen axial ponderada en T2; y b) Imagen axial ponderada en T1. c) Imagen sagital ponderada en T2. Se observa una lesión quística de paredes finas, multiloculada, diagnosticada tras la su resección de un hamartoma quístico retrorrectal en una mujer de mediana edad, que presentaba dolor pélvico y dificultad en la defecación. Esta masa depende del espacio presacro (las flechas negras indican que contacta con la línea media en el espacio presacro). Las cabezas de flecha blancas señalan los múltiples septos internos. Las flechas blancas indican la presencia de contenido hemático en varios estadios en las cavidades del quiste. El recto se encuentra desplazado anterolateralmente por el quiste.
Quiste de duplicación rectal. a) Imagen ponderada en T2 en el plano coronal; b y c) imágenes axiales T1 con supresión grasa tras la administración de contraste intravenoso. Lesión quística de pared gruesa, unilocular, descubierta de forma incidental con TC en un paciente asintomático. Estas lesiones presentan continuidad con la pared del recto, con capa de músculo liso (flechas huecas) y mucosa en continuidad con la mucosa del recto. Las flechas sólidas en b y c) señalan la pared gruesa del quiste con el mismo realce que la pared del recto. Nótese que el quiste de duplicación no contacta con el espacio retrorrectal.
Habitualmente estas lesiones quísticas del desarrollo se descubren de forma incidental en pacientes asintomáticos5. Las complicaciones5,6 como la infección por fistulización, sangrado (fig. 4) o malignización9 son infrecuentes.
El diagnóstico diferencial es extenso, e incluye principalmente a las lesiones quísticas de origen ginecológico y otras lesiones de aparición muy infrecuente10 entre las que hay que considerar al teratoma sacrococcígeo, al meningocele sacro anterior o al leiomiosarcoma rectal con degeneración quística6,11.
Masas quísticas ginecológicasSon bastante más frecuentes que las anomalías del desarrollo retrorrectal y habitualmente se encuentran en pacientes asintomáticas o en estudio por problemas de infertilidad. Rara vez son de tamaño suficiente como para afectar a la defecación o producir síntomas relacionados.
Entre un amplio diagnóstico diferencial, hay que destacar por su frecuencia a las masas ováricas benignas (teratoma maduro, quistes dermoides) (fig. 6) y, entre las lesiones no ováricas, la salpingitis y los quistes del paraovario12.
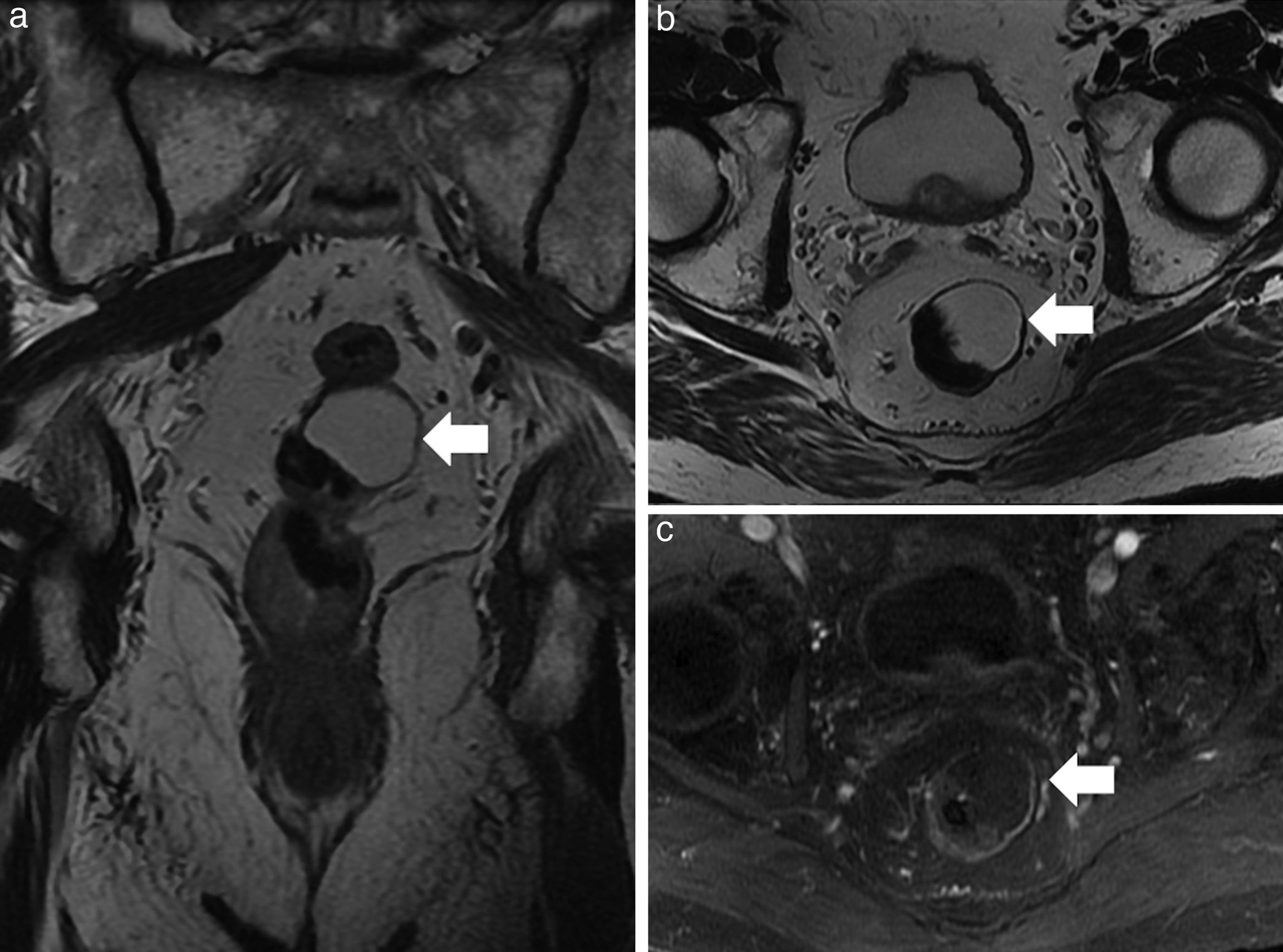
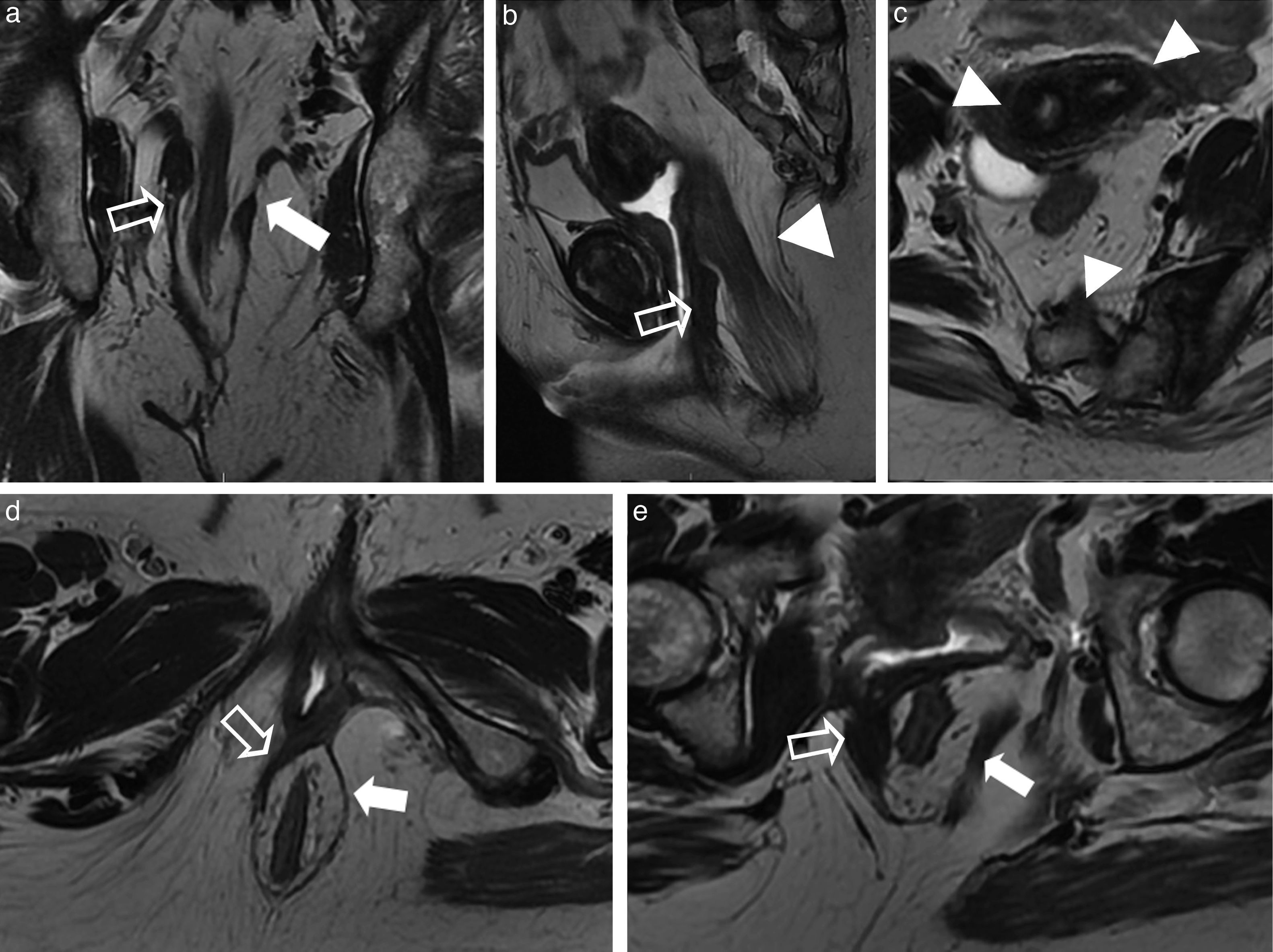
Masas anexiales. a) Imagen axial ponderada en T2 con supresión grasa; b) Imagen axial ponderada en T2 de una paciente joven con problemas en la defecación. Las flechas blancas señalan al recto superior y sigma comprimidos extrínsecamente por 2 masas anexiales con contenido heterogéneo, pero que muestran contenido graso macroscópico, consistentes con 2 voluminosos teratomas maduros, confirmados tras la resección quirúrgica. c) Imagen coronal ponderada en T2 con supresión grasa; d) Imagen axial ponderada en T1 de otra paciente donde se demuestra una lesión quística anexial derecha (flechas huecas) en contacto con la pared lateral derecha del recto, que correspondía a un quiste epidermoide. Los quistes epidermoides son lesiones benignas, uniloculares, que contienen habitualmente un líquido claro y recubierto de una capa fina de epitelio escamoso estratificado. Se diferencian de los quistes dermoides en la apariencia macroscópica y microscópica por la ausencia de apéndices cutáneos como folículos pilosos, glándulas sudoríparas o rudimentos dentales.
Su localización es muy variable. Generalmente se puede determinar bien su dependencia aunque en lesiones grandes o localizadas en el fondo de saco rectouterino puede ser difícil. Es útil para su diagnóstico diferencial la ausencia de contacto con el espacio presacro y localización diferente a línea media.
Tumores benignos de recto y anoLos tumores parietales benignos AR no son infrecuentes, principalmente pólipos mucosos (hiperplásicos o adenomatosos) y menos frecuentemente, lesiones tumorales submucosas mesenquimales (lipomas o leiomiomas)5.
Los pólipos benignos se encuentran en el 7-50% de la población, más frecuentemente en pacientes mayores13. Se pueden dividir en pólipos hiperplásicos (fig. 7), sin potencial maligno, y adenomatosos. Entre estos merecen mención los adenomas vellosos (fig. 8), que pueden presentar un crecimiento extenso tapizando la mucosa, hasta alcanzar gran tamaño5.
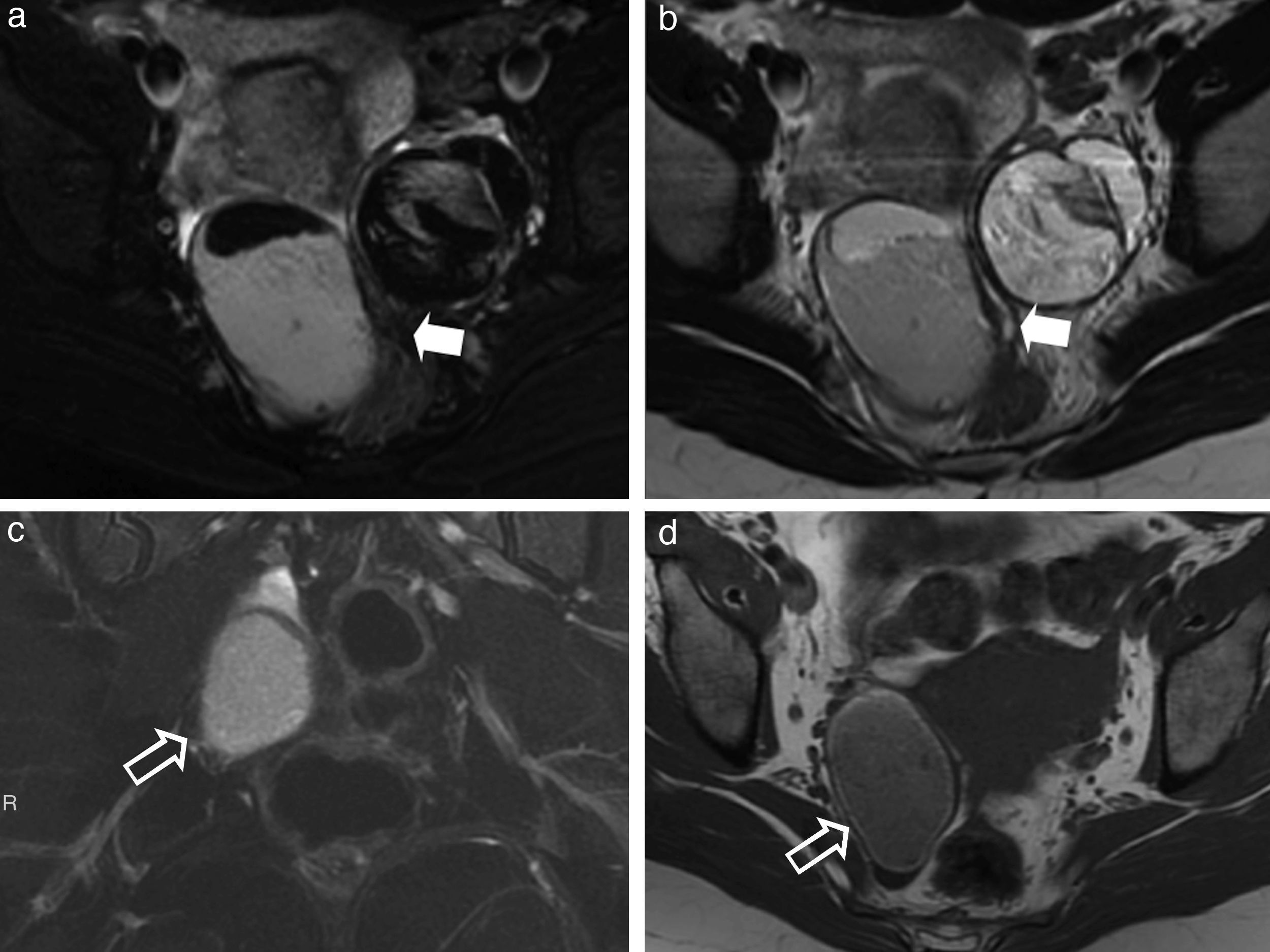
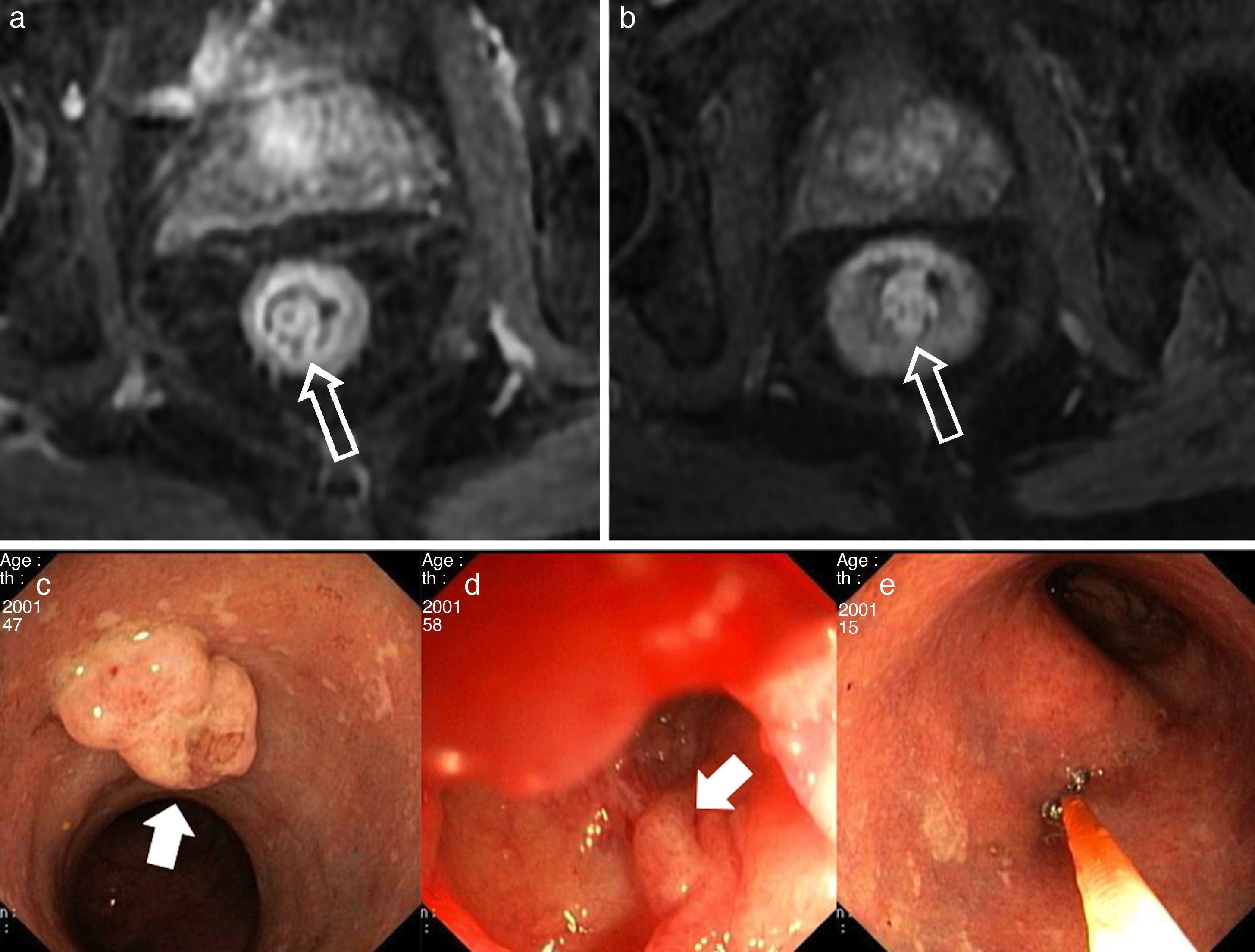
Pólipos hiperplásicos. a y b) Imágenes axiales ponderadas en T1 con supresión grasa tras la administración de contraste intravenoso, a) En fase arterial; y b) En fase venosa tardía. Las flechas huecas señalan a pólipos rectosigmoideos hiperplásicos. Nótese en a) la captación precoz del pólipo que es similar a la de la mucosa rectal, de la cual depende. Se identificaban pólipos hiperplásicos en el íleon distal de similares características (no mostrados). En las imágenes c, d y e) de endoscopia digestiva baja se identifican estos pólipos rectosigmoideos (flecha sólida en c), en el íleon distal (flecha sólida en d) y los cambios inflamatorios en la mucosa rectal compatibles con rectitis (e) en el contexto de una enfermedad de Crohn.
Adenoma velloso. a) Imagen sagital ponderada en T2; b y c) Imágenes coronales ponderadas en T2; d) Imagen axial ponderada en T1 con supresión grasa tras la administración de contraste intravenoso. El recto ha sido distendido con gel ecográfico estéril templado para mejorar la definición de la lesión. Se identifica una formación polipoidea vegetante que tapiza la mucosa con proyecciones papilares hacia la luz rectal (flechas negras) sin afectar ni interrumpir las capas parietales profundas (flechas blancas). En el estudio con contraste se define la dependencia mucosa del pólipo (flecha negra en d). El adenoma velloso se encuentra fundamentalmente en pacientes ancianos y ocasionalmente se manifiesta con sangrado, secreción mucosa o incluso prolapso rectal.
Los pólipos tubulovellosos se deben extirpar por su potencial de malignización. Las lesiones benignas submucosas son infrecuentes, frecuentemente leiomiomas o lipomas (fig. 9). El tratamiento está condicionado por la sintomatología y el tamaño de la lesión.
Gran lipoma submucoso rectal. a) Imagen coronal ponderada en T2; b) Imagen axial ponderada en T2; y c) Imagen axial ponderada en T1 con supresión grasa tras la administración de contraste intravenoso. Las flechas blancas señalan a un voluminoso lipoma rectal submucoso que ocasiona un defecto lobulado de repleción hacia la luz rectal en un paciente con dificultad en la defecación. Nótese que la lesión es homogénea en su señal y se comporta de igual modo que el tejido graso en todas las secuencias de pulso. La mayoría de lipomas submucosos son asintomáticos y se descubren de manera accidental.
Las malformaciones anorrectales son infrecuentes y generalmente esporádicas, aunque pueden verse en síndromes junto a anomalías urogenitales y espinales (VACTERL, Currarino)14,15.
Durante el desarrollo embrionario precoz (<49 días posfertilización), el intestino y seno urogenital primitivos y el tubo neural caudal están íntimamente relacionados (cloaca primitiva). La parte ventral de la cloaca primitiva participa en la formación del seno urogenital. La dorsal se incorporará a la cavidad amniótica sin participar del desarrollo AR.
Durante el período embrionario tardío (>49 días) existe una fase de oclusión del conducto anal, formándose un tapón epitelial temporal con recanalización posterior por mecanismos apoptóticos.
Debe recordarse que: las malformaciones anorrectales pueden subdividirse en malformaciones con ano ectópico y con ano ortotópico anómalo. La mayoría son de tipo ano ectópico comunicante (al tracto genitourinario [fig. 10] o al periné) y se denomina fístula a esta apertura anómala del tracto intestinal. Estos tipos están probablemente causados por una alteración del desarrollo de la región dorsal de la cloaca durante el período embrionario precoz. La localización de la fístula depende del grado de regresión de la cloaca posterior. Cuanto más grave, más craneal y amplia será la comunicación con el seno urogenital. Malformaciones leves comunican más caudalmente (fístulas perineales) (fig. 11).
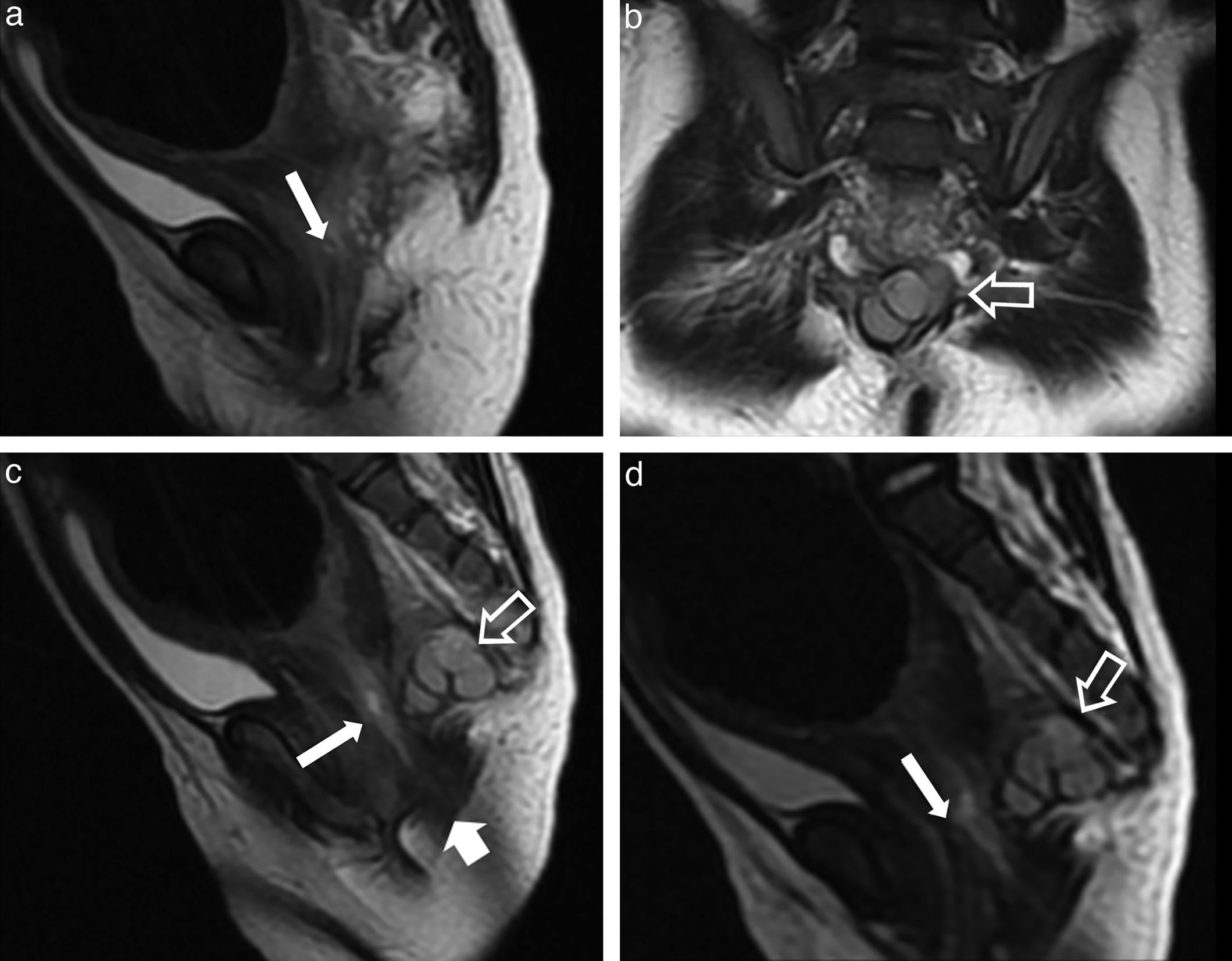
Malformación anorrectal de tipo fístula recto-vaginal. a, c y d) Imágenes sagitales ponderadas en T2; b) imagen coronal ponderada en T2. Malformación con ano ectópico y fístula recto-vaginal alta (flechas sólidas finas) en una niña de 2 meses con clínica de estreñimiento pertinaz y expulsión de heces por la vagina. Existe una rectificación del trayecto rectal con estenosis anorrectal. Nótese la importante dilatación sigmoidea que requirió una ileostomía de descarga y reparación anorrectal. Además, se acompañaba de un hamartoma quístico retrorrectal (flechas huecas) y agenesia de los últimos elementos coccígeos. Falta la anomalía del hueso sacro para cumplir criterios de la triada de Currarino. El denominado síndrome de regresión caudal se define como un espectro de anomalías congénitas anorrectales, urogenitales y esqueléticas, donde encontramos la sirenomelia y el ano imperforado como extremos opuestos.
Malformación anorrectal de tipo fístula anoperineal con ano ectópico. a y b) Imágenes axiales ponderadas en T2 que muestran la malformación anorrectal con ectopia anal (flechas blancas gruesas). Nótese la asimetría del músculo puborrectal y del esfínter externo a favor del lado izquierdo (flechas finas). Se sospechaba además una fístula anovaginal (cabeza de flecha blanca) que se excluyó quirúrgicamente. c) Imagen sagital ponderada en T2. Nótese la posición anterior del ano abierto al periné (ano ectópico) señalado por flechas huecas. El recto ha sido distendido con gel ecográfico estéril templado. Las flechas sólidas señalan la posición de la vagina. d y e) Fotografías de la región perineal pre y poscirugía (cortesía del Dr. Ávila Ramírez). Las cabezas de flecha negras señalan la proximidad del ano y la vagina por ectopia anal corregida en el acto quirúrgico.
La malformación cloacal ocurre exclusivamente en mujeres. Los tractos genital, urinario e intestinal convergen en una cavidad (cloaca) ocasionada por regresión de toda la membrana cloacal.
Menos común es la malformación con ano en posición ortotópica (atresia, ano imperforado, estenosis) por defectos de recanalización en el período embrionario tardío.
La RM es muy útil para valorar la malformación anorrectal tanto antes14 como tras la corrección quirúrgica16 (fig. 12).
Debe recordarse que: estudiarla adecuadamente implica determinar el nivel y tipo de la malformación anorrectal, existencia de fístula, grado de desarrollo esfinteriano y otras anomalías asociadas (comúnmente espinales y urogenitales)14,17. Las antenas de superficie phased-array obtienen resultados similares a las endocavitarias para valorar las estructuras enfinterianas18,19.
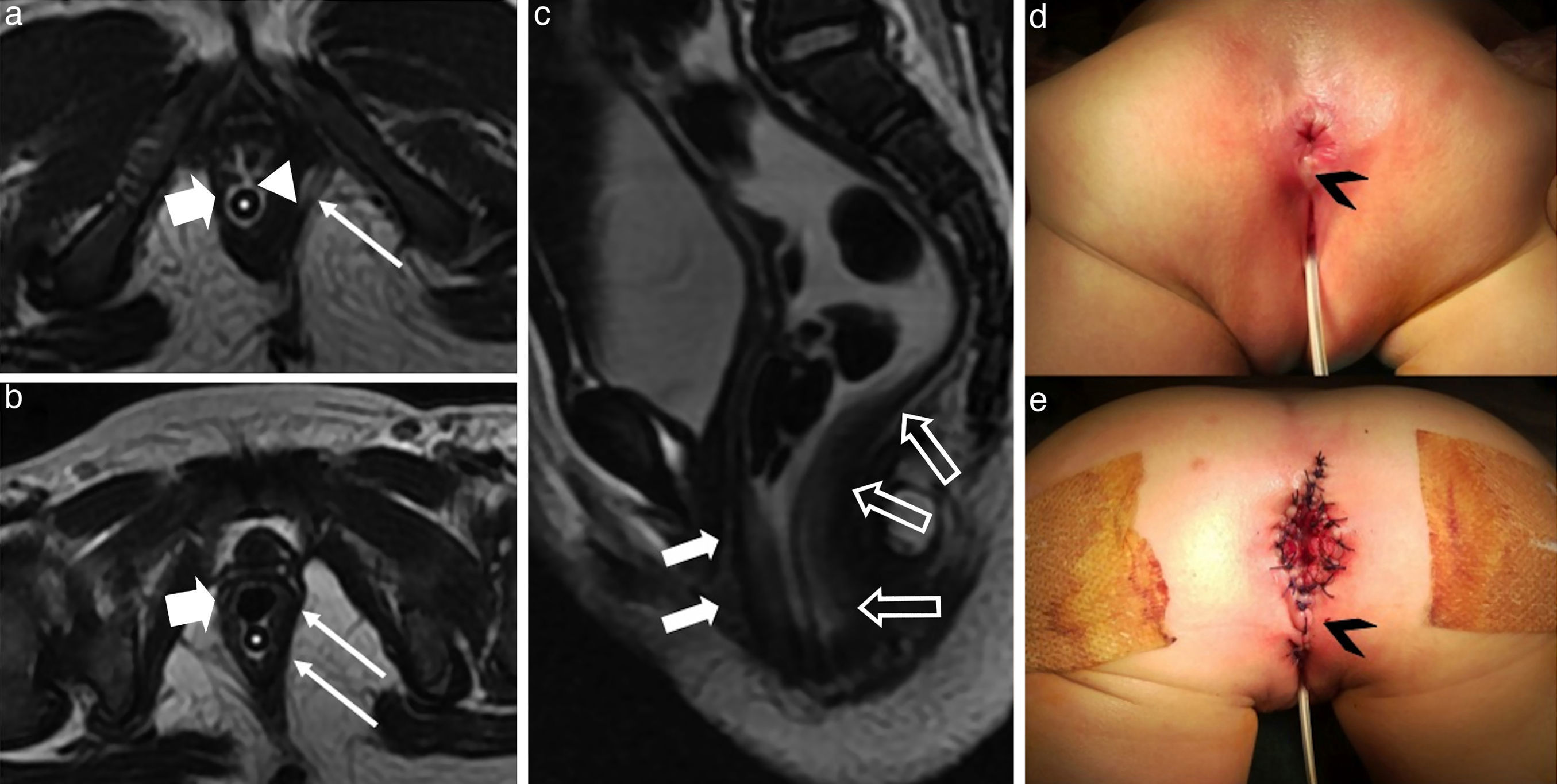
Síndrome de VACTERL. Mujer de mediana edad con antecedente de corrección quirúrgica anorrectal en la infancia por síndrome de VACTERL, que actualmente presenta dificultad en la defecación. a) Imagen coronal ponderada en T2; b) Imagen sagital ponderada en T2; c, d y e) Imágenes axiales ponderadas en T2. El conducto anorrectal corregido quirúrgicamente está situado en la línea media, pero es excéntrico respecto al complejo esfinteriano, el cual es muy asimétrico y presenta una disposición excesivamente rectificada en la imagen sagital. Las flechas huecas señalan el engrosamiento irregular del músculo puborrectal y del esfínter externo derecho. Las flechas sólidas indican la irregularidad y atrofia del músculo puborrectal izquierdo y fibras del esfínter externo en el lado izquierdo. Nótese la presencia del paquete graso acompañando al ano reparado en el interior del conducto anorrectal. Las cabezas de flechas señalan la agenesia sacra y malformación uterina con útero bicorne.
Las anomalías esfinterianas adquiridas en el adulto suelen estar relacionadas con la debilidad del suelo pélvico, que es especialmente frecuente en mujeres multíparas y de edad avanzada20. El uso de imágenes fluoroscópicas (modo cine) o secuencias ultrarrápidas en reposo y Valsalva (fig. 13) puede ser útil para demostrar estas anomalías. No obstante, el estudio dinámico rectal está fuera de los objetivos de esta revisión y no lo incluimos en el protocolo habitual. En raras ocasiones la anomalía de la dinámica AR es secundaria a secuelas traumáticas demostrables en estudio de RM (fig. 14).
Laxitud del suelo pélvico. a) Imagen sagital ponderada en T2; y b) Secuencia fluoroscópica ultrarrápida de estudio dinámico ponderada en T2 con maniobra de Valsalva. La clave para la interpretación de estas condiciones patológicas es reconocer la posición de las estructuras pélvicas respecto a la línea pubococcígea en el plano sagital. La línea pubococcígea se extiende desde el borde anterior de la sínfisis del pubis hasta la última articulación coccígea. Un descenso mayor de 1cm por debajo de esta línea en maniobras de Valsalva es indicativo de laxitud del suelo pélvico. En este caso, ya en el estudio basal se demuestra una excesiva angulación de la transición anorrectal (flecha sólida en a) con el suelo vesical sobrepasando caudalmente la línea pubococcígea (flecha hueca en a). En esta mujer de edad media con estreñimiento, dificultad en la defecación e incontinencia urinaria, el estudio dinámico en Valsalva es diagnóstico de laxitud pélvica. Nótese el importante descenso de la base vesical y uretra (cistocele indicado con la flecha hueca) y abombamiento pseudodiverticular del recto inferior (rectocele, flecha sólida en b).
Anomalías esfintéricas adquiridas. Traumatismo esfinteriano. a) Imagen coronal ponderada en T2; b y c) Imágenes axiales ponderadas en T2; y d) Imagen axial ponderada en T1. Varón joven con dificultades en la defecación y dolor perineal vago de inicio insidioso y progresivo después de un traumatismo pélvico. Nótese la asimetría muscular esfinteriana. Existen cambios atróficos con reemplazamiento graso parcial y adelgazamiento del músculo obturador interno derecho (flechas huecas finas) comparado con el contralateral (flechas huecas gruesas). Nótense también los cambios atróficos crónicos sutiles del músculo elevador del ano derecho (cabeza de flecha) y músculo puborrectal (flechas sólidas finas) en comparación con la musculatura contralateral (flechas sólidas gruesas). La flecha curva en d) señala a las irregularidades del esfínter externo.
La RM 3T con protocolo de alta resolución es la prueba de imagen ideal para la valoración de patología de la AR por su elevada resolución espacial y tisular. En esta primera parte de una amplia revisión de procesos patológicos benignos AR hemos repasado las principales anomalías del complejo esfinteriano AR, congénitas o adquiridas, y de los tumores benignos y lesiones quísticas del desarrollo más frecuentes en esta región anatómica, de utilidad al radiólogo a la hora de realizar su diagnóstico.
Además, realizamos un recuerdo anatómico del complejo esfinteriano AR y de la región perirrectal junto al protocolo de alta resolución en RM de 3.0 T.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autorías- 1.
Responsable de la integridad del estudio: LHH, EAM y VMVF.
- 2.
Concepción del artículo: LHH, RCA y JCA.
- 3.
Diseño del artículo: LHH, RCA, EAM y VMVF.
- 4.
Obtención de los datos: LHH, RCA, EAM, JCA y VMVF.
- 5.
Análisis e interpretación de los datos: No procede.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: LHH, RCA, EAM, JCA y VMVF.
- 8.
Redacción del trabajo: LHH, EAM y RCA.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: LHH, RCA, EAM, JCA y VMVF.
- 10.
Aprobación de la versión final: LHH, RCA, EAM, JCA y VMVF.
Los autores declaran no tener ningún conflicto de intereses.