La patología benigna anorrectal comprende una vasta cantidad de entidades de muy diversos orígenes, congénitas o adquiridas, inflamatorias o tumorales. Sin embargo, ha recibido menos atención en la bibliografía científica que el estudio de la patología tumoral maligna. En esta segunda entrega de la revisión basada en imágenes de la patología benigna anorrectal describimos la patología inflamatoria y fistulosa más frecuente, la anatomía posquirúrgica y las complicaciones secundarias al tratamiento quirúrgico o radioterápico de la patología anorrectal.
Benign anorectal disease comprises a broad group of processes with very diverse origins; these processes may be congenital or acquired as well as inflammatory or tumor related. However, benign anorectal disease has received less attention in the scientific literature than malignant disease. In this second part of this image-based review of benign anorectal disease, we describe the most common inflammatory and fistulous diseases, the postsurgical anatomy, and complications that can occur after surgical treatment or radiotherapy for anorectal disease.
Continuando con la revisión de la patología benigna anorrectal (AR) por resonancia magnética (RM) dedicamos esta revisión a la patología inflamatoria y posquirúrgica. Diagnosticar y describir correctamente la patología inflamatoria es esencial para el manejo quirúrgico y puede resultar en un cambio urgente de la actitud terapéutica.
El objetivo de esta revisión es repasar las principales entidades inflamatorias AR, en especial la patología fistulosa, recordar brevemente los métodos quirúrgicos más frecuentes en la patología AR, la anatomía posquirúrgica y las complicaciones posquirúrgicas y posactínicas más frecuentes de la región AR.
Patología inflamatoria anorrectalPatología fistulosa y sepsisLa RM es la técnica de elección1,2 por su mayor sensibilidad y especificidad para detectar trayectos fistulosos3, valorar complicaciones y determinar la implicación de otros órganos, lo que la hace fundamental para la toma de decisiones prequirúrgicas4. Las fístulas y trayectos fistulosos se delimitan mejor con imanes de 3.0T que de 1.5T, gracias a que la definición tisular y anatómica mejora con la potencia del campo5.
Las fístulas perianales suelen ser idiopáticas, secundarias a una infección crónica de las criptas intramurales anales (hipótesis criptoglandular)6,7, pero también pueden relacionarse con la enfermedad inflamatoria intestinal (EII), especialmente la enfermedad de Crohn, tuberculosis, trauma, radioterapia, neoplasias o infección pélvica1. La elevada frecuencia de recidivas se atribuye sobre todo a la persistencia de trayectos o abscesos no resecados4.
Debe recordarse que: la RM detecta mejor que la exploración quirúrgica los trayectos y colecciones prequirúrgicas, lo que disminuye la tasa de recidivas7–9.
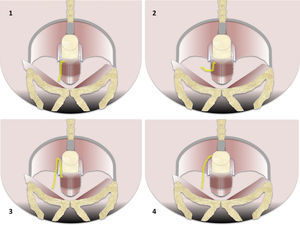
Según el trayecto, las fístulas se dividen en 4 tipos, que por orden de mayor a menor frecuencia son: interesfinteriano, transesfinteriano, supraesfinteriano y extraesfinteriano7 (fig. 1).
Tipos de fístulas en la clasificación de Parks. 1) Interesfinteriana (45%). El trayecto de la fístula cursa caudalmente a lo largo del espacio interesfinteriano a la piel o al periné, completamente confinado por el esfínter externo, al que nunca perfora. Respeta los espacios de la fosa isquiorrectal e isquioanal. 2) Transesfinteriana (30%). Perfora el esfínter anal externo extendiéndose a la fosa isquiorrectal o isquioanal y, a través de ellas, puede prolongarse caudalmente al periné o a la piel, anteriormente a la vagina o vejiga, o incluso cranealmente al músculo elevador del ano. 3) Supraesfinteriana (20%). Diseca el espacio interesfinteriano hasta el espacio supraelevador sobre el músculo puborrectal y perfora al elevador del ano para alcanzar la fosa isquiorrectal e isquioanal, y desde allí la piel o el periné. 4) Extraesfinteriana (5%). No se origina en la región perianal, sino que se produce por extensión caudal de un foco de infección del espacio supraelevador. Se caracteriza porque el espacio interesfinteriano está respetado. En una fístula extraesfinteriana se debe buscar un proceso purulento pélvico que atraviese caudalmente al músculo elevador del ano.
El «interesfinteriano» supone entre el 45-60% de los trayectos fistulosos7,9,10. El espacio interesfinteriano es una barrera anatómica para la extensión a la fosa isquiorrectal. Pueden desarrollarse trayectos secundarios con forma «en herradura» en el propio espacio interesfinteriano1.
El tipo «transesfinteriano» (20-30%)7,9,10 es el que tiene un riesgo de incontinencia potencialmente mayor, puesto que compromete ambos esfínteres1. Se extiende a los espacios isquiorrectales o isquioanales y se acompaña frecuentemente de hiperemia, flemones o abscesos1,2. La fístula «supraesfinteriana» (5-20%) se origina en el espacio interesfinteriano con un trayecto ascendente que se extiende por encima de la inserción de los músculos puborrectal y elevador del ano, y perfora al elevador del ano para alcanzar la fosa isquiorrectal7,9,10. El último tipo, el «extraesfinteriano» (2-5%)7,9,10, no afecta al espacio interesfinteriano7, lo que indica que su origen es diferente, probablemente por patología rectal o pélvica, inflamatoria o maligna7,10.
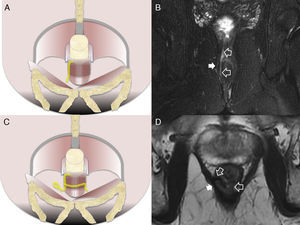
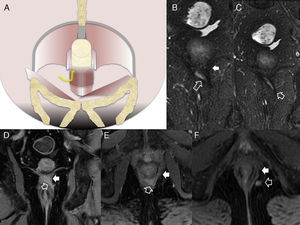
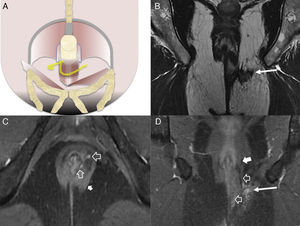
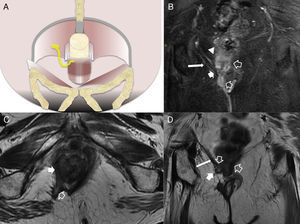
La clasificación quirúrgica de las fístulas perianales descrita por Parks et al.10, comúnmente aceptada, ha sido adaptada a la imagen por RM para convertirse en la clasificación del St James's University Hospital1. En ella, las fístulas se dividen en 5 grados dependiendo de que los trayectos sean simples o complejos, y de que haya abscesos, perforación del esfínter externo y extensión a espacios supraelevadores. En el grado 1, hay un trayecto interesfinteriano simple, sin abscesos, sin perforación del esfínter externo ni extensión a los espacios supraelevadores (fig. 2). El grado 2 se caracteriza por un trayecto interesfinteriano complejo o asociado a absceso (fig. 2). El grado 3 consiste en un trayecto transesfinteriano (perfora el esfínter externo) o supraesfinteriano, con un trayecto simple sin abscesos ni extensión por encima de los espacios supraelevadores (fig. 3). En el grado 4, hay un trayecto transesfinteriano o supraesfinteriano complejo o se asocia a un absceso (fig. 4). Finalmente, el grado 5 consiste en un trayecto que se extiende craneal a los espacios supraelevadores (fig. 5).
Debe recordarse que: el informe radiológico debe describir la afectación del complejo esfinteriano, el punto de origen, el tipo de trayecto principal, los trayectos secundarios, los abscesos, el punto de salida si existe, y la implicación de los músculos puborrectal y elevador del ano4,10. Sin embargo, esta clasificación por sí sola es limitada puesto que es necesario referir también la afectación de otros órganos pélvicos (próstata, raíz del pene, uretra y vagina) (fig. 6), y complicaciones perineales que puedan modificar el tratamiento y pronóstico (fig. 7).
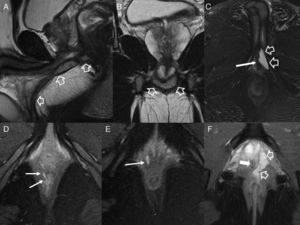
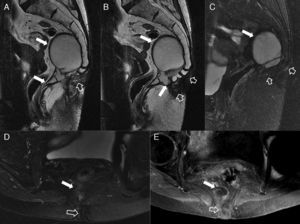
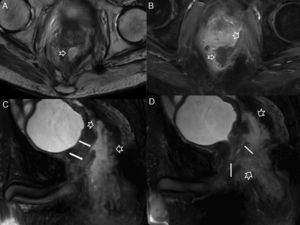
Afectación fistulosa a otras estructuras pélvicas. A) Imagen sagital potenciada en T2. B) Imagen coronal potenciada en T2, en las que las flechas huecas señalan un trayecto fistuloso abscesificado que se extiende hacia la raíz del pene (con trayecto secundario en herradura en B), y a la cavidad escrotal. C) Imagen axial potenciada en T2 con supresión grasa en otro paciente con trayecto fistuloso abscesificado (flechas huecas) en la raíz del pene que se abre a la uretra peneana (flecha sólida fina). D y E) Imágenes axiales potenciadas en T1 con supresión grasa tras la administración de contraste iv en las que las flechas sólidas finas señalan un trayecto fistuloso rectovaginal. F) Imagen axial potenciada en T2 con supresión grasa en la que las flechas huecas indican un trayecto fistuloso perianal abscesificado intraprostático. La flecha sólida señala la posición de la uretra prostática, no afectada.
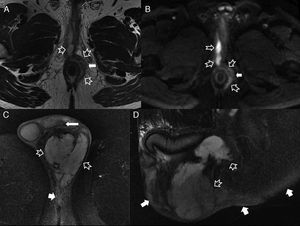
Complicaciones perineales sépticas. A) Imagen axial potenciada en T2. B) imagen axial de secuencia potenciada en difusión (B 600) de un paciente con fístula perianal compleja con un trayecto interesfinteriano en herradura, que perfora después el esfínter externo hacia la fosa isquioanal izquierda y produce un absceso que se extiende a la raíz del pene y al cuerpo cavernoso derecho del pene (flechas huecas). Nótese la extensa afectación inflamatoria del músculo puborrectal y el esfínter externo izquierdos por una miositis grave (flechas sólidas). C) Imagen axial potenciada en T2 con supresión grasa. D) imagen sagital potenciada en T2 con supresión grasa de otro paciente con un voluminoso absceso escrotal izquierdo (flechas huecas) que respeta la túnica albugínea peritesticular (flecha sólida fina en C). Nótese la extensa afectación inflamatoria del tejido celular subcutáneo perineal (flechas sólidas gruesas). El paciente fue intervenido quirúrgicamente con urgencia en la que se confirmó una gangrena de Fournier incipiente que requirió desbridar extensamente el periné.
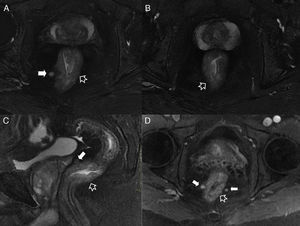
Fístulas interesfinterianas. A y C) Esquemas en el plano coronal de fístulas interesfinterianas simple y compleja, respectivamente. B) Imagen coronal potenciada en T2 con supresión grasa donde se observa una fístula interesfinteriana (flechas huecas) tipo 1 que respeta el plano del esfínter externo (flecha sólida). D) Imagen axial potenciada en T2 donde se aprecia un trayecto fistuloso en herradura (flechas huecas) tipo 2, confinado por el esfínter externo respetado (flecha sólida).
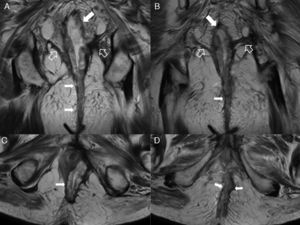
Fístula grado 3 o transesfinteriana. A) Esquema en el plano coronal de una fístula que perfora tanto el esfínter interno como el externo con un trayecto simple. B y C) Imágenes coronales potenciadas en T2 con supresión grasa. D) Imagen coronal T1 con supresión grasa tras administrar contraste iv. E y F) Imágenes axiales potenciadas en T1 con supresión grasa tras administrar contraste iv. Las flechas huecas señalan el trayecto de una fístula transesfinteriana que se inicia en la posición horaria de las 9 con un único trayecto descendente y lateral derecho que alcanza el espacio isquiorrectal izquierdo, perforando el esfínter externo izquierdo (flechas sólidas).
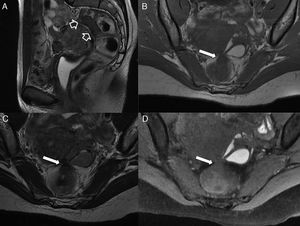
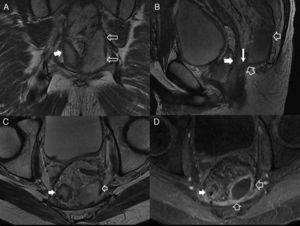
Fístula transesfinteriana compleja o tipo 4. A) Esquema en el plano coronal de una fístula transesfinteriana compleja con un absceso en la fosa isquiorrectal derecha y trayecto secundario. B) Imagen coronal potenciada en T2. C) Imagen axial potenciada en T1 con supresión grasa tras la administrar contraste iv. D) Imagen coronal potenciada en T1 con supresión grasa tras administrar contraste iv. Se identifica una fístula transesfinteriana con un trayecto secundario (flechas huecas), que perfora el esfínter externo izquierdo (flechas sólidas gruesas) y se extiende al espacio isquioanal izquierdo donde se produce un absceso (flechas sólidas finas).
A) Esquema coronal que representa el trayecto fistuloso supraelevador o tipo 5. B) Imagen coronal T2 con supresión grasa. C) Imagen axial potenciada en T2. D) Imagen coronal potenciada en T2. Las flechas huecas señalan una fístula con trayecto supraesfinteriano que perfora a los músculos elevador del ano derecho (flechas sólidas finas) y puborrectal (flechas gruesas). Correspondería a una fístula grado 5 de la clasificación de Parks por su extensión, aunque mínima, al espacio supraelevador derecho (cabeza de flecha blanca).
El 85-95% de las fístulas tienen un trayecto simple4. Los trayectos complejos o con abscesos asociados se acompañan de una mayor tasa de recidiva y complicaciones quirúrgicas4,7. Una complicación importante es la pérdida de la continencia fecal. La lesión del esfínter interno no suele alterar la continencia, mientras que la del externo o músculo puborrectal suele ser más problemática y el riesgo de incontinencia es alto1,11,12. En ocasiones se recurre a colocar setones (pequeños tubos de drenaje medicalizados) que dejan la fístula abierta y permiten que drene lentamente, lo que disminuye el riesgo de sepsis, aunque retrasan la curación13,14. Otra complicación temible es el desarrollo de procesos sépticos perineales extensos que pueden desembocar en la gangrena de Fournier (fig. 7)15.
Fístulas pilonidalesConsisten en un defecto fistuloso cutáneo del desarrollo embrionario en el margen craneal del pliegue interglúteo que puede extenderse en profundidad para conectar con frecuencia con el conducto raquídeo. Puede asociar malformaciones óseas lumbosacras y lesiones intrarraquídeas. Se ha descrito raramente la extensión al espacio isquiorrectal16 e incluso una asociación a patología fistulosa perianal u otras lesiones presacras17 (fig. 8). Diferenciarlas de las fístulas perianales es fácil porque casi nunca afectan al complejo esfinteriano18.
Fístulas pilonidales. A y B) Imágenes sagitales potenciadas en T2. C) Imagen sagital potenciada en T2 con supresión grasa. D) Imagen axial potenciada en T2 con supresión grasa. E) Imagen axial potenciada en T1 con supresión grasa tras administrar contraste iv. Seno pilonidal con extensión fistulosa a la fosa isquiorrectal derecha (flechas huecas) y espacio presacro, donde se aprecia un hamartoma quístico retrorrectal (flechas sólidas) confirmado quirúrgicamente.
La causa más frecuente es la colitis ulcerosa. Comienza en la mucosa rectal y se extiende proximalmente al colon de forma continua. La RM muestra un engrosamiento parietal menos pronunciado y más simétrico que en la enfermedad de Crohn (fig. 9), con un realce parietal marcado2. En la RM hay una hiperintensidad de señal en T2 en la pared con realce estratificado tras administrar contraste intravenoso (iv)2. Puede complicarse con trayectos sinusales, fístulas y/o abscesos perianales, aunque la patología fistulosa perianal es mucho más frecuente en la enfermedad de Crohn.
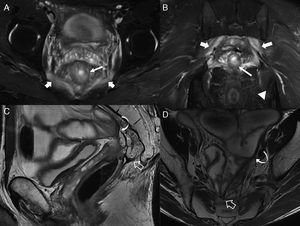
Proctitis. A y B) Imágenes axiales potenciadas en T2 con supresión grasa. C) Imagen sagital potenciada en T2 con supresión grasa. D) Imagen axial potenciada en T1 con supresión grasa tras la administración de contraste iv. Proctitis en un paciente joven con brote inflamatorio activo de enfermedad de Crohn. Cambios inflamatorios en el recto (flechas huecas) con engrosamiento parietal irregular e inflamación transmural demostrada por la hiperintensidad de señal parietal en las secuencias T2 y captación del contraste. Nótese la irregularidad mucosa por las úlceras superficiales y profundas, y las adenopatías mesorrectales inflamatorias (flechas sólidas).
Los divertículos rectales son infrecuentes19,20. La mayoría se diagnostican incidentalmente aunque pueden inflamarse o causar molestias cuando el divertículo es voluminoso19,20.
Endometriosis anorrectalEs un proceso inflamatorio recurrente que puede involucrar al rectosigma y al tabique rectovaginal21.
Debe recordarse que: el tubo digestivo se encuentra afectado con frecuencia en la endometriosis pélvica profunda21,22 y la RM tiene una gran precisión diagnóstica para su detección23,24, por lo que es la técnica de elección, superior a la ecografía, para valorar esta patología en el compartimento posterior21.
La endometriosis anorrectal se produce generalmente en casos avanzados, y las pacientes consultan por molestias en la defecación, crisis suboclusivas o dispareunia21,24. Las localizaciones más frecuentes de endometriosis intestinal son, por este orden: rectosigmoidea25, apendicular, cecal e ileal terminal21.
La endometriosis puede tener apariencias muy diversas en la imagen. Los endometriomas son lesiones quísticas con contenido hemático, heterogéneo, a veces con niveles, hiperintensos en ambas secuencias de pulso, que persisten hiperintensos en las secuencias T1 con supresión grasa (necesario para diferenciarlos de teratomas quísticos), y pueden presentar una degradación de señal interna en T2 (shading) debido al componente de sangrado crónico21.
Debe recordarse que: la endometriosis pélvica profunda, infiltrante o sólida (>5mm de invasión subperitoneal) se caracteriza por implantes, habitualmente hipointensos en las secuencias T2 e iso o hiperintensos en T121,25. Los implantes se adhieren a la serosa e invaden en profundidad la capa muscular estimulando la proliferación de músculo liso, lo que puede causar estenosis por el engrosamiento parietal y procesos obstructivos22,24,25 (fig. 10). Rara vez alcanzan la mucosa intestinal y ocasionan sangrados digestivos. La proliferación glandular también es posible, y se caracteriza por la hiperintensidad en T222. Menos frecuente es que se presente como un depósito fibrótico lineal o nodular espiculado hipointenso, que retrae el asa intestinal afecta24. Este tipo de presentación se acompaña frecuentemente de episodios de suboclusión intestinal cuyo diagnóstico diferencial son las bridas24.
Endometriosis infiltrante rectosigmoidea. A) Imagen sagital potenciada en T2. B) Imagen axial potenciada en T1. C) Imagen axial potenciada en T2. D) Imagen axial potenciada en T1 con supresión grasa. El torus uterino (depresión de la cara posterior del cuerpo uterino donde confluyen los ligamentos uterosacros) está afectado por una endometriosis profunda con un implante de señal de intermedia a baja en las secuencias potenciadas en T2 (flechas sólidas). La retracción de la pared rectosigmoidea puede deberse a adherencias fibróticas entre el torus uterino y la serosa rectosigmoidea, o como en este caso, por invasión directa de la capa muscular con proliferación fibromuscular (flechas huecas en A). Nótese el endometrioma anexial izquierdo.
Una localización infrecuente pero característica es el tabique rectovaginal25. Es útil en estos casos la distensión de la cavidad vaginal con gel para valorar mejor la pared vaginal y el tabique rectovaginal26.
Anatomía posquirúrgica y complicaciones secundarias al tratamiento de la patología anorrectal tumoral o benignaLa RM es eficaz para detallar la anatomía posquirúrgica y estudiar las complicaciones postratamiento de la patología anorrectal14. Conocer las diferentes técnicas quirúrgicas y sus manifestaciones en la RM es esencial para poder interpretar la imagen. Las complicaciones posquirúrgicas más frecuentes son: abscesos, fístulas, fibrosis posquirúrgica o postactínica y recidivas tumorales, son comunes a otras intervenciones.
Procedimientos quirúrgicosLas intervenciones más frecuentes para el tratamiento del cáncer anorrectal incluyen la resección anterior baja y la amputación abdominoperineal14. Ambas incluyen la escisión mesorrectal total. El esfínter se preserva con la resección anterior baja, mientras que en la amputación abdominoperineal se reseca el complejo esfinteriano completo, incluyendo frecuentemente al músculo elevador del ano14. En la amputación abdominoperineal el cierre perineal caudal es variable. Se puede hacer un cierre simple o con refuerzos musculares (flaps de Taylor) de la musculatura glútea o los rectos abdominales14. Siempre que sea posible se preserva el elevador del ano, para conservar la anatomía pélvica. Otra opción es realizar un cierre con refuerzo mediante omentoplastia pediculada14.
En la resección anterior baja, la anastomosis colorrectal o coloanal se puede hacer con o sin un reservorio en «J» del colon para aumentar el volumen del neorrecto14. No debe confundirse con una dehiscencia de la anastomosis o una colección posquirúrgica (fig. 11). La alternativa al reservorio en J es la coloplastia, que es una incisión longitudinal del colon que se sutura transversalmente, como las técnicas de estricturoplastias14.
Dehiscencia anastomótica con absceso. A) Imagen coronal potenciada en T2. B) Imagen sagital potenciada en T2. C) Imagen axial potenciada en T2. D) Imagen axial potenciada en T1 con supresión grasa tras administrar contraste iv. La fuga anastomótica habitualmente se localiza como en este caso, en una dehiscencia del aspecto posterior de la anastomosis entre 2 segmentos intestinales o en el reservorio a lo largo de la línea de sutura (flecha sólida fina). Puede ocasionar como en este caso, una complicación infecciosa (absceso pélvico o fístula). El estudio T1 con supresión grasa tras administrar contraste iv demuestra el absceso de pared hipercaptante (flechas huecas) localizado a la izquierda de la anastomosis coloanal. El reservorio (flechas sólidas gruesas) termina con unas suturas metálicas y sin hiperrealce tras administrar contraste iv.
Las complicaciones precoces son parecidas a las de otros procesos quirúrgicos intestinales (dehiscencias de sutura, fístulas y abscesos) (fig. 12). Las fístulas pueden afectar al reservorio o cualquier estructura pélvica adyacente (vagina, vejiga, uretra, periné) (fig. 13). Los flemones se diferencian de los abscesos estudiándolos con contraste intravenoso14. La complicación más frecuente, de aparición tardía, es la fibrosis presacra. Su forma es muy variable, generalmente con un margen anterior liso, angular y cóncavo homogéneo, diferente de la recidiva tumoral que suele presentarse como una masa nodular, asimétrica, irregular y convexa14. Otras complicaciones tardías incluyen las estenosis fibrosas en la anastomosis (fig. 14), la inflamación del reservorio intestinal en J o las hernias perineales14.
Absceso posquirúrgico complicado con una fístula a la uretra prostática en un paciente de 49 años con antecedente de radio-quimioterapia antes de la amputación abdominoperineal. A) Imagen axial potenciada en T2. B) Imagen axial potenciada en T1 con supresión grasa tras la administración de contraste iv. C y D) Imágenes sagitales potenciadas en T2 con supresión grasa. Las flechas huecas indican a un voluminoso absceso sobre el lecho quirúrgico de la amputación abdominoperineal. Las flechas sólidas señalan la fístula que comunica con la uretra prostática.
Fístula perineal en un paciente varón de 65 años de edad tras una amputación abdominoperineal por adenocarcinoma rectal bajo. A y B) Imágenes coronales potenciadas en T2. C y D) Imágenes axiales potenciadas en T2. En esta intervención se preservó el músculo elevador del ano (flechas huecas). Se identifica un seno perineal persistente (flechas sólidas finas) que comunica una colección en el lecho quirúrgico (flechas sólidas gruesas) con la piel a lo largo del trayecto quirúrgico por una dehiscencia de la sutura del músculo elevador del ano. Es una complicación rara que consiste en que la herida quirúrgica en el trayecto de la amputación abdominoperineal no se cierra.
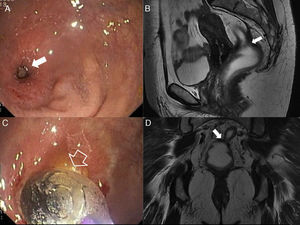
Complicaciones posquirúrgicas. Estenosis rectal. La estenosis rectal se ha definido como la imposibilidad de progresar con un sigmoidoscopio de 12mm de diámetro mediante una luz estrechada. Una estenosis benigna tras una resección anterior baja es generalmente consecuencia de una dehiscencia anastomótica con fibrosis subsiguiente. A y B) Imágenes endoscópicas de una estenosis rectal benigna en una mujer de 55 años tras cirugía de resección anterior baja por cáncer de recto con anastomosis colorrectal. C) Imagen sagital potenciada en T2. D) Imagen coronal potenciada en T2 tras la administración de contraste endorrectal, que localizan la estenosis al nivel de la anastomosis colorrectal (flechas sólidas). La flecha hueca en B señala el catéter-balón en el procedimiento endoscópico de dilatación de la estenosis rectal (flecha sólida en A).
Las complicaciones posradioterapia pueden aparecer precozmente como enteritis o proctitis actínica aguda, o tardíamente como fibrosis y retracción de estructuras pélvicas (fig. 15)27. Un problema diagnóstico es distinguir la fibrosis presacra de la recidiva tumoral28. Se ha propuesto la forma y la intensidad de señal en T2 como claves para diferenciarlas14,28 aunque la variabilidad de presentación, tanto de la fibrosis (puede tener un componente inflamatorio hiperintenso en T2 hasta 12 meses después de la radioterapia) como de las recidivas tumorales, las hacen poco útiles14.
Debe recordarse que: las mejores opciones para sugerir la recidiva tumoral son el estudio dinámico con contraste intravenoso y el valor del coeficiente de difusión aparente en secuencias de difusión. Las lesiones tumorales se caracterizan por una hipercaptación del contraste y restricción de la difusión frente al realce progresivo tardío y la no restricción del tejido fibrótico28–30.
Complicaciones postactínicas precoces y tardías. A) Imagen axial potenciada en T2 con supresión grasa. B) Imagen coronal potenciada en T2 con supresión grasa en un paciente varón con cambios inflamatorios postactínicos agudos. Nótese el engrosamiento e hiperintensidad de la pared del recto (flechas finas largas) por proctitis aguda. Así mismo se observa una miositis postactínica de los músculos pectíneos (flechas gruesas), y cambios inflamatorios en las fosas isquiorrectales (cabeza de flecha en B). C) Imagen sagital potenciada en T2. D) Imagen axial potenciada en T2 de otro paciente con antecedente radioterápico por neoplasia rectal y crisis de suboclusión. Cambios fibróticos crónicos presacros secundarios a la radioterapia (flechas huecas) que afectan tanto a la anastomosis colorrectal como a las asas de intestino delgado pélvico y producen un síndrome adherencial con distensión ileal (flechas curvas).
La RM 3.0T con protocolo de alta resolución, por su elevada resolución espacial y tisular, y por ser una técnica no invasiva y sin efectos secundarios, es la prueba de imagen fundamental para valorar muchos procesos perirrectales y perianales. Para el cirujano, la RM es especialmente útil para conocer las características de las fístulas antes de la intervención, definir las complicaciones secundarias al tratamiento de los procesos tumorales de recto y el conducto anal, y diferenciarlas de posibles recidivas tumorales. Creemos que esta revisión es útil para el radiólogo con objeto de conocer los principales procesos no tumorales que afectan al recto y al ano.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autorías- 1.
Responsable de la integridad del estudio: LHH, EAM y VMVF.
- 2.
Concepción del artículo: LHH, RCA y JCA.
- 3.
Disen¿o del artículo: LHH, RCA, EAM y VMVF.
- 4.
Obtención de los datos: LHH, RCA, EAM, JCA y VMVF.
- 5.
Análisis e interpretación de los datos: No procede.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: LHH, RCA, EAM, JCA y VMVF.
- 8.
Redacción del trabajo: LHH, EAM y RCA.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: LHH, RCA, EAM, JCA y VMVF.
- 10.
Aprobación de la versio¿n final: LHH, RCA, EAM, JCA y VMVF.
Los autores declaran no tener ningún conflicto de intereses.