Describir los hallazgos en resonancia magnética (RM) de las principales enfermedades inflamatorias e inmunomediadas que afectan al troncoencéfalo.
ConclusiónEl diagnóstico diferencial de las lesiones inflamatorias localizadas en el troncoencéfalo es complicado debido al amplio espectro de enfermedades autoinmunes, infecciosas y síndromes paraneoplásicos que pueden causarlas. Conocer estas entidades, sus características clínicas y sus manifestaciones en RM, sobre todo en cuanto a número, morfología, extensión y apariencia en las diferentes secuencias, es útil a la hora de orientar el diagnóstico radiológico.
To describe the magnetic resonance imaging (MRI) findings for the most common inflammatory and immune-mediated diseases that involve the brainstem.
ConclusionInflammatory lesions involving the brainstem are associated with a wide range of autoimmune, infectious, and paraneoplastic syndromes, making the differential diagnosis complex. Being familiar with these entities, their clinical characteristics, and their manifestations on MRI, particularly the number of lesions, their shape and extension, and their appearance in different sequences, is useful for orienting the radiological diagnosis.
Las lesiones inflamatorias del troncoencéfalo aparecen en muchas enfermedades, principalmente en las de etiología autoinmune inmunomediada. Estas lesiones, muestran una apariencia común en resonancia magnética (RM): son hiperintensas en las secuencias potenciadas en T2 y captan contraste de manera parcheada en las secuencias potenciadas en T1 con gadolinio. En algunos casos, presentan restricción de la difusión.
Las características que permiten hacer una aproximación diagnóstica son la morfología, el número y la distribución de las lesiones (tabla 1), su localización dentro del troncoencéfalo y la presencia de otras lesiones asociadas, tanto en el sistema nervioso central (SNC) como en otros órganos. La clínica, la epidemiología y la analítica son útiles para establecer el diagnóstico.
Resumen de localización de las lesiones inflamatorias de cada entidad
| Enfermedad | Localización en troncoencéfalo | Otras localizaciones |
|---|---|---|
| Enfermedades autoinmunes | ||
| Esclerosis múltiple | PeriféricasZona anterior del puenteVentral a sustancia gris periacueductal | Sustancia blanca periventricular / pericallosa / yuxtacorticalCorticalTroncoencéfaloCerebeloNervios ópticosMédula espinal |
| Trastorno de espectro neuromielitis óptica | Bulbo raquídeo periventricularMesencéfalo rostralÁrea postrema | Nervio óptico retrobulbarMielitis de > 3 segmentos medularesDiencéfaloPeriventricularSustancia blanca profundaCuerpo calloso |
| Anti-MOG | Puente periventricularBulbo raquídeo caudal periventricular | Nervio óptico retrobulbarCorteza cerebralSustancia gris profundaDiencéfalo |
| Síndrome de Susac | Leptomeninges en fosa posteriorBulbo raquídeoPuente | Cuerpo callosoCerebelo |
| Neurosarcoidosis | PerivascularLeptomeninges en cisternas basales | Granulomas multisistémicosTallo hipofisario y cisternas basales |
| Neuro Bechet | Bulbo raquídeoPuente | TálamosSustancia blanca subcortical Médula espinal |
| Histiocitosis | Tractos piramidales pontinosSustancia blanca del tegmento | Tallo hipofisarioPlexos coroideosMeningesÓrbitaCerebelo (núcleos dentados)Globos pálidos |
| Encefalitis de Bickerstaff | Bulbo raquídeoPuente | CerebeloTálamo |
| EMAD | Mesencéfalo ventral | Sustancia gris cortical / profundaGanglios basalesTálamoCerebelo |
| LAH | Bulbo raquídeoPuente | Sustancia blanca subcortical TálamoCerebeloMédula espinal |
| Síndrome CLIPPERS | PuenteBulbo raquídeoMesencéfalo | Pedúnculos y hemisferios cerebelososHemisferios cerebrales |
| Encefalitis paraneoplásica anti-receptor de NMDA | Bulbo raquídeoPuente | Corteza cerebral o cerebelosaLóbulo temporal medial |
| Encefalitis paraneoplásica anti-MA | Mesencéfalo | HipotálamoTálamoEstructuras límbicas |
| Enfermedades metabólicas | ||
| Leucodistrofia de Alexander | Bulbo raquídeoPuente | Ribete periventricularLóbulo frontalCabeza del caudadoGlobos pálidosTálamos |
| Enfermedad de Wilson | Tegmento mesencefálicoPuente | Putamen |
| Encefalopatía de Wernicke | Placa tectalSustancia gris periacueductal | Cuerpos mamilaresTálamo dorsomedialAlrededor del tercer ventrículo |
| Infecciones | ||
| Listeria | Suelo del cuarto ventrículo | CerebeloV par craneal |
| TBC | Granulomas o abscesos en fosa posteriorLepto y paquimeninges | Granulomas o abscesosLóbulos temporalesLepto y paquimeninges |
| Enterovirus EV-A71 | Bulbo raquídeoPuente dorsalMesencéfalo | Núcleos dentados cerebeloTálamo |
Anti-MOG: desmielinización inducida por anticuerpos contra la glucoproteína de la mielina oligodendrocitaria; EMAD: encefalomielitis aguda diseminada; LAH: leucoencefalitis aguda hemorrágica; TBC: tuberculosis.
El objetivo de este artículo es repasar las entidades que pueden causar lesiones inflamatorias del troncoencéfalo agrupándolas en tres grupos: autoinmunes, infecciosas y metabólicas.
Enfermedades autoinmunesEsclerosis múltipleLa esclerosis múltiple (EM) es una enfermedad inflamatoria adquirida del SNC que debuta entre la adolescencia y la sexta década, con mayor incidencia en mujeres y en países alejados del ecuador.
Según los Criterios de McDonald, el diagnóstico es posible mediante RM si se demuestra diseminación de las lesiones en tiempo y espacio1. Estas lesiones son ovoideas, circunscritas e hiperintensas en T2. Son perivenulares, con una línea o punto central hipointenso (signo de la vena central) visible en la secuencia T2*, que puede ayudar a diferenciarlas de otras enfermedades inflamatorias2. Las lesiones crónicas son agujeros negros hipointensos en T1, mientras que las agudas captan gadolinio y pueden restringir la difusión1.
Las localizaciones típicas son la sustancia blanca periventricular, pericallosa, cortical y yuxtacortical, el troncoencéfalo y cerebelo, los nervios ópticos y la médula espinal. Las lesiones troncoencefálicas son periféricas, más frecuentes en el puente que en el bulbo raquídeo. Típicamente se localizan en la parte anterior del puente, en la zona de entrada trigeminal, o ventrales a la sustancia gris periacueductal (fig. 1).
Varón de 50 años con EM que presenta oftalmoplejía internuclear. Imágenes axiales de secuencias T2-FLAIR (A,B), susceptibilidad magnética (C) y T1 con gadolinio (D) de RM cerebral. Lesiones desmielinizantes hiperintensas en secuencia T2-FLAIR localizadas en la sustancia blanca periventricular, yuxtacortical en el lóbulo occipital derecho (A), central en el mesencéfalo y en el suelo del cuarto ventrículo (B) (flechas). Se observa una lesión con signo de la vena central periventricular frontal derecha (C). Las lesiones periventriculares del cuarto ventrículo presentan también realce de contraste (D) (punta de flecha).
Apoya el diagnóstico la presencia de bandas oligoclonales en el líquido cefalorraquídeo (LCR)1. En caso de haber pleocitosis, es mononuclear y menor a 50células/μl.
Trastorno de espectro de neuromielitis ópticaEl trastorno de espectro de neuromielitis óptica es una astrocitopatía autoinmune desmielinizante del SNC. Son característicos los anticuerpos IgG anti-acuaporina4 (AQP4-IgG)3. La edad media de inicio de los síntomas es de 39años, aunque es posible en niños y ancianos, y es 9 veces más frecuente en mujeres4.
La neuritis óptica se manifiesta como engrosamiento e hiperintensidad de un segmento largo del nervio óptico retrobulbar, unilateral o bilateral. Otra presentación es la mielitis longitudinalmente extensa con afectación de ≥3 segmentos medulares3. Las lesiones encefálicas son periependimarias, en la sustancia blanca profunda, pericallosas, en el cerebelo, diencéfalo y en el troncoencéfalo en el bulbo raquídeo alrededor del cuarto ventrículo3. Las troncoencefálicas son lineales, hiperintensas en T2 y pueden confluir con las lesiones cervicales5.
Las lesiones diencefálicas se localizan alrededor del tercer ventrículo y en el mesencéfalo rostral y generalmente captan contraste de manera parcheada (fig. 2).
Mujer de 49 años con sospecha de mielitis, disminución de la agudeza visual del ojo derecho y anticuerpos AQP4-IgG. Imágenes de secuencia T2-FLAIR axial (A), TIRM coronal (B) y T2 sagital (C) de RM cerebral y de columna cervicodorsal. Lesión hiperintensa en secuencias potenciadas en T2 en localización central del bulbo raquídeo (flecha) (A). Extensa neuritis óptica derecha retrobulbar (punta de flecha) (B). Lesión medular dorsal longitudinalmente extensa hiperintensa en secuencia T2 que se extiende entre los niveles D1 y D7 (C).
Hasta el 42% de los pacientes con trastorno del espectro de neuromielitis óptica seronegativos para AQP4-IgG presentan anticuerpos anti-MOG6. Suelen ser niños y adultos jóvenes con neuritis óptica bilateral o simultaneidad de mielitis y neuritis óptica monofásica/crónica recurrente.
Las lesiones son corticales y en la sustancia gris profunda, la sustancia blanca subcortical y profunda, el nervio óptico retrobulbar y el diencéfalo, así como en la sustancia blanca periventricular del cuarto ventrículo, en el puente y en el bulbo raquídeo caudal. Las lesiones son hiperintensas, de gran tamaño y edematosas en las secuencias T2 (fig. 3).
Debe recordarse que en las lesiones troncoencefálicas de las principales enfermedades inmunomediadas:
- •
En la EM son periféricas y sobre todo aparecen en el puente.
- •
En la neuromielitis óptica son periventriculares y aparecen sobre todo en el bulbo raquídeo.
- •
En la desmielinización producida por anticuerpos anti-MOG son periventriculares, de gran tamaño y edematosas.
Varón de 33 años con sospecha de encefalitis de origen autoinmune y presencia de anticuerpos anti-MOG. Imágenes en secuencia T2-FLAIR axial (A,C,D) y T1 sangre negra con gadolinio (B) de RM cerebral. Hiperintensidad cortical en lóbulos parietal y temporal izquierdos (A) con áreas de realce parcheadas tras la administración de contraste (B). Extensa lesión inflamatoria hiperintensa en secuencias potenciadas en T2 localizada en el lado izquierdo del mesencéfalo (flecha) (C) que se extiende caudalmente al puente ipsilateral y a la sustancia blanca periventricular del cuarto ventrículo (punta de flecha) (D).
Se trata de una endoteliopatía arteriolar que causa la triada clínica de encefalopatía, oclusión de la arteria central de la retina e hipoacusia sensorial de frecuencias bajas7. Afecta más a mujeres de 20-40años y, cuando presentan encefalopatía, suelen padecer alteraciones en la memoria y en la conducta, confusión, ataxia, disartria, psicosis paranoide, cefalea y mutismo ocasional8. En el LCR hay proteínas elevadas (>1,5g/l), mínima pleocitosis y ausencia de bandas oligoclonales8.
En RM aparecen lesiones multifocales hiperintensas en T2 de 3-7mm que invariablemente afectan al cuerpo calloso. Son conocidas como «en bola de nieve» cuando son redondas y de localización central en el cuerpo calloso, y como icicle-like cuando son cuneiformes y se extienden desde el techo del cuerpo calloso sin alcanzar su base9.
En la fase aguda aparecen lesiones captantes y microinfartos que restringen en difusión. En los casos fulminantes aparece captación leptomenínea nodular en la fosa posterior9,10.
El 30% de los pacientes presentan lesiones puntiformes en los hemisferios cerebelosos y en el troncoencéfalo10 parecidas a las del CLIPPERS, pero con menor captación de gadolinio.
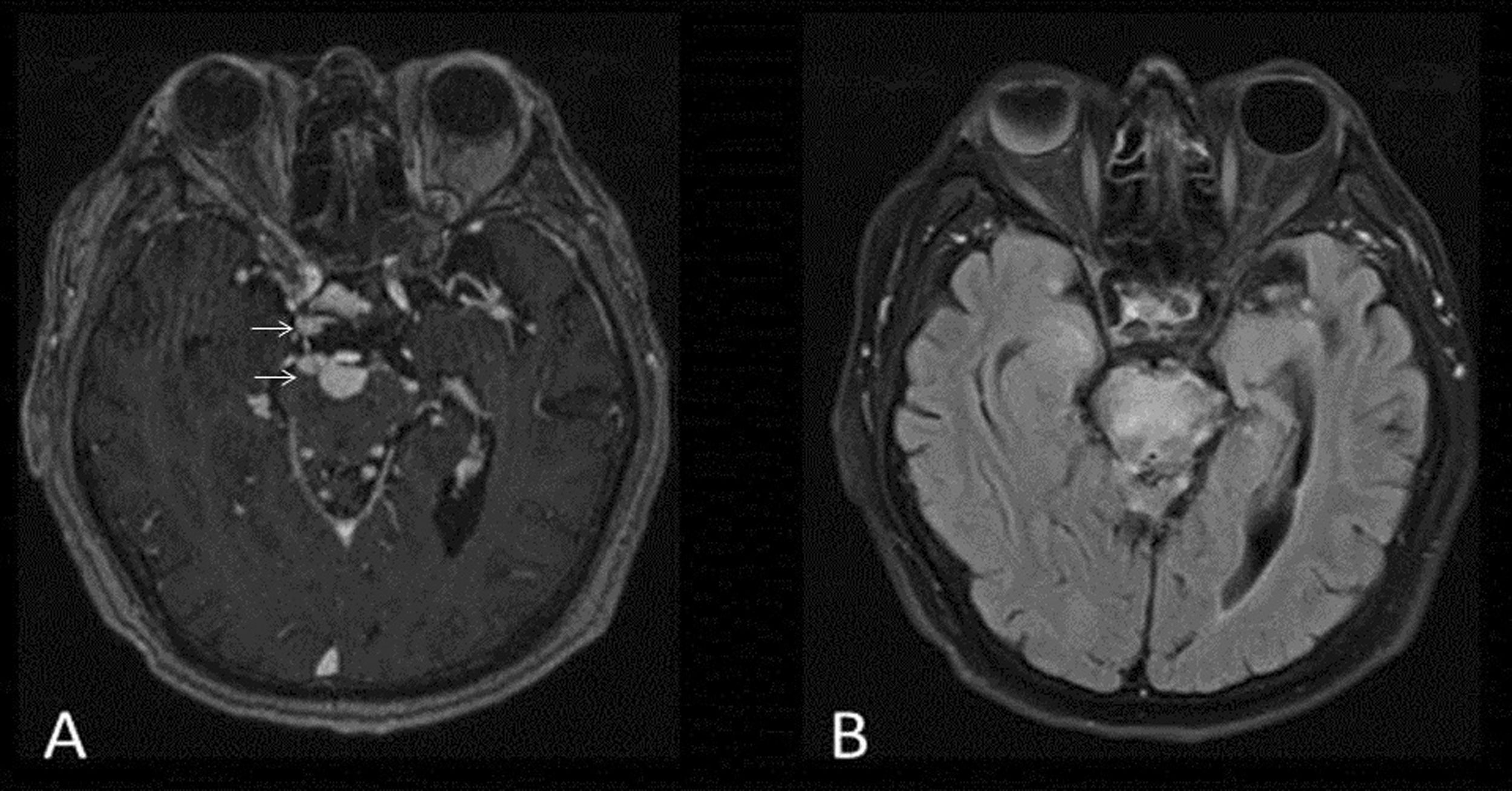
NeurosarcoidosisLa sarcoidosis es una enfermedad granulomatosa sistémica que rara vez afecta al SNC. Cuando lo hace ocasiona síndromes clínicos troncoencefálicos y cerebelosos11. La aparición de lesiones granulomatosas en otros sistemas visualizadas en la TC sugiere el diagnóstico.
Radiológicamente presenta realce de contraste leptomeníngeo nodular, difuso o perivascular, sobre todo en el tallo hipofisario y en las cisternas basales12. Las lesiones troncoencefálicas son hiperintensas en T2, sin una morfología específica. También hay granulomas que conforman verdaderas masas sarcoideas, sobre todo en la fosa posterior, hipointensas en T2 y con captación de contraste discontinuo (fig. 4). Debido a la inflamación meníngea y a las masas que pueden obstruir el drenaje del LCR, es posible que haya hidrocefalia.
Varón de 53 años con sarcoidosis, dolor en el ojo izquierdo y cefalea. Imágenes de secuencia T1 coronal con gadolinio (A), T1 sangre negra axial con gadolinio (B,C) y T1 axial con gadolinio (D) de RM cerebral. Masas sarcoideas hipercaptantes en el vientre muscular del recto interno izquierdo (flecha) (A) y leptomeníngeas supraclinoidea izquierda (B) e infratentoriales anteriores bilaterales en el puente (C,D) (puntas de flecha).
Se trata de una vasculitis multisistémica que afecta a los vasos de pequeño calibre11. La clínica troncoencefálica puede coexistir con síntomas hemisféricos o medulares. Suele asociarse a úlceras orogenitales, alteraciones cutáneas y fiebre.
Las lesiones son edematosas, hiperintensas en T2, con microhemorragias visibles en susceptibilidad y lesiones agudas que captan contraste. El troncoencéfalo es la región más afectada. Otras localizaciones comunes son los ganglios de la base, los tálamos y, con menor frecuencia, la sustancia blanca subcortical y la médula (fig. 5).
Varón de 42 años con enfermedad de Behçet que comienza con signos cerebelosos y piramidalismo marcado. Imágenes T1 con gadolinio axiales (A,B,C) y T2-FLAIR sagital (D) de RM cerebral. Pequeñas lesiones hiperintensas que presentan realce de contraste localizadas en el mesencéfalo (A), el hemisferio cerebeloso izquierdo (B) y el bulbo raquídeo (C,D) (flechas) y atrofia infratentorial.
Es frecuente la asociación con trombosis venosa y neuritis óptica. En la enfermedad crónica aparecen agujeros negros y atrofia infratentorial13.
HistiocitosisLa histiocitosis de células de Langerhans es una enfermedad que afecta a pacientes pediátricos11. Por otra parte, la enfermedad de Erdheim Chester es una forma rara de histiocitosis que aparece en adultos14. Se manifiestan con dolor óseo, alteraciones cutáneas y viscerales. Los síntomas neurológicos son diabetes insípida, deterioro cognitivo, disartria, disfagia y trastornos de la marcha11.
Aparecen lesiones ocupantes de espacio con intenso realce de contraste en el tallo hipofisario, los plexos coroideos, las meninges, el troncoencéfalo y la órbita. También hay lesiones hiperintensas en T2, simétricas y que aparecen progresivamente en el cerebelo, los globos pálidos y el puente.
Las lesiones troncoencefálicas no son tan comunes y suelen aparecer en los tractos piramidales del puente y en la sustancia blanca del tegmento asociadas a lesiones en los núcleos dentados. Las lesiones son hiperintensas en T2 y de una apariencia moteada, con extensión a los pedúnculos cerebelosos15. Las lesiones agudas pueden captar contraste durante semanas (fig. 6).
Mujer de 67 años con histiocitosis de células de Langerhans y cuadro subagudo de afectación cerebelosa. Imágenes de secuencias T2-FLAIR axial (A) y T1 con gadolinio axial (B) de RM cerebral y de TC torácico (C). Lesiones parcheadas hiperintensas en secuencia T2-FLAIR en tractos piramidales pontinos que se extienden a los pedúnculos cerebelosos (flechas) (A) y presentan áreas de realce de contraste (punta de flecha) (B). Pequeños quistes pulmonares bilaterales (C).
Es una encefalitis postinfecciosa, variante del síndrome de Guillain-Barré y el síndrome de Miller-Fisher, que presenta anticuerpos antiGQ1b en el LCR16. Los pacientes tienen alteraciones del nivel de consciencia, ataxia, oftalmoplejía y signos de lesión de motoneurona superior, que aparecen tras una infección viral17.
Hasta en el 70% de los casos no se observan lesiones en la RM; cuando aparecen, las lesiones captan poco o nada en las secuencias con contraste, en ocasiones restringen la difusión y son hiperintensas en T2. Las lesiones se localizan en el puente, el bulbo raquídeo, el cerebelo y el tálamo, y la mayoría desaparecen con la clínica17 (fig. 7).
Varón de 66 años con dolor en la cara posterior de la extremidad inferior derecha, imposibilidad para la micción y fiebre. Imágenes de secuencia T2-FLAIR axial (A) de RM cerebral. Lesiones hiperintensas bilaterales en FLAIR que rodean al cuarto ventrículo y no ejercen efecto de masa (flecha) (A). Imagen de secuencia T1 sagital con gadolinio de columna lumbar (B). Se observa engrosamiento y discreto realce de la cauda equina (punta de flecha). Hallazgos en relación con enfermedad de Bickerstaff.
La encefalomielitis aguda diseminada (EMAD) es una enfermedad inflamatoria desmielinizante que cursa con encefalopatía y déficits neurológicos multifocales tras una infección o vacunación18. Es típica de niños y tiene un curso monofásico rápidamente progresivo19.
La RM muestra lesiones reversibles extensas, mal definidas y asimétricas que afectan a la sustancia gris cortical y profunda, a los ganglios basales, al tálamo, al cerebelo y al troncoencéfalo10,19. Son frecuentes las lesiones en la fosa posterior, pero en comparación con la EM son de mayor tamaño, peor definidas y frecuentemente localizadas en el mesencéfalo ventral10.
Leucoencefalitis aguda hemorrágica o enfermedad de Weston-HurstLa leucoencefalitis aguda hemorrágica (LAH) o enfermedad de Weston-Hurst es la forma más severa de la EMAD. Es una enfermedad desmielinizante esporádica rara que afecta a jóvenes y causa inflamación hemorrágica fulminante de la sustancia blanca.
Las manifestaciones neurológicas van precedidas por infecciones del tracto respiratorio alto, que pueden acompañarse de fiebre alta, pleocitosis neutrofílica en el LCR y leucocitosis.
Las lesiones inflamatorias son bilaterales, asimétricas y pueden aparecer en la sustancia blanca subcortical, el tálamo, el cerebelo, el troncoencéfalo y la médula espinal20. También aparecen lesiones desmielinizantes grandes y tumefactas, hiperintensas en T2, con menor edema del esperado para su tamaño. Estas lesiones pueden captar contraste de manera parcheada. Además, son característicos los focos hemorrágicos visibles en secuencias de susceptibilidad20 (fig. 8).
Mujer de 54 años con LAH que debuta con disminución de fuerza en las extremidades izquierdas rápidamente progresiva con disminución posterior del nivel de consciencia. Imágenes de secuencia T1 sagital con gadolinio (A) y SWI (B) de RM cerebral. Lesión tumefacta que afecta al puente y que presenta realce de contraste (A) y focos hemorrágicos puntiformes (flecha) (B).
Es una enfermedad autoinmune que puede afectar al SNC11 como cerebritis supratentorial, meningitis aséptica, ictus, desmielinización, mielitis transversa y encefalitis troncoencefálica21. Las lesiones agudas son hiperintensas en T2, hipointensas en T1, con posible captación de contraste puntiforme o periférico22 (fig. 9). Estas lesiones corresponden a áreas de edema, infiltrados inflamatorios y desmielinización.
Mujer de 41 años con LES que presenta cuadro de 12 horas de evolución de mareo y diplopía de la mirada binocular. Imágenes de secuencia T2-FLAIR axial (A), T1 axial con gadolinio (B) y T2 sagital (C) de RM cerebral. Lesiones hiperintensas en T2 en el puente (A) y la región diencefálica con realce puntiforme de contraste (flechas) (B). Lesión hiperintensa en T2 en porción anterior de los segmentos medulares C3 y C4 (punta de flecha) (C).
El síndrome CLIPPERS es una enfermedad inflamatoria troncoencefálica y cerebelosa23 inmunomediada cuyo diagnóstico de confirmación se consigue mediante biopsia. Las lesiones y la clínica remiten con tratamiento corticoideo10.
En la RM se observan lesiones hiperintensas en T2 con captación de gadolinio homogénea o curvilínea puntiforme (<3mm) en el puente. Las lesiones no restringen la difusión ni suelen ejercer efecto masa24.
A medida que la densidad de las lesiones en el puente desciende, aparecen lesiones en los pedúnculos cerebelosos, el bulbo raquídeo, el mesencéfalo, los hemisferios cerebrales y los hemisferios cerebelosos23.
También ocurre atrofia pontocerebelosa que condiciona incapacidad residual, incluso tras la mejoría clínico-radiológica25.
Encefalitis paraneoplásicaEn el contexto de diversos síndromes paraneoplásicos pueden desarrollarse anticuerpos contra receptores sinápticos, proteínas de superficie celular o antígenos intracelulares que causan inflamación cerebral. La neoplasia que más frecuentemente se asocia es el carcinoma microcítico de pulmón11.
La forma más frecuente es la encefalitis límbica con hiperintensidad bilateral de los lóbulos temporales en T2 (fig. 10). Sin embargo, ocasionalmente presentan autoanticuerpos antineuronales que asocian patrones específicos en la RM.
Varón de 57 años con diplopía e inestabilidad para la marcha que presentó una neoplasia pulmonar primaria en el estudio de extensión.. Imagen de secuencia T2-FLAIR axial de RM cerebral. Áreas hiperintensas bilaterales de predominio izquierdo en la región medial del lóbulo temporal y en el lado izquierdo del mesencéfalo (flechas).
En la encefalitis secundaria a anticuerpos anti-receptor de NMDA la RM cerebral puede ser normal, pero si existen alteraciones suelen aparecer en el córtex cerebral o en el cerebeloso, en el lóbulo temporal medial y excepcionalmente en el troncoencéfalo26.
En la encefalitis asociada a anticuerpos anti-MA aparecen lesiones hiperintensas que rara vez captan contraste, localizadas en el mesencéfalo, el hipotálamo, el tálamo y las estructuras límbicas.
Alteraciones metabólicasLeucodistrofia de AlexanderEs una enfermedad rara y fatal, también conocida como leucodistrofia fibrinoide. Suele diagnosticarse en la infancia, aunque existen variantes infantil, juvenil y adulta.
La forma adulta se puede presentar radiológicamente de manera indistinguible a la EM, incluso con bandas oligoclonales en el LCR. En esos casos es útil la detección de la mutación GFAP27. La enfermedad comienza en la región frontal y se extiende de forma progresiva a zonas posteriores en el siguiente orden: cabeza del caudado, globos pálidos, tálamos y troncoencéfalo. En estadios precoces se dañan las fibras en U subcorticales y en estadios finales existe leucomalacia quística que capta contraste28.
Las lesiones, de aspecto inflamatorio, son simétricas y bilaterales en la sustancia blanca frontal (fig. 11). Existe un ribete hiperintenso periventricular característico28 y es posible observar hidrocefalia obstructiva.
Varón de 35 años con neurorretinitis bilateral desde la infancia, debilidad y piramidalismo de extremidades inferiores secundarias a leucodistrofia de Alexander. Imágenes de secuencia T2-FLAIR sagital (A), difusión (B), T1 con gadolinio axial (C) y T2-FLAIR axial (D) de RM cerebral. Lesión pontomedular (flecha) hiperintensa en FLAIR (A) que presenta restricción en difusión (B) y áreas con realce de contraste (C). Ribete periventricular hiperintenso en FLAIR (D).
La enfermedad de Wilson es una enfermedad rara autosómica recesiva del metabolismo del cobre11. Los síntomas aparecen en la edad adulta e incluyen manifestaciones neurológicas como distonía, disartria, temblor de manos, pseudoparquinsonismo y síntomas cerebelosos.
El hallazgo más común es la hiperintensidad putaminal en T2. También pueden aparecer áreas hiperintensas en T2 en el tegmento mesencefálico y en el puente, que dan lugar al signo del doble panda. En pacientes con síntomas neurológicos las áreas afectas son hipointensas en T1. Es posible observar restricción de la difusión en estadios precoces29 (fig. 12).
Encefalopatía de WenickeLa encefalopatía de Wernicke es una enfermedad de pacientes alcohólicos causada por déficit de tiamina11.
Las lesiones presentan las características radiológicas inflamatorias típicas y aparecen en los cuerpos mamilares, el tálamo dorsomedial, la placa tectal, la sustancia gris periacueductal y alrededor del tercer ventrículo30.
Etiología infecciosaLa inflamación troncoencefálica también puede estar causada por infecciones. Es crucial descartarlas antes de iniciar inmunoterapia, ya que puede favorecer la progresión de la infección.
ListeriaListeria monocitogenes afecta al SNC con una mortalidad del 32% y con secuelas neurológicas permanentes en el 55% de los pacientes. Aparece tanto en inmunodeprimidos como en inmunocompetentes y puede cursar de manera asintomática o, sobre todo en hombres de mediana edad, con síntomas neurológicos11,31. Genera lesiones inflamatorias en el suelo del cuarto ventrículo y en el cerebelo; microabscesos troncoencefálicos hiperintensos en T2 con realce en anillo tras la administración de contraste y restricción central de la difusión, y, por último, neuritis del trigémino con captación de gadolinio32 (fig. 13).
Varón de 49 años con sospecha de romboencefalitis y punción lumbar positiva para Listeria. Imágenes de secuencia T2-FLAIR axial (A) yT1 axial con gadolinio (B) de RM cerebral. Absceso con relace de contraste en anillo (punta de flecha) (B) en el seno de un área hiperintensa en FLAIR en el puente dorsal que se extiende al pedúnculo cerebeloso superior izquierdo (flecha) (A).
El enterovirus es el principal agente infeccioso de encefalitis troncoencefálica tras Listeria. El subtipo más frecuente es EV-A7, que provoca la enfermedad mano-pie-boca, gastroenteritis aguda e infecciones del tracto respiratorio alto. En el 25% de los casos, sobre todo en niños y en adolescentes, origina síntomas neurológicos33.
La localización de las lesiones del subtipo EV-A71 es característica: puente dorsal, bulbo raquídeo, seguido de núcleos dentados, cerebelo, mesencéfalo y tálamo, sin otras lesiones supratentoriales asociadas34 (fig. 14).
Mujer de 61 años con síndrome febril en el contexto de meningitis viral por enterovirus, presenta fiebre, alteración del habla, marcha imposible y temblor de intención. Imágenes de secuencia T2-FLAIR axial de RM cerebral. Áreas hiperintensas en el lado derecho del puente dorsal (flecha), núcleos dentados cerebelosos bilateral (puntas de flecha) y bulbo raquídeo.
La afectación del SNC en la tuberculosis es rara. Suele aparecer con alta morbimortalidad en inmunodeprimidos, sobre todo en el contexto de VIH11,35.
Puede causar meningitis, hidrocefalia, cerebritis, tuberculomas, abscesos y tuberculosis espinal. En la RM la encefalitis troncoencefálica asocia captación leptomeníngea de gadolinio en las cisternas basales. El aspecto del LCR es turbio, hiperintenso en FLAIR y capta contraste35.
Los tuberculomas no caseificantes captan contraste homogéneamente y los no caseificantes realzan en anillo con centro hipointenso en T235,36 (fig. 15).
Debe recordarse que Listeria monocitogenes y los enterovirus son los agentes infecciosos más frecuentes de la encefalitis troncoencefálica.
- •
Listeria genera lesiones inflamatorias periventriculares, microabscesos y neuritis trigeminal.
- •
Enterovirus EV-A7 genera lesiones en el puente, el bulbo, los núcleos dentados, el mesencéfalo y los tálamos.
Varón de 56 años con desorientación, disminución de conciencia y sospecha de meningitis tuberculosa. Imágenes de secuencia T1 axial con gadolinio (A) y T2-FLAIR axial (B) de RM cerebral. Múltiples nódulos en el espacio subaracnoideo que realzan con contraste localizados en las cisternas basales, que corresponden con tuberculomas no caseificantes (flechas) (A). Extenso edema hiperintenso en el puente (B).
Existe un amplio espectro de enfermedades que causan inflamación troncoencefálica. El conocimiento de las características clínico-epidemiológicas y de su presentación en cuanto a número, distribución, morfología y comportamiento en las distintas secuencias de RM permite realizar una aproximación diagnóstica. El diagnóstico precoz es importante y permite la exclusión de la infección, la instauración del tratamiento y la realización de pruebas específicas.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Autoría- 1.
Responsables de la integridad del estudio: CGdAS, JJGM.
- 2.
Concepción del estudio: CGdAS, JJGM, IAM, LAM.
- 3.
Diseño del estudio: CGdAS, JJGM.
- 4.
Obtención de los datos: N/A.
- 5.
Análisis e interpretación de los datos: N/A.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: CGdAS.
- 8.
Redacción del trabajo: CGdAS.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CGdAS, JJGM, IAM, LAM, RFP.
- 10.
Aprobación de la versión final: CGdAS, JJGM, IAM, LAM, RFP.
Los autores declaran no tener ningún conflicto de intereses.