La aparición de una lesión renal incidental ocurre con relativa frecuencia en la práctica radiológica diaria. Ante una lesión incidental deben conocerse las diferentes posibilidades diagnósticas dependiendo de si la lesión es de apariencia quística o sólida. El manejo de las lesiones quísticas viene determinado por la clasificación de Bosniak, mientras que el manejo de las lesiones sólidas trata de diferenciar entre el cáncer renal y tumores benignos, como el angiomiolipoma pobre en grasa y el oncocitoma. El radiólogo debe conocer las recomendaciones en el manejo de dichas lesiones y la utilidad de las diferentes técnicas por imagen e intervencionistas que se pueden realizar en función de las características de la lesión incidental y de las expectativas de vida del paciente.
Incidental renal lesions are relatively common in daily radiological practice. It is important to know the different diagnostic possibilities for incidentally detected lesions, depending on whether they are cystic or solid. The management of cystic lesions is guided by the Bosniak classification. In solid lesions, the goal is to differentiate between renal cancer and benign tumors such as fat-poor angiomyolipoma and oncocytoma. Radiologists need to know the recommendations for the management of these lesions and the usefulness of the different imaging techniques and interventional procedures in function of the characteristics of the incidental lesion and the patient's life expectancy.
Se considera una lesión renal incidental aquella lesión descubierta al realizar una técnica de imagen indicada por otra patología y que en el momento de su detección es asintomática. La detección ha aumentado considerablemente en los últimos años debido a la creciente indicación de estudios radiológicos abdominales realizados por múltiples causas. Con frecuencia, estas lesiones incidentales son benignas y la probabilidad de benignidad es más frecuente en lesiones de pequeño tamaño. Así, en un estudio de 2.770 nefrectomías realizado por Frank et al., un 12,8% de los tumores sólidos fueron benignos, aunque este porcentaje aumentaba al 46,3% si medían menos de 1cm1. Algunas de estas lesiones incidentales muestran características histológicas que pueden identificarse por imagen, lo que permite un diagnóstico definitivo, como ocurre con los quistes simples y los angiomiolipomas (AML) típicos. Para la caracterización del resto de las lesiones se requiere la administración de contraste endovenoso durante varias fases (se aconseja realizar una fase basal sin contraste y posteriormente una fase corticomedular (entre los 25 y 70 segundos tras la administración del contraste), una fase nefrográfica (hacia los 90 segundos) y una fase excretora (a partir de los 3 minutos) para confirmar que están vascularizadas y poder valorar el tipo de captación2. Las técnicas más utilizadas son la tomografía computarizada (TC), la resonancia magnética (RM) y la ecografía con contraste. El progreso en el diagnóstico por imagen es constante y siguen incorporándose nuevas herramientas que pueden ser útiles, como las técnicas de textura para la cuantificación de la heterogeneidad tumoral mediante TC, la técnicas de difusión y perfusión mediante RM3 y la posibilidad de cuantificar el yodo si se dispone de TC de doble energía que podría ayudar en la diferenciación de tumores4. Además, cada vez existe mayor consenso en el ámbito urológico para incorporar la biopsia en los algoritmos de manejo de lesión renal incidental5. El manejo diagnóstico dependerá no solo de la técnica inicial realizada, sino de la experiencia del centro con las diferentes técnicas complementarias y de las características del paciente, incluyendo su expectativa de vida y posible comorbilidad del tratamiento.
El objetivo de este artículo es presentar la aportación de las diferentes técnicas radiológicas en el manejo de las lesiones focales renales incidentales, tanto de apariencia quística como de apariencia sólida.
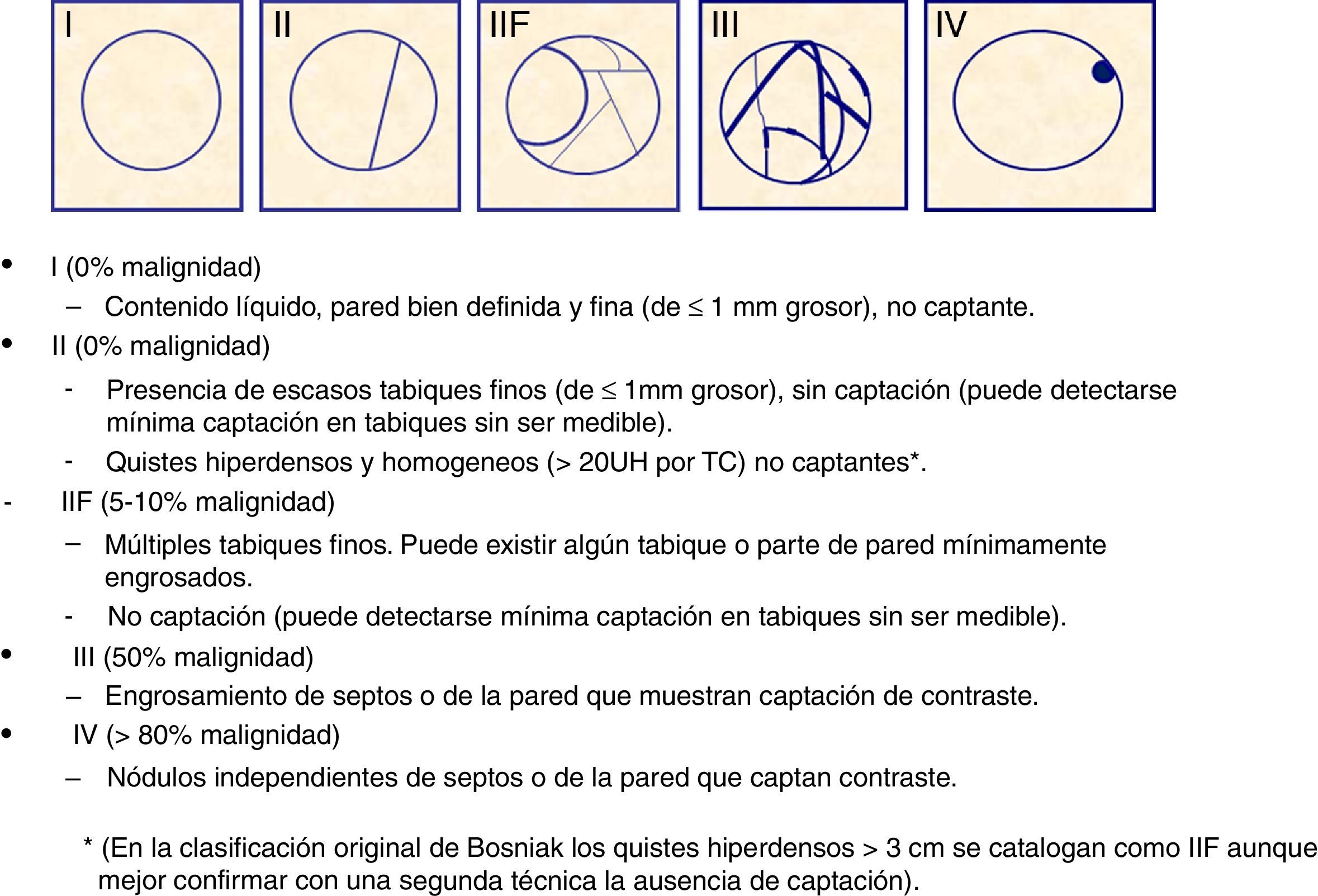
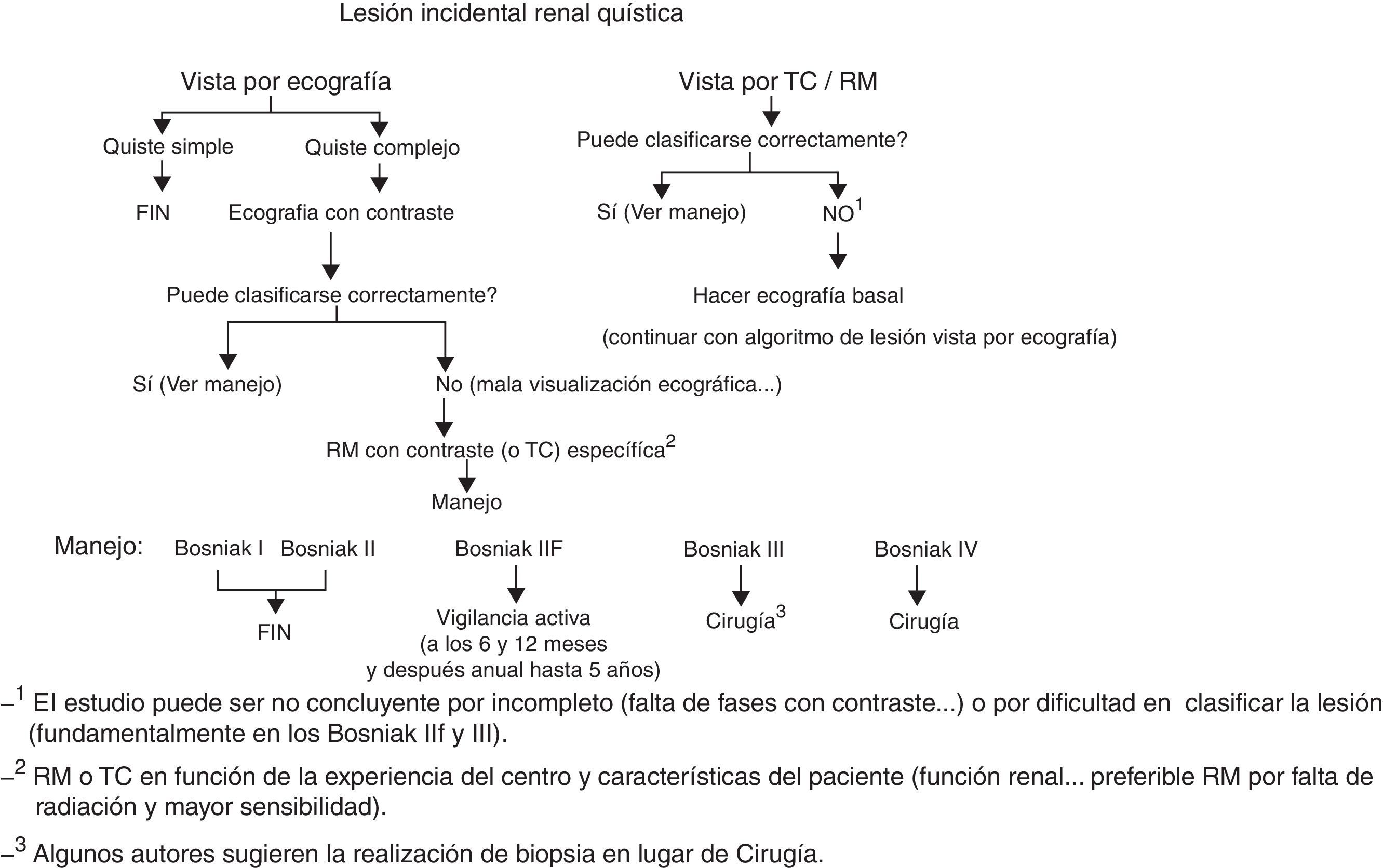
Manejo de las lesiones quísticas incidentalesLos quistes renales son las lesiones incidentales más frecuentes, y aparecen en más del 50% de la población de más de 50 años. El diagnóstico definitivo de quiste simple requiere la identificación de una masa completamente líquida, sin tabiques y con una pared bien definida y fina (de grosor≤1mm). Los quistes simples pueden diagnosticarse por ecografía sin necesidad de contraste (lesiones anecoicas con pared fina), mediante TC (lesiones con atenuación<20 unidades Hounsfield [UH] sin captación de contraste y con pared fina) o mediante RM (lesiones con señal líquida hiperintensas en T2, hipointensas en T1 y con pared fina). Las lesiones quísticas que no cumplen estos criterios se denominan quistes complejos y deben caracterizarse con contraste endovenoso, ya que hasta un 10% de los cánceres de células renales (CCR) pueden manifestarse como lesiones quísticas complejas. Una manera útil y reconocida de catalogarlos es la clasificación de Bosniak, descrita por el Dr. Bosniak en 1986 y modificada posteriormente en el año 1990 para incluir la categoría IIF. Uno de los aciertos de esta clasificación es que da un grado de probabilidad de malignidad a los quistes complejos en función de los hallazgos por imagen (fig. 1)6. Aunque inicialmente se describió para TC, se ha demostrado también su utilidad mediante RM7 y ecografía con contraste8. Respecto al manejo clínico, siguiendo la clasificación de Bosniak (fig. 2), es importante destacar que los quistes Bosniak I y II no requieren control, dado que no tienen riesgo de malignidad, y los Bosniak IIF requieren vigilancia activa dado el riesgo del 5-10% de malignidad. Se recomienda un seguimiento prolongado de al menos 5 años, dado que algunos cánceres pueden tener un crecimiento muy lento9, y se sugiere control cada 6 meses el primer año y luego control anual. Por otra parte, los quistes Bosniak III y IV requieren cirugía dada la probabilidad del 50 y >90% respectivamente, de corresponder a CCR. Otro aspecto que destacar es que actualmente se considera que la presencia de calcificaciones no muestra un mayor riesgo de malignidad.
Clasificación de quistes renales basada en la clasificación de Bosniak9.
Aunque la clasificación de Bosniak es muy útil, existen algunos puntos controvertidos y alguna limitación. Uno de los puntos controvertidos de la clasificación es el manejo de quistes hiperdensos basalmente que no captan contraste mediante TC y que se clasifican como Bosniak II o IIF dependiendo de su tamaño. Un manejo útil consiste en dividirlos según su densidad, ya que si miden más de 70 UH basalmente, corresponderían a quistes hemorrágicos benignos (con un rendimiento diagnóstico del 99% en el estudio de Jonisch10), mientras que si miden entre 20 y 70 UH pueden ser benignos o malignos independientemente de su tamaño, ya que los CCR de bajo grado pueden tener muy escasa captación que pase desapercibida mediante TC. En estos casos sería recomendable ampliar el estudio mediante ecografía, ya que con frecuencia pueden ser diagnosticados como quistes benignos si se muestran totalmente anecoicos y sin tabiques. Por el contrario, si no son anecóicos, estaría indicada la administración de contraste ecográfico para caracterizarlos11. Si la ecografía con contraste demuestra ausencia de captación, dichos quistes pasan a catalogarse como quistes II y no van a requerir posteriores controles. Otro punto controvertido es la utilización de la ecografía con contraste y la RM en el manejo de los quistes complejos. Tanto la RM como la ecografía con contraste muestran mayor sensibilidad que la TC en la detección de la microvascularización tumoral y de tabiques12, por lo que, unido a la ausencia de radiación, hace que el uso de dichas técnicas sea aconsejable no solo para la caracterización de quistes complejos, sino para el seguimiento de dichos quistes cuando está indicado. En nuestro centro, basándonos en nuestra experiencia y las publicaciones encontradas en la literatura médica, se ha incorporado la ecografía con contraste como técnica sistemática tanto para la diferenciación entre lesiones quísticas y sólidas como para valorar mejor la presencia o ausencia de captación de tabiques en quistes Bosniak IIF o III11. Sin embargo, la utilización de la ecografía con contraste y de la RM también comporta una mayor detección de quistes Bosniak III catalogados previamente mediante TC como IIF13. Este hecho comportaría un mayor número de cirugías de lesiones benignas (ya que teóricamente el 50% de estas lesiones etiquetadas como Bosniak III van a ser benignas) y es algo que debería evitarse, por lo que deben realizarse más estudios que permitan demostrar la utilidad tanto de la ecografía con contraste como de la RM en el manejo de los quistes Bosniak IIF y III.
La mayor limitación de las técnicas de imagen utilizando la clasificación de Bosniak es la imposibilidad de diferenciar los quistes Bosniak III benignos de los malignos. Ambos muestran engrosamiento con hipercaptación de la pared y/o de tabiques con la única diferencia por histología de la presencia o no de proliferación de células neoplásicas en dichas localizaciones, condición que hasta la fecha solo puede ser diagnosticada mediante el análisis histológico del tejido. Es por ello que se están investigando nuevas técnicas diagnósticas como la técnica de difusión por RM y planteando la realización de biopsias diagnósticas que permitan evitar la cirugía de los quistes Bosniak III benignos.
Respecto al valor de la biopsia en lesiones quísticas complejas, no se considera indicada a pesar del rendimiento diagnóstico elevado descrito en algunos estudios14, excepto en pacientes de edad avanzada, con un solo riñón o con elevado riesgo quirúrgico. Esto se debe a que la obtención de un resultado negativo para cáncer no excluye la presencia del mismo en otra localización a la puncionada excepto en casos en los que se obtiene un diagnóstico concluyente de benignidad como en los adenomas metanéfricos6. Una opción de futuro técnicamente sencilla es la obtención mediante aspiración con aguja fina del líquido del quiste con el objetivo de analizar la presencia de marcadores tumorales como la proteína CA9, que se encuentra elevada en cánceres quísticos15 y no en lesiones benignas, aunque hasta la fecha no es una técnica universalizada.
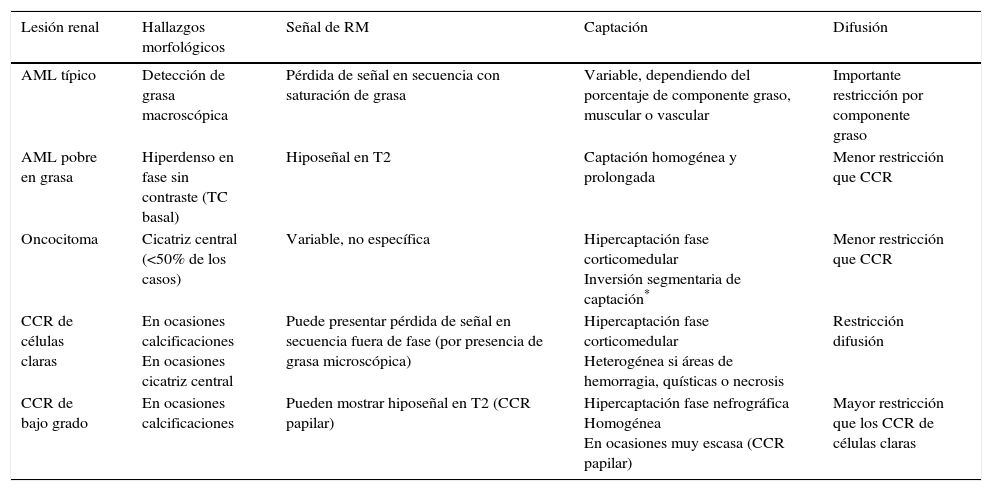
Manejo de las lesiones sólidas incidentalesEn la tabla 1 se muestran las características por imagen más destacables de las lesiones sólidas más frecuentes. El CCR es la lesión renal sólida más frecuente y debe sospecharse ante cualquier masa incidental que no contenga grasa macroscópica. La presencia de grasa puede detectarse mediante TC (atenuación<-20 UH) o RM (hiposeñal igual a la de la grasa subcutánea en todas las secuencias incluyendo la secuencia con saturación de grasa) y permite el diagnóstico de AML, ya que se considera excepcional la presencia de grasa en otros tumores renales, y en el caso del CCR suele ir asociada a otros hallazgos, como la presencia de calcificaciones16. Es importante recordar que la detección de pérdida de señal en fase opuesta utilizando la secuencia de desplazamiento químico (chemical-shift) indica la presencia de grasa microscópica y no permite el diagnóstico de AML. Aunque los AML pueden contener grasa microscópica, un número elevado de CCR también (hasta el 59% de los CCR de células claras en la serie de Outwater et al.)17,18. Ante un tumor sin grasa macroscópica visible, en el diagnóstico diferencial, además del CCR deben incluirse tumores benignos, como el oncocitoma y el AML pobre en grasa (ya que existe un 5% de AML que no tienen suficiente cantidad de grasa macroscópica para poder ser detectada mediante pruebas de imagen)16 (fig. 3). Otros tumores malignos, como el tumor de células transicionales, el linfoma y las metástasis, se manifiestan excepcionalmente como masas renales únicas incidentales, y una historia clínica detallada, la analítica y otras características radiológicas específicas pueden ayudar al diagnóstico. La herramienta más utilizada para la caracterización es la administración de contraste mediante TC o RM, aunque existe una incesante actividad investigadora reflejada en múltiples publicaciones buscando todavía la herramienta que permita, con un alto rendimiento, una diferenciación por imagen entre tumores benignos y CCR. Entre estas se ha descrito la valoración de la intensidad, la duración y la heterogeneidad de la captación de contraste, el análisis del histograma o de la textura para la cuantificación de la heterogeneidad tumoral y la utilidad de diferentes secuencias mediante RM, incluyendo la relativamente nueva técnica de difusión. Entre los resultados publicados se ha descrito que los AML pobres en grasa mediante TC sin contraste muestran hiperdensidad en fase basal19, menor heterogeneidad que los CCR en el análisis de textura20, captación homogénea y prolongada de contraste, y mediante RM muestran hipointensidad de señal en secuencias T221. Por el contrario, una captación heterogénea orienta a CCR (por la presencia de áreas hemorrágicas, necróticas o quísticas). No obstante, se considera hasta la fecha que la diferenciación entre CCR y AML pobre en grasa no es posible, ya que los CCR de bajo grado y especialmente los papilares pueden mostrar también captación homogénea y prolongada de contraste e hipointensidad de señal en T221. Con respecto a los oncocitomas, tampoco pueden diferenciarse con fiabilidad de los CCR, ya que el patrón de captación es muy similar. Se ha descrito que tanto la presencia de una cicatriz central como la inversión de captación segmentaria mediante TC con contraste son hallazgos característicos de los oncocitomas22,23. Sin embargo, menos del 50% de los oncocitomas presentan cicatriz central, y otros tumores incluido el CCR pueden mostrarla24,25. Por otra parte, el patrón de inversión de captación (el segmento tumoral hipercaptante en fase corticomedular pasa a ser hipocaptante en la fase excretora, y viceversa) no ha podido ser demostrado en otros estudios26. Respecto a las nuevas herramientas, destaca la técnica de difusión por su capacidad para detectar cáncer. Recientemente se ha publicado un metaanálisis que incluye 17 estudios en el que se han encontrado diferencias significativas entre los valores de ADC de los CCR y los oncocitomas3. No obstante, estos hallazgos no han sido corroborados en otros estudios27. El rendimiento diagnóstico de la TC y la RM en la caracterización de lesiones renales basándose en la presencia y el tipo de captación es muy similar. Dada la mayor disponibilidad, mayor resolución espacial, facilidad para obtener un estudio de calidad sin artefactos y mejor precio de la TC, muchas guías sugieren caracterizar las lesiones renales mediante TC y dejar la RM para aquellos casos que plantean dudas, como pueden ser la presencia o no de una mínima cantidad de grasa o cuando existen dudas de si una lesión capta o no contraste16. Sin embargo, la ausencia de radiación, así como la información adicional que aportan diferentes secuencias, incluyendo la técnica de difusión, hacen de la RM una herramienta más atractiva y completa, por lo que en función de su disponibilidad podría utilizarse como primera opción diagnóstica.
Características mediante técnicas de imagen de las lesiones sólidas más frecuentes
| Lesión renal | Hallazgos morfológicos | Señal de RM | Captación | Difusión |
|---|---|---|---|---|
| AML típico | Detección de grasa macroscópica | Pérdida de señal en secuencia con saturación de grasa | Variable, dependiendo del porcentaje de componente graso, muscular o vascular | Importante restricción por componente graso |
| AML pobre en grasa | Hiperdenso en fase sin contraste (TC basal) | Hiposeñal en T2 | Captación homogénea y prolongada | Menor restricción que CCR |
| Oncocitoma | Cicatriz central (<50% de los casos) | Variable, no específica | Hipercaptación fase corticomedular Inversión segmentaria de captación* | Menor restricción que CCR |
| CCR de células claras | En ocasiones calcificaciones En ocasiones cicatriz central | Puede presentar pérdida de señal en secuencia fuera de fase (por presencia de grasa microscópica) | Hipercaptación fase corticomedular Heterogénea si áreas de hemorragia, quísticas o necrosis | Restricción difusión |
| CCR de bajo grado | En ocasiones calcificaciones | Pueden mostrar hiposeñal en T2 (CCR papilar) | Hipercaptación fase nefrográfica Homogénea En ocasiones muy escasa (CCR papilar) | Mayor restricción que los CCR de células claras |
AML: angiomiolipoma; CCR: carcinoma de células renales; RM: resonancia magnética; TC: tomografía computarizada.
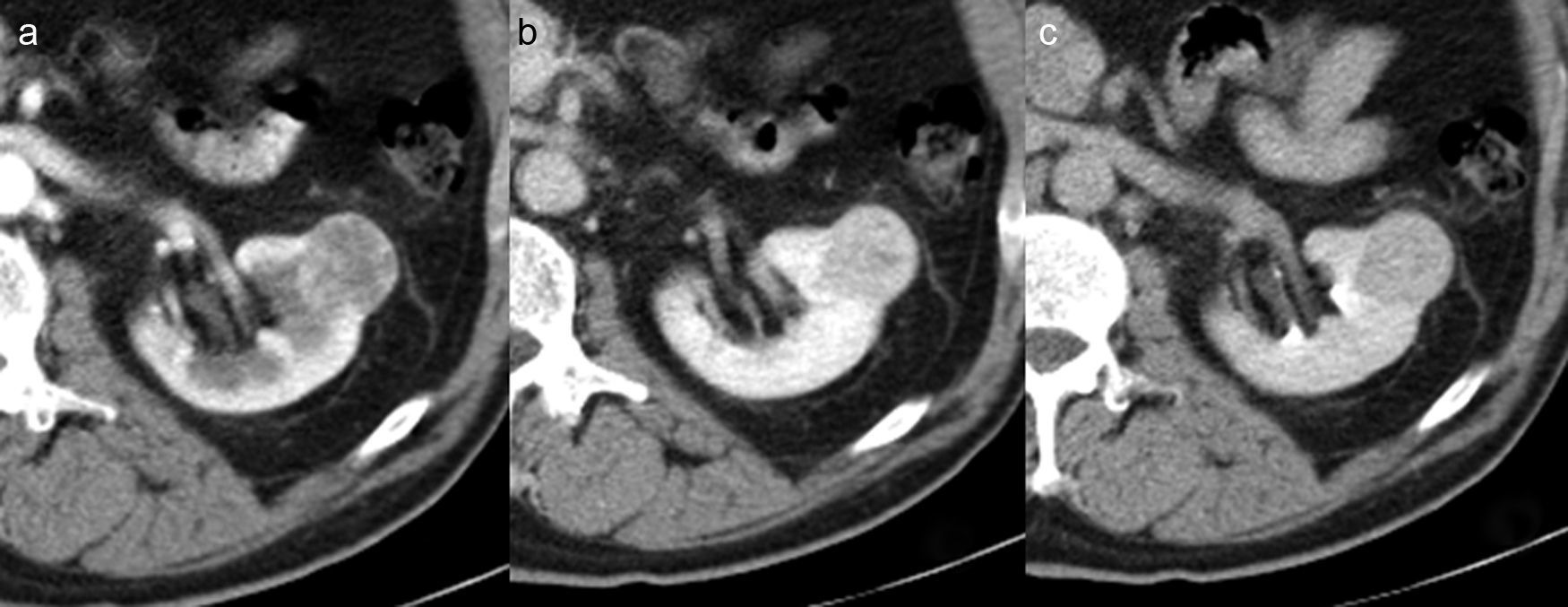
Paciente con masa renal incidental sólida detectada en estudio por sospecha de patología biliar. En el estudio mediante TC específica que incluía fases sin y con contraste se observa una masa sólida en el tercio medio renal izquierdo con captación heterogénea en fases corticomedular (a) y nefrográfica (b) y lavado en fase excretora (c). Ante la posiblidad de CCR se decidió realizar una intervención quirúrgica y el diagnóstico histológico final fue de oncocitoma.
Dadas las limitaciones en el diagnóstico diferencial entre CCR, AML pobres en grasa y oncocitomas, existe un creciente apoyo a la caracterización histológica de las lesiones incidentales mediante biopsia percutánea. La mayoría de las guías urológicas han incorporado la biopsia en sus algoritmos diagnósticos no solo para evitar la cirugía de lesiones benignas sino para, en el caso de malignidad, aportar información sobre el tipo de CCR de cara a decidir el tipo de tratamiento entre un abanico de terapias, incluyendo la vigilancia activa, la ablación percutánea y la cirugía (fig. 4). Estudios recientes muestran un elevado rendimiento diagnóstico, hasta del 90% en el estudio de Richard28 y del 96% en el de Maturen29 (en el que, como resultado de la biopsia, se modificó el manejo clínico en el 60,5% de los casos con respecto al teóricamente esperado), con una tasa baja de complicaciones (del 8,5% y el 2%, respectivamente). Para obtener un buen rendimiento diagnóstico se recomienda que las biopsias las realice personal experto, con agujas de no más de 18 G y que sean evaluadas por patólogos expertos en patología tumoral renal. Aunque las indicaciones de biopsia están claramente establecidas en pacientes sintomáticos y determinadas situaciones clínicas, como en el diagnóstico diferencial entre cáncer renal y metástasis o cáncer renal y patología infecciosa, no existe consenso en su papel en el manejo de lesiones incidentales. En este escenario, la tendencia es realizar biopsia: a) en aquellas lesiones no caracterizadas por imagen con alta sospecha radiológica de benignidad, como son aquellas lesiones con clara cicatriz central (que orienta a oncocitoma) o lesiones hiperdensas espontáneamente en fase basal mediante TC o hipointensas en T2 mediante RM que muestren captación homogénea y mantenida tras administrar contraste (que orienta a AML pobre en grasa); b) en pacientes con alta comorbilidad quirúrgica, y c) en aquellas de pequeño tamaño (< 3cm), dada la mayor probabilidad de benignidad30.
ConclusiónEn conclusión, las técnicas de imagen e intervencionistas son fundamentales en el diagnóstico de una lesión renal incidental, y permiten el manejo diagnóstico en función de los hallazgos radiológicos y de las posibilidades terapéuticas de cada paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Autoría- 1.
Responsable de la integridad del estudio: CN.
- 2.
Concepción del estudio: CN.
- 3.
Diseño del estudio: CN.
- 4.
Obtención de los datos: CN, MS, BP.
- 5.
Análisis e interpretación de los datos: CN, MS, BP.
- 6.
Tratamiento estadístico: no corresponde.
- 7.
Búsqueda bibliográfica: CN, BP, MS.
- 8.
Redacción del trabajo: CN, BP, MS.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CN, BP, MS.
- 10.
Aprobación de la versión final: CN, BP, MS.
Los autores declaran no tener ningún conflicto de intereses.