La miocarditis consiste en la inflamación del miocardio, producida la mayoría de las veces por una infección viral. La confirmación diagnóstica en la práctica clínica habitual es difícil porque la historia clínica y la exploración física, las alteraciones en el electrocardiograma, la determinación de las enzimas cardiacas y el ecocardiograma ofrecen escasa precisión diagnóstica, y no es infrecuente que se plantee el diagnóstico diferencial con el infarto agudo de miocardio. La resonancia magnética (RM) cardiaca se ha convertido en el método de imagen de elección para el diagnóstico de la miocarditis. En este trabajo se describen los hallazgos de imagen en la RM en el momento del diagnóstico y en el seguimiento de los pacientes con miocarditis, el diagnóstico diferencial con otros procesos agudos como el infarto de miocardio, y los factores pronósticos estudiados mediante RM.
Myocarditis, inflammation of the myocardium, is usually due to viral infection. Diagnostic confirmation in ordinary clinical practice is difficult because the findings on the clinical history, physical examination, electrocardiogram, and laboratory tests offer scant diagnostic accuracy, and the differential diagnosis is often done with acute myocardial infarction. Cardiac magnetic resonance imaging (CMR) has become the method of choice for the diagnosis of myocarditis. In this article, we describe the CMR findings at diagnosis and during the follow-up of patients with myocarditis, the differential diagnosis with other acute processes like myocardial infarction, and the prognostic factors studied with CMR.
La miocarditis se define como la inflamación aguda o crónica del tejido miocárdico, focal o difusa, que afecta a cualquier cámara cardiaca. Se incluyó dentro de las miocardiopatías primarias de causa adquirida en la clasificación realizada por la American Heart Association en el año 20061. Posteriormente, la Sociedad Europea de Cardiología clasificó las miocardiopatías en 2008 con un punto de vista más clínico agrupando las enfermedades del miocardio según la forma y función ventricular. La inflamación y/o infección crónica del miocardio puede originar una miocardiopatía dilatada2.
Si se afecta el pericardio, se produce una miopericarditis, a menudo con derrame pleural y pericárdico asociados. Hasta un 15% de las pericarditis agudas tienen una afectación miocárdica importante3.
Es difícil establecer su incidencia real porque no es fácil confirmar el diagnóstico en la práctica clínica habitual. Se ha encontrado en el 5-12% de las autopsias de adultos con muerte súbita4,5 y en el 1-9% de las autopsias en general6. La miocarditis es la causa del 6-8% de las muertes súbitas cardiacas en atletas7. La confirmación diagnóstica es difícil porque la historia clínica y la exploración física, las alteraciones en el electrocardiograma (ECG), la determinación de las enzimas cardiacas y el ecocardiograma son poco precisos, y no es infrecuente que se plantee el diagnóstico diferencial con el infarto agudo de miocardio (IAM). Si bien la biopsia endomiocárdica (BEM) se considera la referencia para el diagnóstico de la miocarditis, no está justificada en la mayoría de los pacientes. En estas circunstancias, la resonancia magnética (RM) cardiaca se ha convertido en el método de imagen de elección para diagnosticar la miocarditis, fundamentalmente por su capacidad de caracterización tisular que permite detectar áreas de edema y de fibrosis miocárdica.
En este trabajo se describen las secuencias de RM empleadas para el diagnóstico, los hallazgos de imagen en la RM en el momento del diagnóstico y en el seguimiento de los pacientes con miocarditis, el diagnóstico diferencial con otros procesos agudos como el infarto de miocardio y los posibles factores pronósticos en los estudios de RM.
EtiopatogeniaEn los países desarrollados la infección vírica es la causa más frecuente. Si bien en las décadas de los 80 y 90 los virus más frecuentes eran los enterovirus (coxsackie B), en los últimos 10 años otros virus como el parvovirus B19, el herpesvirus humano 6, el adenovirus, el virus de la hepatitis C, el echovirus, el virus de la inmunodeficiencia humana, el de Epstein-Barr y el citomegalovirus, han cobrado importancia. Otros agentes infecciosos como bacterias, hongos, protozoos (Trypanosoma cruzi [T. cruzi], toxoplasma) y helmintos pueden causar miocarditis. Otras posibles etiologías son la tóxica (antraciclinas, ciclofosfamida, traztuzumab, catecolaminas), alcohol, cocaína o radiación, las reacciones de hipersensibilidad (antibióticos, diuréticos como las tiazidas, dobutamina, mesalazina, mordedura de insectos y serpientes), enfermedades sistémicas como las colagenosis, la sarcoidosis, la enfermedad celíaca, la enfermedad de Wegener y la tirotoxicosis6,8–12.
Desde el punto de vista fisiopatológico las miocarditis pueden dividirse en 3 fases: 1) aguda viral, 2) subaguda inmune, y 3) crónica miocárdica. En la fase aguda el virus alcanza el miocardio por diseminación linfática, hematógena o ambas en un paciente susceptible, y se introduce en el miocito. Es una fase corta y a menudo pasa desapercibida. La proliferación viral en el miocito puede causar daño tisular directo, pero la mayor parte del daño tisular en las miocarditis se produce por la respuesta del sistema inmune al virus cuando llega al miocito. La evolución del paciente va a depender de la respuesta inmune que en los casos extremos da lugar a una respuesta adversa con formación de autoanticuerpos (anticuerpos anti-miosina). La persistencia viral puede activar mantenidamente el sistema inmune con el resultado de una inflamación crónica del miocardio, remodelación cardiaca y alteración de la función, que desarrollan una miocardiopatía dilatada13.
En la fase aguda de la enfermedad hay edema, infiltrados celulares con histiocitos y células mononucleares, con o sin daño de las células miocárdicas. En las fases subaguda y crónica, la fibrosis reemplaza a las células miocárdicas14,15.
La presentación clínica es muy variable. El paciente puede estar asintomático, tener síntomas inespecíficos, presentar dolor torácico, insuficiencia cardiaca, arritmias, alteraciones de la conducción, shock cardiogénico o muerte súbita. Los pacientes con miocarditis pueden presentar síntomas parecidos a los del IAM, sobre todo los sujetos jóvenes16. Hasta en el 89% de las miocarditis se han descrito síntomas parecidos a los de la gripe, una infección gastrointestinal o de las vías urinarias los días o semanas previos. En la mayoría de los casos el curso clínico de la miocarditis es favorable y cura sin secuelas, pero el 5-10% de los pacientes presentan una evolución desfavorable hacia una miocardiopatía dilatada o muerte súbita. En una revisión de 1.230 pacientes con miocardiopatía de causa inicialmente desconocida, el 9% tenían miocarditis17. En el 12% de los pacientes jóvenes que presentaron muerte súbita, la causa fue una miocarditis4.
Para Mahrholdt et al.6 la presentación clínica es diferente dependiendo del tipo de virus presente en la BEM. Los síntomas parecidos a los de un IAM son más típicos de la miocarditis aguda por el parvovirus B19. Estos pacientes a menudo tienen una función sistólica y un volumen ventricular izquierdo normal y un curso clínico favorable. La infección por el herpesvirus humano 6 y la combinación parvovirus B19-herpesvirus 6 se suele presentar con una clínica de insuficiencia cardiaca de nueva aparición, a menudo con malestar general y alteraciones de la conducción (bloqueos de rama). Es un cuadro clínico más insidioso, de curso más prolongado y con frecuencia cursa con alteración de la función sistólica del ventrículo izquierdo. Dado que el herpesvirus humano 6 tiene tendencia a permanecer latente después de la primoinfección (que suele ocurrir en la infancia), todo individuo infectado puede sufrir reactivaciones a lo largo de su vida.
DiagnósticoLa historia clínica, la exploración física, los datos de laboratorio, incluyendo las enzimas cardiacas que pueden elevarse de forma leve o moderada en los pacientes con miocarditis (la creatinfosfoquinasa [CPK, por sus siglas en inglés], la isoenzima MB de la CPK, y sobre todo, las troponinas T e I), y el ECG ayudan a diagnosticar la miocarditis aunque la precisión diagnóstica es baja. El ECG puede ser normal o mostrar alteraciones del ST y de la onda T, ondas Q, bloqueo aurículo-ventricular y bloqueos de rama y arritmias como taquicardia o fibrilación ventricular. Estos hallazgos tienen un valor limitado y una baja especificidad.
Debe sospecharse una miocarditis aguda cuando un paciente, especialmente un varón joven, se presenta con anomalías cardiacas inexplicables de reciente comienzo, tales como insuficiencia cardiaca, angina, arritmias o alteraciones de la conducción. Suele ser muy frecuente que refiera una infección viral los días o semanas previos. En muchos casos el diagnóstico diferencial se plantea con el IAM por el dolor torácico, la elevación de las enzimas cardiacas y las alteraciones del ECG18,19.
La BEM con análisis inmunohistoquímico y técnicas moleculares es la referencia para diagnosticar la miocarditis y otras miocardiopatías no isquémicas, pero no se recomienda en la mayoría de los pacientes con miocarditis. Está indicada ante un cuadro de miocardiopatía rápidamente progresiva refractaria al tratamiento o una miocardiopatía de causa desconocida con arritmias que amenazan la vida. Las complicaciones graves de la BEM ocurren en el 0,1-0,5% de los casos (perforación miocárdica y taponamiento cardiaco, bloqueo A-V permanente, IAM, isquemia o infarto cerebral, daño valvular grave y muerte). La tasa global de complicaciones es del 6%20. La BEM tiene una sensibilidad y una especificidad limitadas (60 y 80% respectivamente) cuando se toma la autopsia como referente21. La tasa de falsos negativos es alta por la gran variabilidad interobservador en la interpretación histológica, y porque las muestras pueden ser insuficientes debido a que los infiltrados inflamatorios son frecuentemente focales y transitorios, y no suelen afectar al ventrículo derecho (la BEM habitualmente se realiza en la cara septal del ventrículo derecho). Para Yilmaz et al.22, el rendimiento diagnóstico es mayor cuando la biopsia es biventricular (79 frente al 67%), y si se tiene que elegir un solo ventrículo es preferible hacerla en la pared libre del ventrículo izquierdo. Otros autores creen que la rentabilidad de la prueba aumenta si la BEM se obtiene de las zonas afectadas en la RM o en el ecocardiograma14,23. Un problema adicional es que puede encontrarse genoma viral en el miocardio sin que existan cambios histológicos suficientes que cumplan los criterios de Dallas21 (tabla 1). Estos criterios tienen una sensibilidad limitada que puede aumentar si se realiza además un estudio inmunohistoquímico y técnicas de patología molecular23.
Criterios de Dallas para el diagnóstico anatomopatológico de las miocarditis
| – La miocarditis aguda se define como un infiltrado inflamatorio del miocardio con necrosis y/o degeneración de los miocitos adyacentes no típico del daño isquémico asociado a enfermedad coronaria. Estos infiltrados son generalmente de células mononucleares, pero puede haber neutrófilos u ocasionalmente eosinófilos |
| – La miocarditis borderline, cuando el infiltrado inflamatorio es muy escaso o no hay daño de los miocitos |
Fuente: tomado de Aretz et al.15
Para Kindermann et al.23 la BEM puede predecir la evolución de la miocarditis. Los autores consideran la inflamación miocárdica diagnosticada con técnicas de inmunohistoquímica un factor pronóstico adverso, mientras que la histopatología con los criterios de Dallas y la detección del genoma viral no son factores independientes de mal pronóstico. Para ellos, y con vistas a futuras estrategias de tratamiento con antivirales o inmunosupresores, es fundamental distinguir entre una miocarditis activa (inflamación e infección viral), una inflamación sin genoma viral (autoinmunidad posviral) y la persistencia de un genoma viral sin inflamación. Debido a la importancia de la inmunohistoquímica, los autores defienden hacer una BEM precoz con fines pronósticos.
Imagen- –
Ecocardiograma: suele ser la primera técnica de imagen cuando se sospecha una miocarditis. Puede mostrar una alteración global o segmentaria de la contractilidad y una disfunción sistólica del ventrículo izquierdo, que son inespecíficas. El derrame pericárdico se presenta en el 32-57% de los pacientes e indica inflamación activa. En los pacientes con cuadros menos graves el ecocardiograma puede ser normal24,25.
- –
Estudios isotópicos (anticuerpos antimiosina marcados con Indio-111 y Galio-67): rara vez se utilizan en la práctica clínica por su escasa resolución espacial, la dosis de radiación que implican y su limitada disponibilidad. Además, la especificidad y valor predictivo positivo son bajos23.
- –
Angiografía coronaria: tiene valor para descartar la enfermedad coronaria. No se realiza de forma rutinaria en todos los pacientes con sospecha clínica de miocarditis, solo en aquellos en los que existe una duda diagnóstica con el IAM.
- –
Resonancia magnética: desde las primeras series de casos estudiados con secuencias potenciadas en T2 en el año 199126 y los primeros estudios clínicos con contraste en el año 199827, muchos trabajos han mostrado la utilidad diagnóstica de la RM en los pacientes con miocarditis. La gran ventaja de la RM es que ofrece una triple información: morfológica, funcional y de caracterización tisular.
La RM está indicada en los pacientes con síntomas de nueva aparición o persistentes (disnea, ortopnea, palpitaciones, intolerancia al ejercicio y dolor torácico), que presentan datos de lesión miocárdica (disfunción ventricular, alteraciones en el ECG y elevación de troponinas) y en los que se sospecha de una etiología vírica (una infección viral reciente, ausencia de factores de riesgo coronarios y una edad inferior a 35 años). También puede estar indicada en pacientes con alteraciones en el ECG no explicadas por otras causas, aun en ausencia de síntomas de miocarditis. Si se va a realizar una BEM, la RM sirve de guía mostrando las zonas de hiperintensidad de señal en las secuencias potenciadas en T2 y de realce tras la inyección de gadolinio14. Algunos estudios sugieren que es mejor hacer la RM cardiaca a partir del séptimo día del comienzo de la clínica, pues durante los primeros días puede ser menos sensible. Esto parece deberse a la afectación focal en los primeros días de la enfermedad, que se hace más difusa a partir del séptimo día y persiste hasta la tercera-cuarta semanas24.
El diagnóstico de miocarditis aguda con la RM se basa en varias secuencias (tabla 2):
- 1.
Secuencia eco de gradiente en modo cine (precesión libre en estado estacionario [SSFP, por sus siglas en inglés]). Valora la forma y la función cardiaca. En pacientes con miocarditis aguda se ha descrito un aumento transitorio del grosor y de la masa miocárdica, un aumento del volumen y una disminución de la fracción de eyección del ventrículo izquierdo28. También se han descrito alteraciones inespecíficas de la contractilidad segmentaria o global en los casos más graves28,29. Además, puede haber derrame pericárdico.
- 2.
Secuencias eco de espín rápida (FSE, por sus siglas en inglés) de sangre negra potenciadas en T2 (doble inversión-recuperación, triple inversión-recuperación, o short-tau inversion recovery [STIR]) en el eje corto ventricular. Valoran el edema miocárdico, que es conveniente confirmar siempre con al menos un plano ortogonal adicional. El grosor de corte debe ser de 10mm para tener mayor relación señal/ruido. El edema miocárdico se produce por un aumento de la permeabilidad de la membrana celular con salida del agua intracelular. Se manifiesta como áreas de intensidad de señal aumentada en las secuencias potenciadas en T2, de localización subepicárdica o transmural, parcheadas o difusas. La secuencia puede tener una menor sensibilidad en los casos de inflamación miocárdica leve y por la falta de anulación del flujo lento endocavitario que aparece como áreas de hiperintensidad de señal próximas al miocardio. El análisis puede realizarse de forma visual o cuantitativa. Para la valoración cuantitativa es preferible utilizar la antena de cuerpo en lugar de la antena de superficie cardiaca, pues así la intensidad de la señal es más homogénea. Cuando el edema es difuso puede pasar desapercibido si no se hace un análisis cuantitativo de la intensidad de señal calculando el cociente de edema, o cociente T2 entre la intensidad de señal del miocardio dañado y la intensidad de señal del músculo esquelético, generalmente un músculo paraespinal (medido en la misma imagen). Un cociente T2>2 sugiere inflamación activa. Con ese valor de corte, el cociente T2 tiene una sensibilidad, especificidad y precisión diagnóstica del 84, 74 y 79% respectivamente30.
El edema de la fase aguda de las miocarditis y el aumento de la permeabilidad capilar son procesos reversibles y transitorios, y su disminución con el tiempo se asocia a una mejoría de los parámetros de función cardiaca31,32. Otros autores creen que el edema focal sin áreas de realce tardío asociadas puede significar una forma menos grave de lesión que no progresa a necrosis28,31,33,34. Otra posible explicación es que el patrón de evolución/resolución del edema miocárdico en las secuencias potenciadas en T2 tenga una ventana temporal diferente de la que tienen las áreas de realce tardío (fig. 1).
Figura 1.Miocarditis aguda con edema miocárdico. Varón de 32 años de edad, que tras un cuadro catarral con fiebre, presenta dolor centrotorácico con elevación del ST en el ECG y elevación de troponinas y CPK séricas, ecocardiografía normal. A) Secuencia FSE doble-inversión-recuperación potenciada en T2 en eje corto. Se observa una hiperintensidad de señal ínfero-lateral subepicárdica e intramiocárdica (flecha) debida a edema miocárdico. B) Secuencia de realce tardío tras la inyección de gadolinio. Se observa realce de intensidad leve a moderada ínfero-lateral subepicárdico e intramiocárdico, indicativo de cierto grado de necrosis miocárdica (flecha).
(0.1MB). - 3.
Secuencia potenciada en T1 sin y con gadolinio para estudiar el realce precoz. Valora el grado de hiperemia y el aumento de la permeabilidad capilar, que en la miocarditis aguda se deben a la vasodilatación en el tejido inflamado, con mayor volumen sanguíneo y acumulación de mayor cantidad de contraste en la fase vascular precoz. Como el gadolinio pasa rápidamente al espacio extracelular, esta fase dura solo unos minutos después de inyectar el contraste. Por ello esta secuencia se realiza durante los primeros 3min después de la inyección. La mayoría de las veces se utiliza una secuencia FSE de sangre negra, pero también puede hacerse con una secuencia eco de gradiente con un pulso de inversión-recuperación, antes y después de la introducción de gadolinio, en los mismos cortes y con los mismos parámetros.
Aunque a veces puede hacerse visualmente, el realce precoz se debe valorar cuantitativamente, por lo que es preferible utilizar la antena de cuerpo para que la señal sea más homogénea. Se calcula de manera cuantitativa el realce global relativo del miocardio con relación al del músculo esquelético o el realce global absoluto del miocardio con respecto a la señal basal miocárdica (mayor o igual al 45%)35. Para calcular el realce global relativo se utiliza una razón de intensidad de señal miocárdica respecto al músculo esquelético >4 para indicar inflamación activa, con una sensibilidad, especificidad y una precisión diagnóstica del 80, 68 y 74% respectivamente30. En el caso de coexistir afección de los músculos esqueléticos (miositis), es preferible utilizar la cuantificación del realce global absoluto del miocardio.
- 4.
Secuencia de realce tardío. Cuando se ha producido necrosis y/o fibrosis miocárdica, aumenta el espacio extracelular y se concentra más gadolinio en estas zonas. Después de hacer la secuencia de realce precoz se administra una dosis adicional de gadolinio y se realiza una secuencia 2D/3D eco de gradiente con un pulso previo de inversión-recuperación 10-15min tras la inyección (secuencia de realce tardío) en el eje corto y ejes largos ventriculares. El tiempo de inversión se ajusta individualmente para anular la señal del miocardio sano de modo que las áreas de hiperintensidad de señal indican un daño miocárdico irreversible por necrosis o fibrosis. La extensión espacial del realce tardío se puede calcular (volumen de miocardio con intensidad de señal superior a la intensidad de señal del miocardio normal más 2 desviaciones estándar) y se expresa en gramos (volumen del miocardio que realza con gadolinio multiplicado por 1,05g/ml, que es la densidad del miocardio). Los programas dedicados a RM cardiaca de las estaciones de trabajo de los equipos de RM suelen incluir el cálculo de este parámetro.
El realce tardío en las miocarditis agudas está presente en el 44-88% de los casos, típicamente es subepicárdico con extensión variable al resto del espesor miocárdico (fig. 2), pero no afecta al subendocardio de forma aislada. En las miocarditis, con mucha frecuencia se localiza en la cara inferolateral del ventrículo izquierdo, pero también en los segmentos ántero-septales o septales, o de forma multifocal o difusa14,30,36–39. El parvovirus B19 afecta más a la cara lateral del ventrículo izquierdo y el herpesvirus humano 6 al septo interventricular6. En la enfermedad de Chagas el realce tardío se localiza con frecuencia en los segmentos inferolaterales basales y apicales12 (fig. 3). A veces, en las miocarditis activas no se destruye la cantidad de miocitos suficiente para producir necrosis detectable con esta secuencia40,41.
Figura 2.Realce tardío típico en miocarditis aguda. Varón de 19 años con cuadro de infección de vías respiratorias altas, que presenta opresión precordial, con alteraciones de la repolarización en el ECG, elevación de troponinas y CPK séricas y ecocardiografía normal. A y B) Secuencia de realce tardío tras la inyección de gadolinio. Se observa realce subepicárdico e intramiocárdico, que no sigue un patrón de distribución vascular y solo respeta los segmentos medio-inferior y basal-anterior (flechas).
(0.13MB).Los pacientes con IAM tienen edema miocárdico en el territorio coronario afectado, visible en las secuencias de sangre negra potenciadas en T2. Así mismo, presentan alteraciones de la contractilidad segmentaria en el ecocardiograma y en las secuencias eco de gradiente en modo cine, con un grosor miocárdico normal o disminuido. En las secuencias de realce tardío siempre se afecta el subendocardio34,38,41 (fig. 4). El realce suele ser más intenso que el de las miocarditis porque, en estas, las áreas de necrosis tisular dentro de los focos de inflamación son más pequeñas que en el IAM37,38.
Figura 4.Infarto agudo de miocardio. Diagnóstico diferencial con miocarditis. Varón de 47 años con dolor torácico, elevación de CPK y troponinas séricas y elevación del ST en el ECG. A) Secuencia FSE doble-inversión-recuperación potenciada en T2 en el eje corto. Se observa una hiperintensidad de señal lateral (flecha) indicativa de edema miocárdico. Existe también un leve derrame pericárdico inferior. B) Secuencia de realce tardío tras la inyección de gadolinio en el eje corto. Se observa un realce transmural en la cara lateral (flecha) con varios focos intramiocárdicos de ausencia de realce indicativos de obstrucción de la microcirculación. C) Angiografía coronaria que muestra la obstrucción de la arteria circunfleja (flecha). D) RM cardiaca realizada a los dos meses. Secuencia de realce tardío en el eje corto tras inyectar gadolinio. Se observa un intenso realce transmural en la cara lateral compatible con fibrosis miocárdica (flecha).
(0.21MB).En los pacientes con un síndrome coronario agudo, un aumento sérico de las troponinas y un cateterismo cardiaco que no muestre lesiones significativas, la secuencia de realce tardío puede ayudar a diferenciar entre una miocarditis (realce subepicárdico), un IAM por émbolos, trombo recanalizado o espasmo coronario (realce subendocárdico en un territorio vascular coronario) y una enfermedad de Tako-Tsubo, que típicamente no muestra realce tardío18,37,41,42.
Para Baccouche et al.43 la extensión del realce tardío es mayor en los pacientes con una BEM de miocarditis activa, que en los que solo tienen un diagnóstico histológico de miocarditis borderline o genoma viral sin inflamación. El diagnóstico de miocarditis se estableció en un porcentaje significativamente mayor con BEM que con RM, probablemente debido a que la BEM positiva incluye formas más «sutiles» (borderline y genoma viral) que pasan desapercibidas en la RM. Para los autores es razonable empezar por una RM que, si es diagnóstica, evita hacer la BEM.
En general, no existe una clara relación entre la extensión miocárdica del realce tardío en la RM y los niveles séricos de los marcadores de daño miocárdico (CPK, troponina) o las alteraciones en el ECG14,24,32. Tampoco con los parámetros de función ventricular izquierda (fracción de eyección, volumen telediastólico, volumen telesistólico)18,19. Esto puede deberse a que al lesionarse el subepicardio de forma predominante y estar respetado el subendocardio, la repercusión sobre la función sistólica es menor14,44.
La combinación de las secuencias 2, 3 y 4 aumenta la precisión diagnóstica. Si 2 o más son positivas la precisión diagnóstica es del 78%, la sensibilidad del 76% y la especificidad del 95,5%; si solo se utiliza la secuencia del realce tardío, la precisión diagnóstica es del 68-71% con una sensibilidad del 44-54% y una especificidad del 64-100% (tabla 3)45.
Tabla 3.Criterios en RM cardiaca diagnósticos de miocarditis (criterios de consenso de Lake Louise)
Ante la sospecha clínica de miocarditis, los hallazgos en la RM cardiaca son compatibles con inflamación miocárdica si están presentes al menos 2 de los siguientes criterios: 1. Aumento de la señal focal o difusa en las secuencias potenciadas en T2 2. Realce precoz con Gd (midiendo el realce global absoluto o el realce global relativo del miocardio) 3. Al menos un foco de realce tardío focal no isquémico Un estudio de RM cardiaca es compatible con daño del miocito y/o cicatriz por inflamación miocárdica si el tercer criterio está presente Si el estudio inicial con RM es normal, se recomienda repetir la RM entre la primera y segunda semana si la sospecha clínica es muy alta y el comienzo de la clínica ha sido muy reciente – La presencia de disfunción del ventrículo izquierdo o derrame pericárdico son datos adicionales que favorecen la presencia de miocarditis Fuente: tomado de Friedrich et al.45
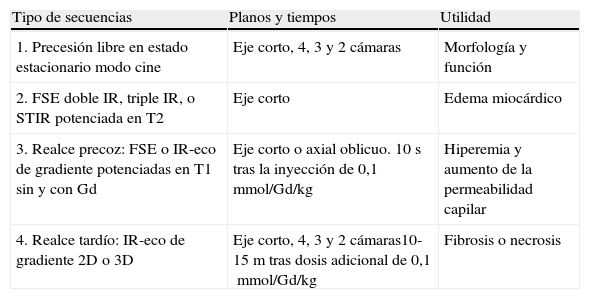
Secuencias de RM en el estudio de miocarditis
| Tipo de secuencias | Planos y tiempos | Utilidad |
| 1. Precesión libre en estado estacionario modo cine | Eje corto, 4, 3 y 2 cámaras | Morfología y función |
| 2. FSE doble IR, triple IR, o STIR potenciada en T2 | Eje corto | Edema miocárdico |
| 3. Realce precoz: FSE o IR-eco de gradiente potenciadas en T1 sin y con Gd | Eje corto o axial oblicuo. 10 s tras la inyección de 0,1mmol/Gd/kg | Hiperemia y aumento de la permeabilidad capilar |
| 4. Realce tardío: IR-eco de gradiente 2D o 3D | Eje corto, 4, 3 y 2 cámaras10-15m tras dosis adicional de 0,1mmol/Gd/kg | Fibrosis o necrosis |
FSE: secuencia eco de espín rápida; Gd: gadolinio; IR: inversión-recuperación; STIR: Short-tau Inversion Recovery.
Son varios los estudios que han descrito la disminución de las zonas de realce tardío en los estudios de seguimiento con RM en pacientes con miocarditis6,14,32,40,46,47. Esto podría explicarse porque al avanzar la curación, el edema se resuelve, la cicatriz se contrae y el miocardio se remodela y, por lo tanto, la extensión del área de realce tardío disminuye (fig. 5). En algunos casos persisten microcicatrices que están por debajo de la resolución espacial de la RM y se produce la desaparición visual de las zonas de realce tardío. Este hecho se ve acrecentado por la distribución parcheada de las cicatrices en las miocarditis48–50. Otras veces, el área de realce puede persistir sin cambios32. También pueden mejorar la función sistólica y el volumen telediastólico del ventrículo izquierdo14.
Evolución del realce tardío en la miocarditis. Varón de 29 años con un cuadro agudo de palpitaciones y dolor torácico, con elevación de troponinas y CPK séricas y alteraciones del ST en el ECG. A) RM cardiaca realizada durante el cuadro agudo. Secuencia de realce tardío en el eje corto tras inyectar gadolinio. Se observa realce subepicárdico medio anteroseptal e inferolateral (flecha). B) RM cardiaca realizada a los 3 meses. Secuencia de realce tardío en el eje corto tras inyectar gadolinio. Persiste el realce pero ha disminuido en intensidad de señal y extensión (flecha).
Zagrosek et al.48 estudiaron con RM 36 pacientes al inicio de la miocarditis y entre 8-18 meses después. En la fase aguda, el cociente T2 estaba elevado en el 86% de los pacientes, el realce global relativo en el 80%, y había realce tardío en el 63% de los casos. En el seguimiento, la fracción de eyección del ventrículo izquierdo aumentó mientras que el cociente T2 y el realce global relativo disminuyeron de forma significativa. El realce tardío persistió en todos los casos excepto en uno que desapareció completamente. La extensión del realce tardío disminuyó de forma significativa entre la fase aguda y la crónica. La distinción entre miocarditis aguda y crónica es importante porque durante la fase aguda se prohíbe el ejercicio físico, dado que puede incluso causar muerte súbita.
Escher et al.51 observaron que un 10-20% de los pacientes con miocarditis evolucionaban a una miocardiopatía dilatada relacionada con una inflamación crónica del miocardio por persistencia viral y/o por una respuesta inmune alterada (fig. 6). El riesgo de muerte de causa cardiaca o la necesidad de trasplante cardiaco era mayor. El 80-90% de los pacientes con miocarditis salían del hospital con una función cardiaca normal. En el seguimiento a los 4-6 años, el 50% de los pacientes con miocarditis grave desarrollaron una insuficiencia cardiaca por disfunción diastólica con una fracción de eyección normal. Todos los pacientes que evolucionaron a insuficiencia cardiaca en los que se realizó una RM cardiaca presentaban realce tardío miocárdico. Los autores concluyeron que es necesario el tratamiento de los pacientes con miocarditis y un seguimiento clínico estrecho. También que la fibrosis miocárdica puede contribuir al desarrollo de disfunción diastólica.
Evolución de miocarditis a miocardiopatía dilatada. Varón de 52 años con miocardiopatía dilatada. Antecedentes de miocarditis aguda. Secuencia de realce tardío tras la inyección de gadolinio, planos de cuatro cámaras (A), eje corto (B y D) y eje largo (C). Se observa realce subepicárdico/intramiocárdico extenso, que no sigue un patrón de distribución vascular.
Una RM realizada después de las 4 semanas tras el comienzo del cuadro clínico, permite distinguir entre una miocarditis no complicada que se resuelve en 2-3 semanas y un curso complicado por persistencia viral o respuesta autoinmune (miocarditis crónicas). Para Wagner et al.35, la persistencia de una captación precoz de gadolinio a partir de la cuarta semana después del comienzo de la enfermedad, se asocia con un peor pronóstico en cuanto a la recuperación funcional y la persistencia de síntomas en el control a los 3 años.
Para Kindermann et al.23 los 3 factores predictores asociados a una peor evolución (muerte de causa cardiaca o necesidad de trasplante cardiaco) en pacientes con miocarditis aguda son las clases funcionales de la insuficiencia cardiaca iii y iv de la New York Heart Association (NYHA), datos de inflamación en la imunohistoquímica de la BEM y la ausencia de tratamiento con beta bloqueantes. La eficacia de los beta bloqueantes puede deberse a que la actividad simpática que estimula la inflamación y la apoptosis, puede relacionarse con la progresión de la disfunción del ventrículo izquierdo, con lo que los bloqueadores beta disminuirían la inflamación.
Mahrholdt et al.6 describieron 3 factores pronósticos independientes de disfunción ventricular crónica y dilatación del ventrículo izquierdo: la dilatación del ventrículo izquierdo, el realce tardío septal y la cantidad total de miocardio con realce tardío, en la fase aguda de la enfermedad. Así mismo, describieron un cuarto factor que es la etiología vírica combinada parvovirus B19-herpesvirus humano 6, porque es menos frecuente la desaparición viral del miocardio y, por lo tanto, es más frecuente el fallo ventricular crónico.
La afectación del ventrículo derecho con disminución de la fracción de eyección en la ecocardiografía es un marcador de mal pronóstico en cuanto a la muerte súbita y la necesidad de trasplante cardiaco52.
ConclusionesLa confirmación diagnóstica de la miocarditis es difícil porque la historia y la exploración clínica, los datos del ECG y del ecocardiograma y la serología tienen una precisión diagnóstica baja. La BEM con estudio inmunohistoquímico sigue siendo la técnica de elección, pero no está indicada en la mayoría de los pacientes, especialmente en aquellos con miocarditis leve. La RM cardiaca tiene un papel fundamental por su triple información morfológica, funcional y de caracterización tisular permitiendo el diagnóstico diferencial con el IAM y el seguimiento en los pacientes sintomáticos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Autorías- 1.
Responsable de la integridad del estudio: ABG, BCM, JFD, CGV y CFG.
- 2.
Concepción del estudio: ABG, BCM y CFG.
- 3.
Diseño del estudio: ABG, BCM y CFG.
- 4.
Obtención de los datos: ABG, BCM y CFG.
- 5.
Análisis e interpretación de los datos: ABG y BCM.
- 6.
Tratamiento estadístico: ABG.
- 7.
Búsqueda bibliográfica: ABG, BCM, JFD y CGV.
- 8.
Redacción del trabajo: ABG, BCM, JFD y CGV.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JFD y CFG.
- 10.
Aprobación de la versión final: ABG, BCM, JFD, CGV y CFG.
Los autores declaran no tener ningún conflicto de intereses.