La neoplasia papilar intraductal de la vía biliar (NPI-VB) es una entidad poco conocida en nuestro medio por su baja prevalencia. Hasta su nueva definición en la cuarta edición de la clasificación de la Organización Mundial de la Salud de los tumores del aparato digestivo publicada en 2010, la enfermedad se agrupaba bajo una terminología heterogénea y poco precisa. Además, en los últimos años se ha avanzado en el conocimiento de su etiopatogenia, su historia natural y sus hallazgos en imagen. El propósito de este artículo es repasar estos datos subrayando los hallazgos radiológicos de la enfermedad y su diagnóstico diferencial.
Intraductal papillary neoplasm of the biliary tract (B-IPN) is a scarcely known entity in our daily practice due to its low prevalence. Until its new definition in the fourth edition of the WHO classification of the digestive tract tumors of 2010 the disease was grouped under a heterogeneous and imprecise terminology. In addition, in recent years there has been progress in the knowledge of its etiopathogenesis, its natural history and its findings in image. The purpose of this paper is to review these data underlining the radiological findings of the disease and its differential diagnosis.
La neoplasia papilar intraductal de la vía biliar (NPI-VB) se considera una nueva categoría dentro de los tumores que afectan a la vía biliar. Unifica, bajo una denominación común, un conjunto de términos1–9 preexistentes, algunos confusos, por ejemplo, neoplasia biliar intrahepática secretora de mucina, ya que no todas las NPI-VB producen mucina3,5–7,10, o papilomatosis biliar. Además, aclara términos erróneos como cistoadenocarcinoma mucinoso ductoectásico, al representar el cistoadenocarcinoma y la NPI-VB entidades diferentes1,5,6,8–13.
La NPI-VB puede manifestarse como episodios recurrentes, intermitentes y autolimitados de colangitis aguda, bien por producción de mucina o por descamación del epitelio tumoral, que en ambos casos conlleva obstrucción de la vía biliar y puede simular hepatolitiasis3,4,6,8,12–14. También puede ser asintomática y diagnosticarse incidentalmente6,8,11,13–15. Su incidencia es más frecuente en hombres entre la quinta y séptima décadas de la vida3,5,6,8,15 y en países del sudeste asiático3,5–8,13,15, probablemente debido a la mayor prevalencia de hepatolitiasis y clonorquiasis en estas regiones, que constituyen dos factores de riesgo de la enfermedad3–6,8,15,16.
Embriología y anatomíaEl desarrollo del sistema hepatobiliopancreático es importante para explicar la etiopatogenia de la NPI-VB (fig. 1)3,5,11,17–19. Los conductos colédoco y pancreático ventral comparten su origen embriológico porque ambos se originan a partir de una evaginación endodérmica del duodeno rudimentario. Esto explica que muestren características histológicas e inmunohistoquímicas comunes: tienen un epitelio columnar plano y expresan citoqueratinas 7 y 195,11,18. Además, se sabe que el epitelio biliar primitivo posee pluripotencialidad para la diferenciación hacia epitelio pancreático, y la expresión final de uno u otro está controlada por la expresión e inhibición de diferentes genes5,18,19. De ese modo, cualquier alteración en la expresión génica podría conducir a la persistencia de restos pancreáticos dentro del epitelio biliar y explicar en parte el origen de la NPI-VB5. Este mecanismo etiopatogénico explicaría también la metaplasia acinar pancreática observada ocasionalmente en las glándulas peribiliares3,5,11,18, la semejanza existente entre la NPI-VB y la neoplasia papilar intraductal del páncreas (NPI-P)2–14,20 y la posible coexistencia de estas neoplasias20,21 (fig. 2).
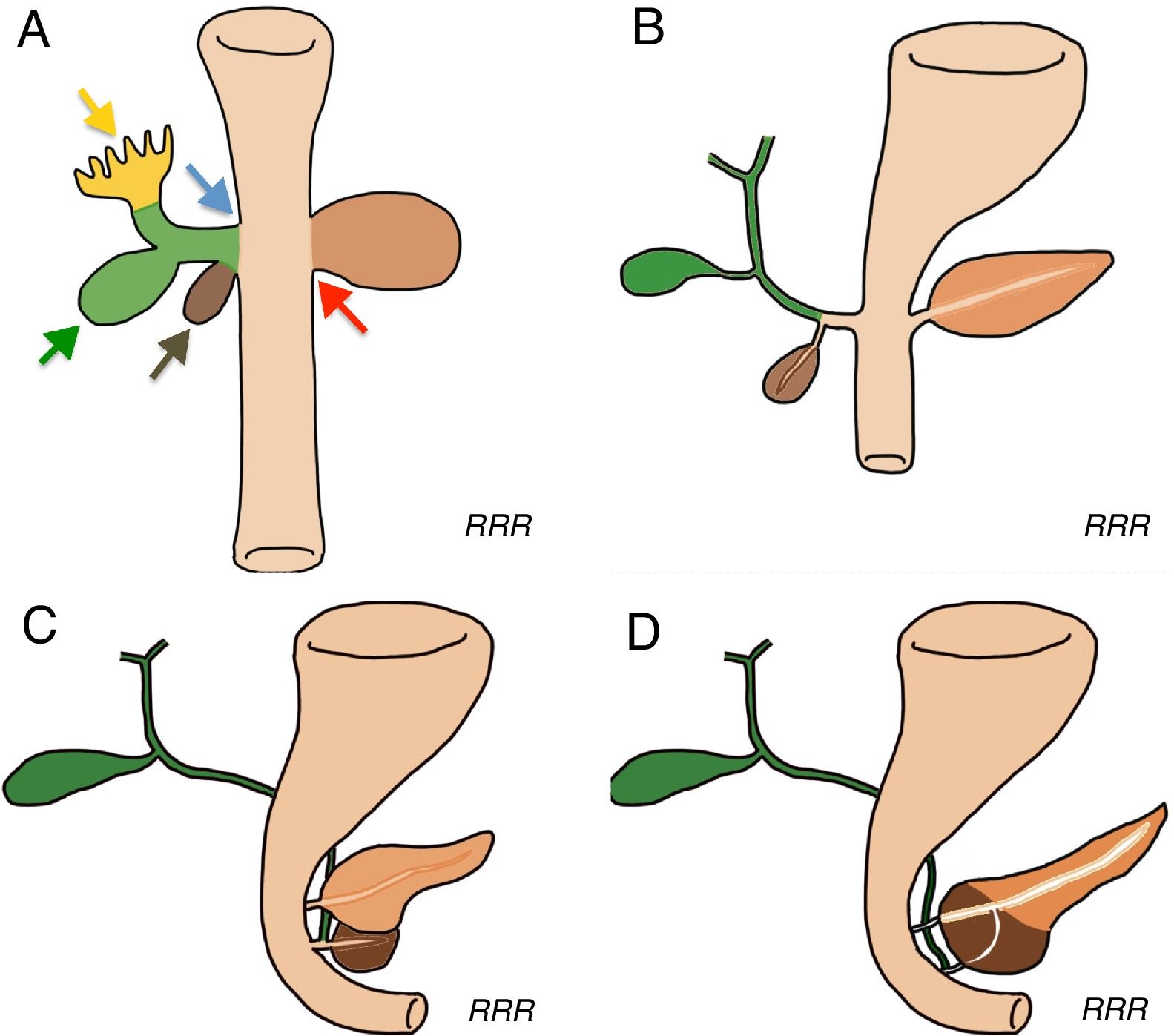
Desarrollo embriológico del sistema hepatobiliopancreático. A partir del endodermo del duodeno primitivo surge una evaginación ventral (flecha azul) y otra dorsal (flecha roja). Desde el brote ventral (o “divertículo hepático”) surgen, por una parte, el primordio hepático (flecha amarilla), que además dará origen a la vía biliar intrahepática, y, por otra parte, la vesícula biliar, la vía biliar extrahepática (flecha verde) y el páncreas ventral (flecha marrón)3,5,11,17–19. El brote dorsal es el precursor del páncreas y del conducto pancreático dorsal. El colédoco y el páncreas ventral rodean la segunda porción del duodeno y se unen al páncreas dorsal. Mientras rota alrededor del duodeno, el colédoco crece hacia el hilio hepático y termina uniéndose con la vía biliar intrahepática y completando el sistema biliopancreático5,17,18.
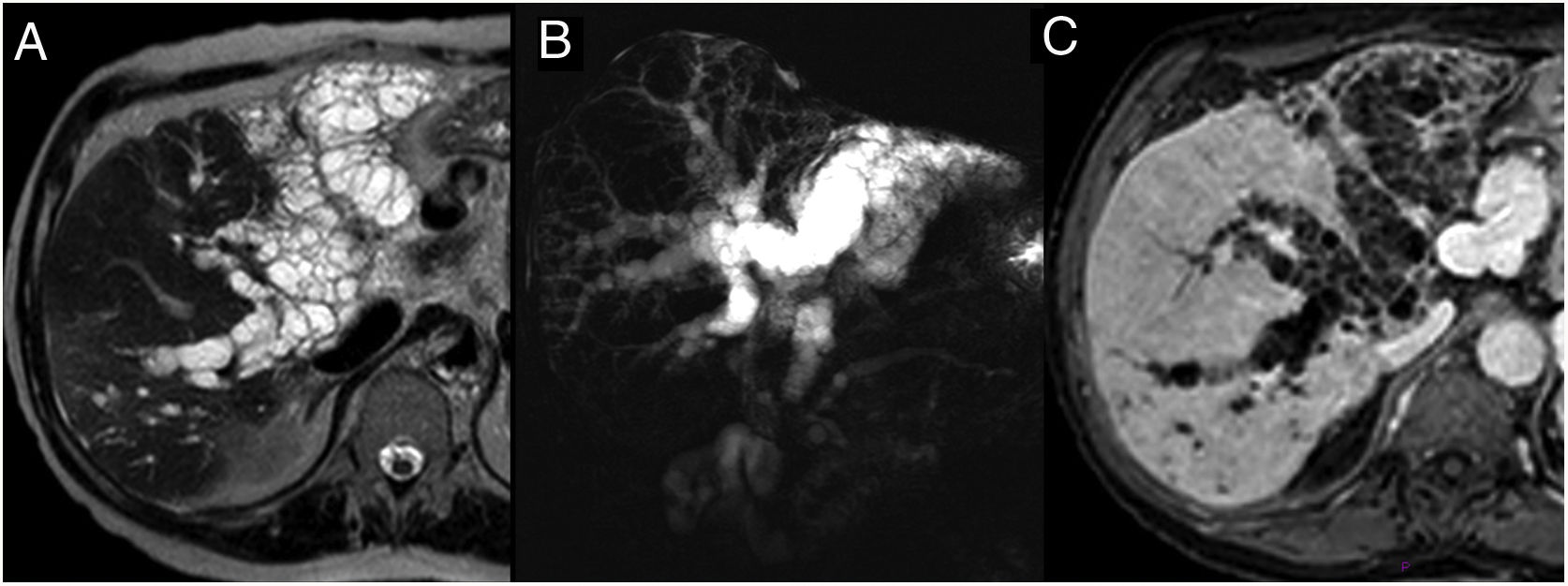
Varón de 66 años en estudio pretrasplante por cirrosis hepática. A) TSE-T2 axial que muestra signos de cirrosis hepática y dilatación de la vía biliar intrahepática más marcada en lóbulo hepático izquierdo, donde adquiere aspecto multiloculado y sustituye prácticamente a todo el parénquima. B) Colangiopancreatografía por resonancia magnética de corte grueso que muestra imágenes quísticas arrosariadas asociadas a la dilatación de la vía biliar intra- y extrahepática. También pequeña imagen quística en cabeza pancreática y dilatación de rama lateral y del conducto pancreático principal. C) T1-THRIVE posgadolinio en fase portal donde se observa la dilatación de la vía biliar, sin focos de realce intrabiliar. El hígado explantado demostró que los hallazgos correspondían a innumerables lesiones quísticas rellenas de material mucinoso comunicadas con la vía biliar dilatada. El estudio histológico demostró tumor papilar de la vía biliar productor de mucina (NPIM), con displasia de bajo grado. El paciente está en seguimiento por la lesión pancreática catalogada como NPIM por ecoendoscopia y la afectación del colédoco distal no resecados.
La NPI-VB puede mostrarse de diferentes formas3,5,6,11,13–16,22: frecuentemente se trata de lesiones multifocales –más raramente solitarias–, intraluminales, con aspecto fúngico, de pólipo o en “hoja de helecho”, pediculadas o sésiles (fig. 3). También pueden mostrar patrón en “escayola” o “enyesado”, en el que el tumor reduce la luz ductal en un segmento largo de la vía biliar. Por último, se puede observar el patrón de afectación superficial, en el que la lesión apenas resulta visible por técnicas de imagen: le confiere a la superficie de la vía biliar un patrón irregular o en “dientes de sierra”, a veces visible mediante ecografía o colangiopancreatografía retrógrada endoscópica (CPRE), que son el resultado de numerosas excrecencias papilares neoformativas presentes en la mucosa de la vía biliar. Este patrón se conoce como “barrera de coral” cuando se visualiza directamente por colangioscopia.
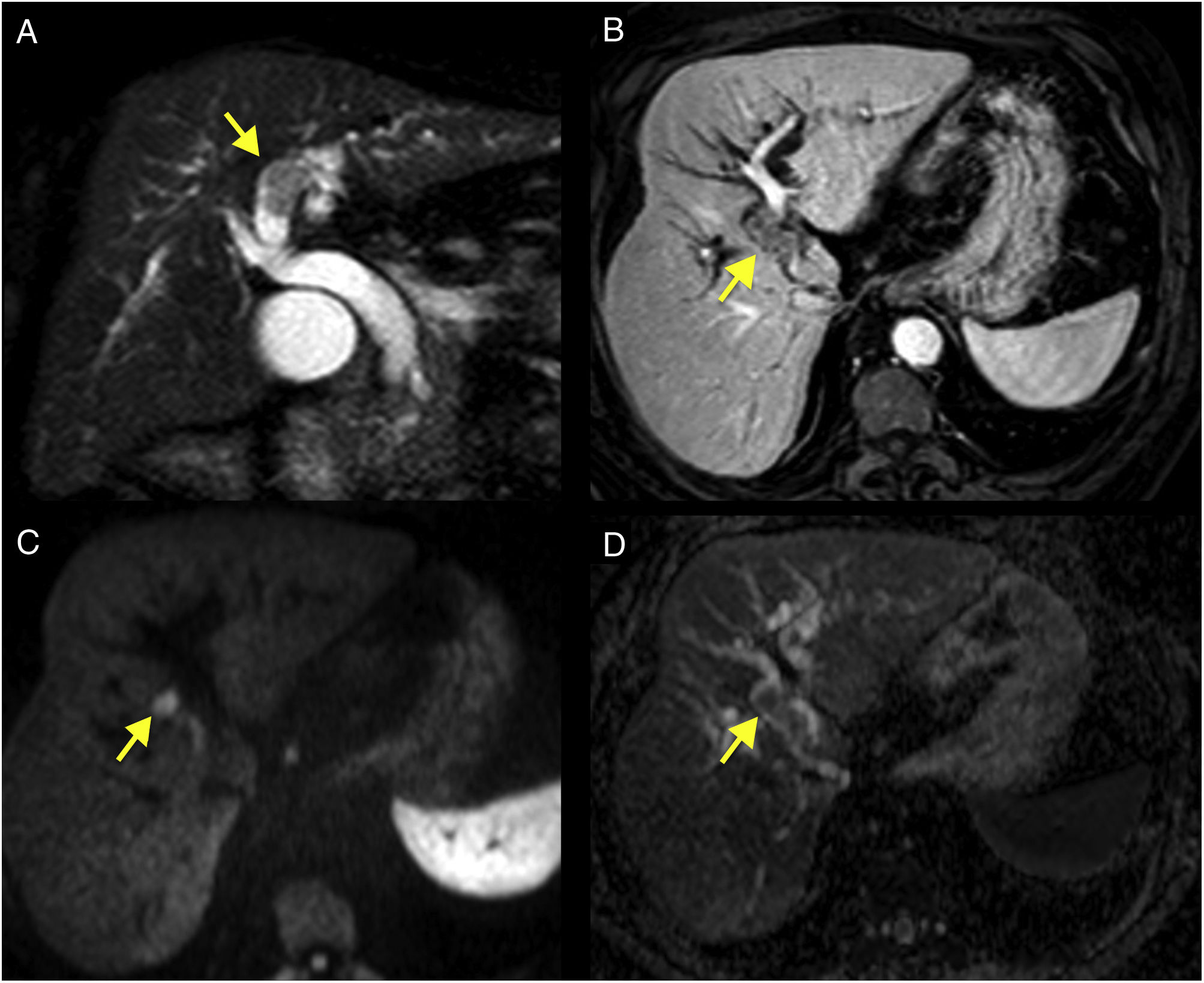
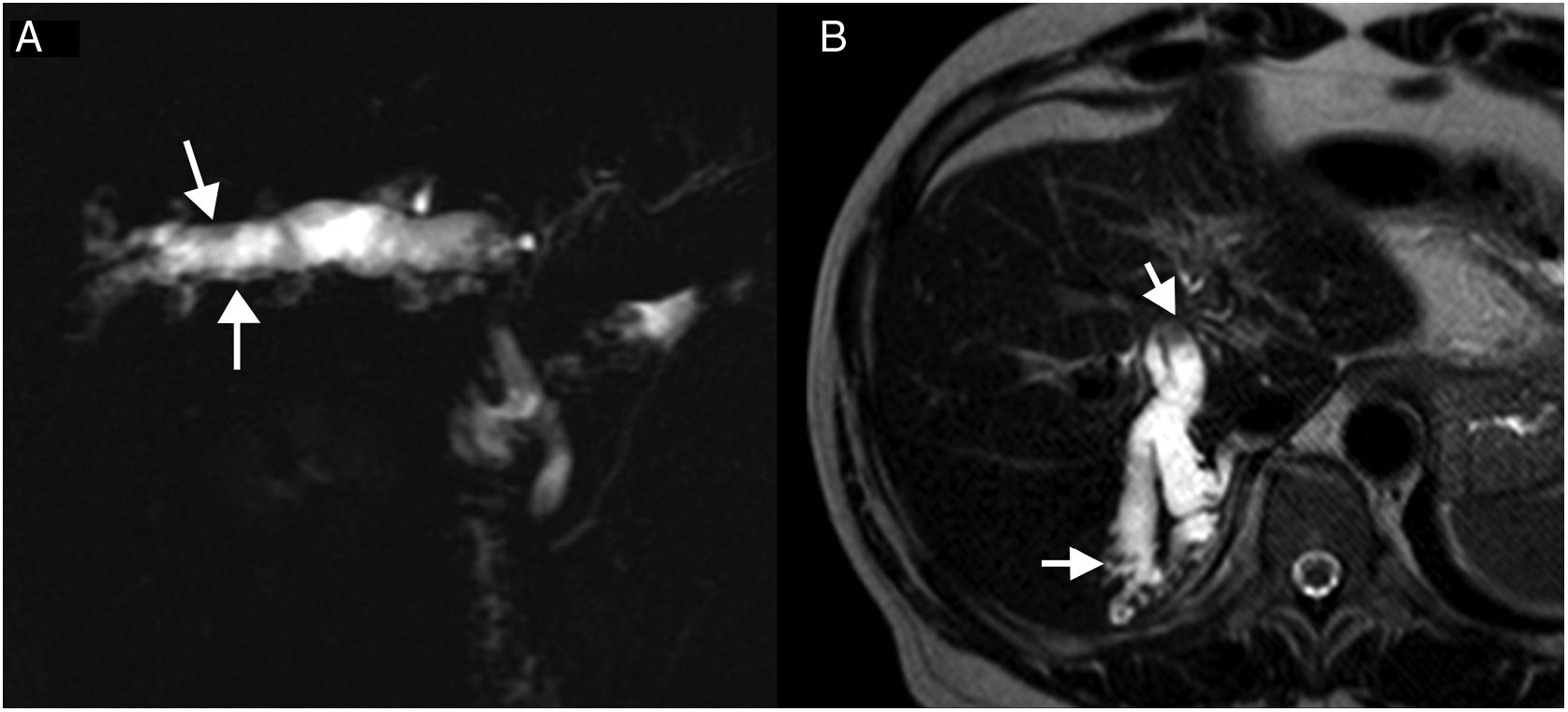
Varón de 72 años en estudio por ictericia obstructiva. A) RM TSE-T2-SPAIR que muestra dilatación de la vía biliar intra- y extrahepática y un defecto de repleción polipoide en el interior del conducto hepático izquierdo (flechas amarillas en A-C). B) T1-THRIVE posgadolinio en fase portal que muestra el defecto de repleción intracanalicular con discreto realce menor que el parénquima. C) Secuencia de difusión (b=1000) que muestra foco hiperintenso en la lesión intrabiliar. D) Mapa ADC (apparent diffusion coefficient) con hipointensidad de la lesión intraductal que indica restricción en la difusión. El paciente fue intervenido mediante duodenopancreatectomía cefálica por adenocarcinoma ampular. La histología mostró además neoplasia papilar intraductal en la vía biliar resecada.
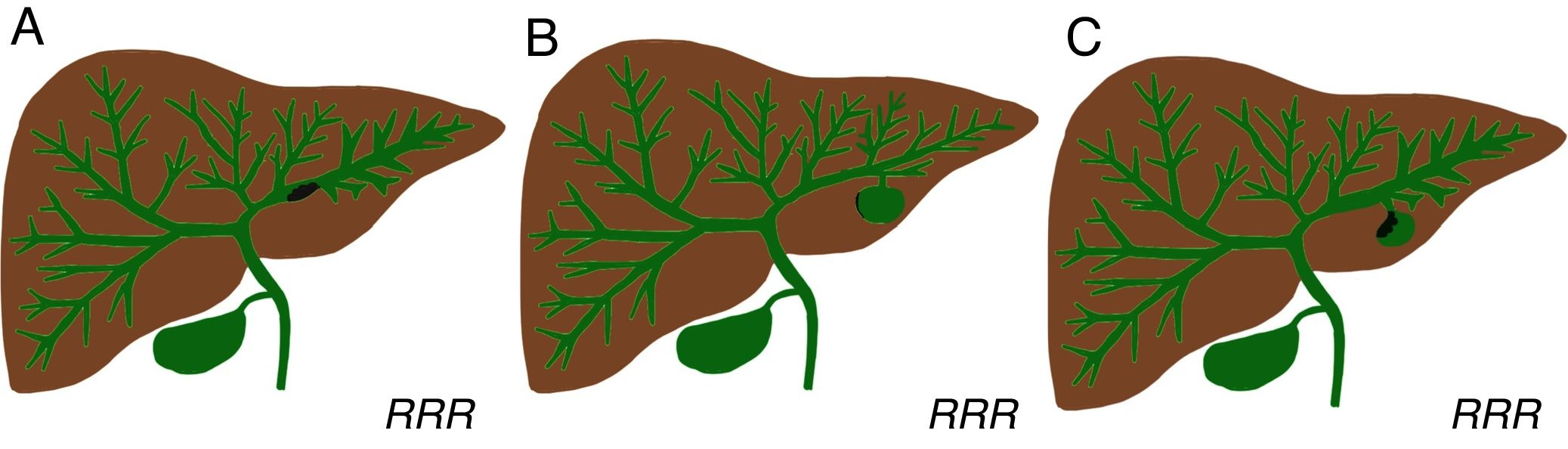
Otro detalle importante para la clasificación de las NPI-VB es la producción de mucina: solo un tercio de estos tumores la producen3,5–7,10 (fig. 4), a diferencia de la NPI-P, donde la producción de mucina ronda el 100%3. Para los tumores papilares de la vía biliar productores de mucina (NPIM-VB) existe una clasificación alternativa5,6,11–13,23, propuesta inicialmente por Sakamoto et al23, según la cual existen tres subtipos de NPIM-VB: el ductoectásico, el quístico y el intermedio (fig. 5):
- 1.
El ductoectásico se caracteriza por la presencia de tumores papilares que proliferan en el interior de la vía biliar, que está dilatada de manera difusa (figs. 2 y 4).
- 2.
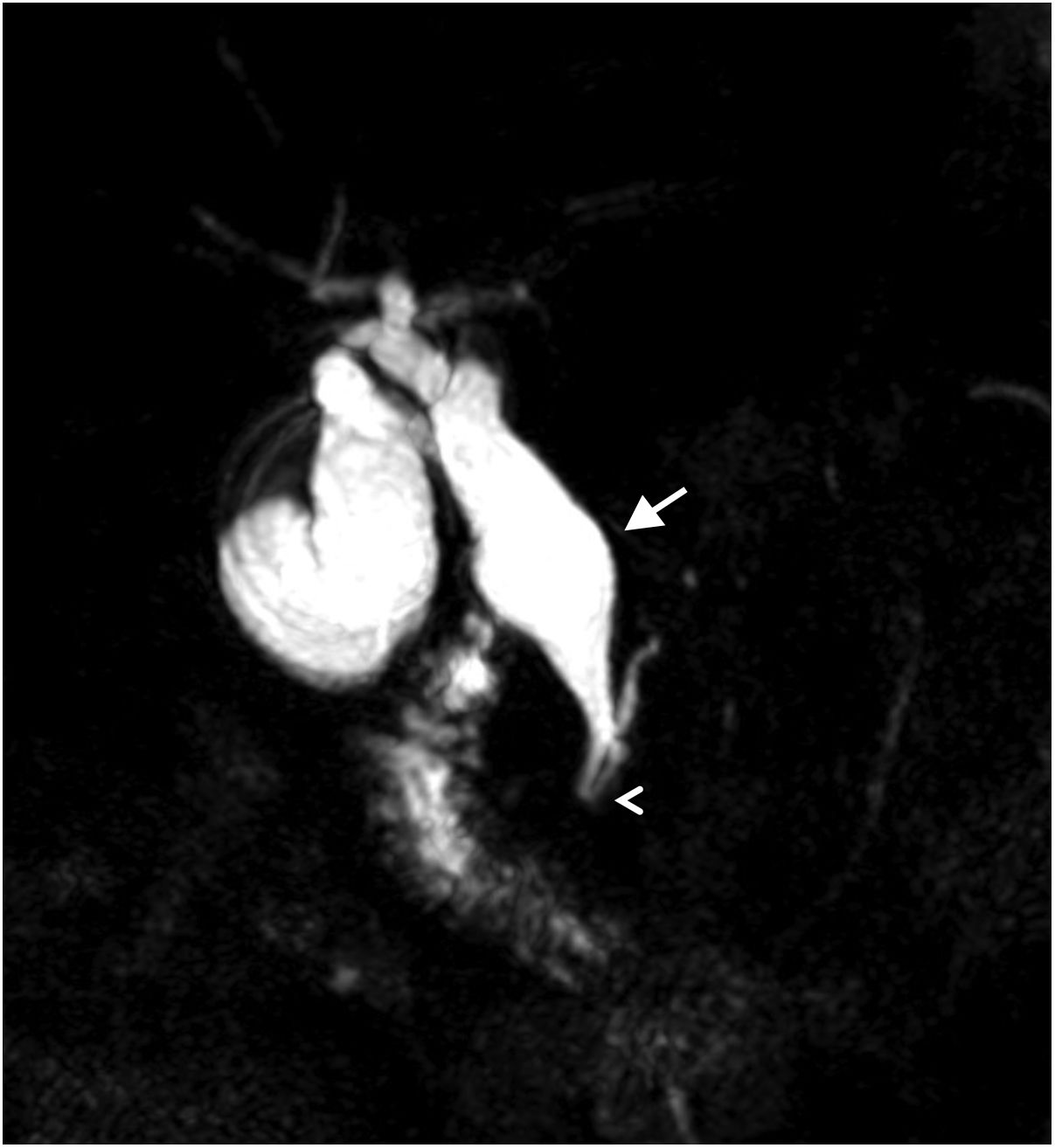
El quístico se caracteriza por la existencia de una lesión quística grande que comunica con la vía biliar intrahepática (fig. 6).
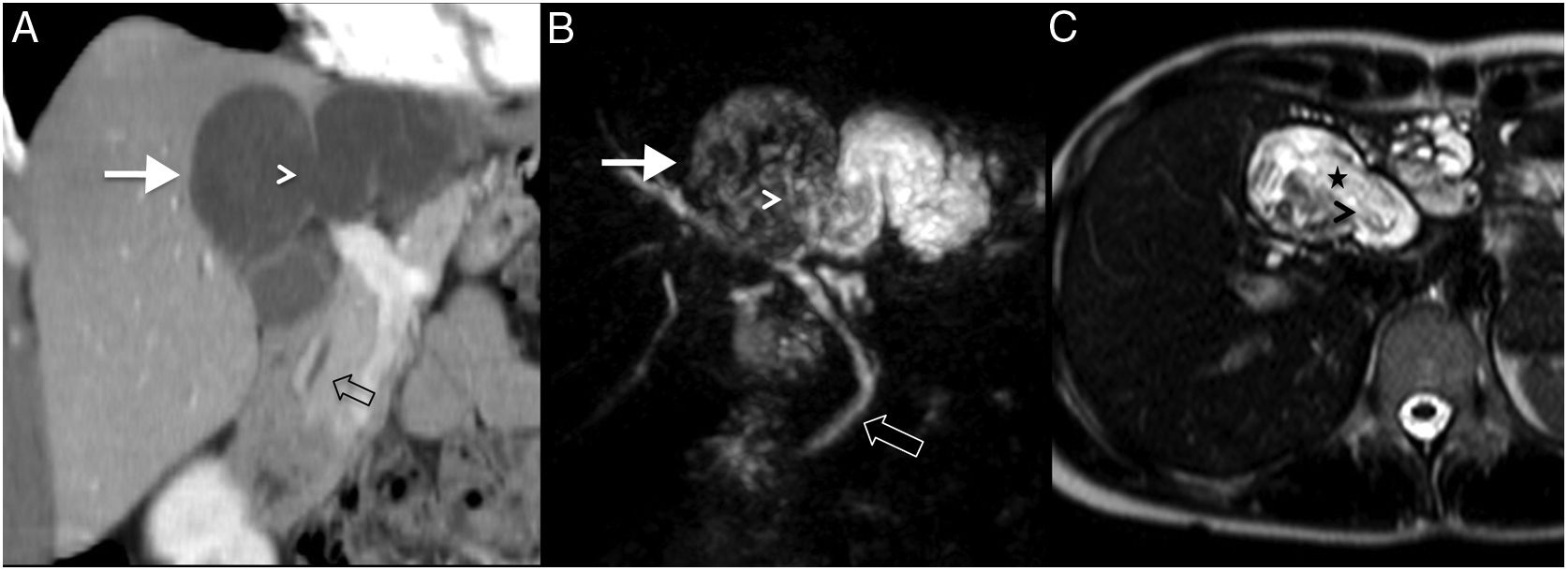
Figura 6.Mujer de 36 años con episodios de colangitis de repetición. A) Reconstrucción coronal en tomografía computarizada (TC) con contraste intravenoso. B) Reconstrucción MIP en colangiopancreatografía por resonancia magnética. C) TSE-T2 axial que muestra lesión quística en unión de segmentos II y IV (flechas) comunicada con vía biliar dilatada (cabeza de flechas). En las secuencias de resonancia magnética se observa un contenido heterogéneo intraquístico y “signo del hilo” (asterisco). Colédoco de calibre normal (flechas huecas). La lesión correspondió a un tumor papilar de la vía biliar productor de mucina de tipo quístico comunicada con la vía biliar.
(0.08MB). - 3.
El intermedio también se caracteriza por una lesión quística que comunica con la vía biliar intrahepática, pero con contenido tumoral sólido detectable que secreta mucina hacia los radicales biliares intrahepáticos y/o los extrahepáticos (fig. 7).
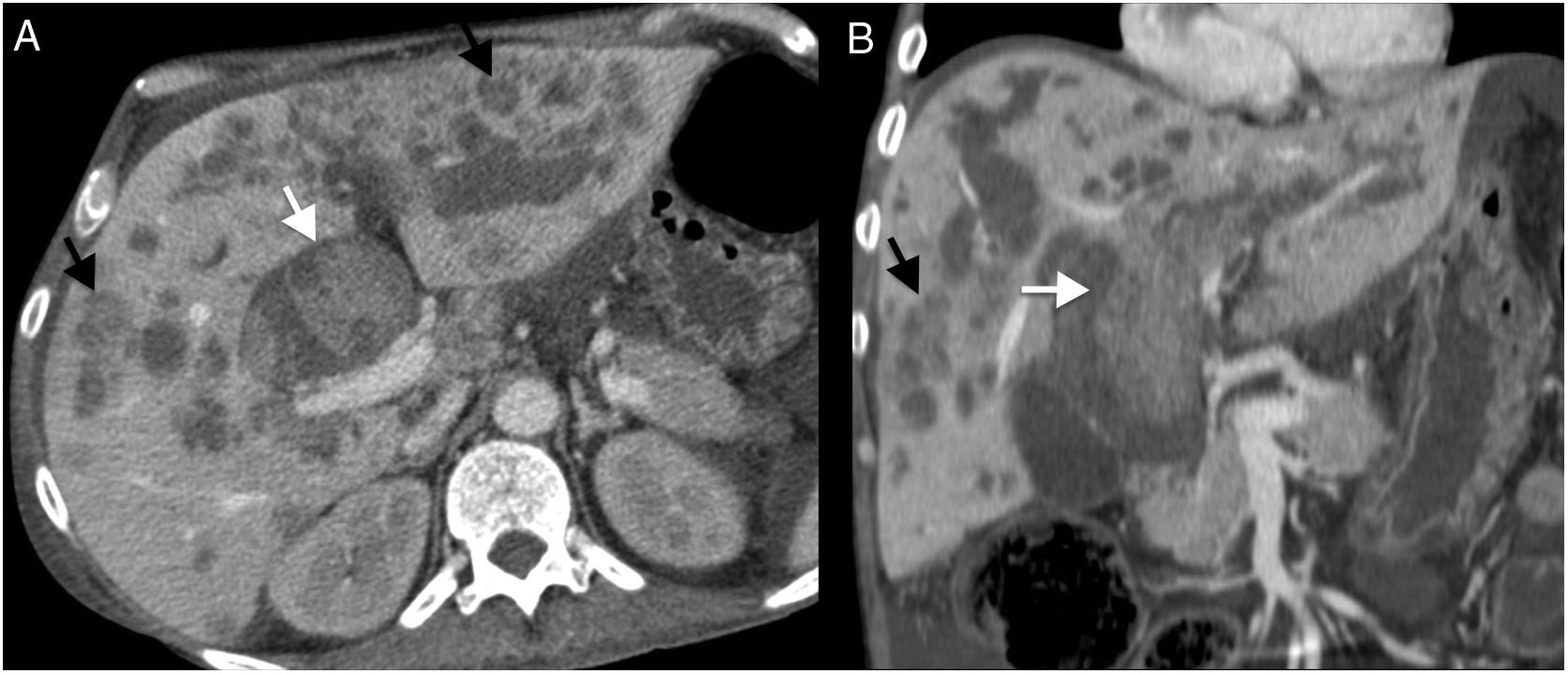
Figura 7.Varón de 50 años con ictericia obstructiva y cuadro constitucional. A) Tomografía computarizada (TC) axial con contraste intravenoso. B) Reconstrucción coronal que muestra dilatación generalizada de la vía biliar intrahepática en ambos lóbulos y del colédoco. En el interior de alguno de los radicales biliares se observa un contenido de mayor atenuación que la bilis (flechas negras), y en la luz del colédoco, con extensión hacia el hepático izquierdo, se observa una lesión sólida que realza menos que el parénquima (flechas blancas), con áreas quísticas intratumorales. El diagnóstico por punción de dicha lesión fue colangiocarcinoma de crecimiento intraductal.
(0.12MB).
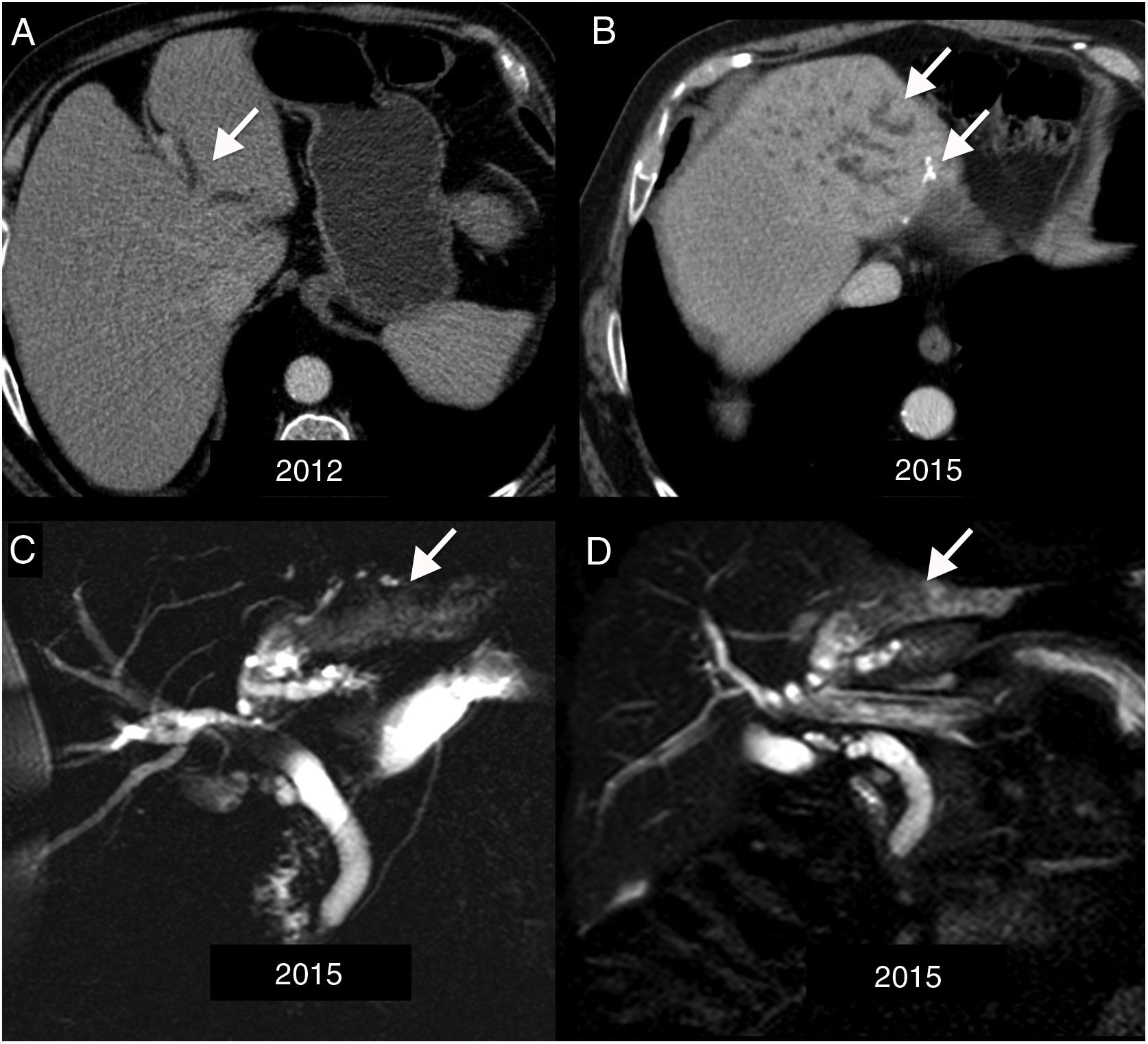
Varón de 70 años al que se realiza estudio por estadificación de carcinoma de colon. A) Tomografía computarizada (TC) en 2012 que muestra ligera dilatación de radicales biliares en segmento II (flecha). B) TC en 2015 que muestra mayor dilatación progresiva de la vía biliar intrahepática y pequeñas calcificaciones periféricas de nueva aparición (flechas). C) Colangiopancreatografía por resonancia magnética de corte grueso. D) TSE-T2-SPAIR coronal en 2015 que muestra dilatación de la vía biliar en segmentos II y III y del colédoco; en los segmentos más dilatados se observan estriaciones hipointensas curvilíneas (flechas) o “signo del hilo”. La hepatectomía izquierda mostró un contenido mucinoso de la vía biliar y tumor papilar de la vía biliar productor de mucina difuso en la VÍA BILIAR con adenocarcinoma mucinoso.
Clasificación de Sakamoto. A) Ductoectásico: los tumores papilares proliferan en el interior de la vía biliar, que está dilatada de manera difusa. B) Quístico: presencia de una lesión quística grande que comunica con la vía biliar intrahepática. C) Intermedio: existe una lesión quística que comunica con la vía biliar intrahepática asociado a contenido tumoral sólido detectable que secreta mucina hacia los radicales biliares intrahepáticos y a veces hacia los extrahepáticos.
Modificado de: Takanami et al12.
Se ha sugerido que los subtipos ductoectásico, quístico e intermedio de la NPIM-VB representan los homólogos biliares de las NPIM del conducto principal, de rama lateral y tipo mixto del páncreas, respectivamente5,6,11,12.
La NPIM-VB puede ocasionar la rotura de la vía biliar por hiperpresión y la aparición de un seudomixoma peritoneal o de fístulas con estructuras colindantes3,13.
Hallazgos por imagenLa detección de la NPI-VB mediante técnicas de imagen depende de su tamaño. Aunque la neoplasia no se identifique, la vía biliar a menudo se dilata y se obstruye, ya sea por la producción de mucina o por la fragmentación del epitelio tumoral. Como la localización tumoral es importante para la planificación quirúrgica, ante la sospecha de una NPI-VB que no se detecte a través de técnicas radiológicas se puede llevar a cabo una colangioscopia directa13. Este método y el estudio histopatológico representan los estándares de referencia, al permitir la visualización en vivo y la confirmación histológica de la neoplasia6,8,12–16.
El tumorPor ecografía se suele observar dilatación de la vía biliar y ocasionalmente masas intraluminales de ecogenicidad variable8,14 o engrosamiento nodular o irregular de la pared ductal6,12.
Debe recordarse que en los estudios dinámicos de tomografía computarizada (TC) y resonancia magnética (RM), cuando se detectan grandes masas intraductales, estas habitualmente muestran hiperrealce en la fase arterial tardía con lavado de contraste durante las fases portal o tardía4,7,8. La existencia de realce parenquimatoso peritumoral o de bordes protruyentes en los márgenes de la lesión son indicativos de invasión del parénquima hepático adyacente7,10, aunque a menudo se sobreestime el grado de invasión7.
Para estos casos puede resultar útil la RM dinámica con contraste hepatoespecífico porque los hepatocitos normales captan el contraste durante la fase hepatobiliar, pero las células tumorales no.
Debe recordarse que este detalle facilita la distinción entre cambios inflamatorios del parénquima hepático peritumoral y la auténtica invasión tumoral22. Existe una adecuada correlación entre estos hallazgos y un aumento de la captación de la fluorodesoxiglucosa (FDG) por PET/TC6,8,12,22.
La secuencia Fast Spin-Echo (FSE)-T2 de RM a veces resulta útil para identificar el patrón papilar del tumor, debido a la alta resolución de contraste que proporciona la hiperseñal de la bilis en esta secuencia3. Las secuencias de difusión y ADC (Apparent Diffusion Coefficient) mejoran la definición de la lesión y se relacionan con la capacidad invasiva del tumor3–6.
Debe recordarse que los radicales biliares con mayor dilatación suelen ser los que contienen las lesiones tumorales, aunque no sean visibles radiológicamente3,11,13.
La mucinaTanto la ecografía como la TC y la RM son técnicas limitadas para la detección de mucina porque comparte ecogenicidad, atenuación e intensidad de señal, respectivamente, con la bilis3,6,10,13.
Debe recordarse que hay que sospechar su presencia en la vía biliar cuando se identifica una discordancia entre el contenido biliar hiperintenso en colangiopancreatografía por resonancia magnética (CPRM) y en CPRE se observan defectos de repleción lineales, amorfos o alargados3,13. La CPRE permite, además, biopsiar y realizar maniobras terapéuticas, como descompresión mediante papilotomía o colocación de stents en casos inoperables4,6,14.
Recientemente se ha descrito un hallazgo con elevada especificidad para el diagnóstico de mucina intrabiliar en RM denominado “signo del hilo”10, que consiste en la presencia de estriaciones hipointensas curvilíneas en la vía biliar dilatada en secuencias FSE-T2 y CPRM (figs. 4 y 6). También el gadolinio hepatoespecífico permite definirla de forma muy fiable como defectos de repleción durante la fase de excreción hepatobiliar6,10,12,22, aunque tiene como inconveniente que la excreción biliar del contraste está disminuida en estos pacientes, debido al deterioro de la función hepática producido por la obstrucción de la vía biliar12,22.
Patología y pronósticoLa NPI-VB se considera una nueva neoplasia dentro de la cuarta edición de la clasificación de la OMS de 20101. Desde entonces, han surgido numerosas cuestiones que conciernen a la distinción patológica de la NPI-VB como una única entidad o un conjunto de neoplasias diferentes2.
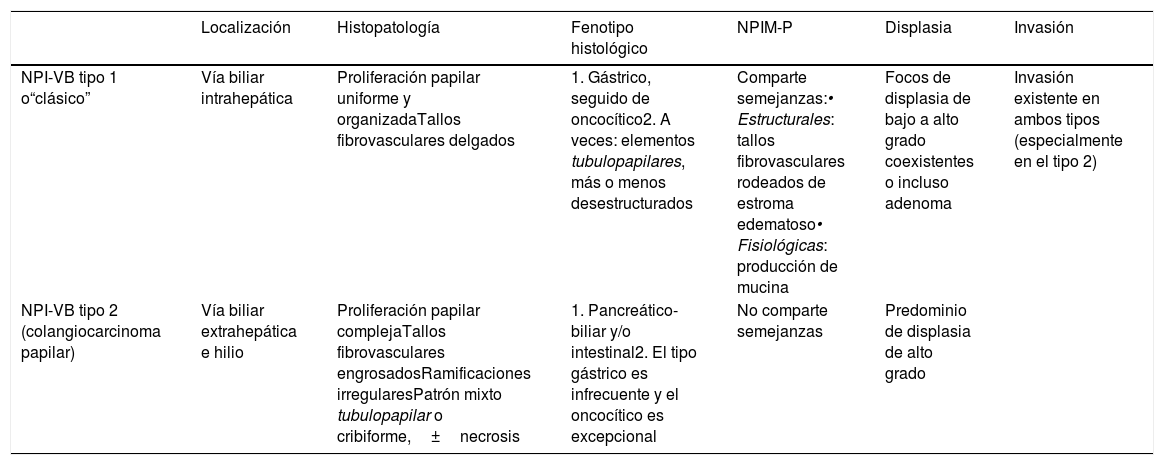
Recientemente se ha propuesto una nueva clasificación provisional (tabla 1) por parte de un grupo de patólogos expertos2, según la cual esta entidad quedaría dividida en dos grupos: NPI-VB tipo 1 (fig. 8) y NPI-VB tipo 2 (fig. 7).
Clasificación histopatológica provisional de las neoplasias intraductales papilares de la vía biliar (NPI-VB)2
| Localización | Histopatología | Fenotipo histológico | NPIM-P | Displasia | Invasión | |
|---|---|---|---|---|---|---|
| NPI-VB tipo 1 o“clásico” | Vía biliar intrahepática | Proliferación papilar uniforme y organizadaTallos fibrovasculares delgados | 1. Gástrico, seguido de oncocítico2. A veces: elementos tubulopapilares, más o menos desestructurados | Comparte semejanzas:• Estructurales: tallos fibrovasculares rodeados de estroma edematoso• Fisiológicas: producción de mucina | Focos de displasia de bajo a alto grado coexistentes o incluso adenoma | Invasión existente en ambos tipos (especialmente en el tipo 2) |
| NPI-VB tipo 2 (colangiocarcinoma papilar) | Vía biliar extrahepática e hilio | Proliferación papilar complejaTallos fibrovasculares engrosadosRamificaciones irregularesPatrón mixto tubulopapilar o cribiforme,±necrosis | 1. Pancreático-biliar y/o intestinal2. El tipo gástrico es infrecuente y el oncocítico es excepcional | No comparte semejanzas | Predominio de displasia de alto grado |
Varón de 60 años en estudio por dolor abdominal en hipocondrio derecho, ictericia y fiebre. A) Colangiopancreatografía por resonancia magnética de corte grueso. B) TSE-T2 axial que muestra dilatación focal de radicales biliares intrahepáticos en segmento VII y pequeños defectos de repleción hipointensos (flechas) en la pared de los conductos dilatados en ambas secuencias. La segmentectomía mostró neoplasia intraductal papilar en la vía biliar con colangiocarcinoma no infiltrante in situ.
Algunos patólogos insisten en que ambos grupos comparten el potencial invasivo y constituirían una única condición patológica preinvasiva. La única diferencia radicaría en su localización1,2.
Otros expertos sugieren que cada grupo es diferente: la NPI-VB de tipo 2 representaría con mayor probabilidad una variante papilar extrema del colangiocarcinoma convencional, ya que no es extraño que junto a su componente fibroso/nodular coexista un patrón papilar o tubulopapilar intraductal2. Por ello, se requieren más estudios para aclarar el valor de esta clasificación provisional2.
La diferencia entre la NPI-VB y la neoplasia intraepitelial biliar (NIBil) es que la primera muestra proyecciones papilares de más de 5mm, mientras que la segunda consiste en una lesión plana o micropapilar con un crecimiento de menos de 3mm2 que la hace indetectable mediante las modalidades de imagen convencionales4. La NIBil también está presente en los especímenes quirúrgicos de los pacientes diagnosticados de hepatolitiasis4.
La forma de extensión de la NPI-VB es superficial, a través de la mucosa3,4,6–8,11–14, lo cual le confiere mejor pronóstico global frente a los colangiocarcinomas de tipo convencional (formador de masa y de infiltración periductal)3–8,10–12,16.
El pronóstico posquirúrgico de la NPI-VB es peor con respecto a la NPIM-P3,24. Aunque las dos variantes de NPI-VB se asocian a componente invasivo, este es más frecuente en el tipo 2 o “colangiocarcinoma papilar”2, lo que explica que tenga peor pronóstico10.
Diagnóstico diferencialEntre las principales entidades que pueden simular una NPI-VB se encuentran las siguientes:
Colangiocarcinoma de infiltración periductalA diferencia de la NPI-VB, este se extiende por vía submucosa. Esto supone un engrosamiento de la pared de la vía biliar con hiperrealce con respecto al parénquima hepático, visible por estudios dinámicos. Condiciona con frecuencia estenosis y dilatación de la vía biliar proximal. Otra diferencia con la NPI-VB radica en la localización: mientras que esta puede afectar tanto a la vía biliar intra- como extrahepática, el colangiocarcinoma infiltrante suele darse en la confluencia del conducto hepático común4.
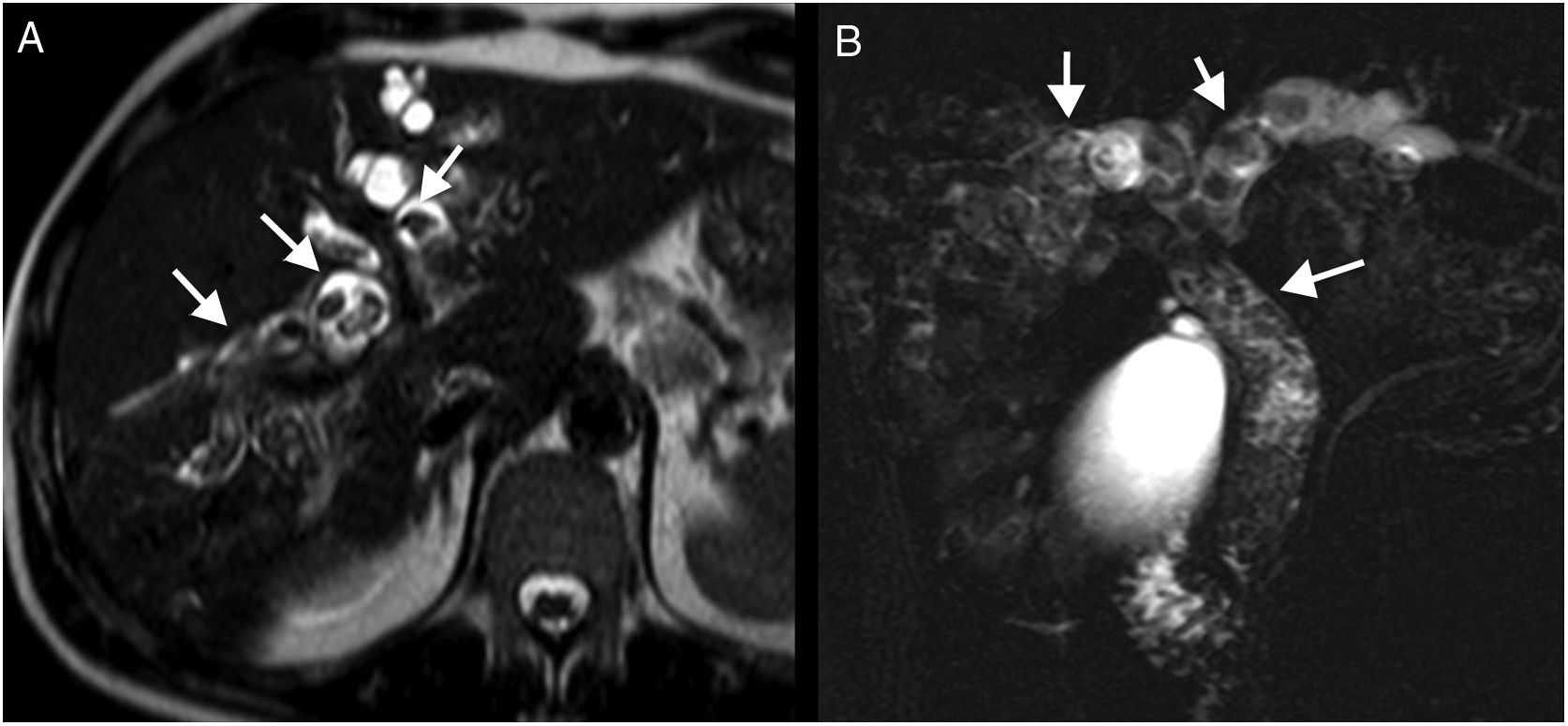
HepatolitiasisEn CPRM y TSE-T2 se muestran como defectos de repleción únicos o múltiples en la vía biliar intra- y/o extrahepática, que pueden confundirse con neoplasias intraductales multifocales (fig. 9).
Varón de 44 años diagnosticado de enfermedad de Caroli y con cuadros colangíticos de repetición. A) TSE-T2 axial. B) colangiopancreatografía por resonancia magnética de corte grueso que muestra dilataciones saculares de algunos radicales intrahepáticos, y dilatación del colédoco, que albergan innumerables defectos de repleción hipointensos, facetados, que corresponden a hepatolitiasis. El hallazgo se confirmó en el hígado explantado tras trasplante hepático.
Debe recordarse que para diferenciar ambas entidades es recomendable realizar estudios dinámicos de TC y/o RM, valorando la presencia o ausencia de realce. No restringen la difusión.
Neoplasia quística mucinosaNueva entidad contemplada dentro de la cuarta edición de la clasificación de la OMS que incluye tanto al cistoadenoma como al cistoadenocarcinoma.
Debe recordarse que el diagnóstico diferencial de la neoplasia quística mucinosa (NQM) se establece con el subtipo quístico de la NPIM-VB13,22. A diferencia de la NQM, la NPIM comunica con la vía biliar y carece de estroma ovárico en la pared del quiste1,5,6,8–13 (fig. 10). La NQM no asocia dilatación de vía biliar extrahepática3,10,13,14.
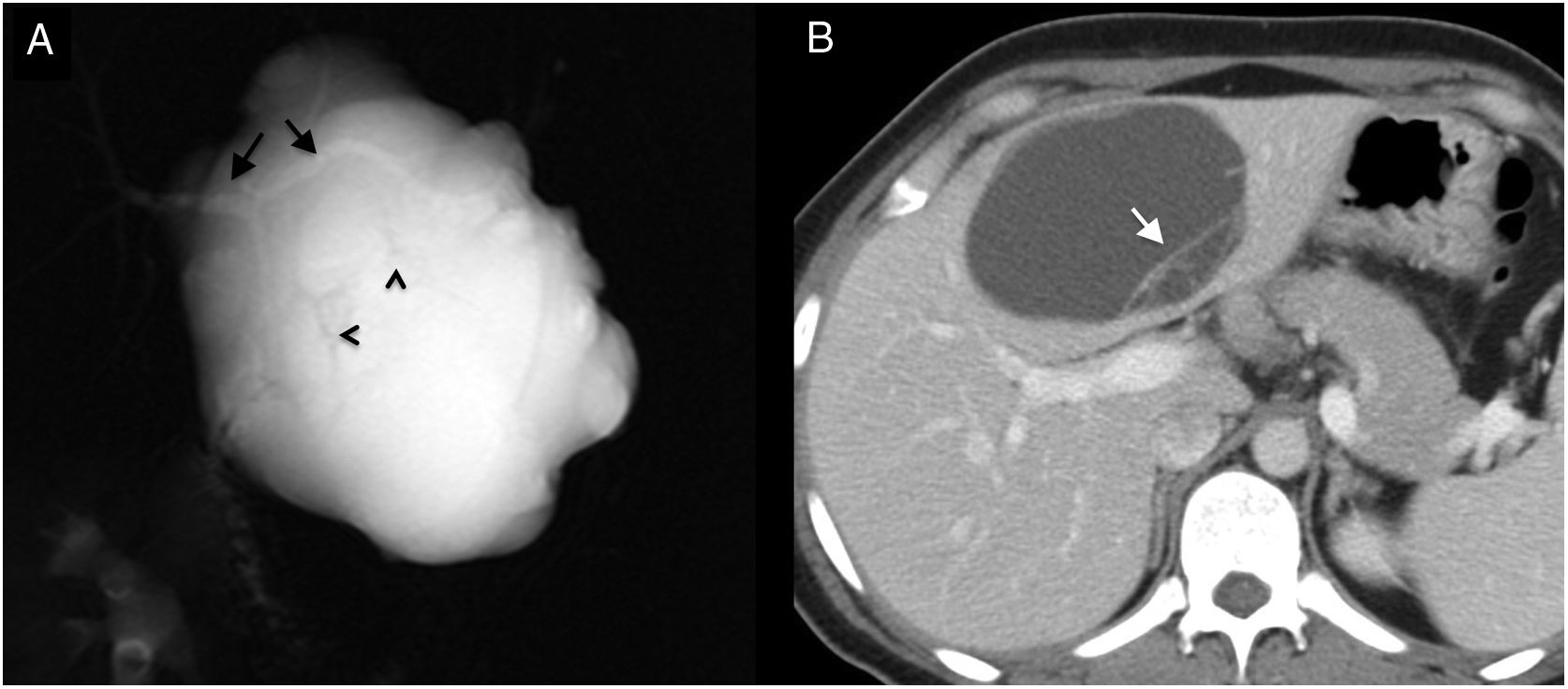
Mujer de 28 años estudiada por dolor epigástrico de días de evolución que no mejora. En ecografía se identificó lesión quística compleja (no mostrada). A) Colangiopancreatografía por resonancia magnética de corte grueso que muestra lesión quística de contornos polilobulados y con septos finos internos (cabezas de flecha) superpuesta a la confluencia de ambos conductos hepáticos (flechas) y al hepatocolédoco proximal, que muestran calibre normal, no comunicados con la lesión. B) Tomografía computarizada con contraste intravenoso en la que se observa una lesión quística en segmento IV con septos internos en su porción posterior (flecha blanca). Tras hepatectomía izquierda, la histología mostró neoplasia quística mucinosa.
Son anomalías congénitas infrecuentes de la vía biliar que constituyen un factor de riesgo para la aparición de colangiocarcinoma4,17 y NPI-VB3,16. La presencia de un colangiocarcinoma del tipo “formador de masa” asociado a quiste coledociano debe diferenciarse de cualquiera de las formas de NPIM-VB4,12 (fig. 11).
Quiste hepático ciliadoEntidad extremadamente rara y con capacidad de degeneración hacia carcinoma escamoso, que se manifiesta como una formación quística unilocular, típicamente localizada en el segmento IVa hepático, de aspecto complejo por técnicas de imagen, sin realce en los estudios dinámicos por TC o RM. El diagnóstico diferencial se realiza principalmente con la NQM, el quiste hidatídico y el quiste hepático simple25–29.
OtrosOtras posibilidades diagnósticas son la metástasis intraductal o el hepatocarcinoma invasivo. En ambos casos suele existir una masa parenquimatosa: en el caso del hepatocarcinoma, con características propias en el estudio dinámico y con hallazgos indicativos de cirrosis, mientras que en el caso de la metástasis suele haber un antecedente de cáncer, más habitualmente colorrectal3,4.
ConclusiónLa NPI-VB constituye una entidad de diagnóstico reciente que puede compartir etiopatogenia con otra neoplasia bien conocida, la NPIM-P. No obstante, no existen unos criterios de diagnóstico patológico estandarizados hasta la fecha; incluso se especula acerca de su correspondencia con un solo tumor o un grupo de diferentes tipos. Es importante que el radiólogo esté familiarizado con sus posibles formas de manifestación mediante las diferentes técnicas de imagen porque el diagnóstico precoz implica una mejoría en el pronóstico.
Autoría- 1.
Responsable de la integridad del estudio: BVS, MJP, DRV.
- 2.
Concepción del estudio: BVS, DRV, MJP.
- 3.
Diseño del estudio: BVS, DRV, MJP.
- 4.
Obtención de los datos: BVS, DRV, MJP.
- 5.
Análisis e interpretación de los datos: BVS, DRV, MJP.
- 6.
Tratamiento estadístico: No aplicable.
- 7.
Búsqueda bibliográfica: BVS, DRV, MJP.
- 8.
Redacción del trabajo: DRV, BVS, MJP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MJP, BVS, DRV.
- 10.
Aprobación de la versión final: MJP, BVS, DRV.
Los autores declaran no tener ningún conflicto de intereses.
Los autores del artículo agradecemos la aportación del Dr. Rafael Rodríguez Romero en la edición gráfica de las figs. 1 y 5.