La neuropatía del nervio peroneo es la mononeuropatía más común de los miembros inferiores. Entre las causas se incluyen el traumatismo, los tumores del nervio y de la vaina, el atrapamiento, y otras como el perineuroma, la fibromatosis, el linfoma y el ganglión intraneural y extraneural. El diagnóstico se basa en las manifestaciones clínicas y los estudios electrofisiológicos. Actualmente, sin embargo, el complemento diagnóstico con neurografía por resonancia magnética (RM) permite aproximarse al lugar y la causa de esta neuropatía. El objetivo de este trabajo es describir con la RM la anatomía del nervio peroneo, sus relaciones y los músculos que inerva; mencionar las manifestaciones clínicas y electrofisiológicas de sus lesiones; describir los parámetros técnicos que se emplean en nuestra institución; y mostrar la apariencia en RM de las diversas enfermedades que afectan al nervio peroneo.
Peroneal neuropathy is the most common mononeuropathy of the lower limbs. The causes of peroneal neuropathy include trauma, tumors of the nerve and nerve sheath, entrapment, and others like perineurioma, fibromatosis, lymphoma, and intraneural and externeural ganglia. The diagnosis is based on clinical manifestations and electrophysiological studies. Nowadays, however, magnetic resonance (MR) neurography is a complementary diagnostic technique that can help determine the location and cause of peroneal neuropathy. In this article, we describe the MR anatomy of the peroneal nerve, its relations, and the muscles it innervates. We also discuss the clinical and electrophysiological manifestations of peroneal neuropathy, describe the technical parameters used at our institution, and illustrate the MR appearance of various diseases that involve the peroneal nerve.
La neuropatía del nervio peroneo (NP) es la mononeuropatía más frecuente de los miembros inferiores1. El NP puede ser asiento de polineuropatías o mononeuropatías. En el primer grupo destacan las enfermedades sistémicas inflamatorias y metabólicas como la diabetes, la enfermedad de Charcot-Marie-Tooth, la polineuropatía desmielinizante inflamatoria crónica, o la amiloidosis2–4. En el grupo de las mononeuropatías se incluyen las traumáticas, los tumores del nervio y de la vaina, el atrapamiento y otras como el perineuroma, el linfoma, la endometriosis, la radioterapia y el ganglión intraneural5–11. Históricamente, el estudio de las neuropatías se ha basado en la evaluación clínica y los estudios electrofisiológicos. Pero en los últimos años se han desarrollado secuencias de resonancia magnética (RM) que permiten evaluar los nervios periféricos. La valoración es más precisa si se emplean equipos de resonancia de 3T. Además, con las secuencias Dixon se ha podido realizar neurografía por RM, obtener secuencias 3D y ver plexos y nervios periféricos, identificar la apariencia fascicular de los nervios, su recorrido y la relación con las estructuras adyacentes, lo que mejora la capacidad diagnóstica de las neuropatías con RM, la localización y causa de las alteraciones12–16. El objetivo de esta revisión es hacer un breve repaso de las manifestaciones clínicas y los métodos electrofisiológicos para diagnosticar la neuropatía del NP, discutir las causas de neuropatía del NP, y mostrar la apariencia tanto normal como patológica del nervio, a través de las nuevas secuencias de RM disponibles.
Anatomía: origen, curso, relaciones y músculos inervados por el nervio peroneoEl nervio peroneo común (NPC) y el nervio tibial (NT) forman un tronco común en el muslo, aunque son componentes independientes del nervio ciático. A este nivel, el NPC inerva la cabeza corta del músculo bíceps femoral17. En general, en el sector proximal de la fosa poplítea, aunque puede ser antes, los 2 componentes se separan en un fascículo medial, el NT, y otro lateral (NPC)18. Dos fascículos emergen de este último, el nervio cutáneo lateral de la pantorrilla, y el nervio peroneo anastomótico, el cual al unirse con su homólogo medial, originado a su vez del NT, forman el nervio sural19.
El NPC se encuentra alojado en un plano graso que separa al músculo gastrocnemio lateral del bíceps femoral. A este nivel puede verse una banda fibroadiposa fina separando sus divisiones profunda (anterior) y superficial (posterior)18,20 (fig. 1). A lo largo del sector lateral de la fosa poplítea, el nervio desciende hasta alcanzar el borde posterior de la cabeza del peroné, se incurva para rodear la cortical externa, y se introduce en el conducto peroneo, un túnel fibro-óseo-muscular delimitado por el cuello del peroné y el músculo peroneo largo21. Antes de entrar en el conducto peroneo, el NPC está cubierto únicamente por piel y tejido subcutáneo, lo que lo hace vulnerable a los traumatismos y a las lesiones por compresión22. Caudalmente al cuello del peroné el nervio se trifurca originando el fascículo recurrente articular (FRA) y los nervio peroneo superficial (NPS) y peroneo profundo (NPP) en mas del 80% de la población, en un espacio que abarca los 3 cm distales de la articulación de rodilla, en su cara externa.23,24.
Recorrido, divisiones y relaciones anatómicas del nervio peroneo común (NPC). A) Vista posterior de la pierna izquierda. Origen del NPC a partir del tronco común con el nervio ciático (NC). Subdivisiones primarias del NPC en la cara posterior nervio cutáneo lateral (NCL) y peroneo anastomótico (NPA) en su unión con el nervio cutáneo medial (NCM), para formar el nervio sural (NS). B) Vista lateral mostrando las divisiones motoras principales del nervio peroneo en su componentes superficial (NPS) y profundo (NPP) por detrás de la cabeza del peroné. C) Vista lateral mostrando la trifurcación del nervio peroneo más frecuente en la población general, con el fascículo recurrente articular (FRA), hacia la cápsula articular. MBF: músculo bíceps femoral; MST: músculo semitendinoso.
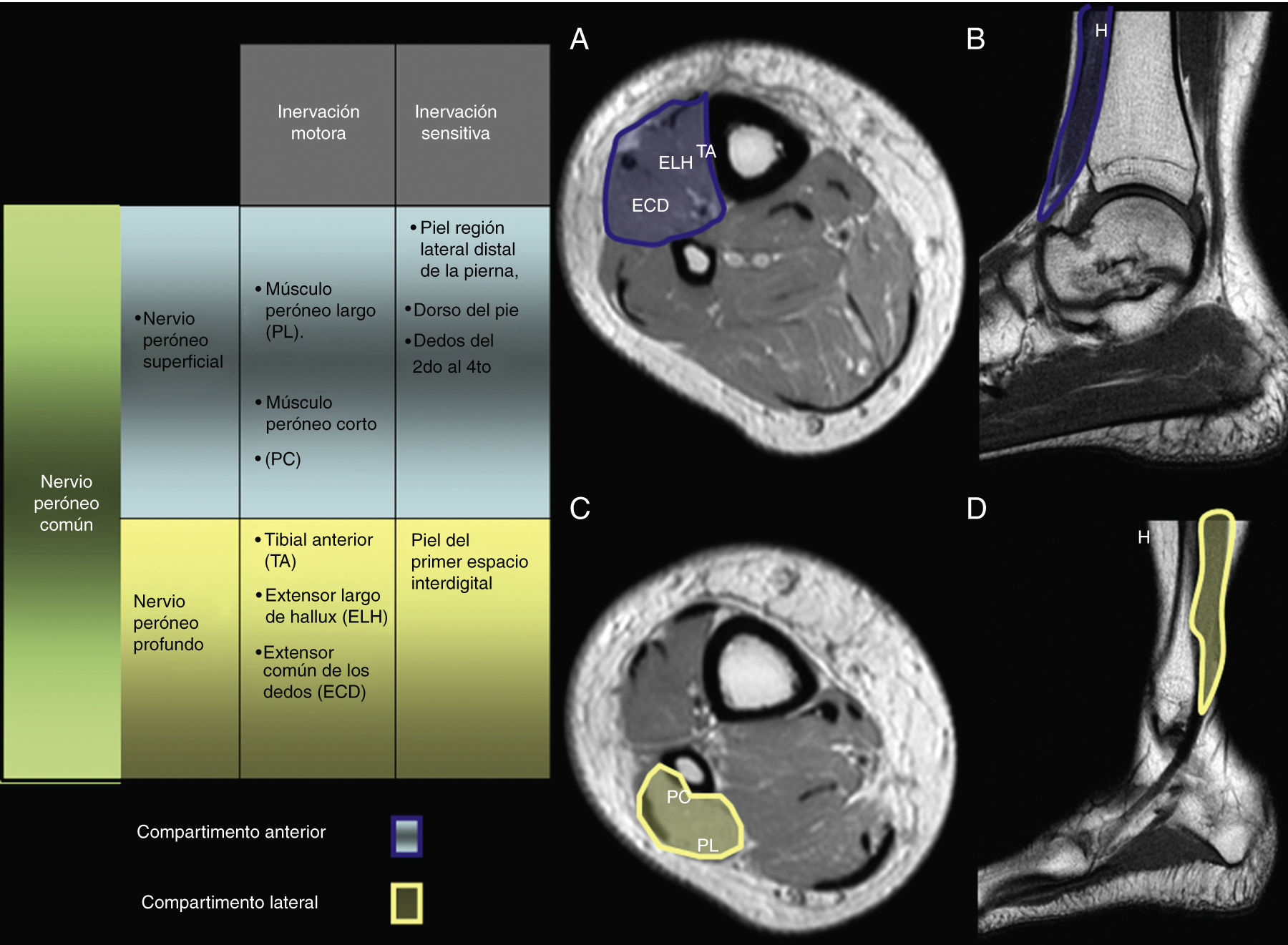
El NPP desciende por el compartimento anterior de la pierna, cerca del periostio del peroné, y, junto con la arteria tibial, atraviesa el septo intermuscular entre los tendones del extensor común de los dedos y el extensor largo del hallux. Al nivel de la articulación tibioperoneoastragalina atraviesa el túnel anterior del tarso y pasa por debajo del retináculo extensor21.
El NPP es un nervio predominantemente motor que inerva el compartimento muscular anterior incluyendo el tibial anterior, el extensor largo del hallux, el extensor común de los dedos y el músculo peroneo anterior25.
Nervio peroneo superficialEl NPS desciende como la rama más posterior tras la trifurcación del NP, atraviesa la fascia crural en el sector lateral de la pierna y se hace superficial. Las ramas distales del nervio, también superficiales, pueden encontrarse aproximadamente 6cm por arriba del maléolo peroneo21.
El NPS es responsable de la inervación motora de los músculos peroneo largo y corto, y de la sensitiva al dorso del pie22 (fig. 2).
Manifestaciones clínicasLas lesiones del NPC se manifiestan con parálisis de la dorsiflexión del pie y de los dedos, y disminución o ausencia de sensibilidad en la cara externa de la pierna y en el dorso del pie.
En la mayoría de los casos la lesión se localiza al nivel del cuello del peroné, comprometiendo las ramas superficial y profunda. Si se localiza en el hueco poplíteo, a los síntomas anteriores se suma hipoestesia en la cara externa de la rodilla, por compromiso de la rama cutánea lateral de la rodilla, que se origina del tronco principal del NPC antes de su bifurcación. Ocasionalmente, la lesión puede comprometer selectivamente la rama profunda, causando parálisis de la dorsiflexión del pie y de los dedos, y un área de hipoestesia en el dorso del pie en forma de cuña, entre el primer y segundo dedo. En casos raros involucra a la rama superficial, lo que resulta en una parálisis de la eversión del pie e hipoestesia de la cara externa de la pierna y del dorso del pie.
En el examen neurológico de un paciente con esos síntomas debe ponerse especial atención a signos indicativos de una lesión proximal al NPC, es decir, en el nervio ciático mayor, en el plexo lumbosacro o en la raíz L5. La paresia de la inversión del pie no suele ser conspicua en lesiones del NPC y sugiere una lesión del ciático mayor, del plexo o de L5. La hipoestesia del borde externo y de la planta del pie excede el territorio del NPC y es sugestiva de lesión del nervio ciático mayor o del plexo lumbosacro. Finalmente, el déficit en la extensión, abducción o rotación de la cadera indican que la lesión afecta al nervio ciático mayor o a los componentes inferiores del plexo lumbosacro26,27.
Exploración electrofisiológicaEl estudio de la conducción nerviosa y la electromiografía suman al examen clínico información topográfica, evolutiva, fisiopatológica y pronóstica.
Las lesiones del NPC que se localizan en el cuello del peroné se correlacionan con una o más de las siguientes alteraciones de la conducción nerviosa: bloqueo de la conducción motora al nivel del cuello del peroné, disminución de la amplitud de los potenciales de acción muscular compuestos en el territorio del NPC y reducción de amplitud de los potenciales sensitivos del NPS. En la electromiografía con electrodo concéntrico durante el reposo se observan alteraciones en los músculos tibial anterior, extensor largo del hallux, peroneo largo y peroneo corto. Cuando la lesión está al nivel del hueco poplíteo, pueden detectarse alteraciones electromiográficas en la porción corta del músculo bíceps femoral. Finalmente, cuando compromete selectivamente las ramas terminales del NPC, las alteraciones se limitan al tibial anterior y extensor del hallux cuando se lesiona el NPP, y a los peroneos lateral largo y corto con lesiones del NPS.
Según la etapa evolutiva y las características fisiopatológicas de la lesión, el electromiograma muestra signos de denervación (fibrilaciones y ondas agudas positivas) y reducción del reclutamiento de unidades motoras en la fase aguda con daño axonal; y potenciales de unidad motora de amplitud y duración aumentadas, exceso de polifásicos y reclutamiento reducido de unidades motoras en la fase crónica con reinervación. En el examen de la conducción se puede observar bloqueo y disminución de la velocidad de conducción sin denervación cuando se trata de una lesión desmielinizante.
El estudio electrofisiológico aporta información pronóstica. Las lesiones desmielinizantes se asocian, en general, con una recuperación rápida y completa. Por el contrario, las lesiones axonales condicionan una recuperación lenta y con posibilidad de déficit residual28,29.
Parámetros técnicos de la neurografía de alta definiciónEn nuestra institución disponemos de un equipo 3T (Signa HDxt 3T, 8ch, GE Healthcare, Milwaukee, Wis, EE. UU.) con bobina de superficie de 8 canales (Torso PA SIGNA – GE Healthcare, Milwaukee, Wis, EE. UU.), o bobina de rodilla de 8 canales. Dentro del protocolo hacemos reconstrucciones multiplanares (MPR) finas basadas en secuencias ponderadas en T1 y T2-fast spin-echo (FSE) con técnica IDEAL (iterative decomposition of water and fat with echo asymmetry and least-squares estimation), T2 CUBE y, eventualmente, 3D FSPGR T1 con medio de contraste de gadolinio, secuencia de difusión (DWI) o tensor de difusión (DTI) (tabla 1).
Parámetros de adquisición de las secuencias IDEAL y CUBE para la evaluación del nervio peroneo al nivel de la rodilla
| Parámetro | IDEAL T1 coronal | IDEAL T2 sagital | 3D CUBE T2 coronal |
| TR (mseg) | 560 | 4.200 | 2.160 |
| TE (mseg) | 8,9 | 92 | 226,7 |
| Matriz | 320×256 | 320×256 | 288×288 |
| FOV (cm) | 26×15,6 | 26×26 | 30×18 |
| Espesor de corte (mm) | 1,2-1,6 | 1,2-1,5 | 1 |
| Espacio entre cortes (mm) | 0,4 | 0 | 0 |
| Ancho de banda (kHz) | 62,5 | 62,5 | 83,3 |
| N.o de excitaciones | 3 | 3 | 1 |
| Tiempo de adquisición (min) | 8 | 8 | 6 |
CUBE: secuencia fast spin-echo (FSE) con flip angle variable; IDEAL: iterative decomposition of water and fat with echo asymmetry and least-squares estimation.
IDEAL, en equipos General Electric (DIXON para equipos Siemens y Phillips), es una secuencia que deriva de los principios descritos por Dixon12 y permite descomponer la señal de los protones de la grasa y el líquido de acuerdo a la diferencia de sus frecuencias de resonancia (o chemical shift), aislándolos para obtener imágenes diferentes. A partir de estas 2 imágenes básicas, con señal pura de grasa o señal pura de agua, se pueden obtener otras 2 imágenes derivadas: en fase (in-phase), con la suma de las señales del agua a la de la grasa; y fuera de fase (out-phase), en la que se resta la señal de la grasa a la del líquido13,14 (tabla 1).
La técnica CUBE, en equipos General Electric (SPACE para equipos Siemens y VISTA para equipos Phillips), es una secuencia FSE con ángulo variable, tridimensional, con cortes finos y resolución isotrópica, lo que reduce los artefactos por volumen parcial. La posibilidad de reformatear la secuencia en MPR elimina la necesidad de repetirla y disminuye considerablemente el tiempo de examen30,31.
Cuando se inyecta medio de contraste paramagnético utilizamos la secuencia FSPGR T1 volumétrica, que permite obtener un buen contraste de señal T1, con cortes finos y MPR, en muy poco tiempo. La secuencia se realiza con una máscara sin contraste y después de inyectar 10ml de gadolinio intravenoso con una bomba inyectora, a 2ml/seg.
En casos seleccionados se utilizan secuencias DWI y DTI para investigar efectos restrictivos en la difusión de moléculas de hidrógeno a lo largo del NP, la fracción de anisotropía de forma segmentaria y, mediante posprocesamientos adicionales (FiberTrak-GE Healthcare, Milwaukee, Wis, EE. UU.), realizar tractografías para evaluar cualitativa y cuantitativamente los haces de fibras32. Las secuencias neurográficas ponen en evidencia la afectación neuronal de forma tanto más manifiesta cuanto más grave es la lesión. Lo opuesto ocurre con la DTI, que parece ser más sensible para valorar la afectación neuronal, lo que puede convertirla en un indicador de información no solo diagnóstica, sino también pronóstica. Permite delimitar las fibras nerviosas con mayor precisión que las secuencias de neurografía lo que puede predecir la recuperación o no de las fibras lesionadas por isquemia, traumatismo o inflamación33. La secuencia DWI con valores b 0 y 200, tiene como finalidad en el sistema nervioso periférico determinar la anatomía y el calibre del nervio. En nuestra institución se añade la DTI especialmente cuando las secuencias neurográficas no demuestran alteraciones de la señal.
Si bien recomendamos las secuencias neurográficas en equipo 3T ante la sospecha clínica de lesión del NP, es posible detectar gran parte de las lesiones con secuencias convencionales de RM como las que se realizan en una exploración de rodilla34. Sin embargo, es importante reconocer que la definición de las imágenes es baja y será necesario complementarlas con secuencias neurográficas para llegar al diagnóstico de certeza.
Apariencia de la mononeuropatía del nervio peroneo en neurografía por resonancia magnéticaNeuropatía por traumatismoEl traumatismo ha sido clasificado tradicionalmente siguiendo los criterios de Seddon35, que dividió los grados de lesión neuronal en neuropraxia, axonotmesis y neurotmesis, en función de la gravedad.
Los cambios anatomopatológicos en la neuropraxia, el grado más leve de lesión, afectan solamente a la vaina de mielina que rodea al axón y provocan una pérdida funcional transitoria con un pronóstico excelente con restitución ad integrum. En la RM se observa un ensanchamiento leve del nervio con hiperintensidad en las secuencias ponderadas en T2-FSE. Suele tratarse de lesiones por atrapamiento leve, estiramiento leve o compresiones por procesos ocupantes de espacio (fig. 3).
En la axonotmesis, el axón sufre una rotura completa y, como resultado, una degeneración walleriana del segmento distal. Sin embargo, las estructuras de soporte, es decir el perineuro y endoneuro, permanecen indemnes36,37. El pronóstico es bueno aunque el tiempo de recuperación es lento, considerando que la regeneración neuronal es de 1mm/día32. En la RM, además de los hallazgos observados en la neuropraxia, se pierde el patrón fascicular. Estos hallazgos pueden observarse en casos de atrapamiento moderado o grave de larga evolución (fig. 4).
Axonotmesis del nervio ciático. Paciente con antecedente de posición de litotomía durante una intervención quirúrgica. A) Secuencia convencional FSE potenciada en T1 que muestra un engrosamiento difuso del nervio ciático (flecha corta), tanto de la porción peronea como tibial. Se observa también edema en el músculo cuadrado femoral (flecha larga). B) Reconstrucción multiplanar de una secuencia 3D IDEAL en el plano coronal, que muestra la señal hiperintensa y engrosamiento del nervio (flecha larga) con cambios inflamatorios en los tejidos blandos adyacentes (flecha corta). C) Misma secuencia que en B, con signos de degeneración walleriana distal a la lesión (flechas).
La neurotmesis es la forma más grave de lesión neuronal, que cursa con pérdida funcional completa, a menos que se repare quirúrgicamente con rapidez. En el periodo agudo se observa la falta de continuidad entre los extremos del nervio. Esa brecha es ocupada por líquido y tejido de granulación, que evoluciona a fibrosis formando un neuroma. En RM, en el periodo agudo se observa un espacio entre los extremos del nervio y, en el periodo crónico, ese espacio es ocupado por un tejido fibroso hipointenso en secuencias ponderadas en T2-FSE38 (fig. 5).
Neurotmesis del nervio peroneo (NP). Traumatismo de la rodilla con rotura del ligamento cruzado anterior. A) Secuencia convencional FSE potenciada en T2 en el plano axial. Se observa un aumento del diámetro del NP con señal hiperintensa, distorsión de sus fibras y engrosamiento del perineuro (circulo). B y C) Secuencia 3D IDEAL potenciada en T1 con saturación de agua, en los planos sagital (B) y coronal (C). Engrosamiento nodular del nervio por un neuroma (flecha).
Aunque el atrapamiento del NP puede ocurrir en cualquier lugar de su curso, el sitio habitual es el túnel peroneo, por la posición fija que adopta entre el hueso peroneo y la fascia. Estas lesiones pueden resultar de la presión que el cuello del peroné puede ejercer sobre el nervio durante el sueño, así como en la anorexia y la cirugía bariátrica (por la rápida pérdida de peso). Además, el atrapamiento puede estar provocado por lesiones extrínsecas ocupantes de espacio, incluyendo el ganglión intraneural, grandes quistes de Baker, tumores de partes blandas, osteocondromas y otros tumores óseos, fracturas no consolidadas, lesiones del ángulo posterolateral de la rodilla o cicatrices posquirúrgicas17,39,40.
El NP es el sitio más común del ganglión intraneural. Spinner et al. publicaron 24 casos detectados con RM que mostraban la conexión entre el quiste y la articulación tibioperonea proximal. Entre sus pacientes, uno fue evaluado con RM 3T que demostró la propia rama articular del NPC. Con la intervención quirúrgica se comprobó en todos los casos la comunicación entre el quiste y la rama articular41.
Los quistes intraneurales suelen ser tubulares, siguiendo el recorrido del nervio, a diferencia de los extraneurales, que tienen el aspecto de una masa. Se han descrito varios signos para poder diferenciarlos: el «signo de la cola» fue descrito para demostrar la conexión articular, aunque no diferencia entre quistes intra y extraneurales; el signo de la «rama transversa» (material quístico dentro de la rama articular del nervio peroneo (NP) que atraviesa la superficie anterior del peroné) ha sido descrito en los casos de quistes intraneurales y nunca en los extraneurales; el «signo del anillo de sello» (desplazamiento extrínseco de los fascículos por el quiste dentro del epineuro), se ha encontrado en los quistes intraneurales con una especificidad del 86%42 (fig. 6).
Quiste perineural. Paciente de 42 años con dolor en la región posteroexterna de la rodilla y parestesias en la región anteroexterna de la pantorrilla. Imagen axial potenciada en T2 que muestra una lesión quística en el aspecto posterior de la articulación tibioperonea proximal (flecha larga) El nervio peroneo muestra una lesión quística rodeando a las fibras a la altura del peroné (flecha corta). La intervención quirúrgica evidenció un quiste perineural.
La RM es útil para planificar la intervención quirúrgica de los pacientes que presentan un ganglión intraneural del NP, porque el éxito de la intervención dependerá de que se cierre la comunicación entre el quiste y la articulación tibioperonea10.
Neuropatía por tumoresEl NP puede estar afectado por tumores que comprometen a la rama peronea del nervio ciático o, directamente al NP desde su división en la región del hueco poplíteo y en alguno de sus 3 ramos terminales. El tumor más frecuente es el de la vaina neural periférica. Puede presentarse aisladamente solitario (schwannoma o neurilemoma o neurinoma) o asociado a neurofibromatosis (NF), incluyendo NF1, NF2 y la schwannomatosis. Las neurofibromatosis son síndromes hereditarios con predisposición a generar neoplasias de la vaina neural, causados por mutaciones en los genes supresores de tumores NF1, NF2 y SMARCB1, respectivamente. Sus criterios clínicos fueron establecidos para la NF1 y NF2 en el año 1987, y para la schwannomatosis en 200543,44 (fig. 7). Los neurofibromas se clasifican como solitarios, cuando afectan un solo fascículo, o plexiformes, cuando afectan múltiples fascículos. El subtipo solitario corresponde al 90% de los casos45.
Schwannoma del nervio peroneo (NP). Secuencia 3D IDEAL con saturación de la grasa y en reconstrucción multiplanar en el plano sagital (A) y coronal (B), donde se observa una lesión ovoidea sobre el territorio del nervio ciático (flechas), en un paciente con marcha polineurítica y electromiograma compatible con lesión del NP.
El diagnóstico de los tumores de la vaina neural periférica está basado en las manifestaciones clínicas, la localización de la lesión, los estudios electrofisiológicos y las imágenes de RM. La RM permite determinar el sitio exacto del tumor, realizar la volumetría tumoral y definir la relación entre el tumor y las estructuras vasculares y musculares adyacentes. Los neurofibromas y los schwannomas tienen características en común en las imágenes de RM. La apariencia habitual de los tumores de la vaina neural periférica es la de una masa, redonda, oval o fusiforme con señal de partes blandas y márgenes bien definidos, que raramente excede de los 5cm. La mayoría de ellos son isointensos o levemente hiperintensos respecto al músculo en las secuencias ponderadas en T1-FSE y marcadamente hiperintensos, similares al agua, en las secuencias ponderadas en T2-FSE. El «signo de la diana» en las secuencias ponderadas en T2-FSE corresponde a una imagen con el centro hipointenso por el componente fibroso y un anillo periférico hiperintenso por material mixoide46. La atrofia de los músculos dependientes del nervio afectado es otro hallazgo a favor de este tipo de tumores47.
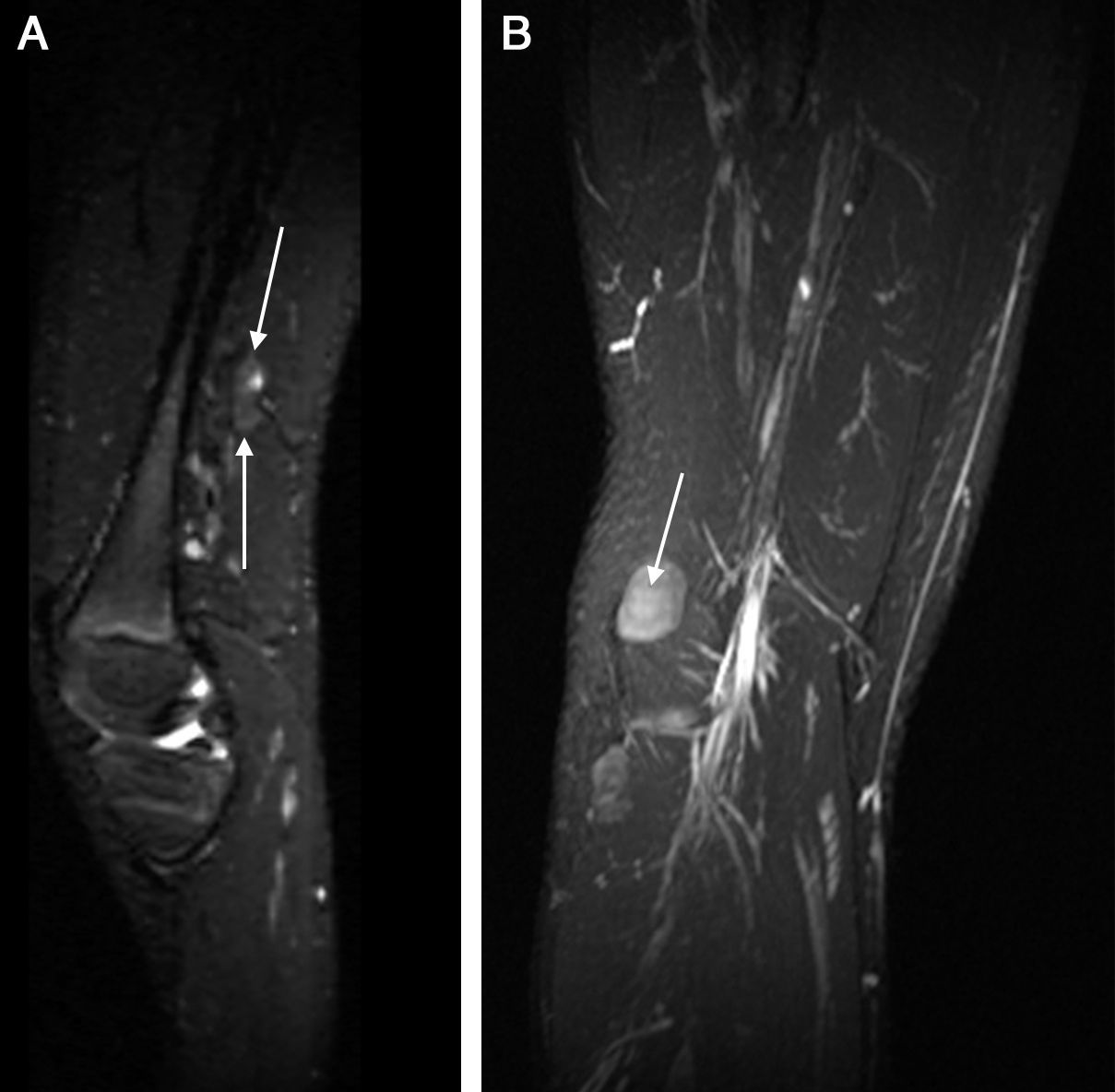
Los neurofibromas solitarios se localizan en el centro del nervio por lo que en la intervención quirúrgica es muy difícil separar las fibras del nervio del tejido tumoral. El «signo de la diana», el realce central y una combinación de ambas es un hallazgo a favor de neurofibromas47. Los neurinomas, por el contrario, suelen estar ubicados excéntricamente en el nervio y encapsulados por el perineuro, por lo que se pueden extirpar con facilidad sin lesionar al nervio. En RM los signos sugestivos de neurilemomas son la apariencia fascicular, un anillo hiperintenso delgado en las secuencias ponderadas en T2-FSE, una combinación de ambos y un realce difuso después de inyectar contraste47. En lesiones de larga evolución se pueden observar áreas quísticas, calcificaciones, hemorragias e hialinización, lo que puede simular un sarcoma48. El neurofibroma plexiforme es prácticamente patognomónico de la NF1. El riesgo de transformación maligna es del 8-12%. A diferencia del neurofibroma localizado, el plexiforme expande y distorsiona un segmento largo del nervio y sus ramas, lo que le da una apariencia radiológica y macroscópica característica en «racimo de uvas». Cuando afecta todo un miembro se denomina elefantiasis neuromatosa, una condición que genera hipertrofia del hueso y de las partes blandas49 (fig. 8). La variante maligna de los tumores de la vaina neural, el schwannoma maligno, representa el tipo más común de sarcoma de partes blandas48. Los schwannomas malignos pueden asociarse con NF, sobre todo tipo 1, aunque también puede presentarse en pacientes con antecedentes de radioterapia y, en ocasiones, sin antecedentes de ninguna índole. Extirpar por completo estos tumores es difícil y la recidiva suele ser la regla. Suelen ser sintomáticos de inicio, crecer con rapidez y, en RM, presentar necrosis y realce50 (fig. 9).
Otras causas de mononeuropatía del NP incluyen el perineuroma, el neurolinfoma, la endometriosis, la radiación, las malformaciones vasculares y los procedimientos para tratar varices17.
Las plexopatías y neuropatías por radioterapia aparecen progresivamente varios años después del tratamiento. Estas lesiones se deben principalmente a la radioterapia de tumores pelvianos y del miembro inferior, causados por sarcomas de partes blandas. La bibliografía ha establecido la dosis máxima tolerable en los 60Gy. Esta neuropatía puede agravarse por enfermedades asociadas como la diabetes o procesos vasculares y tratamientos asociados51.
El daño neuronal por endometriosis está causado por la inflamación cíclica del ciclo menstrual. El tejido uterino ectópico, una vez implantado en el nervio, avanza agresivamente por el epineuro y perineuro. El diagnóstico se basa en asociar los síntomas relacionados con el periodo menstrual y los hallazgos en la RM. Se trata de masas quísticas o sólidas hipointensas en secuencias ponderadas en T2-FSE con señal variable según el tiempo de evolución del sangrado52.
El linfoma afecta ocasionalmente al sistema nervioso periférico. La mayoría de las complicaciones son debidas al linfoma no hodgkiniano que infiltra el nervio causando daño axonal. Pueden presentarse como mononeuropatías o polineuropatías. El diagnóstico es muy difícil si se desconoce la existencia del linfoma53.
La escleroterapia, adecuadamente realizada, es un método eficiente para tratar las varices de los miembros inferiores y la incidencia de complicaciones es baja. El medicamento aplicado es potencialmente neurotóxico pero a la dosis y concentración adecuadas no genera complicaciones mayores. Es conocida la irritación de nervios superficiales que frecuentemente ocurre durante el tratamiento. La neuropatía grave persistente es una complicación rara que dependerá de la concentración y la cantidad del medicamento aplicado así como de la distancia entre el nervio y el lugar de la inyección. La inyección intravaricosa, intraarterial y en torno al vaso puede causar daño neuronal. En estos casos hay que tener en cuenta los aspectos médico-legales de esta complicación. Una situación similar puede darse por la aplicación de láser como tratamiento de las varices54,55 (fig. 10).
Neuropatía del nervio peroneo (NP) por escleroterapia de varices. A) Imagen axial estricta donde se observa un aumento del diámetro del nervio con señal hiperintensa de las fibras y engrosamiento del perineuro (flecha larga). Junto al nervio se observan 2 imágenes tubulares de aspecto varicoso (cabezas de flecha). B) Reconstrucción en el plano sagital oblicuo donde se observa engrosamiento difuso del NP con nódulo distal (neuroma) (flecha). C) Secuencia de tensor de difusión con tractografía que muestra el afinamiento del nervio con distorsión de fibras.
La neurografía por RM con secuencias de alta resolución y en equipos 3T permite identificar con claridad el trayecto y las relaciones del NP. Las secuencias de difusión y tensor de difusión son un complemento de las convencionales para mejorar la visualización de los procesos que afectan a este nervio. Además, las secuencias convencionales aportan información de los músculos denervados. Se trata de un excelente método diagnóstico incruento que complementa los estudios electrofisiológicos para determinar lesiones del nervio, localizar el sitio exacto de la lesión y aproximar la causa de la neuropatía peronea.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Autorías- 1.
Responsable de la integridad del estudio: DP, FB, HCH, CC
- 2.
Concepción del estudio: CC
- 3.
Diseño del estudio: DP, FB, HCH, CC
- 4.
Obtención de los datos: DP, FB, HCH, CC
- 5.
Análisis y presentación de los datos: DP, FB, HCH, CC
- 6.
Tratamiento estadístico: No aplicable en este trabajo
- 7.
Búsqueda bibliográfica: DP, FB, HCH, CC
- 8.
Redacción del trabajo: DP, FB, HCH, CC
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: DP, FB, HCH, CC
- 10.
Aprobación de la versión final: PD, FB, HCH, CC
Los autores declaran no tener ningún conflicto de intereses.
A los técnicos radiólogos Miriam López, Adriana López y Alberto Irala, por la optimización de las secuencias de RM y al físico Dr. Jorge Calvar por su colaboración en la reconstrucción de la secuencia DTI.