La neurografía por resonancia magnética se ha convertido en una técnica de imagen complementaria al estudio clínico y electrofisiológico para explorar los nervios periféricos y los plexos braquial y lumbosacro. Este último es asiento de numerosos procesos focales (inflamatorios, traumáticos, tumorales primarios o secundarios) y difusos (polineuropatía diabética, la desmielinizante crónica idiopática, por amiloidosis o la enfermedad de Charcot-Marie-Tooth). El objetivo de este artículo es revisar la anatomía del plexo lumbosacro, describir la técnica de la neurografía del plexo en nuestra institución y mostrar las diversas enfermedades que lo afectan.
Magnetic resonance neurography is a technique that complements clinical and electrophysiological study of the peripheral nerves and brachial and lumbosacral plexuses. Numerous focal processes (inflammatory, traumatic, primary tumors, secondary tumors) and diffuse processes (diabetic polyneuropathy, chronic idiopathic demyelinating polyneuropathy due to amyloidosis or Charcot-Marie-Tooth disease) can involve the lumbosacral plexus. This article reviews the anatomy of the lumbosacral plexus, describes the technique for neurography of the plexus at our institution, and shows the diverse diseases that affect it.
La neurografía por resonancia magnética (NRM) se ha convertido en una técnica esencial para estudiar las neuropatías periféricas y los plexos braquial y lumbosacro (PLS). El PLS es asiento de enfermedades diversas: traumáticas, por atrapamiento, inflamatorias, metabólicas, tóxicas, por radiación y tumores1–5, valoradas durante décadas clínicamente y con técnicas electrofisiológicas, muy sensibles para detectar anormalidades de la conducción6,7. Desde la aparición de las secuencias neurográficas en los 90, la NRM pasó a formar parte del arsenal diagnóstico de las plexopatías8. En la actualidad, los equipos de RM 3T y las secuencias dedicadas de alta resolución permiten ver con excelente definición el curso, grosor, fascículos e intensidad de señal de las raíces del PLS y los tejidos perineurales, añadiendo además a los estudios electrofisiológicos la localización exacta de la lesión y su naturaleza9–13.
Por último, la NRM aporta datos de los músculos, que indirectamente ayudan a localizar el nervio involucrado14,15.
El objetivo de este trabajo es revisar la anatomía del PLS, la técnica de NRM en nuestro centro e ilustrar con ejemplos las diversas enfermedades que lo afectan.
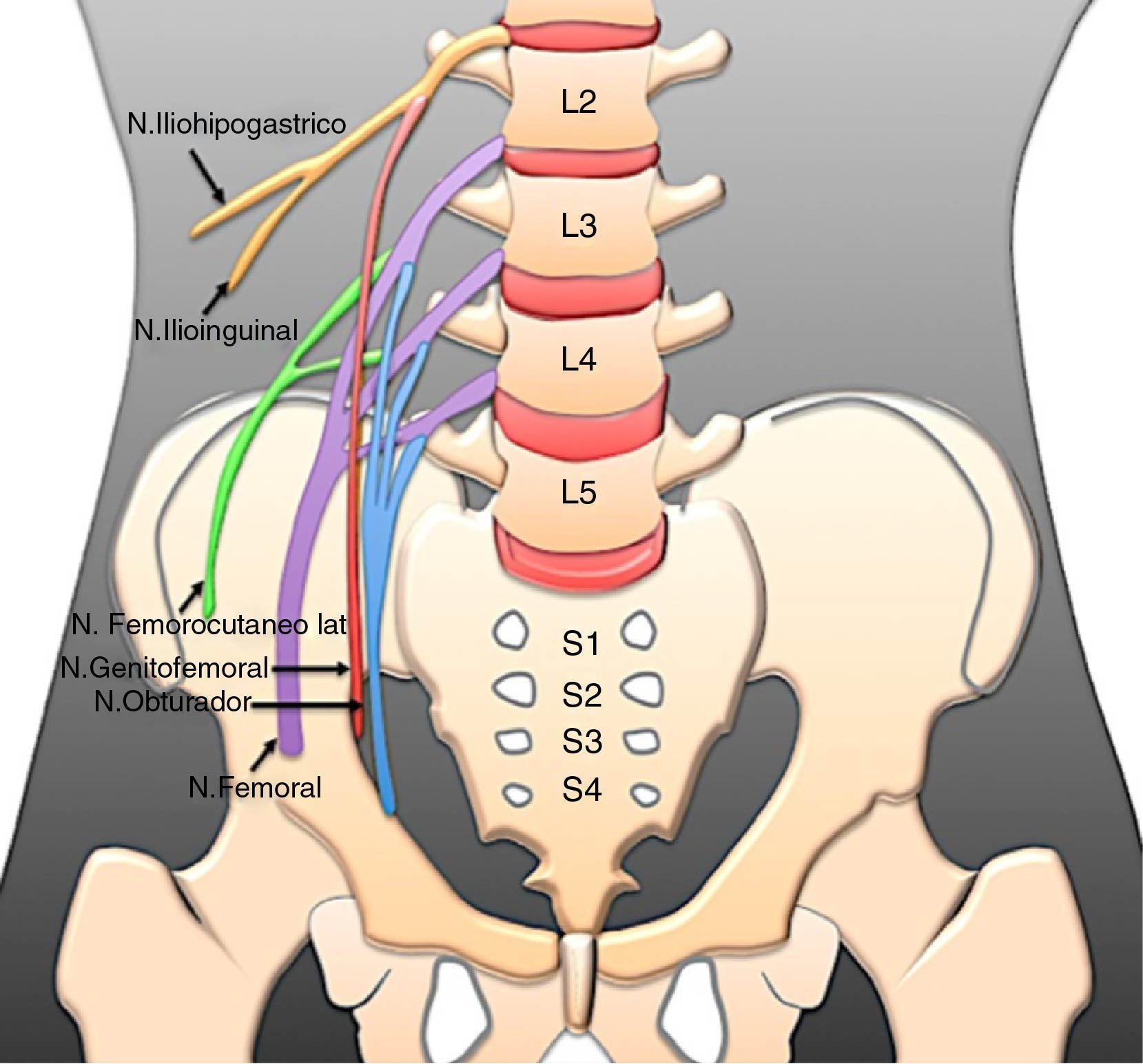
Anatomía del plexo lumbosacroEl plexo lumbar se origina de las ramas ventrales de los nervios L1 a L4, frecuentemente con una contribución del nervio T12. Desciende dorsalmente o dentro del músculo psoas y emite ramas que emergen a) del borde lateral del músculo: nervio iliohipogástrico, ilioinguinal, genitofemoral, femorocutáneo lateral y nervio femoral; y b) del borde medial: nervio obturador y tronco lumbosacro16 (fig. 1).
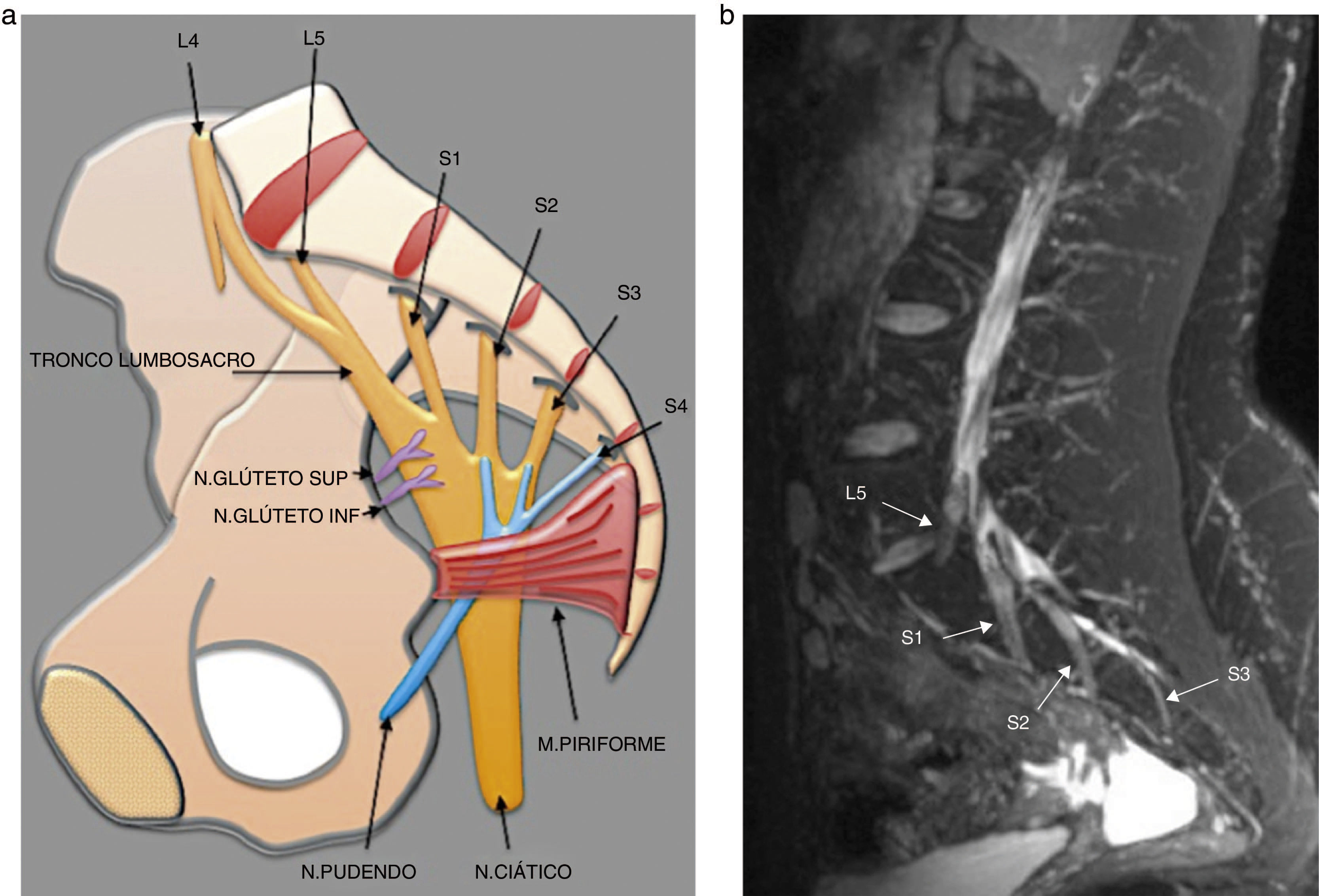
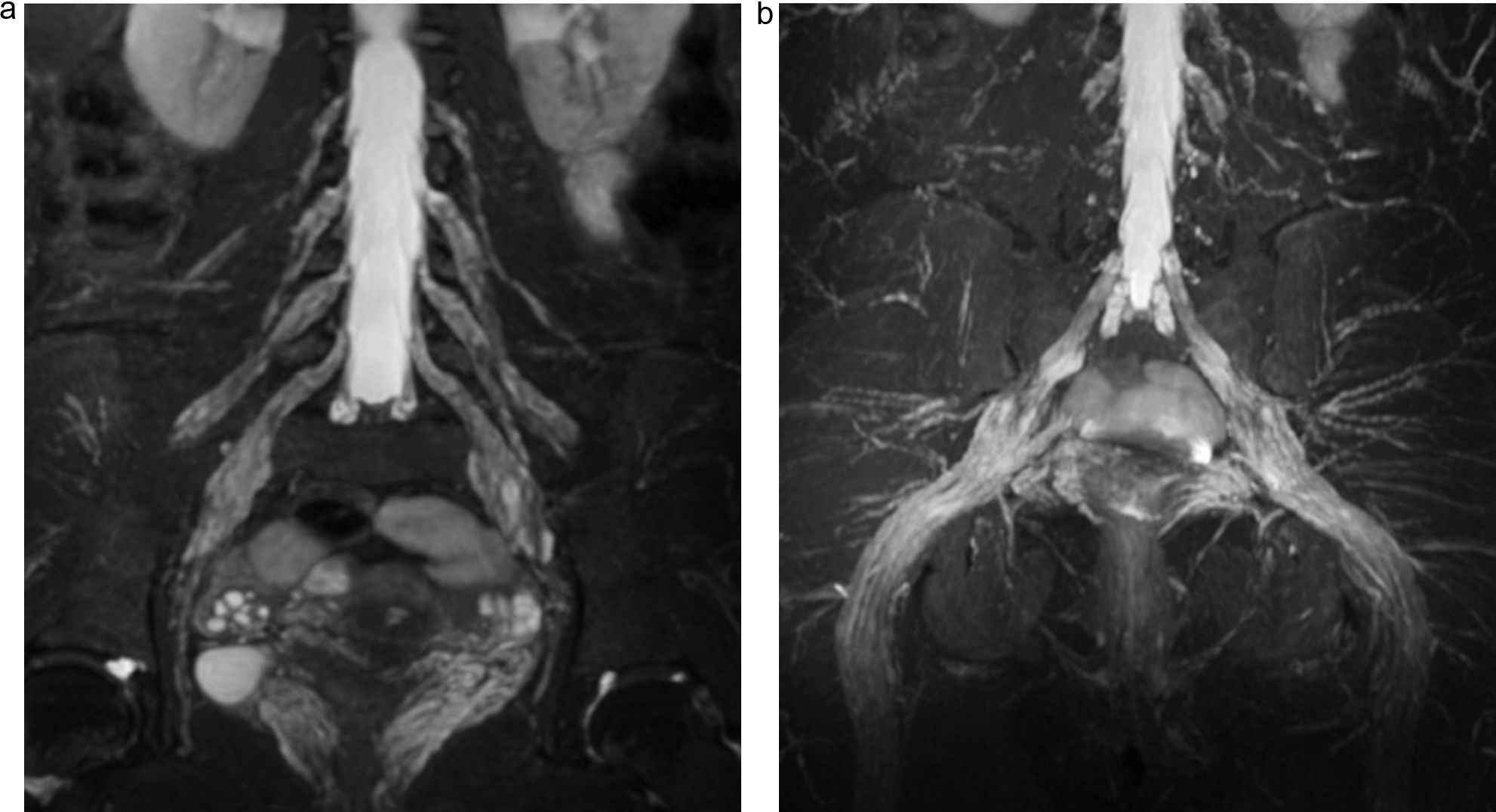
El tronco lumbosacro, formado por una rama menor de L4 y la rama ventral de L5, desciende sobre el ala sacra y se une a las raíces S1 a S3 en la cara anterior del músculo piriforme para formar el plexo sacro, del que nacen el nervio ciático, el nervio pudendo y los nervios glúteos superior e inferior17 (figs. 2 y 3). El plexo lumbar inerva los músculos de la región anteromedial del muslo, mientras que el plexo sacro lo hace con los músculos de la región glútea, la cara posterior del muslo y los distales a la rodilla18 (tabla 1).
a) Esquema representativo del plexo sacro. b) Secuencia sagital T2 IDEAL con saturación grasa. Reconstrucción MIP que identifica las raíces de L5 a S3, de aspecto normal. En la adquisición y reconstrucción sagital, la secuencia T2 IDEAL, permite identificar detalladamente los componentes del plexo sacro.
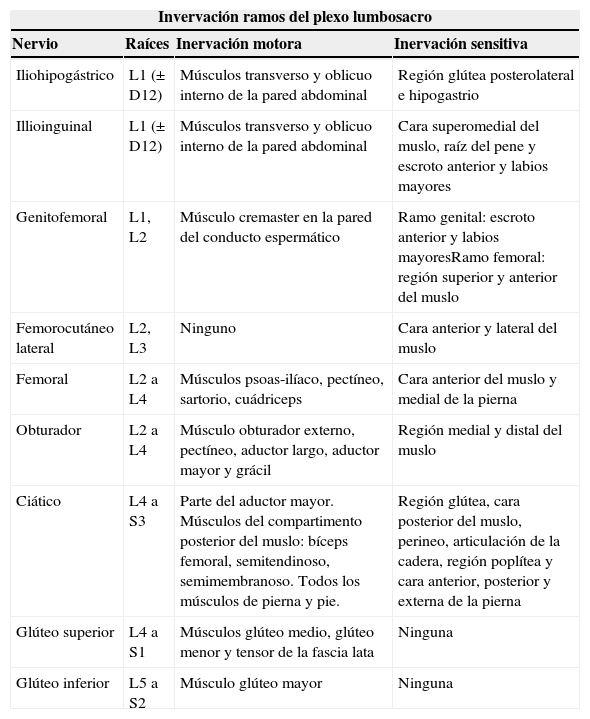
Inervación motora y sensitiva del plexo lumbosacro
| Invervación ramos del plexo lumbosacro | |||
|---|---|---|---|
| Nervio | Raíces | Inervación motora | Inervación sensitiva |
| Iliohipogástrico | L1 (± D12) | Músculos transverso y oblicuo interno de la pared abdominal | Región glútea posterolateral e hipogastrio |
| Illioinguinal | L1 (± D12) | Músculos transverso y oblicuo interno de la pared abdominal | Cara superomedial del muslo, raíz del pene y escroto anterior y labios mayores |
| Genitofemoral | L1, L2 | Músculo cremaster en la pared del conducto espermático | Ramo genital: escroto anterior y labios mayoresRamo femoral: región superior y anterior del muslo |
| Femorocutáneo lateral | L2, L3 | Ninguno | Cara anterior y lateral del muslo |
| Femoral | L2 a L4 | Músculos psoas-ilíaco, pectíneo, sartorio, cuádriceps | Cara anterior del muslo y medial de la pierna |
| Obturador | L2 a L4 | Músculo obturador externo, pectíneo, aductor largo, aductor mayor y grácil | Región medial y distal del muslo |
| Ciático | L4 a S3 | Parte del aductor mayor. Músculos del compartimento posterior del muslo: bíceps femoral, semitendinoso, semimembranoso. Todos los músculos de pierna y pie. | Región glútea, cara posterior del muslo, perineo, articulación de la cadera, región poplítea y cara anterior, posterior y externa de la pierna |
| Glúteo superior | L4 a S1 | Músculos glúteo medio, glúteo menor y tensor de la fascia lata | Ninguna |
| Glúteo inferior | L5 a S2 | Músculo glúteo mayor | Ninguna |
Los nervios iliohipogástrico e ilioinguinal están formados por la división anterior de la raíz L1. Debido a su tamaño, verlos en la NRM es difícil a menos que estén anormalmente agrandados17.
El nervio genitofemoral surge de las divisiones anteriores de las raíces L1 y L2, atraviesa el músculo psoas mayor, pasa dorsal al uréter y se divide en sus ramas genital medial y femoral lateral. En la NRM tiene una trayectoria relativamente sencilla a lo largo del borde anterior del músculo psoas y hacia las regiones inguinales18.
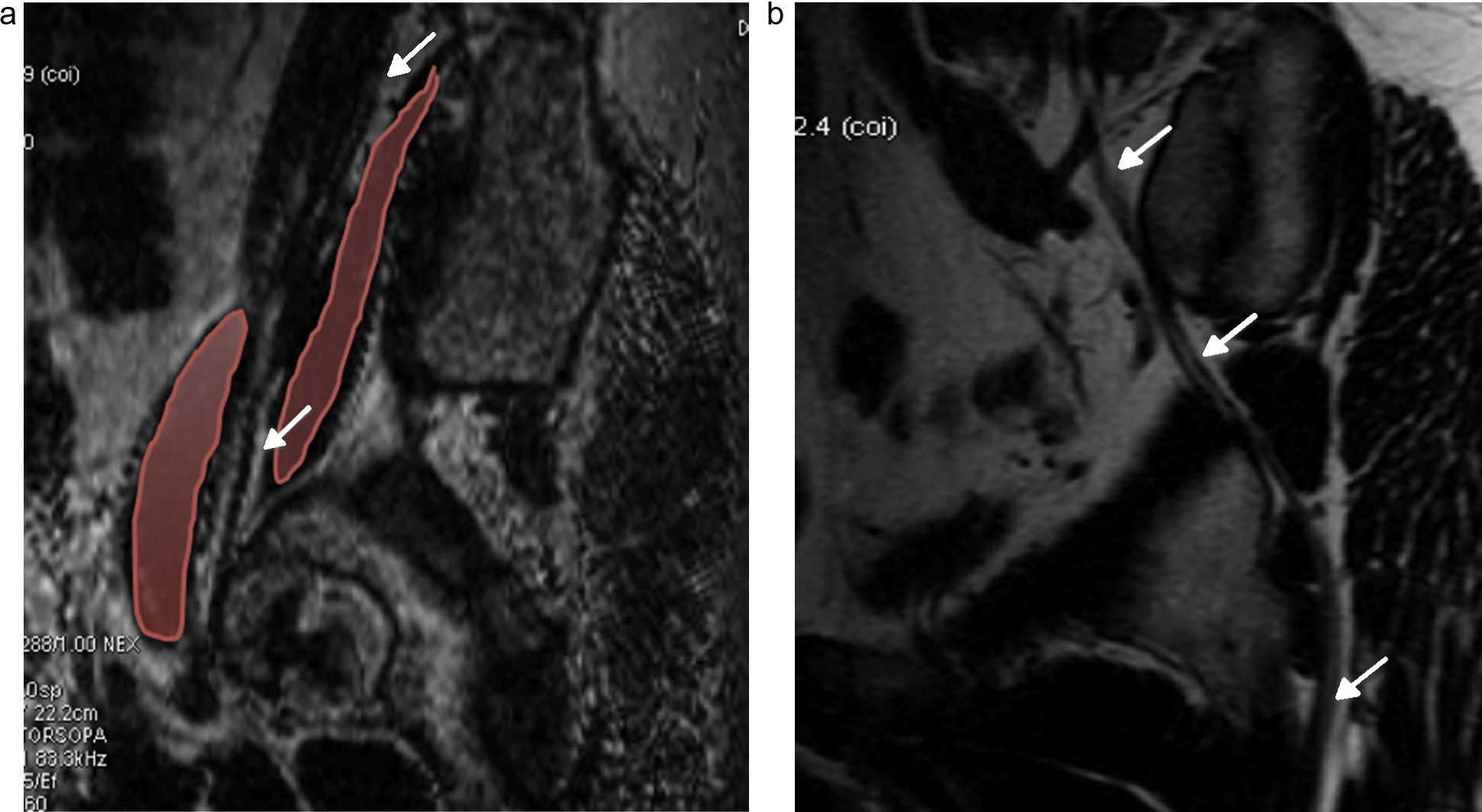
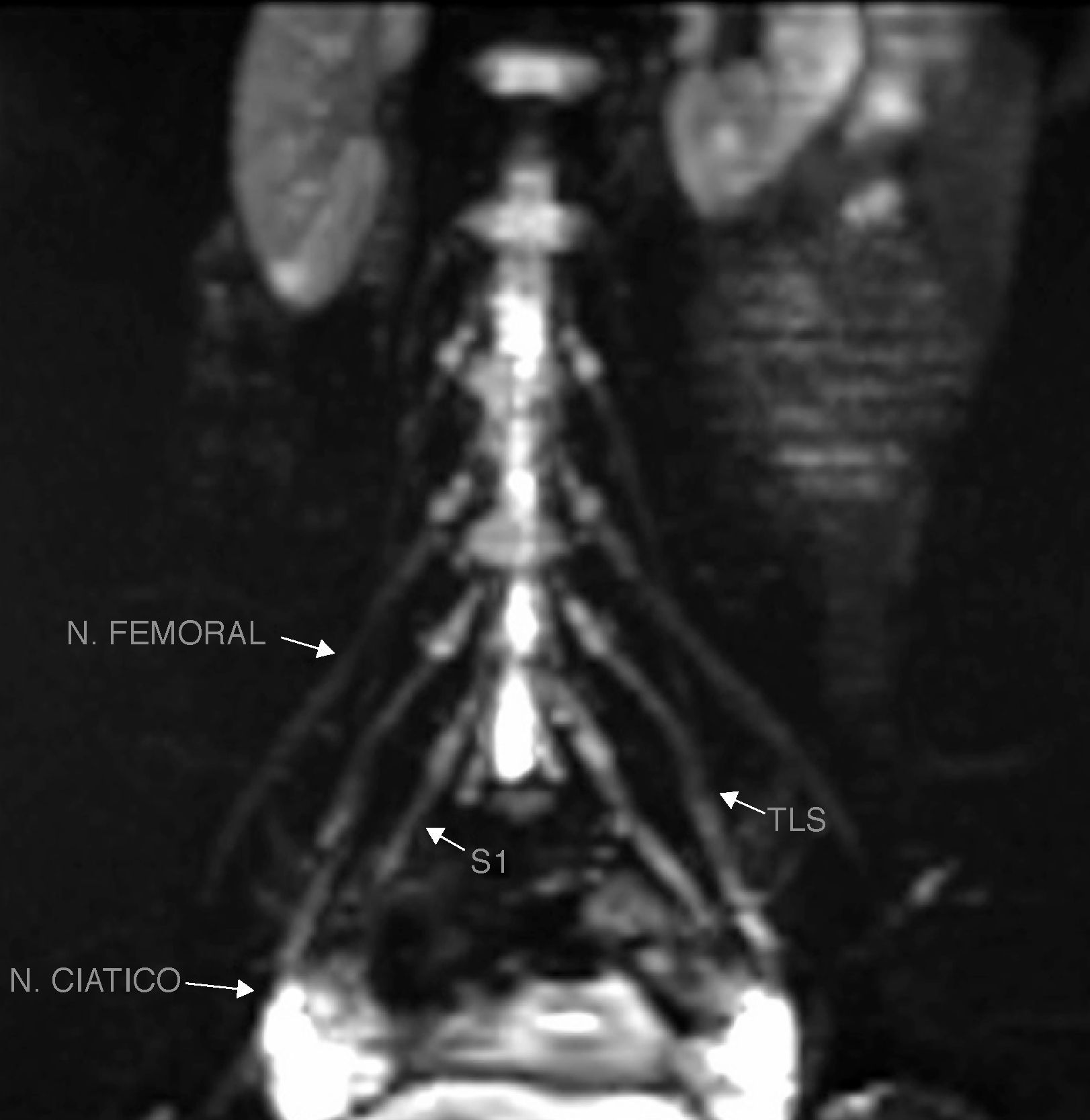
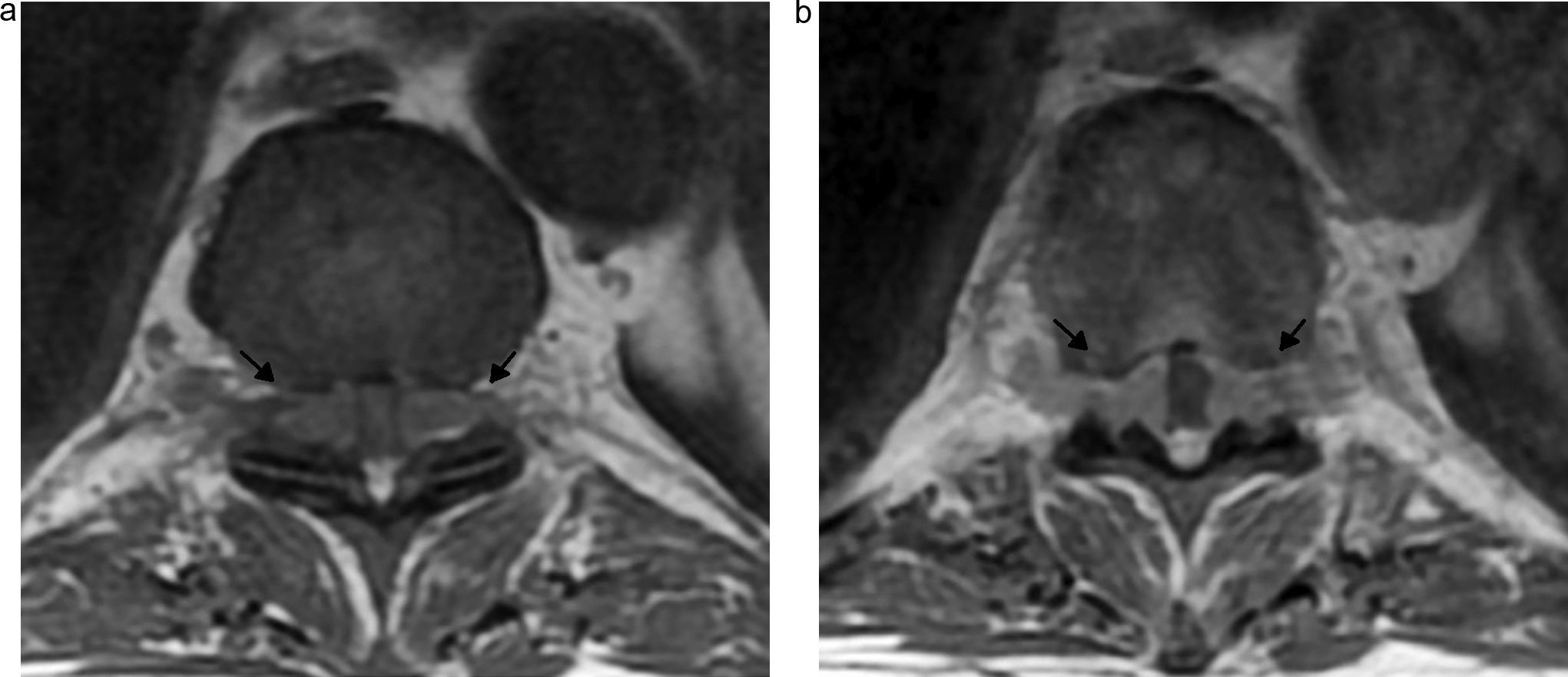
El nervio femorocutáneo lateral (fig. 4) es una rama sensitiva que se origina de las divisiones posteriores de las raíces L2 y L3 y se dirige hacia la espina ilíaca anterosuperior17.
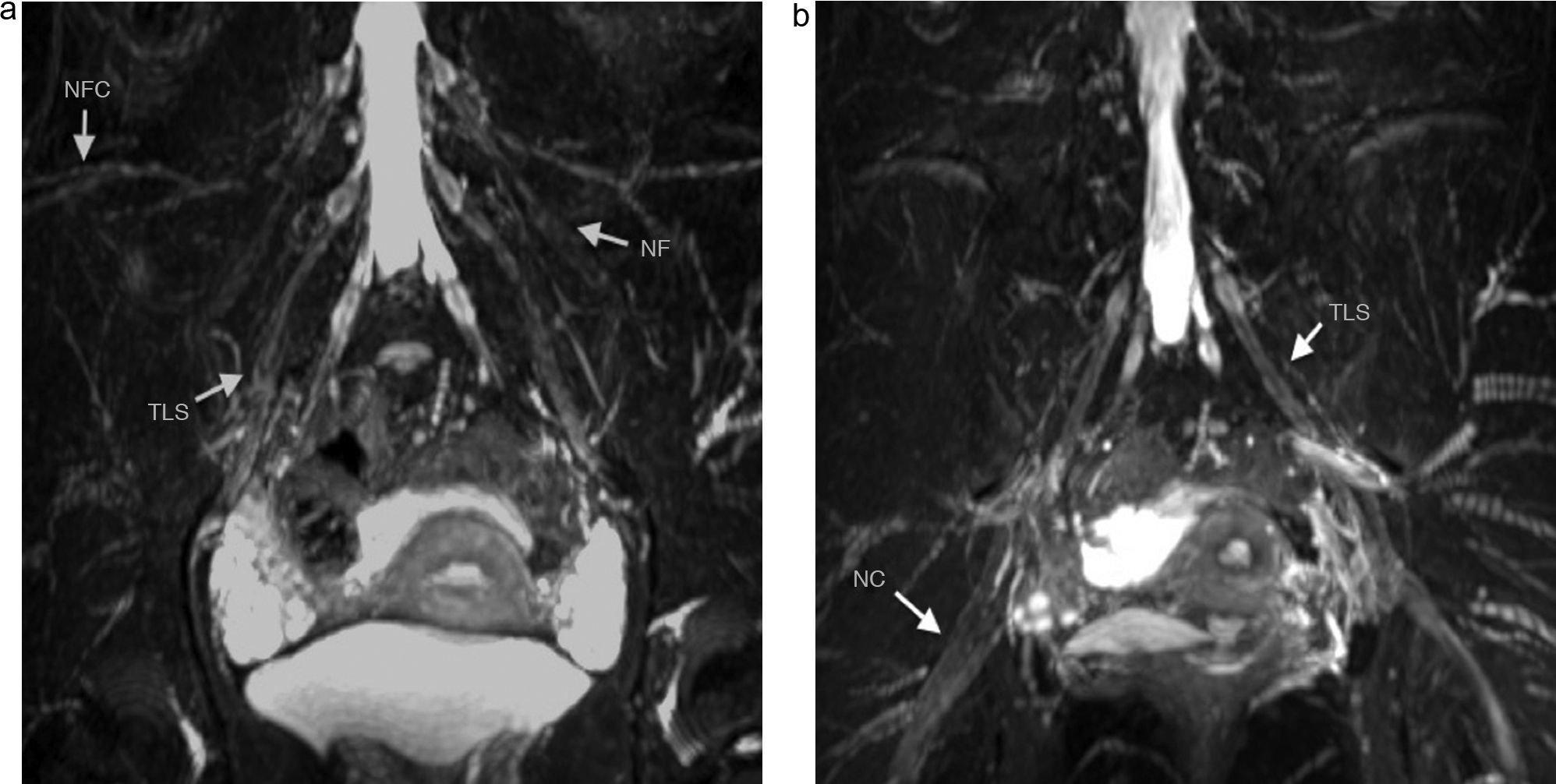
Secuencia coronal T2 IDEAL con saturación grasa. Reconstrucción MIP. a) Nervio femorocutáneo latreal (NFC), nervio femoral (NF) y tronco lumbosacro (TLS), de aspecto normal, se identifican de forma bilateral. b) TLS y nervio ciático (NC) se identifican también de forma bilateral con apariencia normal.
El nervio femoral surge de las raíces posteriores de L2 a L4 (figs. 4 y 5), desciende a través del músculo psoas, emerge por la parte inferior del borde lateral del músculo y pasa inferiormente al ligamento inguinal para entrar al muslo para dar una rama anterior, que inerva a los músculos pectíneo y sartorio, y una división posterior que inerva al músculo cuádriceps. Los nervios femorales se observan constantemente en la NRM, simétricos en hiperintensidad y grosor.
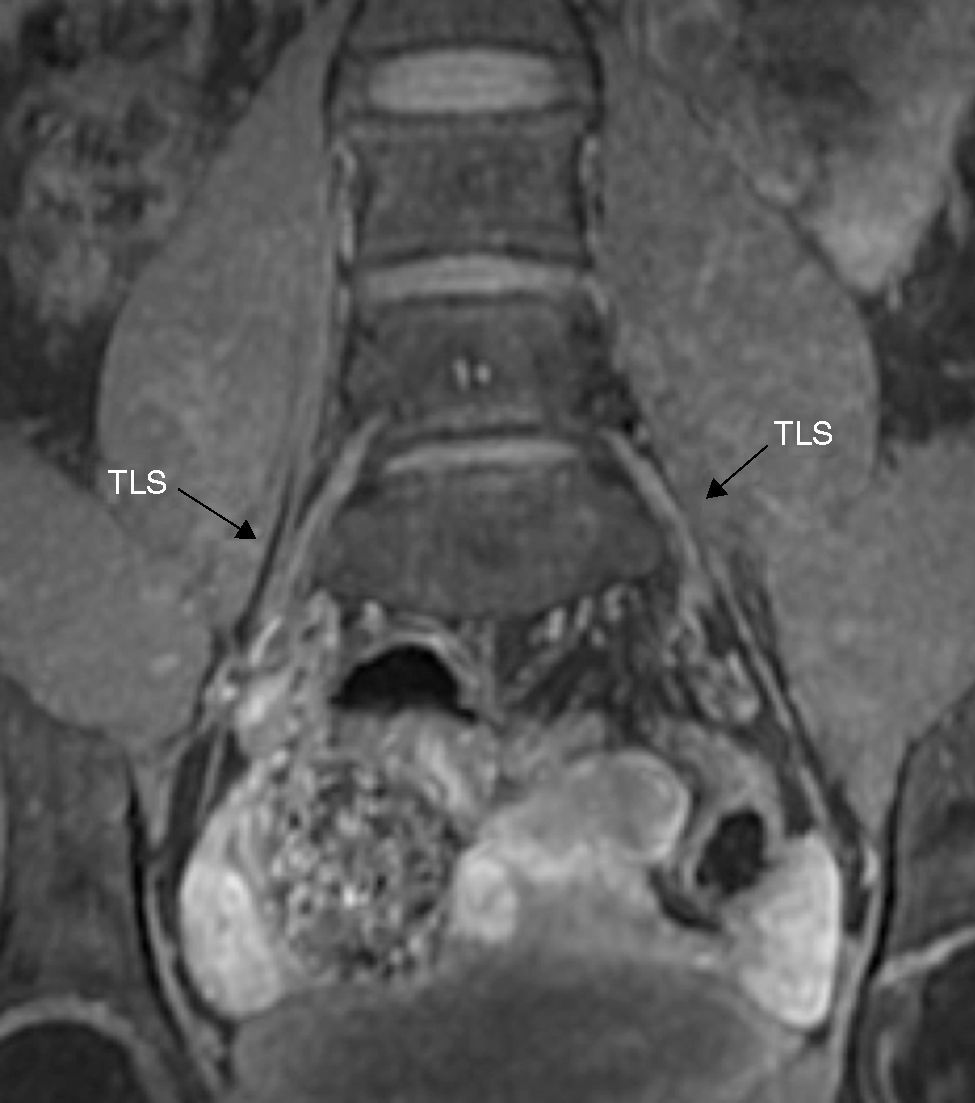
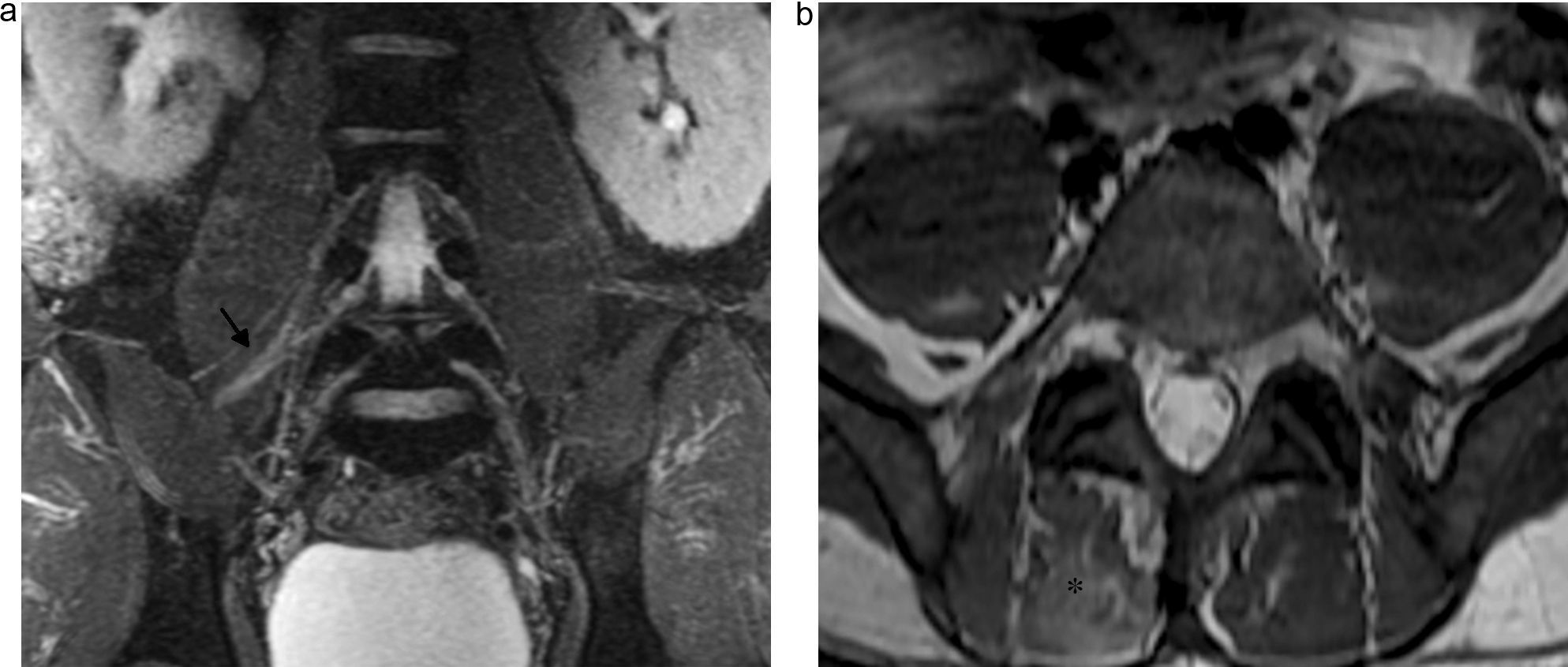
Las ramas ventrales de L2 a L4 forman el nervio obturador, que sigue un curso descendente y sale por el borde medial del músculo psoas, cerca de la cresta ilíaca. Luego pasa a la cavidad pélvica por el conducto obturador en la cara superior del agujero obturador18. Este nervio está rodeado por abundante grasa perineural, lo que facilita identificarlo en todos los planos de la NRM (fig. 6).
El nervio ciático (fig. 4) está formado por las ramas ventrales de las raíces L4 a S3 y puede descender anterior, cranealmente o dentro del músculo piriforme. Sale de la pelvis por el agujero ciático mayor, desciende entre los músculos aductor mayor y glúteo mayor y en el tercio distal del muslo nacen dos ramas: los nervios tibial y peroneo común. Debido a su gran tamaño y abundante grasa perineural, el nervio ciático es fácil de evaluar en todos los planos19.
El nervio pudendo se forma por la unión de las ramas ventrales de S2 y todas las ramas de S3 y S4. Pasa entre el músculo piriforme y el coccígeo y sale de la pelvis por el agujero ciático mayor. Cruza luego la espina isquiática, reingresa en la pelvis por el agujero ciático menor y recorre el canal de Alcock a lo largo de la pared lateral de la fosa isquiorrectal. Sus ramas terminales son los nervios rectal inferior, perineal y dorsal del pene o el clítoris20.
El nervio glúteo superior se origina de las raíces nerviosas de L4 a S1 y surge de la pelvis por el agujero ciático mayor, superiormente al músculo piriforme. El nervio glúteo inferior nace de las raíces de los nervios L5 a S2 y emerge de la pelvis a través del agujero ciático mayor, inferiormente al músculo piriforme. Salvo que incremente su tamaño en forma anormal, su pequeño volumen impide verlo mediante NRM21.
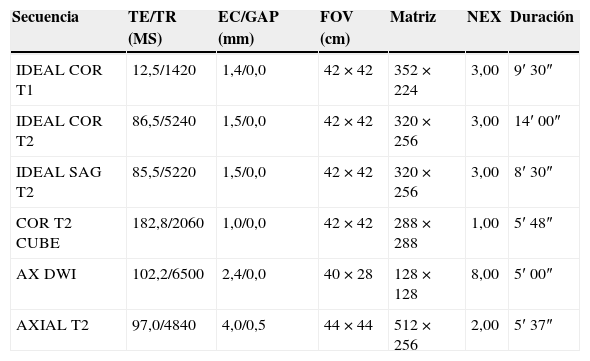
Protocolo de estudio del plexo lumbosacro por resonancia magnéticaEn nuestro centro, el protocolo de estudio del PLS se realiza en un equipo Signa HDxt 3.0 Tesla (GE, Milwaukee, Wis), con bobina de 8 canales CTL Array (Torso PA Signa - GE, Milwaukee, Wis). El paciente se coloca en decúbito dorsal con los miembros extendidos. La bobina cubre desde el apéndice xifoides hasta la raíz de los miembros inferiores. Las secuencias utilizadas son: coronal 3D IDEAL (Iterative Decomposition of water and fat with Echo Asymmetry and Least-squares estimation) potenciada en T1 y T2, sagital IDEAL potenciada en T2, coronal T2 CUBE, axial e-DWI (difusión) (tabla 2). Las secuencias volumétricas se procesan con reconstrucciones multiplanares y reconstrucciones de proyección de máxima intensidad (MIP).
Protocolo de estudio del plexo lumbosacro
| Secuencia | TE/TR (MS) | EC/GAP (mm) | FOV (cm) | Matriz | NEX | Duración |
|---|---|---|---|---|---|---|
| IDEAL COR T1 | 12,5/1420 | 1,4/0,0 | 42×42 | 352×224 | 3,00 | 9′ 30″ |
| IDEAL COR T2 | 86,5/5240 | 1,5/0,0 | 42×42 | 320×256 | 3,00 | 14′ 00″ |
| IDEAL SAG T2 | 85,5/5220 | 1,5/0,0 | 42×42 | 320×256 | 3,00 | 8′ 30″ |
| COR T2 CUBE | 182,8/2060 | 1,0/0,0 | 42×42 | 288×288 | 1,00 | 5′ 48″ |
| AX DWI | 102,2/6500 | 2,4/0,0 | 40×28 | 128×128 | 8,00 | 5′ 00″ |
| AXIAL T2 | 97,0/4840 | 4,0/0,5 | 44×44 | 512×256 | 2,00 | 5′ 37″ |
Con las secuencias IDEAL, desarrollada por General Electric Healthcare, o 3D SPACE (Sampling Perfection with Application Optimized Contrast), desarrollada por Siemens Healthcare13, la imagen separa la señal de agua de la grasa, superando las limitaciones que presentaban las técnicas de supresión grasa tradicionales. Inspirada en el método de Dixon22, adquiere tres imágenes con distinto tiempo de eco para obtener señal de la grasa y del agua con múltiples diferencias de fase y permite trabajar simultáneamente con imágenes potenciadas en T1 y T2 con cuatro combinaciones de pulsos de saturación (supresión de agua, supresión de grasa, imágenes en fase y fuera de fase)9. En T1, los cortes finos, junto con la supresión grasa, son óptimos para evaluar anatómicamente los nervios delimitando adecuadamente los tejidos grasos perineurales, así como para estudiar las estructuras adyacentes (fig. 3). En T2, la alta resolución y la supresión grasa contrastan con la señal del líquido, lo que permite reconstrucciones adecuadas MPR y MIP del recorrido de los nervios (figs. 2, 4 y 5) y evaluar las alteraciones de espesor y señal. Con ambas secuencias se pueden también estudiar los cambios por denervación en los músculos afectados: hiperintensidad en T2 en el estadio agudo y pérdida de volumen muscular, y reemplazo graso en etapas más crónicas15,23.
La secuencia CUBE es una secuencia fast spin eco (FSE) 3D que se obtiene a partir de una única adquisición y que permite luego reconstruir la imagen en todos los planos con la misma resolución. Se consigue utilizando trenes de eco largos para reducir el tiempo de adquisición pero modulando continuamente el ángulo de rotación para evitar la pérdida de señal que suele darse al final del tren. La alta resolución espacial de esta secuencia es ideal para estudiar morfológicamente las raíces nerviosas, el tejido graso perineural y su relación con estructuras adyacentes (fig. 5).
La secuencia de difusión (e-DWI) con valores b de 0 a 1000, además de mostrar los nervios como estructuras hiperintensas, suprime simultáneamente la señal de los vasos sanguíneos, lo que permite una reconstrucción MIP extensa de las estructuras nerviosas sin superponer los vasos. Con valores b bajos (b 200) la imagen tiene menos resolución, pero es útil como complemento de la secuencias IDEAL para evaluar la extensión y distribución de las lesiones. Los valores b altos (700 a 1.000) permiten estudiar la difusión en las lesiones cuantificando el coeficiente de difusión (mapa CDA) particularmente útil en el estudio de tumores24,25 (fig. 7).
Condiciones patológicas que afectan al plexo lumbosacroLesiones por traumaA diferencia del plexo braquial, que es muy vulnerable, el PLS está poco expuesto a los traumatismos debido a la protección del esqueleto axial. Por lo tanto, el trauma directo es poco frecuente. Sin embargo, el indirecto es más frecuente que en el plexo braquial y se relaciona con lesiones de la columna, fracturas o luxaciones de cadera, fracturas de pelvis, iatrogenia quirúrgica ginecológica, colorrectal, o hernia inguinal, aneurisma de aorta, y lesiones que comprometen el músculo psoas, como hematomas y abscesos18,26.
En 1943, Seddon27 propuso una clasificación según la gravedad de las lesiones traumáticas de los nervios periféricos. El grado menor de lesión es la neuropraxia, que produce disfunción axonal, pero sin interrupción de axones ni de la vaina nerviosa. Suele tratarse de un trastorno transitorio con resolución completa. El segundo grado es la axonotmesis, que implica discontinuidad de los axones preservando la integridad del envoltorio conectivo (perineuro, endoneuro y epineuro). El mayor grado de lesión lo constituye la neurotmesis, donde se pierde la continuidad de los axones y de las cubiertas perineurales. El pronóstico dependerá del daño neuronal, condicionado por la capacidad de autorregeneración en los dos primeros grados y en la rapidez de tratamiento quirúrgico en los casos de neurotmesis y de axonotmesis grave. La falta de recuperación produce un neuroma proximal28,29.
En 1951, Sunderland30 amplió la clasificación de la axonotmesis. Dividió las lesiones por trauma en los siguientes grados: tipo I: equivalente a la neuropraxia. La recuperación es completa al cabo de semanas o meses; tipo II: el endoneuro y perineuro están intactos, pero los axones están fisiológicamente interrumpidos. Dado que el endoneuro está íntegro, la regeneración axonal está dirigida a lo largo de su recorrido original y por ello se puede esperar una recuperación funcional completa; tipo III: el endoneuro está interrumpido, y el perineuro íntegro. La recuperación funcional es incompleta; tipo IV: la integridad del recorrido del nervio se debe a un tejido cicatricial que contiene los fascículos nerviosos interrumpidos. La degeneración retrógrada y la fibrosis interfascicular es más extensa, por lo que la recuperación es mínima; tipo V: equivalente a la neurotmesis. Dado que se da en lesiones abiertas, siempre está indicada una exploración quirúrgica. La recuperación espontánea no existe (fig. 8).
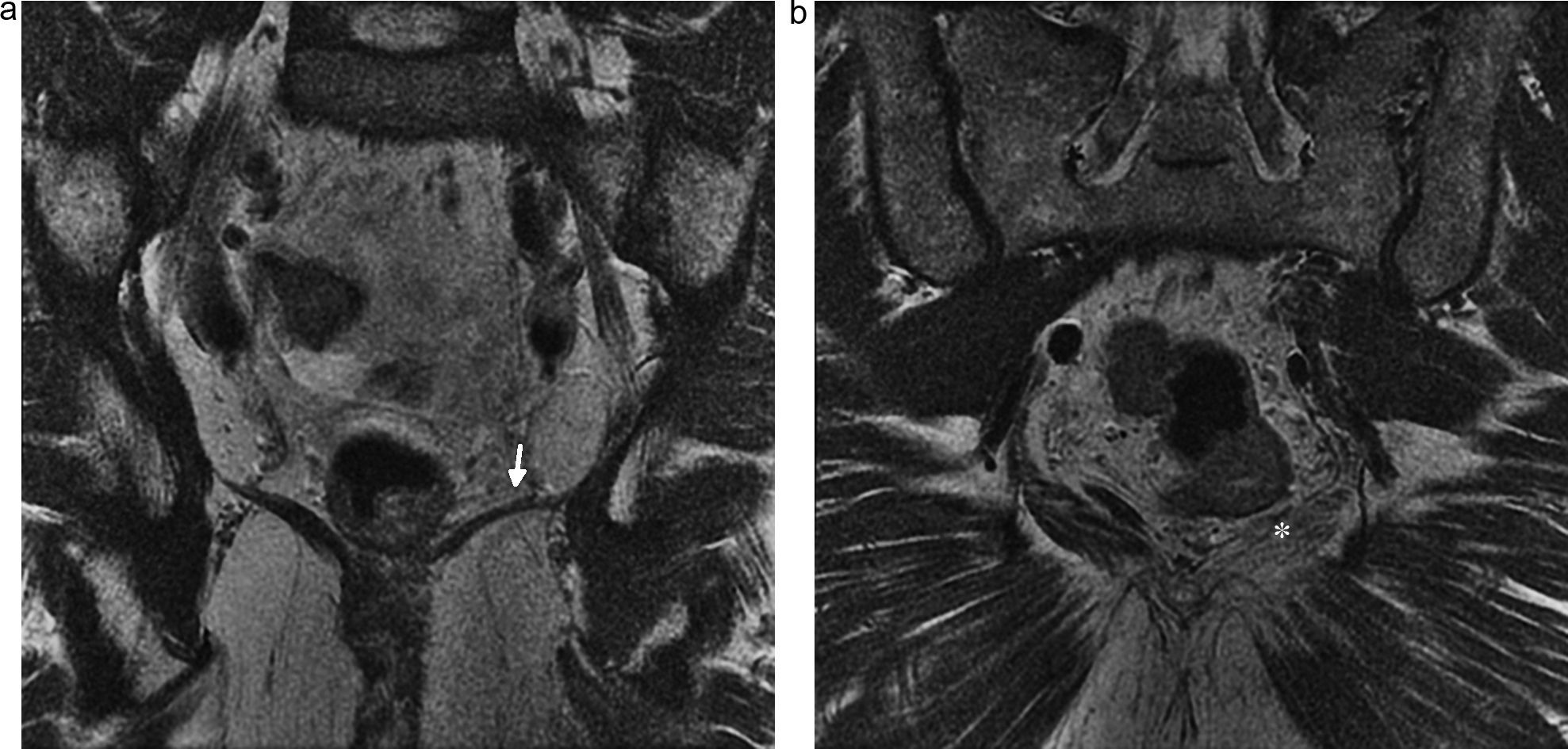
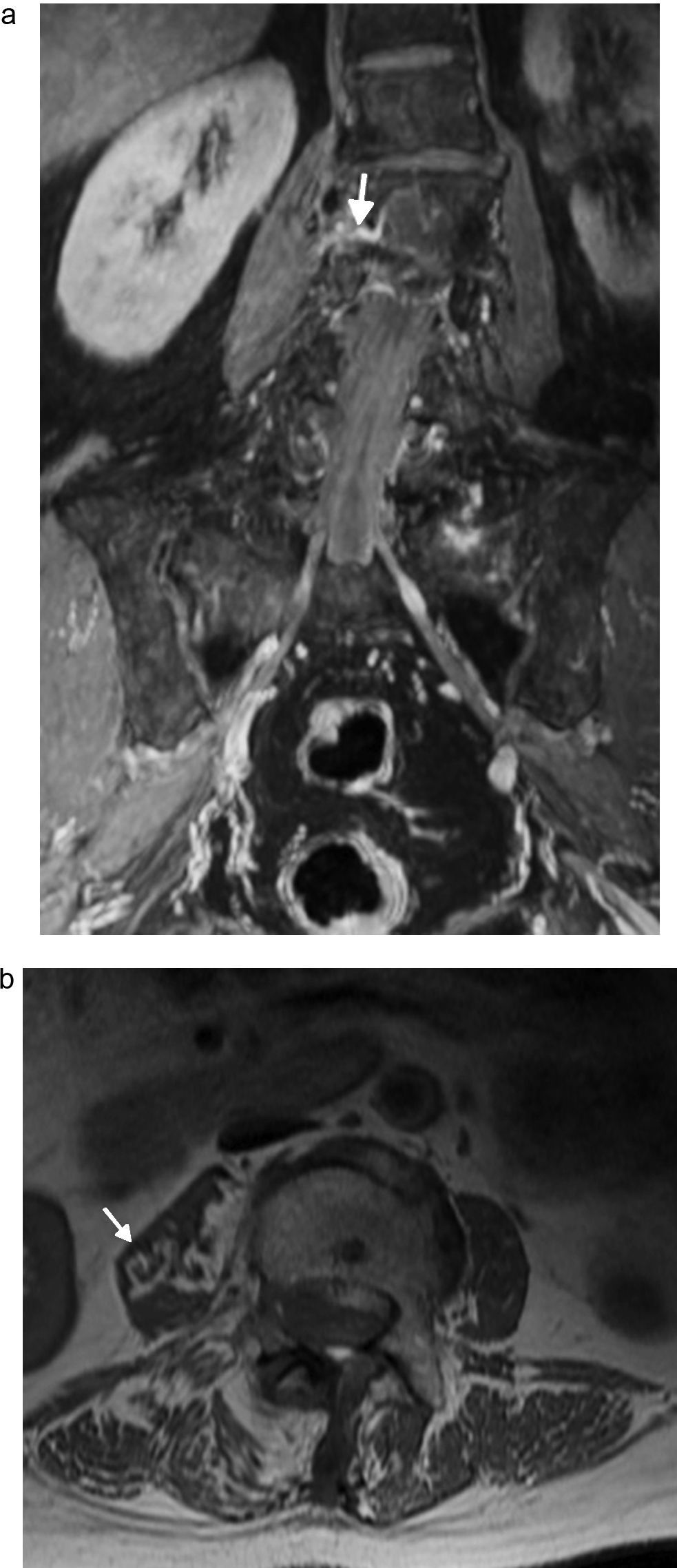
Lesión del nervio pudendo. Hombre de 60 años intervenido quirúrgicamente por carcinoma de próstata con disestesias en la región glútea izquierda y dolor en región perineal que se extiende a genitales externos. a) y b) Imagen coronal T2 IDEAL con saturación grasa que muestra signos de atrofia e infiltración grasa en los músculos elevador del ano izquierdo (flecha) e isquicoccígeo homolateral (asterisco), por denervación crónica del nervio pudendo.
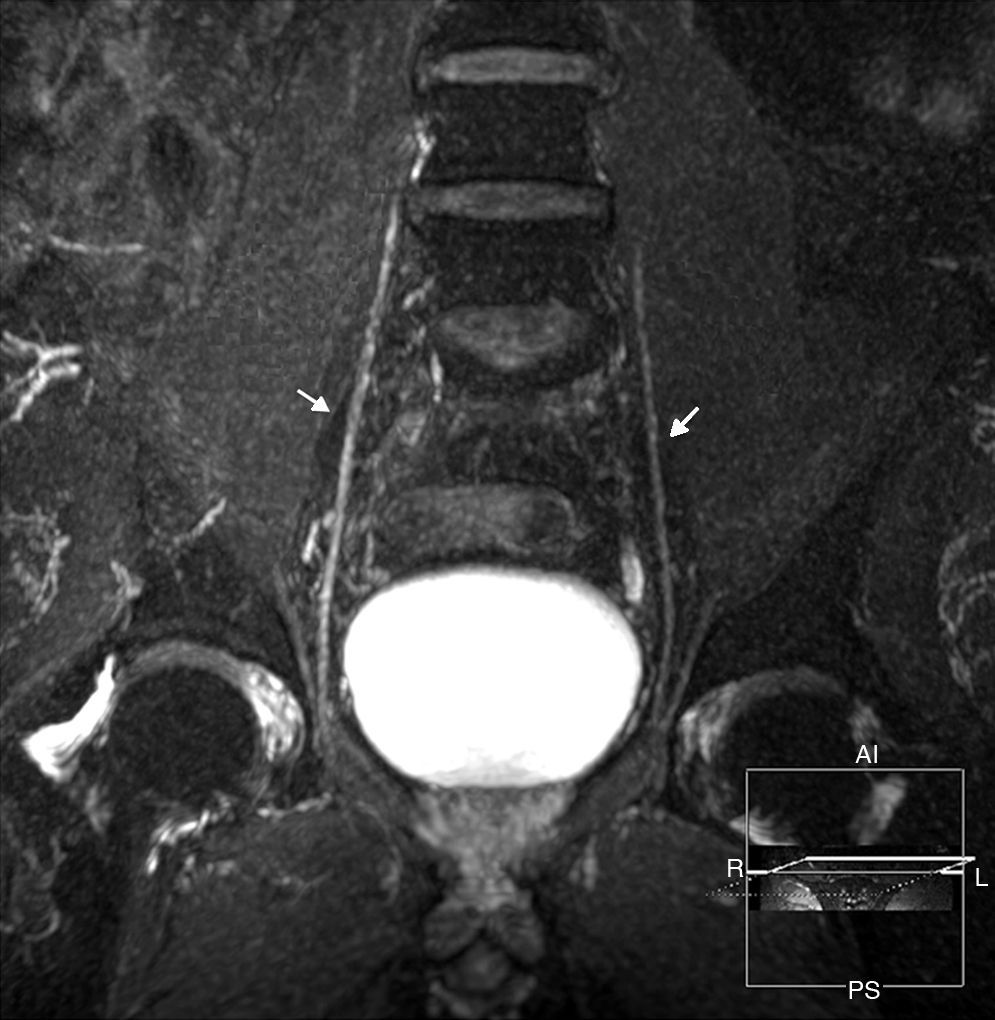
El plexo lumbosacro puede estar afectado directamente por compresión extrínseca, infiltración difusa o, secundariamente, por enfermedades sistémicas o procesos inflamatorios. Los procesos retroperitoneales tienden a comprometer el plexo lumbar, mientras que las enfermedades pelvianas afectan con mayor frecuencia al plexo sacro. Las lesiones del músculo psoas son una de las causas más frecuentes de compromiso del plexo lumbar: traumatismos o intervenciones quirúrgicas, hematomas relacionados con tratamientos anticoagulantes, abscesos e infiltración tumoral. Los procesos osteoartríticos graves de la columna asociados a escoliosis también son causa de compresión radicular (fig. 9). El PLS puede estar también afectado por tumores primarios de colon, ovario, endometrio o cuello uterino, y secundariamente por metástasis de tumores de la mama, sarcomas, linfoma y mieloma múltiple31.
Radiculopatía por compresión. Mujer de 66 años que consulta por lumbalgia y dolor en la cara interna del muslo derecho. a) Secuencia coronal T1 IDEAL con saturación grasa con contraste. Escoliosis lumbar de convexidad izquierda asociada a cambios osteoartríticos que generan engrosamiento y realce poscontraste de la raíz postganglionar derecha L2-L3 con horizontalización de su recorrido (flecha). b) Imagen axial T1 IDEAL con saturación grasa. Atrofia y sustitución grasa del músculo psoas (flecha) del lado derecho en relación a cambios por denervación.
La lesión del plexo sacro, por otra parte, puede estar relacionada con procesos infecciosos o enfermedad osteoartrítica de las articulaciones sacroilíacas, fracturas de pelvis y de cadera, intervenciones quirúrgicas, aneurisma de aorta e infiltración tumoral por cáncer colorrectal y del cuello uterino.
La NRM muestra el engrosamiento del plexo o nervio afectado, la hiperintensidad en pulsos T2 y el realce poscontraste intravenoso. Es común observar cambios denervatorios en los músculos paraespinales así como en los músculos dependientes de nervios periféricos21.
Tumores del plexo lumbosacroTumores benignosEl schwannoma, neurilemoma o neurinoma es un tumor benigno de crecimiento lento de las células de Schwann de la vaina neural. Esta lesión se desarrolla usualmente de forma excéntrica al nervio y queda contenida por el perineuro. Corresponde al 5% de las neoplasias benignas de partes blandas y aparece entre los 20 y 50 años de edad. El PLS es un sitio habitual de desarrollo de estos tumores. La asociación con neurofibromatosis tipo I es rara32–34.
El neurofibroma tiene dos subtipos: solitario y plexiforme. El tipo solitario es la forma más común, y afecta más a los nervios periféricos que al PLS. Representa el 5% de las neoplasias de partes blandas, y afecta a adultos jóvenes de entre 20 y 30 años de edad. Son lesiones fusiformes, centrales, no encapsuladas, por lo que no pueden separarse del nervio35 (fig. 10).
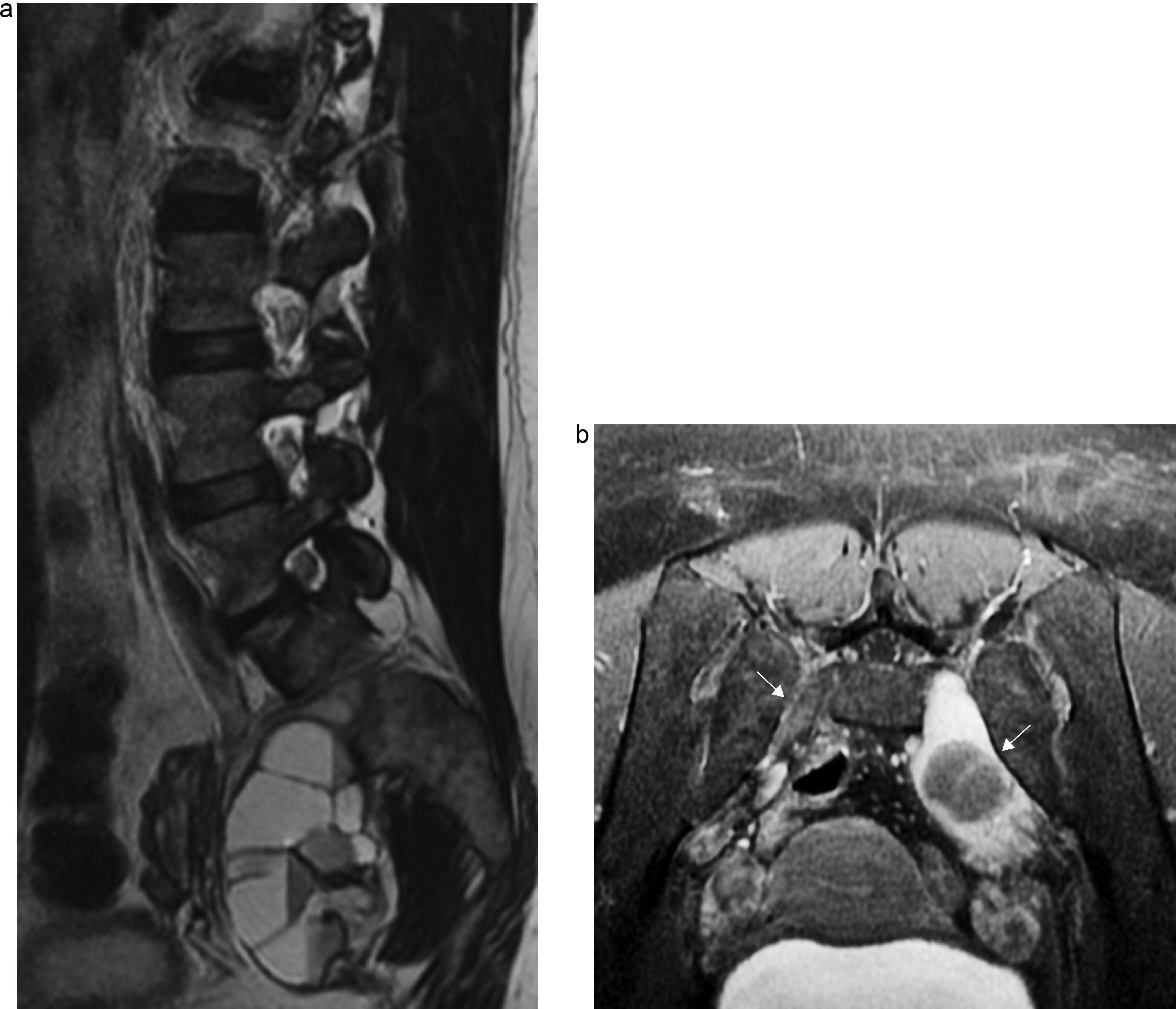
Neurofibroma. Mujer de 34 años con antecedentes de neurofibromatosis que refiere dolor en la región sacra, pantorrilla y pie izquierdo. a) Secuencia FSE sagital T2 de columna lumbosacra. Lesión expansiva heterogénea y aspecto multiquístico, que se extiende desde el agujero de conjunción izquierdo S1-S2 hacia la región pelviana. b) La misma lesión en una imagen axial T2 IDEAL con saturación grasa (flecha gruesa); observese la raíz contralateral normal (flecha fina).
Los schwannomas y los neurofibromas comparten varias características en la NRM como ser fusiformes, bien definidos y raramente mayores de 5cm de diámetro. En las lesiones espinales agrandan el agujero de conjunción y adoptan una forma en «reloj de arena». Con frecuencia es imposible diferenciarlos por la localización intraneural o perineural. Los de localización intermuscular suelen estar rodeados por una capa de tejido graso que se ve bien en imágenes potenciadas en T1 y en cortes orientados en el eje longitudinal al músculo (split fat sign) como una cápsula. La mayoría de los tumores benignos de la vaina neural son isointensos a levemente hiperintensos respecto al músculo en T1 y marcadamente hiperintensos respecto de la grasa en T2. En las secuencias STIR pueden presentar un halo periférico hiperintenso con un área central hipointenso o de señal intermedia debido a la presencia de tejido mixoide en la periferia y fibrosis en el centro denominado el «signo de la diana». Anteriormente se consideraba un signo patognomónico de neurofibroma, sin embargo, puede observarse en ambos y también, ocasionalmente, en la variante maligna del tumor de la vaina neural36,37. El patrón fascicular es otro hallazgo descrito en los tumores neurogénicos como imágenes tipo «capas de cebolla» hiperintensas en T234.
Los schwannomas de larga evolución suelen sufrir fenómenos de degeneración y muestran un patrón más heterogéneo con calcificaciones, áreas de hemorragia y degeneración quística que pueden simular un sarcoma. La captación de contraste es variable, pero es habitual en los tumores pequeños una gran avidez por el contraste, de distribución homogénea, mientras que en los grandes tumores la captación puede ser central, periférica o nodular irregular38.
El subtipo plexiforme es casi patognomónico de NFI, suele desarrollarse en la infancia y tiene una tasa de malignización del 8 al 12%. Estos tumores expanden y distorsionan extensos segmentos de uno o varios nervios y en la NRM suelen ser hiperintensos en las secuencias T2, con un aspecto en «saco de gusanos». El realce poscontraste es similar al de los neurofibromas solitarios39,40 (fig. 11).
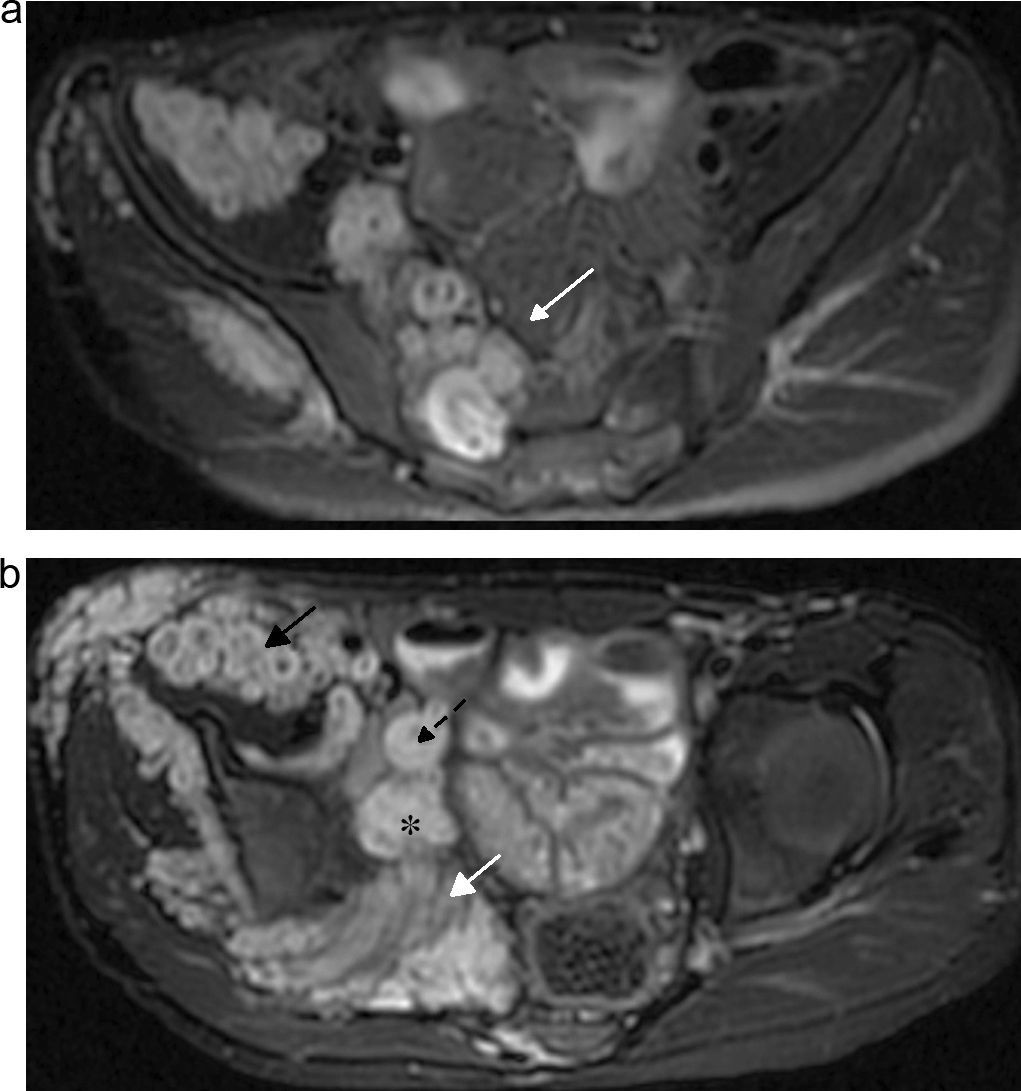
Neurofibroma plexiforme. Niño de 7 años con antecedentes de neurofibromatosis tipo I. RM de control. a) y b) RM axiales STIR, donde se observan múltiples imágenes expansivas, heterogéneas, localizadas en la región del plexo lumbosacro, con compromiso del nervio femoral (flecha negra), tronco lumbosacro (flecha larga blanca), nervio ciático (flecha corta blanca), obturador interno (asterisco) y pudendo (flecha punteada) del lado derecho.
El schwannoma maligno, el sarcoma neurogénico y el neurofibrosarcoma son tumores de novo o provienen de la variante benigna. Corresponden al 5-10% de los sarcomas de partes blandas33. De hecho, entre el 25-50% de los tumores malignos de la vaina neural ocurren en pacientes con NF1. De ellos, la mitad se desarrolla de novo y la otra mitad resulta de la transformación maligna de neurofibromas preexistentes32. La mayoría aparecen entre los 20 y 50 años como masas voluminosas y dolorosas. En pacientes con NF el promedio de edad de aparición es menor. Generalmente son sarcomas de alto grado, por lo cual el pronóstico suele ser malo, con tendencia a la recidiva y metástasis a distancia. Anatomopatológicamente muestran áreas de componente mixoide, hemorragia y necrosis (fig. 12).
Schwannoma maligno. Hombre de 71 años al que se extirpó un schwannoma maligno sacro, que presenta ciatalgia refractaria al tratamiento. En la RM de control se constata una recidiva tumoral. a) Secuencia coronal IDEAL con saturación de agua y grasa T1 con contraste donde se observa una lesión heterogénea que realza intensamente tras inyectar contraste por vía intravenosa (flechas), que depende de las raíces nerviosas L5-S1 y S1-S2. b) La misma lesión en secuencia axial T1 IDEAL con saturación grasa (flecha).
Típicamente se desarrollan en los troncos nerviosos principales, en la porción más proximal del PLS y en nervios principales de los miembros inferiores, como grandes masas que afectan todo el espesor del nervio, con extensión proximal y distal.
Con la NRM no es posible distinguir entre tumores benignos y malignos de la vaina neural9. En general, la intensidad de señal y el realce poscontraste son inespecíficos en la variante maligna, indistinguibles de los tumores benignos. Tampoco difieren significativamente del resto de los sarcomas de partes blandas40. Las características a favor de malignidad en las imágenes de NRM son el tamaño mayor de 5cm, los márgenes irregulares y la señal marcadamente heterogénea33,40,41.
LinfomaA excepción de los de la vaina neural, son extremadamente raros los tumores malignos que afectan al plexo lumbosacro. El compromiso primario del PLS representa una manifestación extraganglionar de linfoma no Hodgkin de células B de alto grado. Se manifiestan como un engrosamiento difuso de un segmento neural hiperintenso en T2 e isointenso al músculo en T1. El realce es variable42,43 (fig. 13).
Linfoma. Hombre de 72 años con antecedente de linfoma de células B y paraparesia rápidamente progresiva con síntomas de disfunción esfinteriana. a) Imagen axial T1 D12-L1 en la que se observa ocupación del espacio epidural por una lesión de señal intermedia que se extiende por los agujeros de conjunción (flechas). b) Secuencia axial T1 con contraste donde se observa captación homogénea de las lesiones.
La afectación secundaria del PLS puede producirse por extensión directa, por contigüidad o por diseminación linfática. El melanoma puede afectar al PLS y con menor frecuencia los tumores de mama y pulmón. Los estudios de imagen no pueden diferenciar este tipo de tumores de los primarios, por lo que conocer el antecedente de la enfermedad de base ayudará a sospechar el diagnóstico, lo mismo que la presencia de ganglios linfáticos adyacentes, la afectación del tejido óseo de la pelvis o columna o la aparición de múltiples lesiones infiltrantes18.
Polineuropatía lumbosacraEl PLS puede afectarse por causas sistémicas e inflamatorias como la diabetes mellitus, síndrome de Guillain-Barré, vasculitis, polineuropatía desmielinizante inflamatoria crónica, neuropatías hereditarias como la enfermedad de Charcot-Marie-Tooth, neuropatías por radiación, amiloidosis, sarcoidosis y enfermedades del tejido conectivo4,44.
Plexopatía diabéticaLa polirradiculoneuropatía lumbosacra diabética, también llamada amiotrofia diabética, suele tener un curso subagudo y se manifiesta con dolor, debilidad y pérdida de peso y afectación multifocal del PLS, uni o bilateral45,46. Katz et al.47 demostraron una afectación coexistente del plexo braquial en el 15% de una serie de 60 pacientes con plexopatía lumbosacra. Massie et al.48 demostraron anatomopatológicamente lesión isquémica y microvasculitis en los nervios afectados por la diabetes, caracterizadas por pérdida multifocal de fibras, engrosamiento perineural, neovascularización y neuromas asociados a colecciones inflamatorias perivasculares, inflamación de las paredes de los vasos y macrófagos cargados de hemosiderina.
En la NRM se observa el nervio hiperintenso en T2, con grados variables, e hipertrofia de las raíces y realce poscontraste. Los músculos dependientes del nervio o tronco afectado muestran cambios en su estructura, hiperintensidad T2 en los casos de denervación aguda o subaguda e hiperintensidad T1 con infiltración grasa por denervación crónica que puede estar asociada a atrofia muscular48 (fig. 14).
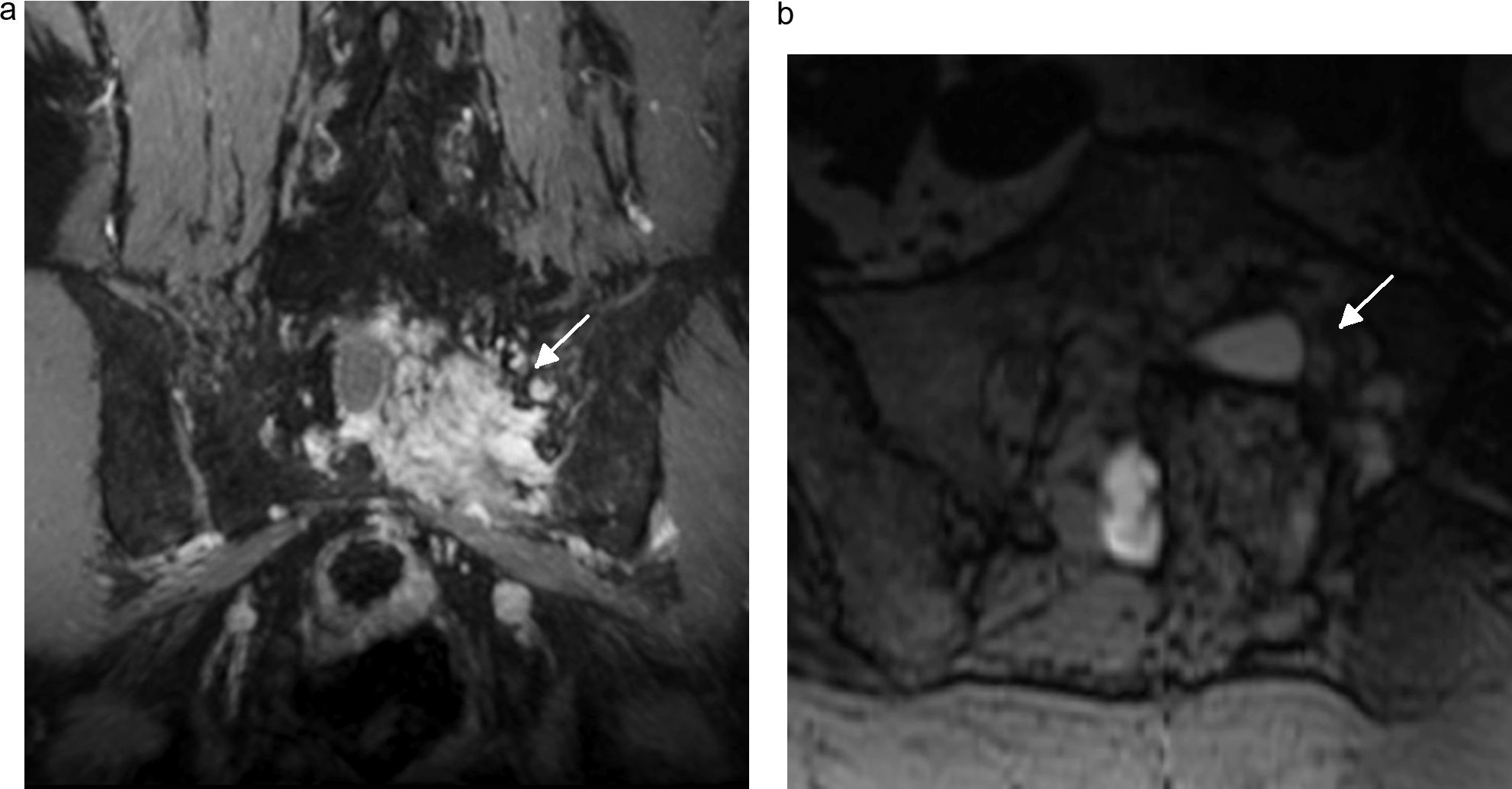
Polineuropatía diabética. Hombre de 43 años con antecedente de diabetes mellitus tipo II no controlada y lumbalgia con irradiación a la cara anterior del muslo derecho. a) Imagen coronal T2 IDEAL con saturación grasa donde se observa plexo lumbosacro ligeramente engrosado con apariencia fascicular, con predominio en nervio femoral derecho (flecha). b) Imagen axial T2 en la que se observa una hiperintensidad del tracto medial derecho de la musculatura paraespinal al nivel L5-S1 como signo de edema muscular (asterisco).
El acrónimo PDIC fue propuesto por Dyck et al.49 en 1982 para designar una neuropatía desmielinizante autoinmune que podía responder a la terapia corticoidea. Los síntomas son sensitivomotores, de predominio sensitivo, de miembros superiores e inferiores y, con menor frecuencia, de pares craneales. Suele tener una instauración subaguda (entre 4 y 8 semanas).
El diagnóstico se sustenta en los signos desmielinizantes al estudiar la conducción nerviosa e hiperproteinorraquia en el líquido cefalorraquídeo. El electromiograma revela signos de desmielinización. La biopsia se reserva para casos no concluyentes y muestra desmielinización y remielinización segmentarias50.
Muchos trabajos han mostrado los cambios hipertróficos de las ramas del PLS en los pacientes con PDIC3,50–55. En la NRM se ha descrito hipertrofia fusiforme de los nervios periféricos y engrosamiento de las raíces nerviosas en la mayoría de los pacientes. Excepcionalmente, se puede observar hipertrofia de las raíces de la cauda equina56. Estos cambios hipertróficos no son patognomónicos de esta polirradiculoneuropatía crónica puesto que también se observan en la infiltración por linfoma o en las polineuropatías hereditarias tipo Charcot-Marie-Tooth57.
En algunos casos se observa realce poscontraste del ganglio anexo a la raíz nerviosa como signo de disrupción de la barrera hemato-neural. El realce persiste aunque los síntomas hayan remitido con el tratamiento58 (fig. 15).
Polirradículoneuropatía desmielinizante crónica (PDIC). Mujer de 38 años con diagnóstico de PDIC. Secuencia coronal T2 IDEAL con saturación grasa. a) Se observa un importante engrosamiento bilateral y simétrico de las raíces del plexo lumbosacro. b) Compromiso de ambos nervios ciáticos.
En los casos en que la exploración clínica no puede revelar la causa de la neuropatía, es posible que en la NRM el PLS sea anormal local o difusamente, lo que indica un daño estructural que suele desaparecer en controles posteriores y que puede tener relación con condiciones inflamatorias, idiopáticas, incluso virales, como las que se observan en la plexitis braquial19.
ConclusiónLa NRM, en particular con equipos 3T y secuencias dedicadas de alta resolución, debe ser considerada como un método diagnóstico que complementa a los datos clínicos y electrofisiológicos para evaluar el plexo lumbosacro. Permite detectar lesiones focales o difusas, su uni o bilateralidad, localizarlas con exactitud, presumir la causa y determinar los cambios musculares por denervación.
Responsabilidades éticasDerecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Protección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Autoría/colaboradores- 1.
Responsable de la integridad del estudio: CC, FB.
- 2.
Concepción del estudio: CC, FB.
- 3.
Diseño del estudio: CC, MS, IE, FB.
- 4.
Obtención de los datos: CC, MS IE, FB.
- 5.
Análisis y presentación de los datos: CC, MS, IE, FB.
- 6.
Tratamiento estadístico: no aplica en este trabajo
- 7.
Búsqueda bibliográfica: CC, MS, IE.
- 8.
Redacción del trabajo: CC, MS, IE, FB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CC, MS, IE, FB.
- 10.
Aprobación de la versión final: CC, MS, IE, FB.
Los autores declaran no tener ningún conflicto de intereses.