Los plasmocitomas extramedulares son neoplasias malignas de células plasmáticas con origen en los tejidos blandos. El plasmocitoma pulmonar primario es la forma más rara de plasmocitoma extramedular. Los hallazgos radiológicos son inespecíficos y el diagnóstico es histológico. La tomografía computarizada (TC) torácica es útil para confirmar su localización y planificar la cirugía.
Se presenta un caso de plasmocitoma endobronquial primario en un paciente adulto, cuyo diagnóstico se realizó por anatomía patológica. Se describen los hallazgos en la radiografía de tórax y en la TC y se analiza la utilidad de las reconstrucciones tridimensionales para planificar la cirugía.
Extramedullary plasmacytomas are malignant neoplasms of the plasmatic cells of the soft tissues. Primary pulmonary plasmacytoma is the rarest type of extramedullary plasmacytoma. The radiologic findings are unspecific and the diagnosis is histologic. Chest CT is useful for confirming its location and planning surgery.
We present a case of primary endobronchial plasmacytoma in an adult diagnosed at histology. We describe the findings at plain-film chest X-ray and at CT, and we analyze the usefulness of 3D reconstructions for planning surgery.
Los plasmocitomas extramedulares (PEM) son tumores de células plasmáticas poco frecuentes originados en los tejidos blandos1, sobre todo en cabeza y cuello2–4. El plasmocitoma pulmonar es extremadamente raro, supone el 5% de los plasmocitomas extramedulares y su crecimiento endobronquial es excepcional1,3,4.
El diagnóstico de plasmocitoma pulmonar antes de la cirugía es difícil y suele ser necesario el análisis inmunohistoquímico2,5. Las reconstrucciones tridimensionales de la tomografía computarizada (TC) torácica son esenciales para planificar el tratamiento (endoscópico o quirúrgico).
Se presentan los hallazgos en TC de un plasmocitoma endobronquial tratado con resección quirúrgica.
Presentación del casoVarón de 64 años, con fiebre y disnea de 1 semana de evolución, diagnosticado previamente de broncopatía obstructiva crónica y gota. El paciente era ex fumador desde hacía 25 años de 40 paquetes/año y refería esputos hemoptoicos de 1 año de evolución.
La exploración física mostró hipertensión arterial, chapetas malares y sibilantes dispersos en ambos campos pulmonares. No había adenopatías ni organomegalias.
La analítica mostraba sólo una ligera leucocitosis con neutrofilia.
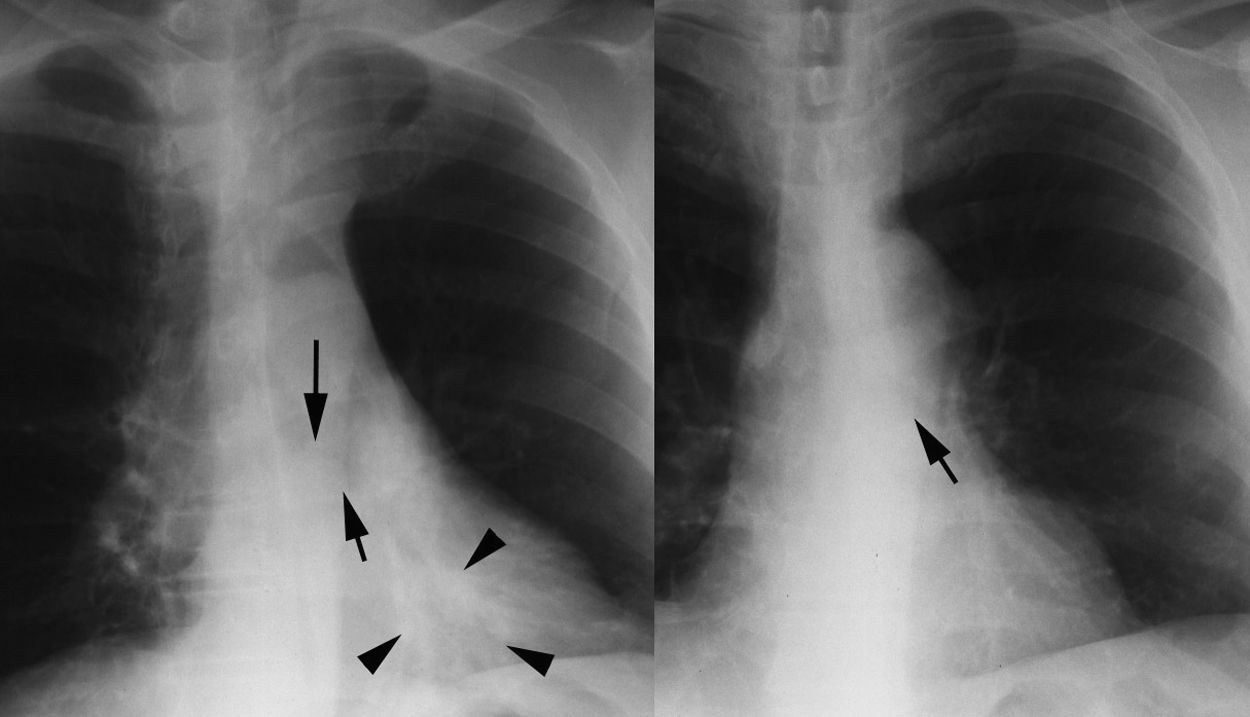
La radiografía de tórax mostró una infiltrado alveolar en el lóbulo inferior izquierdo, con discreta pérdida de volumen y un pequeño nódulo que ocupaba parte de la luz del bronquio principal izquierdo (fig. 1A).
A) Radiografía convencional de tórax. Nódulo que ocupa parte de la luz del bronquio principal izquierdo (flechas) e infiltrado alveolar en lóbulo inferior izquierdo con discreta pérdida de volumen (puntas de flecha). B) Radiografía convencional de tórax tras finalizar el tratamiento antibiótico. Resolución del infiltrado alveolar del lóbulo inferior izquierdo y persistencia del nódulo en el bronquio principal izquierdo (flecha).
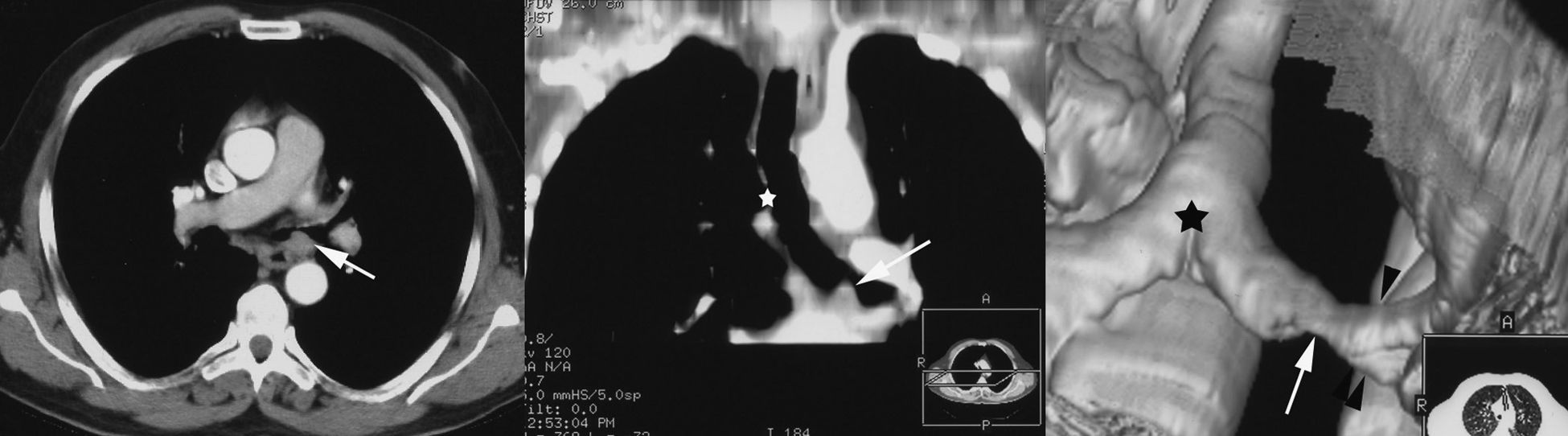
El paciente fue tratado con antibióticos, broncodilatadores y esteroides con buena evolución clínica. En la radiografía de control tras el tratamiento se observó una práctica resolución del infiltrado alveolar sin que el nódulo bronquial hubiera experimentado cambios significativos (fig. 1B). La TC torácica demostró el nódulo, que se originaba en la pared posterior del bronquio principal izquierdo y ocupaba la mayor parte de su luz, así como pequeños ganglios subcarinales (fig. 2A). Las reconstrucciones multiplanares (fig. 2B) y volumétricas tridimensionales (fig. 2C) mostraron que la masa se situaba a 3cm de la carina y ocluía la mayor parte de la luz del bronquio principal izquierdo.
A) En la tomografía computarizada de tórax, tras la inyección de contraste intravenoso en bolo, se demuestra que el nódulo se origina en la pared posterior del bronquio principal izquierdo (flecha) y oblitera parcialmente su luz. B) En la reconstrucción multiplanar coronal se demuestra la protrusión del nódulo en la luz bronquial, el grado de estenosis bronquial (flecha) y su distancia a la carina (asterisco). C) Reconstrucción volumétrica tridimensional de la vía aérea. El nódulo provoca una estenosis parcial del bronquio principal izquierdo (flecha) a una distancia de 3cm de la carina (asterisco). El calibre de la vía aérea distal a la estenosis es normal (puntas de flecha).
La fibrobroncoscopia confirmó la presencia de una tumoración redondeada a 3cm de la carina, de aspecto polipoideo que sangraba con facilidad. Se obtuvieron muestras para biopsia y el estudio histológico demostró una proliferación monoclonal de células tipo IgG kappa compatible con plasmocitoma.
La biopsia de médula ósea y las radiografías de cráneo y de huesos largos fueron normales. El paciente rechazó la práctica de una resonancia magnética (RM).
Fue intervenido mediante una toracotomía posterolateral izquierda y se realizó una resección segmentaria del bronquio principal izquierdo con anastomosis terminoterminal.
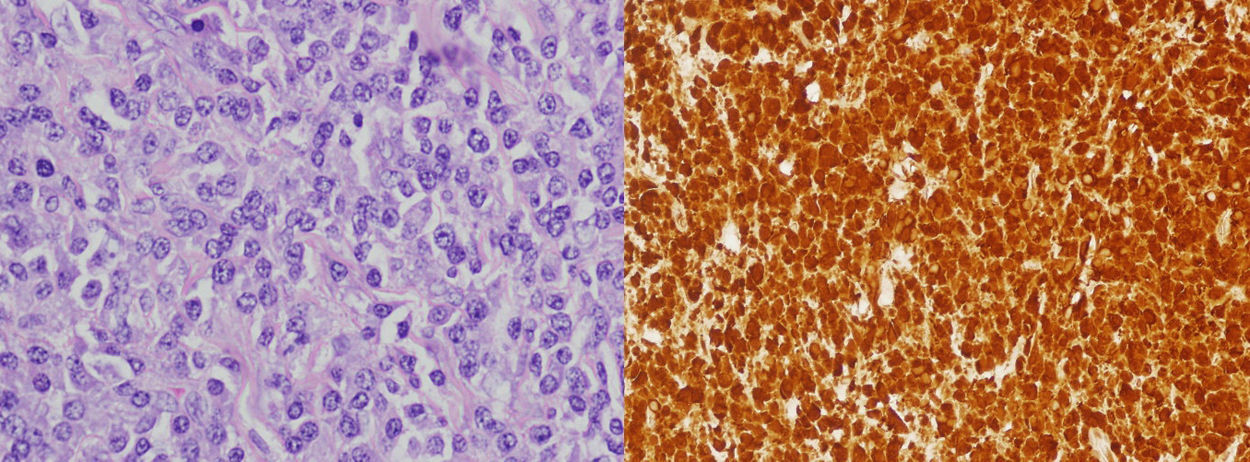
La anatomía patológica mostró una tumoración endobronquial grisácea, polipoide y lobulada, de 1,8cm. Microscópicamente estaba constituida por masas, nidos y cordones de células plasmáticas con citoplasmas amplios y núcleos que mostraban algunas irregularidades. Se observó un infiltrado de polimorfonucleares irregularmente distribuido. Las células plasmáticas infiltraban la pared tumoral en algunas zonas, pero no alcanzaban el borde quirúrgico. La tumoración estaba revestida por mucosa respiratoria con epitelio cilíndrico que en algunas zonas mostraba metaplasia escamosa sin atipia.
El estudio con inmunohistoquímica demostró que las células plasmáticas eran positivas con los anticuerpos IgG kappa (fig. 3).
Un año más tarde, el paciente permanecía asintomático y la TC torácica, broncoscopia y analítica eran normales.
DiscusiónPlasmocitoma es el término aceptado para definir al tumor de células plasmáticas, que se puede localizar en un hueso (plasmocitoma óseo solitario) o fuera de él (PEM)3. Los PEM suponen sólo el 3–5% de los tumores de células plasmáticas4,6 y habitualmente se localizan en la vía aérea o digestiva superior2,4. La afinidad del plasmocitoma por la submucosa del tracto respiratorio superior ha llevado a la hipótesis de que la estimulación crónica por un virus o irritante inhalado puede provocar su desarrollo7. En el pulmón, típicamente se presentan como un nódulo solitario, pero también pueden originar consolidación o infiltrados parcheados1–3,5. En el tórax se han descrito también plasmocitomas en las costillas, en el mediastino y pleurales2. El crecimiento hacia la luz bronquial constituye una forma extremadamente rara de presentación y, según nuestros datos, el nuestro supone el sexto caso descrito en la bibliografía4.
Cuando los PEM se localizan en el tórax, se asocian con tos, disnea, dolor y hemoptisis2.
El diagnóstico de PEM requiere la confirmación histológica de que se trata de una tumoración de células plasmáticas, la presencia en médula ósea de menos de un 10% de estas células y la ausencia de síntomas y signos de mieloma múltiple, como la anemia, la hipercalcemia o el dolor óseo6,8. Los hallazgos en los métodos de imagen no son específicos y el diagnóstico definitivo es histológico, mediante la demostración inmunohistoquímica de inmunoglobulinas citoplasmáticas monoclonales en las células plasmáticas2,5.
No hay suficientes estudios para estimar la utilidad tanto de la TC como de la RM en la detección y en la valoración de la extensión de los tumores de células plasmáticas6,8 aunque, por la experiencia existente hasta el momento, la RM parece ser la prueba más sensible para la exclusión de lesiones múltiples y la elección de la mejor opción terapéutica. Sólo los pacientes con afectación verdaderamente solitaria en la RM, son susceptibles del tratamiento con radioterapia6. El estudio con isótopos tiene todavía un valor limitado, pero los resultados parecen prometedores7.
En nuestro caso, aunque el diagnóstico se estableció por biopsia, cuando se descartó la posible afectación de la mucosa proximal, las reconstrucciones volumétricas tridimensionales en el estudio con TC ayudaron a planificar la cirugía, al definir que la distancia desde el borde del tumor hasta la carina era suficiente para realizar la resección del tumor y la anastomosis de la vía aérea. La broncoscopia virtual permitió, además, analizar la vía aérea distal a la estenosis, la cual no era accesible a la fibrobroncospia óptica.
El tratamiento habitual de estas neoplasias es la cirugía o la radioterapia, solas o combinadas con quimioterapia4,6,7, mostrando buenos resultados, aunque debido a su rarísima frecuencia no se ha establecido todavía un protocolo generalizado6–8.
Debido a la falta de casuística aún se sabe poco de la evolución natural de los plasmocitomas del tracto respiratorio inferior. En la mayoría de las series de PEM, la recidiva local es menor del 10% y la tasa de supervivencia de los pacientes a los 10 años oscila entre el 50 y el 80% o el 30–50%, según distintos estudios8. La evolución de plasmocitoma a mieloma múltiple es frecuente, por lo que debe realizarse un seguimiento estricto de los pacientes tras el tratamiento para detectar cualquier síntoma o signo de enfermedad sistémica o conversión a mieloma múltiple. Para ello se ha propuesto la búsqueda de proteína M en suero u orina1,4,8,9, radiografías del esqueleto y exámenes periódicos de médula ósea1. Recientemente, Iagaru et al10 demostraron la utilidad de la tomografía por emisión de positrones en la detección de una recidiva tumoral tras la resección quirúrgica de un PEM pulmonar, aunque el papel de esta técnica todavía no se ha definido y parece estar limitado a las lesiones líticas de la médula ósea.
Por último, es sabido que los PEM suelen afectar a los ganglios linfáticos regionales. Según algunos estudios hasta el 30–40% de los pacientes tendrá infiltración de la primera estación ganglionar en el momento del diagnóstico y habrá, por lo tanto, que detectarlos y tratarlos4.