Evaluar el rendimiento diagnóstico de la longitud del contacto tumoral con la cápsula (LCT) y la cuantificación del mapa del coeficiente de difusión aparente (ADC) en la predicción de la extensión extracapsular (EEC) microscópica en pacientes con cáncer de próstata candidatos a prostatectomía radical.
MétodoSe realizó un estudio retrospectivo de prueba diagnóstica con curvas receptor-operador (ROC) evaluando el rendimiento diagnóstico del valor de ADC y LCT como predictores de EEC microscópica en 92 pacientes con cáncer de próstata de moderado y alto riesgo, entre mayo de 2011 y diciembre de 2013.
ResultadosEl punto de corte óptimo para el valor del mapa de ADC fue de 0,87× 10−3 mm2/s, con un área bajo la curva ROC del 72% (intervalo de confianza del 95% [IC95%]: 57-86%), una sensibilidad del 83% y una especificidad del 61%. Para la LCT, el punto de corte óptimo fue de 17,5mm, con un área bajo la curva ROC del 74% (IC95%: 61-87%), una sensibilidad del 91% y una especificidad del 57%. Empleando ambos criterios, el rendimiento diagnóstico mejoró con un área bajo la curva ROC del 77% (IC95%: 62-92%), una sensibilidad del 77% y una especificidad del 61%. Se calculó un modelo de regresión logística y se obtuvo un área bajo la curva ROC del 82% (IC95%: 73-93%).
ConclusionesEl uso de criterios cuantitativos mejora la exactitud diagnóstica de la resonancia magnética multiparamétrica en la estadificación del cáncer de próstata. Se encontró que los valores de ADC y de LCT son predictores de EEC microscópica, y que se obtienen mejores resultados si se usan de manera conjunta.
To evaluate the diagnostic performance of the length of the tumor contact with the capsule (LTC) and the apparent diffusion coefficient (ADC) map in the prediction of microscopic extracapsular extension in patients with prostate cancer who are candidates for radical prostatectomy.
Material and methodsWe used receiver operating curves to retrospectively study the diagnostic performance of the ADC map and the LTC as predictors of microscopic extracapsular extension in 92 patients with prostate cancer and moderate to high risk who were examined between May 2011 and December 2013.
ResultsThe optimal cutoff for the ADC map was 0.87× 10−3 mm2/s, which yielded an area under the ROC curve of 72% (95% CI: 57%–86%), corresponding to a sensitivity of 83% and a specificity of 61%. The optimal cutoff for the LTC was 17.5mm, which yielded an area under the ROC curve of 74% (95% CI: 61%–87%), corresponding to a sensitivity of 91% and a specificity of 57%. Combining the two criteria improved the diagnostic performance, yielding an area under the ROC curve of 77% (95% CI: 62%–92%), corresponding to a sensitivity of 77% and a specificity of 61%. We elaborated a logistic regression model, obtaining an area under the ROC curve of 82% (95% CI: 73%–93%).
ConclusionsUsing quantitative measures improves the diagnostic accuracy of multiparametric magnetic resonance imaging in the staging of prostate cancer. The values of the ADC and LTC were predictors of microscopic extracapsular extension, and the best results were obtained when both values were used in combination.
El cáncer de próstata es el segundo cáncer más frecuente en los hombres en el mundo (15%) y es la quinta causa de mortalidad por cáncer en esta población (6,6%)1. En Colombia el panorama no difiere y es la segunda causa más frecuente de cáncer en los hombres, con una incidencia de 46,5 por cada 100.000 habitantes y una tasa de mortalidad de 12,6 por cada 100.000 habitantes2.
La selección del tratamiento y el pronóstico de los pacientes con cáncer de próstata dependen de la presencia de extensión extracapsular (EEC). Para los casos de cáncer de próstata localizado la prostatectomía radical es el tratamiento de elección, con altas tasas de sobrevida3.
A los pacientes con cáncer de próstata localizado se les hace una estratificación clínica del riesgo, según la cual se toman decisiones en cuanto al manejo (prostatectomía radical con o sin terapia adyuvante) y se predice el riesgo de EEC y de posible recaída bioquímica posterior a la prostatectomía, que puede presentarse hasta en el 15-40% de los casos4–7. Esta estratificación se hace dependiendo del resultado del antígeno prostático específico (PSA), el tacto rectal y el grupo histológico de Gleason8. La evaluación de Gleason se calcula a partir de la suma de los dos patrones de crecimiento más prevalentes del tejido biopsiado, y con el puntaje obtenido se hace una clasificación en cinco grupos-grados (1: ≤6; 2: 3+4=7; 3: 4+3=7; 4: 8; y 5: 9 y 10), siendo el grupo-grado 1 de bajo riesgo y los grupos-grados 4-5 de alto riesgo9,10.
Lamentablemente, con el uso de estos parámetros clínicos se encuentra una subestadificación del 59%11, con presencia de EEC microscópica del 20% al 50% de las piezas quirúrgicas que habían sido clasificadas inicialmente como cáncer de próstata localizado12,13. Es por esto que se realiza una resección quirúrgica amplia que incluye el paquete neurovascular, lo que conlleva disfunción eréctil como posible complicación14. Debido a esta situación, la determinación de EEC es crucial para lograr un mejor desenlace quirúrgico, con menor comorbilidad y un mejor resultado oncológico15.
La resonancia magnética multiparamétrica (RMmp) es el mejor método de imagen para realizar la estadificación tumoral de esta neoplasia. Utiliza secuencias anatómicas (T1 y T2) y secuencias funcionales (difusión y dinámica posterior a la administración de contraste). Para el diagnóstico de EEC normalmente se usan los criterios convencionales en secuencias T216,17; es así como en el año 2011 la Sociedad Europea de Radiología Urogenital estableció los criterios PI-RADS y se determinó una puntuación para predecir el compromiso extracapsular (1 a 5 puntos) usando las secuencias T2. Estos criterios evalúan el contacto capsular (1 punto), la irregularidad capsular (3 puntos), el engrosamiento del paquete neurovascular (4 puntos), el abombamiento o la pérdida capsular (4 puntos) y la enfermedad extracapsular evidente (5 puntos). Con una puntuación ≥4 se considera probable la presencia de EEC8. En 2015 se realizó una actualización de PI-RADS (versión 2), en la cual no hubo cambios en estos criterios de EEC, pero se destacó el papel de las secuencias DWI-mapa del coeficiente de difusión aparente (ADC) y de la longitud de contacto del tumor con la cápsula (LCT) en la predicción de EEC18.
En la literatura se ha encontrado una gran variabilidad en los valores de sensibilidad y especificidad usando estos criterios convencionales (T2). En un metaanálisis del año 2015 se identificó una sensibilidad baja, del 53% (intervalo de confianza del 95% [IC95%]: 44-63%), y una especificidad alta, del 91% (IC95%: 88-93%)19.
Ante el panorama de subestadificación clínica y la amplia variabilidad de la sensibilidad y la especificidad usando los criterios convencionales de T2 para el diagnóstico prequirúrgico de EEC, en los últimos años se han estudiado nuevos marcadores (cuantitativos) en RMmp, como son la LCT y los valores cuantitativos del mapa ADC. Hasta la fecha existen muy pocos estudios en la literatura y estos marcadores de imagen se han evaluado solo de forma independiente.
Por lo tanto, el objetivo de este estudio es evaluar el rendimiento diagnóstico de la cuantificación del mapa ADC y de la LCT, de manera individual y conjunta, en la predicción de EEC microscópica en pacientes con cáncer de próstata, utilizando el espécimen de prostatectomía radical como estándar de referencia.
MétodoSe realizó un estudio de pruebas diagnósticas con revisión de datos retrospectiva, a partir de historias clínicas de pacientes con diagnóstico confirmado de cáncer de próstata de moderado y alto riesgo tratados con prostatectomía radical en un centro de referencia de patología prostática, entre mayo de 2011 y diciembre de 2013. El estudio contó con la aprobación del comité de ética e investigación institucional, el cual no consideró necesario obtener el consentimiento informado dada la naturaleza observacional y retrospectiva del estudio.
PacientesSe incluyeron la totalidad de los pacientes con cáncer de próstata tratados en la institución con prostatectomía radical a quienes se les realizó RMmp durante su valoración prequirúrgica.
Se excluyeron del estudio: 1) los pacientes con antecedente de cáncer de próstata que hubieran recibido radioterapia o terapia de reemplazo hormonal; 2) los pacientes con signos evidentes de EEC en las secuencias ponderadas en T2; 3) los pacientes con RMmp en las que no se evidenciara contacto del tumor con la cápsula prostática; y 4) los pacientes cuyas imágenes tuvieran artefactos técnicos que no permitiesen el cálculo certero de los valores en mapas de ADC.
Método de imagenA todos los pacientes se les practicó RMmp de próstata en un equipo superconductor de 1,5T, Signa Excite HDxT (GE Medical Systems®, Milwaukee, Wisconsin, EE.UU.) con antena pélvica (phase array 16 canales). Se incluyeron imágenes de alta resolución con secuencias ponderadas en T1 (plano axial, TR/TE, 500/11,48, grosor del corte/gap 3mm/0mm, campo de visión 240mm y matriz 256×256), T2 (planos axial, sagital y coronal, TR/TE 4300/61, grosor del corte/gap 3mm/0mm, campo de visión 180mm y matriz 256×256), secuencias dinámicas tras la administración de medio de contraste (plano axial, TR/TE 3,3/1,5, grosor del corte 3mm, campo de visión 180mm y matriz 256×192) y secuencias de difusión-mapa ADC (plano axial, valores b200, b500, b800 s/mm2, TR/TE, 4725/91, grosor del corte 3mm, campo de visión 280mm y matriz 256×256).
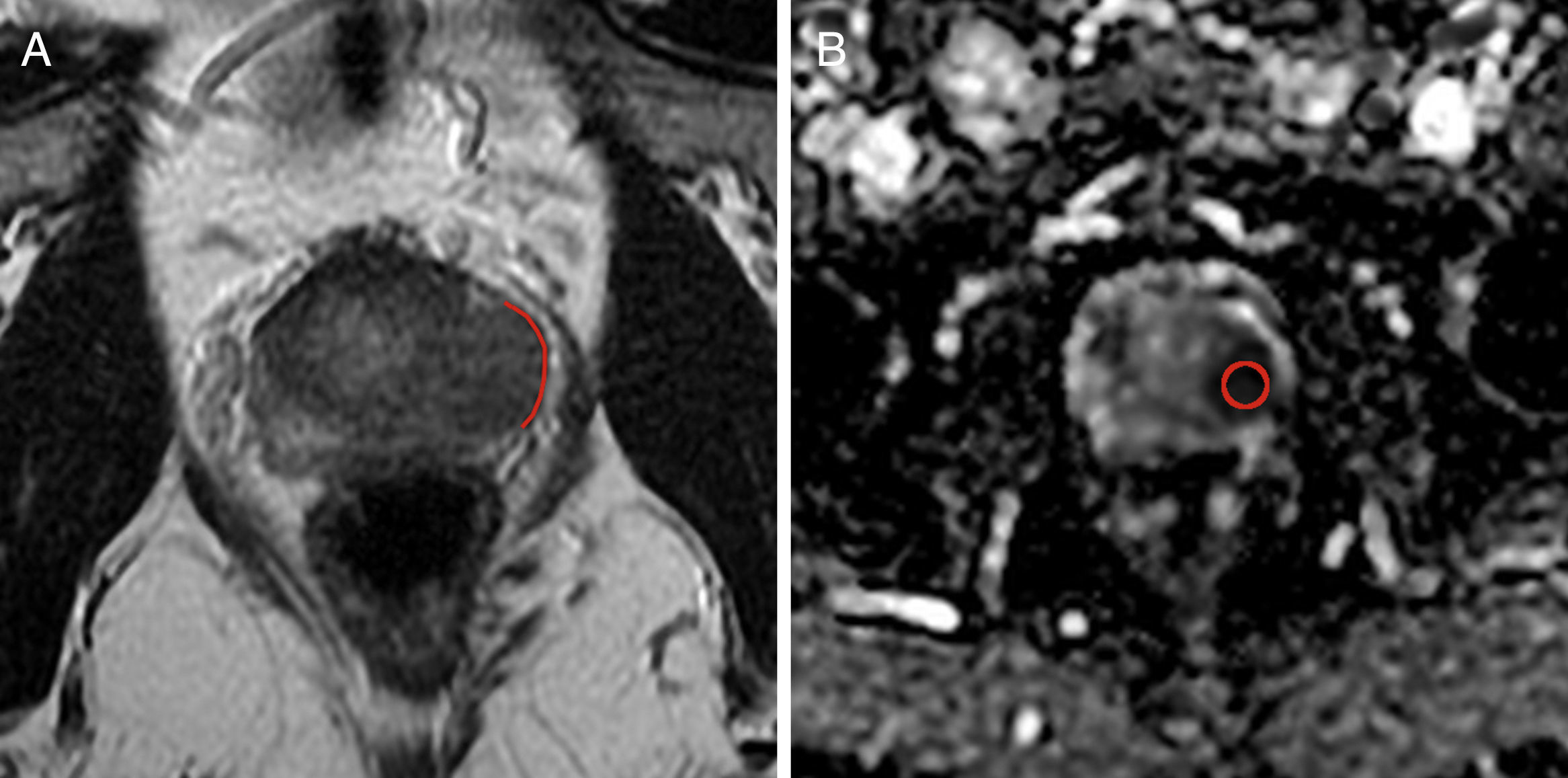
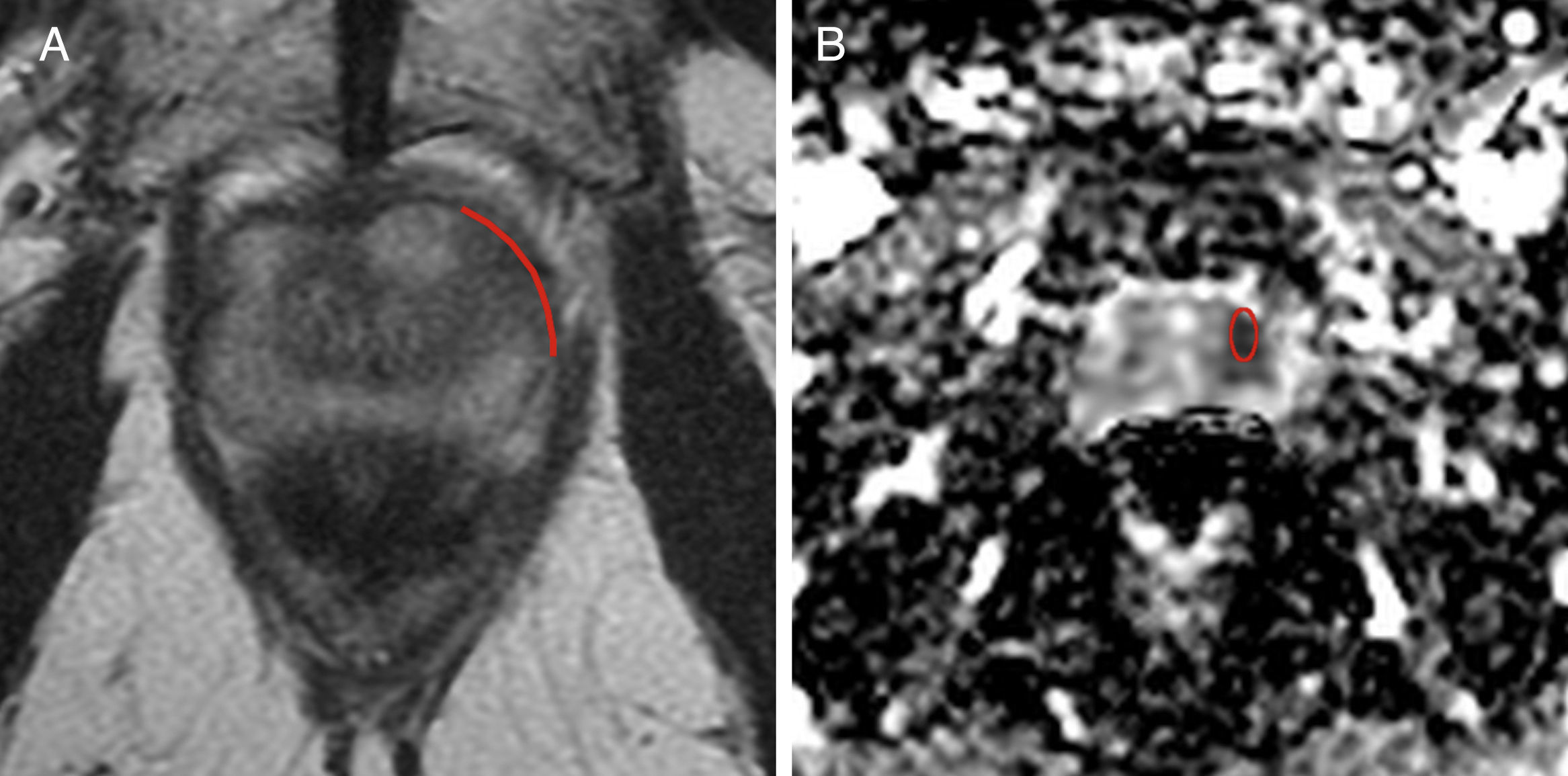
Un radiólogo identificó la lesión diana por patología y posteriormente la localizó en las imágenes potenciadas en T2 y ADC b800. En la estación de trabajo Advantage WorkStation (GE Medical Systems®, Milwaukee, Wisconsin, EE.UU.) se estimaron los valores de ADC mediante el uso de una región de interés en la lesión descrita, y se obtuvieron el valor y la desviación estándar del mapa de ADC b800. Así mismo se calculó la medida en milímetros de la LCT en la lesión con mayor contacto con la cápsula visualizada en los cortes axiales de T2, mediante una función métrica digitalizada de la estación de trabajo (figs. 1 y 2).
Paciente de 51 años de edad con cáncer de próstata Gleason 8 (4+4), localizado en la zona periférica del tercio medio del lado izquierdo. A) Imagen axial en T2, en la cual la línea roja representa la medición de la longitud del contacto tumoral con la cápsula, que es de 19,7mm. B) Imagen axial del mapa de coeficiente de difusión aparente (b 800) con un valor de 0,645×10−3 mm2/s. Esta lesión presentó extensión extracapsular microscópica en el análisis de patología.
Paciente de 65 años de edad con cáncer de próstata Gleason 8 (4+4), localizado en la zona periférica anterior del tercio medio izquierdo. A) Imagen axial en T2, en la cual la línea roja representa la medición de la longitud del contacto tumoral con la cápsula, que es de 26,5mm. B) Imagen axial del mapa de coeficiente de difusión aparente (b 800) con un valor de 0,798×10−3 mm2/s. Esta lesión presentó extensión extracapsular microscópica en el análisis de patología.
Posterior a la prostatectomía radical, un patólogo con 12 años de experiencia en enfermedades del sistema genitourinario realizó un estudio minucioso de la pieza quirúrgica usando el siguiente protocolo: se obtuvieron secciones de corte con un grosor de 3mm, primero en el plano axial, luego en el plano sagital y por último en cuadrantes del ápex a la base. Se hicieron cortes de 3μm y se realizó coloración con hematoxilina-eosina. Se definió EEC como la presencia de células cancerosas fuera de la cápsula prostática, y posteriormente se determinó si la EEC era focal/microscópica (extensión radial <0,5mm) o evidente/macroscópica (cuando superaba esta extensión). En la literatura, en algunos estudios se ha definido EEC focal como la identificación de células cancerosas más allá de la cápsula en una extensión radial <0,5mm, y en otros estudios <2 mm20,21.
Igualmente se determinó el grado Gleason según los patrones de crecimiento más prevalentes en la pieza quirúrgica, con lo cual se clasificó en uno de los cinco grupos-grados establecidos en la literatura9.
Análisis estadísticoPara el análisis de la información se utilizaron los programas STATA 13® (Stata Inc, College Station, Texas, EE.UU.) y SPSS 21® (SPSS, Chicago, Illinois, EE.UU.). Se realizó un análisis univariado para establecer las frecuencias relativas de las variables categóricas. Se calcularon las medidas de tendencia central y dispersión de las variables cuantitativas, entre ellas la edad de los pacientes, el PSA y los valores de ADC y LCT en los pacientes discriminados por categoría de Gleason. Se realizó un análisis bivariado para evaluar la asociación mediante la prueba t de Student para determinar las diferencias entre las medias de los valores de ADC y LCT en los pacientes con y sin EEC.
Se determinaron las características operativas de los mapas de ADC y de la LCT empleando como referencia la EEC microscópica descrita en patología. A partir del área bajo la curva ROC, se establecieron puntos de corte óptimos.
Se desarrolló un modelo de regresión logística tomando como variables independientes el valor de ADC y la LCT, y como variable dependiente la EEC definida por el espécimen de patología como referencia. Se realizó un análisis de curvas ROC para evaluar el desempeño operativo del modelo de predicción para la EEC microscópica. Se consideró estadísticamente significativo un valor de p <0,05.
ResultadosEn la muestra total de 92 pacientes se encontró que el promedio de edad fue de 61 años (39-78 años), el valor promedio del PSA fue de 9,25ng/ml (4,9 a 12ng/ml) y la mayoría (66%) de los pacientes tenían un puntaje Gleason de 7 (grupos-grados 2 y 3), tal como se resume en la tabla 1.
Características demográficas y clínicas de los pacientes
| Características | |
|---|---|
| Edad (años), media±(DE) | 61±7,3 |
| PSA al momento del diagnóstico (ng/ml), media±DE | 9,25±7,0 |
| Grupo-grado (Gleason) según espécimen quirúrgico (N=92), n (%) | |
| Grupo-grado 1 (≤6) | 9 (9,7) |
| Grupo-grado 2 (3+4) | 34(36,9) |
| Grupo-grado 3 (4+3) | 27(29,3) |
| Grupo-grado 4 (8) | 12 (13) |
| Grupo-grado 5 (≥9) | 10 (10,8) |
DE: desviación estándar; PSA: antígeno prostático específico.
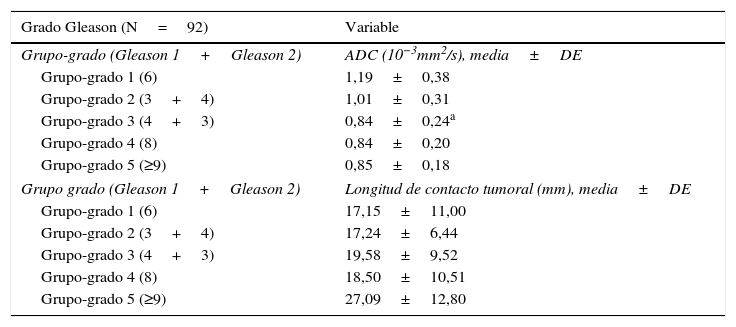
Al comparar los valores de ADC con los puntajes Gleason, se encontró que los pacientes con Gleason de grupo-grado 3 (4+3) presentaron el valor más negativo de ADC, con una media de 0,84±0,24×10−3 mm2/s, y les seguían en orden descendente los valores de ADC correspondientes a los puntajes de los grupos-grados 4 y 5, con una media de 0,85±0,18×10−3 mm2/s y 0,88±0,27×10−3 mm2/s, respectivamente. Se identificó una diferencia significativa (p=0,03) entre los valores de ADC de Gleason del grupo-grado 2 (3+4) y el grupo-grado 3 (4+3), con valores de 1,0±0,31×10−3 mm2/s y 0,84±0,24×10−3 mm2/s, respectivamente (tabla 2).
Distribución del valor del coeficiente de difusión aparente y la longitud de contacto tumoral según Gleason
| Grado Gleason (N=92) | Variable |
|---|---|
| Grupo-grado (Gleason 1+Gleason 2) | ADC (10−3mm2/s), media±DE |
| Grupo-grado 1 (6) | 1,19±0,38 |
| Grupo-grado 2 (3+4) | 1,01±0,31 |
| Grupo-grado 3 (4+3) | 0,84±0,24a |
| Grupo-grado 4 (8) | 0,84±0,20 |
| Grupo-grado 5 (≥9) | 0,85±0,18 |
| Grupo grado (Gleason 1+Gleason 2) | Longitud de contacto tumoral (mm), media±DE |
| Grupo-grado 1 (6) | 17,15±11,00 |
| Grupo-grado 2 (3+4) | 17,24±6,44 |
| Grupo-grado 3 (4+3) | 19,58±9,52 |
| Grupo-grado 4 (8) | 18,50±10,51 |
| Grupo-grado 5 (≥9) | 27,09±12,80 |
ADC: coeficiente de difusión aparente; DE: desviación estándar.
Al evaluar la media de LCT con los puntajes Gleason, se encontró el menor valor en el grupo-grado 1, con 17,15±11,00mm, y el mayor valor en el grupo-grado 5, con 27,09±12,80mm; sin embargo, no se encontraron diferencias significativas en estos valores, como se observa en la tabla 2.
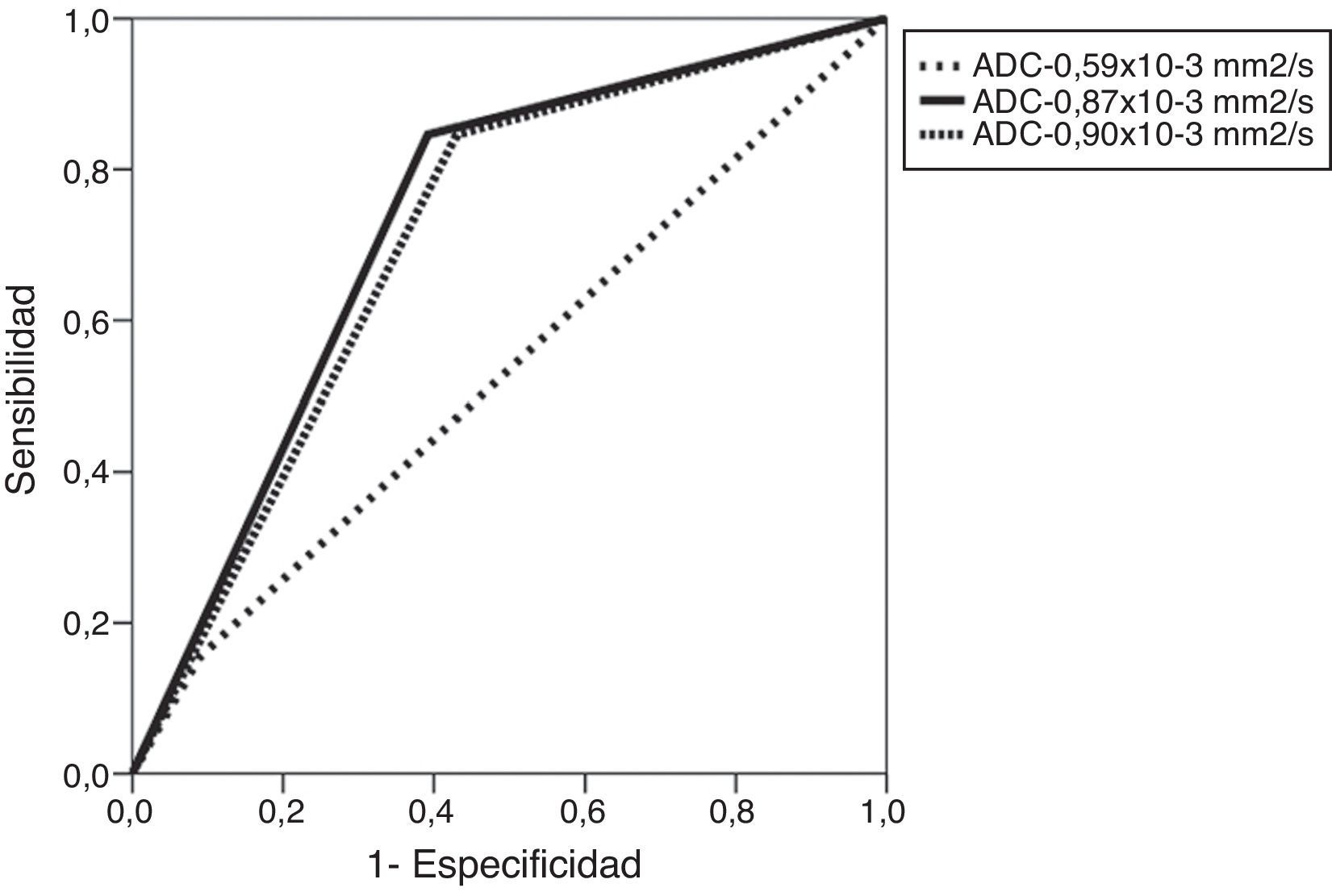
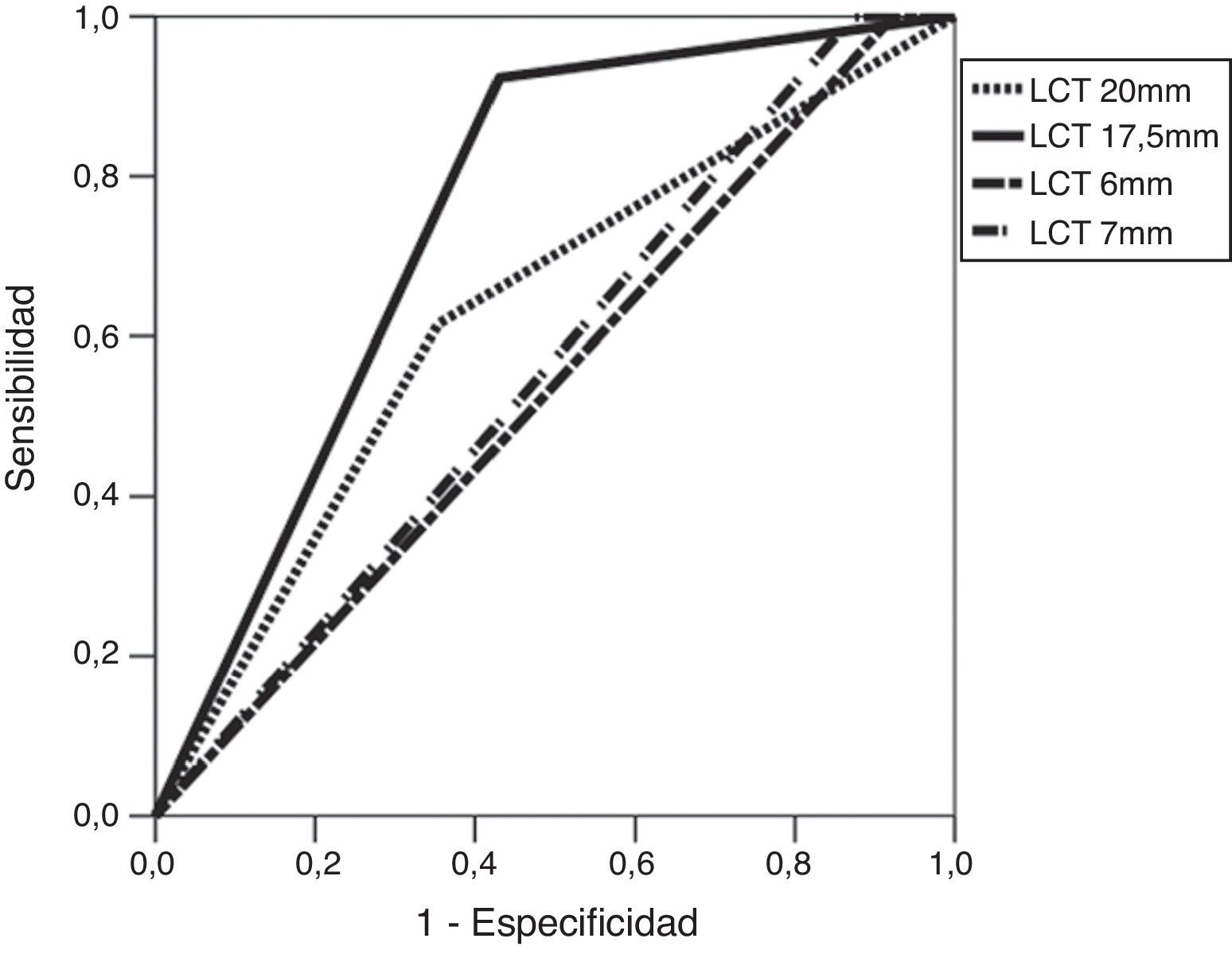
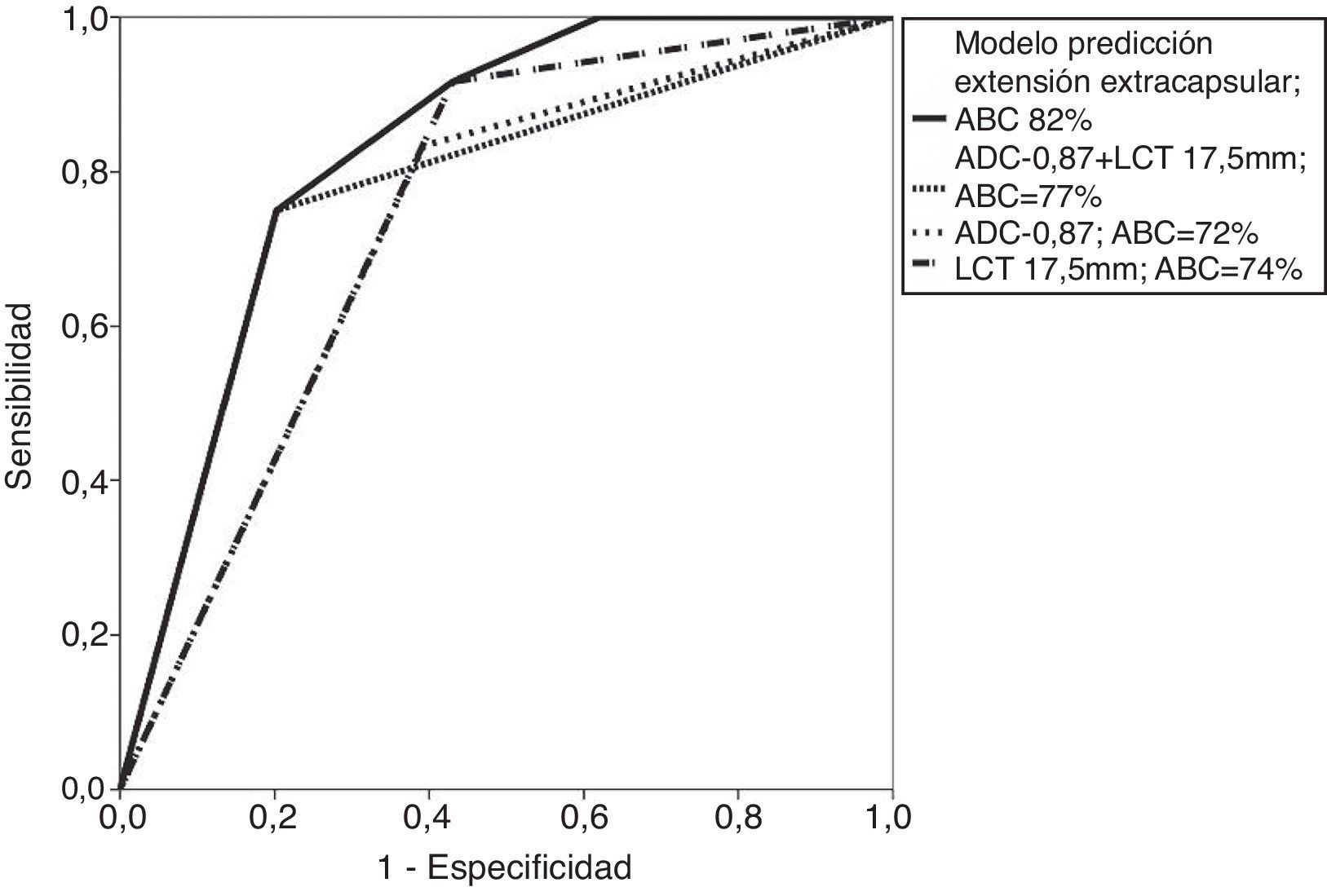
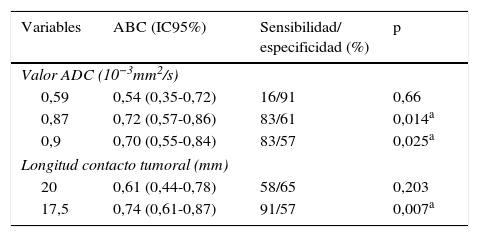
Al evaluar los valores de ADC para predecir EEC microscópica se tomaron tres puntos de corte (0,59, 0,87 y 0,9×10−3 mm2/s) y se identificó que la mayor área bajo la curva (ABC) era del 72% para el punto de corte 0,87×10−3 mm2/s (tabla 3 y fig. 3). Así mismo, para este punto de corte (0,87×10−3 mm2/s) se obtuvo una sensibilidad de 83% y una especificidad del 61% para predecir EEC microscópica, la cual fue estadísticamente significativa (p=0,014). De la misma forma se evidenció que, con un punto de corte de 17,5mm para la LCT, se obtiene la mayor ABC (74%) para predecir EEC microscópica, y al compararlo con un punto de corte de 20 mm2 se encontró un ABC mucho menor, del 61%. Con el punto de corte de 17,5 mm2 se definió una sensibilidad alta, del 91%, y una especificidad del 57%, que también fueron estadísticamente significativos (p=0,007) (tabla 3 y fig. 4).
Características receptor-operador y áreas bajo la curva para el diagnóstico de extensión extracapsular microscópica
| Variables | ABC (IC95%) | Sensibilidad/ especificidad (%) | p |
|---|---|---|---|
| Valor ADC (10−3mm2/s) | |||
| 0,59 | 0,54 (0,35-0,72) | 16/91 | 0,66 |
| 0,87 | 0,72 (0,57-0,86) | 83/61 | 0,014a |
| 0,9 | 0,70 (0,55-0,84) | 83/57 | 0,025a |
| Longitud contacto tumoral (mm) | |||
| 20 | 0,61 (0,44-0,78) | 58/65 | 0,203 |
| 17,5 | 0,74 (0,61-0,87) | 91/57 | 0,007a |
ABC: área bajo la curva; ADC: coeficiente de difusión aparente; IC95%: intervalo de confianza del 95%.
No se encontraron diferencias significativas en los valores de ADC entre los pacientes con EEC microscópica (media: 0,82; desviación estándar [DE]: 0,26×10−3 mm2/s) y sin EEC (media: 0,94; DE: 0,29×10−3 mm2/s) (p=0,11), mientras que sí fue posible identificar diferencias significativas en los valores de LCT entre los pacientes con EEC microscópica (media: 23,48; DE: 6,96mm) y sin EEC (media: 18,4; DE: 9,68mm) (p=0,03). Sin embargo, al realizar un análisis de regresión logística binominal se comprobó que, para el valor de ADC, un punto de corte de 0,87×10−3 mm2/s es un predictor de EEC microscópica con resultados estadísticamente significativos (p=0,02) (coeficiente: 1,89; intervalo de confianza del 95% [IC95%]: 0,27±3,52); para la LCT, un punto de corte de 17,5mm también es un predictor estadísticamente significativo de EEC microscópica (p=0,037) (coeficiente: 2,26; IC95%: 0,13±4,39).
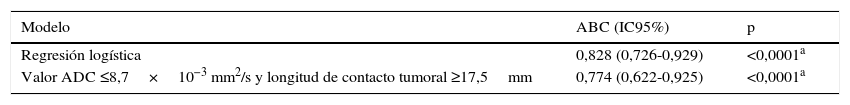
Al combinar los puntos de corte del valor de ADC (0,87×10−3 mm2/s) y de la LCT (17,5mm) se obtuvo un ABC mayor que la encontrada de forma independiente: del 77%, con una sensibilidad de 77% y una especificidad del 61%. Sin embargo, al evaluar estos puntos de corte de forma conjunta en un modelo de regresión logística aumentó el ABC a un 82%. Estos valores fueron estadísticamente significativos, con p <0,0001, como se ve en la tabla 4 y la figura 5.
Características receptor-operador y áreas bajo la curva para el diagnóstico de extensión extracapsular microscópica mediante el modelo de regresión logística y la presencia de un valor de coeficiente de difusión aparente ≤0,87×10−3 mm2/s y una longitud de contacto tumoral ≥17,5mm
| Modelo | ABC (IC95%) | p |
|---|---|---|
| Regresión logística | 0,828 (0,726-0,929) | <0,0001a |
| Valor ADC ≤8,7×10−3 mm2/s y longitud de contacto tumoral ≥17,5mm | 0,774 (0,622-0,925) | <0,0001a |
ABC: área bajo la curva; ADC: coeficiente de difusión aparente; IC95%: intervalo de confianza del 95%.
Curvas ROC para la predicción de la extensión extracapsular empleando los puntos de corte óptimos obtenidos para los valores cuantitativos del mapa del coeficiente de difusión aparente y la longitud de contacto tumoral con la cápsula, el uso conjunto de estos criterios y el modelo de regresión logística calculado.
La elección del tratamiento y el pronóstico de los pacientes con cáncer de próstata dependen de la presencia o no de EEC, reservándose la prostatectomía radical para pacientes con cáncer de próstata localizado (sin EEC). Actualmente, el diagnóstico prequirúrgico usando solo criterios clínicos en cáncer de próstata de moderado y alto riesgo presenta una subestadificación del 59%11, y después de la cirugía se ha hallado EEC microscópica en un 20-50% de los casos12,13. Incluso al usar los criterios convencionales (T2) de RMmp para el diagnóstico de EEC se ha encontrado una gran variabilidad en la sensibilidad y la especificidad en los diferentes estudios. Así, en un metaanálisis (30 estudios) se encontró una sensibilidad baja, del 53% (IC95%: 44-63%), y una especificidad alta, del 91% (IC95%: 88-93%)19. En otros artículos la variabilidad es mayor, con sensibilidades del 13% al 95% y especificidades del 49% al 97%23. El diagnóstico de EEC microscópica (focal) usando estos criterios convencionales de T2 es mucho menor que el diagnóstico de EEC establecida o macroscópica (50% vs. 69%)24; de ahí la importancia de mejorar el diagnóstico prequirúrgico en la estadificación local de estos pacientes al usar nuevas herramientas cuantitativas de RMmp.
En el presente estudio se evaluaron dos criterios cuantitativos para predecir EEC microscópica, la LCT y la cuantificación del mapa de ADC, ya que se ha visto que añadir estas medidas cuantitativas a los criterios convencionales T2 mejora el diagnóstico de EEC, como se ha reportado en estudios recientes20–22,25. Es por ello que en la actualización de los criterios PI-RADS (versión 2) del año 2015 se hace la anotación de que el uso de la LCT y la cuantificación del mapa de ADC pueden usarse como buenos predictores de EEC18.
En este estudio se encontraron diferencias significativas en las medias de LCT entre los pacientes con y sin EEC microscópica (p=0,03), pero no en las medias de los valores de ADC (p=0,11). El punto de corte óptimo para el valor de ADC fue de 0,87×10−3 mm2/s, con ABC del 72%, sensibilidad del 83% y especificidad del 61%, y para la LCT fue de 17,5mm, con ABC del 74%, sensibilidad del 91% y especificidad del 57%, los cuales fueron estadísticamente significativos (p=0,014 y p=0,007, respectivamente).
Los resultados de nuestro estudio son similares a los hallados en la literatura. En un estudio de Baco et al.22 (111 pacientes, equipo de 1,5T y antena pélvica) se encontró un punto de corte similar para LCT (20mm), con ABC del 88%, sensibilidad del 79% y especificidad del 85%. Sin embargo, en otro estudio realizado por Rosenkrantz et al.20 (90 pacientes, equipo de 3T y antena pélvica), el punto de corte para LCT (6mm) fue menor que en nuestro estudio y que en el de Baco et al.22, con ABC del 81,3%, sensibilidad del 80,4% al 89,1% y especificidad del 73,1% al 74,6%20, hallazgo que parece de difícil reproducción en cualquier escenario clínico a pesar de las diferencias en los equipos de adquisición de las imágenes. Las razones de las diferencias entre estos puntos de corte para la LCT no son claras20.
Los valores de ADC también son similares a los referidos en la literatura. En un estudio de Woo et al.25, un punto de corte de 0,893×10−3 mm2/s presenta un ADC del 75%, una sensibilidad del 92% y una especificidad del 55%. En otro estudio, realizado por Chong et al.26, se evidenciaron valores similares de ADC, con una media de 0,883±0,18×10−3 mm2/s, con diferencias significativas (p <0,001) entre pacientes con EEC (0,729±0,15×10−3 mm2/s) y sin EEC (0,985±0,23×10−3 mm2/s).
Al comparar las características del presente estudio con los estudios de la literatura antes mencionados encontramos que son similares. Todos fueron estudios retrospectivos. En cuanto al número de pacientes, en el presente estudio se incluyeron 92 pacientes y en los otros el rango fue de 69 a 117 pacientes. De igual forma, en estos estudios se usó antena pélvica como la utilizada en el presente estudio. Con respecto a la unidad de RMmp utilizada, en el estudio de Baco et al.22 también usaron un equipo de resonancia de 1,5T, pero en los otros tres estudios utilizaron una unidad de resonancia de 3 T20,25,26. Se ha discutido ampliamente el beneficio de usar equipos de resonancia de 3T en vez de 1,5T, y antena pélvica en vez de antena endorrectal. En el último consenso PI-RADS del año 2015 (versión 2) se concluyó que, aunque 3T es superior a 1,5T, los dos equipos permiten un adecuado diagnóstico cuando se usan con los parámetros apropiados y optimizados. Aunque no recomienda el uso sistemático de antena endorrectal, sí sugiere su uso en equipos de resonancia de 1,5T para mejorar la calidad de la imagen18.
No se han publicado estudios que evalúen de manera conjunta estos criterios cuantitativos (LCT+ADC). En este estudio se encontró que la suma de estos dos criterios mejora el ABC (77%), e incluso al usar un modelo de regresión logística aumentó aún más el ABC (al 82%), lo cual fue mayor (y estadísticamente significativo) que las ABC obtenidas empleando cada criterio por separado.
Con la evidencia presentada se considera que es posible usar el valor de ADC y la LCT para su medición sistemática en RMmp en los pacientes con cáncer de próstata, con el fin de realizar una mejor estadificación prequirúrgica y una planificación quirúrgica más precisa, que disminuya las recidivas locales y los efectos secundarios tras la cirugía, como la disfunción eréctil y la incontinencia.
Como punto fuerte destacamos que no hemos encontrado en la literatura ningún estudio que evalúe la LCT y el valor de ADC como valores cuantitativos para predecir EEC microscópica, y por tanto el nuestro sería el primero en relacionar estos parámetros.
Como limitaciones cabe considerar que es un estudio retrospectivo y que el número de pacientes es escaso. Para estudios posteriores debería incluirse una población mayor, deberían ser estudios prospectivos y la evaluación de las imágenes deberían realizarla más de un radiólogo.
Consideramos que los resultados de este estudio permiten la aplicación de nuevos criterios cuantitativos en RMmp para el diagnóstico de EEC, específicamente su afectación microscópica, para mejorar la planificación quirúrgica y el pronóstico de estos pacientes con cáncer de próstata de moderado y alto riesgo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Autoría- 1.
Responsable de la integridad del estudio: DCFC, DAA.
- 2.
Concepción del estudio: MFGS, CMPA, DCFC, DAA y JR.
- 3.
Diseño del estudio: MFGS, CMPA, DCFC y DAA.
- 4.
Obtención de los datos: DCFC, DAA, JR y MP.
- 5.
Análisis e interpretación de los datos: MFGS, DAA y CMPA.
- 6.
Tratamiento estadístico: MFGS, DAA y CMPA.
- 7.
Búsqueda bibliográfica: DAA.
- 8.
Redacción del trabajo: MFGS, CMPA, DCFC, DAA, JR y MP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MFGS, CMPA, DCFC, DAA, JR y MP.
- 10.
Aprobación de la versión final: MFGS, CMPA, DCFC, DAA, JR y MP.