Para la ablación pulmonar con radiofrecuencia no solo son necesarias habilidades intervencionistas. Tras seleccionar adecuadamente al paciente, hay que coordinar las actuaciones previas, durante y posteriores al procedimiento. Conocer las variantes de la técnica, las precauciones, las complicaciones, los riesgos y las recomendaciones para el seguimiento garantizará la seguridad del paciente. Diferenciar precozmente en las pruebas de imagen el tejido tumoral de los cambios normales secundarios al tratamiento permitirá volver a tratar pronto al paciente, lo que aumentará su supervivencia. El objetivo de este trabajo es describir cómo coordinar y realizar la ablación pulmonar con radiofrecuencia, sus complicaciones y la evidencia actual en el seguimiento.
Pulmonary radiofrequency ablation requires more than just interventional radiology skills. Patients must be selected carefully, and the acts that need to be done before, during, and after the procedure must be coordinated. To guarantee patient safety, radiologists need to know the variants of the technique, the precautions that must be taken, the complications that can occur, and the risks involved. Early differentiation between tumor tissue and normal changes secondary to treatment on imaging tests will make it possible to repeat the treatment without delays, and this will increase survival. This article describes how to coordinate and carry out pulmonary radiofrequency ablation, the complications of the technique, and the current evidence in follow-up.
La ablación con radiofrecuencia (ARF) es una alternativa actual para tratar las neoplasias pulmonares localizadas con recomendaciones concretas1,2. Tan importante como conocer el procedimiento es coordinar las actuaciones del proceso, desde seleccionar adecuadamente al paciente en un comité multidisciplinar que garantice la mejor alternativa terapéutica posible, hasta realizar la ARF sin demora pero con el menor riesgo y el mínimo impacto de las complicaciones. Es fundamental seguir la lesión con un método que detecte precozmente la persistencia tumoral local, que tratada con ARF mejora la supervivencia3. El tumor tratado con ablación permanece «in situ» y sufrirá cambios dinámicos secundarios al tratamiento durante largo tiempo. Diferenciarlos de la persistencia o recurrencia tumoral es un reto complejo y solo puede hacerse con pruebas de imagen4–6. El tipo de prueba, el momento, el protocolo técnico y la interpretación correcta serán claves. Nuestro objetivo es describir cómo coordinar y realizar el procedimiento de radiofrecuencia pulmonar, conocer sus complicaciones y la evidencia actual en el seguimiento.
Actuaciones antes del procedimiento- 1.
Determinar el tratamiento óptimo en sesión multidisciplinar7 con el oncólogo, radiólogo experimentado en intervencionismo pulmonar, radioterapeuta, cirujano torácico y neumólogo.
- 2.
Valorar la situación cardiopulmonar y el riesgo de sangrado y corregir posibles contraindicaciones2. La warfarina y el acenocumarol deben retirarse 4-5 días antes8; aunque no hay evidencia firme para retirar los antiplaquetarios9, es recomendable que el ácido acetilsalicílico, el clopidogrel y los antiinflamatorios no esteroideos se retiren 5-7 días antes1,7,10,11, y el resto de antiagregantes, según sus propiedades farmacodinámicas. En procedimientos no complejos debe retirarse una dosis terapéutica previa de heparina subcutánea de bajo peso molecular o derivados, y en los complejos, dos dosis11. La espirometría pulmonar es útil en pacientes con enfermedad pulmonar difusa o cirugía pulmonar, pero no se realiza sistemáticamente12. El paciente debe realizar una entrevista preanestésica.
- 3.
Excluir la enfermedad diseminada y valorar la necesidad de confirmar la malignidad. Se recomienda una TC en el mes previo a la ARF para estadificar la neoplasia, establecer, según el tamaño, la localización y los riesgos, si se puede tratar con ARF y planificar el abordaje13. Realizar PET-TC o RM antes del procedimiento dependerá del tumor primario12. La PET-TC es especialmente útil para detectar adenopatías y metástasis hematógenas con avidez por la flurodeoxiglucosa, como las de mama y colon14, que cambiarían la estrategia terapéutica15. Conviene estudiar anatomocitológicamente la lesión si hay sospecha de tumor primario pulmonar16,17, pero con el tiempo suficiente para que se resuelva una eventual hemorragia pospunción, que interferiría para realizar la ARF15,18 y para evaluar su resultado inmediato. Recomendamos realizarla el mismo día de la TC previa a la ARF. Confirmar anatomocitológicamente una metástasis no es generalmente necesario si la apariencia radiológica es típica17. Conviene realizar el consentimiento informado en las semanas previas al procedimiento, aclarar que las complicaciones graves son excepcionales19,20 e insistir en que tomen la medicación la mañana del procedimiento (antihipertensivos, medicación cardíaca y la mitad de la dosis habitual de insulina)19. Generalmente conviene no tratar a la vez lesiones en los dos pulmones y espaciar su tratamiento semanas, para evitar complicaciones bilaterales graves simultáneas, como la hemorragia o el neumotórax. Estudios de centros con experiencia, pero con tamaño muestral moderado (n=27), lo consideran factible en casos seleccionados21. Sí pueden tratarse varias lesiones unilaterales en la misma sesión12.
Aunque no se ha demostrado la efectividad de la antibioterapia profiláctica, el tejido desvitalizado puede ser un foco de infección16. Algunos autores la recomiendan sistemáticamente22, y otros antes del procedimiento en pacientes con prótesis valvulares o articulares, y después en pacientes con movilidad disminuida o EPOC, para reducir el riesgo de neumonía1,10. Debe hacerse 30-60 minutos antes por la vía venosa que lleva el paciente. Deben quitarse joyas y objetos metálicos10. Se coloca al paciente en la mesa de la TC según criterio del radiólogo, como para una biopsia pulmonar. La TC es la única modalidad precisa como guía de imagen pulmonar12,20,23. La posición en supino o prono reduce el riesgo de movimiento y de desplazamiento del electrodo respecto a la lateral u oblicua10. Cuanto más baja esté la mesa, más espacio habrá dentro del gantry10. Para disminuir el riesgo de quemaduras, se colocan las almohadillas conductivas en las piernas, con las piernas separadas, o en la pared torácica contralateral al lugar a tratar, contactando con la piel en toda su superficie, sin pliegues y lo más equidistantes de la zona a tratar. Deben chequearse tras cada movilización del paciente y durante la ablación para evitar un calentamiento excesivo16. Se monitorizan los signos vitales (saturación de oxígeno, frecuencia respiratoria, pulso, electrocardiograma, tensión arterial) y se suministra oxígeno con mascarilla10,24. Se realiza la TC sin contraste intravenoso (CIV) para planificar el trayecto exacto de la aguja, de manera que la punta activa quede en el centro del tumor siguiendo su eje longitudinal19. Puede angularse el gantry para conseguir un acceso más seguro entre costillas y evitar atravesar vasos, bronquios y cisuras10,16. Una vez decidido el trayecto, se administran 10ml de lidocaína local al 1% hasta la grasa extrapleural con control de TC y se inicia la técnica anestésica. La sedación consciente es la técnica más empleada10,25,26. Coordinar las pausas respiratorias con la introducción de la aguja14,17 y evitar los movimientos torácicos respiratorios amplios10 bajo anestesia general, facilita el procedimiento, mejora su tolerancia12 y aumenta el porcentaje de ablación según algunos autores23. Pero la morbilidad es mayor14 por mayor riesgo de exacerbar un neumotórax27, de hemorragia pulmonar y de fístula bronco-pleural (FBP)10, y también la estancia hospitalaria1. Hay quien la recomienda en tumores múltiples y de acceso difícil12,17, en pacientes con compromiso de la vía aérea, riesgo de sangrado alto o limitación importante de la reserva cardiopulmonar (dependencia de oxígeno, estenosis aórtica, carotídea, enfermedad arterial coronaria grave)1,10, que no tolerarían la ablación con sedación consciente19. Se deben emplear tubos endotraqueales de doble luz, que protegen el pulmón contralateral de una hemorragia1,17. Para la sedación consciente intravenosa se combinan midazolam (0,07–0,08mg/kg), propofol (0,5–2,0mg/kg/h) y fentanilo (0,5–2,0mg/kg/h)24. La dosis debe aumentar al colocar el electrodo y en los primeros minutos de ablación10. El paciente debe permanecer inmóvil sin hablar ni toser, para evitar complicaciones y que se mueva el electrodo10. La superficie pleural debe atravesarse una sola vez10. La punta activa de la aguja debe atravesar al nódulo 0,5cm por cada extremo10. Las reconstrucciones multiplanares de TC serán muy útiles para colocar la aguja12,16. Algunos autores recomiendan emplear la TC fluoroscopia con imágenes en tiempo real, pero debe considerarse el incremento sustancial de radiación para profesionales y paciente12. Podremos tratar lesiones <2cm con una única ablación y, entre 2 y 3cm, con técnicas que aumenten el volumen de ablación2. Para lesiones >3cm conviene valorar otro tratamiento2. Hay que evitar atravesar el tumor con el eje central de los electrodos expansibles, para evitar la siembra tumoral12. Sus puntas activas múltiples deben rodear el tumor y cubrir el margen de seguridad. El resto de las agujas de la piel vecina deben extraerse antes de hacer pasar la corriente. Actualmente no existen protocolos oficiales de ARF. El nivel adecuado de impedancia10,19, el número y duración de los ciclos varían según las especificaciones de cada generador16. La temperatura máxima debe estar entre 60 y 100°C10. Con el sistema Cool-tip se activa el sistema de refrigeración de la aguja y, a continuación, el paso de corriente, bajo control de impedancia. En el pulmón es recomendable comenzar con baja potencia (35W) y aumentarla progresivamente, a diferencia de los órganos sólidos15,16, para evitar la carbonización (se traduce en un aumento brusco de impedancia). En caso de carbonización debe recolocarse el electrodo alejándolo del tejido carbonizado para que el calor y la corriente puedan difundir. La aparición de «picos» repetidos de impedancia (aproximadamente 90 en 60 segundos) bajo modulación de la potencia indica que el tejido que rodea al electrodo ha sido tratado con éxito20. Al final se valoran los efectos del tratamiento con TC10,20. Si el tumor no se rodea completamente de un halo en «vidrio deslustrado» (HVD) de 0,5-1cm, o no se han alcanzado 60°C, se continúa con otro ciclo. Debe reposicionarse la aguja, manteniéndola «caliente», hacia la zona no rodeada por HVD10 sin sobrepasar la pleura para disminuir el riesgo de neumotórax10. Finalizado el tratamiento, retiramos el electrodo cauterizando el trayecto (no es necesario en electrodos expansibles) y valoramos complicaciones con TC. El paciente se coloca con el hemitórax tratado abajo, para minimizar el riesgo de neumotórax10 y de aspiración de una hemorragia. Oxigenarlo con mascarilla favorece la reabsorción de neumotórax pequeños10. Se debe monitorizar al paciente y controlar el dolor en reanimación durante 2-3 horas20,27. Se realiza una radiografía de tórax en decúbito supino, entre una4 y 4 horas después del procedimiento17,27 y una TC torácica sin y con CIV al día siguiente para evaluar complicaciones y el resultado del tratamiento. Si no hay complicaciones, se da el alta 24 horas después de la ARF. Existen recomendaciones de alta a las 3-4 horas10,20 con control a las 24 horas con una radiografía19. A la semana se hace una radiografía de tórax posteroanterior y lateral y se evalúa al paciente en consulta4.
SeguimientoA. ¿Por qué con pruebas de imagen?
En una ARF el tumor permanece «in situ» y no es posible asegurar anatomopatológicamente la necrosis tumoral completa ni la ausencia de diseminación linfática. Únicamente podemos valorar el resultado radiológicamente4–6. El estudio citológico (punción-aspiración) de los márgenes de ablación puede dar resultados falsos negativos porque se haga en una zona sin células tumorales, y falsos positivos por células tumorales muertas, en proceso de apoptosis inducida por hipertermia4, pero con apariencia errónea de viabilidad al estar preservada la arquitectura tisular tras la ablación (células fantasma)4. La biopsia tiene más valor diagnóstico, pero sigue teniendo falsos negativos4.
Además de valorar el resultado inmediato y evolutivo del tratamiento, detectar complicaciones10,17,19, diseminación tumoral y tumores metacrónicos4 también compete a las pruebas de imagen.
B. ¿Con qué prueba?
No hay directrices sobre la prueba ideal. La TC y la PET-TC se emplean más4-6,15,17–20,28. Muchos autores consideran a la PET-TC más sensible y específica para evaluar la respuesta4,23,26,27 y la recomiendan para el seguimiento4,5, pero son necesarias más investigaciones para definir su papel28. La TC es más accesible5. Debe realizarse sin y con CIV antes y después de la ARF18 para medir y comparar evolutivamente la captación de contraste. Medir con TC densitometría la captación dinámica del contraste por una lesión, reflejo de su vascularización, puede ser teóricamente más sensible para diferenciar lesiones benignas de malignas3-5,23,27 y detectar precozmente tejido tumoral. Consiste en una TC sin CIV y adquisiciones secuenciales con CIV (0, 45 [90], 180 y 300 segundos)3–5. Se obtienen imágenes con captación máxima de contraste sustrayendo la densidad de la lesión en el estudio simple a las imágenes de máxima atenuación de la lesión con contraste4. Se emplea poco por ser engorrosa, inútil en lesiones múltiples o cavitadas3 y suponer más dosis de radiación que la TC convencional.
La RM también se usa poco por ser costosa, poco disponible y limitada para valorar el pulmón4. Datos experimentales indican que la difusión es un indicador precoz de respuesta3-5,29.
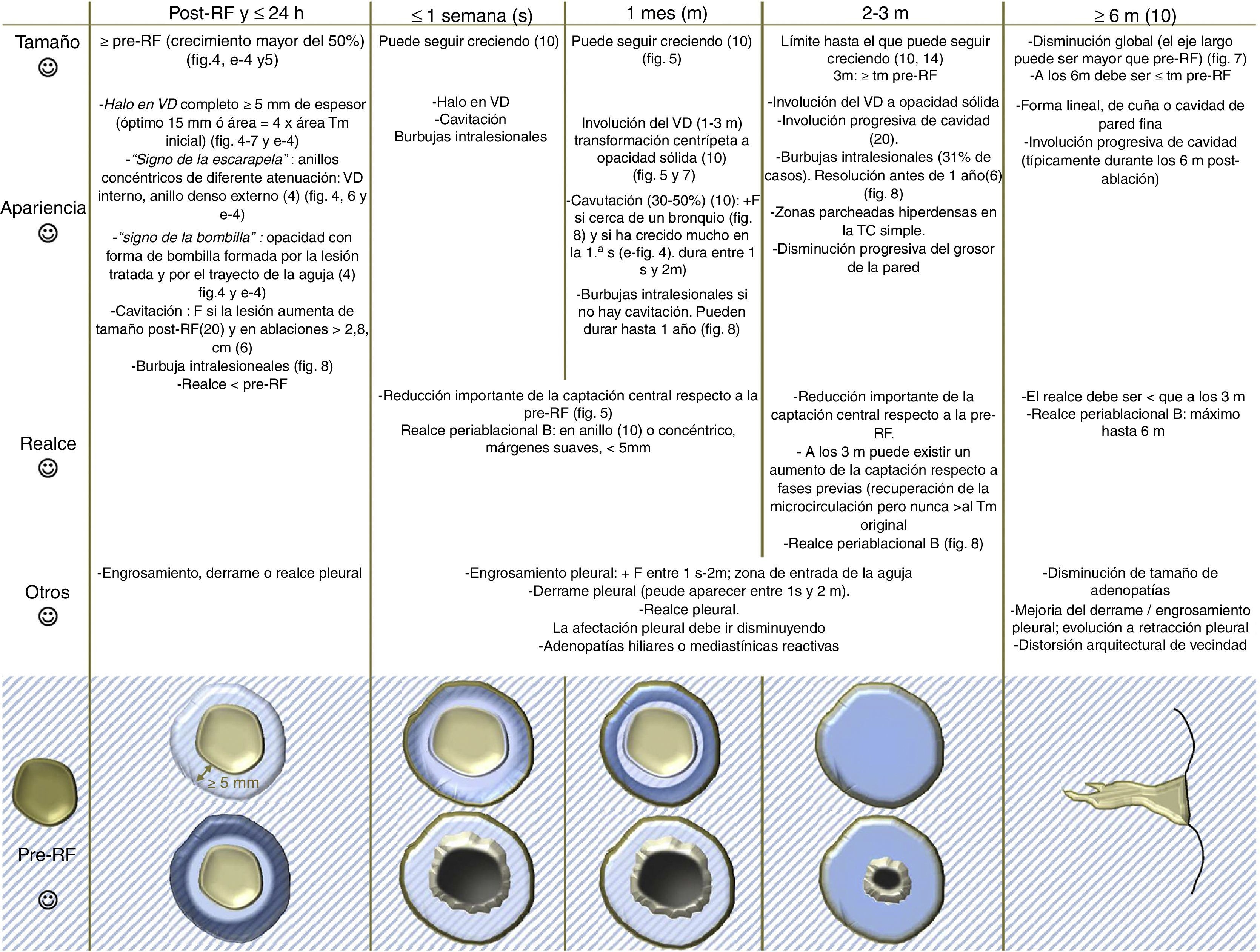
C. Interpretación de las pruebas de imagen (figs. 1–3).
Hallazgos en TC esperables tras la ablación por radiofrecuencia pulmonar.
Código de colores: azul claro-translúcido: vidrio deslustrado; azul oscuro: consolidación; dorado oscuro: captación de contraste iv; dorado claro: no captación de contraste iv; gris-negro: cavitación. El color de esta figura solo puede apreciarse en la versión electrónica del artículo.
B: benigno; F: frecuencia; m: mes; RF: radiofrecuencia; s: semana; Tm: tumor; VD: vidrio deslustrado.
Fuente: Sharma et al.1, Abtin et al.4, Eradat et al.5, Chheang et al.6, Sharma et al.10, Sofocleous et al.14, Pua et al.15, Schneider et al.17, Alexander et al.19, Healey et al.20, Casal et al.27y Rasmussen et al.35.
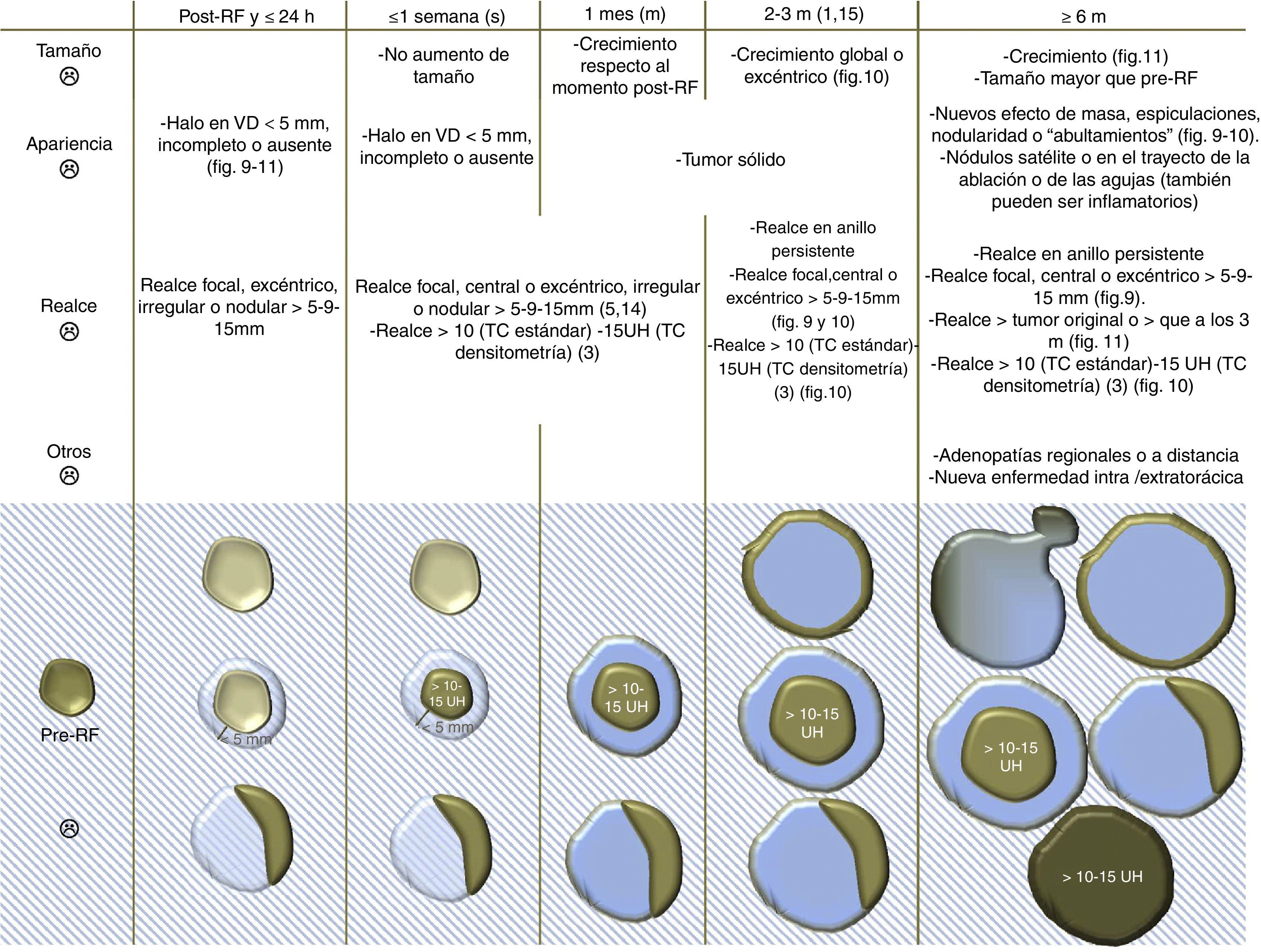
Hallazgos en TC sugestivos de fracaso del tratamiento tras la ablación por radiofrecuencia pulmonar.
Código de colores: azul claro translúcido: vidrio deslustrado; azul oscuro: consolidación; dorado oscuro: captación de contraste iv; dorado claro: no captación de contraste iv. El color de esta figura solo puede apreciarse en la versión electrónica del artículo. Realce >10-15 UH (>10 UH en la TC convencional y a 15 UH en la TC densitometría).
m: meses; RF: radiofrecuencia; UH: unidades Hounsfield; VD: vidrio deslustrado.
Fuente: Sontag et al.3, Eradat et al.5, Sharma et al.10, Sofocleous et al.14, Pua et al.15, Schneider et al.17, Alexander et al.19, Healey et al.20 y Rasmussen et al.35
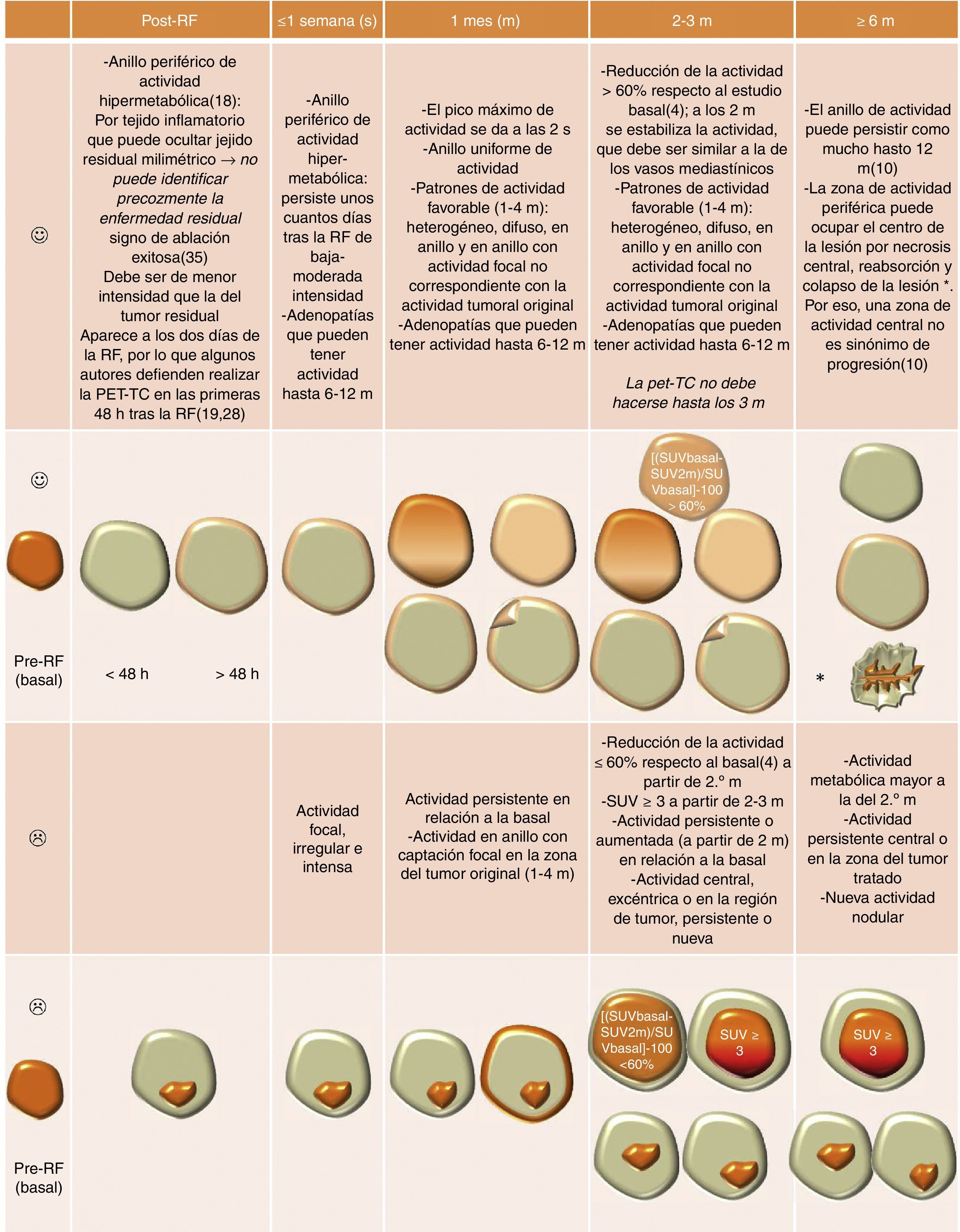
Hallazgos esperables (
Código de colores: naranja: áreas de actividad metabólica (más oscuro cuanta mayor es la actividad); gris: área tratada fotopénica. El color de esta figura solo puede apreciarse en la versión electrónica del artículo.
m: meses; RF: radiofrecuencia; s: semanas; SUV: Standardized Uptake Value.
Fuente: Abtin et al.4, Sharma et al.10, Sofocleous et al.14 Pua et al.15, Pua et al.18 Alexander et al.19, Tatli et al.25, Purandare et al.28 y Rasmussen et al.35
El tejido tumoral y peritumoral sufrirá procesos dinámicos de necrosis, citolisis y cambios inflamatorios durante días tras la ARF que hacen que la lesión crezca10. Esto dificulta y convierte en un reto diferenciar radiológicamente la evolución normal de un tratamiento incompleto y de una recurrencia tumoral5,6,19, más frecuentes que tras una lobectomía5. Es necesario diferenciarlos precozmente para volver a tratar sin demora. El signo clásico del crecimiento tumoral no es útil. El realce en la TC y la actividad metabólica en la PET-TC tienen un papel importante3,5,19,23, aunque tampoco son específicos del tumor (figs. 1 y 2).
1. Hallazgos esperables en la TC (fig. 1):
- -
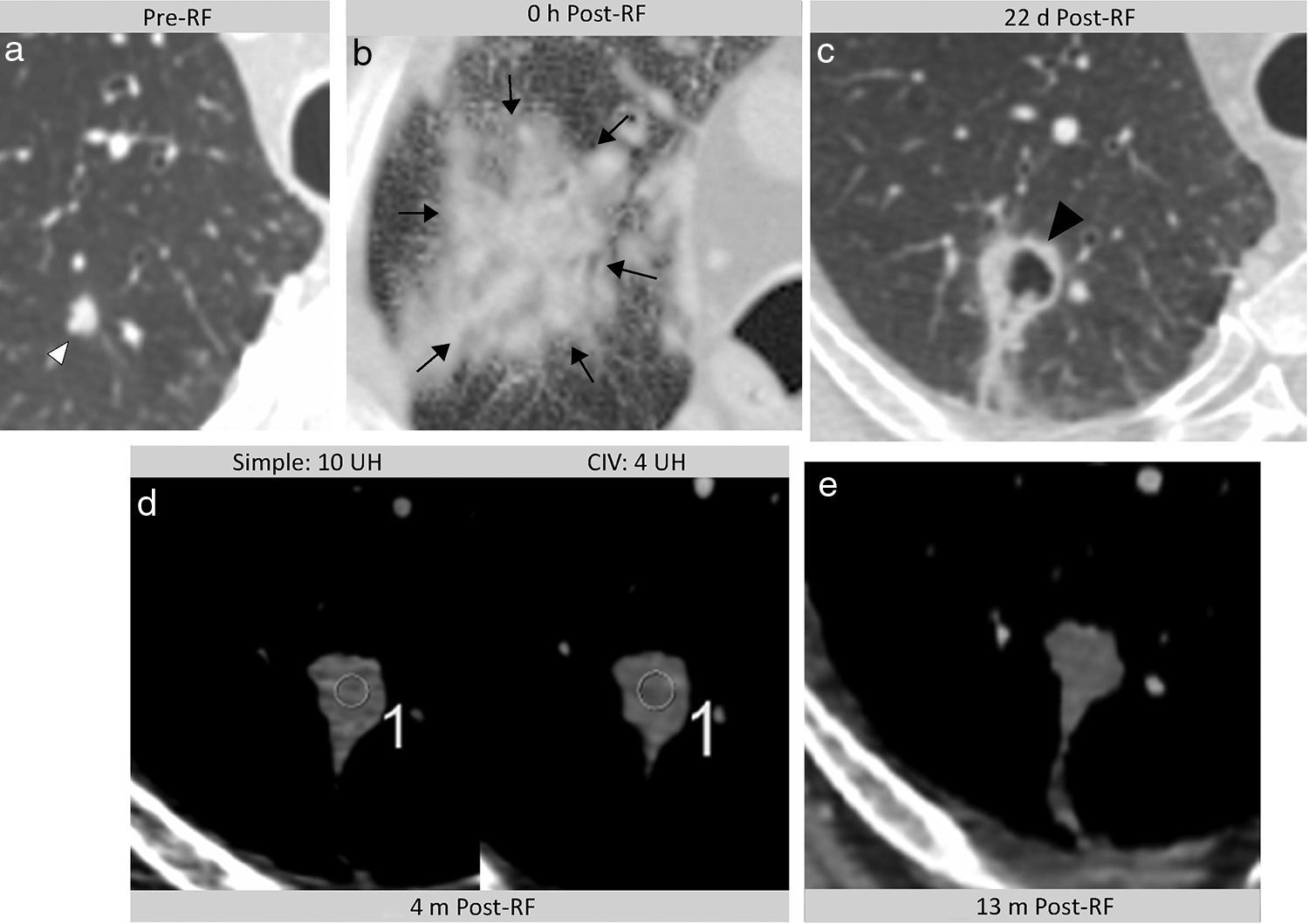
Halo en vidrio deslustrado y crecimiento. Indicadores tempranos de éxito terapéutico14 (figs. 4–7 y e-fig. 4). Inmediatamente tras la ARF aparece el HVD peritumoral. Representa la necrosis coagulativa pero también de congestión, inflamación y hemorragia1. Se han definido experimentalmente 3 capas anatomopatológicas en el HVD. La central contiene células muertas por necrosis coagulativa (citoplasma con núcleos de cromatina condensada) y la intermedia luces alveolares rellenas de líquido4,20. En la periférica, de 2,6-4,1mm, constituida por áreas de congestión hemorrágica no necrótica e infiltración neutrofílica, persiste tumor viable4,6,20. Por ello, el HVD puede sobrestimar el área de muerte celular4. Para considerar completa la necrosis tumoral, el HVD debe tener un espesor, medido desde el margen tumoral4,18,30, de 5-10mm1. Dado que pueden persistir células tumorales viables en la capa periférica del HVD6, lo óptimo es que tenga un espesor de 15mm6 o un área cuatro veces la tumoral de antes de la ARF6,18,29. Se han descrito los signos de la escarapela, de la bombilla4 (fig. 1, 4–6 y e-fig. 4) y del halo inverso31.
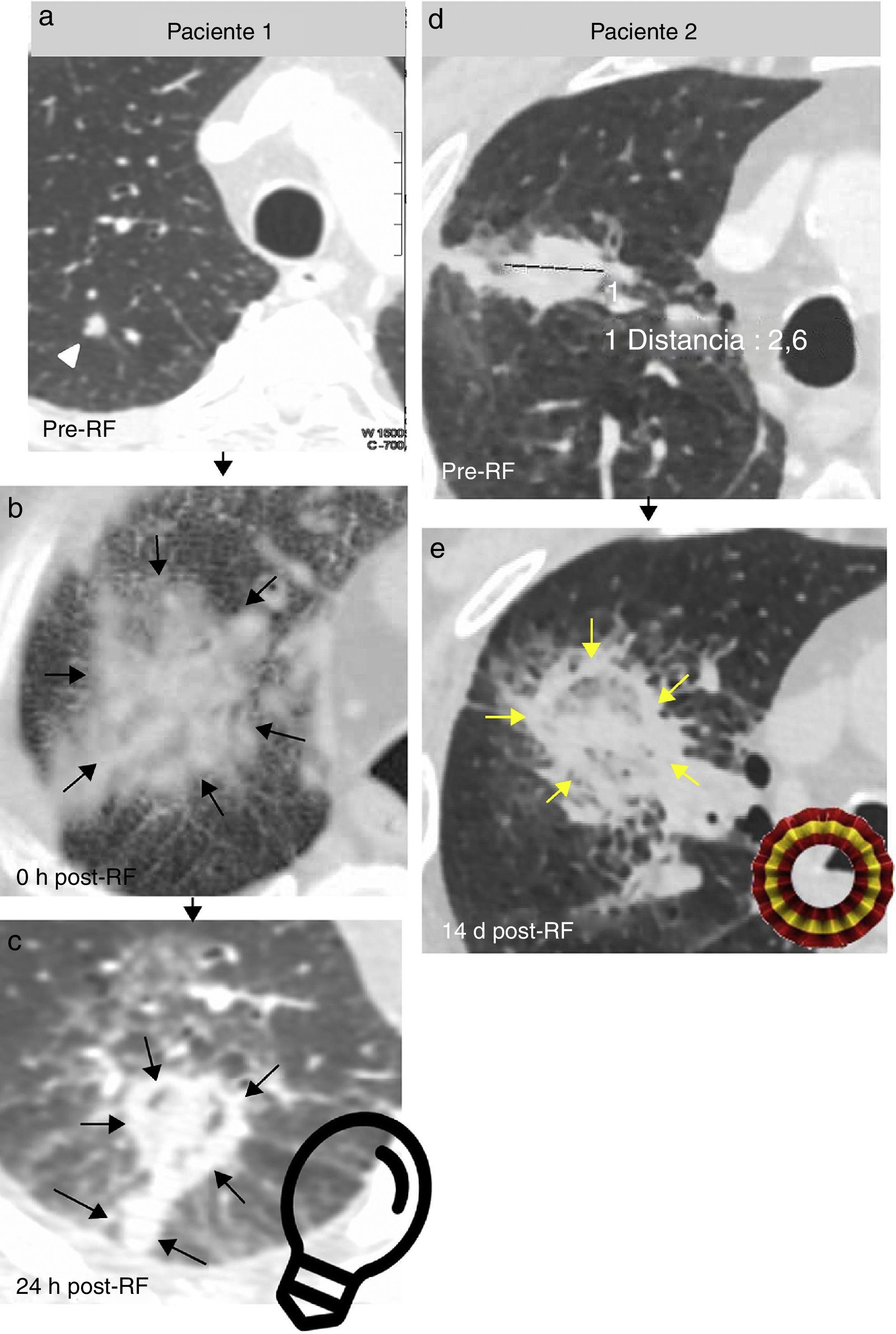
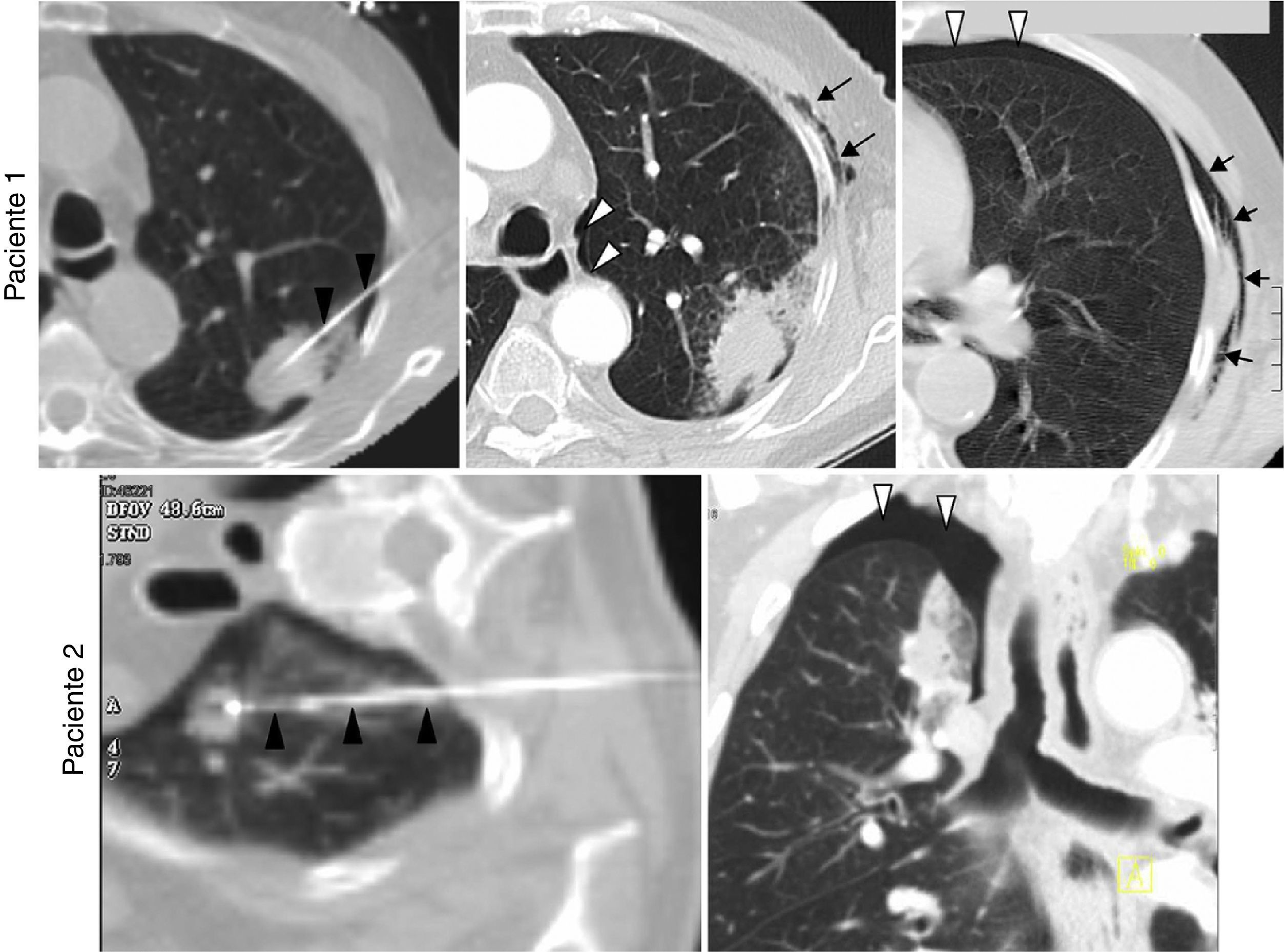
Figura 4.Hallazgos precoces esperables tras el éxito de una ablación con radiofrecuencia (ARF) de dos lesiones pulmonares pequeñas a) y d): importante crecimiento tras la ARF de la lesión en el paciente 1 (cabeza de flecha en a) por formación de un gran halo en vidrio deslustrado en torno a la lesión (flechas en b). «Signo de la bombilla» (opacidad con forma de bombilla formada por la lesión tratada y por el trayecto de la aguja) a las 24 horas (h) (flechas en c) y «signo de la escarapela» (anillos concéntricos de diferente atenuación, con vidrio deslustrado interno y anillo denso externo), (flechas en e) a los 14 días (d) de la ARF en el segundo paciente.
Figura ampliada online (e-fig. 4).
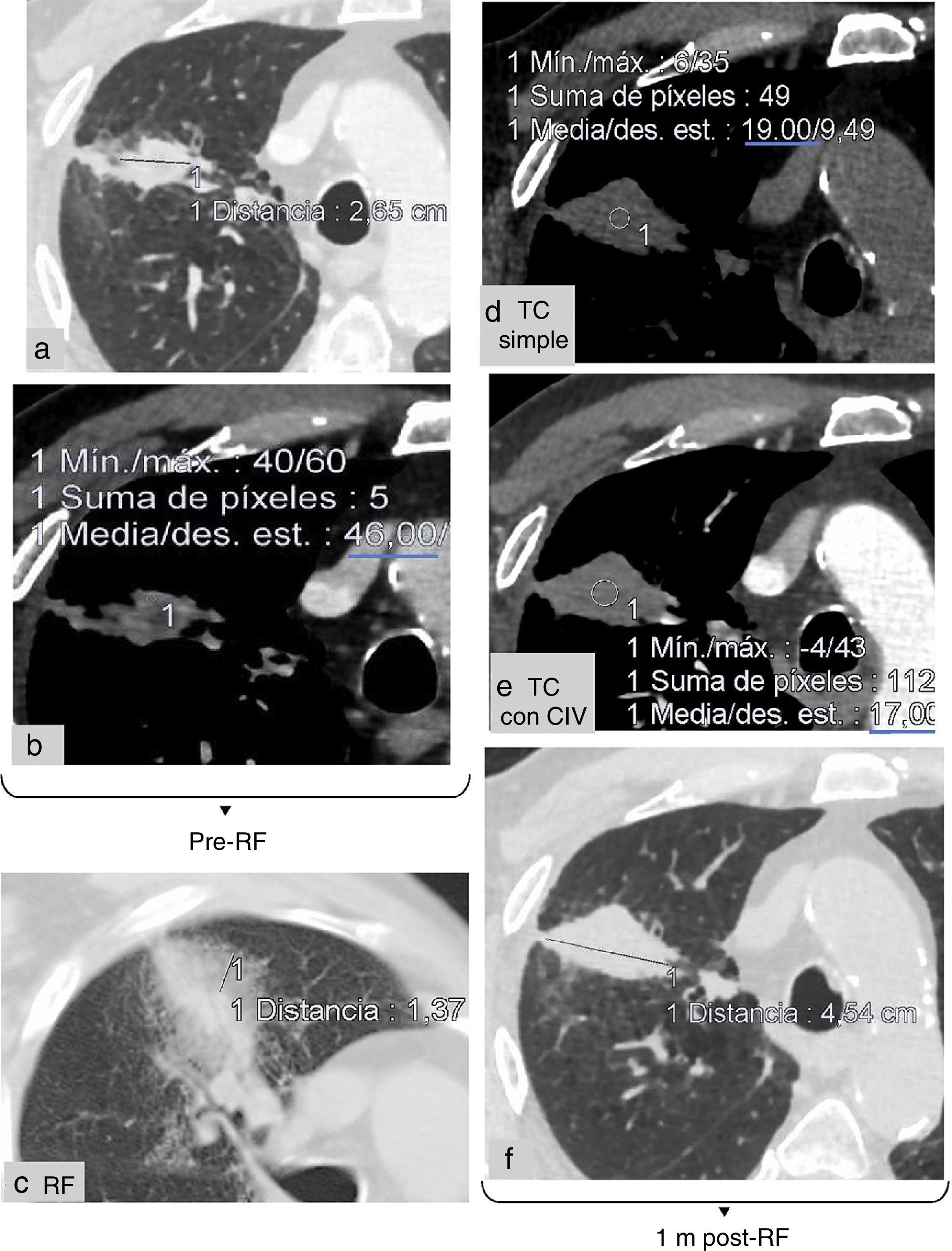
(0.44MB).Figura 5.Ejemplo de tratamiento con éxito de un nódulo en el LSD previamente radiado, con SUV elevado en la PET (no mostrada) indicativo de recaída. a) El tamaño del nódulo (medida tomada en a) es adecuado para tratarlo con radiofrecuencia (RF) (<3cm). c) Área en vidrio deslustrado en torno a la lesión tras la ablación, de tamaño adecuado (14mm). Ausencia de realce tras la ablación: las unidades Hounsfield (UH) no aumentan en el estudio con contraste intravenoso (CIV) (17 UH) e) respecto al simple (19 UH) d) al mes (m) del tratamiento. La lesión captaba contraste antes de la ablación (46 UH) b). f) Buena evolución al mes, con transformación del área de vidrio deslustrado en consolidación, que es de mayor tamaño que la lesión antes de la ablación (medida tomada en f). Recaída en la língula a los 7 meses (no mostrada).
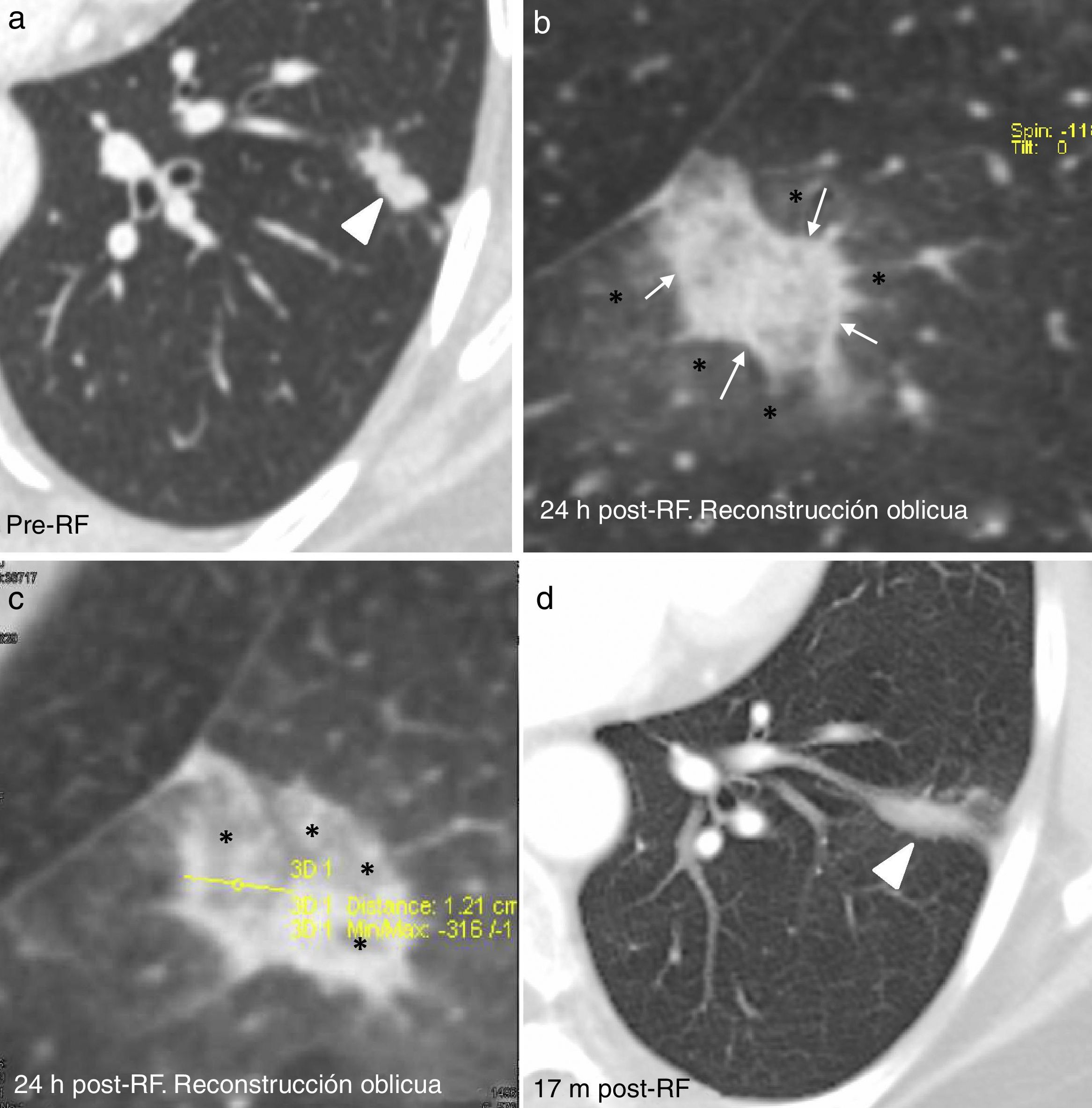
(0.53MB).Figura 6.Ejemplo de tratamiento exitoso: Nódulo de pequeño tamaño en el lóbulo inferior izquierdo (cabeza de flecha en a) con formación de anillos concéntricos de diferente atenuación (“signo de la escarapela“) a las 24 horas (h) de la RF (flechas en b) y vidrio deslustrado (asteriscos en b y c). La lesión crece al día siguiente por el halo en vidrio deslustrado (asteriscos en c), que es de tamaño adecuado como para considerar exitoso el tratamiento (12 mm). Lesión cicatricial residual a los 17 meses (m), sin signos de recaída, d).
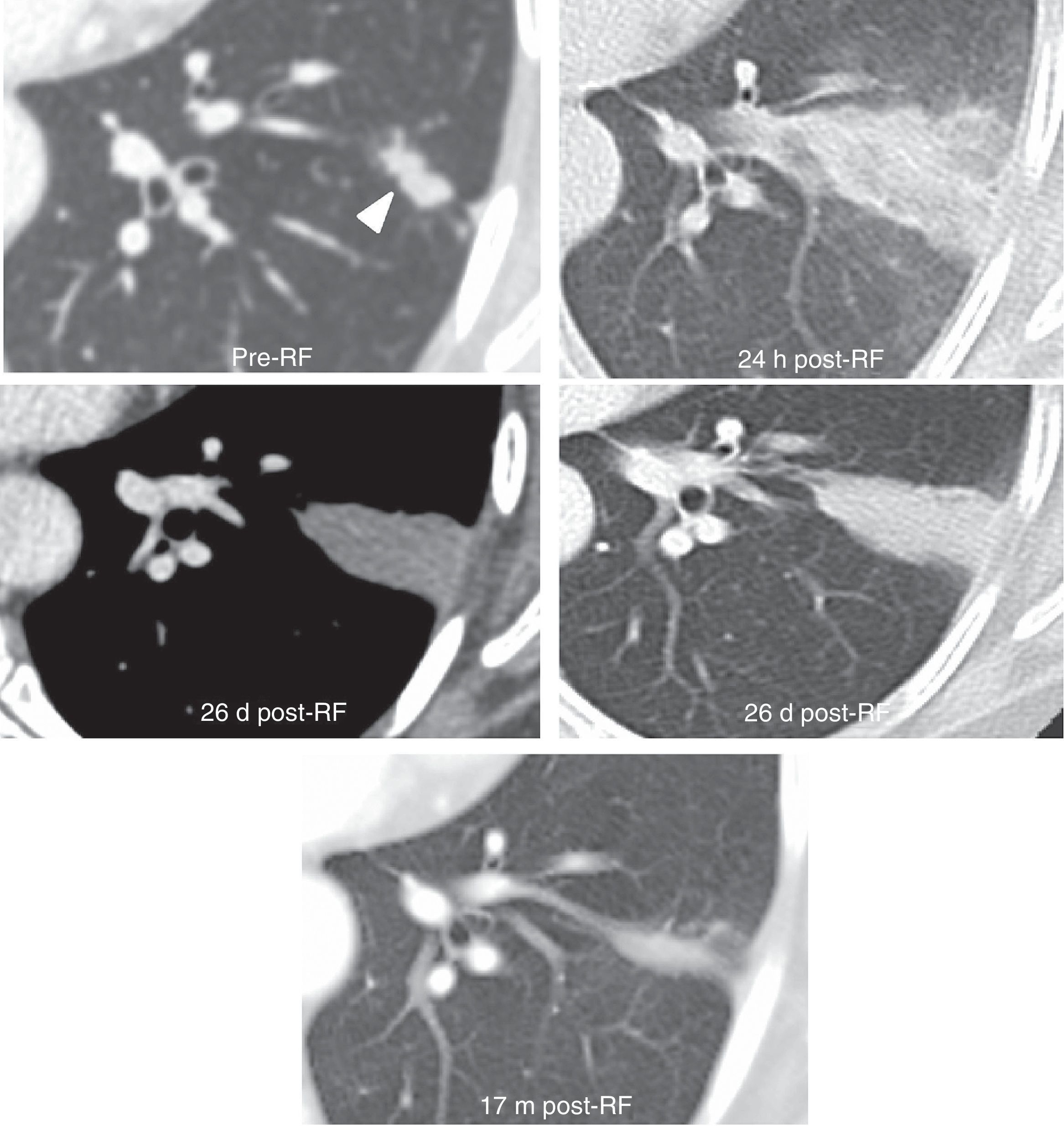
(0.33MB).Figura 7.Hallazgos esperables tras una ablación por radiofrecuencia (RF) con éxito. La lesión (cabeza de flecha) crece mucho a las 24 horas (h) tras la ARF por la aparición de un grueso halo en vidrio deslustrado en torno a la lesión (imágenes superiores). Involución del vidrio deslustrado a una opacidad sólida a los 26 días (d), sin captaciones focales de contraste intravenoso (imágenes centrales). Lesión cicatricial residual de pequeño tamaño a los 17 meses de la RF (imagen inferior).
(0.37MB). - -
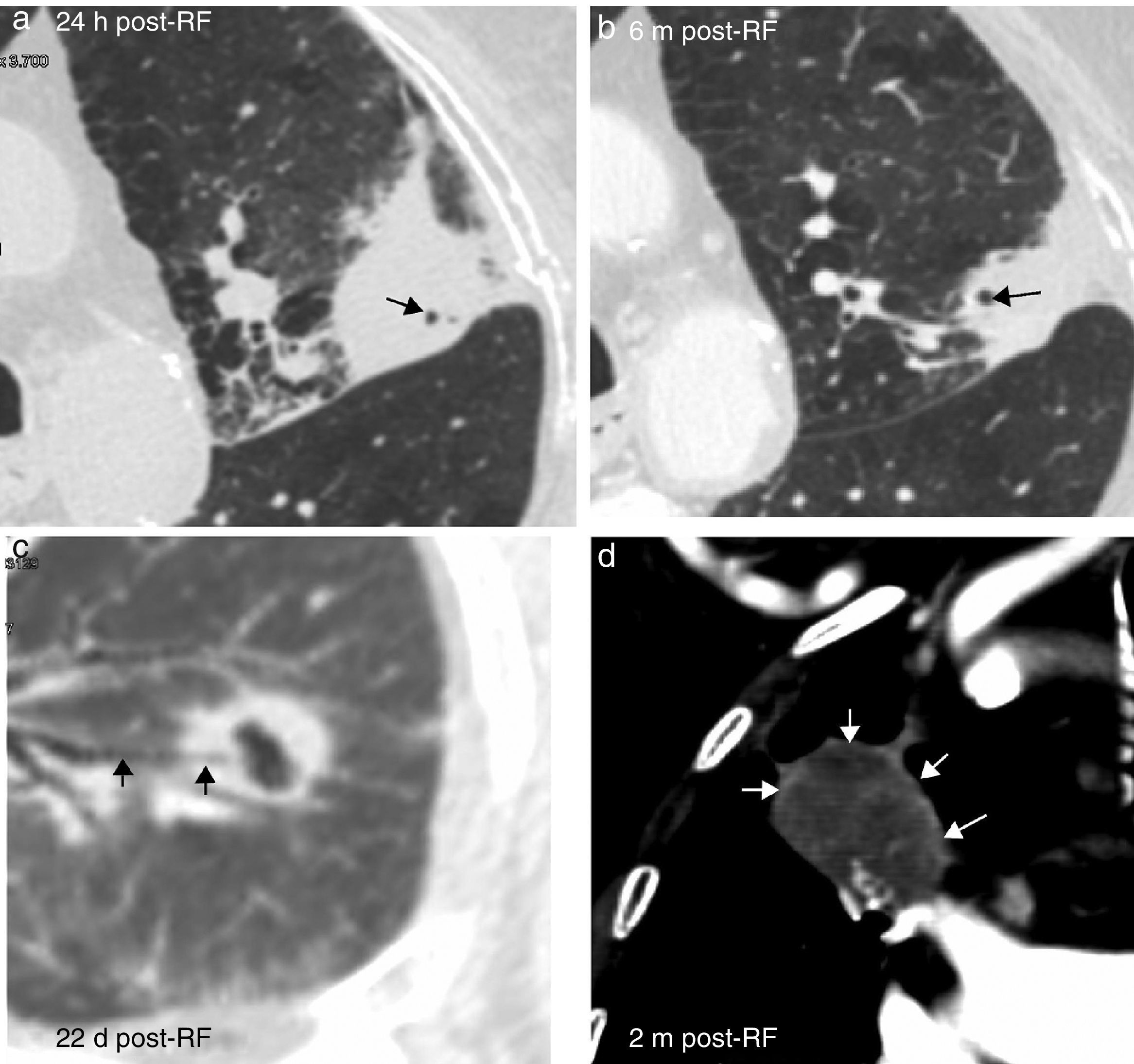
Cavitación. Se produce por devascularización del tumor y del pulmón que, con el tiempo, comunican con la vía aérea, también necrosada. Persiste tejido de granulación peritumoral que forma una cápsula (fig. 8 y e-fig. 4). Es estéril y no requiere antibioterapia10. Se considera un signo de respuesta positiva al tratamiento6.
- -
Burbujas de gas en la lesión (fig. 8).
Figura 8.Hallazgos esperables tras la ablación por radiofrecuencia (ARF) en diferentes pacientes. Burbujas intralesionales a las 24 horas (h) de la ARF, no presentes antes de la ablación (no mostrado), que persisten a los 6 meses (m) (flechas en a y b). Cavitación tras la ablación que comunica con un bronquio (flechas en c) a los 22 días d) de la ARF. Realce en anillo, fino y de márgenes suaves en torno a la ablación (benigno), (flechas en d).
(0.3MB). - -
Realce benigno en torno a la ablación. Concéntrico, de márgenes suaves y <5mm, a diferencia de un absceso, cuya pared sería gruesa e hipercaptante (54). No debe existir captación central ni nodular (fig. 8).
- -
Captación menor que antes de la ARF (fig. 5).
- -
Derrame o engrosamiento pleural, adenopatías hiliares o mediastínicas.
Los hallazgos de la PET se detallan en la figura 3.
2. Hallazgos sugestivos de fracaso del tratamiento (figs. 2 y 3).
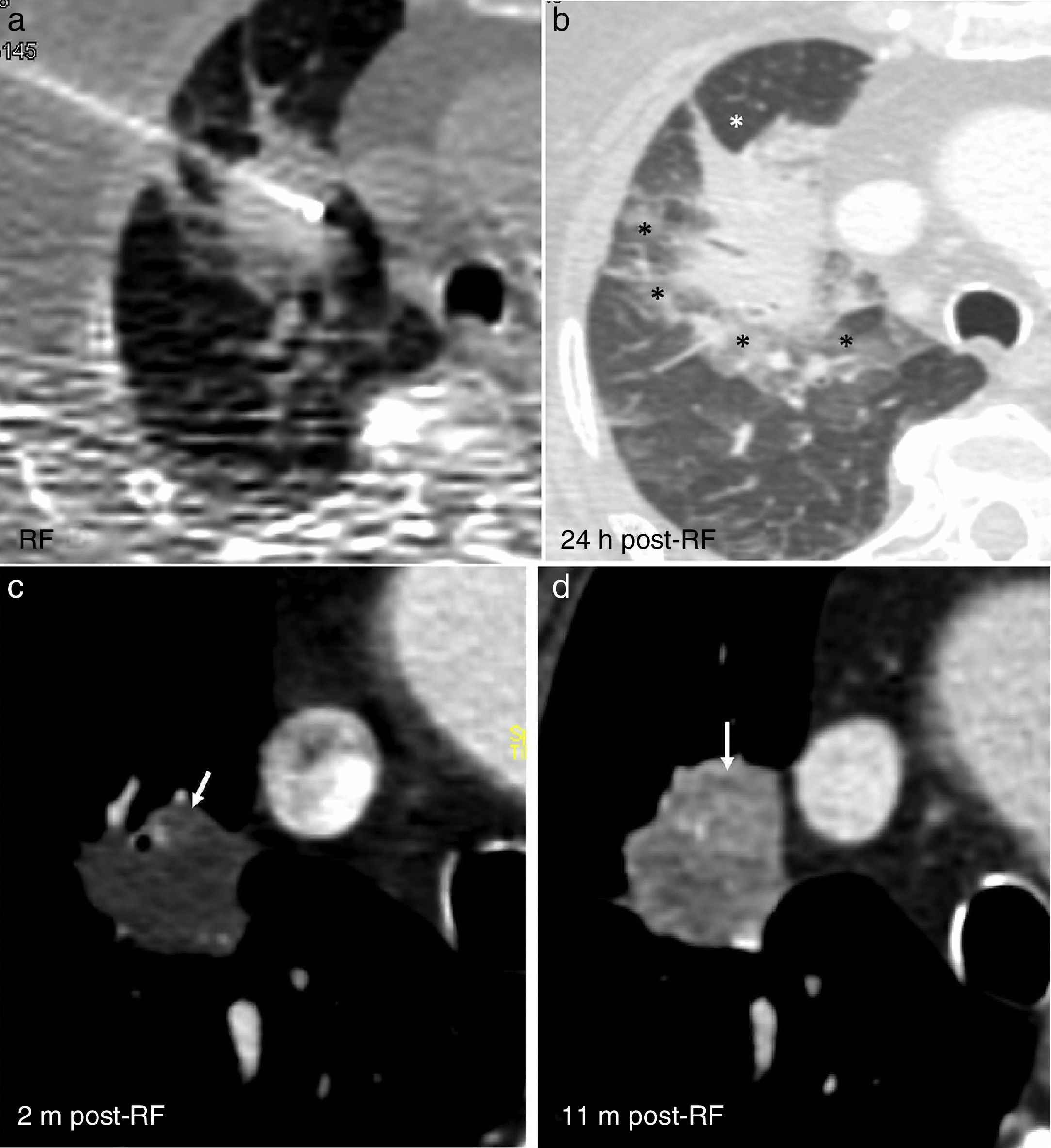
Un HVD incompleto o <5mm de espesor (figs. 9–11)4,5, que la lesión no crezca inmediatamente tras la ARF o que realce de forma nodular o irregular, tanto central como excéntricamente5, son signos de tratamiento incompleto.
Signos de tratamiento sin éxito y de recurrencia. A las 24 horas (h) del procedimiento de ablación por radiofrecuencia (RF) (a) se forma un halo en vidrio deslustrado estrecho e incompleto que rodea la región posterior y lateral de la lesión (asteriscos negros en b), pero no el polo anterior (asterisco blanco en b). Captación nodular excéntrica en el polo anterior, apenas visible a los dos meses (m) (flecha en c), que es claramente evidente a los 11 meses (flecha en d), momento en el que la lesión también crece excéntricamente.
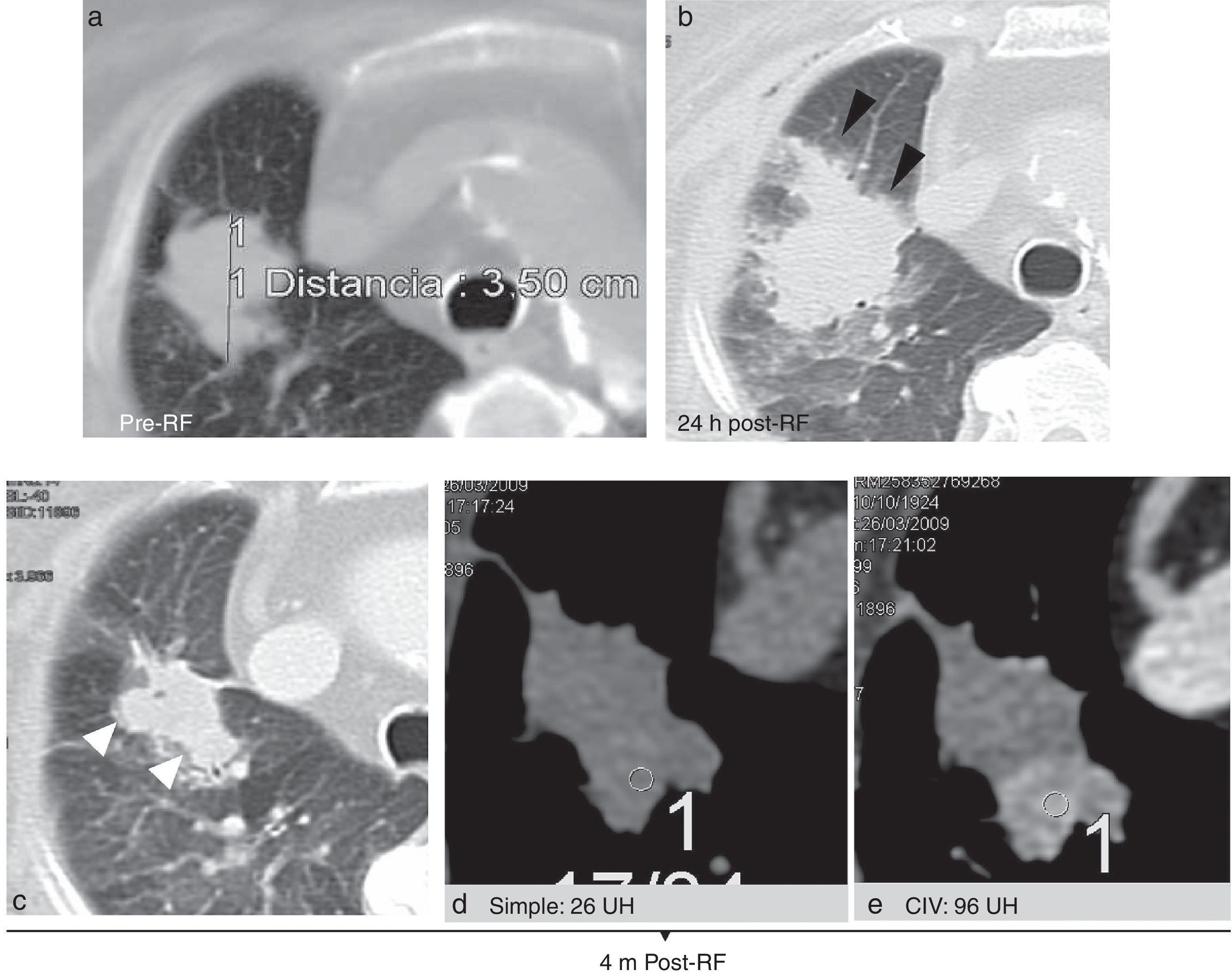
Ejemplo de mala evolución tras una ablación por radiofrecuencia (ARF). Tumor >3cm (medida en a), con halo en vidrio deslustrado incompleto (cabezas de flecha negras en b) a las 24 horas (h) de la ARF. Crecimiento excéntrico de la lesión (cabezas de flecha blancas en c) que capta contraste de forma nodular a los 4 meses (regiones de interés - ROIs), con un aumento de 70 unidades Hounsfield (UH) entre el estudio simple d) y con contraste iv (CIV) e), indicativo de recaída.
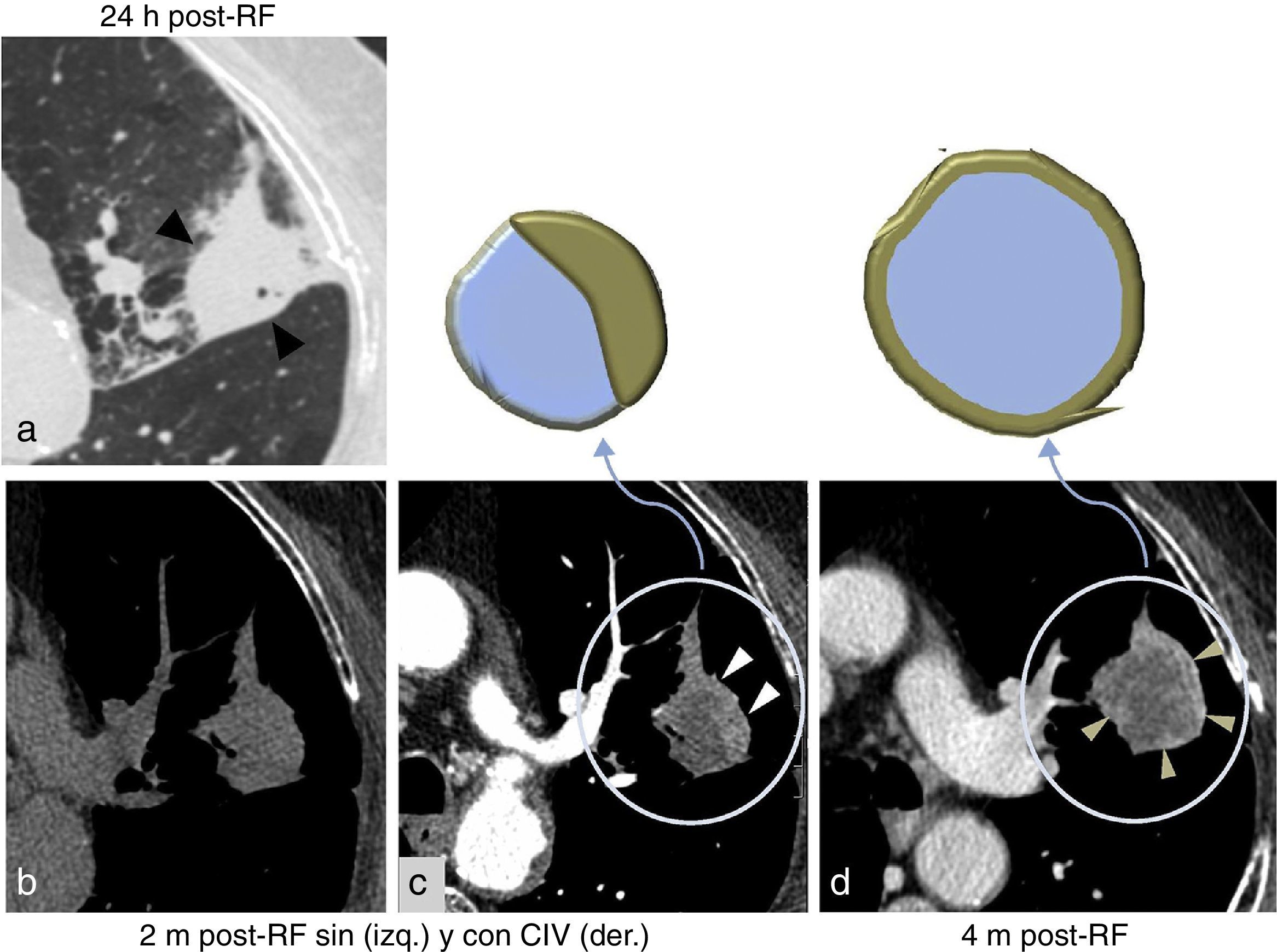
Ejemplo de mala evolución tras una ablación con radiofrecuencia (ARF). Tumor >3 cm en contacto con la cisura (cabezas de flecha en a). Después de la ARF no se forma el halo en vidrio deslustrado en torno a la lesión (a). Comparando con el estudio sin contraste intravenoso (CIV) b), tras administrar CIV puede apreciarse la captación de CIV excéntrica a los 2 meses (m) (cabezas de flecha blancas en c) y en anillo grueso a los 4 meses (m) (cabezas de flecha doradas en d), momento en el que también crece la lesión.
El crecimiento excéntrico10 y el crecimiento global a partir del 3.er mes23 y el realce, generalmente excéntrico, >10 UH en la TC estándar con CIV3 y >15UH en la TC densitometría, sin las características del realce benigno en torno a la ablación, sugieren tumor (figs. 9–11). En la PET-TC lo hacen una reducción de la actividad metabólica <60% respecto a antes de tratar4, generalmente excéntrica, o un SUV (Standardized Uptake Value) >3 a partir de los 2-3 meses3,4,18,23. Un SUV de 1,5 a los 3-9 meses tiene una sensibilidad de recurrencia del 77,8% y una especificidad del 85,7-90,5%. Así, algunos autores sugieren bajar su umbral10,15,18. Estas lesiones deben seguirse más estrechamente con TC sin y con CIV, o biopsiarse10,18.
3. Criterios de respuesta y progresión/recurrencia.
Los criterios RECIST clásicos, que fundamentan la progresión tumoral en el crecimiento, no sirven para valorar el resultado inmediato de la ARF14,23,27. Herrera et al.33 propusieron unos criterios RECIST modificados para TC y PET-TC (fig. 12), que evalúan el tamaño, la apariencia y la actividad metabólica de la lesión14,20,27,34. Menos referenciados son los criterios de la OMS, que también consideran el realce y la diseminación a distancia27 (fig. 12).
Criterios RECIST modificados de Herrera et al.) y Criterios de la OMS.
Recomendaciones en el protocolo de seguimiento con PET-TC y/o TC.
m: meses; SUV: Standardized Uptake Value; TC s/c CIV: TC sin y con CIV; UH: unidades Hounsfield.
Fuente: Sharma et al.10, Pua et al.15, Healey et al.20, Palussière et al.21, Standards for radiofrequecy ablation22, Baisi et al.23, Herrera et al.31 y Herrera et al.32.
4. Hallazgos en RM.
La necrosis coagulativa es hiperintensa en T1 (o isointensa a la lesión de antes de la ARF)10 e hipointensa en T2. Periféricamente, la lesión puede ser hiperintensa en T2, por congestión y cambios inflamatorios en el pulmón vecino10. La ausencia de captación, previamente existente, sugiere ablación completa. El área de ablación debe sobrepasar en 1cm el margen tumoral. Puede verse un anillo de captación delgado como hallazgo normal. El tejido nodular focal en el margen de ablación con características de señal y captación similares al tumor original sugiere tumor residual25. La difusión es prometedora para detectar precozmente enfermedad residual. Un estudio mostró que el coeficiente de difusión aparente 3 días después de la ARF fue significativamente mayor en pacientes con progresión a los 6 meses32.
D. ¿Cuándo?
Será fundamental realizar una TC aproximadamente un mes tras la ARF, como estudio basal, y posteriormente, a intervalos de tres meses, según recomienda el Comité Tecnológico de la Sociedad de Radiología Intervencionista18. El momento óptimo para realizar la PET no está claro28. Los cambios inflamatorios en las semanas posteriores pueden incrementar la captación de CIV y la actividad metabólica en la PET-TC23 (fig. 1), fuentes de falsos positivos. Aunque algunos autores defienden realizar una PET-TC en las primeras horas (<48h o ≤4 días)19,28 para detectar tumor residual antes de que aparezcan los cambios inflamatorios, la mayoría recomienda no realizarla antes de un mes12, incluso de tres meses4, pues la hiperactividad metabólica de causa inflamatoria no se estabiliza hasta los dos meses (fig. 3). La progresión tumoral suele detectarse con TC y PET-TC entre 2-6 meses después de la ARF, cuando han disminuido los cambios inflamatorios5,10.
Todos los autores recomiendan realizar TC, TC densitometría o PET-TC de seguimiento a los 1-2, 3, 6, 9 y 12 meses. Durante el segundo año las recomendaciones son variables3-6,10,14,15,20,26,27,30,35. Mientras que unos recomiendan hacer TC y/o PET-TC cada 3 o 6 meses, otros sugieren alternarlos cada 3 meses. Dos trabajos recientes4,6 recomiendan realizar TC6 TC densitometría4 cada 6 meses y otros TC densitometría cada 3 meses y PET-TC cada 65. Después, conviene seguir anualmente hasta los 5 años1. La recurrencia puede presentarse tras desaparecer la actividad metabólica de la PET18, por lo que el seguimiento debe ser prolongado4. Presentamos nuestra recomendación en la figura 12.
Las pocas publicaciones sobre RM sugieren realizarla 1-2 semanas antes de la ARF y una semana después25.
La coordinación de las actuaciones específicas en torno al procedimiento para nuestro centro se ha esquematizado como vía clínica (e-tabla 1).
ComplicacionesSu frecuencia y factores de riesgo se exponen en la e-tabla 2. Son frecuentes (50-60%), variadas, pero la mayoría leves y autolimitadas. En ocasiones evolucionan a complicaciones mayores.
A. Pleurales.
- -
Neumotórax (fig. 12). Es la complicación más frecuente en todas las técnicas ablativas. Suele ser asintomático. Generalmente se desarrolla en las 2 horas siguientes a la ARF20. Tendrá que drenarse cuando aumente en radiografías sucesivas, si hay síntomas o enfisema10. El neumotórax tardío, por necrosis subpleural o FBP, suele tener poca relevancia6 pero un 12% requirió tratamiento tardío en una serie15. El tiempo hasta el diagnóstico fue de 24±66 horas. La ablación del trayecto disminuye el riesgo27. Pueden persistir 1-2 semanas como FBP contenida4.
- -
Derrame pleural. Segunda complicación en frecuencia. Generalmente pequeño, autolimitado y asintomático. Puede ser una respuesta al daño térmico36. Aparece 1-2 semanas después de la ARF31. Aun siendo pequeño, puede ser sintomático en pacientes con un pulmón único o con fallo respiratorio crónico grave y requerir toracocentesis o toracostomía.
- -
Complicaciones raras (≤1%):
- –
Hemotórax. Potencialmente letal si no se diagnostica. Ante un derrame pleural rápidamente creciente durante el procedimiento, con o sin signos de hipovolemia, hay que descartar el sangrado arterial. Se puede embolizar14.
- –
Fístula broncopleural. Se presentan como un neumotórax intratable. Se desarrollan en las primeras 4 semanas, mientras existe necrosis tras la ARF28. La mayoría se resuelven espontáneamente. Tienen actividad aumentada en la PET10.
- –
Empiema.
- –
B. Pulmonares.
- -
Cavitación. También indica una respuesta favorable al tratamiento. La mayoría son asintomáticas. Se han descrito casos raros de hemorragia y neumotórax por rotura de la cavidad36.
- -
Hemorragia intraparenquimatosa. Por daño de vasos pequeños en el trayecto de la aguja. Se asocia a hemoptisis en una minoría de casos (2-16,1%), generalmente menor, autolimitada y durante los 2-7 días después del procedimiento12. El riesgo de muerte es extremadamente raro, con dos casos descritos36, al menos uno relacionado con braquiterapia asociada3,7. Para evitarla se recomienda mantener la aguja «caliente» cuando se reposicione o se retire37.
- -
Neumonía. El empleo profiláctico de antibióticos no ha demostrado mejoría12.
- -
Neumonitis (e-tabla 2).
C. Pared torácica y vasos. Son poco frecuentes (<2%).
- -
Neuropatía (intercostales, frénicos, plexo braquial). La lesión frénica puede disminuir hasta 1 litro la capacidad vital36. El tratamiento del dolor neuropático persistente con gabapentina es efectivo20.
- -
Siembra en el trayecto del electrodo o en la piel. Se suele detectar de 3 a 12 meses tras la ARF. La ablación del trayecto disminuye el riesgo37.
- -
Complicaciones raras (< 1%):
- –
Enfisema subcutáneo (fig. 13). Desaparece espontáneamente, aunque a veces tarde semanas. Puede asociarse a neumoperitoneo12. Es más extenso si se asocia a FBP.
Figura 13.Complicaciones. Neumotórax (cabezas de flecha blancas) a las 24 horas del procedimiento en dos pacientes. Factores de riesgo (FR): trayecto intrapulmonar largo de la aguja de radiofrecuencia (cabezas de flecha negras), edad avanzada (89 años el paciente superior y 70 años el inferior) (FR controvertido) y tumor grande en el primer paciente (FR controvertido). También se produjo enfisema subcutáneo en el primer paciente (flechas negras).
(0.36MB). - –
Embolia aérea. Se produce al comunicar una vena pulmonar con la vía aérea o el aire atmosférico37. Si es sintomática, debe administrarse oxígeno al 100% y posicionar al paciente en Trendelenburg o en decúbito supino36.
- –
Anecdóticas (≤0,2%): necrosis costal, pseudoaneurisma de la arteria pulmonar36, hernia diafragmática36 y fallo renal agudo10.
- –
D. Clínicas.
- -
Tos productiva (0-36%). Puede durar hasta 4 semanas.
- -
Dolor torácico pleurítico. Común (14-18%). Por irritación pleural en tumores periféricos tratados. Puede empezar a las dos semanas. Suele durar 2-7 días. Puede manejarse con analgésicos orales.
- -
Disnea. Puede requerir oxigenoterapia12.
- -
Síndrome postablación38: fatiga, mialgias y fiebre. Común. Puede durar dos semanas. Se atribuye a la circulación de toxinas procedentes de la necrosis tumoral. Mejora con antiinflamatorios no esteroideos10.
- -
Alteración transitoria del FEV1 (volumen espiratorio forzado en el primer segundo). La tolerancia a la técnica en términos de función respiratoria generalmente es excelente. Pueden producirse cambios temporales, con necesidades de oxígeno entre un día y 3 semanas, pero no a largo plazo12.
- -
Quemaduras por las almohadillas. Cuando hay pliegues en la porción metálica de las almohadillas se generan corrientes cutáneas que impiden la disipación uniforme del calor10 y pueden producir quemaduras. Se puede monitorizar su temperatura17.
La mayor frecuencia de complicaciones en lesiones centrales (64% de los cánceres pulmonares)17 hace que la ARF sea menos recomendable en ellas34. Determinadas lesiones nerviosas son más frecuentes en tumores apicales39. Para aislar la pared torácica o el mediastino del daño térmico en ablaciones próximas puede producirse intencionalmente un derrame pleural10,36 o un neumotórax, atravesando la pleura parietal e introduciendo aire ambiente en el espacio pleural12,19. En hemorragias en torno a la ARF debemos localizar el punto sangrante con una TC con CIV y tratarlo inmediatamente36. La ablación del trayecto minimizará la siembra tumoral30,36, la hemorragia37 y el neumotórax27. La indicación de la ARF en pacientes radiados debe valorarse cuidadosamente36. La ventilación con presión positiva favorece el hemotórax y la embolia aérea, aunque son muy raros.
Las complicaciones mayores (8-12%) son:
- -
Muerte. En el 0,2-2,6%. El índice de mortalidad a 30 días es del 3,9% y la mortalidad específica del 2,6%34. Puede producirse por hemorragia pulmonar masiva, fallo respiratorio, fallo cardíaco e infarto de miocardio30. Se ha descrito en pacientes con neumonectomía10,40.
- -
Otras. Neumotórax intratable, embolismo aéreo, absceso pulmonar, fiebre>38,5°C, hemorragia masiva, neumonitis, hemotórax, siembra tumoral en el trayecto, empiema y quemaduras cutáneas.
Es prioritario investigar nuevas opciones de tratamiento para el cáncer de pulmón y las metástasis pulmonares. La ARF es una técnica viable. Es crucial diferenciar radiológicamente los cambios evolutivos normales de la persistencia tumoral, conocer las precauciones para minimizar sus complicaciones, pocas pero potencialmente serias, y cómo tratarlas. Se necesitan más investigaciones para definir la mejor estrategia de seguimiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.