La pancreatitis aguda es una patología frecuente que requiere un manejo multidisciplinar. La revisión de 2012 de la clasificación de Atlanta proporciona la terminología más aceptada en este momento para hablar de sus tipos morfológicos y clínicos entre los distintos especialistas expertos. El papel de la radiología viene dado fundamentalmente por la tomografía computarizada (TC), que permite hacer una clasificación morfológica de esta patología y predecir su gravedad clínica con la aplicación de índices de gravedad por imagen. Además, el drenaje radiológico guiado por TC o ecografía es, junto con el endoscópico, la técnica de elección actual en el abordaje inicial de las colecciones que aparecen como complicación. El objetivo de este trabajo es difundir los conceptos acuñados en la revisión de la clasificación de Atlanta y describir el papel actual del radiólogo en el diagnóstico y tratamiento de la pancreatitis aguda.
Acute pancreatitis is common and requires multidisciplinary management. The revised Atlanta classification, published in 2012, defines the terminology necessary to enable specialists from different backgrounds to discuss the morphological and clinical types of acute pancreatitis. Radiologists’ role depends fundamentally on computed tomography (CT), which makes it possible to classify the morphology of this disease and to predict its clinical severity by applying imaging severity indices. Furthermore, CT- or ultrasound-guided drainage is, together with endoscopy, the current technique of choice in the initial approach to collections that appear as a complication. This paper aims to disseminate the concepts coined in the revised Atlanta classification and to describe the current role of radiologists in the diagnosis and treatment of acute pancreatitis.
La pancreatitis aguda (PA) es una de las causas más comunes de ingreso hospitalario por enfermedad gastrointestinal y requiere un manejo multidisciplinar, especialmente en sus formas de presentación graves1. Es preciso utilizar una terminología común al hablar de sus distintos tipos clínicos y morfológicos para una adecuada comunicación entre especialistas, una mejor clasificación de los pacientes para ofrecerles el tratamiento más apropiado, y una mayor consistencia y reproducibilidad de los datos de cara a la investigación. La revisión de 2012 de la clasificación de Atlanta (CA)2, documento de consenso que surgió a partir de un borrador de trabajo disponible en la red desde 20083 que ya incluía la mayor parte de los cambios en la nomenclatura clínica y radiológica de la PA posteriormente publicados en 2012, acuñó las definiciones más aceptadas internacionalmente en este momento para hablar sobre PA y ha supuesto un gran avance en la estandarización de la nomenclatura.
La tomografía computarizada (TC) es la técnica de imagen en la que se sigue basando la valoración de la PA2, aunque otras técnicas como la ecografía y la resonancia magnética (RM) tienen una función complementaria, sobre todo en la valoración de sus complicaciones4,5. Desde hace unos años, la tendencia en el manejo de la PA es hacia procedimientos mínimamente invasivos, tanto en el diagnóstico de la infección como en el tratamiento de las complicaciones, con un importante papel de las técnicas radiológicas.
En el presente trabajo, revisando las publicaciones recientes, se recordará la terminología propuesta por la revisión de la CA para hablar de los tipos morfológicos y clínicos de la PA (haciendo hincapié en algunos aspectos de mejora), se revisará la utilidad de la radiología en la evaluación de sus complicaciones y se expondrán las tendencias actuales y perspectivas de futuro en su tratamiento.
Clasificación morfológica de la pancreatitis aguda según la revisión de la clasificación de AtlantaLa CA establece dos tipos morfológicos de PA2,6,7:
- •
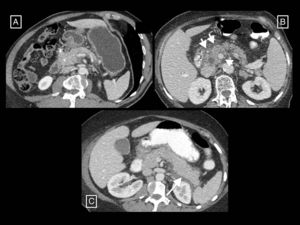
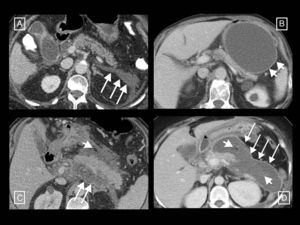
Pancreatitis edematosa intersticial (fig. 1): más frecuente y en la que se produce una inflamación no necrotizante del páncreas. En la TC con contraste, la glándula suele mostrar un engrosamiento focal o difuso y un realce generalmente homogéneo o en ocasiones heterogéneo debido al edema. La grasa peripancreática puede encontrarse estriada y se pueden observar pequeñas cantidades de líquido peripancreático (v. el apartado de colecciones pancreáticas y peripancreáticas). Sus síntomas suelen resolverse durante la primera semana.
Figura 1.Ejemplos de pancreatitis edematosa intersticial. A) Aumento del tamaño y contornos mal definidos de la cabeza del páncreas (asterisco). B) Otro caso con mayor estriación de la grasa peripancreática (flechas cortas) y un realce pancreático mínimamente heterogéneo debido a edema intersticial. C) Aumento de tamaño difuso y realce homogéneo del páncreas, y una pequeña colección líquida peripancreática aguda en torno a la cola (flecha larga).
(0.25MB). - •
Pancreatitis necrotizante (fig. 2): constituye del 5% al 10% de las PA y puede ser pancreática (5%), peripancreática (20%) o ambas (75%). En la TC con contraste, la necrosis pancreática se manifiesta como una o varias áreas de hipodensidad parenquimatosa, mientras que en la necrosis peripancreática el páncreas realza normalmente, pero los tejidos peripancreáticos desarrollan necrosis (v. el apartado de colecciones pancreáticas y peripancreáticas). Los pacientes con necrosis peripancreática aislada tienen una tasa de morbimortalidad superior a aquellos con una pancreatitis edematosa intersticial, aunque menor que los que presentan necrosis glandular. La historia natural de la necrosis pancreática y/o peripancreática es variable, ya que puede permanecer sólida o licuarse, permanecer estéril o infectarse, persistir o desaparecer con el tiempo.
Figura 2.Pancreatitis necrotizante. A) Necrosis pancreática: hipodensidad de la cola del páncreas con respecto al resto de la glándula (asterisco) compatible con necrosis. B) Necrosis peripancreática: el páncreas muestra un realce completo y homogéneo, pero se rodea de una colección parcialmente encapsulada (flechas largas) con contenido heterogéneo por elementos sólidos hipodensos en el seno del líquido (flechas cortas) indicativos de necrosis. C) Necrosis pancreática y peripancreática: necrosis glandular (asteriscos) y de los tejidos peripancreáticos formando una colección anterior al páncreas (flechas).
(0.34MB).
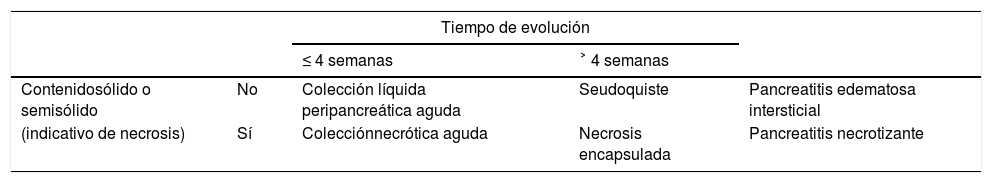
La CA divide las colecciones que pueden aparecer como complicación de la PA en función del contenido y el tiempo de evolución (se considera comienzo del cuadro el momento de inicio de los síntomas)2,6,7 (tabla 1, fig. 3):
- •
Colección líquida peripancreática aguda. Es la colección que aparece en la pancreatitis edematosa intersticial en las primeras 4 semanas de evolución. Se encuentra siempre adyacente al páncreas y se caracteriza por contener solo líquido (por definición carecen de componentes sólidos que indicarían necrosis), densidad homogénea, no tener pared definida y adaptarse a los planos fasciales del retroperitoneo (celda peripancreática, espacios pararrenales anteriores, etc.).
- •
Seudoquiste. Se refiere a la colección que aparece en la pancreatitis edematosa intersticial cuando persiste más de 4 semanas desde el inicio del cuadro. Se piensa que surge por disrupción del conducto pancreático principal o sus ramas. En la TC aparece como una colección redondeada u ovalada, en este caso con pared bien definida, y contenido solo líquido homogéneamente hipodenso sin elementos sólidos. El desarrollo de seudoquistes en la PA (en contra de lo que ocurre en la pancreatitis crónica) es un evento muy raro (la mayoría de las colecciones peripancreáticas persistentes en una PA contienen material necrótico), por lo que este término en el contexto de la PA se cree que posiblemente caerá en desuso.
- •
Colección necrótica aguda. Es la que aparece en la pancreatitis necrotizante durante las primeras 4 semanas. La necrosis puede afectar al parénquima pancreático y/o a los tejidos peripancreáticos y resulta de la liberación de enzimas pancreáticas que ocasionan digestión, saponificación de la grasa y necrosis de la misma. En la TC aparecen como colecciones intra- y/o extrapancreáticas que pueden ser múltiples, con una morfología frecuentemente loculada o septada, sin pared definida que las delimite por completo, y con densidad característicamente heterogénea por contener tanto líquido como material sólido indicativo de necrosis.
- •
Necrosis encapsulada. Es la colección que persiste más allá de 4 semanas en una pancreatitis necrotizante y consiste en tejido necrótico contenido en el interior de una cápsula hipercaptante de tejido inflamatorio reactivo. Aparecen como colecciones intra- y/o extrapancreáticas completamente encapsuladas y con densidad heterogénea por la presencia tanto de contenido líquido como sólido.
Tipos de colecciones en la pancreatitis aguda
| Tiempo de evolución | ||||
|---|---|---|---|---|
| ≤ 4 semanas | ˃ 4 semanas | |||
| Contenidosólido o semisólido | No | Colección líquida peripancreática aguda | Seudoquiste | Pancreatitis edematosa intersticial |
| (indicativo de necrosis) | Sí | Colecciónnecrótica aguda | Necrosis encapsulada | Pancreatitis necrotizante |
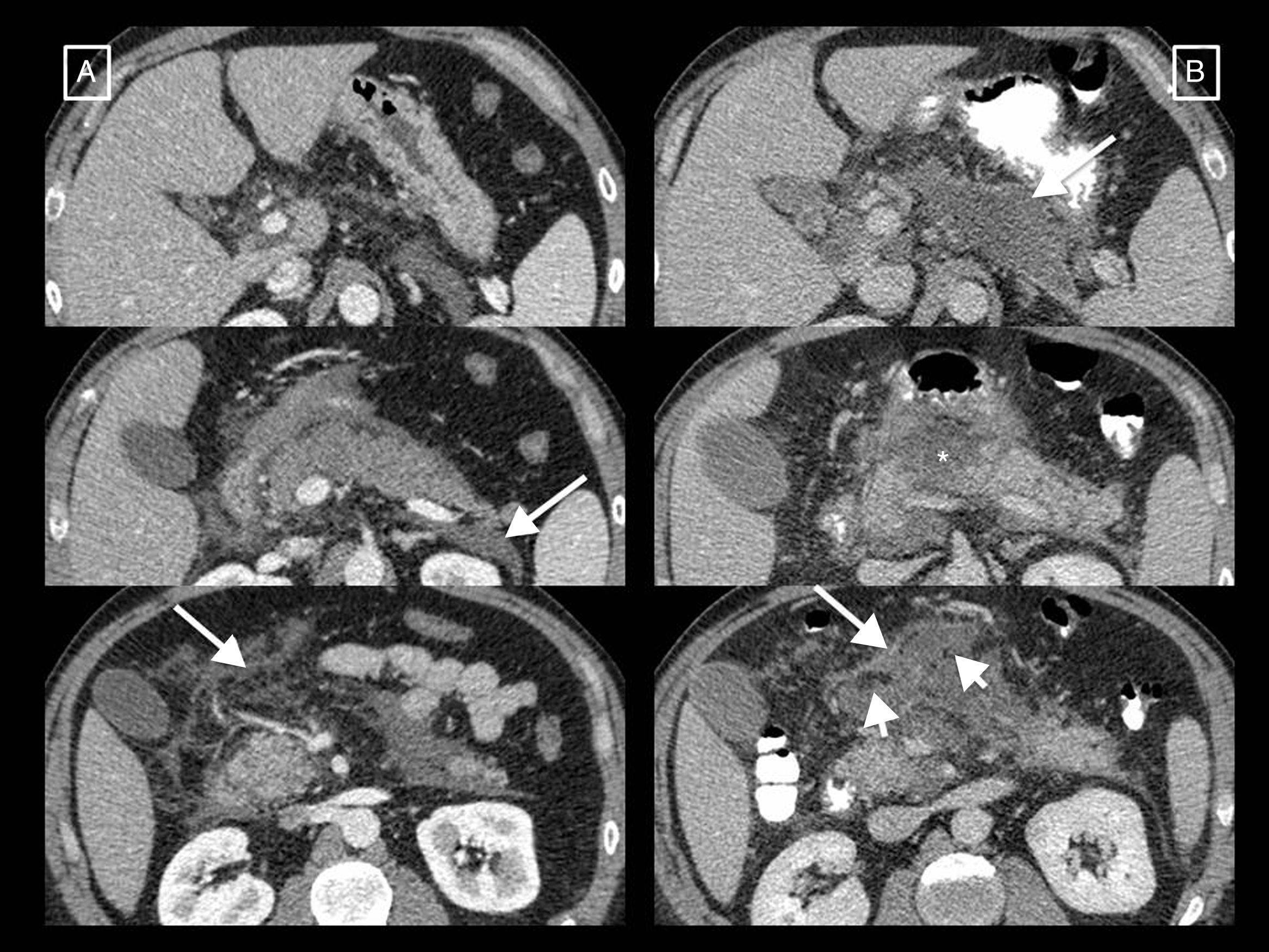
Tipos de colecciones en la pancreatitis aguda. A) La colección líquida peripancreática aguda (CLPA) es una colección líquida homogénea que se adapta a los espacios y planos fasciales (flechas largas). B) El seudoquiste resulta de la persistencia de una CLPA en el tiempo, dando lugar a una colección que sigue siendo homogéneamente líquida, pero que se rodea completamente de una cápsula de tejido de granulación (flechas cortas). C) La colección necrótica aguda (CNA) se caracteriza por su contenido heterogéneo, formado por líquido entremezclado con elementos sólidos o semisólidos (flecha corta). Puede estar parcialmente encapsulada (flechas largas). D) Cuando una CNA persiste más de 4 semanas y se encapsula completamente (flechas largas) se denomina necrosis encapsulada. Véanse los elementos sólidos hipo- e hiperdensos en su interior (flechas cortas) entremezclados con el líquido.
La CA acuña también el término seudoquiste posnecrosectomía2,6,7 para denominar la colección que puede aparecer en el lecho de necrosectomía cuando después de extraer el contenido de una necrosis encapsulada, la cavidad vuelve a rellenarse de jugo pancreático vertido por la cola remanente secretora que comunica con ella en el contexto de lo que se denomina un síndrome de desconexión del conducto pancreático (fig. 4). Suele formarse meses o incluso años después del inicio de la PA, y es el único caso en el que se habla de seudoquiste en la pancreatitis necrotizante.
Seudoquiste posnecrosectomía. Paciente con pancreatitis necrotizante que en la tomografía computarizada (TC) inicial (A) presenta una necrosis central del páncreas (asteriscos) sobre la que posteriormente desarrolló una necrosis encapsulada que se sobreinfectó (B, flechas cortas). La TC posnecrosectomía (C) muestra los catéteres Martín Palanca en el lecho. Los controles en los siguientes meses (D) demuestran la resolución de la colección. Sin embargo, 4 meses tras la necrosectomía (E) la colección recidiva (flecha larga) y se rellena de un líquido homogéneo correspondiente a jugo pancreático secretado por la cola viable debido a un síndrome de desconexión del conducto pancreático. Esta colección recidivada corresponde a un seudoquiste posnecrosectomía.
Quedan obsoletos el resto de términos previamente empleados como absceso pancreático, necroma, secuestro pancreático.
Clasificación clínica de la pancreatitis aguda según la revisión de la clasificación de AtlantaLa CA diferencia dos fases en el transcurso dinámico de esta patología2,6,7:
- •
Fase temprana: Comprende, en general, la primera semana del proceso y en ella la PA se manifiesta como una respuesta inflamatoria sistémica. La gravedad de la pancreatitis y su tratamiento van a depender, por tanto, fundamentalmente de parámetros clínicos, concretamente de si se produce o no fallo orgánico y de su duración. Aunque en esta fase se pueden producir complicaciones locales, se ha comprobado que la extensión de los cambios morfológicos en la PA en este momento no necesariamente se correlaciona con su gravedad clínica.
- •
Fase tardía: A partir de la segunda semana, aunque puede durar semanas o meses. Ocurre, por definición, solo en pacientes con PA moderada o grave y se caracteriza por la persistencia de los datos sistémicos de inflamación o por la presencia de complicaciones locales o sistémicas, de manera que el tratamiento se basará, en este momento, tanto en criterios clínicos como radiológicos. Y así, aunque el principal determinante de la gravedad seguirá siendo el fallo orgánico persistente, será importante distinguir por imagen los diferentes tipos de complicaciones locales por las implicaciones que hacerlo conllevará en el manejo del paciente.
La CA define complicaciones locales y sistémicas2. Las primeras incluyen las colecciones peripancreáticas (colección líquida peripancreática aguda, seudoquiste, colección necrótica aguda o necrosis encapsulada), la alteración funcional en el vaciamiento gástrico, la trombosis venosa esplénica o portal, y la necrosis colónica. Y considera complicación sistémica la exacerbación de comorbilidades preexistentes (coronariopatía, enfermedad pulmonar obstructiva crónica) precipitada por la PA. Por otra parte, siguiendo la escala modificada de Marshall8 (tabla 2), la CA distingue entre fallo orgánico transitorio (aquel que se resuelve en las primeras 48h), persistente (el que persiste más de 48h) y fallo multiorgánico (el que afecta a más de un órgano o sistema). Y teniendo en cuenta los tipos de complicaciones y de fallo orgánico determina los siguientes grados de gravedad (tabla 3):
- •
PA leve es aquella que cursa sin fallo orgánico, complicaciones locales ni sistémicas. Estos pacientes suelen ser dados de alta durante la fase temprana, no suelen requerir pruebas de imagen y la mortalidad asociada es muy rara.
- •
PA moderada es la que cursa con fallo orgánico o multiorgánico transitorio o con complicaciones locales o sistémicas. Puede resolverse sin intervención (p. ej., si hay fallo orgánico transitorio o una colección líquida peripancreática aguda) o requerir cuidados especializados prolongados (como en caso de necrosis estéril extensa) y su mortalidad, aunque mayor que la de la PA leve, es mucho menor que en la grave.
- •
PA grave es la que cursa con fallo orgánico o multiorgánico persistente. Los pacientes que lo desarrollan a menudo tienen una o varias complicaciones locales asociadas, y los que lo hacen en los primeros días tienen un riesgo aumentado de mortalidad de hasta el 36-50%. El desarrollo de necrosis infectada en estos pacientes asocia una mortalidad extremadamente alta.
Sistema de puntuación de Marshall modificado para la definición de fallo orgánico
| Puntuación | |||||
|---|---|---|---|---|---|
| Órgano-sistema | 0 | 1 | 2 | 3 | 4 |
| Respiratorio | |||||
| (PaO2/FiO2) | >400 | 301-400 | 201-300 | 101-200 | ≤ 101 |
| Renala | |||||
| (Cr μmol/l) | ≤ 134 | 134-169 | 170-310 | 311-439 | > 439 |
| (Cr mg/dl) | <1,4 | 1,4-1,8 | 1,9-3,6 | 3,6-4,9 | > 4,9 |
| Cardiovascular | |||||
| (PS mmHg)b | > 90 | <90, respondiendo a fluidoterapia | <90, no respondiendo a fluidoterapia | <90, pH <7,3 | <90, pH <7,2 |
| Para pacientes no ventilados, la FiO2 puede estimarse de la siguiente manera: | |
| Oxígeno suplementario (l/min) | FiO2(%) |
| Aire ambiente | 21 |
| 2 | 25 |
| 4 | 30 |
| 6-8 | 40 |
| 9-10 | 50 |
Nota: Una puntuación de 2 o más en cualquier sistema define la presencia de fallo orgánico.
Grados de gravedad de la pancreatitis aguda según la revisión de la clasificación de Atlanta
| Pancreatitis aguda leve |
| Sin fallo orgánico |
| Sin complicaciones locales ni sistémicas |
| Pancreatitis aguda moderada |
| Con fallo orgánico transitorio (se resuelve en menos de 48 h) y/o |
| Complicaciones locales o sistémicas sin fallo orgánico persistente |
| Pancreatitis aguda grave |
| Con fallo orgánico persistente (>48 h), ya sea de un solo órgano o multiorgánico |
Esta clasificación clínica ha supuesto también un avance en la estandarización de la nomenclatura; sin embargo, adolece de considerar de forma somera factores con un impacto importante en la evolución de los pacientes, como las complicaciones vasculares arteriales del tipo trombosis o sobre todo los seudoaneurismas9. La CA sí que hace mención, después de clasificar los grados de gravedad de la PA, a que la fistulización al tracto gastrointestinal o la diferente naturaleza de las distintas colecciones peripancreáticas serán de potencial importancia porque conllevarán un diferente manejo2, pero dichas diferencias no influyen en el momento de clasificar la gravedad de los pacientes y son aspectos con diferente pronóstico (p. ej., no tienen la misma evolución y consecuencias una colección líquida peripancreática aguda que una colección necrótica aguda) que probablemente deban ser incluidas en la determinación de la gravedad en futuras revisiones9. Lo mismo ocurre con la infección de la necrosis, puesto que la CA afirma que es un marcador de riesgo aumentado de muerte y que dicho riesgo es diferente en pacientes sin o con fallo orgánico persistente2, pero su presencia o ausencia tampoco cambia la clasificación de la gravedad. A este respecto, en 2012 la Determinant-based Classification (DBC)10, otra clasificación de la PA internacional multidisciplinar definió la necrosis glandular o peripancreática y el fallo orgánico como determinantes locales y sistémicos de gravedad, respectivamente, y clasificó la PA en leve, moderada, grave y crítica; esta última es la que cursa sincrónicamente con necrosis infectada y fallo orgánico persistente. No obstante, se ha publicado algún trabajo en el que no se han encontrado diferencias significativas en el desenlace de los pacientes aplicando la CA o la DBC11.
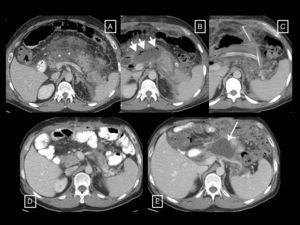
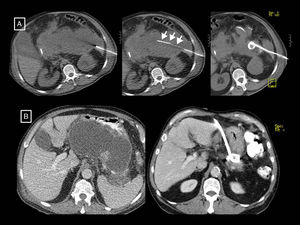
Papel de la radiología en la evaluación de la gravedad de la pancreatitis agudaEl diagnóstico de PA requiere de dos de los tres criterios siguientes2,12: a) clínico (dolor sugerente), b) analítico (elevación de los niveles de amilasa o lipasa séricas tres veces por encima del límite superior) y/o c) radiológico (criterios de PA en la TC –v. el apartado de tipos morfológicos de pancreatitis aguda–, la RM o la ecografía). La principal técnica de imagen en la evaluación de la PA sigue siendo la TC, que se realizará en la valoración inicial solo en caso de diagnóstico incierto de abdomen agudo (cuando no se cumplan criterios clínicos y analíticos, ya que si se cumplen y no hay criterios clínicos de gravedad no serán necesarias pruebas de imagen), cuando haya predictores clínicos de PA grave o si falla la respuesta inicial al tratamiento conservador o hay deterioro clínico12. El momento óptimo para hacerla será al menos 72 horas después del inicio del cuadro 12 porque es el tiempo que puede tardar la necrosis en establecerse y hacerse patente en la imagen13; una TC demasiado precoz podría infraestimarla (fig. 5). En el seguimiento se hará en caso de no mejoría o empeoramiento, o si se plantea un tratamiento invasivo12.
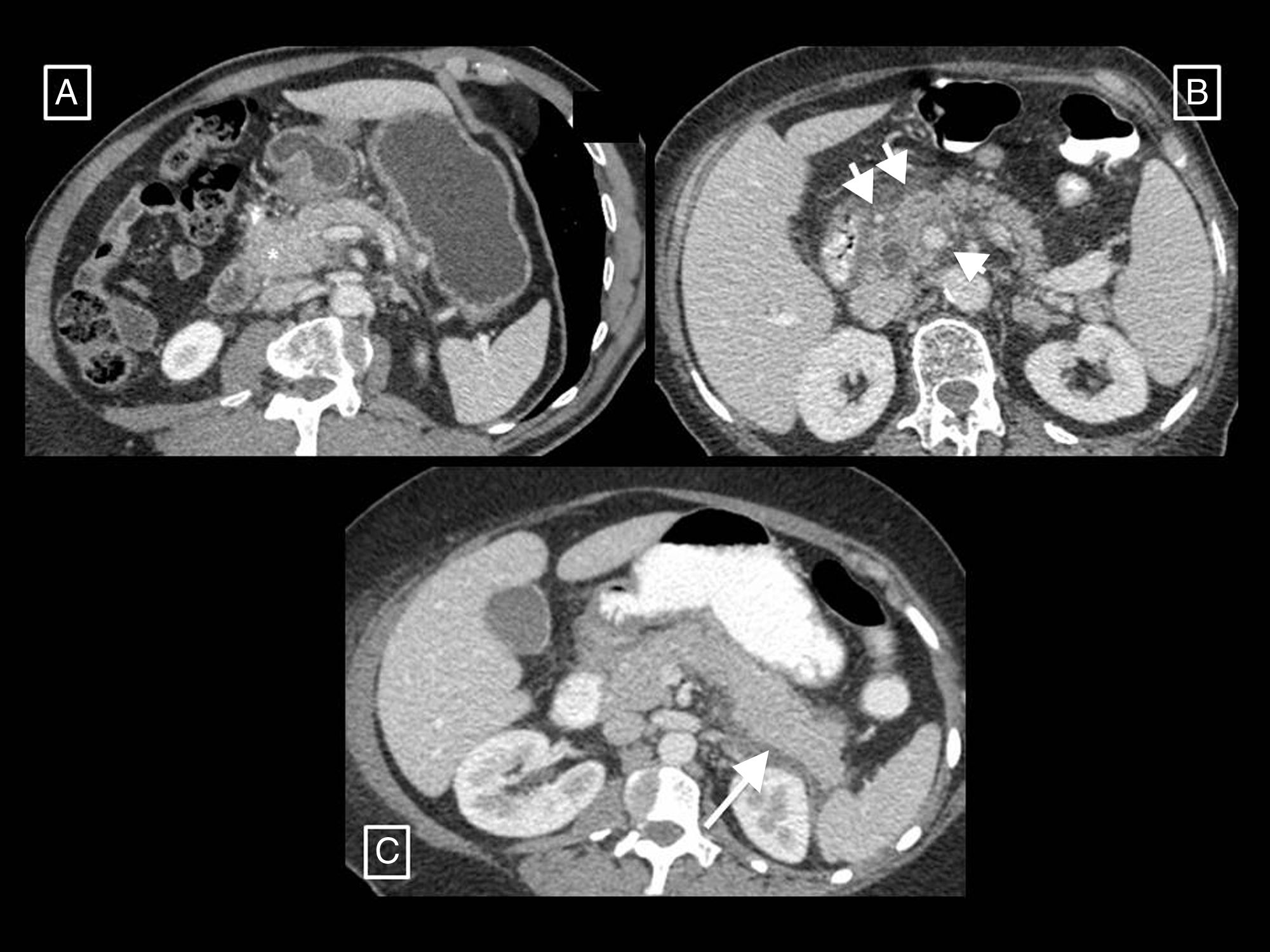
Ejemplo de cómo una tomografía computarizada (TC) demasiado precoz puede infraestimar la necrosis en la pancreatitis aguda. En este estudio de TC (columna de imágenes (A), realizado el día de inicio de un cuadro de dolor abdominal, se describió que el páncreas se encontraba aumentado de tamaño sin zonas sugerentes de necrosis y con colecciones líquidas peripancreáticas agudas (flechas largas). En el control llevado a cabo 10 días después (columna de imágenes B), se hace evidente una zona de necrosis glandular (asterisco) y un aumento de las colecciones, que muestran encapsulación parcial (flechas largas) y contienen elementos sólidos grasos (flechas cortas) que las hace compatibles con colecciones necróticas agudas.
Hay gran variabilidad en la literatura científica respecto al protocolo técnico que utilizar. Pero en general se recomienda emplear cortes finos (≤ 5mm), administrar 100-150 ml de contraste intravenoso no iónico a unos 3 ml/s y obtener una fase pancreática (retardo de 35-40 s) y/o portal (retardo de 50-70 s)12. Para el seguimiento puede ser suficiente con la fase portal y solo se realizarán estudios multifásicos si se sospecha hemorragia, seudoaneurisma arterial o isquemia mesentérica12.
La función fundamental de la TC en la evaluación de la gravedad de la PA será determinar la presencia de complicaciones locales, la extensión de la necrosis y la sobreinfección. Desde hace años se han utilizado sistemas de puntuación radiológicos para predecir la gravedad clínica de la PA13 y poder adoptar así medidas más precoces y radicales en caso de PA grave por imagen. Los más extendidos han sido el grado de Balthazar, publicado en 198514 (tabla 4), basado en los datos de inflamación pancreática/peripancreática y la presencia de colecciones, y el índice de gravedad por TC (IGTC), descrito en 1990 también por Balthazar et al.15 (tabla 5) teniendo en cuenta además la extensión de la necrosis pancreática. Pero este último, el más popular de todos, ha demostrado según algunos autores16 solo una moderada concordancia interobservador y una correlación clínicamente no significativa con el desarrollo de fallo orgánico. Otros autores17 han señalado una correlación significativa entre la PA grave y la presencia y extensión de las colecciones extrapancreáticas, y se han demostrado casos de PA grave con grados D o E de Balthazar sin necrosis pancreática18. Todo ello pone de relieve la importancia pronóstica de la necrosis de los tejidos extrapancreáticos19. En esta línea, Mortele et al. publicaron en 2004 el IGTC modificado16 (tabla 6), en el que además de los parámetros del IGTC se puntúa la necrosis grasa peripancreática y se tienen en cuenta las complicaciones extrapancreáticas (derrame pleural, ascitis, complicaciones vasculares, afectación del tracto gastrointestinal), con lo que demuestra, además, mayor correlación que el IGTC con el tiempo de estancia hospitalaria y el desarrollo de fallo orgánico16. Tanto el IGTC como el IGTC modificado han demostrado una buena concordancia con la gradación de la gravedad clínica de la pancreatitis según la CA20. No obstante, al utilizar la nomenclatura estandarizada acuñada por la CA parece más sencillo y reproducible el cálculo del IGTC modificado (en el que se puntúan términos similares a los establecidos por la CA como «colección líquida pancreática o peripancreática» o «necrosis grasa peripancreática», v. tabla 6) que el del IGTC (en el que se consideran otros más ambiguos y no estandarizados como «una o varias colecciones líquidas mal definidas» u otros obsoletos como el de «flemón», v. tabla 5). Estudios como el de Heiss et al.21, que demuestran una mortalidad significativamente mayor en presencia de colecciones a distancia (en gotieras paracólicas y espacios pararrenales posteriores, especialmente izquierdo), que en ausencia de ellas, y otros más recientes como el de Meyrignac et al.22, basados en la valoración cuantitativa de la necrosis extrapancreática, persisten en la búsqueda de predictores de gravedad por imagen, los más recientes empleando la terminología actualizada de la CA. Esta terminología, por cierto, ha demostrado una buena concordancia interobservador, que llega a ser muy buena entre radiólogos expertos23.
Grados de Balthazar
| Criterios tomográficos | Grado |
|---|---|
| Páncreas normal | A |
| Aumento de tamaño focal o difuso del páncreas sin enfermedad peripancreática | B |
| Inflamación peripancreática | C |
| Colección líquida aguda peripancreática única | D |
| Dos o más colecciones líquidas peripancreáticas agudas. Gas pancreático o retroperitoneal | E |
Índice de gravedad por tomografía computarizada
| Características | Puntuación |
|---|---|
| Inflamación pancreática | |
| Páncreas normal | 0 |
| Aumento focal o difuso del páncreas | 1 |
| Inflamación peripancreática | 2 |
| Colección líquida aguda peripancreática o flemón únicos | 3 |
| Dos o más colecciones líquidas peripancreáticas agudas o gas en o adyacente al páncreas | 4 |
| Necrosis parenquimatosa pancreática | |
| Ausente | 0 |
| Menor del 30% | 2 |
| Entre el 30% y el 50% | 4 |
| Mayor del 50% | 6 |
Nota: Siguiendo este sistema de puntuación, la gravedad de la pancreatitis para cada paciente se cataloga como leve (0-3 puntos), moderada (4-6 puntos) o grave (7-10 puntos).
Índice de gravedad por tomografía computarizada modificado
| Características | Puntuación |
|---|---|
| Inflamación pancreática | |
| Páncreas normal | 0 |
| Alteraciones pancreáticas con o sin inflamación en la grasa peripancreática | 2 |
| Colección líquida pancreática o peripancreática o necrosis grasa peripancreática | 4 |
| Necrosis parenquimatosa pancreática | |
| Ausente | 0 |
| Menor o igual al 30% | 2 |
| Mayor del 30% | 4 |
| Complicaciones extrapancreáticas (derrame pleural uni- o bilateral, ascitis, complicaciones vasculares, complicaciones parenquimatosas o afectación del tracto gastrointestinal) | 2 |
Nota: Siguiendo este sistema de puntuación, la gravedad de la pancreatitis para cada paciente se cataloga como leve (0-2 puntos), moderada (4-6 puntos) o grave (8-10 puntos).
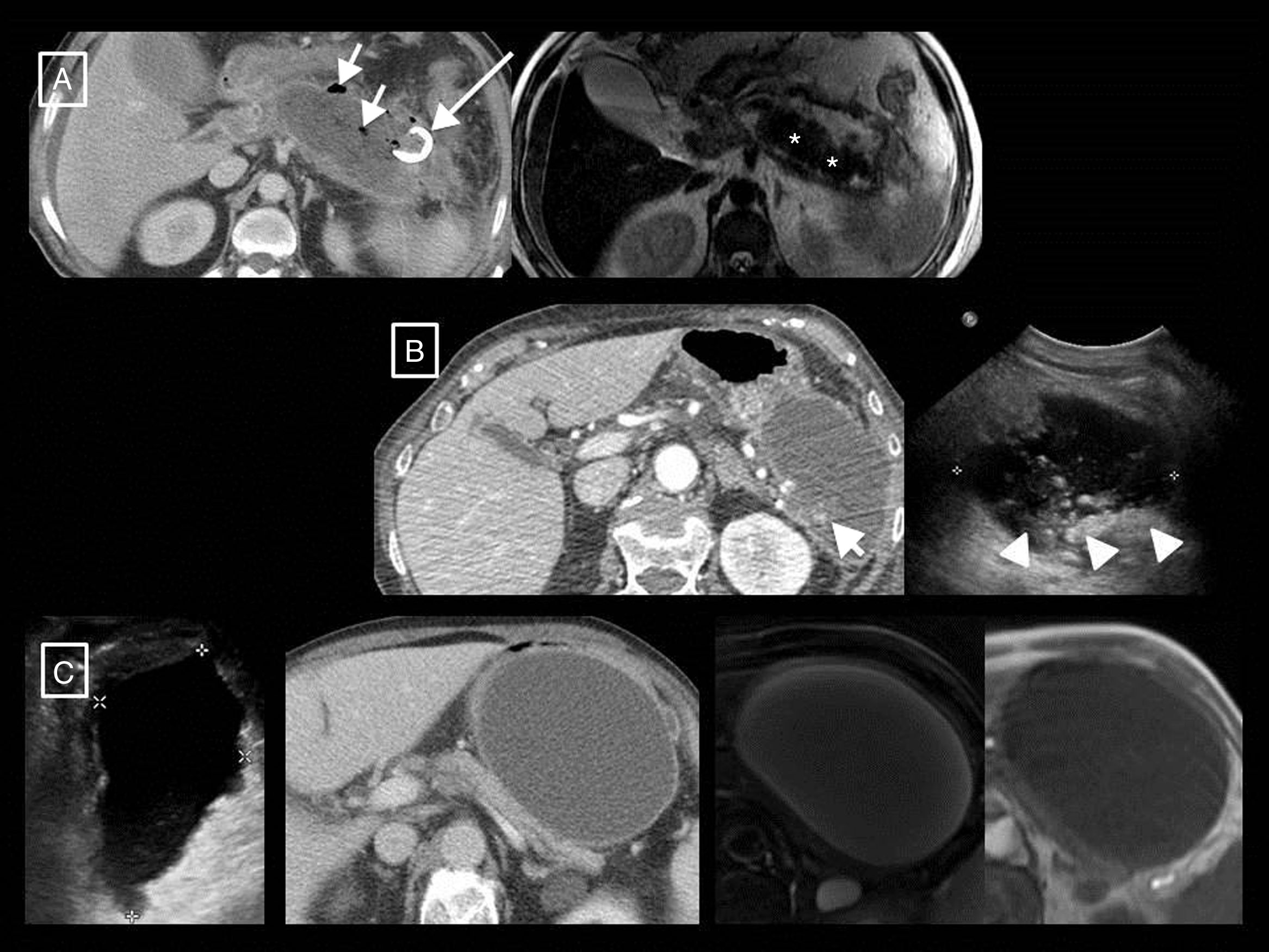
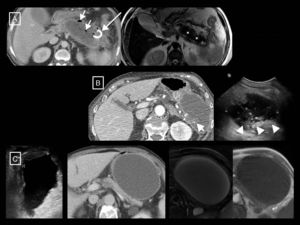
Otra técnica de imagen de gran utilidad en la valoración de la PA, aunque en general menos disponible, es la RM. Las secuencias potenciadas en T1 y T2, sin y con saturación grasa (esta última con la ventaja de permitir una mejor diferenciación entre las colecciones y la grasa retroperitoneal), y 3D eco de gradiente potenciadas en T1 antes y después de la administración de contraste intravenoso12 proporcionarán la misma información que el TC en cuanto a gravedad, aunque con mayor resolución tisular a la hora de diferenciar el contenido de las colecciones. De hecho, tanto la RM potenciada en T2 como la ecografía en modo B estarán indicadas cuando sea clínicamente relevante la diferenciación entre seudoquiste y colección necrótica y la TC no sea capaz de discriminarlas12 (fig. 6). Además, añadir secuencias de colangio-RM permitirá valorar la existencia de obstrucción ductal, dilatación, variantes anatómicas o complicaciones como el síndrome de desconexión del conducto pancreático24. La ecografía sigue siendo la técnica inicial para el diagnóstico de la etiología litiásica, y se ha descrito la ecografía con contraste como alternativa a la TC para detectar la necrosis pancreática y predecir el curso clínico de la enfermedad4, aunque esta técnica no se ha incluido en la mayoría de las guías.
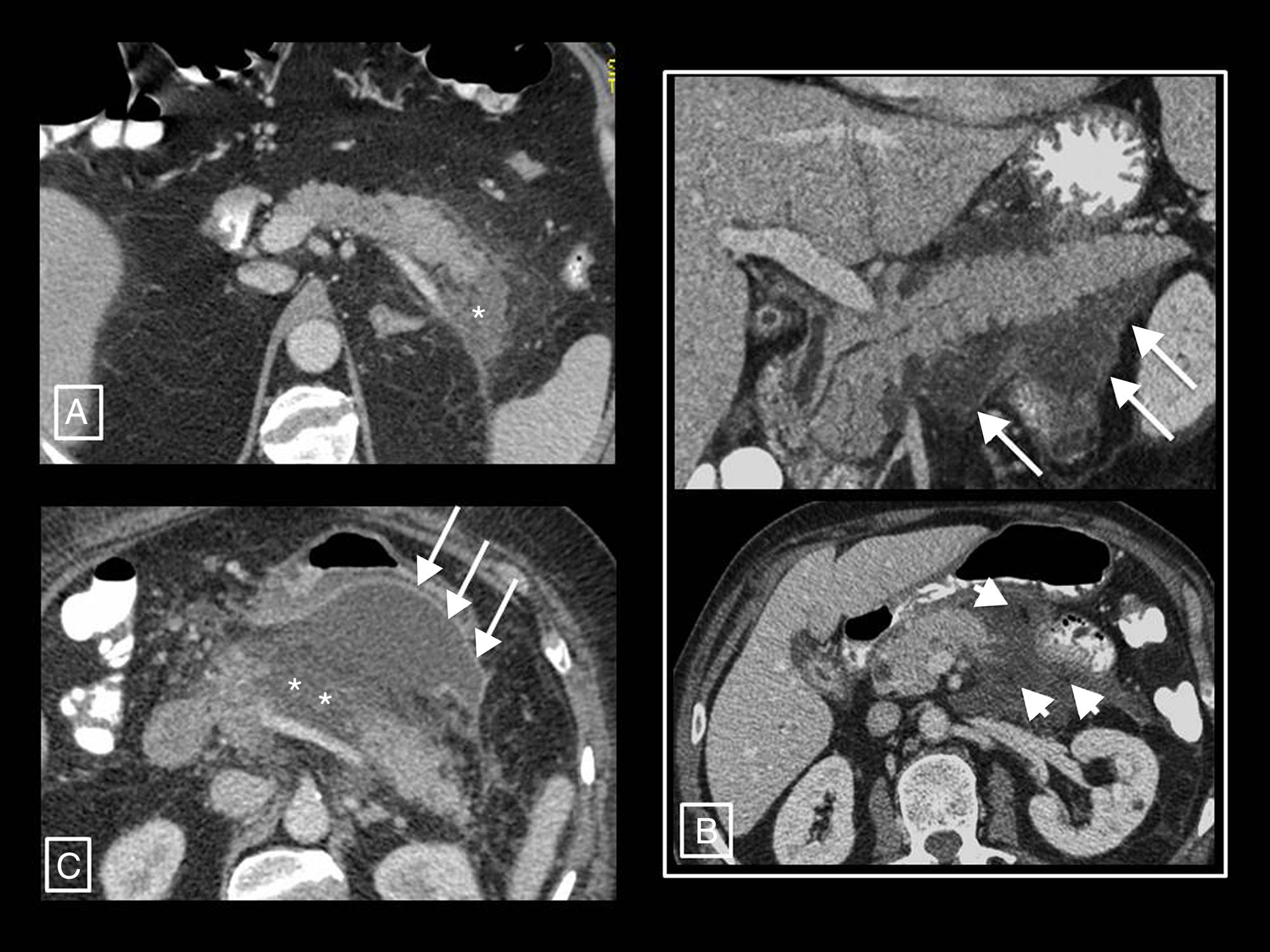
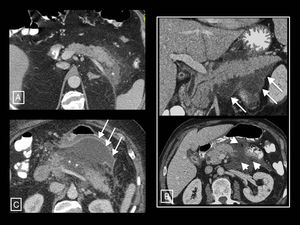
Ejemplos de la mayor resolución tisular de la resonancia magnética (RM) y la ecografía en la diferenciación del contenido sólido y líquido de las colecciones de la pancreatitis aguda. A y B) Necrosis encapsulada en dos pacientes. En el primero, la RM potenciada en T2 demuestra mejor que la tomografía computarizada (TC) que la mayor parte de la colección está formada por la cola pancreática necrosada (asteriscos). Véase, sin embargo, la mayor sensibilidad y especificidad de la TC con respecto a la RM en la demostración de pequeñas burbujas de gas (flechas cortas), en este caso secundarias a un catéter radiológico (flecha larga). En el segundo, aunque la TC muestra algunos focos densos sólidos en su interior (flecha corta), la ecografía los pone de manifiesto más claramente y en mayor cantidad (cabezas de flecha). En este otro paciente (C; mismo de la Figura 3 B) se demuestra de izquierda a derecha el aspecto homogéneo de un seudoquiste que fue creciendo en ecografía, TC y RM potenciada en T2 y T1. Los seudoquistes en ecografía pueden mostrar finos ecos en su interior, pero nunca elementos claramente sólidos como los del ejemplo B.
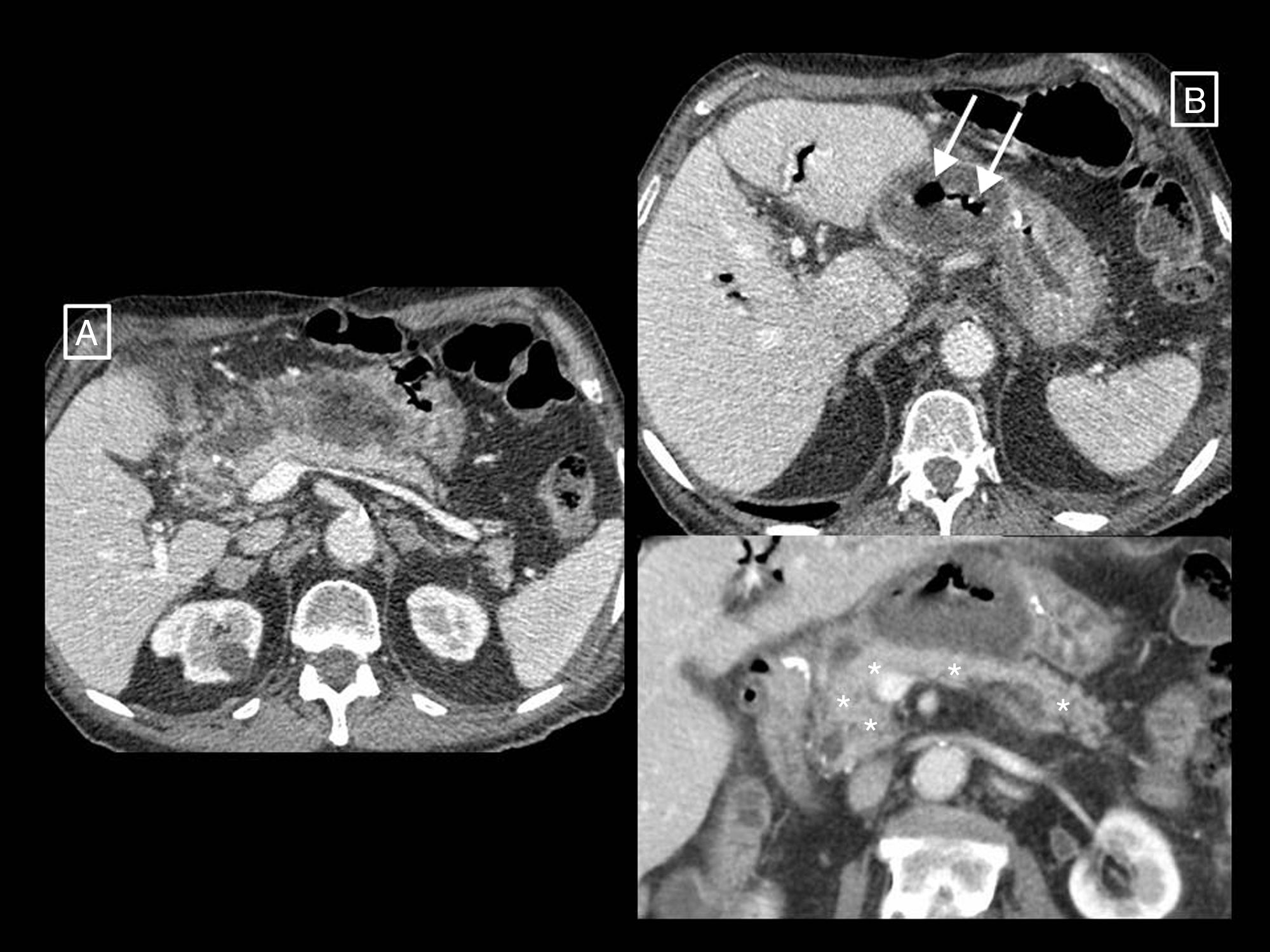
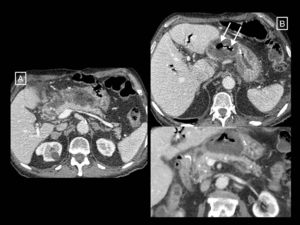
En cuanto a la infección, esta se produce hasta en el 30% de las pancreatitis necrotizantes, y detectarla es importante por la necesidad de tratamiento antibiótico y posible tratamiento invasivo que puede requerir2. En la práctica diaria, su diagnóstico se basa en criterios clínicos (fiebre, marcadores inflamatorios séricos elevados, fallo orgánico de nueva aparición), radiológicos (presencia de gas extraluminal pancreático o peripancreático en la TC) (fig. 7) o en el resultado positivo de un cultivo o Gram tras una punción-aspiración con aguja fina (PAAF)2,25. Previamente, la sospecha de infección suponía la necesidad de confirmarla mediante PAAF y en su caso realizar una necrosectomía electiva26,27. Sin embargo, actualmente la utilidad de la PAAF es más controvertida. Van Baal et al.25 o las guías del Grupo de Trabajo de Pancreatitis Aguda de la Asociación Internacional de Pancreatología y la Asociación Pancreática Americana12 defienden que en la mayoría de los casos los signos clínicos y radiológicos son suficientemente precisos en el diagnóstico de sobreinfección. Otros, como Freeman et al.28 o la guía del Colegio Americano de Gastroenterología29 argumentan que ahora se tiende a evitar la intervención temprana y si se hace es con técnicas de drenaje percutáneo o endoscópico mínimamente invasivas con las que se pueden obtener muestras para cultivo sin necesidad de una punción diagnóstica previa. Además, la necrosis con sospecha de sobreinfección puede tratarse solo con antibióticos empíricos (sin necesidad de PAAF) cuando no hay signos de sepsis28,29. Y se han descrito tasas de falsos negativos de hasta el 25%, así como riesgo de introducir la infección con la propia punción25. En conclusión, las indicaciones de la PAAF han quedado reducidas a pacientes sin signos clínicos o radiológicos claros de infección, pero que no mejoran durante semanas12,25, o a sospecha de sobreinfección fúngica en pacientes en los que la antibioticoterapia no mejora la fiebre o la leucocitosis28,29.
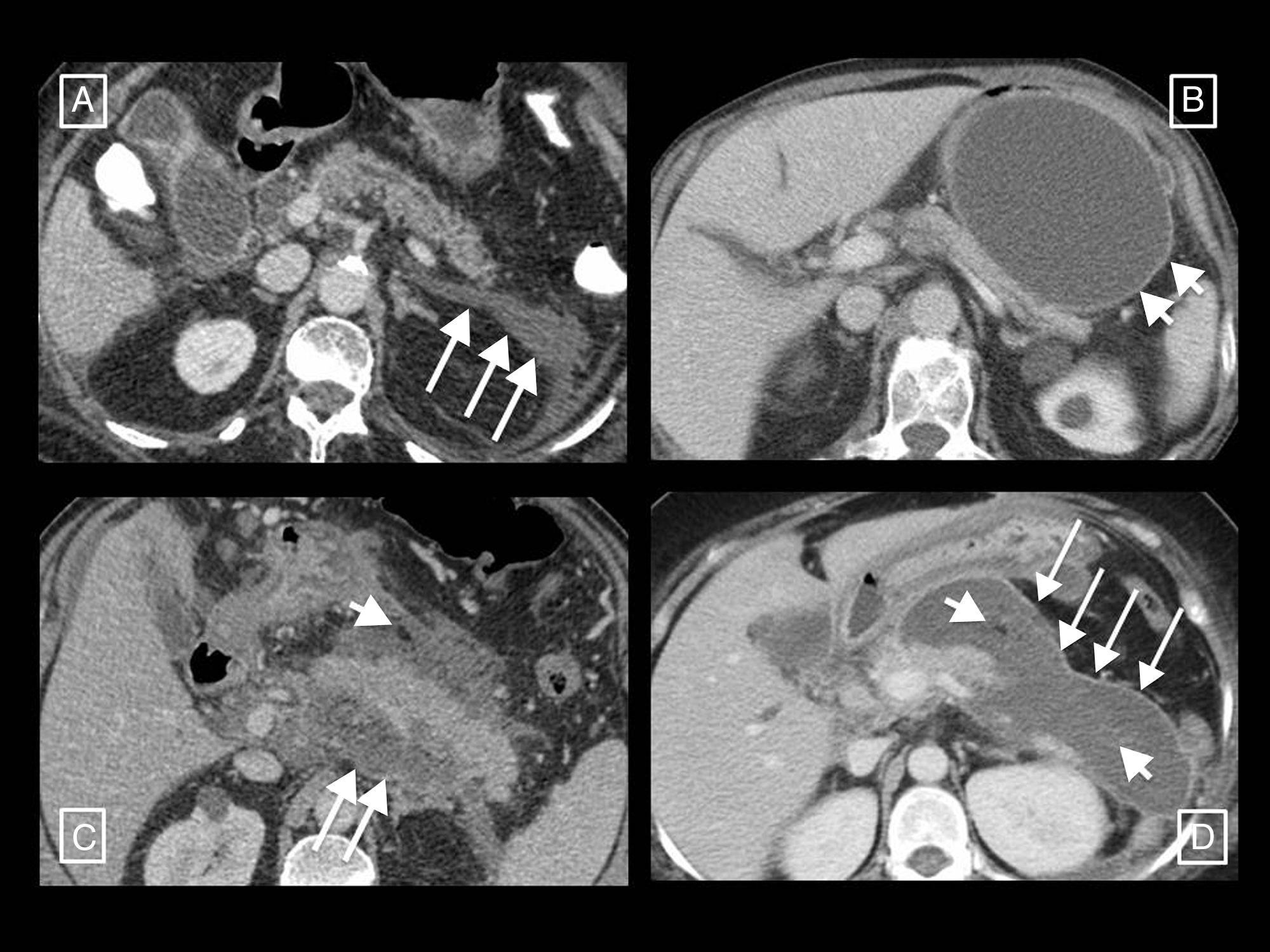
Necrosis peripancreática infectada. En el primer estudio (A) se observan datos de pancreatitis necrotizante solo peripancreática en forma de colección heterogénea y mal definida anterior a la cabeza y cuerpo del páncreas compatible con colección necrótica aguda. En un control realizado por fiebre pasadas más de 4 semanas desde el inicio del cuadro (B) se observa que la colección está completamente encapsulada (necrosis encapsulada) y han aparecido burbujas de gas (flechas largas) compatibles con sobreinfección. En la reconstrucción coronal inferior se aprecia el páncreas normalmente realzante (asteriscos).
Otros métodos no invasivos de detección de infección en la PA estudiados recientemente son la RM-difusión5,30 y la tomografía por emisión de positrones-tomografía computarizada (PET-TC) con leucocitos marcados con 18F-FDG31, con buenos resultados preliminares.
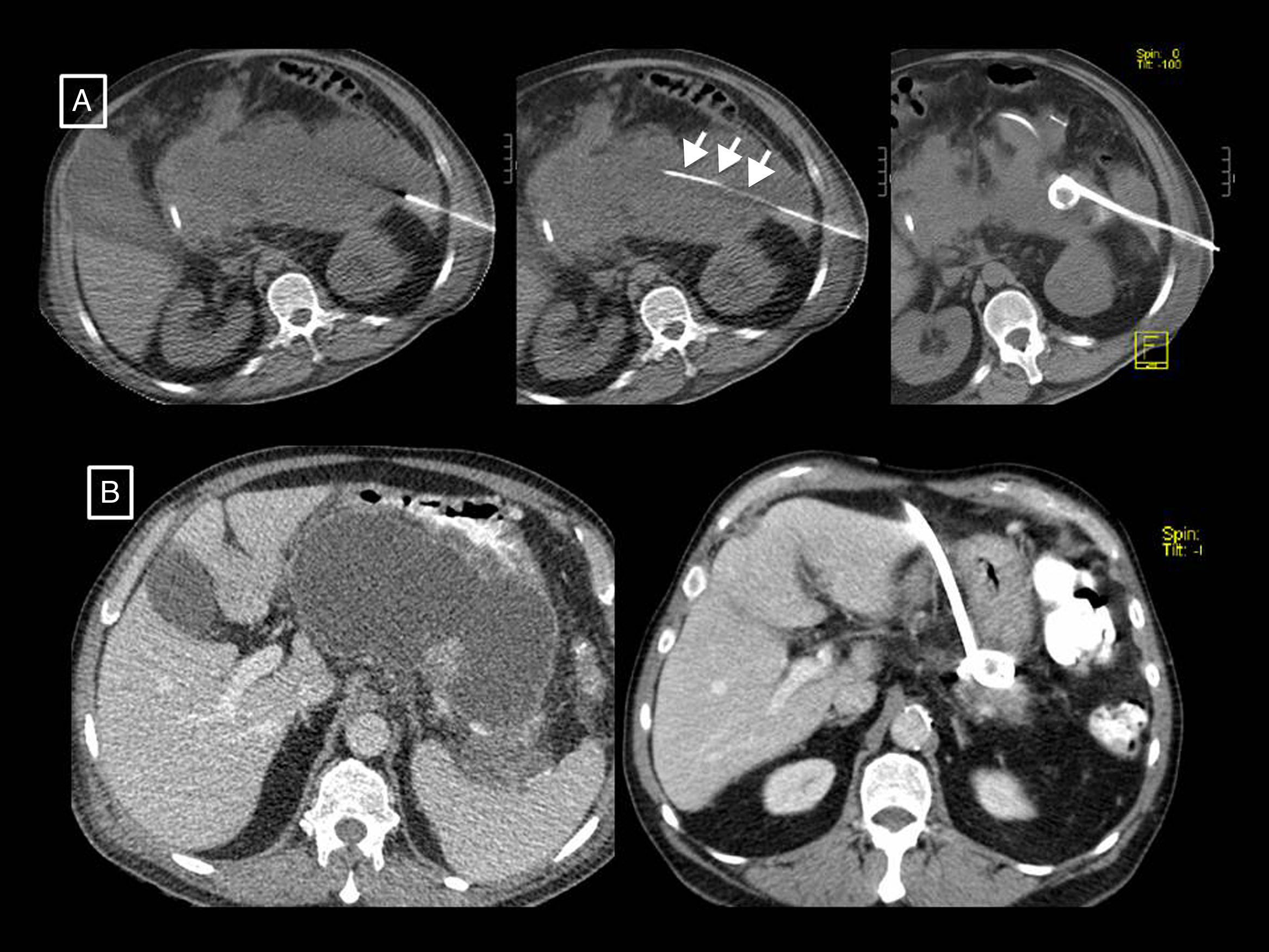
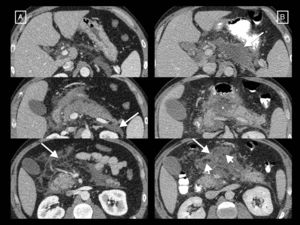
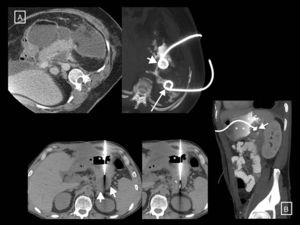
Papel de la radiología en el tratamiento de las complicacionesEl papel de las técnicas radiológicas en el tratamiento de las complicaciones de la PA es la monitorización del tratamiento y servir de guía para el drenaje de colecciones. A lo largo de los años ha habido un cambio en el manejo de la PA complicada respecto a las indicaciones, cronología y abordaje32. Históricamente, muchas necrosis estériles se intervenían, mientras que la principal indicación actual es la infección. Se ha pasado de la necrosectomía precoz a la intervención diferida, pasadas al menos 4 semanas, para facilitar que las colecciones se encapsulen, lo que ha demostrado menor morbimortalidad. La tendencia actual es hacia el tratamiento mínimamente invasivo frente a la clásica necrosectomía quirúrgica abierta que ha quedado relegada a la última opción terapéutica. El cambio de paradigma tuvo su punto de inflexión en 2010 con la publicación de los resultados del ensayo clínico aleatorizado PANTER33. Este estudio demostró que, comparado con la necrosectomía abierta, un abordaje escalonado mínimamente invasivo basado en el drenaje percutáneo como primera intervención, seguido o no de necrosectomía retroperitoneal videoasistida (el llamado «step-up approach» percutáneo/quirúrgico), reducía la tasa de complicaciones mayores y muerte en pacientes con pancreatitis necrotizante infectada, y que más de un tercio se trataban exitosamente con el drenaje no requiriendo una cirugía mayor. Posteriormente se han publicado varios estudios que demuestran también que la mayoría de los pacientes con pancreatitis necrotizante se pueden manejar de manera conservadora32,34,35, y que un número considerable del resto (hasta un 55,7%) pueden tratarse con drenaje radiológico sin necesidad de necrosectomía34 (fig. 8). En caso de necesitarla, el drenaje habrá permitido controlar la sepsis y demorar la cirugía, favoreciendo una mejor delimitación del tejido necrótico y minimizando así la resección de tejido viable, disminuyendo los efectos adversos postoperatorios y mejorando la función endocrina y exocrina pancreática a largo plazo28. Posteriormente, en 2012, el ensayo PENGUIN36 comparó la necrosectomía transgástrica endoscópica con la necrosectomía quirúrgica retroperitoneal videoasistida, encontrando que con la endoscópica se reducía la respuesta proinflamatoria y se producían menor tasa de muerte y complicaciones mayores, incluida la aparición de fallo orgánico. Desde entonces, el abordaje escalonado endoscópico ha ido ganando popularidad al mismo tiempo que el anteriormente comentado abordaje escalonado percutáneo/quirúrgico. En 2018, el ensayo TENSION37 concluyó que ambos abordajes son igual de válidos, pero que la menor tasa de fístulas pancreáticas y estancia hospitalaria que conlleva el endoscópico probablemente haga que en aquellos lugares en los que ambas opciones estén disponibles se empiece por la endoscópica. En nuestro centro, donde no existe disponibilidad de necrosectomía endoscópica, el drenaje percutáneo es la técnica de elección para el tratamiento de las complicaciones. El drenaje radiológico de las colecciones es técnicamente factible en el 95% de los casos12, y sus indicaciones son12 la pancreatitis necrotizante con sospecha de infección y deterioro clínico (principal indicación) o con fallo orgánico que persiste varias semanas aun en ausencia de signos de infección, y excepcionalmente las pancreatitis necrotizantes estériles cuando hay una obstrucción al vaciamiento gástrico, intestinal o biliar por el efecto masa de la necrosis, dolor o malestar persistente, o en caso de conducto pancreático desconectado persistentemente sintomático. El procedimiento puede realizarse mediante control de TC o ecografía, y técnica Seldinger o punción directa, si es posible mediante un abordaje retroperitoneal a través del espacio pararrenal anterior izquierdo (fig. 8 A), aunque puede optarse por un trayecto transperitoneal o transgástrico si se considera más accesible y/o seguro para el paciente (fig. 8 B, fig. 9). En nuestra experiencia se emplean catéteres autorretentivos de gran calibre (12-16 F) para maximizar el drenaje, si bien es cierto que no hay estudios que demuestren qué calibres utilizar primero ni que confirmen que mayores calibres conlleven mejores resultados37; la colocación de varios drenajes puede ayudar incluso a crear un sistema de lavado de la cavidad drenada. Es muy importante el cuidado periódico del mecanismo por parte de enfermería, con lavados-aspiración por turno (10 cc de suero salino fisiológico cada 8h), así como por el radiólogo cada 24-48 horas para evitar su obstrucción. En caso de que se produzca, se procederá al recambio del tubo y solo cuando el paciente no mejore con estas medidas, que es en contadas ocasiones, se planteará el paso a la necrosectomía quirúrgica. Hasta el momento se solía esperar 4 semanas desde el inicio del cuadro para el drenaje de colecciones, pero un tema controvertido últimamente cuando se emplea el drenaje radiológico como estrategia inicial de tratamiento es el momento de hacerlo38. El ensayo POINTER39, actualmente en marcha, pretende dilucidar si es necesario esperar también 4 semanas para drenar o si hacerlo antes podría reducir complicaciones y tiempo de estancia hospitalaria. Sus resultados están previstos para 2019.
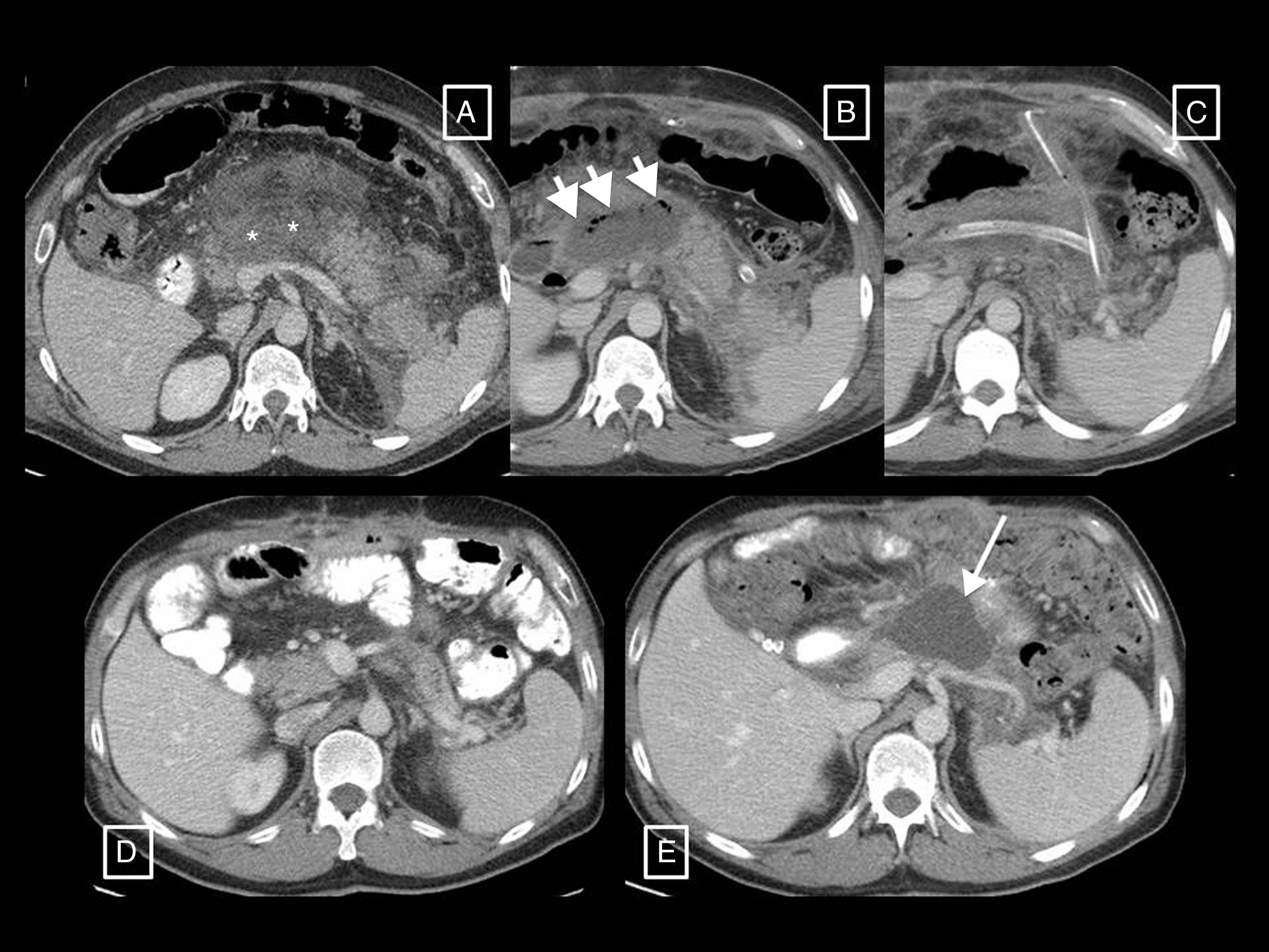
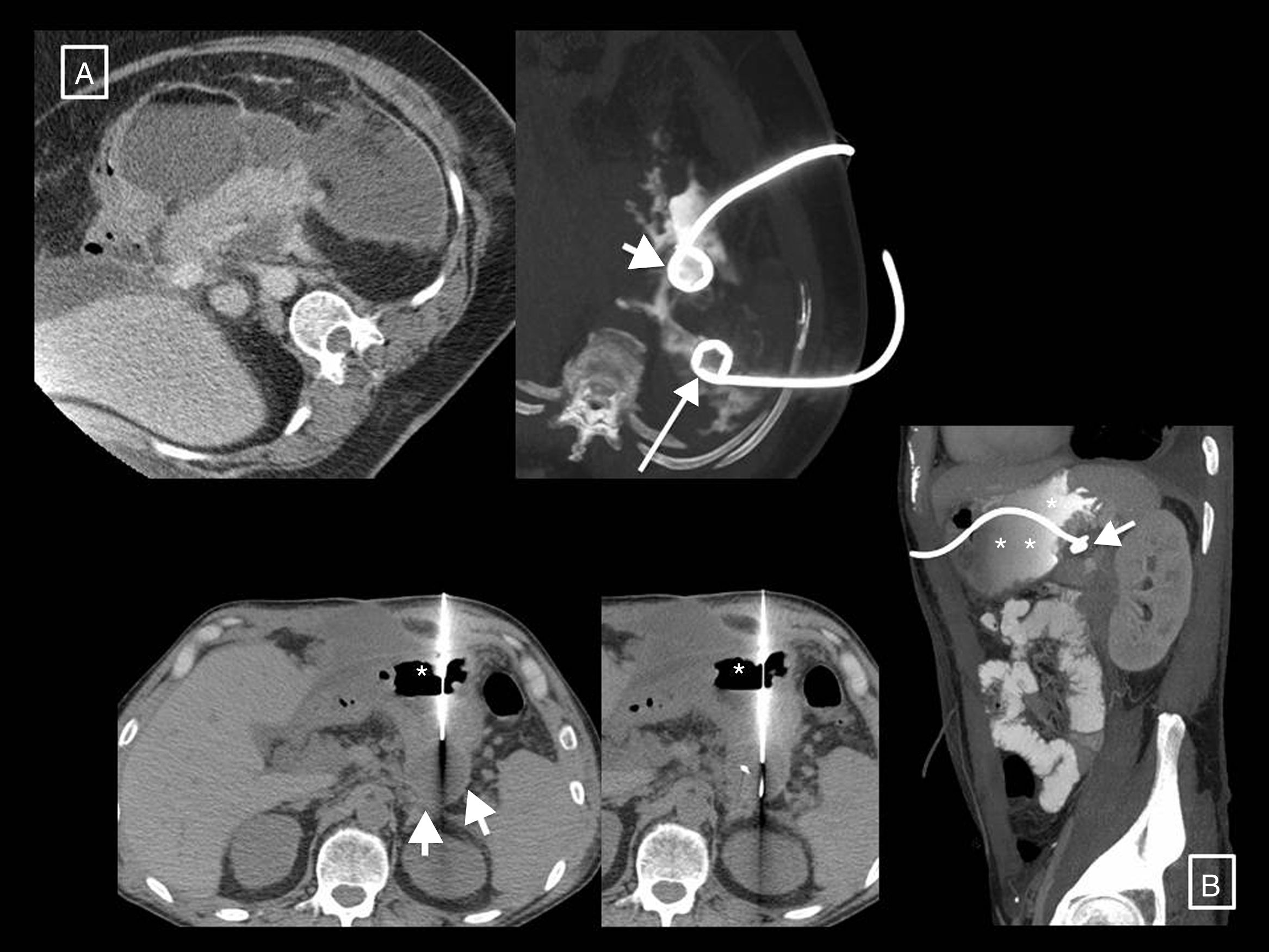
Dos ejemplos de pancreatitis necrotizante resueltas solo con drenaje radiológico. A) En el primer paciente se muestra, de izquierda a derecha, la colocación de un tubo de drenaje con técnica Seldinger mediante el abordaje clásico a través del espacio pararrenal anterior izquierdo, colocando en primer lugar la aguja de punción inicial en el interior de la colección, pasando a través de ella una guía (flechas cortas) y dejando alojado, previo paso de los respectivos dilatadores (no mostrados), un catéter de 12 F. B) En el segundo paciente se observa cómo una gran necrosis encapsulada se resuelve gracias al drenaje radiológico, en este caso con un abordaje subcostal anterior derecho y un tubo de 14 F.
Otros dos ejemplos de pancreatitis necrotizantes resueltas solo con drenaje radiológico. A) En el primer paciente se muestra una gran colección necrótica que rodea anteriormente el cuerpo del páncreas y se extiende al espacio pararrenal anterior izquierdo. En ella se colocó un primer catéter más anterior y medial (flecha corta) que no terminó de resolver la colección por sí solo, motivo por el cual más tarde se colocó otro más posterior y lateral (flecha larga). La introducción de contraste a través de estos catéteres (imagen de la derecha, reconstrucción MIP axial oblicua) demostró que efectivamente drenaban zonas interconectadas entre sí, de manera que se creó un sistema de lavado de la cavidad, con un tubo para la entrada del suero y el otro para el drenaje de la necrosis, que consiguió resolverla finalmente. B) Paciente con datos clínico-analíticos de infección y varias necrosis encapsuladas, una de ellas retrogástrica (flechas cortas), sobre la que se decidió realizar un drenaje transgástrico. Véase el acceso a la colección a través del estómago cuya luz se señala con asteriscos, y cómo en la reconstrucción MIP sagital de un control posterior (en este caso la luz gástrica está opacificada con contraste oral) la colección en torno al extremo del tubo se ha resuelto (flecha corta).
La revisión de 2012 de la CA proporciona la terminología más aceptada en este momento para referirse a la PA. Los parámetros que predicen su gravedad son el desarrollo y duración del fallo orgánico y la aparición de complicaciones. La TC es la técnica de elección en la valoración de sus complicaciones locales, y se han descrito varios índices radiológicos como predictores adicionales de gravedad, si bien el consenso actual no les otorga el papel central que tienen los datos clínicos. Desde hace unos años, la tendencia en el manejo de la PA es hacia procedimientos cada vez menos invasivos, por lo que ahora son excepcionales los casos en los que se realiza PAAF o que se intervienen quirúrgicamente. La infección se presume ante signos clínicos y/o radiológicos sugerentes, y el drenaje radiológico es, junto con el endoscópico, la técnica de elección actual en el abordaje de las colecciones. En estos momentos se investigan los potenciales beneficios de realizarlo antes de las 4 semanas de evolución.
Autoría- 1.
Responsable de la integridad del estudio: CMOM.
- 2.
Concepción del estudio: CMOM.
- 3.
Diseño del estudio: CMOM.
- 4.
Obtención de los datos: CMOM, ELGB, JROM, EPDA, JALC.
- 5.
Análisis e interpretación de los datos: CMOM, ELGB, JROM, EPDA, JALC.
- 6.
Tratamiento estadístico: NA.
- 7.
Búsqueda bibliográfica: CMOM, JROM.
- 8.
Redacción del trabajo: CMOM, ELGB, JROM.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ELGB, JROM.
- 10.
Aprobación de la versión final: CMOM, ELGB, JROM, EPDA, JALC.
Los autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a aquellos que, junto con los autores, han contribuido también a la culminación de este trabajo, especialmente al Dr. José María García Santos por haber participado en la revisión crítica del manuscrito y habernos animado, ahora y siempre, a publicar.