La RM es una técnica de imagen que se ha ido incorporando paulatinamente a la práctica clínica diaria del radiólogo de mama. Hay consenso en que deben cumplirse una serie de requerimientos técnicos mínimos para conseguir un estudio de calidad diagnóstica y los criterios diagnósticos se basan fundamentalmente en las categorías BI-RADS del ACR (American College of Radiology). La estadificación del cáncer de mama es una de sus principales aplicaciones clínicas, aunque no está exenta de polémica. Otras aplicaciones donde se ha validado la técnica son la evaluación de respuesta al tratamiento, el cribado en pacientes de alto riesgo, el estudio del cáncer de mama oculto, el estudio de una sospecha de recidiva y la valoración de las prótesis de mama.
Breast magnetic resonance imaging is a modality that is being progressively integrated into the breast radiologist's daily clinical practice. There is consensus on the minimal technical requirements that a breast MR exam should have in order to attain diagnostic quality. Diagnostic criteria are mainly based on the American College of Radiology's BI-RADS magnetic resonance imaging categories. Breast cancer staging is a main clinical application, but it is not universally accepted. Other applications are: response evaluation in patients treated with chemotherapy, screeening in high-risk patients, cancer of unknown origin, assessment of a possible relapse and breast implant evaluation.
La integración de la RM de mama en el arsenal diagnóstico del radiólogo implica que debe conocer una serie de requisitos prácticos y técnicos si desea obtener el máximo rendimiento de la información morfológica y funcional que esta modalidad nos proporciona1,2.
Hardware: imanes y bobinasEn la elección de la máquina y otros componentes convergen dos requerimientos opuestos: la resolución espacial y temporal. La RM de mama es técnicamente exigente y se beneficia de estrategias de imagen avanzadas (imagen en paralelo), gradientes potentes (> 20 mT/m) y alto campo (> 1 T). Deben emplearse bobinas de superficie receptoras específicas para el estudio de las mamas. Las bobinas multielementos ofrecen mayor relación señal-ruido y la posibilidad de imagen en paralelo.
Posición de la paciente, field of view y cobertura anatómicaLa paciente estará posicionada en decúbito prono, con los brazos situados a lo largo del cuerpo para aumentar la cobertura anatómica de la bobina. Habitualmente se utilizan fields of view (FOV) de 280 a 320mm con una matriz de 512 x 256 o 512 x 512mm (dependiendo del plano de corte). La cobertura anatómica en la dirección del grosor de corte debe incluir desde la región supraclavicular hasta el pliegue inframamario. El estudio incluirá ambas mamas.
Elección del plano de corte: sagital, axial o coronalEl plano sagital es probablemente el plano más natural, pero no es el de elección. La ventaja técnica de este plano es que requiere un FOV relativamente pequeño, lo cual mejora la resolución espacial en cualquier matriz de adquisición (sin penalización en el tiempo de adquisición). La única desventaja es que se necesitan demasiados cortes para cubrir ambas mamas, razón por la cual se ha utilizado solo en RM de una sola mama. Recientemente han aparecido protocolos sagitales bilaterales basados en la imagen en paralelo (VIBRANT).
Los protocolos dinámicos actuales más difundidos utilizan el plano axial o coronal. Las imágenes en plano coronal presentan la ventaja de que pueden ser adquiridas con un FOV rectangular al 50-60%, lo cual reduce el tiempo de adquisición. Sin embargo, requiere un mayor número de cortes en la dirección AP que en el caso de la imagen axial (cráneo-caudal). No obstante, ambas orientaciones son perfectamente válidas.
Es imprescindible orientar la dirección de la codificación de fase de tal manera que se minimicen los artefactos por movimiento. En el plano sagital, la dirección deberá ser cabeza-pies. En el plano axial, de izquierda a derecha. En el plano coronal, cabeza-pies, de manera que el FOV pueda ser rectangular y se reduzca así el tiempo de adquisición.
Secuencias básicasSecuencias potenciadas en T2 precontrasteMediante las secuencias T2 precontraste podremos identificar los quistes debido a que presentan valores T2 muy superiores al resto de las estructuras de la glándula mamaria. También nos permitirán evaluar la intensidad de señal de las lesiones sólidas (excepto los carcinomas mucinosos y los fibroadenomas mixoides, hiperintensos, la mayoría de cánceres de mama son hipointensos), las regiones ganglionares y los cambios postratamiento (necrosis grasa, hematoma y seroma). Los valores de TR (tiempo de repetición) y de TE (tiempo de eco) son respectivamente TR > 2 s y TE > 80ms y la secuencia óptima es la de eco de espín rápida o fast spin-echo (FSE).
Las secuencias STIR (short ti inversion recovery) son una alternativa a las secuencias T2 FSE cuando se quiere suprimir la señal de la grasa y no presenta los requerimientos de homogeneidad de campo necesarios para las secuencias T2 con supresión grasa.
Secuencias dinámicas potenciadas en T1 3D eco de gradienteLas secuencias 3D presentan mayor relación señal-ruido que las 2D porque la señal se adquiere a partir de un volumen y no de un solo plano (en cada adquisición de datos se recoge más señal). Las secuencias 3D requieren un TR más corto y mantienen los tiempos de adquisición lo suficientemente cortos como para mantener la resolución temporal necesaria. En algunos protocolos se recomienda adquirir estas secuencias con supresión grasa para minimizar los artefactos por movimiento, pero hay que tener en cuenta que se requieren campos muy homogéneos. La sustracción de las secuencias es la alternativa a la supresión grasa, acompañada de una compresión suave de la mama para evitar artefactos por movimiento.
Las secuencias de perfusión, difusión y espectroscopia no han sido validadas todavía a gran escala y deben considerarse un complemento, no un sustituto, de las secuencias básicas.
Resolución temporalEl pico de captación en las lesiones malignas suele producirse entre los minutos 1 y 3 tras la inyección de contraste, razón por la cual la resolución temporal necesaria debe ser de menos de 120 segundos. La adquisición continua de secuencias temporales de 60-90 segundos a lo largo de un tiempo total de adquisición de 6 minutos es suficiente para determinar la morfología de la curva de contraste y determinar si la captación es continua, en meseta o lava precozmente.
Resolución espacialLa resolución espacial es el segundo requisito para el diagnóstico del cáncer con RM de mama, al igual que en el caso de la mamografía o la ecografía. Algunos de los criterios diagnósticos más importantes para el diagnóstico diferencial se basan en la morfología de las lesiones: bordes y arquitectura interna. En la RM de mama un aumento en la resolución espacial (aumento en el tamaño de la matriz de adquisición) se asocia a un aumento en el tiempo de adquisición. Se recomienda ajustar el tiempo de adquisición dinámica por secuencia en 60-120 segundos e invertir el resto en resolución espacial. Debería utilizarse la matriz de imagen más grande que se pueda obtener en esta ventana de adquisición: una matriz de adquisición real (no interpolada) de 512 x 512 en las secuencias bilaterales axiales o coronales (con un FOV de 320-350 mm). Estas especificaciones deberían traducirse en un tamaño de píxel en los planos X e Y de 0, 5 x 0, 5 a 0, 8 x 0, 8mm (resolución espacial isotrópica) y en un grosor de corte de 1-3mm (plano Z).
Administración del contrasteLa mayoría de los grupos emplean una dosis de 0,1 mmol/kg aunque la dosis aceptada oscila entre 0,1 y 0,2 mmol/kg. No está demostrado que una dosis superior a 0,1 mmol/kg mejore la detección. El contraste se inyecta a través de una vía intravenosa antes de colocar a la paciente en el imán y durante la inyección no se deberá mover a la paciente. Se debe utilizar un inyector a una velocidad de 3 ml/s seguido de un bolo de suero salino de 20ml. Habitualmente se inicia la primera secuencia poscontraste tras haber inyectado el contraste (durante la inyección del bolo de suero salino). No es necesario esperar entre la inyección y el inicio de la primera secuencia con contraste en protocolos de resolución temporal de 1-2 minutos. Lo ideal es que siempre se siga el mismo protocolo de inyección aunque hay que tener en cuenta que existen factores que alteran la velocidad de captación de las lesiones (edad de la paciente, frecuencia cardiaca, fracción de eyección, tiempo de circulación total).
Posprocesado de imágenesEl objetivo del posprocesado de las imágenes obtenidas con el estudio de RM de mama es proporcionar al radiólogo datos adicionales para la interpretación del mismo. El post-procesado de imágenes deberá incluir:
- 1)
Sustracción de imágenes (sustraer la primera o segunda secuencia con contraste de la secuencia sin contraste)
- 2)
Proyecciones de intensidad de señal máxima (MIP)
- 3)
Reconstrucción de las imágenes de sustracción en planos ortogonales (reconstrucciones multiplanares o MPR) y en planos que sigan el lobulillo anatómico mamario
- 4)
Curvas de captación en el tiempo en lesiones sospechosas (análisis cinético)
En el caso de que se disponga de software de CAD (computer-aided diagnosis) o software específico para análisis de imágenes paramétricas, se pueden crear mapas de imágenes paramétricas o mapas de captación con codificación de color según los parámetros asignados (velocidad máxima, lavado, captación superior al 100%, lavado superior al 10%, etc.).
Aspectos fisiopatológicos de las pacientesEn pacientes premenopáusicas el tejido fibroglandular es sensible a los estrógenos, modificando los fenómenos de vasodilatación y permeabilidad capilar a través de una respuesta histamina-like al estrógeno. El pico de captación en este grupo de mujeres aparece en las semanas 1 y 4 del ciclo menstrual. Habitualmente este patrón de captación es bilateral y casi nunca muestra lavado precoz (habitualmente se trata de un patrón de captación precoz pero continuo). No obstante, si es posible, la exploración deberá realizarse durante la segunda semana del ciclo menstrual (días 6-14) para evitar falsos positivos y enmascarar un cáncer de mama. Otro subgrupo de pacientes son las pacientes en periodo de lactancia y pacientes en tratamiento con THS, en quienes el patrón de la captación de contraste puede dar lugar también a falsos positivos. En estas últimas se puede interrumpir el tratamiento durante 4 semanas antes de realizar el estudio.
Resonancia magnética de mama: semiología básicaAngiogénesisLa angiogénesis en los tumores malignos es un proceso desorganizado y caótico. Existen ciertas características morfológicas y funcionales en el lecho tumoral que permiten la distinción entre procesos malignos y benignos y facilitan la detección del tumor por métodos de imagen:
- -
heterogeneidad espacial y estructura caótica
- -
vasos frágiles altamente permeables para las macromoléculas
- -
shunts arterio-venosos, tortuosidad vascular y vasodilatación
- -
heterogeneidad en la densidad vascular
La mayoría de estudios de RM de mama emplean secuencias T1 eco de gradiente para monitorizar los efectos de captación de contraste. El aumento en la intensidad de señal no es directamente atribuible al contraste per se sino que depende de un número de factores fisiológicos y físicos: perfusión tisular, permeabilidad capilar al contraste, volumen del espacio extracelular donde fuga el contraste, tiempos de relajación T1 basales del tejido, dosis de contraste y tipo de secuencia empleada. En estos métodos no se visualiza el contraste sino los cambios que produce en la relajatividad de los tejidos adyacentes (plasma y espacio extravascular-extracelular).
Criterios diagnósticos en resonancia magnética de mamaExiste acuerdo general sobre cuáles son los criterios diagnósticos más relevantes, aunque hay diferencias en la consideración de su peso específico. Las clasificaciones de Fischer y del Colegio Americano de Radiología (ACR), las más difundidas3-5, muestran criterios diagnósticos comunes, ambas han sido validadas6,7 e integran conjuntamente los criterios morfológicos y dinámicos en el análisis de las lesiones. La clasificación del ACR presenta la ventaja de que muestra un paralelismo con la clasificación BI-RADS de la mamografía y la ecografía y es la más utilizada, aunque enfatiza menos las características dinámicas. La clasificación de Fischer comparte con esta los criterios morfológicos y cuantifica mejor las características dinámicas aunque quizás da excesiva relevancia a estas en su puntuación o score final. La clasificación de Fischer propone un sistema de puntuación de signos semiológicos y puede ser muy útil para quien empieza a trabajar con imágenes de RM y en los estudios de evaluación de respuesta a la quimioterapia.
En los primeros estudios sobre criterios dinámicos se insistió en la importancia de la fase precoz para discriminar entre lesiones benignas y malignas, pero actualmente un gran porcentaje de autores atribuyen un mayor peso específico a la fase postinicial y tardía, considerando el wash-out o lavado como un criterio fiable de malignidad. Los cánceres de mama muestran captación de contraste (con algunas excepciones como casos aislados de carcinoma lobulillar y CDIS de bajo grado), pero también es cierto que muchas lesiones benignas captan contraste. Estos hechos nos demuestran que los datos dinámicos no deben constituir el único criterio diagnóstico empleado, sino que deben integrarse con otros criterios (los denominados morfológicos) para aumentar la especificidad al tipificar las lesiones.
Criterios diagnósticos de FischerLos criterios diagnósticos de Fischer-Baum se exponen en las tablas 1–3.
Criterios morfológicos y cinéticos en la clasificación de Fischer.
| Puntuación | 0 | 1 | 2 |
|---|---|---|---|
| Morfología | Redondeada, ovoidea | Dendrítica, irregular | - |
| Contornos | Bien definidos | Mal definidos | - |
| Patrón captación | Homogéneo | Heterogéneo | Anillo |
| Captación inicial | <50% | 50-100% | > 100% |
| Captación postinicial | >10% | Del +10 al -10% | < -10% |
Fuente: Fischer3.
Fórmulas para el cálculo de las captaciones inicial y postinicial.
| Captación inicial=(ISmáx durante minutos 1-3)−(IS pre-contraste)/ISpre-contraste |
| Captación postinicial=[(IS al minuto 6)−(IS máx durante minutos 1-3)/ISmáx durante minutos 1-3)] x 100 (%) |
| Captación continua: captación postinicial <10% |
| Plateau: captación postinicial del +10% al -10% |
| Lavado: captación postinicial <-10% |
IS: intensidad de señal.
Asignación de categorías según puntuación en la clasificación de Fischer.
| Grupo BI-RADS RM | Puntos | Valor diagnóstico |
|---|---|---|
| I | 0-1 | Benigno |
| II | 2 | Probablemente benigno |
| III | 3 | Probablemente benigno |
| IV | 4-5 | Sospechoso |
| V | 6-8 | Muy sugestivo de malignidad |
Fuente: Fischer3.
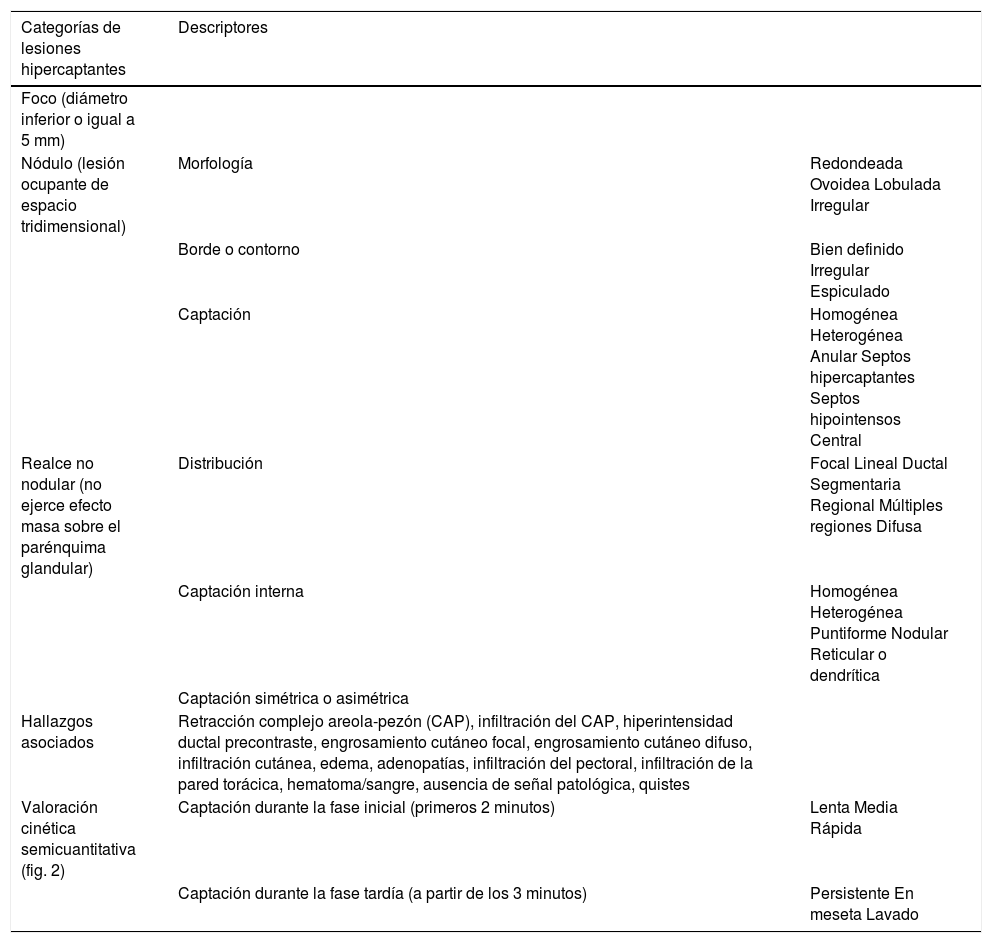
Los descriptores BI-RADS se exponen en la tabla 4 y las categorías diagnósticas son las mismas que se emplean en ecografía o mamografía (BI-RADS 0 a 6).
Criterios diagnósticos BI-RADS con sus correspondientes descriptores.
| Categorías de lesiones hipercaptantes | Descriptores | |
|---|---|---|
| Foco (diámetro inferior o igual a 5 mm) | ||
| Nódulo (lesión ocupante de espacio tridimensional) | Morfología | Redondeada Ovoidea Lobulada Irregular |
| Borde o contorno | Bien definido Irregular Espiculado | |
| Captación | Homogénea Heterogénea Anular Septos hipercaptantes Septos hipointensos Central | |
| Realce no nodular (no ejerce efecto masa sobre el parénquima glandular) | Distribución | Focal Lineal Ductal Segmentaria Regional Múltiples regiones Difusa |
| Captación interna | Homogénea Heterogénea Puntiforme Nodular Reticular o dendrítica | |
| Captación simétrica o asimétrica | ||
| Hallazgos asociados | Retracción complejo areola-pezón (CAP), infiltración del CAP, hiperintensidad ductal precontraste, engrosamiento cutáneo focal, engrosamiento cutáneo difuso, infiltración cutánea, edema, adenopatías, infiltración del pectoral, infiltración de la pared torácica, hematoma/sangre, ausencia de señal patológica, quistes | |
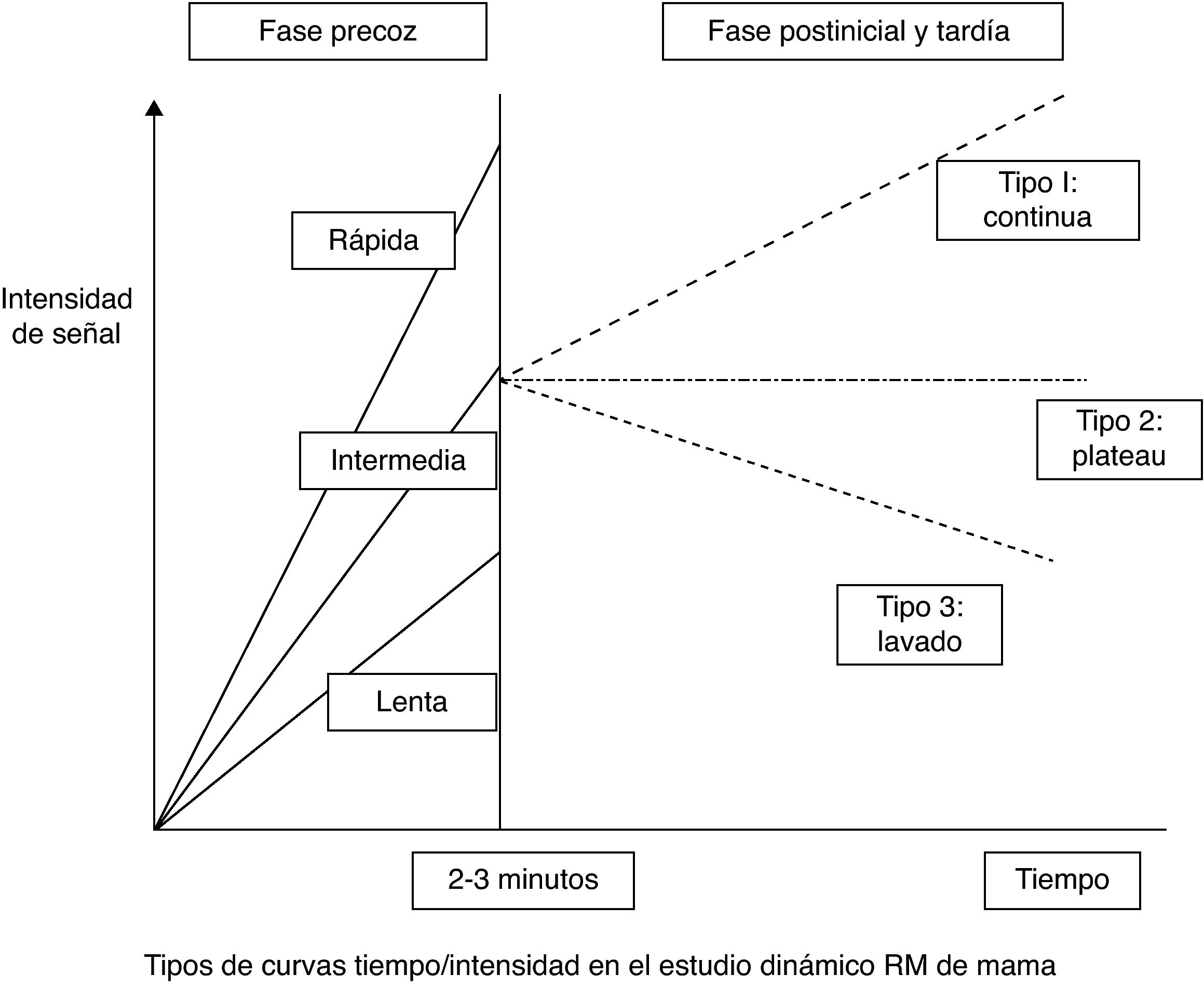
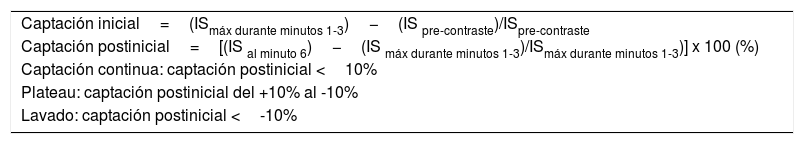
| Valoración cinética semicuantitativa (fig. 2) | Captación durante la fase inicial (primeros 2 minutos) | Lenta Media Rápida |
| Captación durante la fase tardía (a partir de los 3 minutos) | Persistente En meseta Lavado |
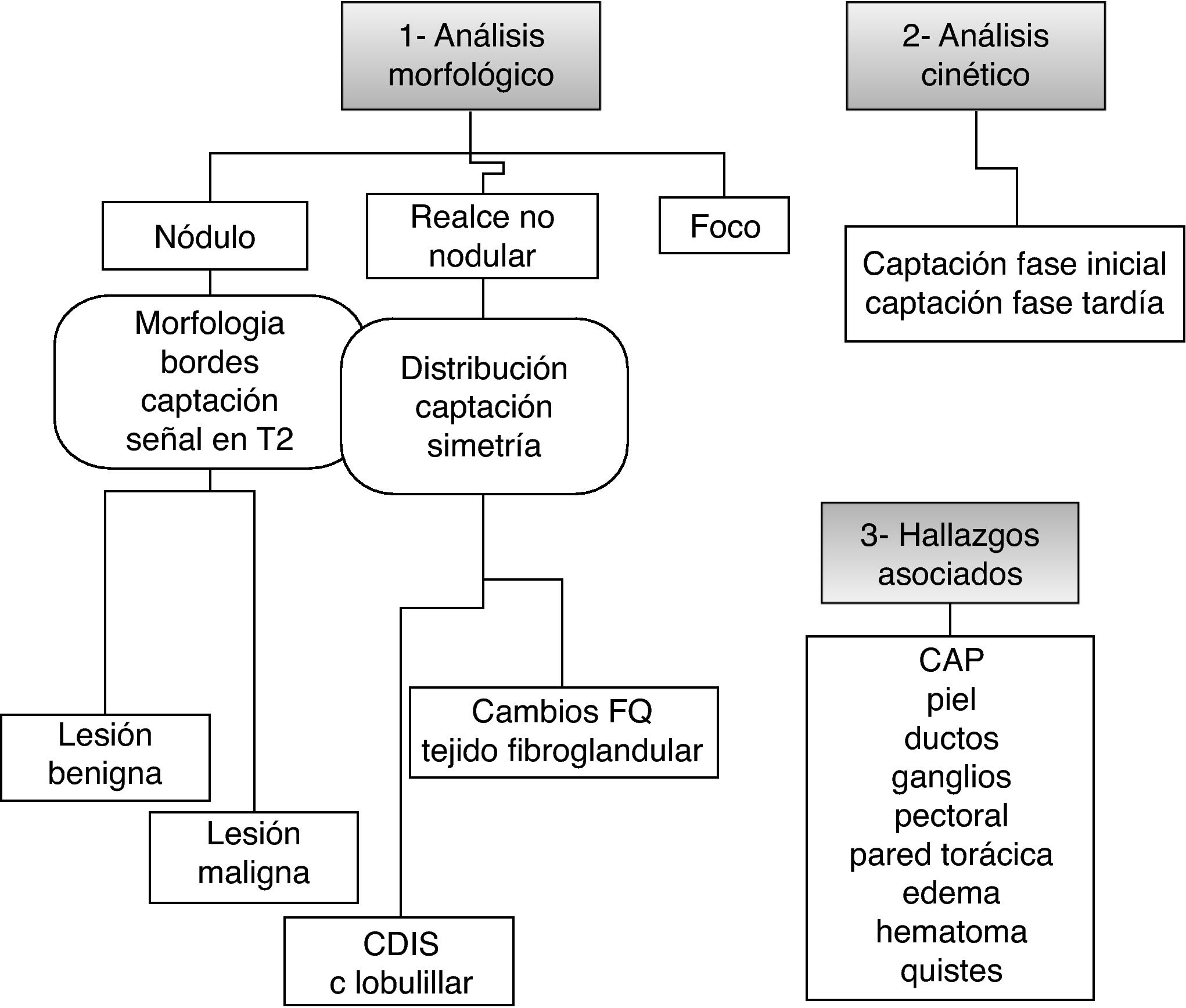
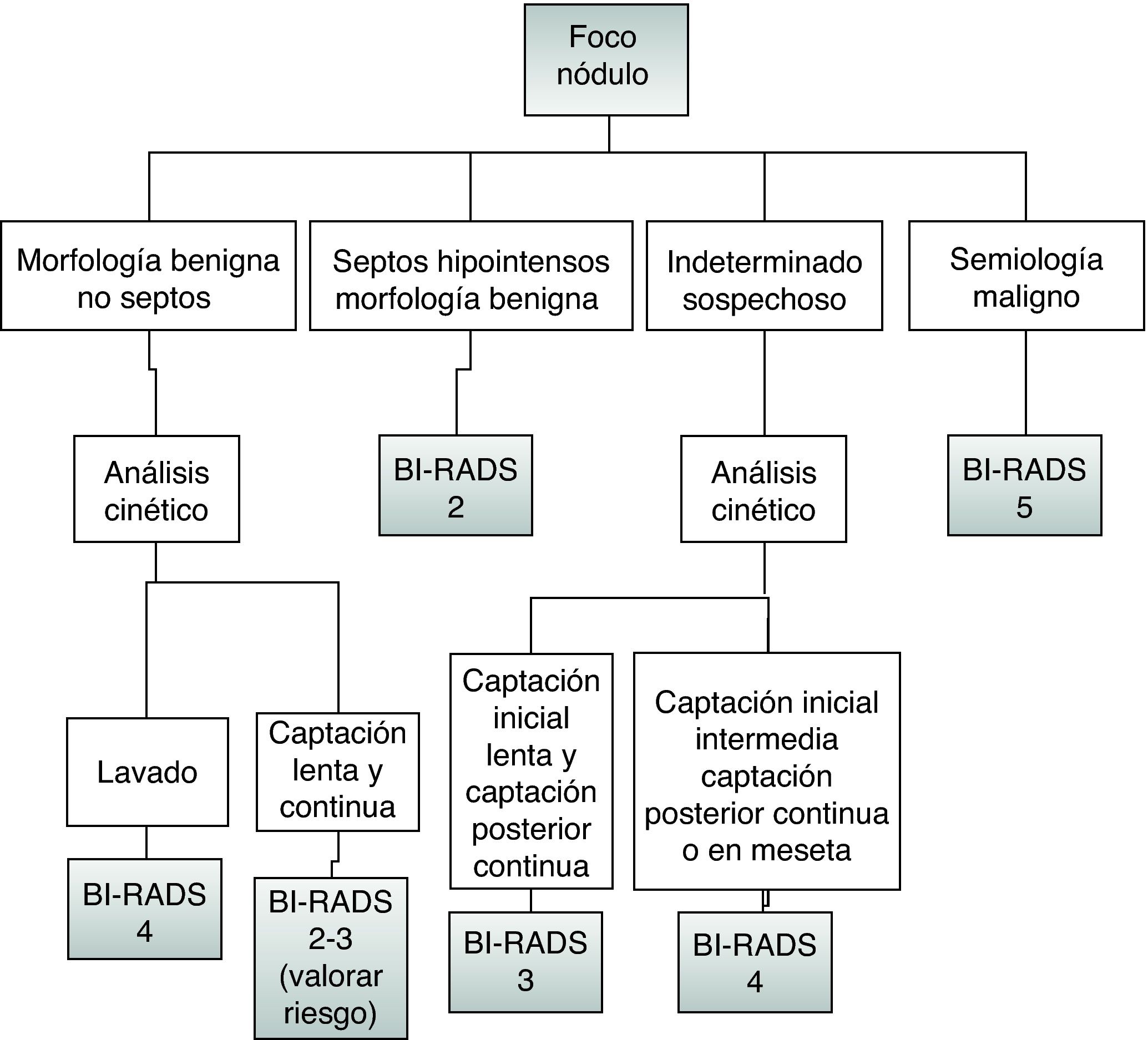
La caracterización de una lesión siempre se iniciará con el análisis morfológico7-9. El análisis cinético se realizará posteriormente, tras identificar las lesiones a incluir y su probabilidad de malignidad. A partir del análisis morfológico determinaremos si una lesión es un nódulo o un realce no nodular. Este paso es fundamental, ya que se aplican descriptores distintos según el tipo de lesión. Toda aquella lesión aislada de menos de 5mm de diámetro será catalogada como «foco».
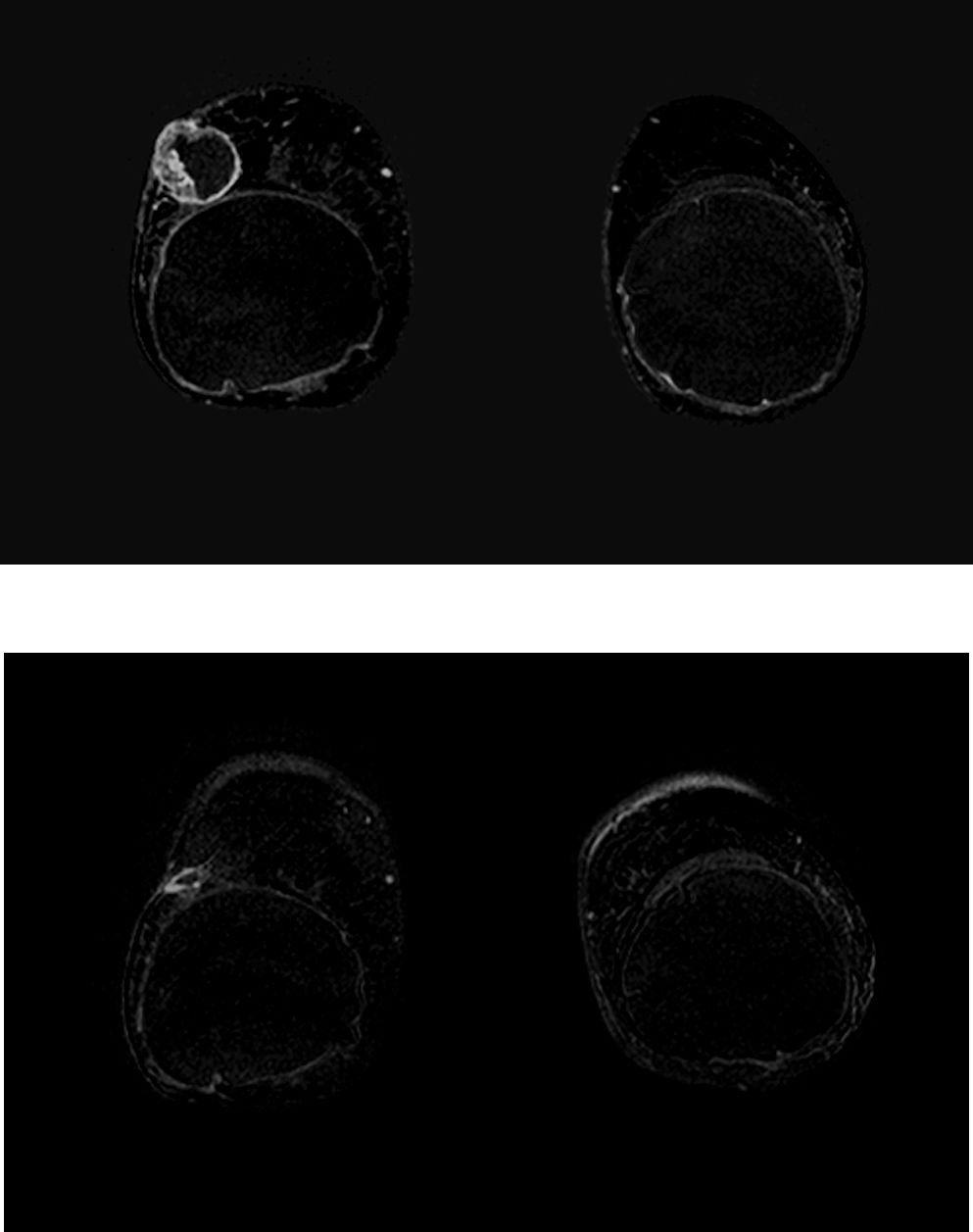
El diagnóstico diferencial de los nódulos se reduce a lesión benigna o maligna. Definiremos su morfología, sus bordes y por último, su arquitectura interna tras la captación de contraste. Las lesiones malignas (cánceres de mama infiltrantes) suelen presentar morfología irregular y estrellada, contornos mal definidos o espiculados y captación heterogénea o en anillo (fig. 2).
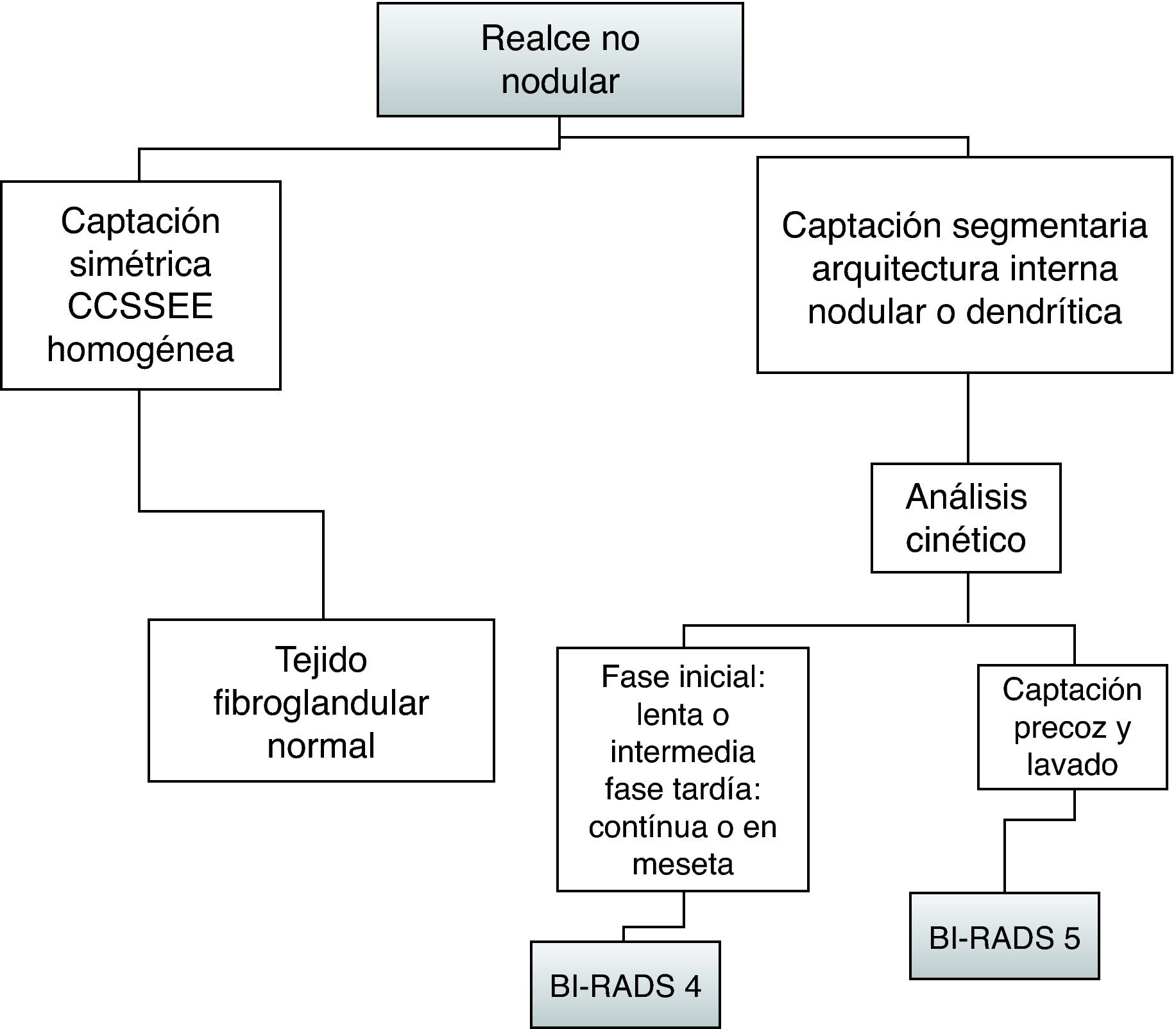
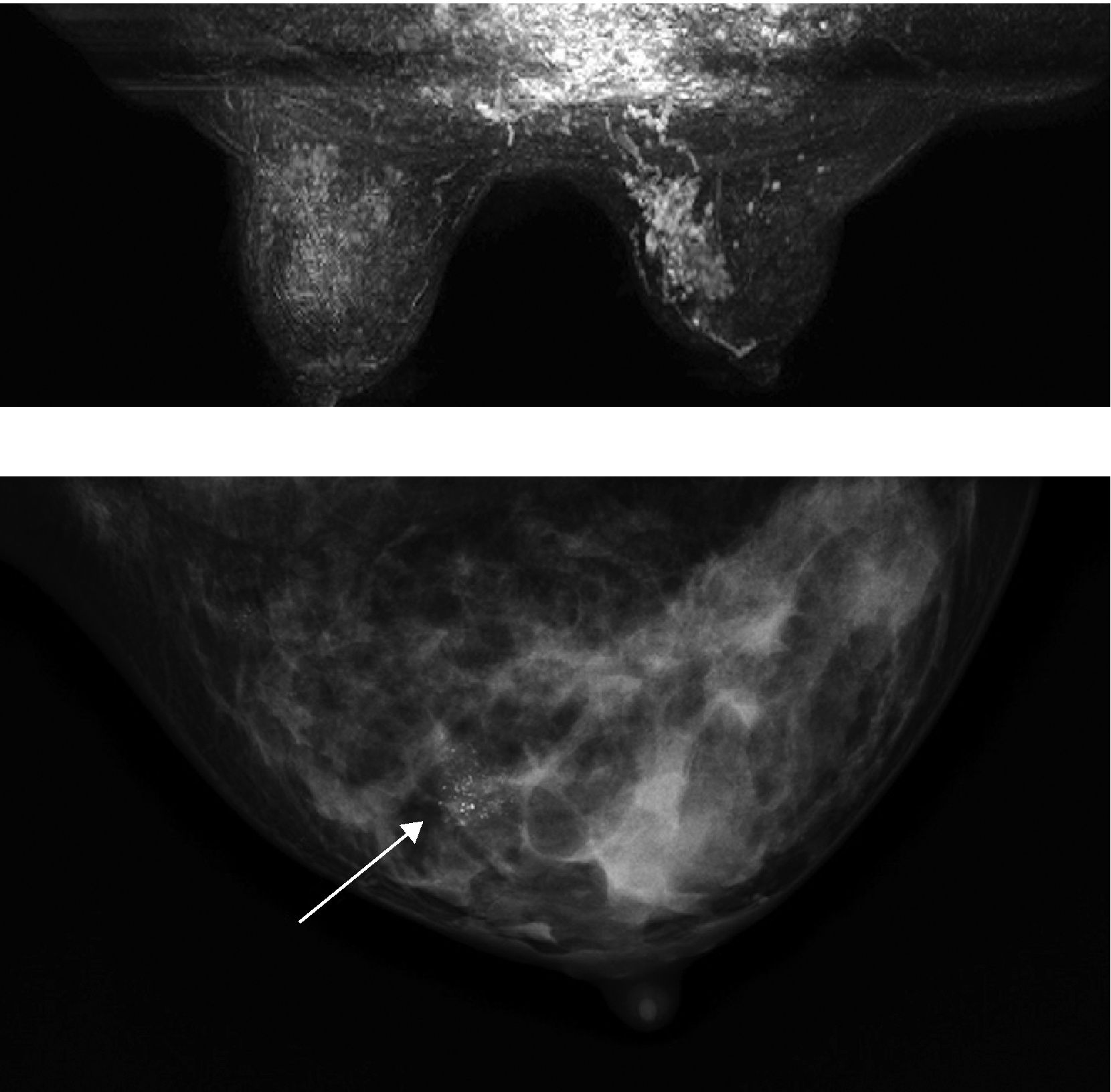
En el caso de los realces no nodulares (fig. 3) el diagnóstico diferencial se establecerá entre el CDIS o cambios fibroquísticos/tejido glandular normal. Inicialmente se analizará la distribución de las lesiones y posteriormente, su patrón de captación. Las lesiones malignas con realce no nodular (CDIS) suelen mostrarse como un foco solitario de hipercaptación o como un área de captación regional, segmentaria o lineal/dendrítica. Si la captación es regional o segmentaria la morfología de captación suele ser multinodular o en empedrado (fig. 4).
Patrón de realce no nodular de distribución segmentaria con captación interna multinodular. CDIS de alto grado. (a) Imagen MIP (máxima intensidad de proyección) de una paciente cuya mamografía (b) en proyección craneo-caudal mostraba (flecha) un grupo de microcalcificaciones agrupadas, sospechosas de malignidad. La extensión del CDIS era, según se muestra en la imagen de RM, mayor de lo inicialmente previsto por la mamografía, lo cual obligó a extirpar un área mayor de la prevista con el objetivo de obtener bordes libres.
El análisis cinético se realizará después del análisis morfológico (fig. 5) y se centrará fundamentalmente en aquellas lesiones cuya captación ya muestra un aumento en la intensidad de señal significativo en la primera imagen postcontraste. Las lesiones malignas suelen mostrar una captación intensa y precoz. Si observamos la parte postinicial de la curva, veremos que suelen mostrar una captación posterior en meseta (en el 30% de los casos) o de tipo lavado (en el 60% de los casos) aunque visualmente estos cambios son mucho menos evidentes que la intensa captación observada durante la primera fase de la curva).
En las lesiones tipo nódulo se analizará la intensidad de señal (IS) en la secuencia T2 con respecto al tejido fibroglandular (hiper, iso o hipointensa). Las lesiones malignas suelen presentar una IS hipo o isointensa comparadas con el parénquima. Las excepciones a esta regla son los cánceres mucinosos o medulares (y la rara aparición de necrosis central tumoral). Los fibroadenomas mixoides y los ganglios intramamarios suelen ser hiperintensos. Los fibroadenomas con escaso componente glandular suelen ser hipointensos pero, a diferencia de los cánceres, no captan contraste.
Aplicaciones clínicas de la resonancia magnética de mamaEntre las aplicaciones clínicas de la RM de mama, existen algunas asentadas (las que aquí se exponen), otras polémicas (estadificación del cáncer de mama) y otras menos aceptadas universalmente (estudio de microcalcificaciones, secreción mamaria, lesiones premalignas, tumor residual en paciente intervenida, hallazgos no concluyentes en mamografía y ecografía) que no se incluyen en la presente actualización2,10.
Estadificación del cáncer de mamaUna vez diagnosticado el cáncer de mama, el siguiente paso es evaluar la extensión del mismo y para ello es imprescindible conocer el significado clínico de los hallazgos de imagen en la estadificación. Dependiendo del tamaño del tumor, su patrón de crecimiento y la distribución del mismo, la paciente se tratará con quimioterapia neoadyuvante, cirugía conservadora o mastectomía.
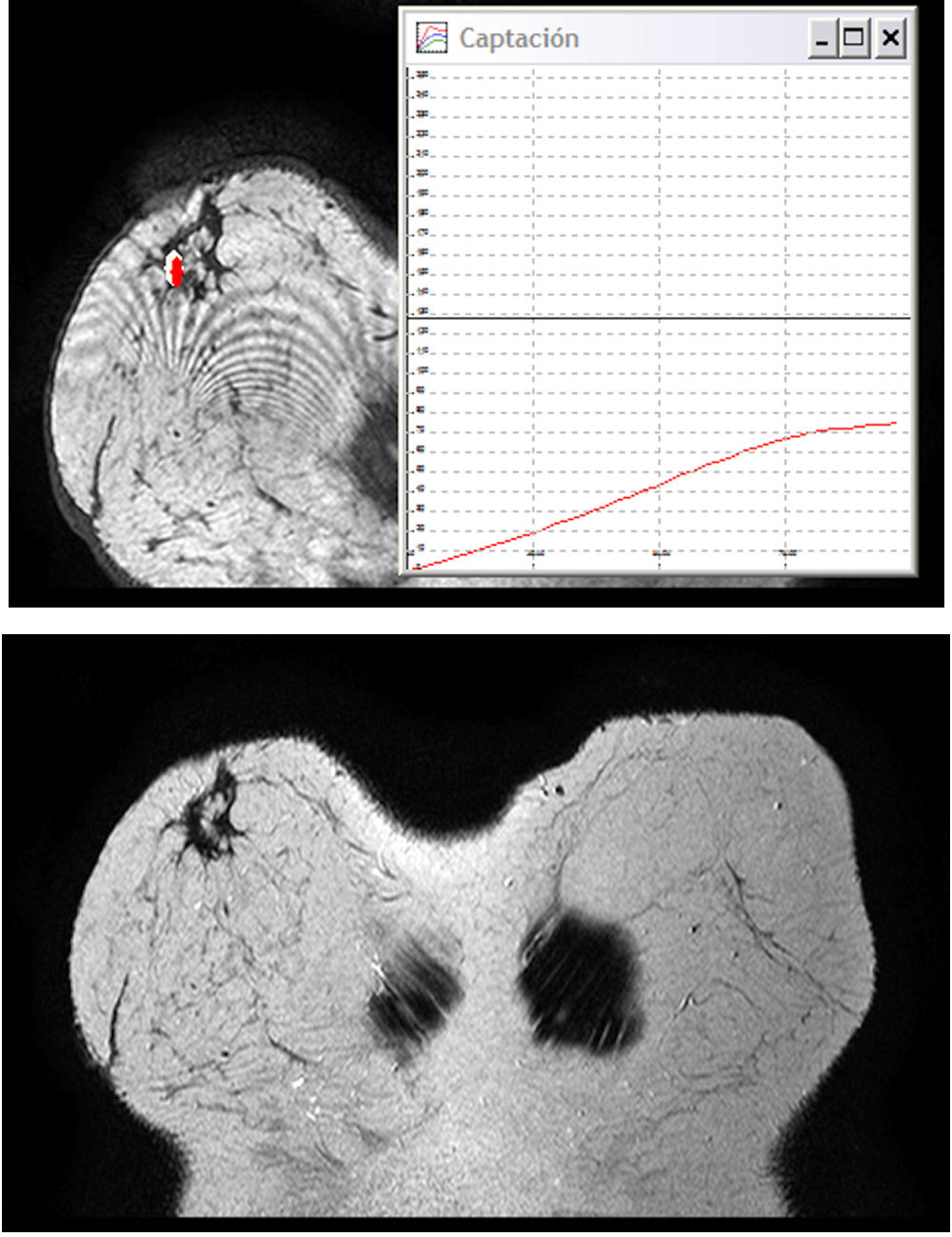
Los hallazgos a analizar en la estadificación serán: el tamaño, la presencia de lesiones multifocales (incluyendo las variantes de multifocalidad (fig. 6) de la extensión al complejo areola-pezón o el componente intraductal extenso), la presencia de lesiones multicéntricas y lesiones contralaterales. En el informe final se indicará si existen lesiones adicionales que deben ser reevaluadas con ecografía o biopsiadas en la RM y las recomendaciones pertinentes. Los posibles cambios en la actitud terapéutica derivados de la información que aporte la RM deben ser consensuados en una Unidad de Mama multidisciplinar.
Cáncer de mama multifocal. En la imagen MIP de la RM (a) se identifica el tumor índice de 22mm situado en el CSI de la mama derecha y a 35mm del mismo, hacia la vertiente areolar de la mama, se identifica otro pequeño foco de captación de unos 4mm (flecha) que se reevaluó con ecografía. En la ecografía (b) se identificó (flecha), se biopsió y se dejó un clip metálico. La biopsia fue positiva para malignidad. En la imagen mamográfica (c) puede verse el clip y la correlación entre la RM y la mamografía. Antes de la cirugía se marcó el área del clip (visible en ecografía) mediante radiotrazador (ROLL o Radio Occult Lesion Localization) y en la pieza quirúrgica resultante se puede ver el clip incluido en el área extirpada (marcado con una aguja intramuscular para que el patólogo encuentre la lesión). Este hallazgo en RM implicó una ampliación de la cirugía conservadora.
Es indiscutible que la RM presenta una mayor sensibilidad que las técnicas convencionales para detectar carga tumoral adicional11,12. La aceptación de la técnica en el contexto de la estadificación, una vez demostrado su rendimiento diagnóstico, implica demostrar el impacto sobre el tratamiento de las pacientes, sobre las tasas de reescisión y sobre las tasas de recidiva.
Cambio de actitud terapéuticaEl impacto del hallazgo de enfermedad adicional con RM medido en términos de cambio de actitud terapéutica (CAT) muestra una tasa de CAT correcta que oscila entre el 5 y el 30% y un CAT incorrecto que oscila entre el 0,5 y el 11%. Los metaanálisis publicados13-15 evidencian la complejidad del análisis del CAT debido al gran número de variables que entran en juego. El porcentaje de cambio en la actitud quirúrgica se estima, en el metaanálisis de Houssami15, en un 16,6%.
Tasas de reescisiónAunque no existen estudios aleatorizados que demuestren la superioridad de la RM (los resultados del estudio COMICE muestran una tasa de reescisión del 19% tanto en pacientes estadificadas con RM como no estadificadas con RM)16, algunos autores apuntan que la estadificación con RM consigue menores tasas de reescisión. Grobmyer et al17 consiguen unas tasas del 10% en una serie retrospectiva de 79 pacientes y las comparan con una serie de pacientes de su misma institución con un 20% de reescisiones. Recientemente se ha publicado un estudio de casos y controles que evalúa el impacto sobre las tasas de reescisión18 y aunque no demuestran una diferencia significativa entre las pacientes estadificadas con RM (tasa de reescisión 13,8%) y las no estadificadas con RM (tasa de reescisión del 19,4%), sí que observan (cuando estratifican por tipo tumoral) que un carcinoma ductal infiltrante con escisión incompleta se asocia significativamente a una ausencia de RM en la estadificación.
Tasas de recidivaEl estudio de Fischer19 analiza el impacto de la estadificación preterapéutica sobre las tasas de recidiva y de contralateralidad a largo plazo, pero existen ciertas objeciones sobre la metodología científica empleada para valorar el impacto sobre la recidiva, ya que el grupo de pacientes en las que no se realizó RM presentaban criterios de peor pronóstico. El sesgo metodológico no afecta sin embargo a la mayor tasa de cánceres contralaterales detectados en pacientes que no han sido estadificadas con RM y por tanto su conclusión sobre el menor número de cánceres contralaterales en el grupo de pacientes estadificadas con RM (1,7%) respecto a las pacientes no estadificadas con RM (4%) es perfectamente válido.
Evaluación de respuesta al tratamientoEl beneficio principal del tratamiento con quimioterapia primaria (QTP) o neoadyuvante es conseguir una reducción tumoral que permita la cirugía conservadora con bordes libres. La QTP también proporciona teóricamente un tratamiento precoz de las células potencialmente metastásicas circulantes y permite una evaluación «in vivo» de la quimiosensibilidad del tumor. Durante la última década se ha producido un auge de la evaluación de respuesta con RM debido a que esta técnica muestra consistentemente mejores valores de correlación histopatológica que los métodos convencionales, en gran parte debido a que además de morfología, valora función y supera por tanto las limitaciones que la fibrosis y la necrosis postratamiento imponen sobre la mamografía, la ecografía y la palpación. Los estudios publicados con pacientes tratadas con QTP demuestran que la correlación de entre la RM y la histología final oscila entre el 0,71 y el 0,9020-25.
Los estudios de RM en estas pacientes se realizan antes del tratamiento, a mitad de tratamiento (tras el 3° o 4° ciclo) e inmediatamente antes de la intervención quirúrgica (figs. 7 y 8). Los parámetros a evaluar son:
- -
Cuantitativos: las modificaciones en el diámetro o el volumen tumoral a lo largo del tratamiento. Habitualmente se utilizan los criterios RECIST o los criterios de la UICC, según los cuales la respuesta puede ser parcial mayor (> 50%), parcial menor (< 50%), completa o no respuesta.
- -
Cualitativos: el tipo de respuesta concéntrica o fragmentada, relacionada con la probabilidad de conseguir bordes libres en una cirugía conservadora (mayor en el primer caso).
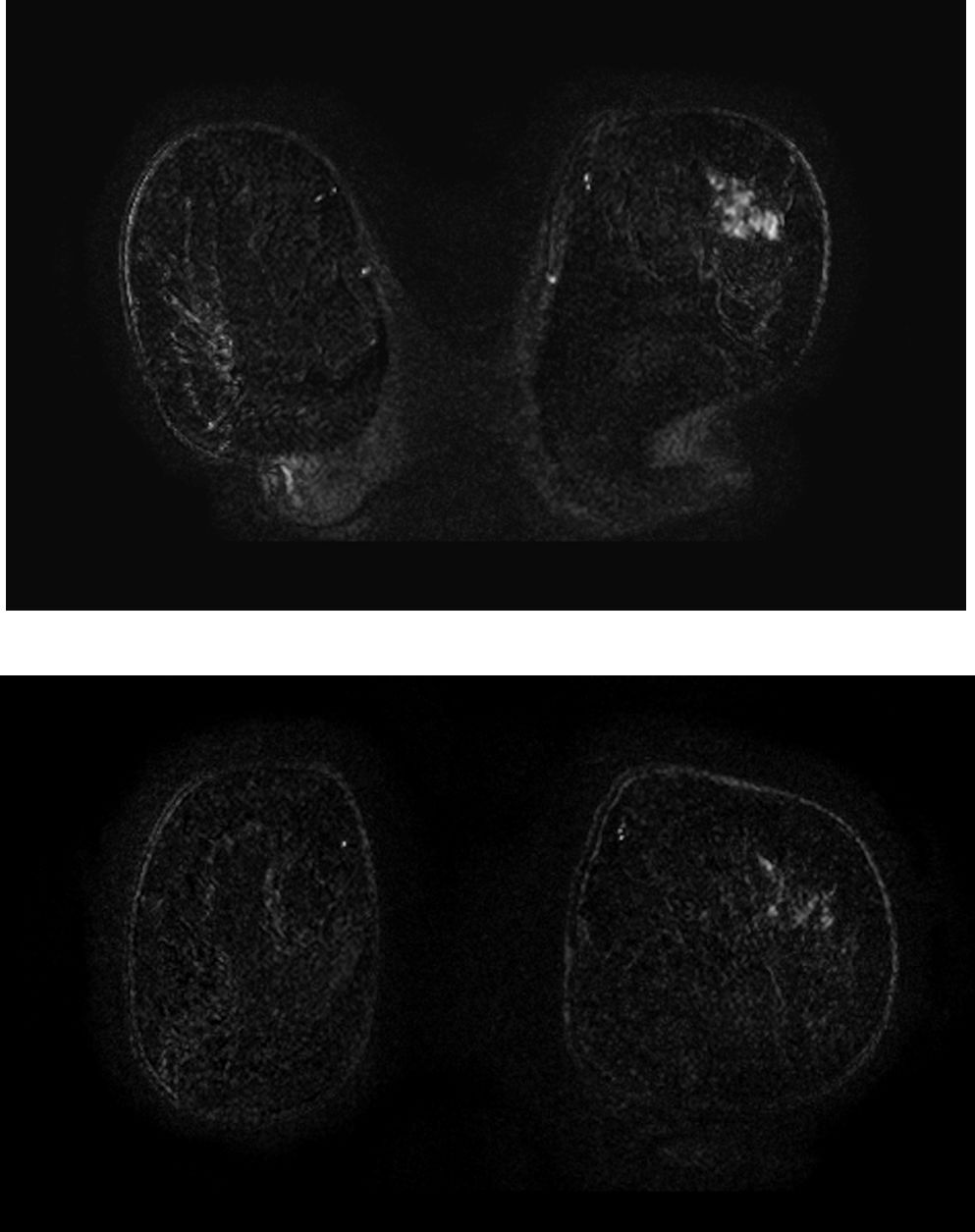
Respuesta parcial mayor fragmentada. Imagen de RM de mama en una paciente con un CDI extenso correspondiente a la estadificación. En la segunda imagen (RM posttratamiento, realizada antes de la cirugía), se identifica enfermedad residual en forma de pequeños focos de captación dispersos que ocupan la misma área que en la imagen pretratamiento. Debido a que en esta paciente la relación volumen tumoral / volumen mamario posibilitaba la cirugía conservadora, la paciente pudo conservar la mama, pero la pieza quirúrgica incluyó toda la zona inicialmente afecta.
Respuesta concéntrica. En la RM de estadificación (a) se identifica un tumor adyacente a la prótesis de mama. En el estudio posttratamiento (b) se evidencia una respuesta parcial mayor concéntrica. En este caso, debido a la proximidad del tumor a la prótesis, se extirpó ésta conjuntamente con el tumor.
La mayor limitación de la RM en este contexto son los porcentajes de infra y sobreestimación de enfermedad residual (6-25%)26,27. Las secuencias de espectroscopia y difusión muestran resultados esperanzadores, incluso con valor pronóstico28,29.
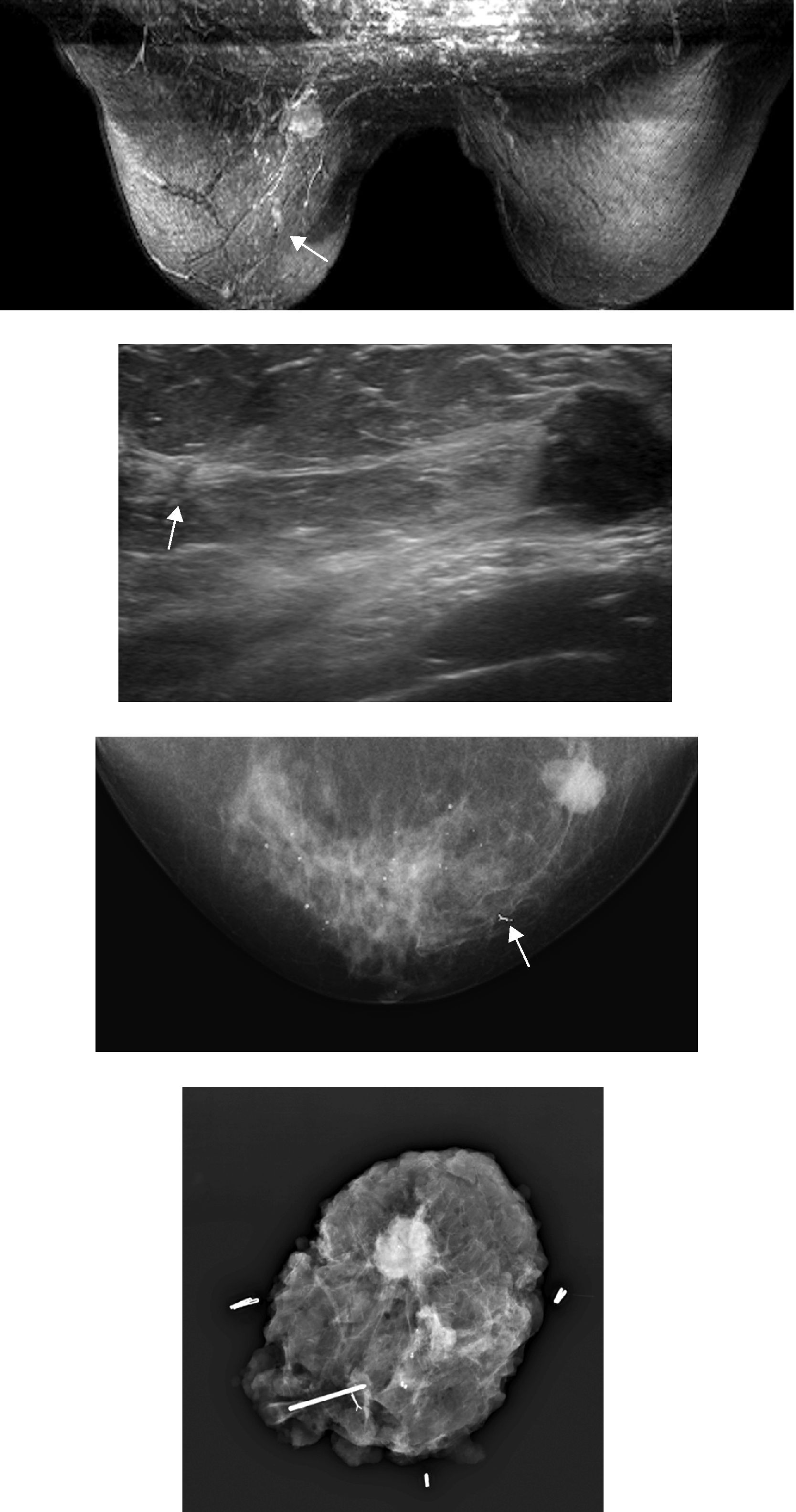
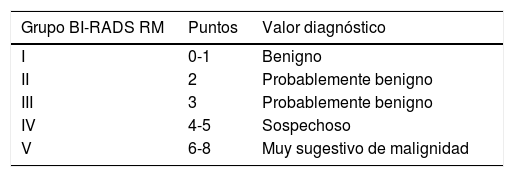
Diagnóstico de recidiva tumoralLa recidivas son raras durante los primeros 18 meses tras el tratamiento y en la mayoría de los casos aparecen en el lecho quirúrgico durante los primeros 5 años. El riesgo anual de recidiva está estimado en un 1-2% por año. Existe consenso respecto a la superior capacidad de la RM en el diagnóstico diferencial entre la recidiva o los cambios postcirugía o radioterapia, con respecto a la mamografía o la ecografía. La RM es la técnica más sensible en el diagnóstico de la recidiva y a su vez la técnica con mayor valor predictivo negativo, evita biopsias innecesarias y disminuye la ansiedad en las pacientes30. Hay que tener en cuenta sin embargo que la cicatriz quirúrgica suele captar contraste durante los primeros 6 meses y que la fase inflamatoria de la necrosis grasa puede dar lugar a hallazgos falsos positivos31 (fig. 9). Se recomienda asimismo que los estudios se realicen a partir de los 18 meses tras el fin de la radioterapia. La recidiva tumoral muestra en RM la misma semiología que el tumor primario (captación precoz y lavado posterior), mientras que la cicatriz quirúrgica que capta suele mostrar un realce progresivo y ausencia de lavado posterior. El diagnóstico de necrosis grasa se puede realizar sin tener que recurrir a la biopsia analizando las imágenes de las secuencias eco de gradiente T1 y FSE T2. Característicamente, la necrosis grasa muestra un área central de tejido graso, hiperintensa en la secuencia eco de gradiente T1 e hiper o hipointensa en secuencias potenciadas en T231.
Necrosis grasa en paciente tratada con reconstrucción mamaria. En ambas secuencias potenciadas en T1 (a) y en T2 (b), respectivamente, puede identificarse el centro hiperintenso secundario a la presencia de grasa, característico de la necrosis grasa. En la secuencia dinámica se identifica una discreta captación en el lecho quirúrgico debido a que se trata de una necrosis grasa en fase inflamatoria.
Uno de los factores de riesgo más importantes en el cáncer de mama son los antecedentes familiares. Se estima que los factores heredofamiliares se encuentran entre los factores causantes en aproximadamente un 10-15% de los casos.
Desde finales de la década de los 90, el seguimiento intensivo de estas pacientes ha incluido la RM32 y durante los últimos 10 años han aparecido varios estudios prospectivos no aleatorizados analizando los resultados del cribado con RM. Los resultados de los estudios multicéntricos con mayor número de pacientes33-37 demuestran que la RM muestra una sensibilidad dos veces mayor que la mamografía y tanto en el análisis combinado de 5 estudios prospectivos de Sardanelli (3571 pacientes)38 como en la revisión de Warner de 11 estudios39 los resultados son similares: la sensibilidad de la RM fue de 81% y la de la mamografía del 40% en el estudio de Sardanelli y del 77% y 39% respectivamente en el estudio de Warner. La tasa de cánceres de intervalo es, asimismo, inferior al 10% en todos los estudios y casi todos aparecen en pacientes portadoras de mutaciones genéticas.
Los cánceres de mama en las portadoras de la mutación genética BRCA1/2 presentan unas características clínico-patológicas y radiológicas especiales40: se trata de tumores aparentemente benignos (de contornos bien definidos) que aparecen en pacientes muy jóvenes, con un tiempo de duplicación mucho más corto (40-50 días) que en pacientes no portadoras (80 días) y el fenotipo molecular más prevalente es el triple negativo, de peor pronóstico. La mamografía presenta un menor valor en estas pacientes, ya que se trata de pacientes con mamas muy densas y más radiosensibles que la población general.
Estudio de un cáncer de mama ocultoEl cáncer primario desconocido representa menos del 1% de todos los cánceres de mama. Puede presentarse como una metástasis axilar de cáncer de mama o como enfermedad diseminada41. Si las técnicas convencionales no identifican el tumor en la mama, la indicación es la realización de una mastectomía y hasta en un tercio de estas pacientes no se encontrará tumor en la pieza. Otra alternativa es la irradiación total de la mama, pero este tratamiento se ha asociado a una alta tasa de recidivas. La RM se ha ido perfilando como la técnica de elección en este contexto clínico por dos motivos: porque presenta mayor sensibilidad para la localización del cáncer en la mama y porque consiguientemente puede evitar mastectomías si la extensión de la enfermedad es susceptible de tratamiento conservador42,43.
Evaluación de la paciente con prótesis de mamaLa RM tiene dos indicaciones en la paciente con prótesis de mama: detección de la rotura de la prótesis y detección de un cáncer de mama en pacientes en quienes las prótesis impiden la visualización correcta del tejido mamario. Respecto a la primera indicación, un metaanálisis de 18 estudios publicados44 concluyó que la sensibilidad global de la RM para la rotura era del 78% y la especificidad del 91%. Los autores apuntan que en mujeres sintomáticas, es razonable realizar una RM por su alto valor predictivo positivo. Otros estudios han confirmado estos datos y la recomendación es utilizar la RM (sin contraste) en pacientes sintomáticas. En pacientes asintomáticas no está justificada la RM como modalidad de cribado. En pacientes con prótesis de mama y dificultad para ver el tejido glandular con mamografía para descartar un cáncer de mama, la ecografía y la RM pueden ser útiles.
ConclusiónLa RM constituye un arma diagnóstica muy potente, siempre que se utilice conjuntamente con la información proporcionada por la mamografía y la ecografía. Representa un reto para el conocimiento debido a sus peculiaridades técnicas y a la alta prevalencia del cáncer de mama en la población general. Su espectro de aplicaciones clínicas está en continua expansión y es de esperar que en breve se convierta en una técnica habitual en todos los servicios de Radiología.
Declaración de conflicto de interesesLa autora declara no tener ningún conflicto de interés.