Estudiar la utilidad de los parámetros de perfusión en RM para identificar la seudoprogresión tumoral en astrocitomas de alto grado.
Material y métodosEste estudio retrospectivo de casos y controles comparó el volumen sanguíneo cerebral relativo (VSCr), el porcentaje de recuperación de intensidad de señal relativo (PRSr) y la altura relativa del pico (relative Peak Height [rPH]) en una muestra de 17 casos de astrocitomas anaplásicos y glioblastomas diagnosticados de seudoprogresión (mediante biopsia o control evolutivo), con otra muestra de 17 tumores tratados, histológicamente parecidos, y diagnosticados anatomopatológica o evolutivamente de progresión. Se evaluó la precisión de tales parámetros y su correlación. La significación estadística se estableció con una p<0,05.
ResultadosEl VSCr, PRSr y rPH fueron estadísticamente distintos entre ambos grupos (p=0,001). La sensibilidad (S) y especificidad (E) para los puntos de corte 1,37 rPH; 0,9 VSCr y 99% PRSr fueron respectivamente del 88% (S) y 82,2% (E) rPH; 100% (S) y 100% (E) VSCr; y 100% (S) y 70,6% (E) PRSr. Las variables PRSr-rPH (−0,76) y PRSr-VSCr (−0,81) se correlacionaron negativamente. La correlación rPH-VSCr fue alta (0,87).
ConclusiónLa rPH y el VSCr fueron útiles en nuestra muestra para diferenciar los casos de seudoprogresión tumoral de los de progresión verdadera. El PRSr también fue un parámetro muy sensible aunque el solapamiento de valores entre las muestras lo hacen a priori menos útil.
To study the usefulness of common MRI perfusion parameters for identifying pseudoprogression in high grade astrocytomas.
Material and methodsThis retrospective case-control study compared the relative cerebral blood volume (rCBV), the relative percentage of signal intensity recovery (rPSR), and the relative peak height (rPH) recorded in a sample of 17 cases of anaplastic astrocytomas and gliomas considered to be undergoing pseudoprogression by biopsy or follow-up with those recorded in a sample of histologically similar tumors that were treated and considered to be undergoing progression by histologic study or follow-up. We evaluated the accuracy of these parameters and the correlations among them. Statistical significance was set at P<.05.
ResultsThe rCBV, rPSR, and rPH were significantly different between the two groups (P=.001). The cutoff values rPH=1.37, rCBV=0.9, and rPSR=99% yielded sensitivity (S)=88% and specificity (Sp)=82.2% for rPH, S=100% and Sp=100% for rCBV, and S=100% and Sp=70.6% for rPSR, respectively. We found negative correlations between rPRS and rPH (−0.76) and between rPRS and rCBV (−0.81) and a high positive correlation between rPH and rCBV (0.87).
ConclusionThe variables rPH and rCBV were useful for differentiating between pseudoprogression and true progression in our sample. The variable rPRS was also very sensitive, although the overlap in the values between samples make it less useful a priori.
El tratamiento estándar de los astrocitomas de alto grado (astrocitoma anaplásico y glioblastoma [GBM]) se basa generalmente en combinar el tratamiento quirúrgico, la radioterapia (RT) y la quimioterapia (QT). La temozolomida (TMZ) es el principal agente quimioterápico empleado1–3.
En 2005 ya se demostró que añadir TMZ al tratamiento de RT prolongaba la supervivencia media en 12,1-14,6 meses4,5. Pero también facilitaba un fenómeno conocido como seudoprogresión6, que consiste en una reacción secundaria al tratamiento con aumento del área de realce e incluso del edema, que semeja una progresión tumoral. Generalmente, aparece en los 2-3 primeros meses postratamiento3,4,7. Sin una confirmación histológica, la progresión se descartaba por la estabilización o disminución del tamaño de la lesión durante el seguimiento sin un nuevo tratamiento antitumoral. Este hecho, ya presente con el tratamiento de RT aislado, se hizo más evidente con la combinación de RT y TMZ6. No está aún bien definido el sustrato patológico de la seudoprogresión4,8,9.
Detectar la seudoprogresión tiene importantes implicaciones clínicas, ya que diagnosticar erróneamente una progresión podría privar al paciente de un tratamiento que realmente está siendo efectivo al cambiarlo por tratamientos de rescate. Otra importante consecuencia de los falsos positivos es la selección incorrecta de pacientes con una supuesta progresión tumoral en los ensayos clínicos de forma que los resultados pueden malinterpretarse como una respuesta a los tratamientos10. Se ha llegado incluso a correlacionar el diagnóstico de seudoprogresión con un mejor pronóstico que los pacientes que no experimentaron el fenómeno de seudoprogresión11.
Las técnicas de resonancia magnética (RM) convencional no pueden diferenciar prospectivamente una seudoprogresión de una verdadera progresión tumoral, puesto que ambas pueden manifestarse como áreas de realce en ocasiones con edema perilesional1–4,7,10,12. Otras modalidades de imagen como la perfusión con RM, la espectroscopia y la tomografía por emisión de positrones pueden ayudar a diferenciar los efectos secundarios del tratamiento de la verdadera progresión, aunque deben ser validadas rigurosamente antes de incorporarse a los criterios de respuesta para gliomas de alto grado del Neuro-Oncology Working Group (RANO)7,13–15.
El realce tumoral en la RM con contraste depende de la rotura de la barrera hematoencefálica (BHE) y de la densidad vascular, por lo que es una técnica poco fiable para valorar el crecimiento tumoral, sobre todo si el paciente está siendo tratado con agentes antiangiogénicos o que reduzcan la permeabilidad vascular16–18.
Existen varias técnicas de perfusión por RM, de las que las más utilizadas son las de susceptibilidad magnética potenciada en T2, basadas en el efecto paramagnético del gadolinio, que al pasar por los vasos cerebrales produce una caída de señal T2 y, fundamentalmente, T2*19–22.
De entre los parámetros que pueden calcularse, los más conocidos son el volumen sanguíneo cerebral (VSC), el flujo sanguíneo cerebral (FSC) y el tiempo de tránsito medio (TTM). Otros de los parámetros que pueden obtenerse son el porcentaje de recuperación de intensidad de señal (PRS) y la altura del pico (Peak Height [PH]) mediante cálculos matemáticos sencillos23–25.
Por todo ello, el objetivo de nuestro trabajo es estudiar la utilidad de la perfusión con RM, en concreto de sus parámetros volumen sanguíneo cerebral relativo (VSCr), porcentaje de recuperación de intensidad de señal relativo (PRSr), y relative Peak Height o altura del pico relativa (rPH), para establecer la seudoprogresión tumoral en astrocitomas de alto grado.
Material y métodosSe realizó un estudio observacional analítico retrospectivo de casos y controles comparando los parámetros de perfusión con RM en una muestra de pacientes con seudoprogresión, y otra muestra parecida formada por pacientes con tumores tratados con RT y TMZ con igual distribución histológica. Este estudio, aún siendo retrospectivo, fue debidamente aprobado por nuestro comité ético hospitalario.
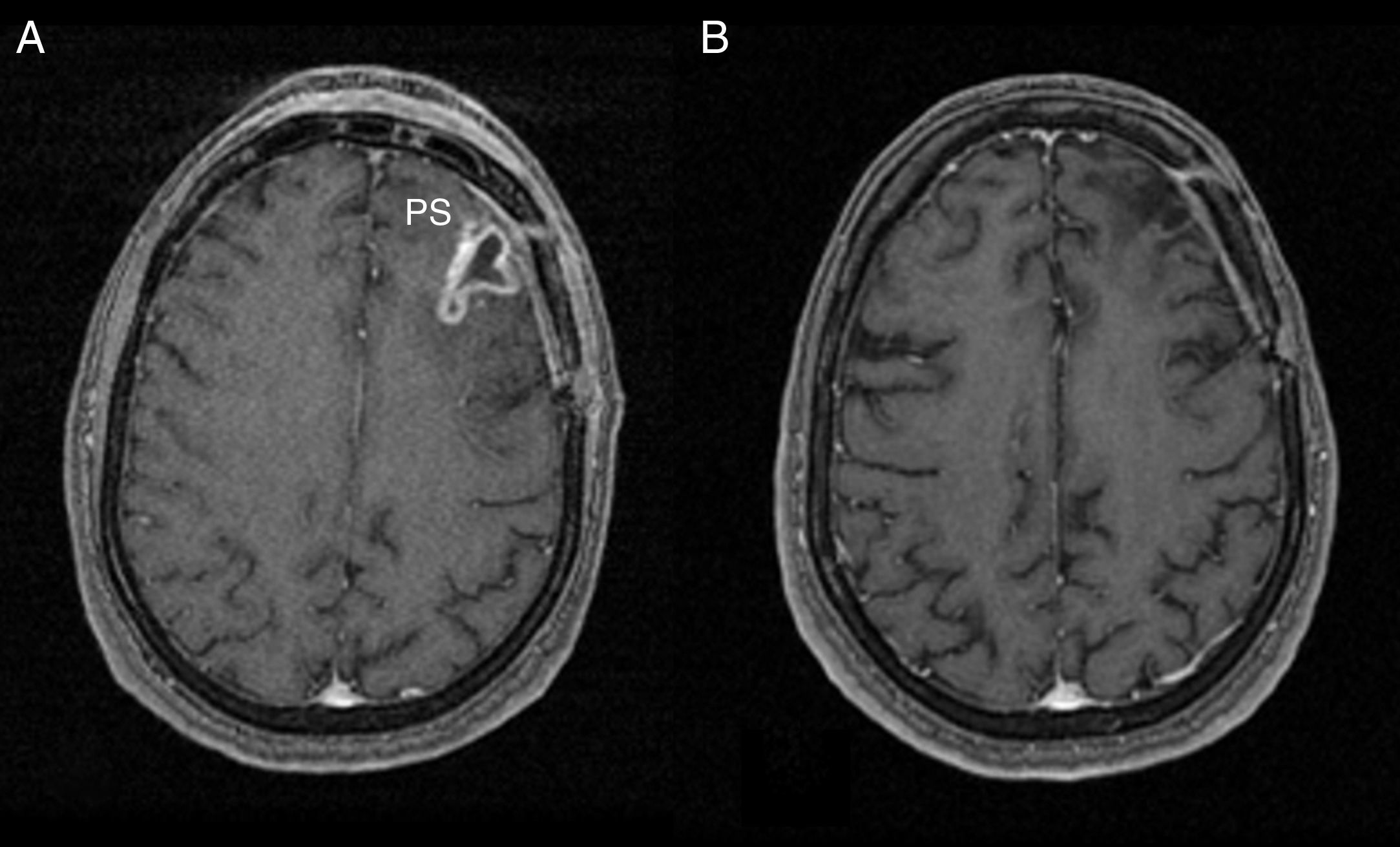
PacientesRecuperamos todos los pacientes con diagnóstico histológico de astrocitomas anaplásicos y glioblastomas diagnosticados entre marzo de 2007 y septiembre de 2011, a partir del registro estadístico de codificación de casos de nuestro centro. El total de casos fue de 118 (83 GBM y 29 astrocitomas anaplásicos). Los criterios de inclusión para el grupo de seudoprogresión2,10,12,23 fueron: a) pacientes seguidos en nuestro centro que hubieran recibido tratamiento con RT+TMZ; b) aumento de tamaño o aparición de nuevas lesiones en la RM con contraste en el lecho del tumor dentro del campo irradiado, en los 6 primeros meses de seguimiento tras la RT; c) disminución de tamaño o desaparición de las lesiones en los controles siguientes sin necesidad de un nuevo tratamiento antitumoral, o bien confirmación histológica de la ausencia de progresión o recidiva tumoral (fig. 1); y d) calidad técnica óptima de los estudios de perfusión con RM en la fecha de la seudoprogresión.
Seudoprogresión. A) RM T1 SPGR con contraste intravenoso en paciente intervenido de glioblastoma y tratamiento con TMZ+RT, clínicamente asintomático. En el lóbulo frontal izquierdo (PS) se aprecia un área de realce periférico que podría corresponder a una persistencia o recidiva tumoral. B) Control evolutivo realizado 3 meses después, sin nuevos ciclos de tratamiento antitumoral en el que se aprecia que el área de realce ha desaparecido.
PS: seudoprogresión; RT: radioterapia; SPGR: spoiled gradient recalled; TMZ: temozolomida.
Se excluyeron de la muestra: a) los pacientes sin estudios de perfusión en la fecha de la seudoprogresión; b) los pacientes sin tratamiento combinado RT-TMZ; y c) los pacientes en tratamiento antiangiogénico en el periodo de seguimiento que pudieran alterar el realce en la RM con contraste.
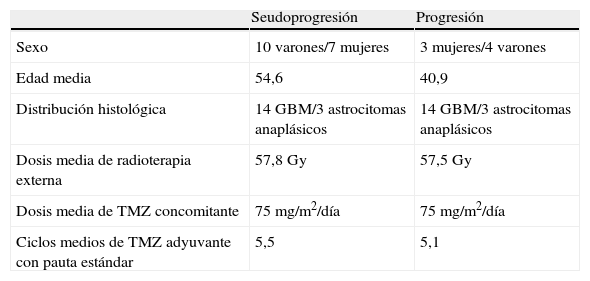
Tras haber excluido 2 estudios técnicamente deficientes, finalmente, recogimos 17 casos de seudoprogresión (14 GBM y 3 astrocitomas anaplásicos) que cumplían todos los criterios. La media de edad fue de 54,6 años, 10 varones y 7 mujeres. Esta muestra se comparó con otra obtenida de forma aleatoria de nuestro archivo estadístico conformada por 17 tumores tratados con RT y TMZ con progresión confirmada mediante biopsia o control evolutivo con igual distribución histológica constituida por 13 mujeres y 4 varones con una media de edad de 40,9 años (tabla 1).
Datos demográficos, clínicos, histológicos y terapéuticos de las muestras
| Seudoprogresión | Progresión | |
| Sexo | 10 varones/7 mujeres | 3 mujeres/4 varones |
| Edad media | 54,6 | 40,9 |
| Distribución histológica | 14 GBM/3 astrocitomas anaplásicos | 14 GBM/3 astrocitomas anaplásicos |
| Dosis media de radioterapia externa | 57,8Gy | 57,5Gy |
| Dosis media de TMZ concomitante | 75mg/m2/día | 75mg/m2/día |
| Ciclos medios de TMZ adyuvante con pauta estándar | 5,5 | 5,1 |
GBM: glioblastoma; Gy: gray; TMZ: temozolomida.
Los estudios de RM se llevaron a cabo en un equipo Signa® HDxt 1.5T scanner (GE Healthcare, Milwaukee, Wisconsin, EE. UU.). Se incluyeron secuencias convencionales T1 FLAIR en el plano sagital, imágenes de difusión en el plano axial, T2 FSE y T2 FLAIR en el plano axial, adquisiciones volumétricas en el plano axial T1 Spoiled Gradient recalled (SPGR) sin y con contraste intravenoso. Los estudios de perfusión por susceptibilidad magnética se realizaron mediante secuencias eco-planares SE T226, con los siguientes parámetros: TR/TE=2.000/80ms; NEX=1; tamaño de matriz=256×256; grosor de sección=8mm. En total se adquirieron un total de 40 volúmenes de imágenes. Se realizaron 14 cortes contiguos en los que se incluyó prácticamente todo el parénquima cerebral y cerebeloso. La técnica T2 eco de gradiente está más extendida y aceptada porque ha demostrado disponer de mejor relación señal/ruido, curvas de intensidad de señal/tiempo más homogéneas y, en concreto, valores mayores de VSC en astrocitomas de alto grado que las técnicas eco de espín26,27. Por otro lado, las técnicas T2 eco de espín tienen la ventaja de estar menos influenciadas por los vasos cercanos, así como por efectos de la extravasación del contraste. Por ello, se ha defendido su utilidad en lesiones con rotura de la BHE como los astrocitomas de alto grado, metástasis y abscesos17.
El material de contraste empezó a inyectarse 8s después de iniciarse la secuencia para esperar a la estabilización de la intensidad de señal. El protocolo consistió en inyectar 10ml de Gadovist® (Bayer Schering Pharma, Berlín, Alemania) (Gadobutrol 1mmol/ml) y, posteriormente, 20ml de suero salino, ambos con caudal de 5ml/s. No se utilizó una dosis previa de contraste que, al extravasarse, pudiera minimizar el efecto T1. Algunos estudios han sugerido que inyectar gadolinio antes hace que la intensidad de señal estabilizada sea menor, lo que hace que los valores de PRSr se infraestimen23.
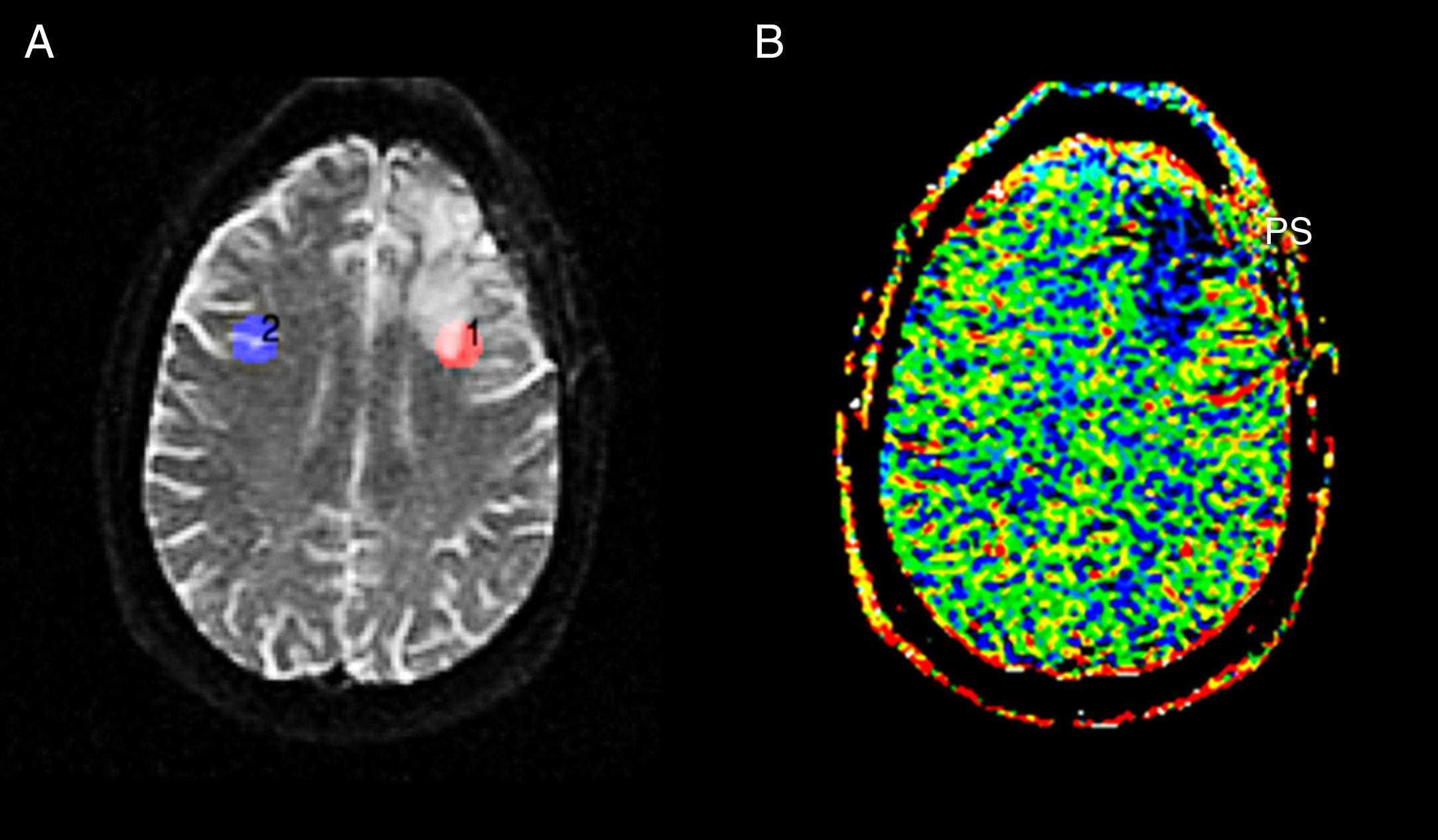
Posproceso y medidas de perfusiónEl posproceso de los estudios de perfusión se llevó a cabo de forma simultánea y consensuada por 2 autores con 4 y 30 años de experiencia en neurorradiología respectivamente. Para calcular el VSCr utilizamos el software de perfusión Lund University Perfusion Evaluation (LUPE) (software, Lund, Suecia)11,24 y para el rPH y PRSr el programa FuncTool® v.2 (Advantage Windows, GE Healthcare, Milwaukee, WI, EE. UU.)23–25. En todos los casos los cálculos se hicieron dibujando manualmente las regiones de interés (ROI) entre los 2 operadores. Los 3 parámetros fueron calculados en valores relativos. Para el VSCr obtuvimos sus mapas paramétricos en los que se seleccionaron ROI de aproximadamente 90-100 píxeles, haciéndolos coincidir con las áreas de realce de las secuencias SPGR T1 con contraste y evitando las de hemorragia o los vasos macroscópicos evidentes. Los valores obtenidos se normalizaron con los de un ROI contralateral simétrico insertado con la herramienta correspondiente del software (fig. 2). Utilizamos el software de perfusión LUPE por la posibilidad que ofrece de corregir mediante algoritmos matemáticos el efecto de la fuga de contraste por la rotura de la BHE. El PRSr y el rPH se calcularon a partir de la curva intensidad de señal/tiempo dibujando ROI de aproximadamente 40-60mm2 en los mapas de integral de realce negativo. Los ROI se dibujaron en las zonas correspondientes a las de realce en las secuencias potenciadas en T1 con contraste, excluyendo áreas de vasos macroscópicos evidentes o hemorragia. Los valores de rPH y PRSr fueron normalizados con la sustancia blanca contralateral (figs. 3 y 4). Las fórmulas para obtenerlos fueron las siguientes:
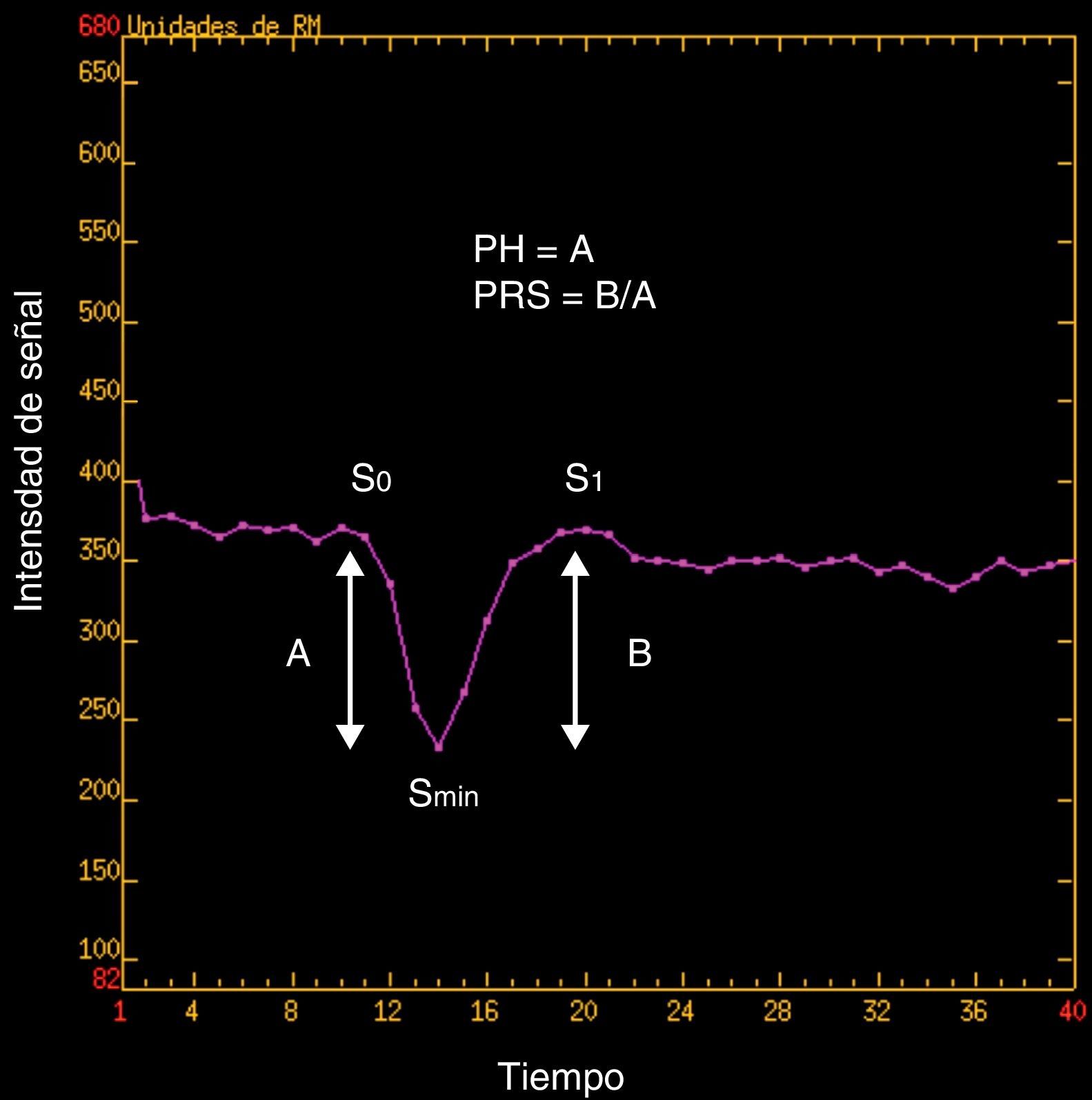
donde S0(ROI) es la intensidad de señal precontraste en la curva del ROI tumoral, Smin(ROI) la intensidad de señal en el pico de la curva del ROI tumoral, S0(SB) es la intensidad de señal precontraste en la curva del ROI de la sustancia blanca sana contralateral y Smin(SB) la intensidad de señal en el pico de la curva del ROI de la sustancia blanca contralateral.donde S1(ROI) es la intensidad de señal poscontraste en el ROI tumoral y S1(SB) la intensidad de señal poscontraste en la sustancia blanca sana contralateral (fig. 5).Imagen de mapa de colores de VSCr elaborado con el programa LUPE en el mismo paciente de la figura 1. Se aprecia un área de color predominantemente azul en región frontal izquierda (PS) que se corresponde con el área de realce de la figura 1, la cual presentó menores valores de VSCr que la región análoga contralateral.
LUPE: lund university perfusion evaluation software; PS: seudoprogresión; VSCr: volumen sanguíneo cerebral relativo.
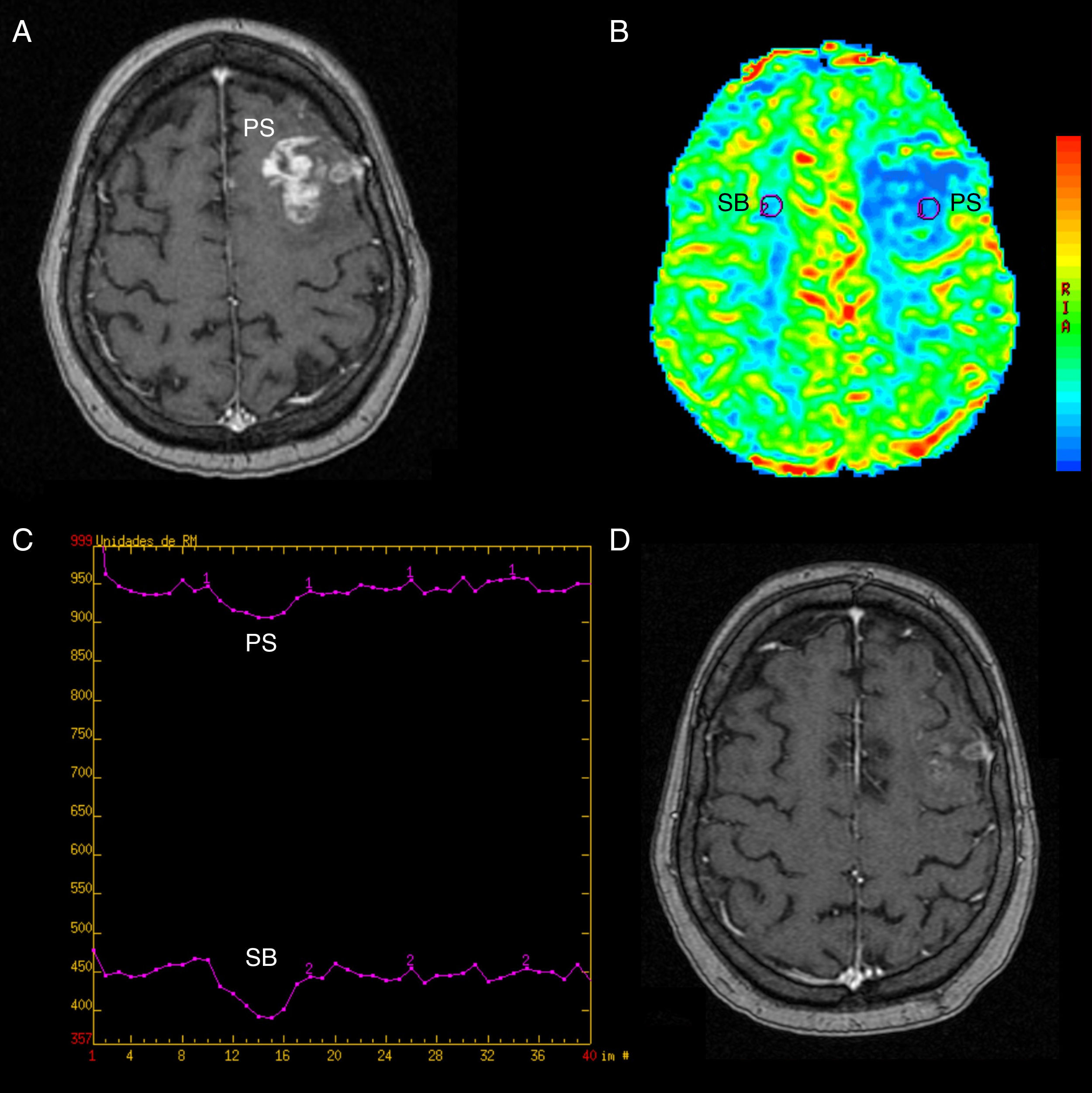
Seudoprogresión. A) RM volumétrica potenciada en T1 SPGR con contraste. Se observa un área de realce frontal izquierda (PS) en un paciente en seguimiento por glioblastoma tratado con cirugía, RT y TMZ. B) Mapa de colores de la integral de realce negativa elaborado con FuncTool® v.2, con regiones de interés en la lesión (PS) y en la sustancia blanca contralateral (SB). El VSCr ha disminuido en la lesión. C) Gráfica de intensidad de señal/tiempo elaborada con FuncTool® v.2, sin diferencias significativas en la caída de intensidad de señal en la lesión y en la SB contralateral. D) RM volumétrica potenciada en T1 SPGR con contraste 2 meses después. El realce ha disminuido llamativamente sin que haya mediado ningún tratamiento.
PS: seudoprogresión; RM: resonancia magnética; RT: radioterapia; SB: sustancia blanca; SPGR: spoiled gradient recalled; TMZ: temozolomida; VSCr: volumen sanguíneo cerebral relativo.
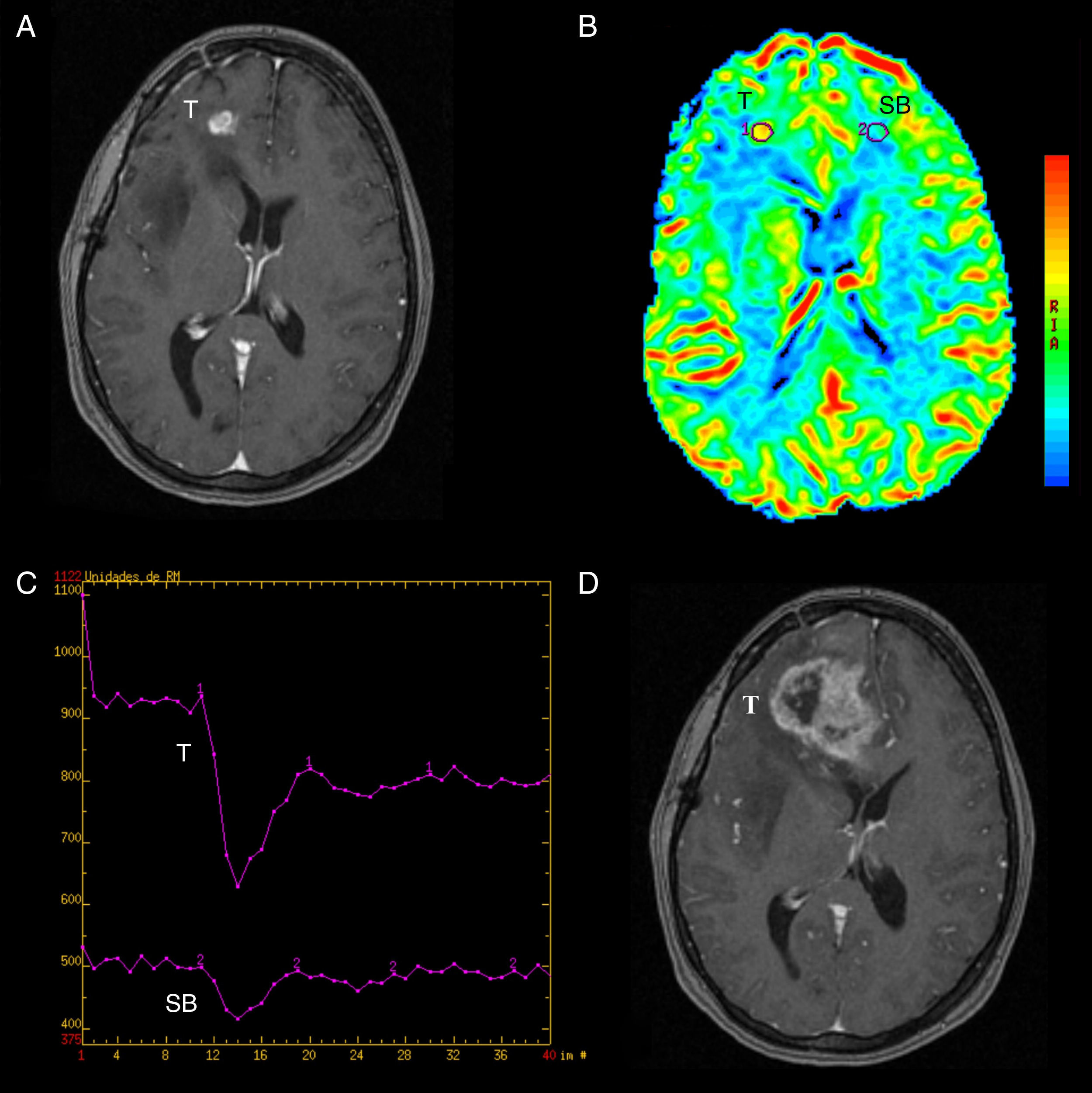
Verdadera progresión. A) RM volumétrica potenciada en T1 SPGR con contraste que muestra un área de realce frontal derecha (T) en un paciente en seguimiento por glioblastoma tratado con cirugía, RT y TMZ. B) Mapas de colores de la integral de realce negativa elaborados con FuncTool® v.2, con regiones de interés en la lesión (T) y la SB contralateral. En la lesión hay un aumento del VSCr sugerente de progresión tumoral. C) Gráfica de intensidad de señal/tiempo elaborada con FuncTool® v.2 en la que se aprecia un aumento evidente de la caída en la intensidad de señal en la zona de tumor con respecto a la SB contralateral. D) RM volumétrica potenciada en T1 SPGR con contraste 3 meses después, tras tratarlo con corticoides, que muestra aumento del área de realce (T) compatible con progresión tumoral.
RT: radioterapia; SB: sustancia blanca; SPGR: spoiled gradient recalled; T: tumor; TMZ: temozolomida; VSCr: volumen sanguíneo cerebral relativo.
Curva T2 de intensidad de señal/tiempo. PH=S0-Smin; PRS=(S1-Smin)/(S0-Smin), donde S0 es la intensidad de señal precontraste, Smin el mínimo de intensidad de señal y S1 la intensidad de señal poscontraste.
PH: peak height o altura del pico; PRS: porcentaje de recuperación de intensidad de señal.
Se calcularon en primer lugar los valores estadísticos descriptivos (media e intervalos de confianza al 95%). Posteriormente, comparamos las medias de cada uno de los parámetros entre ambas muestras con la prueba no paramétrica para muestras independientes U de Mann-Whitney. Asimismo, hicimos un análisis Receiver Operating Characteristic (ROC) de los 3 parámetros para establecer el valor con la mejor relación de sensibilidad y especificidad para discriminar entre seudoprogresión y progresión. Las 3 variables se correlacionaron con la prueba de Spearman. Como el posproceso se llevó a cabo por los 2 autores de forma simultánea y consensuada, no calculamos la concordancia interobservador. Para el análisis estadístico utilizamos el programa SPSS® v.20.0 (IBM, Armonk, New York, EE. UU.). La significación estadística se estableció para una p<0,05.
ResultadosLos casos de seudoprogresión mostraron un PRS mayor, así como una altura relativa del pico, y un volumen sanguíneo relativo cerebral menor que los tumores en progresión. Los valores medios e intervalos de confianza al 95% en el grupo de seudoprogresión fueron de 127,1% (110,5-148,4) para el PRSr; 1,11 (0,98-1,26) para el rPH, y 0,41 (0,32-0,50) para el VSCr. En el grupo de verdaderas progresiones fueron de 92,2% (86,2-98,6) para el PRSr; 3,49 (2,61-4,47) para el rPH, y 3,07 (2,36-3,8) para el VSCr. Los 3 parámetros fueron estadísticamente distintos entre los grupos (p=0,001).
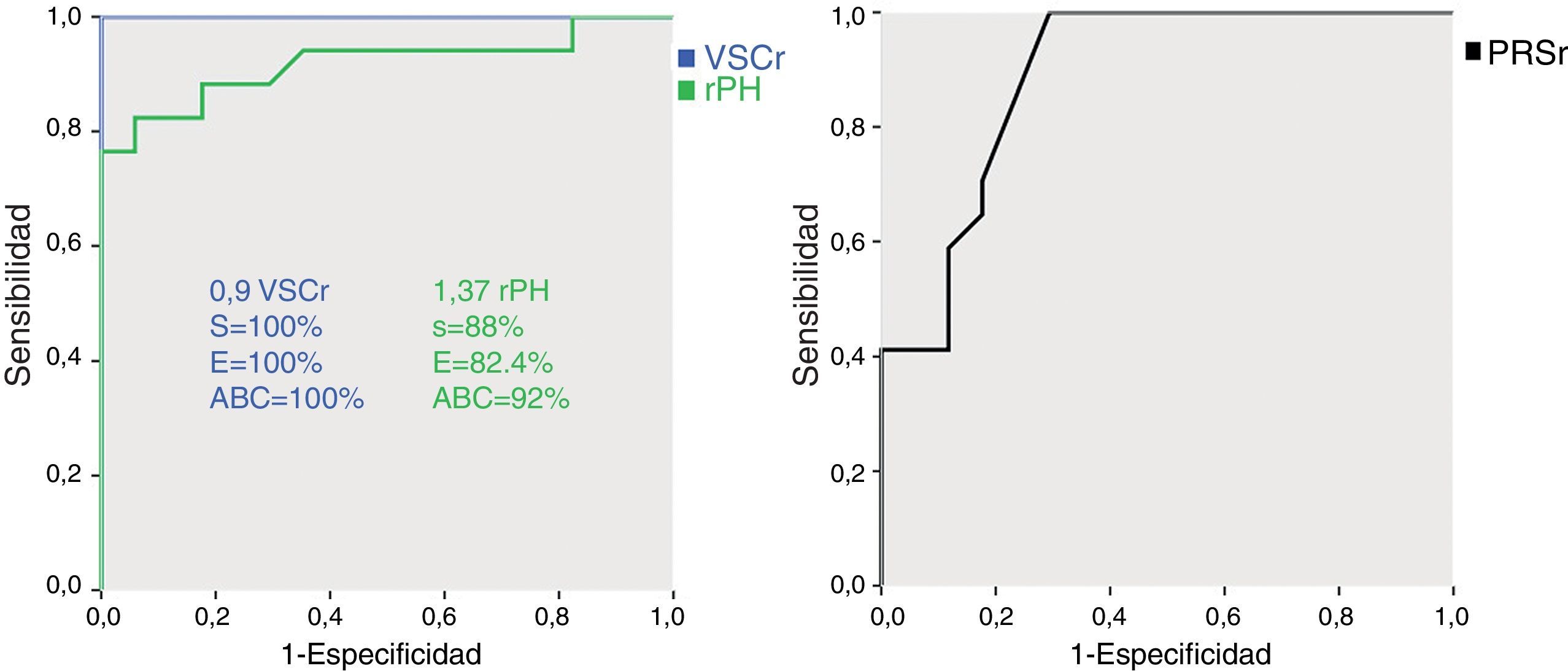
Con el análisis ROC, la rPH tuvo una sensibilidad del 88% y especificidad del 82,4% para el valor 1,37, área bajo la curva (ABC) 92%. En el caso de VSCr, la sensibilidad y especificidad fueron del 100% tomando 0,9 como punto de corte, ABC 100%. Finalmente, para un PRSr de 99%, la sensibilidad fue del 100% y la especificidad del 70,6%, ABC 89% (fig. 6). Todos estos valores fueron estadísticamente significativos (p=0,001). Las variables PRSr-rPH y PRSr-VSCr se correlacionaron fuertemente de forma inversa (−0,76 y −0,81 respectivamente). La correlación de las variables rPH-VSCr fue positiva y alta (0,87). Las correlaciones fueron significativas para todos los parámetros con valor p<0,01.
Curva Receiver Operating Characteristic (ROC) del volumen sanguíneo cerebral relativo (VSCr), relative peak height (rPH) y porcentaje de recuperación de intensidad de señal relativo (PRSr). Se indican respectivamente los valores de sensibilidad y especificidad para los puntos de corte escogidos, así como el área bajo la curva (ABC).
Nuestro estudio ha mostrado que la progresión y el fenómeno de seudoprogresión en los astrocitomas de alto grado tratados tienen valores de PRSr, rPH y VSCr distintos. De ellos, ha sido el VSCr el que ha demostrado disponer más valor para discriminar entre ambos fenómenos.
Son varias las publicaciones que han mostrado que la correlación entre los parámetros de perfusión RM, el grado histopatológico y la densidad vascular de los gliomas es alta16,28–31, y que, probablemente, pueden ser útiles para diferenciar las lesiones secundarias al tratamiento de recidivas tumorales1–4,22,23,32,33. Pero su aplicación con ese fin no está totalmente validada7. En nuestra muestra, los valores de VSCr en los casos de seudoprogresión fueron todos ellos inferiores a los que mostraron las progresiones. Asimismo, los casos de seudoprogresión tuvieron un valor medio de rPH menor y de PRSr mayor que las verdaderas progresiones. El rPH se ha mostrado como un indicador de la vasculatura tumoral y en nuestra serie, al igual que en otras, está muy relacionado con el VSCr7,8,31,34,35. Los valores bajos de rPH y VSCr en las áreas de realce del grupo de pacientes con seudoprogresión concuerdan con los de otros trabajos que han estudiado lesiones motivadas por el tratamiento1–4,21,23,32,33. Nuestros puntos de corte (rPH: 1,37, y VSCr: 0,9) son también parecidos a otros publicados23, de modo que valores superiores a esos puntos de corte podrían corresponder a una progresión tumoral verdadera.
Los estudios que han investigado la utilidad de los parámetros de RM en la seudoprogresión son muy escasos. Barajas et al.23 emplearon parámetros parecidos a los de nuestro trabajo para diferenciar entre radionecrosis y recurrencia del GBM. Para ellos, el parámetro con mayor seguridad para diferenciar radionecrosis de recurrencia fue el rPH23. Young et al.36 examinaron también el papel de estos parámetros en RM con técnicas de susceptibilidad magnética T2 eco de gradiente. En su trabajo, el rPH fue el más exacto para diferenciar seudoprogresión de verdadera progresión en el GB, con sensibilidad y especificidad del 100%, aunque se trató de una muestra pequeña de tan solo 20 individuos (16 progresiones y 4 seudoprogresiones). En nuestro caso, el parámetro con mejores valores de sensibilidad y especificidad fue el VSCr. El software empleado para calcularlo fue LUPE, que corrige el efecto de la extravasación del contraste por la rotura de la BHE. No hemos comparado los valores de VSCr calculados con FuncTool® y los obtenidos con LUPE. Varios trabajos han advertido de la posibilidad de una infraestimación del VSCr en la progresión tumoral debido a la fuga del contraste provocada por la rotura de la BHE21,22. Una de las estrategias realizadas para minimizar este efecto es dar una dosis previa de contraste antes de la secuencia de perfusión. En nuestro caso, el hecho de utilizar el software LUPE permitió que pudiéramos corregirlo.
Según resultados previos con perfusión RM mediante técnicas de susceptibilidad magnética T2*, el PRSr puede ser un parámetro más sensible que el VSCr para diferenciar las metástasis del glioblastoma e incluso del linfoma24. Consiste en el PRS inicial que se recupera tras el primer paso del medio de contraste, y presenta como también hemos demostrado en nuestra serie, una fuerte correlación negativa con el rPH y el VSCr. Son los casos de seudoprogresión los que presentan unos valores de PRS mayores con menores de rPH y VSCr. El grado de recuperación depende de varios factores como la fuga extravascular del contraste (que hace que la intensidad de señal T2 disminuya más y se recupere menos, por la acumulación intersticial del medio de contraste), las características del espacio extravascular o la tasa de flujo sanguíneo. Esto ocasiona diferentes efectos T1 y T2 que determinarán la menor o mayor recuperación de la intensidad de señal en la curva intensidad/tiempo. Algunos autores han descrito que el PRSr es menor en las metástasis que en el GBM y, sobre todo, que en los linfomas24. Únicamente, hemos encontrado un trabajo en el que se ha estudiado su utilidad para diagnosticar la seudoprogresión tumoral aunque con una muestra menor a la nuestra36. En nuestra serie, el PRSr fue mayor en la seudoprogresión (127,12%), que en astrocitomas iii y iv con verdadera progresión (94%). Esta diferencia fue estadísticamente significativa, aunque los valores de PRSr se solaparon discretamente entre ambas muestras. El solapamiento puede estar justificado por la disrupción endotelial y la laxitud del espacio extravascular que se ha descrito en la seudoprogresión24, lo que facilitaría la extravasación y acumulación del medio de contraste. La coexistencia de pequeñas áreas de verdadera progresión, seudoprogresión y gliosis en los casos de seudoprogresión puede justificarlo también24. En el estudio de Barajas et al.23, el PRSr en las recurrencias del GBM (80,2±10,3%) fue menor que en los casos de radionecrosis (89,3±12,4%). Sin embargo, estos resultados no se pueden comparar con los nuestros porque la perfusión RM se hizo con técnicas de susceptibilidad magnética potenciada en T2*. Con estas técnicas, la variación de la señal es más sensible a la extravasación del contraste y, por lo tanto, que tras la caída en la gráfica intensidad de señal/tiempo, la recuperación sea menor. Este hecho puede justificar que los valores de PRSr en ese estudio hayan sido siempre menores que los nuestros.
Es ya conocido, que las técnicas de perfusión por susceptibilidad magnética, sobre todo de parámetros como el VSCr, pueden ser biomarcadores que determinen el grado tumoral estimando la angiogénesis, que, junto con la celularidad, la mitosis, el pleomorfismo y la necrosis, es uno de los criterios histológicos más importantes para determinar el grado de los astrocitomas37,38. Otra utilidad potencial de la perfusión por RM es monitorizar la respuesta al tratamiento con la aparición de efectos, tales como la radionecrosis, seudoprogresión y seudorremisión4,6,7. En el caso concreto de la seudoprogresión, varios autores han sugerido que el VSCr es útil para diferenciarla de la verdadera progresión, por lo que puede ser un biomarcador del curso de la enfermedad39. Como ya se ha comentado, la utilidad del PRSr ha sido evaluada para diferenciar el glioblastoma recurrente de la radionecrosis con buenos resultados aunque, como en nuestro caso, los valores se han solapado entre las muestras. El PRSr tiene también ventajas sobre parámetros que, como la Ktrans, estiman la permeabilidad en estudios de perfusión T123. La idea de que la intensidad de señal T1 es proporcional a la concentración de contraste parece ser no válida y, sin una calibración previa, los valores de Ktrans pueden ser imprecisos. Tales calibraciones no son necesarias en el cálculo del PRSr como estimador de la permeabilidad capilar. La mayor limitación en el uso de perfusión T1 es la imposibilidad del cálculo simultáneo del VSCr y del rPH, que han sido los 2 biomarcadores más reconocidos por su capacidad para estimar la angiogénesis35,37.
Nuestro trabajo presenta varias limitaciones: 1) Se trata de un estudio retrospectivo de una muestra pequeña; 2) Otra limitación importante es que en ninguno de nuestros pacientes hubo confirmación histológica; 3) En nuestro análisis no tuvimos en cuenta el tratamiento con corticoides, que pueden modificar los parámetros de perfusión, aunque no sean una terapia antiangiogénica; 4) No se ha podido comparar la perfusión en la seudoprogresión con la perfusión antes del tratamiento, y evitar la variabilidad interindividual. Sin embargo, sí construimos 2 muestras parecidas en cuanto al grado tumoral y tratamiento recibido; 5) El hecho de que los ROI se dibujaran consensuadamente por los 2 neurorradiólogos, y que los cálculos se hiciesen conjuntamente, hace que no podamos determinar la variabilidad interobservador para extrapolar mejor los resultados; 6) El posproceso se realizó definiendo ROI normalizados con los valores de la sustancia blanca contralateral en el caso del PRSr y rPH y con un ROI homólogo simétrico en caso del VSCr. No llevamos a cabo un análisis vóxel a vóxel con herramientas matemáticas, el cual podría realizarse en investigaciones futuras; y 7) No hemos evaluado en este estudio lo que podría aportar a nuestro objetivo el cálculo de parámetros de perfusión relacionados con un modelo farmacocinético bicompartimental, más frecuentemente usados en técnicas de perfusión T1, como la ktrans (paso de contraste desde el compartimento intravascular al intersticio mediante el endotelio o permeabilidad), Kep (vuelta al espacio vascular o coeficiente de extracción), Ve (volumen intersticial) y Vp (volumen vascular)40.
En conclusión, nuestros datos sugieren que los parámetros de rPH y VSCr pueden ser útiles para diferenciar la seudoprogresión tumoral de la progresión en los pacientes tratados con RT y TMZ. El PRSr parece en principio, un parámetro menos útil.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autorías- 1.
Responsable de la integridad del estudio: AMM.
- 2.
Concepción del estudio: AMM y JMB.
- 3.
Diseño del estudio: AMM y JMB.
- 4.
Obtención de los datos: AMM.
- 5.
Análisis e interpretación de los datos: AMM.
- 6.
Tratamiento estadístico: AMM.
- 7.
Búsqueda bibliográfica: AMM y JMB.
- 8.
Redacción del trabajo: AMM.
- 9.
Revisión crítica del artículo con aportaciones intelectualmente relevantes: AMM y JMB.
- 10.
Aprobación de la versión final: AMM y JMB.
Los autores declaran no tener ningún conflicto de intereses.