La creciente precisión de la resonancia magnética multiparamétrica de próstata, en combinación con una mayor experiencia y estandarización en su interpretación, han conferido a esta técnica un papel actual sustancial en el manejo del cáncer de próstata, neoplasia no cutánea más prevalente en el varón. Revisamos los conceptos del sistema PI-RADS versión 2.1 para la estimación de la probabilidad y localización zonal de tumores significativos de próstata, con un enfoque práctico que incluye consideraciones actuales sobre los requisitos previos de la prueba y recomendaciones para su interpretación. Se hace hincapié en hallazgos benignos que pueden llevar a confusión y los criterios de valoración de la probabilidad de extensión local de la enfermedad, que deben también formar parte de un informe estructurado.
The increasing precision of multiparametric magnetic resonance imaging of the prostate, together with greater experience and standardization in its interpretation, has given this technique an important role in the management of prostate cancer, the most prevalent non-cutaneous cancer in men. This article reviews the concepts in PI-RADS version 2.1 for estimating the probability and zonal location of significant tumors of the prostate, using a practical approach that includes current considerations about the prerequisites for carrying out the test and recommendations for interpreting the findings. It emphasizes benign findings that can lead to confusion and the criteria for evaluating the probability of local spread, which must be included in the structured report.
El carcinoma de próstata (CP) es la neoplasia no cutánea más prevalente en el varón y segunda responsable de muerte por cáncer tras el broncopulmonar1. Su manejo es particularmente complejo, ya que es necesario diferenciar entre tumores indolentes y tumores agresivos o clínicamente significativos2, que pueden definirse como aquellos con un grado histológico Gleason ≥ 7 y/o con un volumen tumoral ≥ 0,5cm3 y/o con extensión extraglandular3. El uso de la resonancia magnética (RM) multiparamétrica (RMmp) de próstata ha experimentado un crecimiento exponencial para la detección y estimación del riesgo de cáncer de próstata clínicamente significativo (CPCS), guía de biopsia o de terapia focal y seguimiento de pacientes4–6. Numerosos estudios con alto nivel de evidencia respaldan su uso para el diagnóstico de CP, mostrando una importante mejora diagnóstica en comparación con la biopsia de próstata transrectal sistemática no dirigida7–16. Las últimas guías recomiendan incluso realizarla antes de la primera biopsia en pacientes con elevación de los niveles de antígeno prostático específico (PSA), tacto rectal patológico o ambos12,17,18. El desarrollo de la RMmp conlleva una necesidad permanente de actualización en los estándares de realización, interpretación e informe radiológico, con el fin de optimizar su implantación y aceptación clínica4,19.
En marzo de 2019, el Comité rector del sistema de datos e informe en imagen prostática (Prostate Imaging – Report and Data System, PI-RADS) publicó la versión actual de este documento, denominada PI-RADSv2.14, que incluía una serie de aclaraciones y reajustes para solventar algunas inconsistencias o ambigüedades detectadas en la versión anterior20–23.
El objetivo principal de este trabajo es proporcionar una guía práctica que facilite la lectura e informe estructurado de la RM de próstata de acuerdo con las directrices del PI-RADSv2.1. Revisamos para ello la anatomía de la próstata, los conceptos básicos y algunos aspectos novedosos o equívocos del sistema PI-RADS, las estructuras anatómicas y hallazgos benignos que pueden llevar a confusión, y los criterios de extensión extraprostática (EEP) tumoral, que deben valorarse también como parte del estudio.
Anatomía de la próstataLa morfología de la próstata es semejante a un cono invertido, y se diferencian en ella cuatro zonas histológicamente diferentes, según describió McNeal24:
- 1.
Zona periférica (ZP): contiene el 70-80% del tejido glandular, con conductos radiados posterolateralmente a partir de la uretra distal al verumontanum.
- 2.
Zona central (ZC): contiene el 20% del tejido glandular; rodea los conductos eyaculadores en la porción posterosuperior de la glándula, por debajo de las vesículas seminales (VS).
- 3.
Zona transicional (ZT): contiene el 5% del tejido glandular y forma dos lóbulos periuretrales proximales al verumontanum con pequeños conductos, que en la edad adulta desarrollan la hiperplasia benigna de próstata (HBP).
- 4.
Estroma fibromuscular anterior (EFMA): no posee tejido glandular3,25–29.
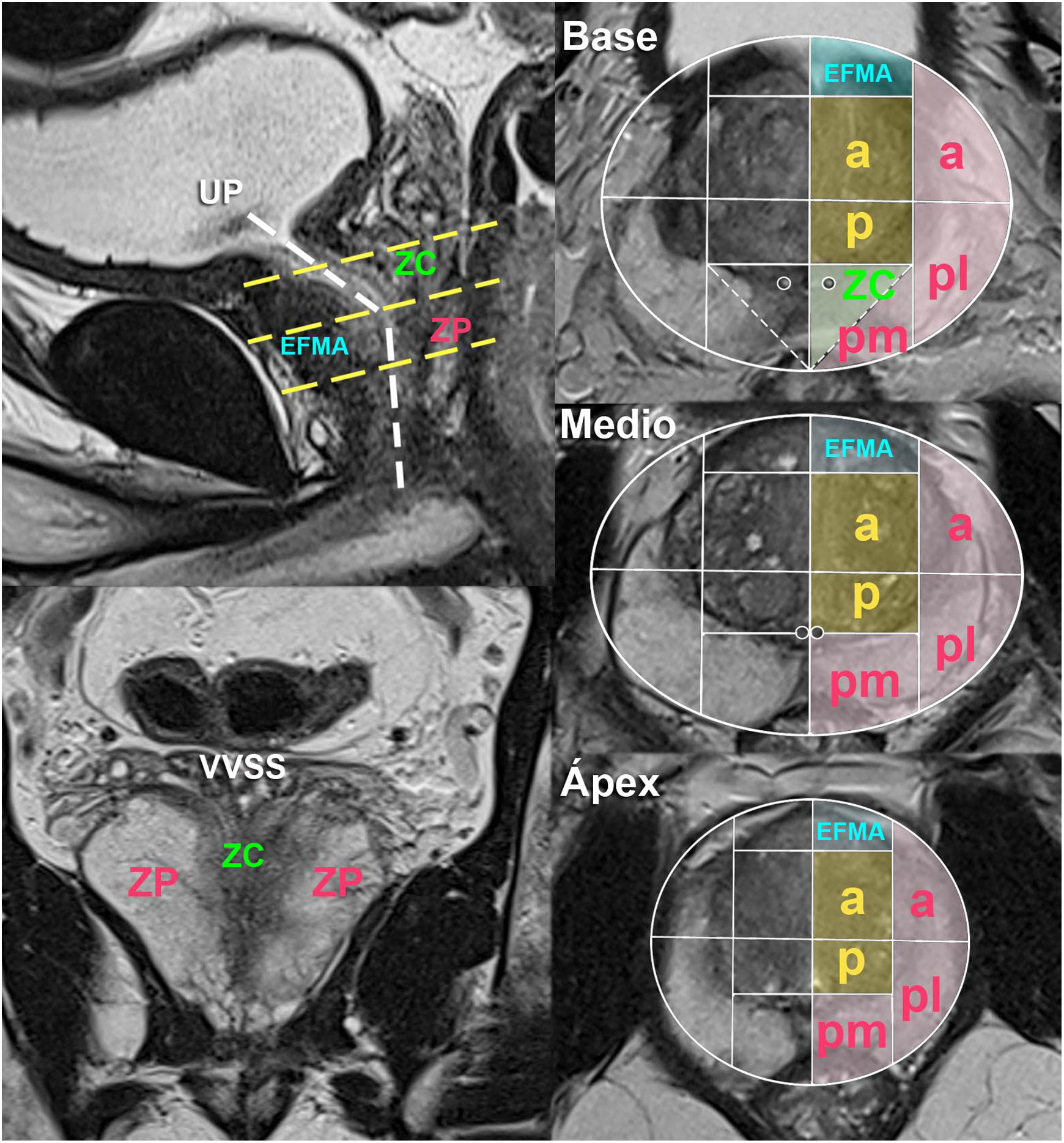
El modelo de segmentación anatómica adoptado por el PI-RADS v2.1, respecto al cual debe especificarse la localización de las lesiones, diferencia en la próstata dos lóbulos (derecho e izquierdo), tres niveles de arriba abajo (base, medio y ápex) y varios sectores en cada zona de McNeal, que suman un total de 41 segmentos (incluyendo las dos VS y la uretra membranosa)3(fig. 1).
Anatomía sectorial de la próstata según PI-RADSv2.1. El esquema sectorial (ZP en rosa, ZT en naranja, ZC en verde y EFMA en azul) es idéntico en los tres niveles excepto los dos pequeños sectores adicionales de la ZC en el basal. Por delante de la uretra prostática (UP) se encuentra el EFMA y por detrás de ella, la ZC en la mitad superior y la ZP medioapical en la parte inferior. La ZC normal es simétrica en forma de V en planos coronales.
EFMA: estroma fibromuscular anterior; ZC: zona central; ZP: zona periférica; ZT: zona transicional.
Aproximadamente, el 70-75% de los CP se originan en la ZP y el 20-30%, en la ZT. Los cánceres que se originan en la ZC son infrecuentes y habitualmente secundarios a la extensión a partir de los tumores de la ZP3.
La ZP normal es hiperintensa y la ZC y el EFMA, hipointensos. La HBP se presenta sistemáticamente hacia los 50 años y se acentúa con la edad. Los nódulos hiperplásicos resultan de una proliferación mixta de componente glandular y estroma fibromuscular en la ZT. Los nódulos de predominio glandular son hiperintensos en T2 y los de predominio estromal, hipointensos, con mayor restricción de la difusión y realce precoz por el contraste26.
La próstata está delimitada en secuencias T2 por una línea hipointensa, producida por una condensación estromal superficial en su interfase con la grasa periprostática que no constituye una verdadera cápsula30,31. De aquí que resulte más correcto indicar que una lesión muestra o no signos de EEP y no extracapsular o de infiltración de la cápsula. El ápex prostático ni siquiera cuenta con esta estructura, por lo que constituye una de las regiones proclives a la EEP tumoral25,32.
PI-RADS v2.1Consideraciones técnicasLa RMmp de próstata es una herramienta altamente dependiente de la calidad de imagen, basada en una combinación de secuencias de pulso, T2 multiplanares de alta resolución, potenciadas en difusión (DWI) y estudio dinámico con contraste (DCE-MRI), que tendrían una baja rentabilidad de usarse de manera aislada13,33.
En la tabla 1 se resumen las principales medidas de preparación del paciente que menciona PI-RADS, sin especificar pautas ante la falta de consenso, y los requerimientos técnicos fundamentales para la adquisición de imágenes3. El nivel de evidencia y el grado de recomendación de ambos tipos de directrices, analizados en una reciente revisión del comité PI-RADS, son moderados en general excepto los referidos a la combinación óptima de antenas receptoras (con nivel 1A): espinal integrada en la mesa y externa multicanal phase-array, sin necesidad de bobina endorrectal que puede resultar incluso contraproducente33.
| Preparación del paciente | |
| Evacuación rectal | • Microenema autoadministrado el día de la prueba• Evacuación de gas rectal por sonda o jeringa (opcional) y dieta blanda 2 días |
| Evacuación vesical | • Antes de comenzar (suele ser incompleta por el tipo de paciente) |
| Espasmolítico | • Butilbromuro de escopolamina, 20mg i.v., en infusión lenta en dos fracciones, antes de la prueba y 2 minutos antes de secuencias de difusióna• Contraindicaciones: retención urinaria aguda, hipertensión intraocular |
| Otras | • Considerar abstinencia eyaculatoria de 3 días (opcional)• Instrucciones al paciente: inmovilidad, respiración libre superficial, duración |
| Generales | |
| Intensidad de campo | • 3 T preferible. 1,5 T aceptable con tecnología moderna (gradientes, bobinas) |
| Bobina endorrectal | • Opcional. No necesaria en equipos modernos con bobinas externas de 16 canales o más |
| Tecnología CADb | • Opcional (flujo de trabajo, cuantificación, integración biopsia dirigida) |
| Imágenes T2 | |
| Planos | • Axial (estricto u oblicuo: considerar plano perpendicular a interfase rectoprostática)• Al menos otro plano ortogonal adicional, coronal o sagital |
| Secuencias | • 2D RARE (FSE, TSE) preferible a 3D isométricos. TE 90-120 ms• Espesor de corte 3mm (gap 0), FOV 12-20cm (próstata y VS) |
| Imágenes T1 | |
| Secuencias | • 2D RARE (FSE, TSE) o GRE. Con o sin supresión. Plano axial estricto• Espesor <5mm, FOV pelvis, cobertura: bifurcación aórtica-perineo |
| DWI: secuencia EPI con b alto | |
| b | • ≥1400 s/mm2, adquirido o calculado |
| Secuencia | • SE EPI sat. grasa. TE ≤ 90ms TR ≥ 3000ms. Plano igual que T2 axial• Espesor ≤ 4mm (gap 0). FOV 16-22cm. RE en plano ≤ 2,5 mm×2,5 mm |
| DWI: mapa ADC | |
| Valores de b | • Bajo entre 50-100 s/mm2 e intermedio entre 800-1000 s/mm2 (evitando efecto de kurtosis de b superalto) para el cálculo del mapa |
| Estudio dinámico con contraste | |
| Secuencias | • 3D T1W GRE preferibles. TR/TE: <100 ms/<5ms. Plano igual que T2 axial. Dosis: 0,1 mmol/kg. Flujo: 2-3 ml/s• Espesor de corte 3mm (gap 0). FOV: 12-20cm (próstata y VS). RE en plano ≤ 2×2mm. Res. temporal ≤ 15 s. Tiempo de observación ≥ 2 minutos |
Se destaca también la utilidad de agentes espasmolíticos para reducir la motilidad intestinal y la consiguiente borrosidad de imágenes T2, la superioridad de un microenema de limpieza previo autoadministrado frente a la aspiración rectal de gas por catéter para evitar artefactos en difusión, y el razonable efecto positivo de una abstinencia eyaculatoria de 3 días en la visibilidad de lesiones en la ZP e invasión tumoral de las VS33.
La orientación de planos aconsejada en este estudio, otro punto impreciso en PI-RADSv2.1, es paralela y perpendicular a la interfase rectoprostática para los cortes coronales y axiales, respectivamente. Los planos coronales muestran la glándula con forma de “corazón” y una buena representación de la eventual afectación seminal, y los planos axiales, una mejor correlación con las secciones transversales de especímenes de prostatectomía. Los planos de difusión y perfusión deben ser idénticos en angulación y geometría a los T2 axiales seleccionados, para una óptima interpretación sincronizada del estudio33.
Sobre los valores de b para la difusión, PI-RADSv2.1 recomienda al menos uno bajo, en el rango 0-100 s/mm2, y uno alto pero inferior a 1000 (entre 800-1000) para el cálculo del mapa ADC, evitando efectos vasculares y de kurtosis, respectivamente, además de un valor de al menos 1400 s/mm2 para la secuencia DWI, ya sea calculado o mejor adquirido3,33.
El estudio dinámico con contraste (DCE) debe tener una resolución temporal inferior a 15 segundos. A pesar de su limitado papel en la detección tumoral, se mantiene su valor como “técnica de apoyo” para observadores menos expertos, estadificación tumoral, inadecuación de otras secuencias por artefactos y casos con elevada sospecha clínica y RM previa negativa3,33.
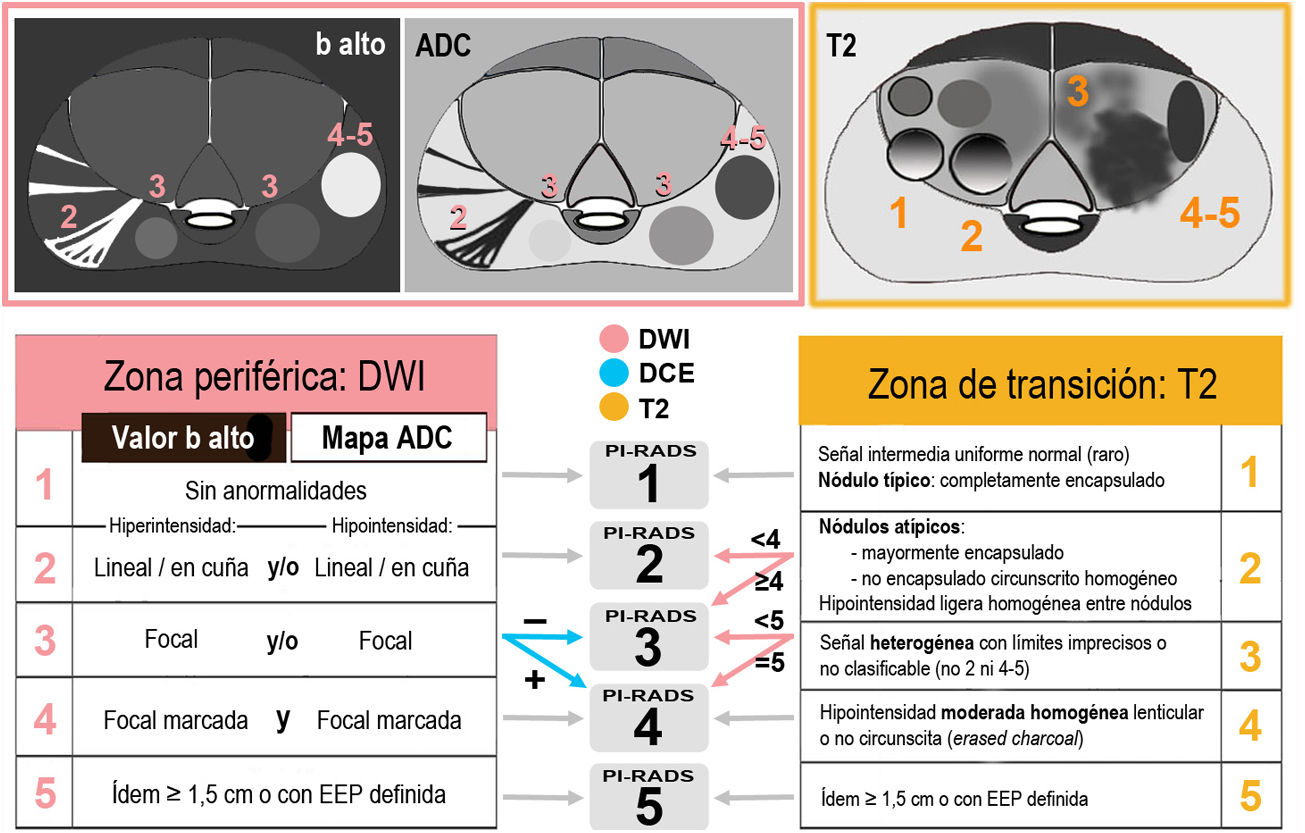
Claves de interpretaciónPI-RADS es un método de valoración de riesgo que predice la probabilidad de CPCS (entre 1, muy improbable, y 5, muy probable) mediante una lectura estandarizada y ponderada por zonas anatómicas de las secuencias que componen la RMmp (fig. 2). Así, se establece en cada zona una secuencia dominante con mayor peso en la puntuación definitiva de la lesión: difusión (valorando conjuntamente DWI con b alto y mapa ADC) en la ZP, y T2 en la ZT3,34 (fig. 3).
Esquema de las claves de la categorización en PI-RADSv2.1: secuencias dominantes según la zona y PI-RADS final. En la zona periférica (ZP) predomina la difusión y se valora el estudio dinámico con contraste si el PI-RADS en difusión es 3. En la zona transicional predomina el T2 y se valora la difusión en caso de que el PI-RADS en T2 sea de 2 o 3. Una lesión focal en la ZP se mantiene con puntuación de 3 en difusión incluso si la hiperintensidad en DWI o la hipointensidad en ADC es marcada, no ambas a la vez. Si la señal es marcada en ambas la puntuación final es 4.
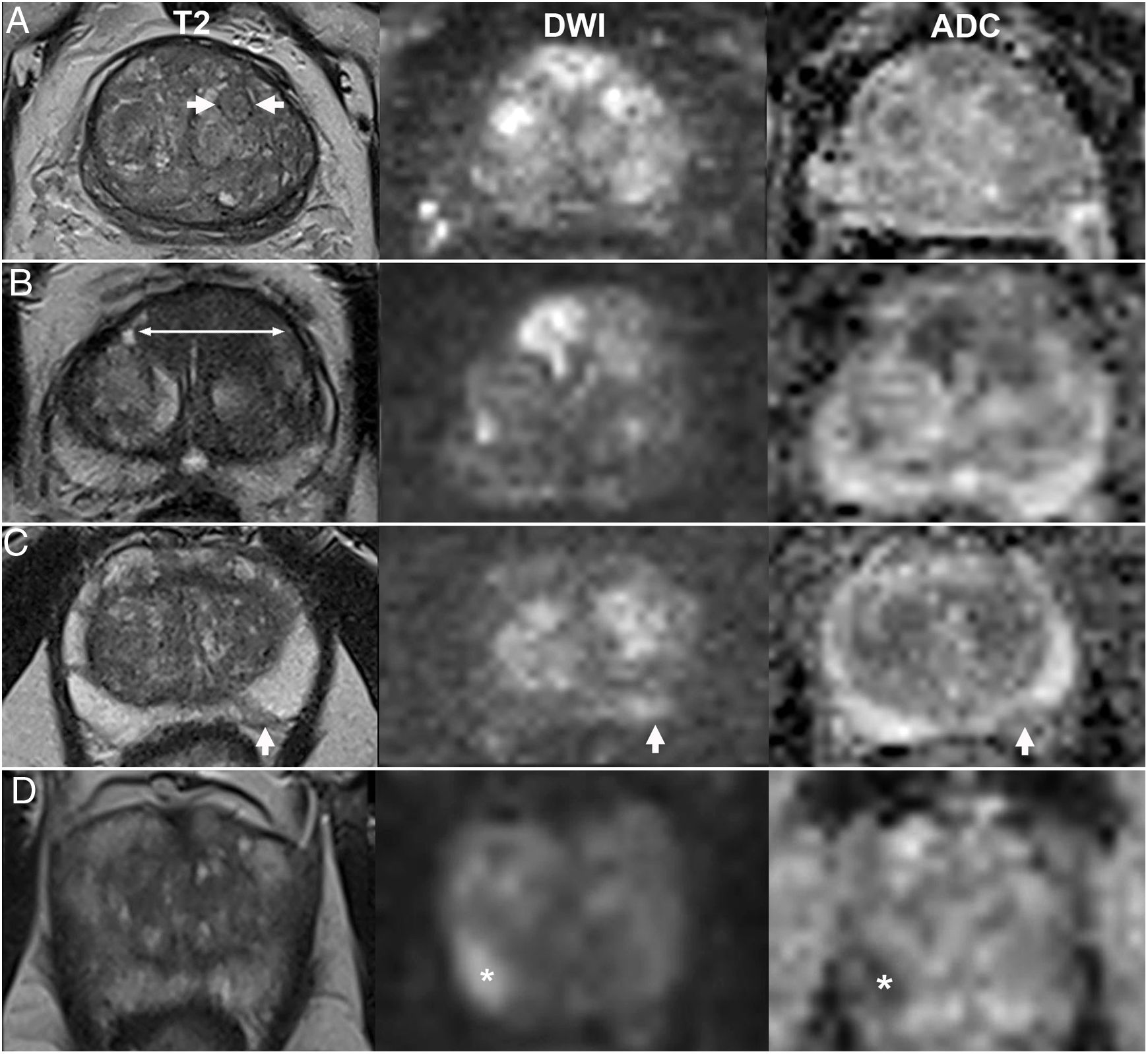
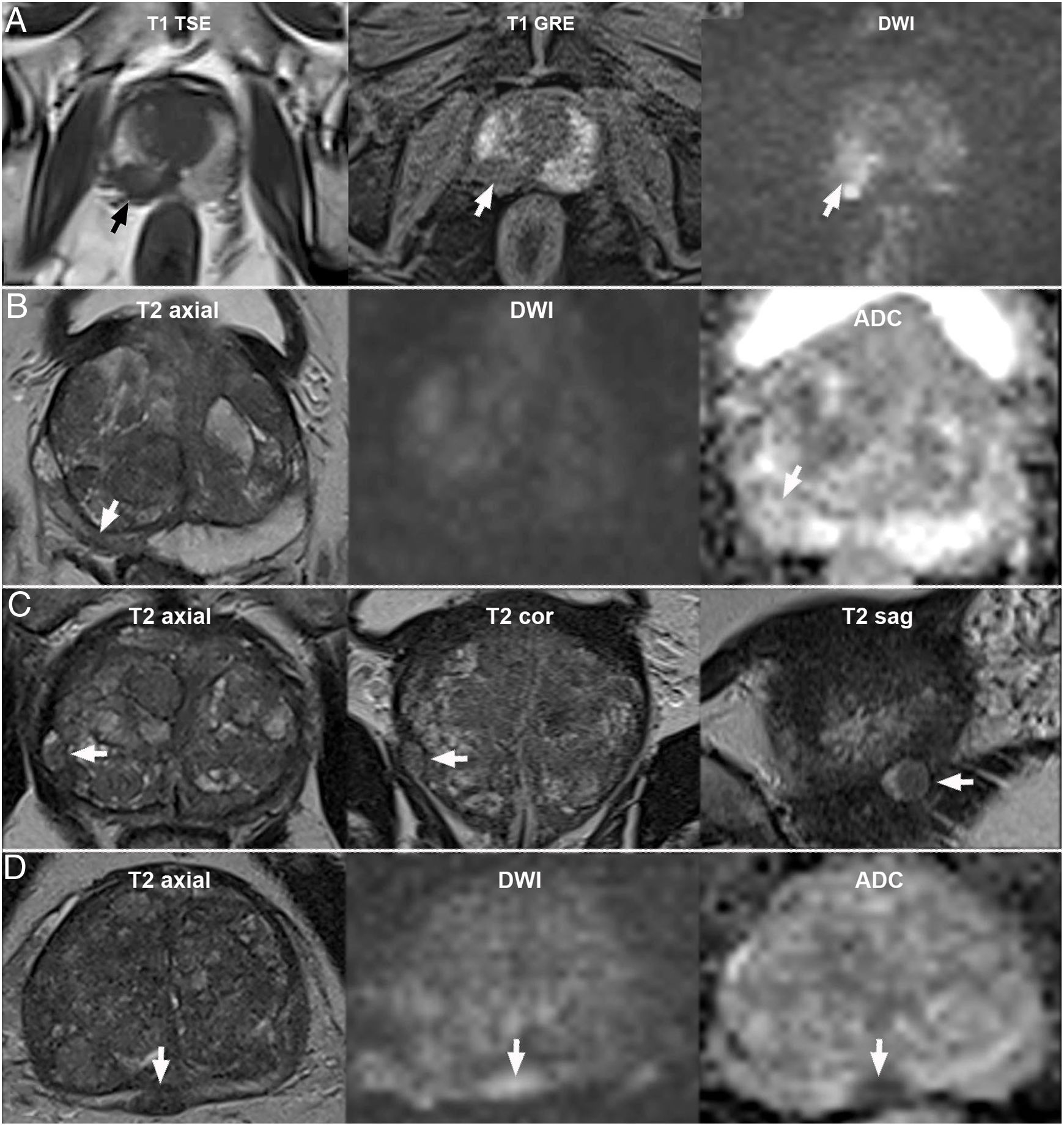
Ejemplos de categorías PI-RADS v2.1 determinadas casi exclusivamente por la secuencia dominante. A) PI-RADS 1 en la zona transicional (ZT): nódulo hiperplásico típico. B) PI-RADS 5 en la ZT: hipointensidad homogénea no circunscrita (“en mancha de carbón”) mayor de 1,5cm en los sectores anteriores de ambos lóbulos a nivel medio. C) PI-RADS 2 en la zona periférica (ZP): hiperintensidad en DWI e hipointensidad en ADC en forma de cuña. La secuencia T2, aun siendo no dominante, contribuye a valorar su morfología. D) PI-RADS 4 en la ZP: foco de restricción marcado tanto en DWI con b1400 como en el mapa ADC, menor de 1,5cm.
Las secuencias no dominantes decantan la puntuación final de un hallazgo, por lo general manteniendo o bien elevando un punto su categoría definitiva en casos de probabilidad baja o indeterminada en la secuencia dominante. Por ejemplo, los nódulos de HBP se consideran típicos y reciben en PI-RADSv2.1 una puntuación definitiva de 1 cuando son completamente encapsulados. En cambio, los nódulos parcialmente encapsulados, incluso circunscritos, se consideran atípicos y se les asigna una puntuación provisional de 2 (fig. 4A) que aumenta a 3 si, como ocurre con frecuencia, muestran una marcada restricción de difusión3 (fig. 4 B).
Valor de la difusión en la zona transicional como secuencia no dominante. A) PI-RADS 2: nódulo parcialmente encapsulado (asterisco) con alteración de la difusión poco marcada (3) en DWI b1400 y mapa ADC (mantiene 2 como puntuación definitiva). B) PI-RADS 3: nódulos atípicos, hipointensos no encapsulados (asteriscos), con puntuación de 4 en difusión (2 en T2, que aumenta definitivamente a 3). En estos casos, la difusión facilita también la detección de las áreas que requieren un análisis morfológico más detallado en T2.
Este resultado indeterminado, observado con frecuencia en la ZT, es una de las limitaciones inherentes del PI-RADS actual para la detección del CPCS en esta zona, más compleja que en la ZP y basada en la disrupción del “caos organizado” de la HBP por lesiones mal definidas o con forma no nodular3,34.
El papel del DCE se limita a la valoración de lesiones de la ZP con puntuación 3 en difusión, secuencia dominante en la zona (fig. 5). Se utiliza para ello un criterio binario (positivo o negativo), considerando positivo un realce focal respecto al tejido adyacente, ya sea precoz o simultáneo, que se corresponde con el hallazgo sospechoso en difusión y/o T2. El resultado negativo incluye la ausencia de este realce, la falta de correlación con una lesión focal visible en otra secuencia o su correlación con un nódulo típico de HBP3.
Valor del estudio dinámico con contraste (DCE). A) PI-RADS 3 en difusión en la zona periférica que se eleva a 4 tras el DCE: restricción focal poco marcada al menos en uno de los tipos de imágenes de difusión (ligera hiperintensidad en DWI b alto, inapreciable en ADC), con DCE positivo: realce focal temprano que corresponde al hallazgo sospechoso. B) Secuencia dominante inadecuada: mapa ADC no valorable por artefactos con origen en prótesis de cadera derecha. Hiperintensidad focal en DWI con DCE positivo: PI-RADS 4.
Es recomendable un software dedicado y una estación de trabajo que permita presentar todo el estudio en una sola vista, adecuada para evaluar su calidad y la presencia o ausencia de hemorragia, ajustar si es preciso los niveles de brillo y contraste y medir el volumen prostático, como pasos iniciales35.
A continuación, resulta útil una configuración de pantalla que muestre de forma sincronizada las tres secuencias axiales fundamentales (T2 axial, DWI b alto y mapa ADC), junto con una T2 longitudinal, preferiblemente coronal, como referencia del nivel de corte analizado. Cualquier secuencia es válida para la detección de lesiones como paso previo para su caracterización, que requiere siempre valorarlas simultáneamente en todas ellas. La concordancia en la posición de un hallazgo y su correcta localización zonal son cruciales.
Cuando sea necesario por el tipo de lesión, hay que incorporar al panel visible el resto de las series, por ejemplo, para un análisis morfológico triplanar en T2. Aunque PI-RADSv2.1 lo permite, es difícil en la práctica renunciar a uno de los dos planos longitudinales: el sagital es tal vez más prescindible por no representar la simetría glandular, aunque sí la invasión de VS y la morfología de componentes anatómicos, y es el idóneo para medir los diámetros longitudinal y anteroposterior del volumen prostático. En el DCE, la perfusión se valora visualmente mediante un desplazamiento continuo entre planos en modo cine, con o sin el apoyo de mapas paramétricos codificados en color o de curvas intensidad-tiempo regionales. Existe una elevada variabilidad en el comportamiento del CP y pocos datos publicados que apoyen la utilidad clínica de la clasificación de curvas o del análisis de modelos farmacocinéticos de realce3.
Las lesiones deben medirse en la secuencia dominante y plano axial salvo que se encuentren mucho mejor delimitadas en otra secuencia o plano, en cuyo caso hay que especificarlo3. Se recomienda también registrar los valores numéricos mínimos del ADC en los focos de sospecha.
La asignación de categorías PI-RADS por las alteraciones observadas en morfología e intensidad de señal es un proceso básicamente cualitativo, en el que es decisiva la precisión terminológica. PI-RADS cuenta para ello con un apéndice lexicográfico, donde circunscrito es sinónimo de bien definido y lo contrario de mal definido, indistinto o borroso. La hiper- o hipointensidad se definen en relación con el tejido prostático de fondo o bien otro tejido o estructura de referencia: marcada hipointensidad es una señal muy inferior a la habitual en un tejido o similar a las calcificaciones o el gas. Focal significa localizado en un foco, distinto o diferente del patrón de fondo, en contraposición a difuso, continuo, no localizado o diseminado. Regional denota una extensión intermedia entre focal y difuso, como puede ser un sextante, una zona o un lóbulo prostático3.
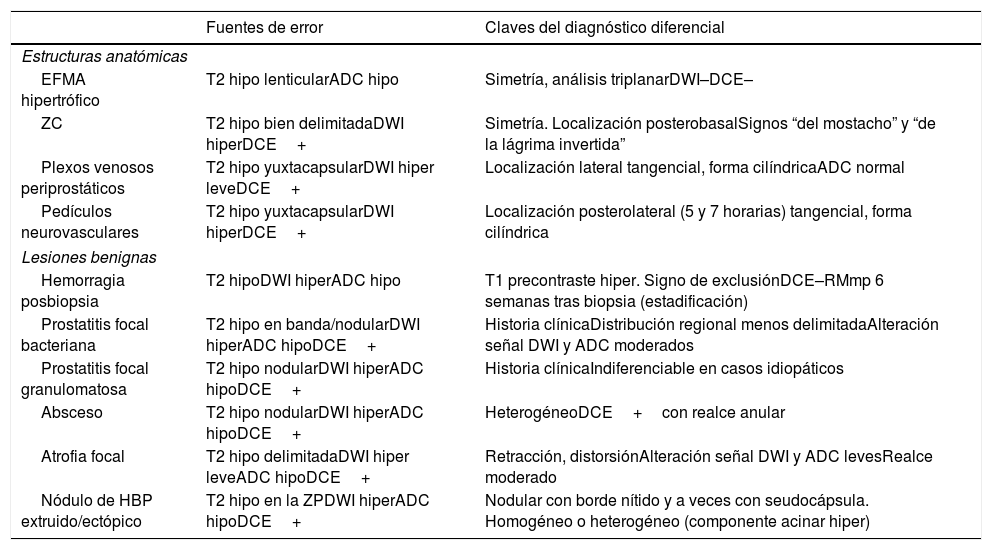
Hallazgos benignos que pueden conducir a error diagnósticoA pesar de la estandarización en RMmp, existen estructuras anatómicas normales o con cambios parafisiológicos y lesiones benignas que simulan cáncer27,35–40. Pueden originar falsos positivos, pero también falsos negativos. Las fuentes de error que deben tenerse presentes y las claves para evitar su confusión, aplicando el conocimiento anatómico, datos clínicos y criterios PI-RADS con especial rigor, se resumen en la tabla 2.
Hallazgos que pueden conducir a error diagnóstico en resonancia magnética de próstata y recomendaciones para evitaro27,35–52
| Fuentes de error | Claves del diagnóstico diferencial | |
|---|---|---|
| Estructuras anatómicas | ||
| EFMA hipertrófico | T2 hipo lenticularADC hipo | Simetría, análisis triplanarDWI–DCE– |
| ZC | T2 hipo bien delimitadaDWI hiperDCE+ | Simetría. Localización posterobasalSignos “del mostacho” y “de la lágrima invertida” |
| Plexos venosos periprostáticos | T2 hipo yuxtacapsularDWI hiper leveDCE+ | Localización lateral tangencial, forma cilíndricaADC normal |
| Pedículos neurovasculares | T2 hipo yuxtacapsularDWI hiperDCE+ | Localización posterolateral (5 y 7 horarias) tangencial, forma cilíndrica |
| Lesiones benignas | ||
| Hemorragia posbiopsia | T2 hipoDWI hiperADC hipo | T1 precontraste hiper. Signo de exclusiónDCE–RMmp 6 semanas tras biopsia (estadificación) |
| Prostatitis focal bacteriana | T2 hipo en banda/nodularDWI hiperADC hipoDCE+ | Historia clínicaDistribución regional menos delimitadaAlteración señal DWI y ADC moderados |
| Prostatitis focal granulomatosa | T2 hipo nodularDWI hiperADC hipoDCE+ | Historia clínicaIndiferenciable en casos idiopáticos |
| Absceso | T2 hipo nodularDWI hiperADC hipoDCE+ | HeterogéneoDCE+con realce anular |
| Atrofia focal | T2 hipo delimitadaDWI hiper leveADC hipoDCE+ | Retracción, distorsiónAlteración señal DWI y ADC levesRealce moderado |
| Nódulo de HBP extruido/ectópico | T2 hipo en la ZPDWI hiperADC hipoDCE+ | Nodular con borde nítido y a veces con seudocápsula. Homogéneo o heterogéneo (componente acinar hiper) |
EFMA: estroma fibromuscular anterior; HBP: hiperplasia benigna de próstata; ZC: zona transicional.
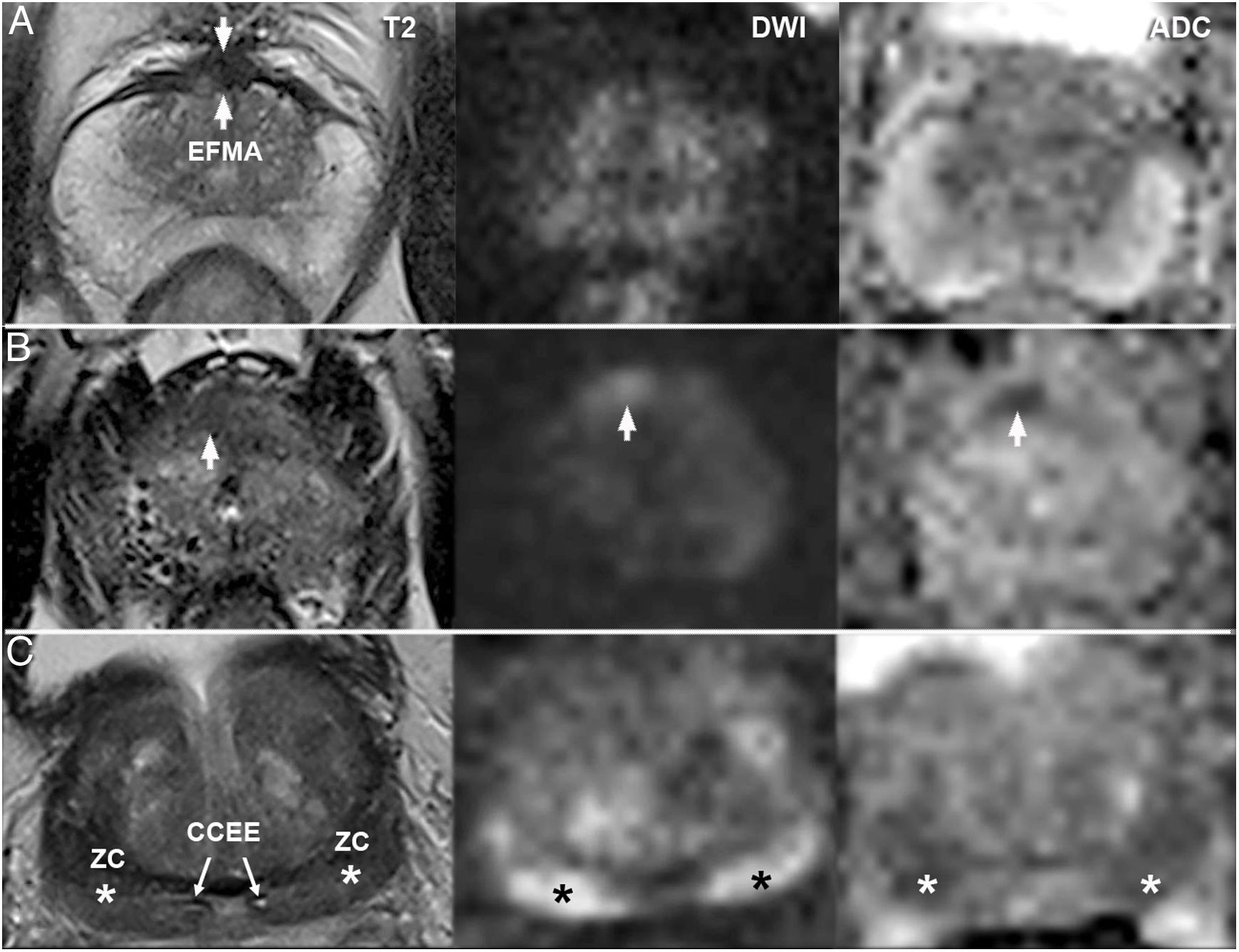
El EFMA hipertrófico y el engrosamiento seudonodular de la cápsula quirúrgica del adenoma transicional son posibles fuentes de error por su hipointensidad en T2, si bien no brillan en DWI: esta secuencia junto con su característica topografía y simetría permiten diferenciarlos de neoplasia u otra lesión (fig. 6 A y 6 B)27,31,36,41,42. El DCE tiene menor utilidad27,43–45.
Fuentes de error por estructuras anatómicas. A) Estroma fibromuscular anterior (EFMA) normal: hipointenso y simétrico en T2, sin brillo en DWI. B) Lesión PI-RADS 4 que debe diferenciarse del EFMA: hipointensidad asimétrica muy anterior en el lóbulo derecho con aumento de señal en DWI e hiposeñal en ADC. Prostatitis crónica en biopsia tras resonancia magnética (RM). C) Zona central normal (asteriscos): hipointensa en T2 y marcadamente hiperintensa en DWI, con apariencia simétrica en todas las secuencias (“signo del mostacho”). Biopsia sistemática previa a resonancia magnética, negativa para malignidad: hiperplasia adenomiomatosa de predominio estromal en todos los cilindros basales.
La distorsión y compresión de la ZC contra la ZP, secundaria a la HBP y asociada en ocasiones con fibrosis periductal alrededor de los conductos eyaculadores, produce focos ovoideos de hipointensidad homogénea bien delimitada en ambos lóbulos prostáticos, con alteración de señal tanto en DWI como en ADC (fig. 6C). Su diferenciación con el CP depende de un análisis morfológico triplanar, con la simetría como rasgo clave26,37,39,46. El ‘signo del mostacho’ describe la apariencia de estos focos rechazados hacia el margen posterobasal de la glándula, tanto en planos axiales como coronales. El “signo de la lágrima invertida” se observa cuando su disposición es más medial y vertical en el plano coronal, convergentes y adelgazados distalmente y con un aspecto nodular en la línea media en planos axiales, proximales siempre al verumontanum36.
Tanto la ZC como el EFMA no deben puntuar cuando son normales3, mientras que su asimetría de señal en cualquiera de las secuencias sugiere CP27,31,41. A veces es imposible diferenciar entre una ZC asimétrica y un foco PI-RADS 4, y esta duda diagnóstica debe reflejarse en el informe, siendo conscientes de las limitaciones de la técnica y proponiendo la biopsia dirigida27,31,41,44. Aunque el CP se presenta raramente en la ZC (7%), suele ser más agresivo, con mayor grado y probabilidad de EEP e invasión de las VS26,45.
Los plexos venosos y fascículos neurovasculares periprostáticos producen hipointensidades yuxtacapsulares con mayor o menor restricción de difusión e intenso realce vascular, susceptibles de simular CP con EEP4,41,42. Su localización lateral y posterolateral, respectivamente, y forma cilíndrica tangencial a la próstata deberían servir para diferenciarlos32,42.
Lesiones benignas que simulan cáncerLa hemorragia tras biopsia prostática es frecuente, sobre todo en la ZP y VS, y muestra características semejantes al CP en imágenes T2, DWI y mapa ADC que pueden simular u ocultar una neoplasia, así como su EEP. La ausencia de captación precoz en imágenes contrastadas con sustracción contribuye a diferenciarlas, pero es indispensable disponer de una secuencia T1 precontraste, donde aparece como focos hiperintensos que suelen respetar la región donde se localiza un tumor en caso de coexistir3,27,37,47. El “signo de exclusión de hemorragia” (fig. 7A) describe esta ausencia de sangrado en el tejido tumoral por su escaso contenido en citrato (anticoagulante endógeno que contribuye a preservar el semen), en relación con el tejido prostático normal que sí lo posee y es por tanto más propenso a presentar sangrado: donde hay hemorragia no suele haber tumor36,37.
Fuentes de error debidos a lesiones benignas. A) Signo de exclusión de hemorragia: Hemorragia extensa que delimita un foco tumoral en el lóbulo derecho como un defecto de sangrado (flechas). B) Atrofia secundaria a prostatitis crónica: hipointensidad focal en la zona periférica (ZP) (flecha) con DWI negativa, leve hipointensidad en ADC y retracción: PI-RADS 2. C) Nódulo hiperplásico encapsulado extruido en la ZP (flecha): PI-RADS 2 por su localización, a pesar de su morfología típica. D) Nódulo hiperplásico ectópico no encapsulado: pequeño abultamiento capsular (flecha) por un nódulo circunscrito con PI-RADS 4 en difusión, sugerente de nódulo de hiperplasia benigna de próstata que se recomendó biopsiar por su localización y características atípicas, con resultado negativo para malignidad.
La prostatitis bacteriana focal, tanto aguda como crónica, produce una elevación del PSA típicamente fluctuante en respuesta al tratamiento antibiótico. Los síntomas inflamatorios locales y sistémicos son menores en la forma crónica, que puede ser asintomática o cursar solo con un síndrome de tracto urinario inferior. Estos casos de prostatitis indolente con persistencia de PSA elevado motivan estudios de RMmp y pueden coexistir con tumor30–32,41. Las alteraciones de señal propias de la prostatitis son: hipointensidad en T2, restricción de la difusión e hipervascularidad en la ZP, todo ello de forma menos intensa y localizada en general que el CP26,36,38,48–50.
Es útil realizar la medición numérica del coeficiente ADC en una región de interés (ROI) trazada en el centro de la lesión. Aún con solapamiento, se considera como umbral 0,9mm2/s, por debajo del cual resulta sospechosa de neoplasia, mientras que la inflamación tiene por lo general valores superiores3,49–51. El hallazgo de un patrón de realce en anillo alrededor de una lesión heterogénea puede orientar en determinadas circunstancias clínicas hacia un diagnóstico de absceso36.
La prostatitis granulomatosa, poco frecuente, puede ser idiopática o rara vez secundaria a instilación intravesical de BCG en el cáncer de vejiga, tuberculosis genitourinaria o intervenciones prostáticas. Se considera la gran simuladora clínica y en la imagen del CP, ya que en ambos procesos puede encontrarse un nódulo firme en el tacto rectal y hallazgos que simulan incluso EEP tumoral, debidos a infiltración inflamatoria de la grasa periprostática. Ante la sospecha de prostatitis micobacteriana, cabe la opción de evaluar a corto plazo la respuesta al tratamiento específico, que se manifiesta por áreas de necrosis en el estudio contrastado (prostatitis necrotizante)37–39.
La atrofia focal o regional de la próstata (fig. 7 B) es una entidad frecuente, generalmente a consecuencia de inflamación crónica, isquemia, irradiación o terapia antiandrogénica. Se caracteriza por hipointensidades en T2 asociadas con adelgazamiento de la ZP y distorsión arquitectural, con márgenes más definidos y menores alteraciones de la difusión que en otros procesos, lo que permite en general su identificación39,42,52.
Nódulos hiperplásicos aislados de HBP pueden encontrarse con frecuencia en la ZP, extruidos o ectópicos según su mayor o menor conexión con la ZT. Pueden reconocerse como tales cuando son encapsulados (fig. 7 C), y reciben en este caso una puntuación de 2 incluso si son hipointensos en ACD, es decir, sin aplicarse los criterios de la ZT o ZP. A veces contienen focos internos brillantes de componente acinar. Los nódulos redondeados de borde nítido, pero no encapsulados, plantean un dilema diagnóstico en la ZP (fig. 7 D). La experiencia del observador para reconocer los rasgos de la HBP y el análisis preciso de todos los planos y secuencias, en particular las T2, resultan determinantes.
Estadificación local del cáncer de próstataLa estadificación local del CP se rige por la 8.ª edición de 2017 del sistema TNM del American Joint Comittee on Cancer (AJCC). La RM contribuye sobre todo a diferenciar entre tumor primario confinado en la glándula o extendido fuera de ella (categorías T2 y T3), pero tiene más limitaciones para valorar su extensión intraglandular (subcategorías T2), que tiende a subestimar. Ello es debido a que identifica la lesión índice o más agresiva en una elevada proporción de los casos, pero es menos sensible para la detección de otros focos de CP, que es con frecuencia multicéntrico53.
El descriptor T, en combinación con PSA sérico y grado de Gleason en la biopsia, determinan, según diferentes clasificaciones, grupos de riesgo que comparten manejo diagnóstico posterior, opciones terapéuticas y pronóstico. La categoría T3 (tumor con EEP) supone enfermedad de alto riesgo, que no excluye la terapia radical con intención curativa, aunque modifica el planteamiento e intensidad terapéuticos. En este caso, prevalece la seguridad oncológica sobre otros aspectos (preservación de bandeletas neurovasculares, linfadenectomía asociada a prostatectomía, duración de la terapia hormonal adyuvante a radioterapia, etc.) 54–57. En el estadio T4 raramente se indicará prostatectomía53.
La fiabilidad de la RM para la detección de EEP es muy variable en dependencia de factores técnicos, experiencia del lector y umbral diagnóstico que se adopte58. En general, la RMmp es más específica que sensible: en un metanálisis de 2015 demostró una especificidad del 91% para la detección de EEP59. PI-RADSv2.1 menciona en su último capítulo los signos de EEP y recomienda evaluarlos3, aunque no les asigna una gradación de probabilidad preoperatoria de EEP, como sí propuso la ESUR, basada en la relación del tumor con la superficie o “cápsula” prostática60. Sin embargo, la operatividad y consistencia de la escala ESUR ha sido cuestionada por una insuficiente definición semiológica y, en particular, por ignorar la longitud del contacto capsular del tumor, fuerte predictor de extensión según diferentes autores59,61–64.
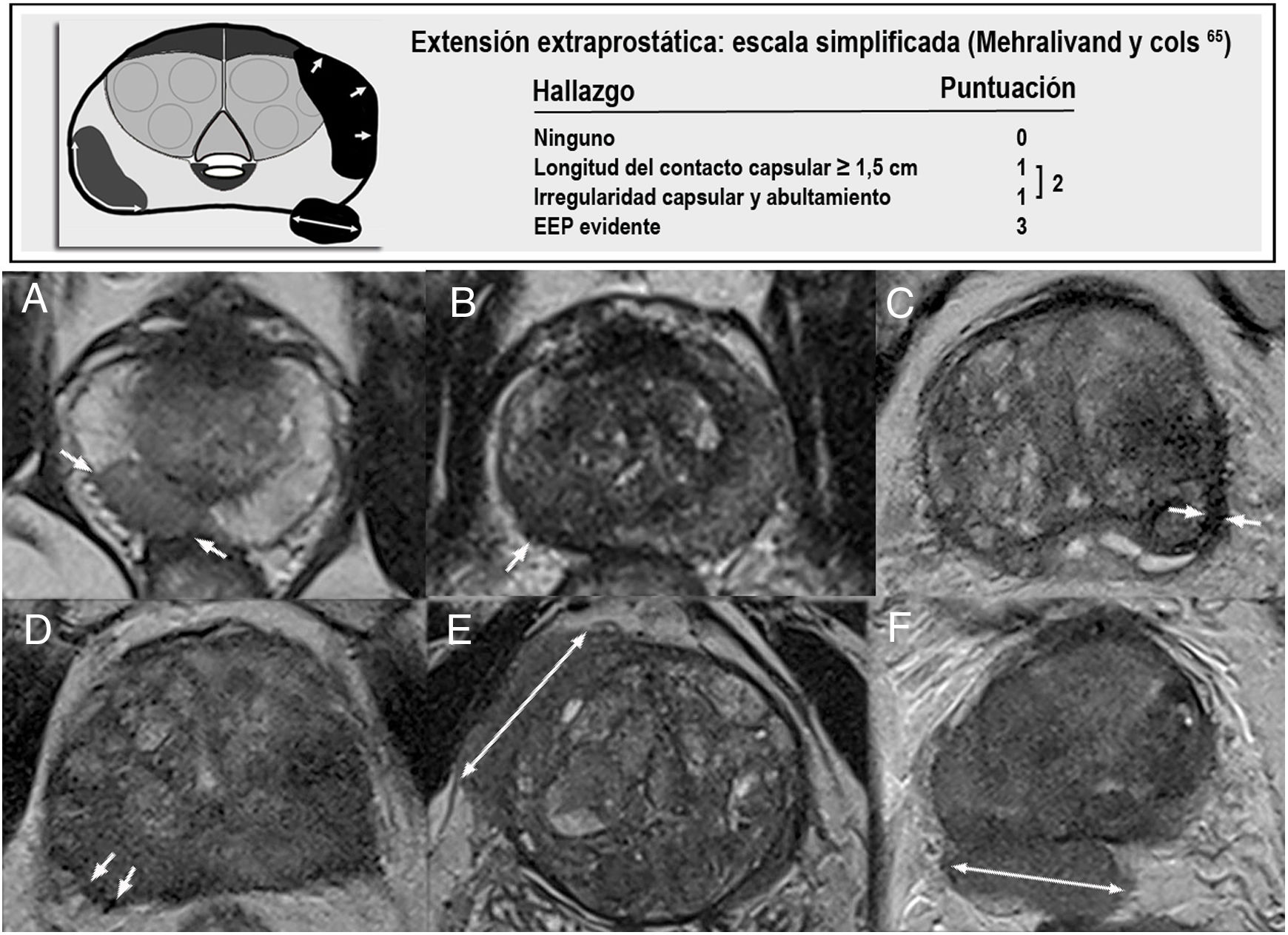
Mehralivand y colaboradores propusieron un nuevo sistema de puntuación (de 0 a 3) que reduce la subjetividad y mejora la precisión de la RM, basado en dos hallazgos: longitud del contacto capsular mayor de 1,5cm e irregularidad capsular con abultamiento. La presencia de uno de ellos puntúa como 1 y de ambos, como 2; el grado 3 corresponde a una disrupción capsular manifiesta. La asimetría de bandeletas neurovasculares y la obliteración del ángulo rectoprostático se consideran indicadores de EEP tardíos, poco sensibles y dependientes de la localización del tumor, excluyéndose de este sistema de puntuación cuya principal ventaja es su simplicidad65 (fig. 8).
Signos y gradación de probabilidad de extensión extraprostática (EEP) según Mehralivand y colaboradores65. A) Contacto capsular mayor de 1,5cm (flechas). B-D): irregularidad capsular con abultamiento. E y F) EEP evidente. Corresponderían respectivamente en la antigua escala de la European Society of Urogenital Radiology (ESUR) a: contacto capsular, irregularidad, engrosamiento, englobamiento de fascículos neurovasculares, abultamiento y EEP medible.
La invasión de las VS (T3b) (fig. 9) se manifiesta principalmente por focos de hipointensidad en T2, que conviene analizar en los tres planos para una mejor detección de asimetrías55,61,66. La DWI y el DCE son también útiles para la valoración de las VS y, en general, de la extensión del tumor primario (T), con valor añadido para la rentabilidad de la técnica respecto al T2 aislado, secuencia fundamental en la estadificación55,59,61,67.
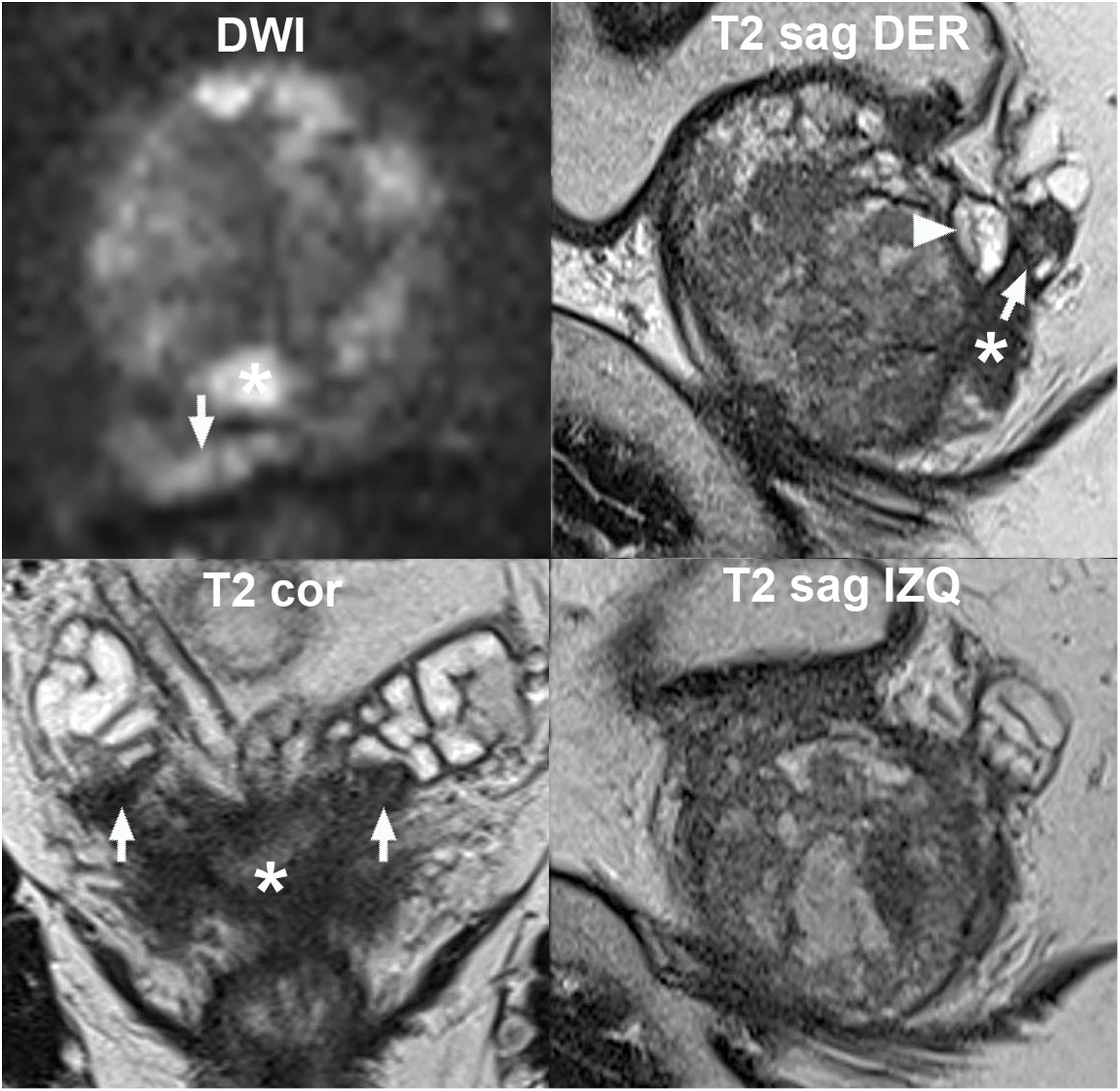
Invasión de vesículas seminales (VS) (estadio local T3b). Valor de la DWI y de imágenes multiplanares T2: tumor multifocal, con lesión índice en la zona periférica de ambos lóbulos (asterisco) que invade ambas VS (flechas), con mayor extensión en la derecha según muestra la imagen de difusión y las imágenes T2 parasagitales comparativas. Es visible también un nódulo típico de hiperplasia benigna de próstata extruido en la base de la zona periférica derecha (cabeza de flecha).
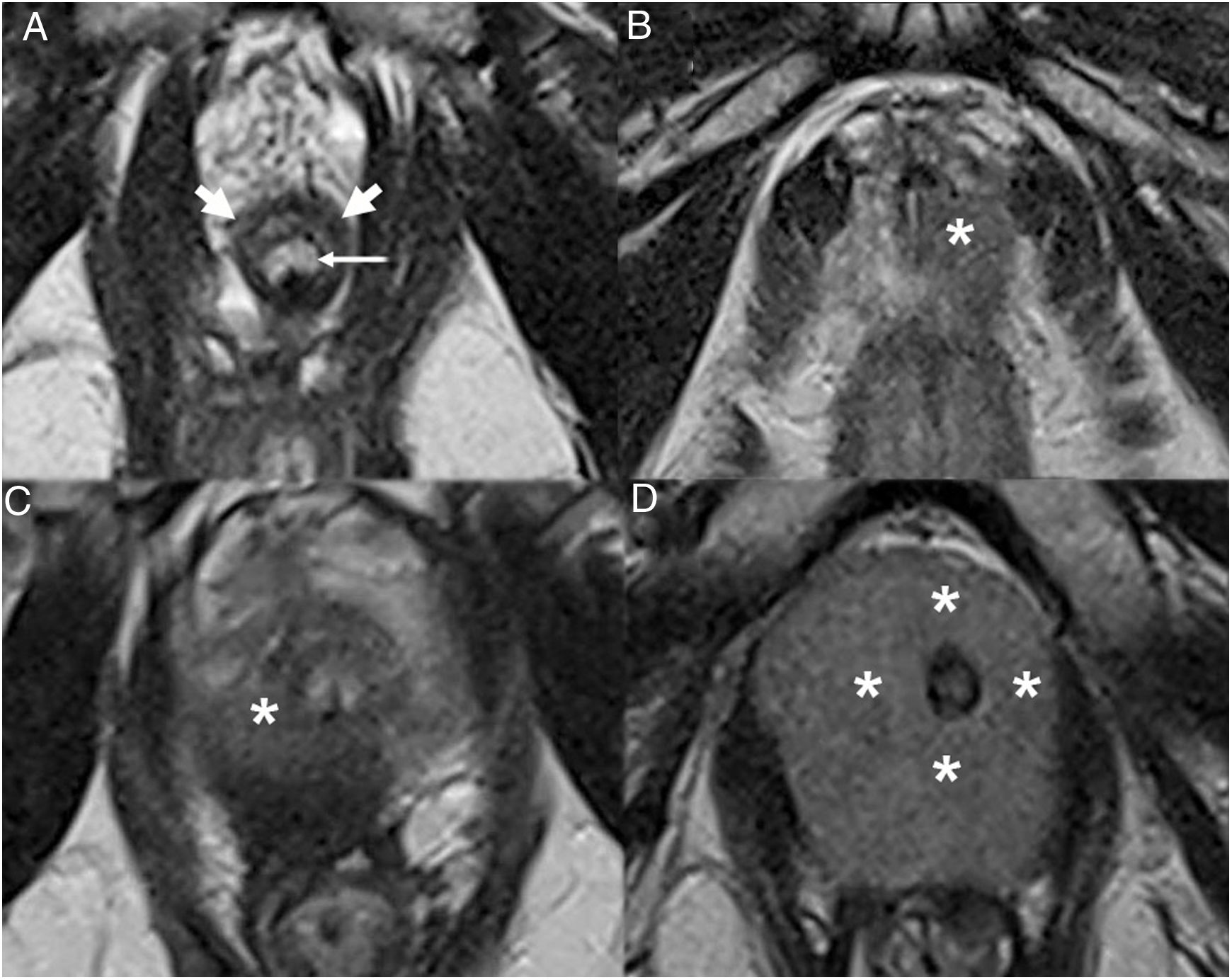
La localización de la lesión índice es un dato relevante para la estadificación. Si los tumores basales son proclives a la extensión seminal, la importancia del ápex radica en la ausencia de cápsula y su proximidad al esfínter uretral externo (EUE), cuya integridad es clave para la preservación de la continencia urinaria. El EUE aparece en T2 como una estructura semilunar hipointensa que rodea anterolateralmente la uretra membranosa. La alteración de señal del esfínter, en asociación con lesiones apicales de tipo PI- RADS 4 o 5 (fig. 10), debe alertar sobre su posible invasión que contraindica la cirugía (categoría T4)53.
Imágenes T2 axiales del esfínter uretral externo (EUE) normal y en varios casos de carcinoma de próstata. A) EUE normal (flechas gruesas) rodeando por delante la uretra membranosa (flecha delgada). B-D) Infiltración del EUE. Tumores apicales (asterisco) con diferente grado de contacto con el EUE, hallazgo decisivo para la decisión y planificación quirúrgica, aun en ausencia de claros signos de infiltración.
El estudio de difusión con FOV (field of view) ampliado a la pelvis menor es sensible para detectar ganglios pélvicos, pero inespecífico para diagnosticar su infiltración tumoral (categoría N1), que debe basarse en características morfológicas, semejantes en resonancia y tomografía computarizada: forma redondeada, eje corto mayor de 8mm, borde espiculado o hiperrealce en el DCE3. Los ganglios metastáticos no regionales (cadena iliaca común o retroperitoneales) se consideran M1a43.
Finalmente, no hay que olvidar prestar atención al resto de estructuras óseas o viscerales incluidas en el estudio para detectar posibles metástasis o neoformaciones primarias, de recto o vejiga entre otras.
Recomendaciones acerca del informeLa actual versión del PI-RADS proporciona un modelo de informe estructurado, que mostramos con pequeñas modificaciones en la tabla 3, con el fin de facilitar el manejo del paciente en función de la puntuación obtenida en la RMmp para un máximo de 4 lesiones, ordenadas por su importancia.
Modelo de informe estructurado, modificado de PI-RADS 2.13
| Justificación | |
| • PSA actual (fecha) y previo o previos | |
| • Biopsia previa: fecha, tipo (aleatoria, fusión o en imán) y resultados | |
| • Tratamientos previos | |
| Técnica | |
| • Conforme a PI-RADS | |
| • 1,5 T/ 3 T. Bobina externa de [≥16] canales con/sin bobina endorrectal | |
| • Secuencias y parámetros principales (valores b para cálculo del mapa ACD, valor b alto, resolución temporal del DCE) | |
| • DCE: dosis 0,1 mmol/kg, flujo 2,5 ml/s, concentración y volumen | |
| Hallazgos RM previas | |
| • Fecha y hallazgos (localización, tamaño, PI-RADS final) | |
| Hallazgos | |
| Volumen prostático | • DT×DAP×DL×0,52• PSAD (ng/ml2)=PSA/VP |
| Impresión general | • Calidad del estudio y preparación rectal• Hemorragia• Diferenciación zonal y configuración general de la ZT y la ZP |
| Lesión #1 (orden: categoría, tamaño) | • Localización sectorial• Tamaño• Características en sec. dominante y en otras• Categoría PI-RADS definitiva |
| Lesión #2, #3, #4 | (Ídem) |
| Estadificación local (lesión índice u otras) | • Signos de EEP presentes en la lesión índice o en otras• Relación con fascículos neurovasculares, VS y EUE |
| Estadificación regional | • Ganglios linfáticos: pélvicos, iliacos comunes, bifurcación aórtica, inguinales• Estructuras óseas pélvicas |
| Incidentales | • Otros órganos (vejiga, recto) y partes blandas |
| Conclusión | |
| • Lesiones: localización y categoría (y probabilidad de CPCS derivada) | |
| • Grado de probabilidad de EEP (bajo, intermedio, alto, muy alto) | |
| • Estadio de presunción TNM por RM: T y N | |
| • Recomendación de manejo derivada de RM | |
CPCS: cáncer de próstata clínicamente significativo; DCE: estudio dinámico con contraste; EEP: extensión extraprostática; EUE: esfínter uretral externo; PSA: antígeno prostático específico; VS: vesículas seminales; ZT: zona transicional; ZP: zona periférica.
El informe debe contener: justificación clínica, datos técnicos principales, hallazgos y conclusión. En la conclusión debe constar de forma explícita no solo la puntuación definitiva de las lesiones, sino también su significado (probabilidad de CPCS)54,68.
En el cuerpo del informe, las lesiones deben localizarse siempre en el mapa sectorial y describirse en cada una de las secuencias de imagen con la categoría global resultante, resultando opcional, según PI-RADSv2.1, reflejar también su categoría particular en cada secuencia3. Es útil incorporar al informe las imágenes clave o, al menos, identificarlas de manera permanente en el PACS.
Los hallazgos relevantes para la estadificación, o bien su ausencia, deben figurar expresamente, y en particular la longitud del contacto capsular, el abultamiento o irregularidad capsulares, y la distancia o relación de las lesiones índice con los fascículos neurovasculares, las VS y el EUE.
La estimación global de la probabilidad de EEP puede considerar una escala de cuatro grados (bajo, intermedio, alto y muy alto) que corresponderían a los niveles 0, 1, 2 y 3 de la escala simplificada65. Es recomendable, aunque no obligado antes del diagnóstico histológico, indicar el presunto estadio.
PI-RADSv.2.1 no incluye recomendaciones de manejo. Por ello es necesario, especialmente ante resultados equívocos, que la conclusión se acompañe de una recomendación que integre características de imagen y datos clínicos disponibles: edad, historial y densidad de PSA (nivel de corte> 0,15 ng/ml2), biopsias o RM previas, tacto rectal, síntomas inflamatorios, expectativas del paciente y estándares de atención69–74. Es conveniente que los casos indeterminados o con discordancia entre clínica, imagen y anatomía patológica se discutan en equipo en comités multidisciplinares.
ConclusiónLa RMmp, una técnica en permanente desarrollo, ha alcanzado un alto nivel de estandarización y uso clínico que la convierten en una herramienta de gran interés para el radiólogo. Este trabajo muestra una revisión del conjunto de recomendaciones actuales para su realización, con especial incidencia en aspectos prácticos y posibles causas de error o confusión que deben tenerse en cuenta al interpretarla. Comprender y asimilar las directrices PI-RADS es un requisito inicial que, junto a otros recursos formativos, permite mejorar la calidad de la información radiológica de la RMmp y su valor para el diagnóstico y manejo inicial del cáncer de próstata en diferentes ámbitos.
Autoría- 1.
Responsable de la integridad del estudio: RSO, JTN y GMS.
- 2.
Concepción del estudio: RSO y JTN.
- 3.
Diseño del estudio: RSO, JTN, GMS, QGO, MB.
- 4.
Obtención de los datos: No procede.
- 5.
Análisis e interpretación de los datos: No procede.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: RSO, JTN y QGO.
- 8.
Redacción del trabajo: RSO, JTN, GMS, QGO y MB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: RSO, JTN, GMS, QGO y MB.
- 10.
Aprobación de la versión final: RSO, JTN, GMS, QGO y MB.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores queremos mostrar nuestro agradecimiento a los equipos de T.E.R. y enfermería del Servicio de Radiodiagnóstico del Hospital General de Teruel, y a los Dres. E.M. Alonso-Muñoz, E. García Martínez, S.P. Alandete Germán y M.A Meseguer Ripollés.