El sistema de datos e informe en imagen prostática (Prostate Imaging and Reporting and Data System, PI-RADS) en su versión 2 fue creado con el fin de ayudar en la detección, localización y caracterización del cáncer de próstata con resonancia magnética (RM). Sus recomendaciones de estandarización de parámetros de adquisición de imágenes pretenden disminuir la variabilidad en la interpretación de los estudios de RM prostática, lo que, junto con la realización de un informe estructurado, tiene el valor añadido de mejorar la comunicación entre los radiólogos, y entre estos y los urólogos.
El objetivo de nuestro trabajo es explicar de manera sencilla el sistema de clasificación PI-RADS v2 mediante imágenes ilustrativas de cada una de las categorías, así como recomendar el uso de una técnica estándar que ayude en la reproducibilidad de los estudios de RM multiparamétrica.
ConclusiónEl documento PI-RADS v2 es sencillo de aplicar a la lectura de la RMmp de próstata. Es importante que los radiólogos dedicados a la imagen prostática lo incluyamos en la práctica diaria para realizar informes claros y concisos que mejoren la comunicación entre radiólogos y urólogos.
Version 2 of the Prostate Imaging and Reporting and Data System (PI-RADS) was developed to help in the detection, location, and characterization of prostate cancer with magnetic resonance imaging (MRI). Its recommendations for standardizing image acquisition parameters aims to reduce variability in the interpretation of MRI studies of the prostate; this approach, together with structured reporting, has the added value of improving communication among radiologists and between radiologists and urologists.
This article aims to explain the PI-RADS v2 classification in a simple way, using illustrative images for each of the categories, as well as to recommend the use of a standard technique that helps ensure the reproducibility of multiparametric MRI.
ConclusionThe PI-RADS v2 is simple to appy when reading multiparametric MRI studies of the prostate. It is important for radiologists doing prostate imaging to use the PI-RADS v2 in daily practice to write clear and concise reports that improve communication between radiologists and urologists.
El cáncer de próstata es la segunda causa de muerte por cáncer en hombres y su incidencia se doblará hacia el año 2030 por el incremento en la edad poblacional1. Debemos ofrecer a estos pacientes y a sus urólogos de referencia un diagnóstico fiable de este tipo de cáncer, con el fin de ajustar el tratamiento adecuado a cada paciente. Los cánceres clínicamente significativos (CCS) habitualmente se tratan con prostatectomía radical, radioterapia o criocirugía, siendo la vigilancia activa una alternativa para pacientes con cáncer de próstata pequeños y de bajo grado de Gleason. No hay duda de que los últimos avances en la resonancia magnética multiparamétrica (RMmp) han cambiado la forma de diagnosticar, estadificar, controlar y tratar el cáncer de próstata2–4.
Asociado al impacto clínico de la RMmp, también ha aumentado la preocupación en la comunidad radiológica por realizar unos informes radiológicos con consistencia y uniformidad. Con ese fin, la European Society of Urogenital Radiology (ESUR) estableció en 2012 un documento de consenso conocido como Prostate Imaging Reporting and Data System (PI-RADS) v1. Los avances técnicos posteriores y cambios en la práctica clínica pusieron en evidencia ciertas limitaciones, por lo que un comité formado por el American College of Radiology (ACR), ESUR y la Fundación AdMeTech actualizó dicha clasificación, lo que dio lugar al PI-RADS versión 2 (v2)5.
El documento PI-RADS v2 incluye datos clínicos y parámetros técnicos mínimos para una RMmp aceptable y reproducible, hallazgos anatómicos, guías y advertencias para el informe radiológico, imágenes que ilustran los hallazgos relevantes en resonancia magnética (RM), un diagrama para el mapeo de los resultados, plantillas de informe y un léxico de la terminología. Se puede acceder a un atlas online que sirve como método de aprendizaje y referencia con hallazgos y casos en http://www.acr.org/Quality-Safety/Resources/PIRADS.
El objetivo final del documento PI-RADS v2 es establecer una vía de comunicación eficiente con los urólogos y los pacientes, disminuyendo la variabilidad y aumentando la consistencia de nuestros informes radiológicos. El uso de un lenguaje común nos permitirá realizar estudios multicéntricos con resultados reproducibles, nos abre camino a la certificación individual o institucional, y al establecimiento de programas integrales de alta calidad en imagen prostática, lo que redundará, en definitiva, en una mejora de la atención al paciente con CP6–12.
En este artículo explicamos de forma esquemática y sencilla el documento PI-RADS v2 con imágenes que ilustran todas las categorías diagnósticas, con el objetivo de que todos los radiólogos, especialmente los dedicados a imagen prostática, lo conozcan y lo apliquen en los estudios de RMmp de próstata, paso previo para conseguir los fines anteriormente mencionados.
Preparación y parámetros técnicos de RMmp de próstata en PI-RADS v2Se recomienda esperar al menos 6 semanas tras la biopsia antes de la realización de la RMmp, para evitar los cambios de señal por hemorragia. El recto debe estar vacío de heces y aire, y se puede utilizar un fármaco antiperistáltico para minimizar los artefactos por movimiento intestinal. La antena endorrectal no es obligatoria, pero sí recomendable en los equipos de 1,5T. El Comité PI-RADS recomienda la realización del estudio en equipos de 3T5,9–12.
Es importante que la técnica de adquisición de las imágenes sea homogénea y reproducible. Recomendamos los parámetros de la tabla 1.
Técnica de adquisición de RMmp. Requerimientos básicos
| Secuencia | TR/TE | Resolución (mm) | FOV (mm) | Sección de corte (mm) |
|---|---|---|---|---|
| T2 (TSE/FSE/RARE) axial, sagital, coronal | > 3000/120 ms | ≤0,7 (fase)×≤ 0,4 (frecuencia) | 120-200 a | 3 (gap: 0) |
| DW SG EP axial | > 3000/90 ms | ≤ 2,5mm (fase y frecuencia) | 160-220 | 3 (gap: 0) |
| SDC 3D SG EGR T1 | < 100 ms/<5ms | ≤2mm (fase y frecuencia) | 120-200 a | 3 (gap: 0) |
| TSE T1 | 497/8 ms | 1,25 (fase)×1,30 (frecuencia) | 160 | 3 |
Incluir la glándula prostática y vesículas seminales.
El plano de la imagen, ángulo, localización y grosor de corte deben ser similares en todas las secuencias (T2, DW y SDC).
FSE: fast espin eco, RARE: rapid acquisition with relaxation enhancement; TSE: turbo espin eco.
DW: secuencia ecoplanar con saturación grasa (SG EP), respiración libre.
Secuencia dinámica con contraste (SDC): secuencia tridimensional (3D), saturación grasa (SG), eco de gradiente (EGR) T1. Resolución temporal 10 s (preferible≤7 s). Contraste intravenoso: Gd a 2-3ml/s.
Secuencia T1 de toda la pelvis en estudios de estadificación. Debe incluir la glándula prostática hasta la bifurcación aórtica.
GAP: distancia entre cortes; TE: tiempo de eco; TR: tiempo de repetición.
El PI-RADS v2 persigue el objetivo de detectar CCS, es decir, tumores de 5 cc o más, con un Gleason ≥ 7 (3 + 4) y/o con extensión extracapsular. Para ello, la RMmp debe constar de las siguientes secuencias:
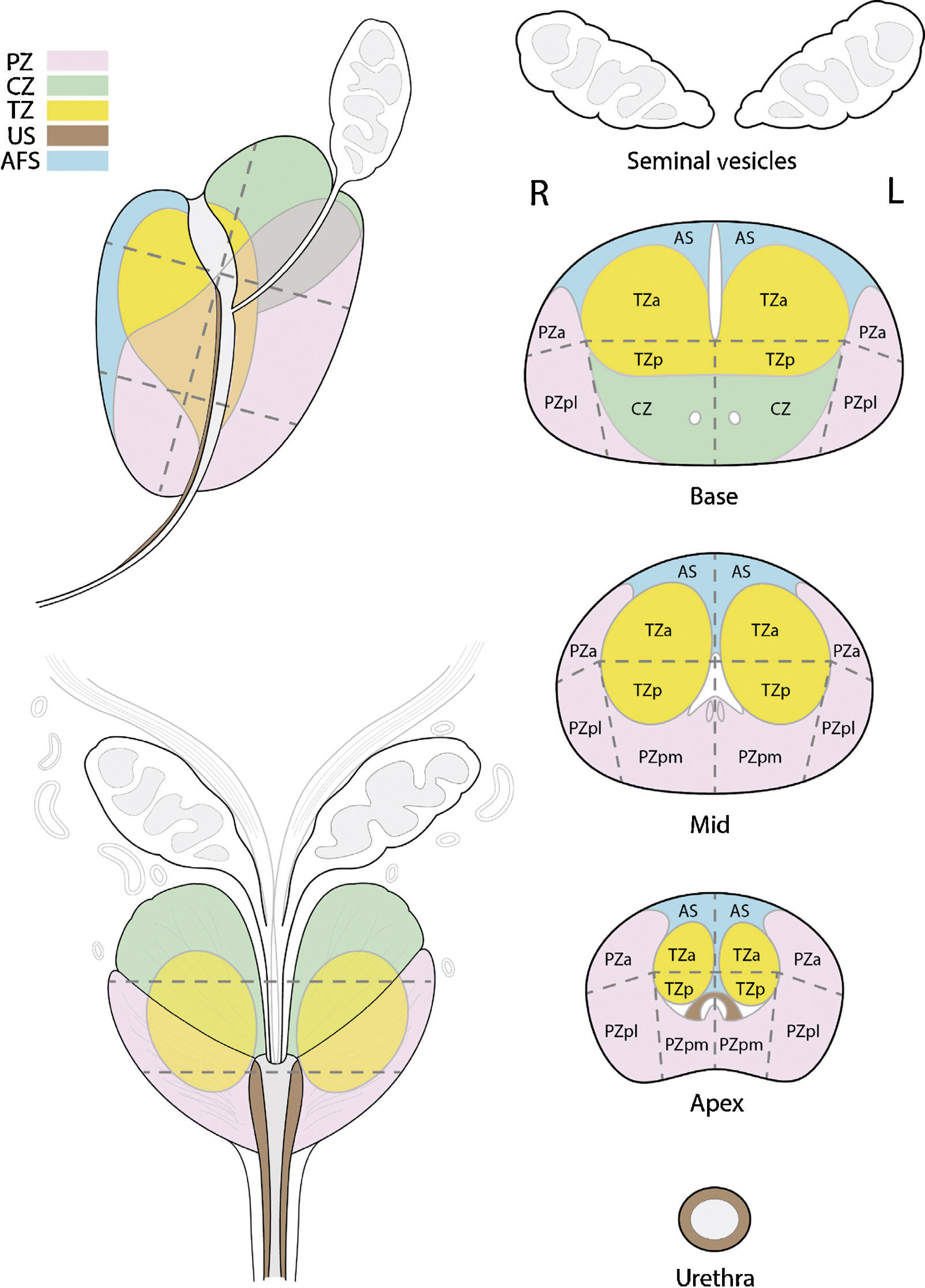
Secuencias T2Son las secuencias anatómicas fundamentales dado que permiten valorar la anatomía zonal glandular. El campo de exploración (FOV, field of view) debe incluir la glándula prostática y las vesículas seminales5,9–12.
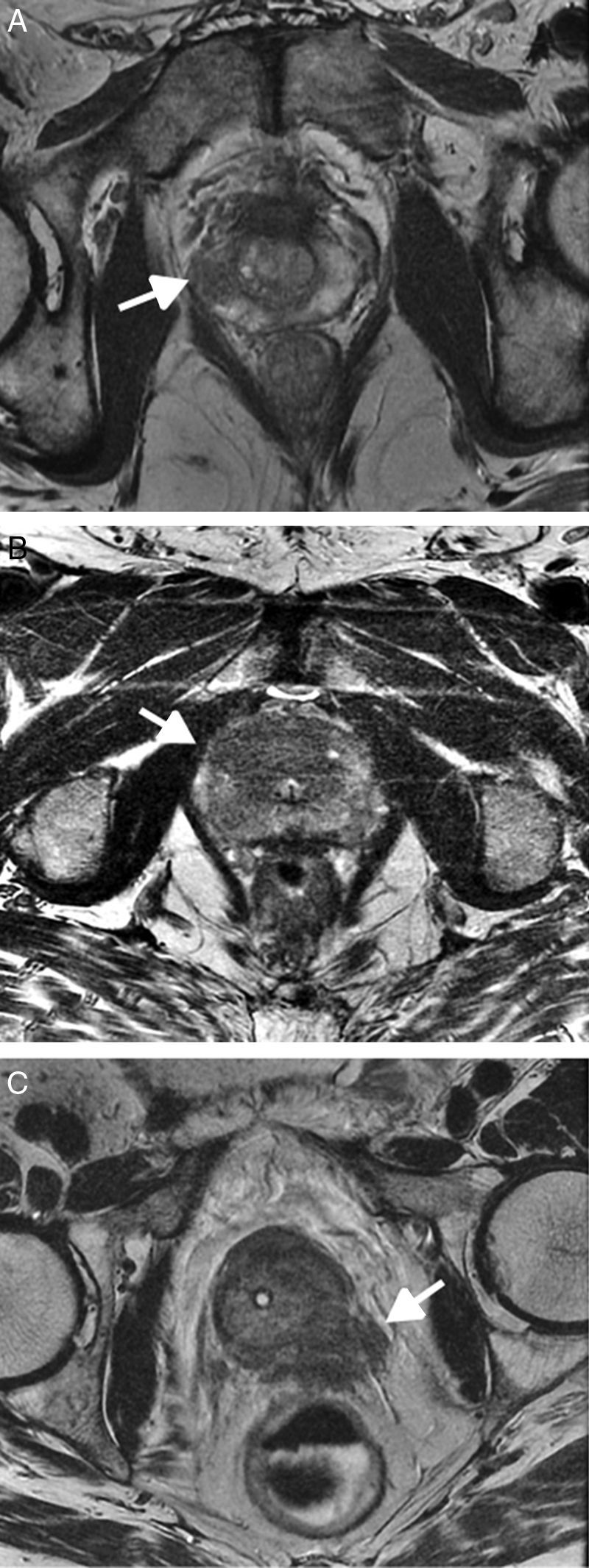
El CCS de la zona periférica (ZP) se manifiesta en T2 como focos de hiposeñal que contrastan con la hiperseñal característica de la anatomía zonal, apariencia que puede darse también en zonas de hemorragia posbiopsia, focos de prostatitis o hiperplasia, o tras tratamiento hormonal o con radioterapia (fig. 1A).
A) Secuencia T2 donde se muestra un foco de hiposeñal (flecha) en la zona periférica (ZP) derecha de la próstata media-apical correspondiente a tumor. B) Secuencia T2 donde se muestra un foco de hiposeñal y bordes mal definidos, localizado en la zona de transición anterior de la próstata apical (flecha) correspondiente a tumor con extensión a la cara anterior de la uretra. C) Secuencia T2 con presencia de tumoración hipointensa en ZP de la próstata apical izquierda con clara extensión extracapsular (flecha).
La zona de transición (ZT) presenta una apariencia habitualmente compleja, combinando focos glandulares de hiperseñal con nódulos hipointensos estromales en función del grado de hipertrofia benigna prostática (HBP). El cáncer se manifiesta en forma de áreas lenticulares de hiposeñal, de bordes mal definidos, con apariencia de “borrón de carboncillo”, focos de espiculación y/o solución de continuidad de la cápsula quirúrgica, invasión del esfínter uretral o del estroma fibroglandular anterior, por lo que la probabilidad de corresponder a un CCS es mayor cuantas más características de las citadas tenga la lesión (fig. 1B)13.
También consideramos extensión extracapsular en T2 cuando el tumor se extiende más allá de los límites de la glándula, a los haces neurovasculares, ángulo rectoprostático, vesículas seminales o estructuras vecinas (fig. 1C).
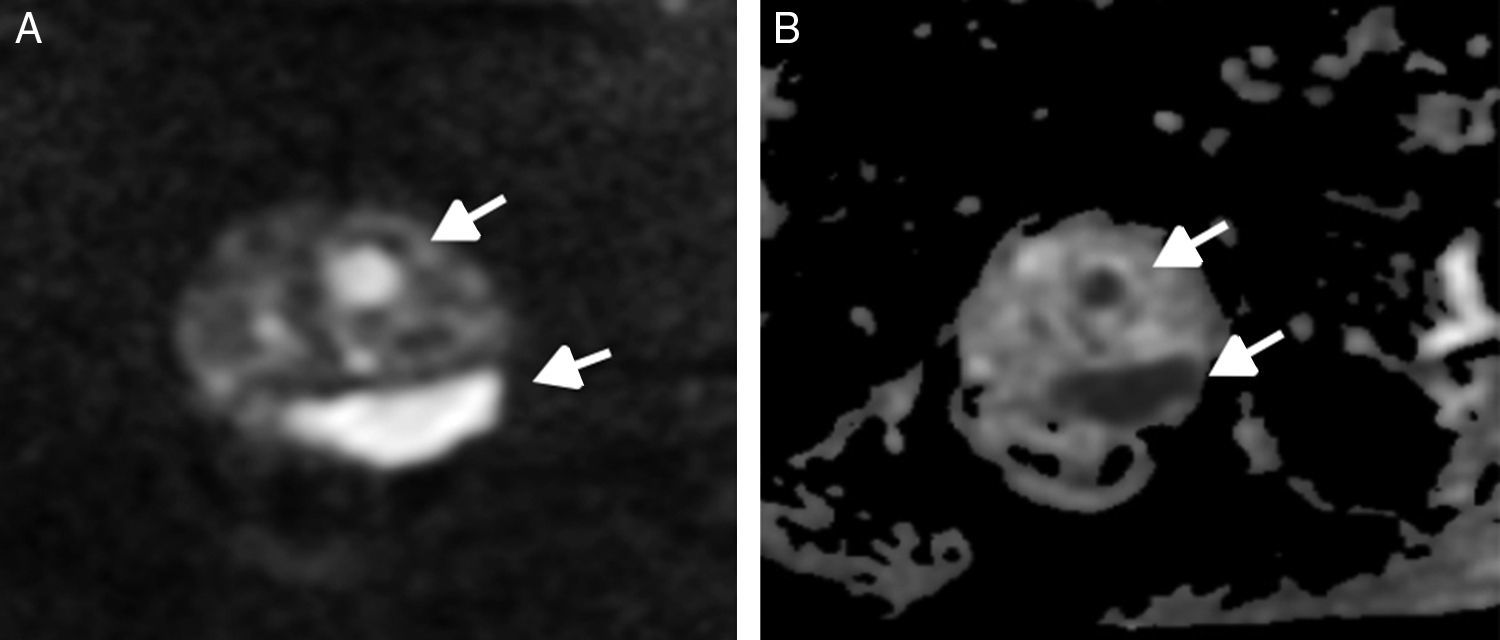
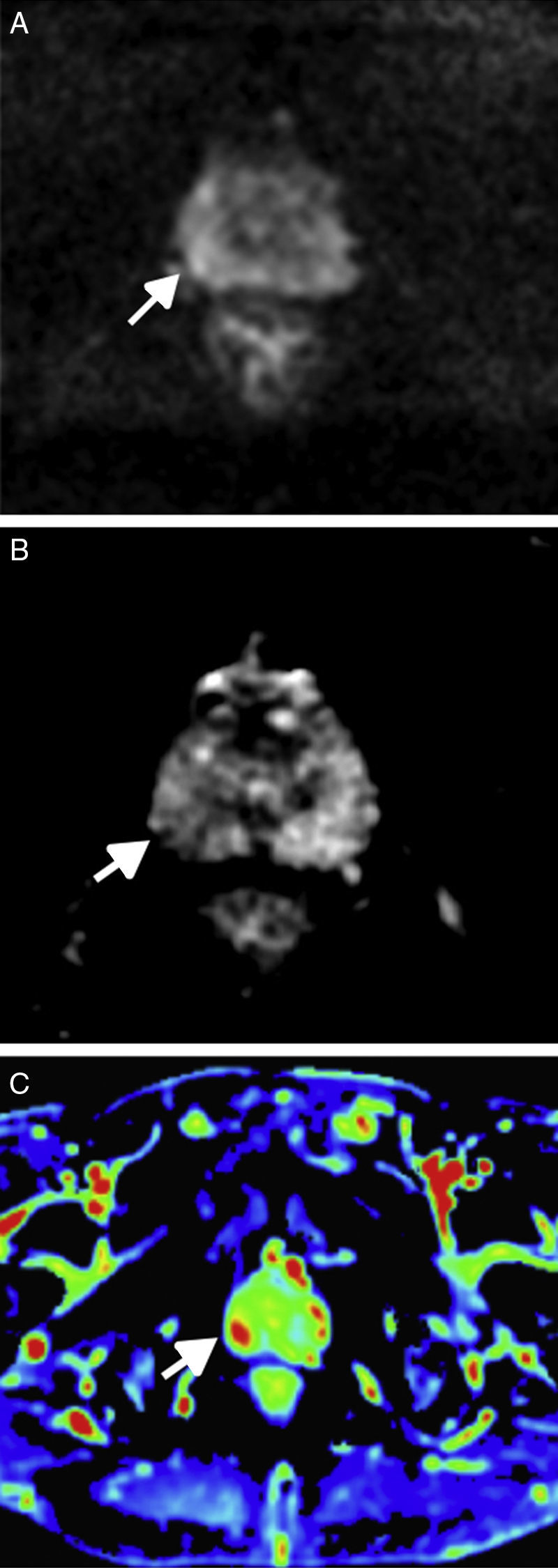
Secuencia de difusiónLa valoración cualitativa de la secuencia de difusión (DW) es clave para detectar cáncer de próstata, presentando los CCS restricción en la imagen en difusión y manifestándose como focos de hiposeñal en el mapa ADC (fig. 2 A y B). Deben utilizarse al menos 2 valores b, b ≤ 1000 s/mm2 para calcular el coeficiente de difusión aparente (ADC) con modelo monoexponencial, y b alto>1400 (preferiblemente 1500-2000 s/mm2, mediante adquisición directa o extrapolación) para detectar CCS.
La valoración cuantitativa del ADC no forma parte del sistema PI-RADS V2, aunque es recomendable su realización, ya que es conocida la relación inversamente proporcional entre los valores de ADC de la lesión y su grado de Gleason. De forma práctica, y a tenor de diferentes estudios previos, podemos tomar como punto de corte los valores de 750-900×10_3 s/mm2, correspondiendo a alta probabilidad de CCS lesiones con un ADC inferior14–17.
Los hallazgos en DW deben correlacionarse con el resto de secuencias, y es, además, importante establecer un mismo nivel de ventana y la misma codificación de colores en los mapas ADC, compartidos por el mismo grupo de trabajo en la valoración de la secuencia.
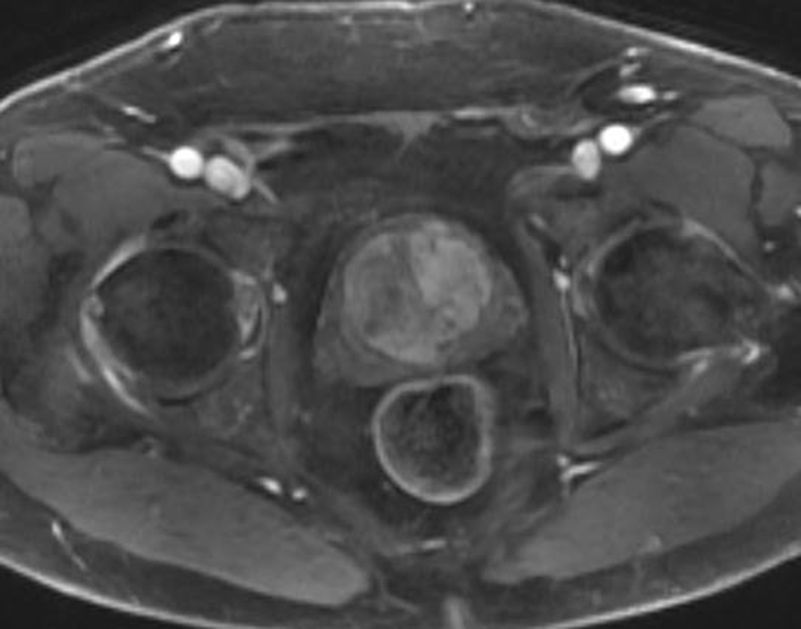
Secuencia dinámica con contraste intravenoso (SDC)PI-RADS v2 recomienda una secuencia dinámica con contraste intravenoso (CIV). No habiendo suficiente evidencia científica como para recomendar el análisis farmacocinético rutinario, se recomienda solo el análisis cualitativo de las imágenes. La utilidad de esta secuencia es limitada y no es determinante en la asignación de categorías, salvo en lesiones indeterminadas. Asimismo, puede aportar información añadida en algunos tumores pequeños, en tumores difusos o ante secuencia DW limitada por la presencia de prótesis u otros artefactos)6–12.
Debemos tener en cuenta los falsos positivos en casos de prostatitis o los nódulos hiperplásicos de la zona de transición que captan CIV (fig. 3), así como los falsos negativos en caso de tumores hipovasculares localizados en la zona fibromuscular anterior.
En los estudios de estadificación se debe añadir una secuencia T1 con FOV amplio incluyendo la pelvis, para valorar posibles focos hemorrágicos posbiopsia y la existencia de metástasis ganglionares u óseas pélvicas9–12.
Valoración del PI-RADS v2PI-RADS v2 se basa en una escala de probabilidad de 5 puntos con el objetivo de detectar CCS. Las categorías de probabilidad son:
- •
PI-RADS 1: muy baja probabilidad de CCS.
- •
PI-RADS 2: baja probabilidad de CCS.
- •
PI-RADS 3: probabilidad intermedia de CCS.
- •
PI-RADS 4: alta probabilidad de CCS.
- •
PI-RADS 5: muy alta probabilidad de CCS.
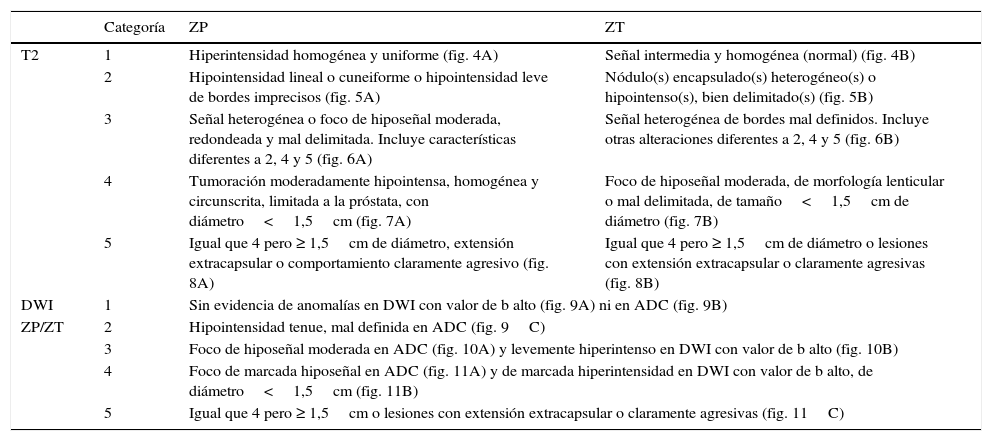
Esta escala solo tiene en cuenta la información de la secuencia T2 (escala de 5 puntos), de la secuencia DW (escala de 5 puntos), y en algunos casos, de la SDC (escala binaria). Véase tabla 2 y figuras 4–11.
Valoración de hallazgos en RMmp según PI-RADS v2
| Categoría | ZP | ZT | |
|---|---|---|---|
| T2 | 1 | Hiperintensidad homogénea y uniforme (fig. 4A) | Señal intermedia y homogénea (normal) (fig. 4B) |
| 2 | Hipointensidad lineal o cuneiforme o hipointensidad leve de bordes imprecisos (fig. 5A) | Nódulo(s) encapsulado(s) heterogéneo(s) o hipointenso(s), bien delimitado(s) (fig. 5B) | |
| 3 | Señal heterogénea o foco de hiposeñal moderada, redondeada y mal delimitada. Incluye características diferentes a 2, 4 y 5 (fig. 6A) | Señal heterogénea de bordes mal definidos. Incluye otras alteraciones diferentes a 2, 4 y 5 (fig. 6B) | |
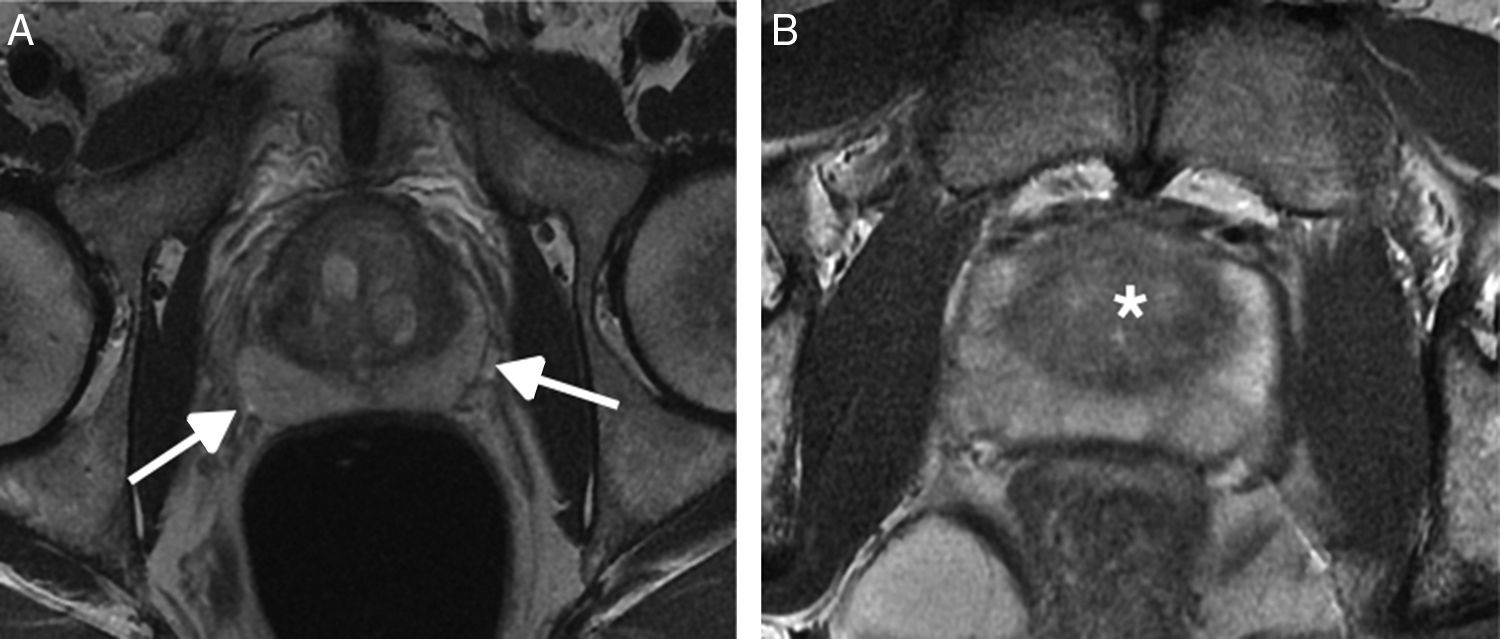
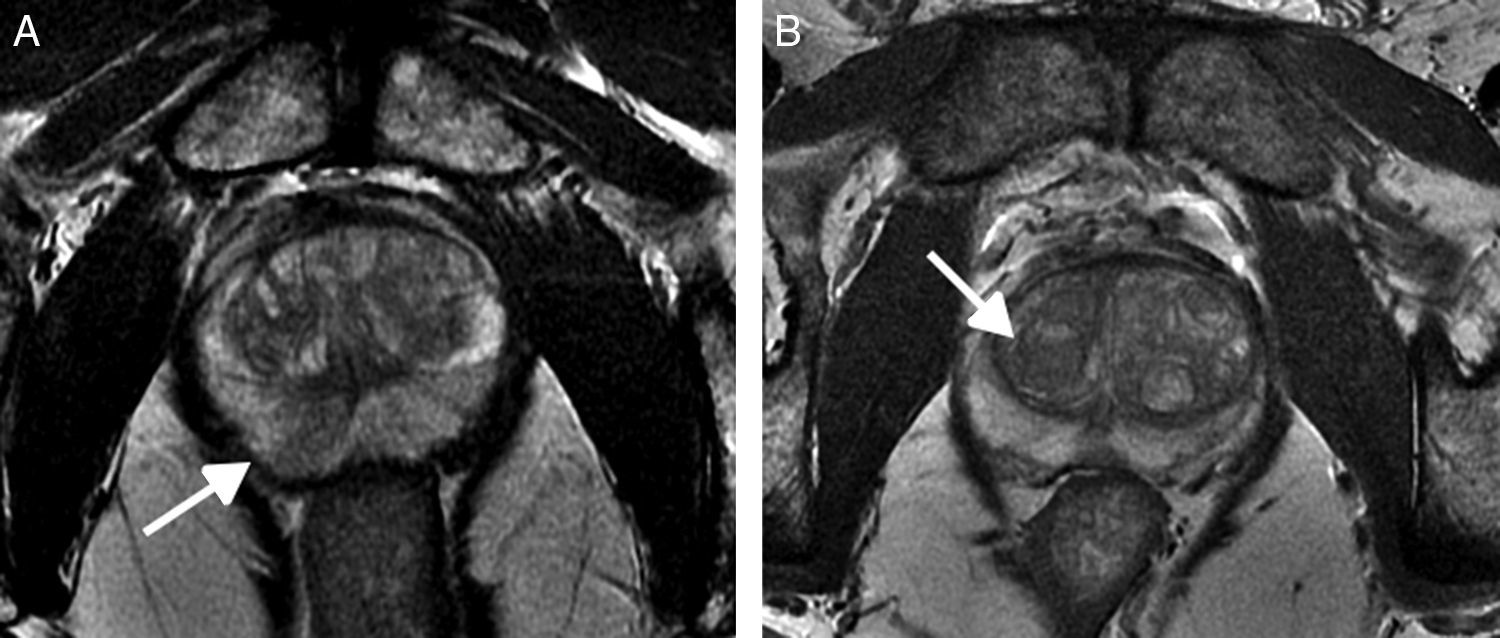
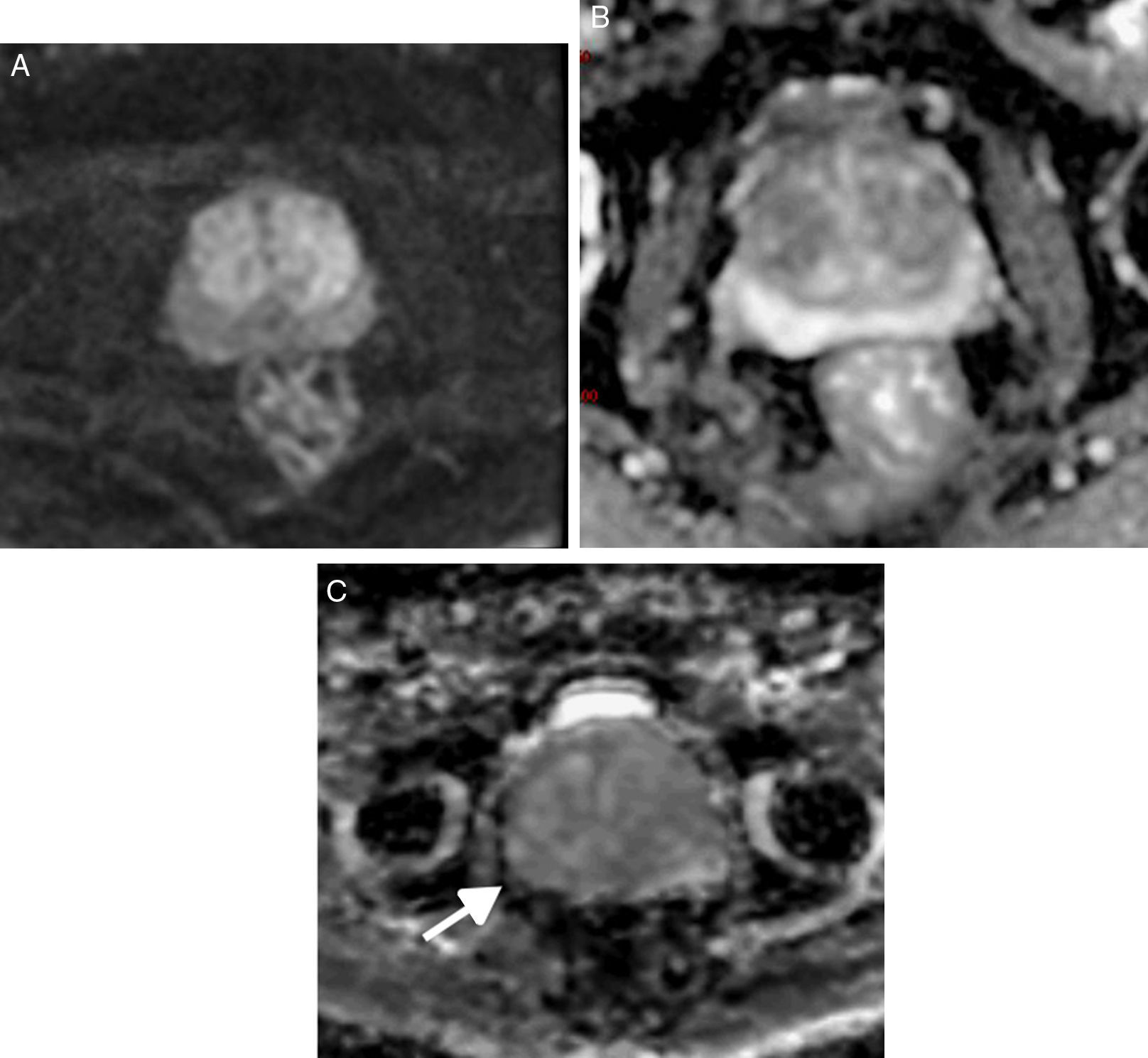
| 4 | Tumoración moderadamente hipointensa, homogénea y circunscrita, limitada a la próstata, con diámetro<1,5cm (fig. 7A) | Foco de hiposeñal moderada, de morfología lenticular o mal delimitada, de tamaño<1,5cm de diámetro (fig. 7B) | |
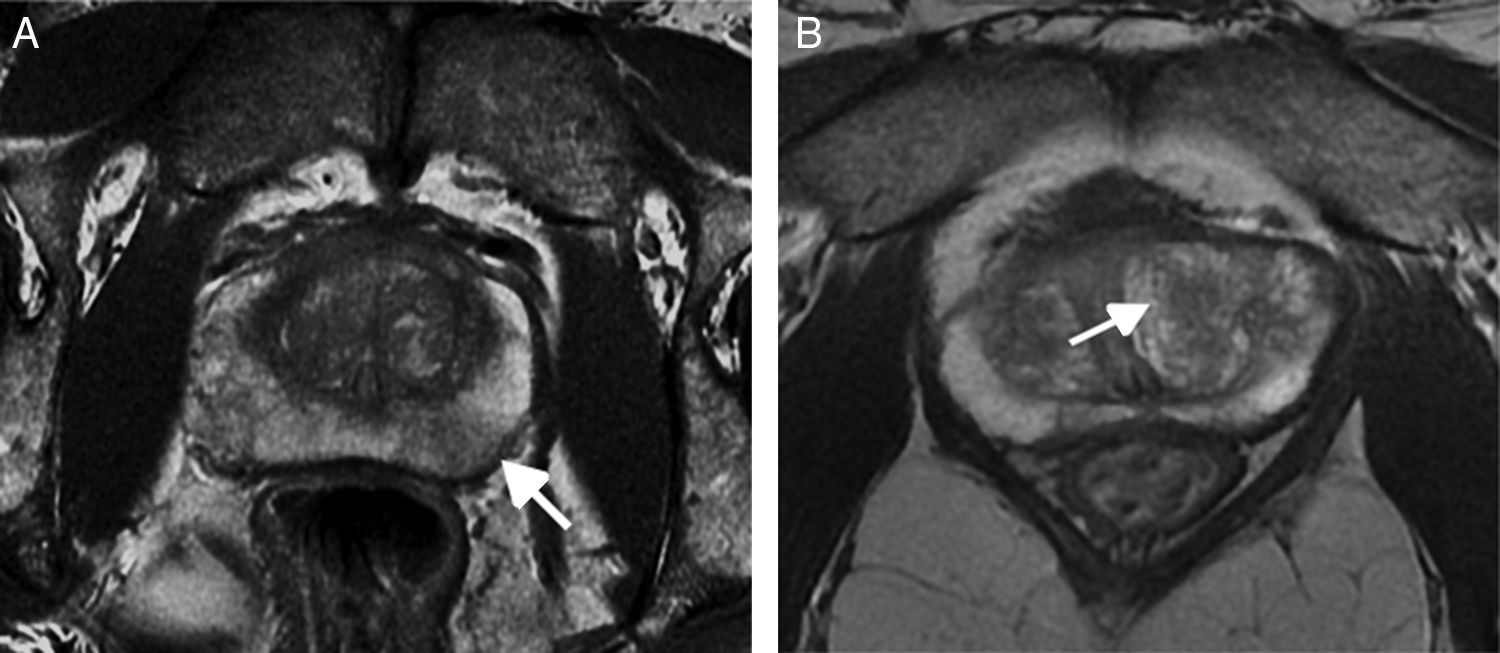
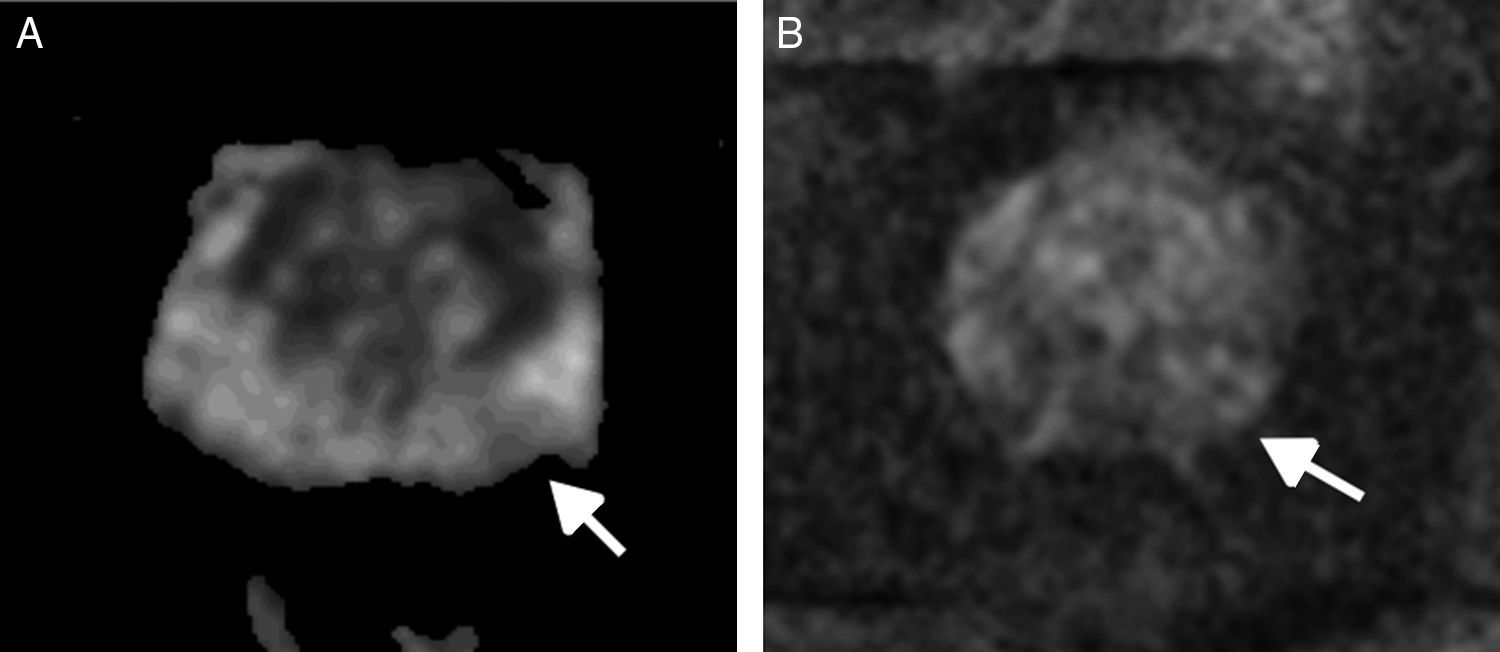
| 5 | Igual que 4 pero ≥ 1,5cm de diámetro, extensión extracapsular o comportamiento claramente agresivo (fig. 8A) | Igual que 4 pero ≥ 1,5cm de diámetro o lesiones con extensión extracapsular o claramente agresivas (fig. 8B) | |
| DWI | 1 | Sin evidencia de anomalías en DWI con valor de b alto (fig. 9A) ni en ADC (fig. 9B) | |
| ZP/ZT | 2 | Hipointensidad tenue, mal definida en ADC (fig. 9C) | |
| 3 | Foco de hiposeñal moderada en ADC (fig. 10A) y levemente hiperintenso en DWI con valor de b alto (fig. 10B) | ||
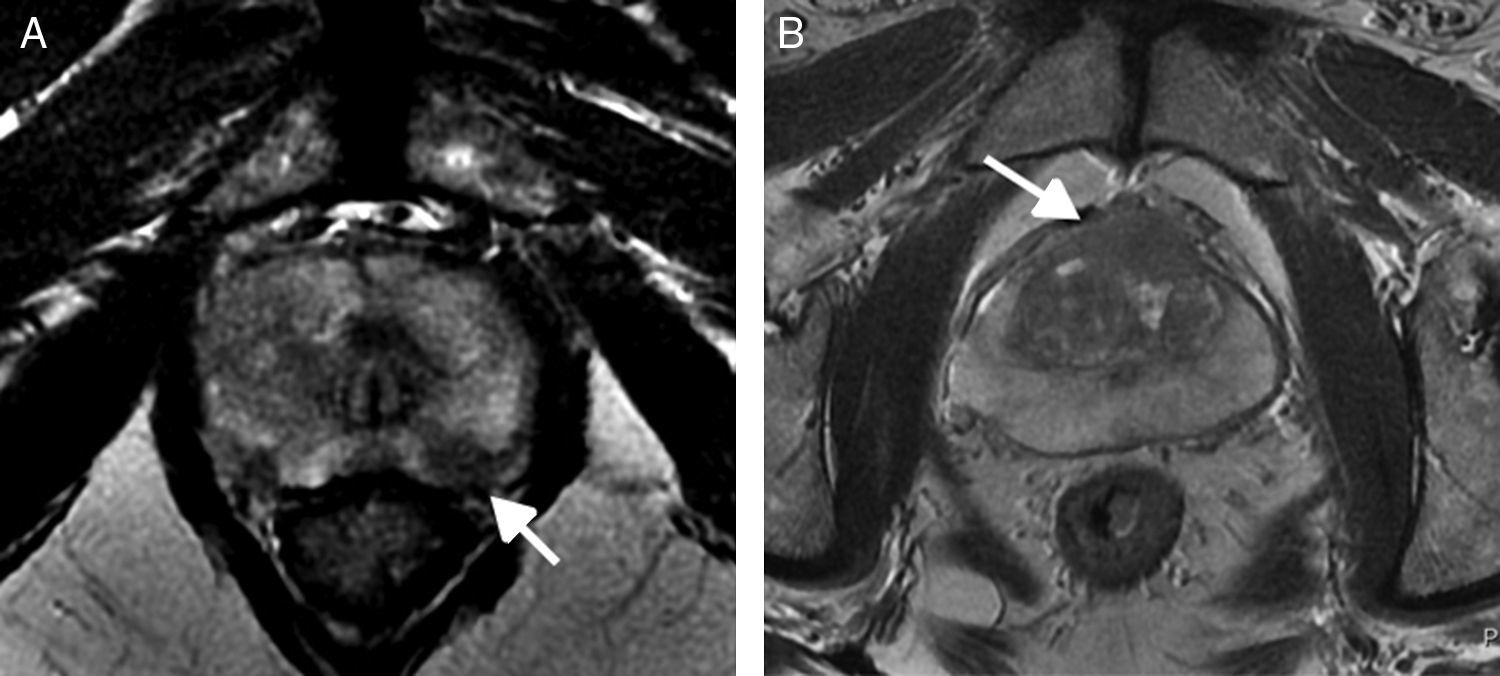
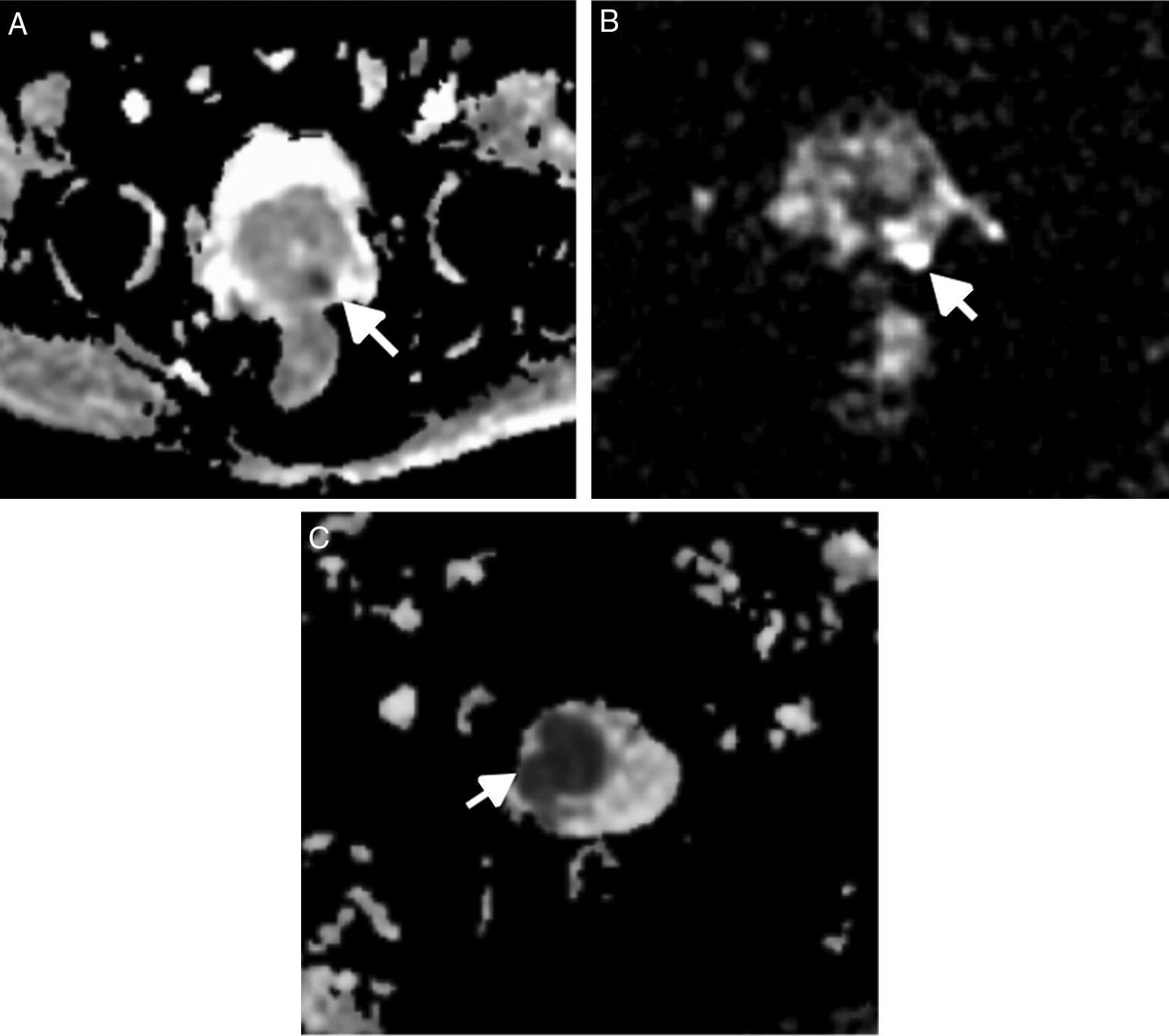
| 4 | Foco de marcada hiposeñal en ADC (fig. 11A) y de marcada hiperintensidad en DWI con valor de b alto, de diámetro<1,5cm (fig. 11B) | ||
| 5 | Igual que 4 pero ≥ 1,5cm o lesiones con extensión extracapsular o claramente agresivas (fig. 11C) | ||
ADC: siglas en inglés de coeficiente de difusión aparente; DWI: secuencia de difusión; T2: secuencia T2; ZP: zona periférica de la próstata; ZT: zona de transición de la próstata.
A) Secuencia T2. ZP. PI-RADS 4. Lesión nodular moderadamente hipointensa, homogénea y circunscrita, limitada a la próstata, con diámetro<1,5cm (flecha). B) Secuencia T2. ZT. PI-RADS 4. Foco de hiposeñal<1,5cm de diámetro en la vertiente anterior de la zona transicional, de morfología lenticular y contornos mal definidos (flecha).
A) Secuencia T2. ZP. PI-RADS 5. Foco de clara hiposeñal con retracción capsular y márgenes mal definidos en la zona periférica apical del lóbulo izquierdo (flecha). B) Secuencia T2. ZT. PI-RADS 5. Foco de hiposeñal>1,5cm localizado en la zona de transición de la próstata basal del lóbulo derecho (flecha).
Secuencia DW. PI-RADS 4. Foco de marcada hiposeñal en ADC (flecha) (A) y de marcada hiperintensidad en DWI con valor de b alto (flecha) (B), de diámetro< 1,5cm. PI-RADS 5. Mapa ADC (C). Lesión claramente agresiva centrada en zona de transición con extensión a zona periférica (flecha).
No se tienen en cuenta en PI-RADS v2 la espectroscopia ni otras variables como el antígeno prostático específico (PSA) o el tacto rectal. Asimismo, no es una escala sumatoria, sino una valoración de la dominancia de cada parámetro; así, en la ZP domina la DW y en la ZT domina el T2, es decir, los hallazgos en DW clasifican por sí solos las lesiones en ZP, mientras que los hallazgos en T2 lo hacen en ZT.
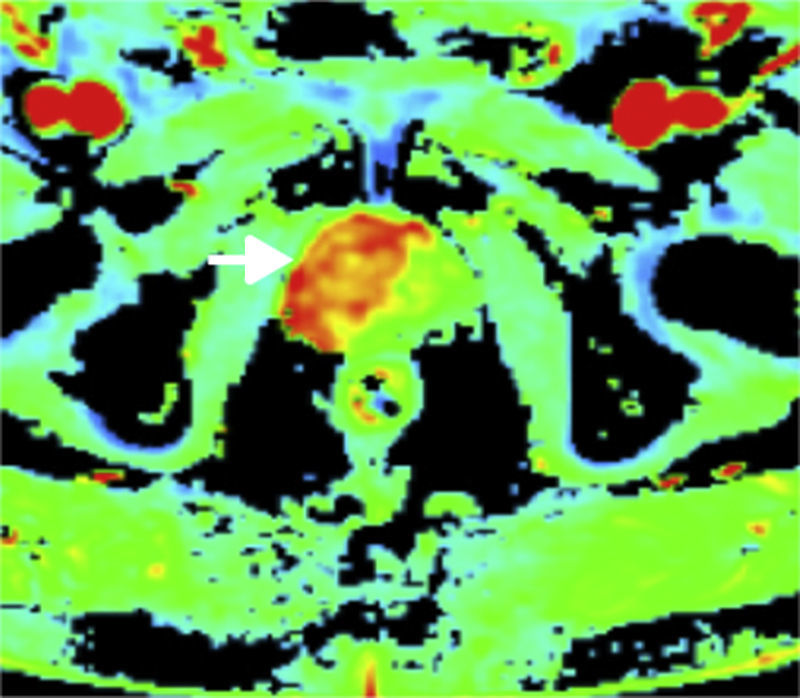
El estudio dinámico con contraste (SDC) se valora en escala binaria:
- a)
Realce negativo (-): la lesión no presenta realce focal precoz.
- b)
Realce positivo (+): la lesión presenta realce focal y precoz (fig. 12).
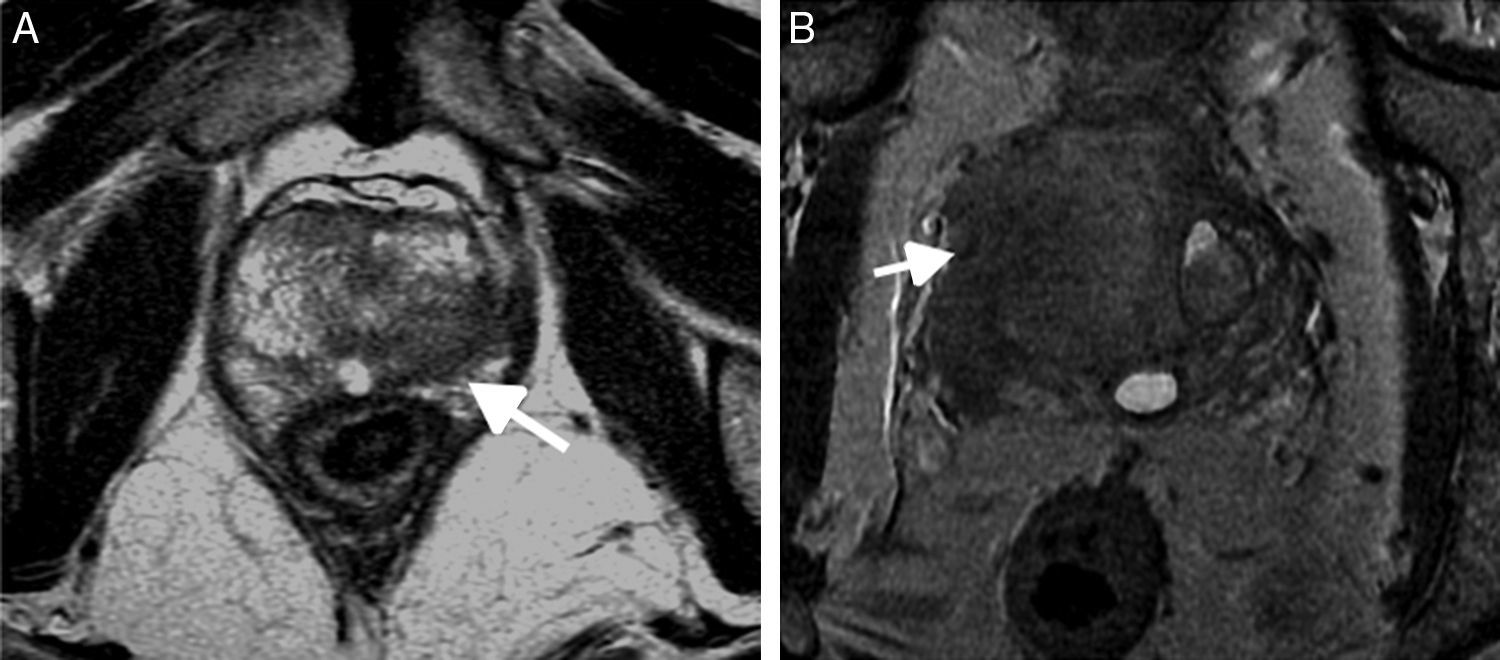
La asignación de categoría definitiva PI-RADS se basa en la valoración de cada lesión en las secuencias T2, DWI y SDC de acuerdo con la diferente anatomía zonal, teniendo en cuenta la dominancia de cada secuencia en las zonas específicas de la próstata (véase esquema PI-RADS v2). Así, la SDC añade valor solo en la valoración de la ZP cuando una lesión en la secuencia de DW presenta un valor de 3, teniendo un realce positivo el valor de reclasificar dicha lesión en la categoría PI-RADS 4 (fig. 13 A-C).
La DW también puede reclasificar una lesión en la ZT. Cuando una lesión tiene un valor en T2 de 3, un valor en DW de 5 reclasifica dicha lesión en PI-RADS 4 (fig. 14 A y B).
PI-RADS no debe aplicarse en la evaluación de la recurrencia postratamiento, en la progresión en vigilancia activa ni en la evaluación de enfermedad a distancia.
Para el manejo del paciente deben valorarse otros hallazgos como son la cinética del PSA, el tacto rectal, la historia familiar y el resultado de biopsias previas.
Elaboración de informe estructuradoPara realizar el informe estructurado, el radiólogo debe conocer ciertos datos de la historia clínica del paciente como son: nivel reciente del PSA, fecha y resultado de la biopsia, número de fragmentos de biopsia, localización de los mismos, grado de Gleason de las biopsias positivas (porcentaje de afectación del fragmento), historia familiar de cáncer de próstata, hallazgos de tacto rectal y tratamientos previos prostáticos. Todos estos datos deben reflejarse en el apartado para la historia clínica del informe radiológico.
El informe radiológico debe reflejar:
- a)
Medición del volumen prostático; por ejemplo, con la fórmula elipsoide (volumen = 0,52 × diámetro máximo anteroposterior×diámetro máximo transversal×diámetro máximo craneocaudal). El volumen se puede correlacionar con el PSA para calcular la densidad de PSA.
- b)
Todas las lesiones sospechosas (PI-RADS 3, 4 y 5) deben ser referidas en el mapa sectorial de 39 sectores (fig. 15), asignándole su categoría.
Figura 15.Mapa sectorial de la próstata: división en 39 sectores anatómicos de la próstata del adulto. Reproducido con el permiso del Colegio Americano de Radiología (ACR)5.
(0.29MB). - c)
Se debe identificar la lesión índice (mayor PI-RADS) o la lesión de mayor tamaño si hay varias con la misma categoría.
- d)
Si hay más de cuatro lesiones, se señalarán solo las cuatro con mayor PI-RADS.
- e)
Si una lesión afecta a más de un sector, todos los sectores afectados deben señalarse como parte de una sola lesión.
- f)
Se debe medir la lesión de mayor tamaño en el plano transversal. Si el diámetro mayor es en el plano sagital o coronal, se debe señalar. Las lesiones de la ZP se deben medir en el mapa ADC y las de la ZT en el T2.
- g)
Se debe identificar en el informe el número de la imagen y secuencia utilizada para la medición.
- h)
Debe sugerirse realizar biopsia en las lesiones de categoría 4 y 5, pero no en las de categoría 1 y 2. En las lesiones de categoría 3, si los datos clínicos son sugestivos, se debe recomendar también biopsia.
El documento PI-RADS v2 es sencillo de aplicar a la lectura de la RMmp de próstata. Debe extenderse su conocimiento a toda la comunidad radiológica, especialmente a los radiólogos dedicados a la RM de próstata con el fin de estandarizar la adquisición y lectura de imágenes, lo que, sin duda, repercutirá positivamente en el manejo de los pacientes con cáncer de próstata.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio. ATA y MOG.
- 2.
Concepción del estudio. ATA y MOG.
- 3.
Diseño del estudio. ATA, MOG y MSG.
- 4.
Obtención de los datos. No procede.
- 5.
Análisis e interpretación de los datos. No procede.
- 6.
Tratamiento estadístico. No procede.
- 7.
Búsqueda bibliográfica. ATA, MOG y MSG.
- 8.
Redacción del trabajo. ATA, MOG y MSG.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes. ATA y MOG.
- 10.
Aprobación de la versión final. ATA, MOG y MSG.
Los autores declaran no tener ningún conflicto de intereses.