Analizar el impacto clínico de adquirir la secuencia de susceptibilidad magnética (SWI) de forma rutinaria en los estudios de resonancia magnética (RM) cerebral.
Material y métodosSe lleva a cabo un estudio prospectivo observacional unicéntrico durante 6 meses a pacientes a los que se le realizó una RM cerebral. Los grupos de estudio se establecieron basándose en la información clínica remitida: el grupo 1 de estudio está formado por aquellos pacientes a los que el radiólogo protocolizó la adquisición de la secuencia SWI, y el grupo 2, por aquellos a los que se les realizó la secuencia SWI sin haber sido protocolizada. Se recogen la edad, sexo y factores de riesgo (hipertensión arterial, historia de traumatismo craneal o de malformaciones vasculares intracraneales). Se analizaron los hallazgos en la secuencia de SWI, si estos eran visibles en el resto de las secuencias y si su identificación suponía cambios sustanciales en el informe radiológico del paciente.
ResultadosEl grupo 1 estaba formado por 62 pacientes y el grupo 2, por 79. No hubo diferencias al comparar la edad y los factores de riesgo entre los dos grupos. En el grupo 1, los hallazgos de la SWI supusieron un cambio en el informe radiológico en el 34% de los pacientes, y en el grupo 2, en un 14%: las diferencias fueron estadísticamente significativas.
ConclusiónLa secuencia SWI puede ayudar al radiólogo a detectar hallazgos adicionales a las secuencias convencionales en la RM cerebral, que en algunos casos suponen un cambio en el informe radiológico.
To analyze the clinical impact of routine acquisition of susceptibility-weighted imaging (SWI) in magnetic resonance imaging (MRI) studies of the brain.
Material and methodsThis prospective observational study included all patients undergoing brain MRI including SWI during a 6-month period. Patients were divided into two groups based on the clinical information provided: Group 1 comprised patients in whom SWI acquisition formed part of the brain MRI protocol, and Group comprised patients who underwent SWI without these sequences being included in the protocol. We recorded patients’ age, sex, and risk factors (hypertension, history of brain trauma or intracranial vascular malformations). We analyzed the SWI findings, whether these findings were visible on the other sequences, and whether identifying these findings resulted in substantial changes to the radiological report.
ResultsThere were 62 patients in Group 1 and 79 in Group 2. The groups were similar in age and risk factors. SWI findings resulted in substantial changes to the radiological report in 34% of the patients in Group 1 and in 14% of those in Group 2; this difference was statistically significant.
ConclusionSWI can help radiologists detect findings not seen on conventional brain MRI that sometimes result in substantial changes to the radiological report.
La secuencia de susceptibilidad magnética (SWI) es una secuencia de resonancia magnética (RM) que es especialmente sensible a las inhomogeneidades del campo magnético.
Comenzó a utilizarse en los años 90, donde originalmente se llamó “VEN BOLD” o venografía de alta resolución dependiente del nivel de oxígeno en sangre, y se empleaba como una forma de visualizar las venas, es decir, de realizar una “venografía” pero sin administrar contraste gracias a los efectos paramagnéticos de la desoxihemoglobina que actúa como contraste intrínseco. En el año 2004 se renombró como secuencia de susceptibilidad magnética con las siglas SWI (susceptibility weighted imaging) porque se vio que proporciona mucha más información más allá de la venografía1,2.
Se basa en una secuencia T2*-3D eco de gradiente combinada con un TE largo que va a potenciar el efecto de la susceptibilidad y que utiliza la magnitud y el filtro de la información en fase.
Las secuencias GRE son sensibles a las diferencias de susceptibilidad de los tejidos porque no pueden refasar los spines desfasados por las heterogeneidades del campo magnético. Las secuencias clásicas T2* GRE se han utilizado tradicionalmente para detectar hierro, productos de degradación de la sangre y calcificaciones. Las secuencias modernas de SWI incorporan varias características y mejoras técnicas que las hacen superiores3,4. Generalmente son 3D, por lo que se pueden adquirir con un grosor de corte más fino y con menor tamaño de vóxel. Se utiliza una compensación de flujo en las tres direcciones del espacio para reducir los artefactos, y se adquiere en paralelo para reducir el tiempo de adquisición. Se pueden adquirir ecos simples o múltiples a un determinado tiempo de repetición (TR), pero una de las claves de esta secuencia es que la información de la fase y de la magnitud se procesan y se muestran de forma independiente o bien de forma combinada para ayudar al diagnóstico5–7.
Los parámetros típicos de la imagen incluyen un TR=25-50 ms, un TE=20-40 ms y un ángulo de inclinación=15-20°. Los datos de la magnitud y de la fase se reconstruyen de forma separada.
La imagen de la magnitud se guarda con fines diagnósticos, y se muestra como un tejido de fondo con un contraste similar a la densidad de spin.
Los datos de la fase se posprocesan para que puedan ser utilizados clínicamente. Los datos brutos de la fase muestran las heterogeneidades del campo magnético, así como las distorsiones debidas a la interfase entre el aire y el hueso de la base de cráneo. Posteriormente se hace un filtrado digital para eliminar las fluctuaciones de baja frecuencia y una serie de algoritmos de corrección local de la fase para eliminar los artefactos de la base de cráneo. El resultado es la imagen de la fase filtrada, que es la que finalmente se muestra con fines diagnósticos6–8.
En esa imagen de la fase filtrada, los productos de degradación de la sangre, es decir, las sustancias paramagnéticas, tienen una intensidad de señal opuesta a las sustancias diamagnéticas9,10. Es importante saber interpretar estas imágenes, ya que los diferentes fabricantes de aparatos de RM lo muestran de forma distinta: las sustancias paramagnéticas son blancas en Siemens® y Canon® y negras en Philips® y GE®. La máscara de la fase se crea a partir de la fase filtrada para acentuar los tejidos con diferentes susceptibilidades. La imagen de la magnitud se multiplica digitalmente por la fase de la máscara varias veces hasta obtener una mezcla adecuada. El resultado es la imagen de SWI, que contiene simultáneamente la información de la magnitud y de la fase, y es la que se utiliza con fines diagnósticos. Además, se pueden mostrar proyecciones de mínima intensidad (mIP), cuyo grosor de corte varía, para identificar mejor las lesiones hipointensas.
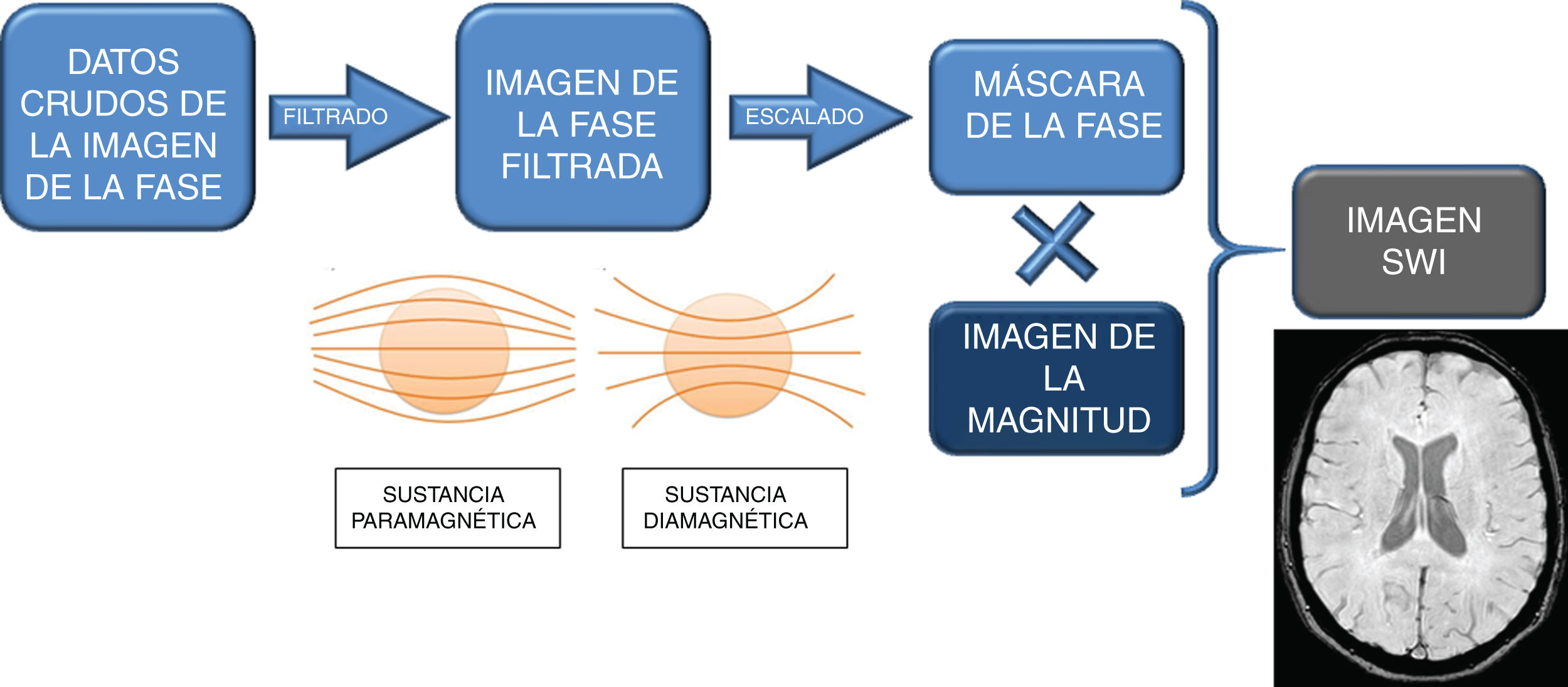
Estas bases físicas se resumen mediante un diagrama representado en la figura 1.
Esquema de las bases físicas de la secuencia de susceptibilidad magnética. En la imagen de la fase filtrada, las sustancias paramagnéticas y diamagnéticas tienen un comportamiento diferente: las paramagnéticas ocasionan una divergencia de las líneas del campo magnético y las diamagnéticas, una convergencia de estas. Esta imagen de la fase filtrada se muestra de forma diferente en equipos de RM de distintos fabricantes, y es importante saber interpretarla. A partir de ella se crea la máscara de la fase, que al multiplicarla digitalmente por la imagen de la magnitud proporciona la imagen SWI. Por tanto, la SWI contiene simultáneamente información de la magnitud y de la fase.
Esta forma de adquirirla hace que sea tan sensible a las alteraciones del campo magnético que se utiliza para explorar las diferencias de susceptibilidad magnética entre tejidos.
Esto va a permitir, por tanto, diferenciar entre sustancias paramagnéticas, como son la hemosiderina y la desoxihemoglobina (los productos de degradación de la sangre) y diamagnéticas, como las calcificaciones y los depósitos de minerales9,10, lo que supone un gran avance para las imágenes neurorradiológicas y resulta una secuencia muy útil para el diagnóstico de múltiples patologías, no solo vasculares, sino también de enfermedades neurodegenerativas, desmielinizantes, demencia, infecciones, traumatismos y tumores1.
En la literatura especializada existen múltiples estudios donde se describen sus cualidades y demuestran sus ventajas respecto a otras secuencias para el diagnóstico de las patologías descritas, y cada vez es más amplio su campo de aplicación1,6,7. Por tanto, llega un momento en el que es planteable su adquisición dentro del protocolo básico de estudio.
El objetivo de este estudio es analizar el impacto clínico que tendría la adquisición de la SWI de forma rutinaria o si, por el contrario, debe estar ligada a la sospecha diagnóstica.
Material y métodosPacientesDesde agosto del 2016 a enero del 2017 se realizó un estudio prospectivo aprobado por el comité de ética de la investigación de Galicia (Xunta de Galicia, Consellería de Sanidade), que incluía a todos los pacientes a los que se les solicita una RM cerebral realizada en un equipo de RM de 1,5T.
Se hicieron dos grupos de estudio en función de la adquisición de la secuencia SWI. El grupo 1 estaba constituido por aquellos pacientes a los cuales los neurorradiólogos (con 6 y 10 años de experiencia, respectivamente) protocolizaron la adquisición de la secuencia de SWI según la información clínica de la solicitud, los antecedentes personales y los factores de riesgo cardiovasculares. A los técnicos superiores de radiodiagnóstico, que desconocían el motivo de este estudio, se les pidió que adquirieran la secuencia SWI a pacientes a los que los neurorradiólogos no hubieran protocolizado su adquisición, formando el grupo 2 del estudio (pacientes a los que no se les habría hecho esta secuencia si no se hubiera realizado este estudio).
En todos los casos se recogieron datos de la epidemiología de los pacientes: sexo, edad, antecedentes del paciente y la información clínica remitida por el clínico. Respecto a los antecedentes personales de interés, se recogieron factores de riesgo para la presencia de restos hemáticos: hipertensión arterial, historia de traumatismo craneoencefálico e historia conocida de malformaciones vasculares intracraneales, variables que se obtuvieron realizando una búsqueda en las historias clínicas de los pacientes.
Posteriormente, se analizaron los hallazgos de la secuencia SWI y se correlacionaron con los factores de riesgo de cada sujeto y con la información clínica que se remitía de cada paciente. No se tuvieron en cuenta las calcificaciones fisiológicas que pueden aparecer en el sistema nervioso central que carecen de significado patológico, como las calcificaciones de la glándula pineal o de los plexos coroideos.
Se estudiaron las imágenes de forma independiente por un neurorradiólogo con 10 años de experiencia y un residente de tercer año y también si estos hallazgos se podían identificar en el resto de las secuencias adquiridas. Se analizó si estos hallazgos únicamente visibles en la SWI se reflejaron en el informe, y si cambiaron la conclusión del informe de forma relevante.
Protocolo de RMTodos los estudios se realizan en un aparato de resonancia Philips® Ingenia (1.5T, Philips Healthcare, Best, Holanda) utilizando una antena de cabeza de 32 canales. El protocolo básico de RM cerebral incluye una secuencia T1-3D sagital, FLAIR-3D sagital, T2 axial y difusión axial.
La secuencia SWIp se adquirió con los siguientes parámetros técnicos: FOV 230×186; tamaño de la matriz,272×220; tamaño medio del vóxel, 0,85×0,85×2 mm; TE 12 ms; TR más corto y ángulo de inclinación de 20° con SENSE, y 130 cortes con un grosor de 2 mm. El tiempo total de adquisición de esta secuencia fue de 5:08 minutos.
En todos los casos se almacenaron en el PACS (picture archiving and communication system) los mapas combinados de posprocesar la magnitud y la fase (SWIp) y los mapas de la fase filtrada donde, en el equipo utilizado, las sustancias paramagnéticas (la sangre venosa) son hipointensas mientras que las diamagnéticas (calcificaciones) son hiperintensas.
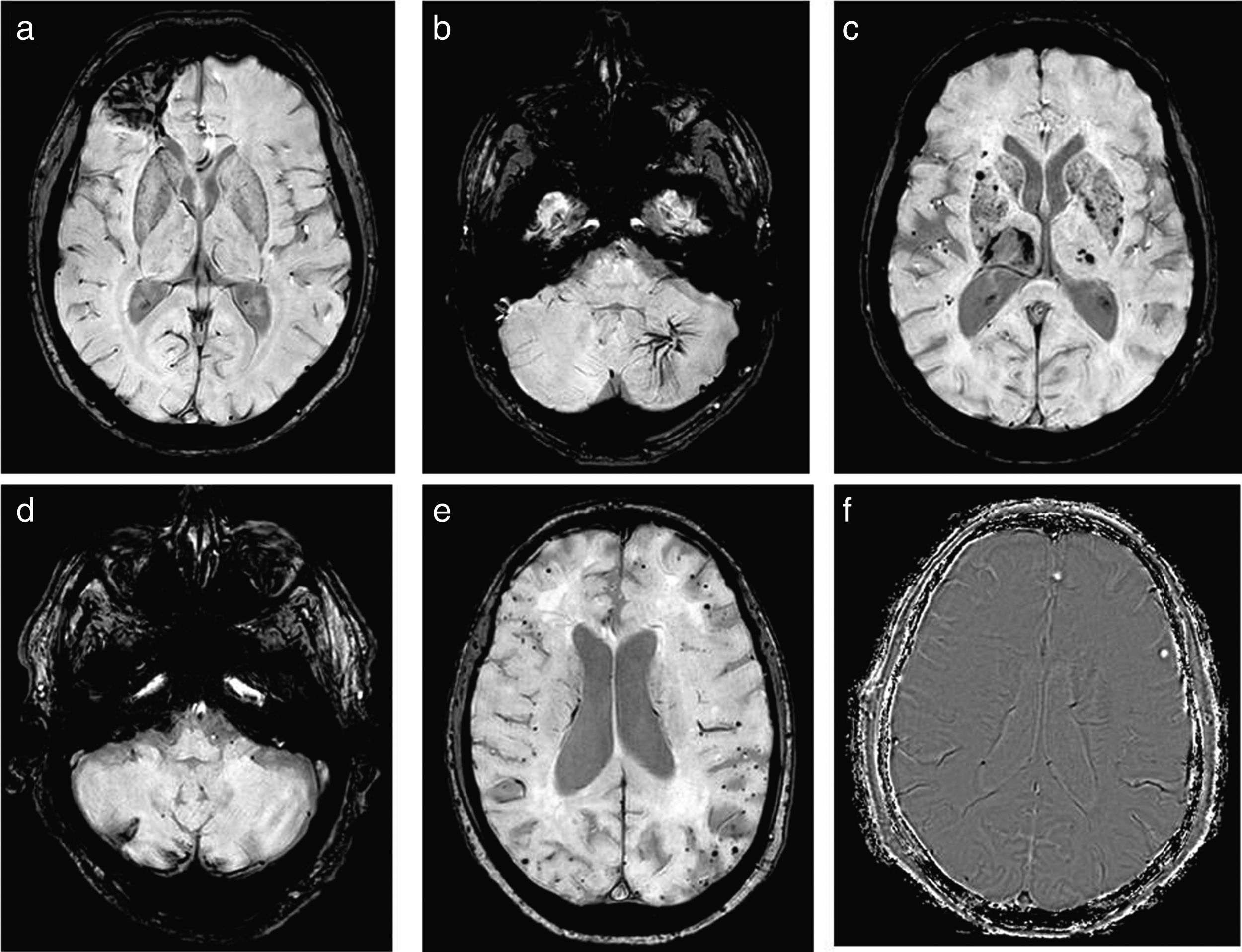
Análisis de las imágenesSe analizaron minuciosamente todas las imágenes de la secuencia SWI por dos radiólogos (un neurorradiólogo con 10 años de experiencia y un residente de 3.er año), y se registraron todos los hallazgos de esta, agrupados en los siguientes diagnósticos: focos de microhemorragia aislados inespecíficos, hemorragias tras traumatismo craneal o tras cirugía, malformaciones vasculares, focos hemorrágicos en ganglios basales sugestivos de etiología hipertensiva, infartos hemorrágicos, focos hemorrágicos en ganglios basales sugestivos de angiopatía amiloide, calcificaciones y depósitos de hierro, todos ellos resumidos en la tabla 1. Se muestran varios ejemplos en la figura 2.
Hallazgos radiológicos encontrados en la secuencia SWI
| Normales | 73 |
| Focos de microhemorragia aislados inespecíficos | 23 |
| Hemorragias tras traumatismo craneal o tras cirugía | 14 |
| Malformaciones vasculares | 13 |
| Focos hemorrágicos en ganglios basales sugestivos de etiología hipertensiva | 7 |
| Infartos hemorrágicos | 4 |
| Focos hemorrágicos en ganglios basales sugestivos de angiopatía amiloide | 4 |
| CalcificacionesDepósito de hierro | 21 |
Ejemplos de hallazgos visualizados en SWI: a) hemorragia tras TCE. b) Malformaciones vasculares; en este caso, una anomalía del desarrollo venoso del hemisferio cerebeloso izquierdo. c) Microhemorragias en ganglios basales de etiología hipertensiva. d) Infartos hemorrágicos; en este ejemplo, en el hemisferio cerebeloso derecho con hemosiderosis superficial. e) Angiopatía amiloide, que se identifica como hemorragias puntiformes periféricas. f) Calcificaciones, tipificadas gracias a la máscara donde se visualizan hiperintensas.
Posteriormente, se analizaron el resto de las secuencias de pulso adquiridas para comprobar si estos hallazgos eran identificables.
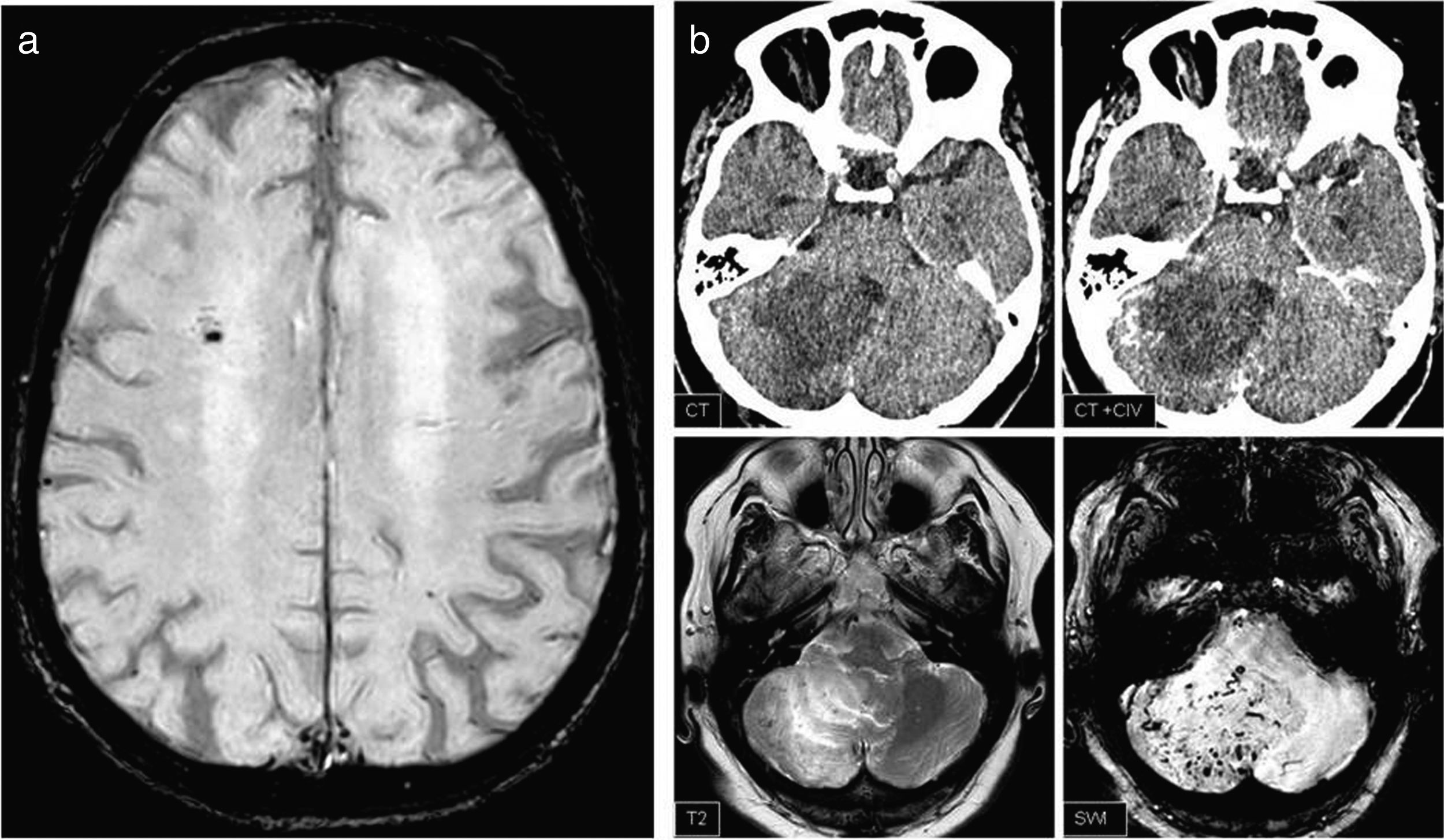
Por último, los hallazgos de la SWI se clasificaron en: a) alteraciones identificadas en la secuencia SWI que no tienen relevancia clínica (como puede ser demostrar restos hemáticos en un lecho quirúrgico) o que se identifican en el resto de las secuencias y que por tanto su visualización en SWI no supone un cambio en el informe radiológico y b) hallazgos en SWI que tienen valor patológico, que no se identifican en otras secuencias o, en el caso de que se visualicen, no serían concluyentes, que van a suponer un cambio en el informe (fig. 3).
a) Hallazgo general: microhemorragia aislada, que no cambia el informe ni el manejo del paciente. b) Hallazgo relevante: lesión hipodensa en hemisferio cerebeloso difícil de interpretar en tomografía computarizada a pesar de contraste intravenoso (CIV), que en resonancia magnética muestra vasos arrosariados en SWIp y se corresponde con una malformación arteriovenosa.
Se utilizó el programa estadístico SPSS® (Chicago, Illinois) versión 15, empleando pruebas paramétricas. Los resultados de los datos demográficos se muestran como media±desviación estándar. Para comparar los dos grupos se realizó una t de Student para muestras independientes, considerando las diferencias estadísticamente significativas cuando p<0,05.
ResultadosSe reclutaron 141 pacientes, 74 hombres y 67 mujeres, con una edad media de 59,5 años. En el grupo 1 hubo 62 pacientes y en el grupo 2, 79 pacientes.
Se documentaron aproximadamente 47 informaciones clínicas diferentes, muchas de ellas agrupables por características comunes. En la tabla 2 se recogen las informaciones clínicas que se consideraron para la programación de la SWI.
Información clínica que se consideró indicativa de programar SWI
| Déficit neurológico focal transitorio (ataque isquémico transitorio) | Hemiparesia (1), afasia (1), lateropulsión (1) y parestesias (1) |
|---|---|
| Infartos isquémicos agudos (17) | |
| TCE (6) | |
| Lesiones vasculares | Aneurisma (9), MAV (2), cavernomas (3), hemorragias y microsangrados (6), HSA (5), anomalías de desarrollo venoso (1) y trombosis de seno (1) |
| Enfermedades metabólicas | Sospecha enfermedad de Wilson (1) |
| Lesiones dudosas en TC | Sospecha de cavernoma: fue normal (1)Lesiones en protuberancia: fueron infartos isquémicos (1) |
| Trastornos del movimiento | Parkinson (2) y temblor sin cumplir criterios de Parkinson (3) |
HSA: hemorragia subaracnoidea; MAV: malformación arteriovenosa.
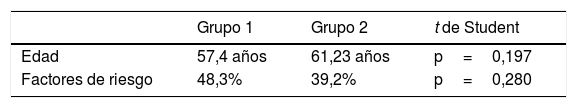
No se encontraron diferencias estadísticamente significativas al comparar la edad y los factores de riesgo entre los dos grupos (tabla 3).
La secuencia SWI fue completamente normal en 73 y no demostró ninguna alteración de señal: 28 (45%) en el grupo 1 y 46 (58%) en el grupo 2.
Los que si presentaban hallazgos en SWI (2) fueron sustancias diamagnéticas: en un paciente se trataba de calcificaciones parenquimatosas (corroboradas en una tomografía computarizada [TC] previa), secuelas de una tuberculosis remota, y otra en la hoz cerebral, que correspondía a una osificación de esta. El resto eran sustancias paramagnéticas o ferromagnéticas: uno de ellos presentaba depósitos de hierro en los ganglios basales y el resto eran productos de degradación de la sangre.
Se identificaron focos puntiformes hipointensos aislados en 23 SWI, 10 de los cuales pertenecían al grupo 1 y 13 formaban parte del grupo 2.
Las hemorragias asociadas a traumatismos craneales o cirugía se identificaron en 14 pacientes y en 13 pacientes con malformaciones vasculares, todos ellos del grupo 1. En la tabla 1 se resumen los hallazgos en la SWI de todos los pacientes incluidos en el estudio.
Al comparar los hallazgos de la SWI entre los dos grupos sí hubo diferencias significativas entre ambos (tabla 4):
- •
En el grupo 1, en 34 pacientes (55%) hubo hallazgos en la SWI y en 21 pacientes (34%) se cambió el informe en función de estos hallazgos: 5 casos por focos microhemorrágicos supra e infratentoriales de predominio en ganglios de la base que eran compatibles con encefalopatía hipertensiva crónica, en 5 pacientes se identificaron alteraciones vasculares (dos correspondieron a malformaciones arteriovenosas, dos a anomalías del desarrollo venoso y en 1 caso se identificaban venas de drenaje dilatadas, secundarias a trombosis del seno transverso), 4 casos de angiopatía amiloide (en uno de ellos también se visualizaba siderosis superficial), 3 pacientes con cavernomatosis múltiple y por último 3 casos con hematomas intraparenquimatosos (uno de los casos correspondía a un paciente con clipado de un aneurisma reciente).
- •
En el grupo 2, la SWI presentó hallazgos en 33 pacientes (42%); de estos, solo en 11 casos de los 79 (14%), estos hallazgos supusieron un cambio en el informe radiológico, que fueron los siguientes: en 3 pacientes se sugirió una angiopatía amiloide (2 presentaban microsangrados de distribución periférica y 1 siderosis superficial), 3 presentaban anomalías del desarrollo venoso, en 3 casos se pusieron de manifiesto restos hemáticos en infartos no detectados en el resto de las secuencias, y por último en 2 casos se sugirió la encefalopatía hipertensiva crónica por presentar microsangrados en los núcleos grises de la base.
Relación entre hallazgos generales y relevantes entre los dos grupos de estudio
| Grupo 1 | Grupo 2 | t de Student | |
|---|---|---|---|
| Hallazgos generales | 34 patológicos (55%) 28 normales (45%) | 33 patológicos (42%) 46 normales (58%) | p=0,451 |
| Hallazgos relevantes | 21 relevantes (34%) 41 NO relevantes (66%) | 11 relevantes (14%) 68 NO relevantes (86%) | p=0,005 |
Con este trabajo se ha estudiado si el hecho de incluir la SWI como una secuencia rutinaria en el protocolo básico de RM cerebral aporta datos relevantes que supongan un cambio importante en el diagnóstico y por tanto en el manejo del paciente. Para ello se ha realizado un estudio observacional: se han comparado los hallazgos de la SWI en pacientes en los que, según la información clínica aportada por el médico peticionario, los antecedentes personales y los factores de riesgo de cada paciente, el radiólogo considera necesario que se adquiera, y así lo protocoliza, y se ha comparado con los hallazgos de la SWI en un grupo control en el que a priori no se consideró necesario adquirirla.
Las bases físicas de la secuencia SWI permiten la detección de todas aquellas heterogeneidades en el campo magnético1–6.
En la literatura científica hay múltiples estudios que documentan su utilidad para el diagnóstico de ciertas patologías, principalmente anomalías venosas, hemorragias o incluso la detección de lesiones con calcio o depósitos de hierro, gracias a su propiedad de ser sensible a sustancias que distorsionan el campo magnético, pero dando un paso más que las secuencias T2* clásicas, ya que al adquirir la fase permite diferenciar las sustancias paramagnéticas de las diamagnéticas7–9.
Estas características han permitido demostrar la eficacia de la secuencia SWI frente al T2*3 y su rentabilidad a la hora de diagnosticar microhemorragias4,11; por ejemplo, en casos de hipertensión arterial, traumatismos craneoencefálicos (TCE) crónicos12 o para demostrar restos hemáticos en daño axonal difuso13. También ha demostrado su utilidad en casos de angiopatía amiloide14, y más recientemente se está empleando en estudios de tumores y esclerosis múltiple15–17. Se han descrito tantas ventajas que incluso hay autores que han recomendado su adquisición en el protocolo de rutina en las patologías descritas1.
Dado que cada vez se demuestran más aplicaciones de esta secuencia, se puede plantear hacerla de forma rutinaria a todos los pacientes, lo que supondría aumentar el TE. Sin embargo, dada la importante demanda de pruebas de imagen que hay en los servicios de radiodiagnóstico, es fundamental optimizar los protocolos y los tiempos de máquina, haciendo estudios dirigidos a responder al motivo clínico que motivó la solicitud de la prueba.
Los resultados del trabajo muestran que en el grupo en el que se protocolizó su adquisición, la SWI sí mostró hallazgos relevantes. En cambio, al adquirirla de forma rutinaria sin seleccionar previamente a los pacientes, que es lo que ocurría en el grupo 2, se produjeron hallazgos significativos en la SWI en 11 pacientes (14%): en 3 pacientes se sugirió una angiopatía amiloide por microsangrados subcorticales, ninguno de los cuales presentaba deterioro cognitivo y no se cambió la actitud clínica; las 3 anomalías del desarrollo venoso no tenían malformaciones vasculares asociadas, por lo que se puede considerar prácticamente un hallazgo sin relevancia; en los 3 casos en los que se demostraron restos hemáticos en infartos crónicos el manejo clínico no varió, y por último, en 2 casos se sugirió descartar una encefalopatía hipertensiva crónica por microsangrados en los núcleos grises de la base y tampoco se cambió el manejo. Por tanto, teniendo en cuenta que añadir esta secuencia de forma rutinaria supone tiempo de máquina, cada centro o cada equipo de trabajo debería plantearse si es conveniente su introducción, porque hay hallazgos relevantes que cambian el informe radiológico, aunque en este estudio no supusieron un cambio en el manejo de estos pacientes.
Este estudio tiene varias limitaciones: el principal es el propio diseño del estudio, ya que el grupo 1 se formó en función de la información remitida y los factores de riesgo. En muchas ocasiones, la información facilitada acerca del paciente es escasa o incompleta, y también, a veces, los factores de riesgo no están bien recogidos. Además, el grupo 2, en el que no se protocolizó, sino que fue el técnico el que, en función del tiempo de máquina disponible la adquirió o no, no se aleatorizó, pero como se ha comentado, no hubo diferencias estadísticamente significativas entre los grupos. Otra limitación es el hecho de qué se considera patológico, ya que, por ejemplo, la identificación de alguna imagen aislada puntiforme hipointensa en SWI se consideró inespecífica, no dándole relevancia clínica en ninguno de los dos grupos.
Como conclusión, la SWI es una secuencia que aporta información muy relevante y con múltiples aplicaciones clínicas. Incluirla en el protocolo básico de estudio rutinario puede aportar datos que cambien el informe radiológico, pero dado que conlleva un aumento del tiempo de exploración, cada centro o cada equipo de trabajo debe valorar su adquisición rutinaria.
Autoría- 1.
Responsables de la integridad del estudio: EUP, ESA, NSP, AVC y CJB.
- 2.
Concepción del estudio: EUP, ESA y NSP.
- 3.
Diseño del estudio: EUP y ESA.
- 4.
Obtención de los datos: EUP, ESA, NSP, AVC y CJB.
- 5.
Análisis e interpretación de los datos: EUA y ESA.
- 6.
Tratamiento estadístico: EUP y ESA.
- 7.
Búsqueda bibliográfica: EUP, ESA, NSP, AVC y CJB.
- 8.
Redacción del trabajo: EUP y ESA.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes:
- 10.
EUP, ESA, NSP, AVC y CJB.
- 11.
Aprobación de la versión final: EUP, ESA, NSP, AVC y CJB.
Las autoras declaran no tener ningún conflicto de intereses.