Los síndromes de compresión vascular consisten en el atrapamiento de un vaso por otra estructura en un espacio anatómico reducido, lo que provoca sintomatología diversa y para cuyo diagnóstico se emplean diferentes pruebas de imagen. Es importante familiarizarse con este tipo de patología y ser capaces de identificar sus hallazgos más representativos. El objetivo de este artículo es revisar los principales síndromes de compresión vascular, aportando datos clave de hallazgos en la ecografía Doppler que permitan establecer un diagnóstico acertado, evitar otras pruebas más agresivas o seleccionar aquellos pacientes que las requieran y orientar el tratamiento adecuado.
Vascular compression syndromes arise when a vessel in a tight anatomic space is entrapped by another structure, resulting in diverse symptoms for which different imaging tests are used to diagnose. Radiologists need to be familiar with vascular compression syndromes and to be able to identify their most representative findings. This paper aims to review the principal symptoms of vascular compression, describing and illustrating the key findings on Doppler ultrasonography that enable accurate diagnosis and guide further workup, avoiding unnecessary invasive tests and pointing to the appropriate treatment.
Los síndromes de compresión vascular consisten en el atrapamiento de un vaso por otra estructura, en un espacio anatómico reducido. Se presentan habitualmente en personas jóvenes, con sintomatología diversa, dependiendo de la estructura involucrada. Para su diagnóstico, se requiere la combinación de manifestaciones clínicas y hallazgos de imagen, siendo la ecografía Doppler, la angio-TC y la angio-RM las técnicas utilizadas actualmente. Las opciones terapéuticas dependerán de la gravedad de los síntomas y de las complicaciones asociadas.
En este artículo presentamos los hallazgos relevantes de los síndromes de compresión vascular más frecuentes: síndrome del estrecho torácico, del ligamento arcuato, de cascanueces y del atrapamiento poplíteo.
Destacaremos el estudio de la ecografía Doppler, método de elección para la mayoría de estas entidades, por ser un examen rápido, económico, no invasivo y realizado de forma dinámica.
A continuación, presentamos una revisión sobre los aspectos generales más importantes de los síndromes de compresión vascular y sus hallazgos con la ecografía Doppler.
Síndromes de compresión vascularSíndrome del estrecho torácicoEl síndrome del estrecho torácico (SET) es un síndrome causado por la compresión de los vasos subclavios y/o del plexo braquial a nivel del estrecho torácico superior. Según las estructuras afectadas puede ser: neurológico (95%), venoso (4%) o arterial (1%)1.
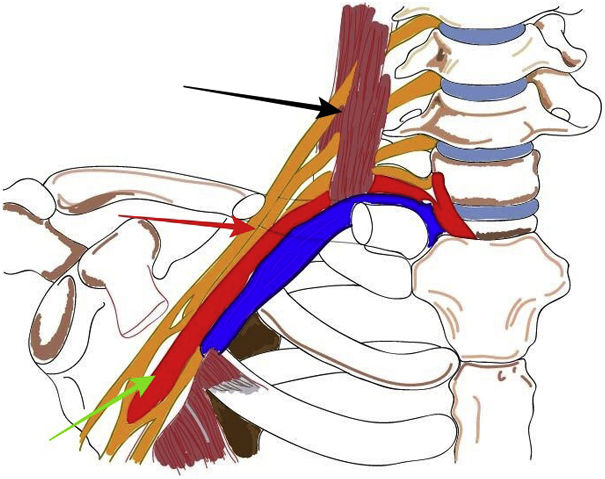
El estrecho torácico superior es aquel segmento anatómico que abarca desde la columna cervical al mediastino y al borde superior del músculo pectoral. Incluye tres espacios anatómicos diferenciados: el triángulo interescaleno, el espacio costoclavicular y el compartimento retropectoral menor. La mayoría de las compresiones vasculares se producen en el espacio costoclavicular (fig. 1)2. Las causas pueden ser alteraciones anatómicas o lesiones postraumáticas.
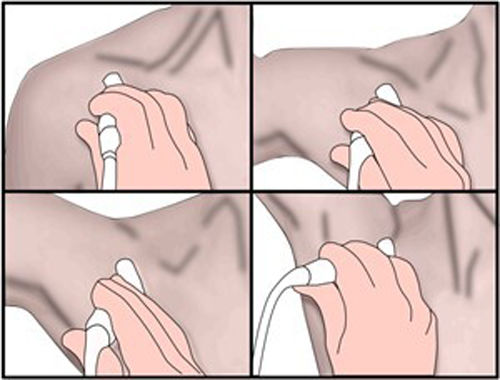
Existen varios test que incrementan la sintomatología y confirman el diagnóstico; el test de Allen y el de Adson (fig. 2) son los más utilizados2:
Test de Allen: valora el pulso radial con el brazo del paciente a 90°, en rotación externa y abducción. Es positivo cuando hay abolición o disminución del pulso, lo que indica compresión vascular por el tendón del pectoral mayor. Test de Adson: valora el pulso radial en inspiración y giro de la cabeza hacia el lado explorado. Se considera positivo cuando hay reducción o supresión del pulso radial, lo que indica compresión vascular por el músculo escaleno.
Test de Adson: localizamos el pulso radial del paciente y le pedimos que realice una respiración profunda y gire la cabeza hacia el lado examinado. Se considera positivo cuando hay reducción o supresión del pulso radial. Indica compresión vascular por el músculo escaleno contra la primera costilla.
Test de Allen: mientras palpamos el pulso radial realizamos una rotación externa y abducción del brazo del paciente a 90°. Se considera positivo cuando hay abolición o disminución del pulso. Indica compresión vascular por el tensor del pectoral mayor.
Los síntomas y signos se manifiestan habitualmente con la elevación y abducción del brazo, y varían según el punto de compresión y de las estructuras afectadas. Los síntomas neurológicos, secundarios a la compresión del plexo braquial, son los más frecuentes e incluyen habitualmente dolor, debilidad, entumecimiento y hormigueo en la extremidad afectada. Cuando la compresión es venosa, la clínica consistirá en edema, cianosis y dolor. Si la compresión es arterial, se manifestará como debilidad, frialdad y dolor1,2.
Diagnóstico por imagenLa ecografía Doppler evalúa signos indirectos de estenosis, pero no permite una valoración exacta del punto de compresión ni determina la causa que lo produce1. La ventaja fundamental de esta técnica es que permite realizar una valoración dinámica, en posición de reposo y con las maniobras de provocación2.
Realizamos el estudio con el paciente en sedestación, colocando el transductor a nivel infraclavicular, en el espacio costoclavicular. Se valoran la arteria y vena subclavia, en posición neutra y con la maniobra de Adson modificada (fig. 3), que consiste en realizar una abducción-hiperabducción progresiva del brazo, con extensión contralateral del cuello. Posteriormente, valoramos la arteria radial en posición neutra y con las maniobras de provocación de Allen y Adson. En ambas posiciones determinamos el calibre, el patrón de flujo y las velocidades pico sistólicas (Vps). Suele ser necesaria la realización de una angio-TC en hiperabducción para obtener información del punto exacto de la compresión y la causa.
Maniobra de Adson modificada: paciente en sedestación, se coloca el transductor a nivel infraclavicular, en el espacio costoclavicular. Se valoran la arteria y vena subclavia, en posición neutra y en abducción-hiperabducción progresiva del brazo mientras realiza extensión contralateral del cuello.
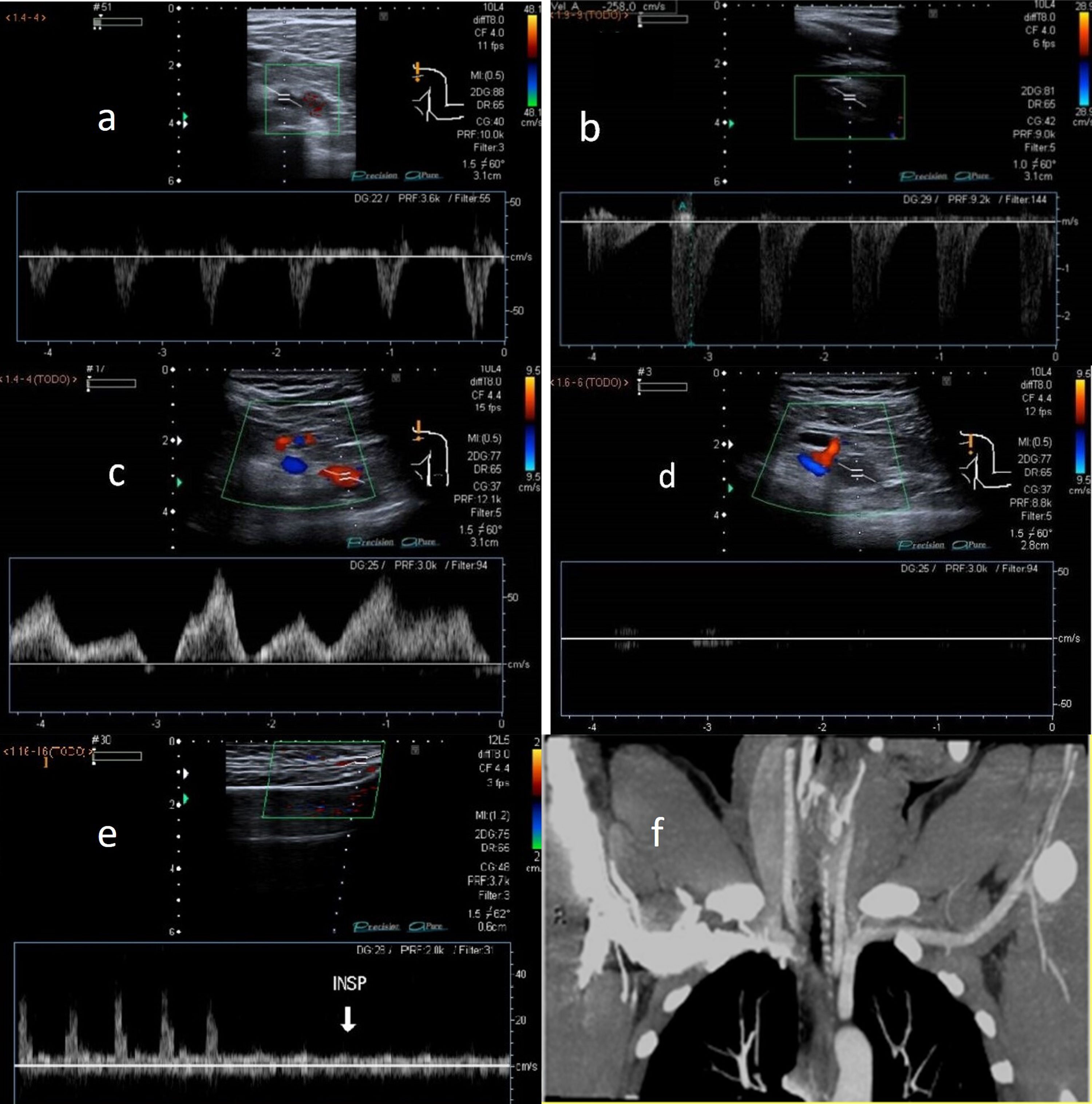
El hallazgo Doppler más relevante es la duplicación de la Vps, respecto a su valor en reposo en la arteria subclavia y la pérdida de la dinámica respiratoria en la vena subclavia en la abducción a 90°. El cese total del flujo arterial y/o venoso en hiperabducción indica oclusión completa2,3. Otro hallazgo es la atenuación del flujo radial con las maniobras de Adson y Allen (fig. 4).
A) Flujo arterial normal en posición neutra de la arteria subclavia. B) Duplicación de la Vps en la arteria subclavia en la abducción a 90° en el síndrome del estrecho torácico (SET). C) Flujo venoso normal en posición neutra de la vena subclavia. D) Pérdida de la dinámica respiratoria en la vena subclavia con las maniobras de abducción en el SET. E) Onda arterial radial normal en posición neutra y atenuada con la maniobra de Adson en el SET. F) Tomografía computarizada con contraste, en proyección coronal, donde se observa compresión de arteria subclavia izquierda en la región costoclavicular.
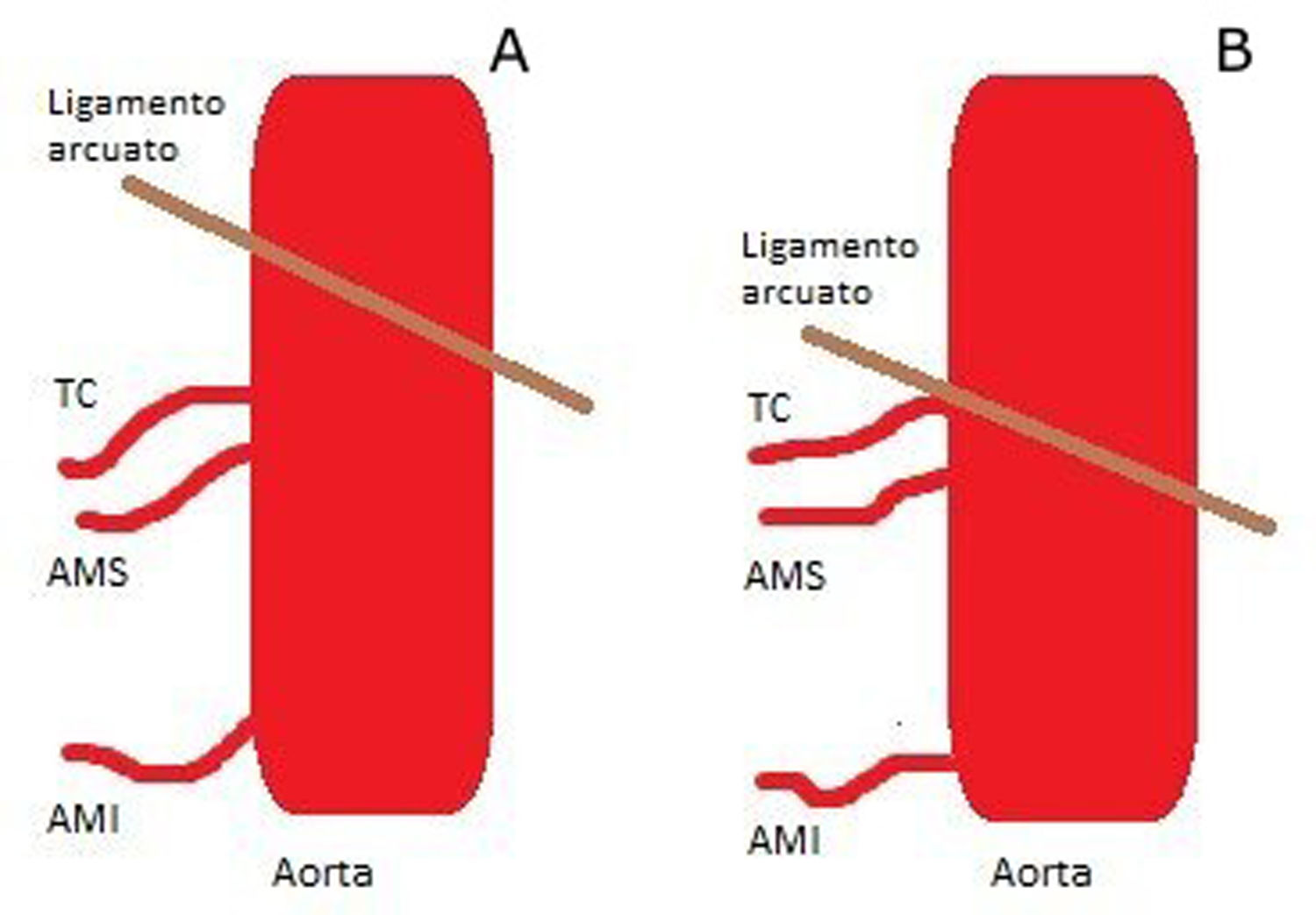
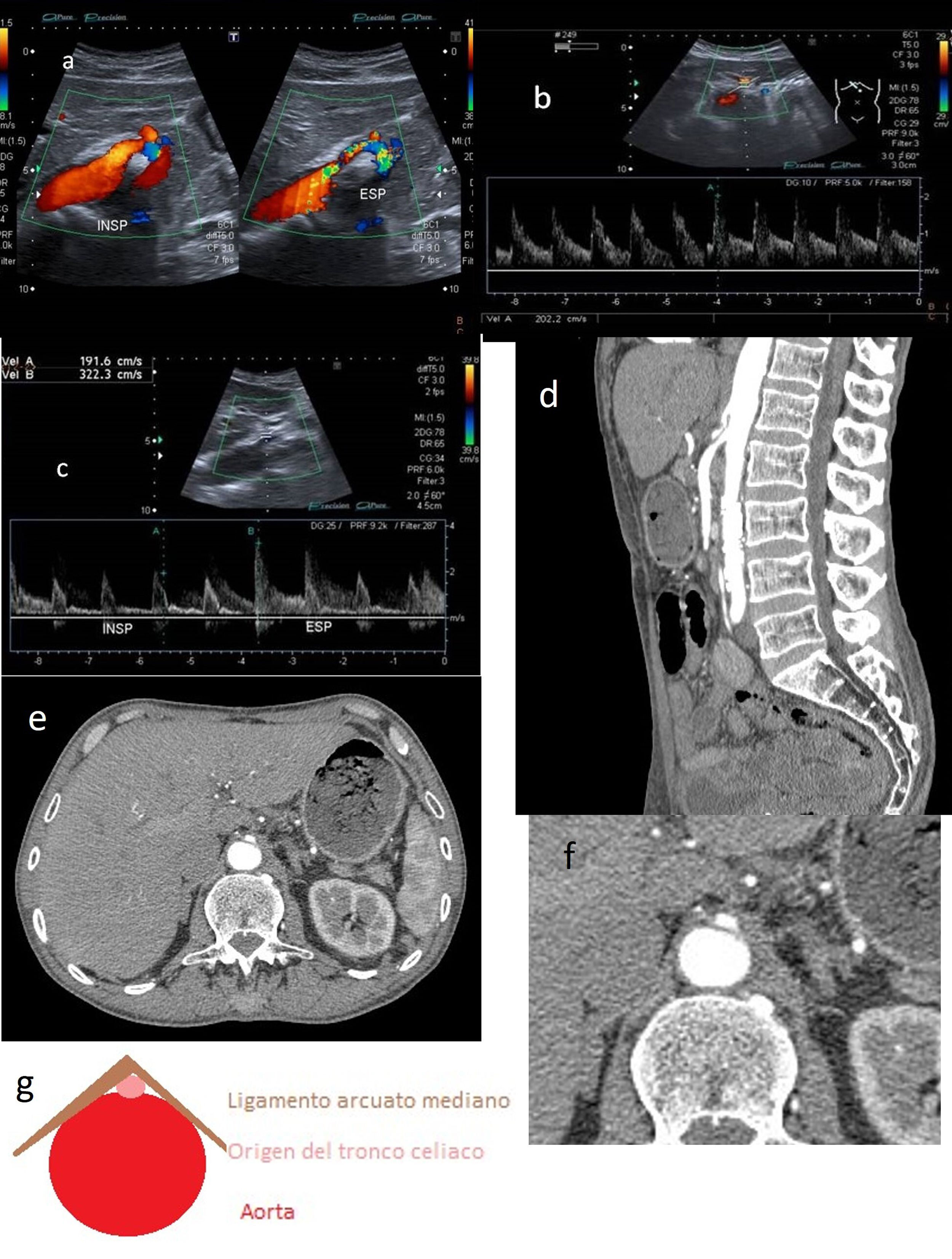
El ligamento arcuato es una estructura fibrosa que une entre sí las dos cruras diafragmáticas, abrazando la aorta por su cara anterior en el hiato aórtico. En la mayoría de los casos se sitúa craneal al tronco celiaco, a la altura de los cuerpos vertebrales de D12-L2, pero en ocasiones el ligamento presenta una localización baja, contactando con el origen del tronco celiaco[40,5 (fig. 5).
El síndrome de compresión del tronco celiaco es una alteración rara que predomina en el sexo femenino entre los 20 y 40 años. Este síndrome se caracteriza clínicamente por dolor epigástrico posprandial intermitente, náuseas, vómitos, diarrea y pérdida de peso. El dolor abdominal puede estar relacionado con otras actividades distintas a comer4,6.
Los hallazgos descritos al examen físico son un soplo epigástrico que varía con la respiración y que es más acentuado en espiración profunda. Estos síntomas son debidos a un compromiso de flujo causado por la disposición del ligamento6.
Diagnóstico por imagenLa ecografía con técnica Doppler se utiliza para el diagnóstico del síndrome del ligamento arcuato medio, donde se evidencia un cambio en la orientación del tronco celiaco en relación con la inspiración y la espiración (fig. 6).
A) Morfología en gancho del tronco celiaco con cambio en la orientación en relación con la inspiración y la espiración. B) Tronco celiaco con elevación de las velocidades en el pico sistólico > 200 cm/s. C) En espiración, la velocidad asciende de 192 hasta 322 cm/s. D) Angio-TC: (espiración) estenosis focal de la porción proximal del tronco celiaco (apariencia en gancho). E y F (detalle): angio-TC (fase arterial) donde se visualiza el signo del “moño y la mantilla”. G) Signo del “moño y la mantilla”.
Para el diagnóstico, si observamos una elevación de las velocidades en el pico sistólico en espiración máxima superior a 200cm/s con índice tronco celiaco/aorta > 3, estaremos ante un compromiso del flujo significativo (fig. 6 B y C).
Esta técnica es muy utilizada, sobre todo en evaluación de vasos sanguíneos en niños y adolescentes4. Si colocamos el transductor en modo B en el plano axial, podríamos ver cómo el tronco celiaco es comprimido y deformado entre la aorta abdominal, dorsalmente, y el ligamento arcuato, ventralmente5,7.
A menudo es necesaria la realización de una angio-TC para valorar el grado de estenosis. Es característica la impronta superior en el origen del tronco celiaco, que adopta una morfología en “gancho” o “garfio”. Otro hallazgo radiológico es el signo del “moño y la mantilla”, que consiste en la visualización, en un mismo plano axial, del tronco celiaco comprimido y deformado entre la aorta abdominal ubicada dorsalmente y el ligamento arcuato mediano localizado ventralmente, el cual rodea prácticamente a los otros dos. Estos hallazgos asemejan una cabeza (aorta) tocada con un moño (origen del tronco celiaco) y cubierta por un paño (ligamento arcuato mediano). Este permite establecer el diagnóstico en estudios no dirigidos y la selección de los pacientes a los que completar estudios8.
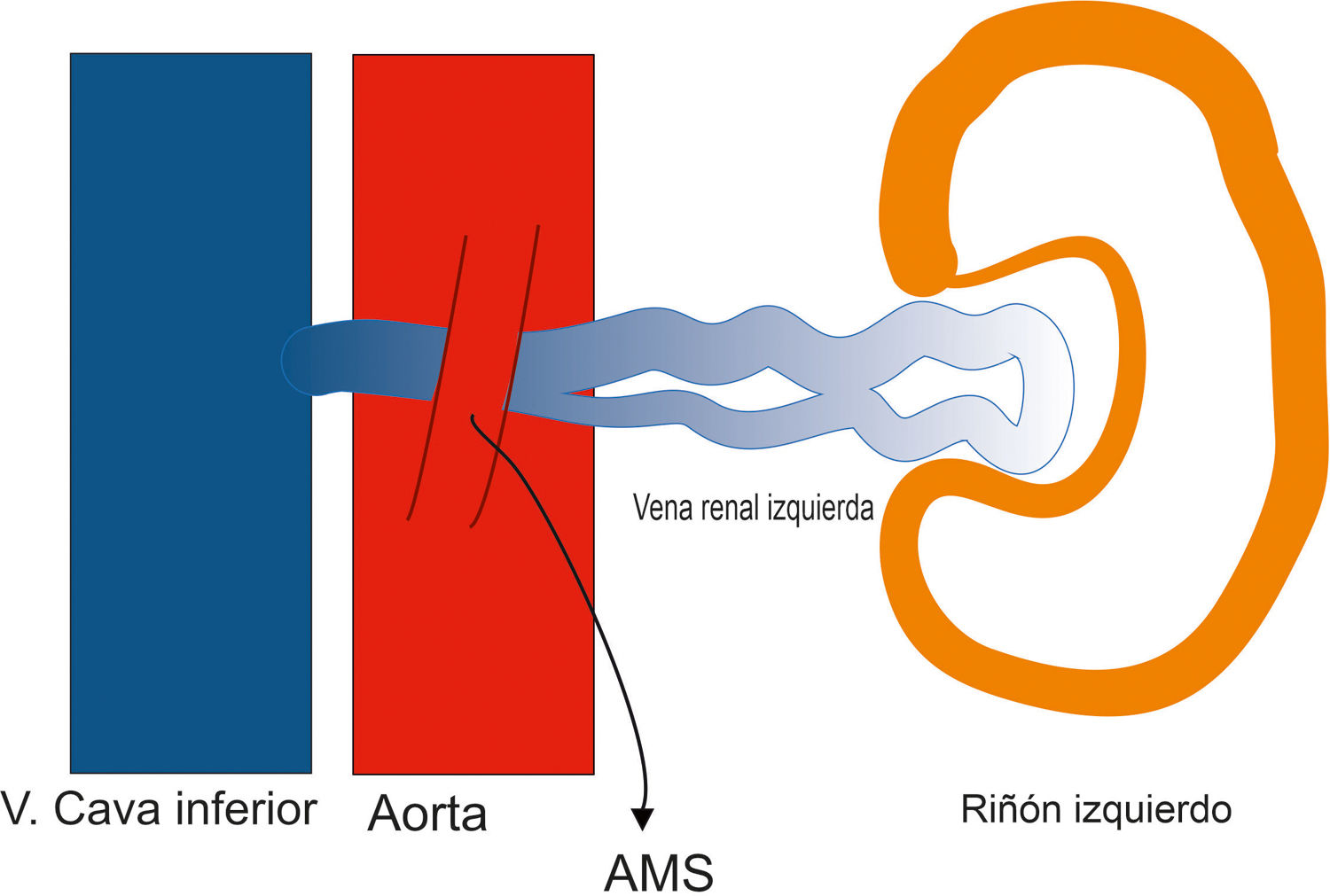
Síndrome de cascanuecesEs un síndrome causado por el atrapamiento de la vena renal izquierda (VRI) entre la arteria mesentérica superior (AMS) y la aorta (cascanueces anterior), debido a una disminución del ángulo que forman ambos vasos (ángulo aortomesentérico), con un valor normal habitualmente comprendido entre los 38° y 65° (fig. 7). En ocasiones, la VRI sigue un trayecto retroaórtico o circumaórtico, y puede estar comprimida entre la aorta y la columna vertebral, siendo conocido en estos casos como síndrome de cascanueces posterior9–11. Pueden coexistir ambos síndromes, anterior y posterior, por la duplicación de la VRI, aunque este hallazgo es infrecuente12. Existe un cuadro clínico análogo, el síndrome de Wilkie, en el que la tercera parte del duodeno se comprime entre la AMS y la aorta, dando lugar a un cuadro obstructivo intestinal13.
La configuración anatómica puede ser considerada una variante de la normalidad. Por lo tanto, el término síndrome de cascanueces debe ser reservado para los pacientes con síntomas clínicos característicos (hipertensión de la VRI con hematuria macroscópica, dolor en flanco izquierdo, proteinuria ortostática, varices periureterales, gonadales y varicocele) asociados con características morfológicas demostrables1,14.
Debido a la variabilidad de los síntomas y la ausencia de consenso sobre los criterios de diagnóstico, se desconoce la prevalencia exacta; sin embargo, se estima que es más frecuente en personas jóvenes, principalmente en mujeres entre la 3.ª y 4.ª décadas de la vida. En estas últimas puede darse el síndrome de congestión pélvica, que cursa con dolor pélvico, varices genitales, pélvicas y en los muslos, dismenorrea, dispareunia y dolor poscoital. En los hombres, el reflujo a la vena testicular produce varicocele, dolor testicular izquierdo e infertilidad1,10,12.
Diagnóstico por imagenPara el diagnóstico del síndrome de cascanueces se considera la flebografía selectiva de la VRI como el método más exacto para diagnosticar esta enfermedad. Debido a que no es imprescindible para su diagnóstico y que es una prueba invasiva, está siendo sustituida por el resto de modalidades diagnósticas: ecografía en modo B, ecografía Doppler, angio-TC y angio-RM11,12,14.
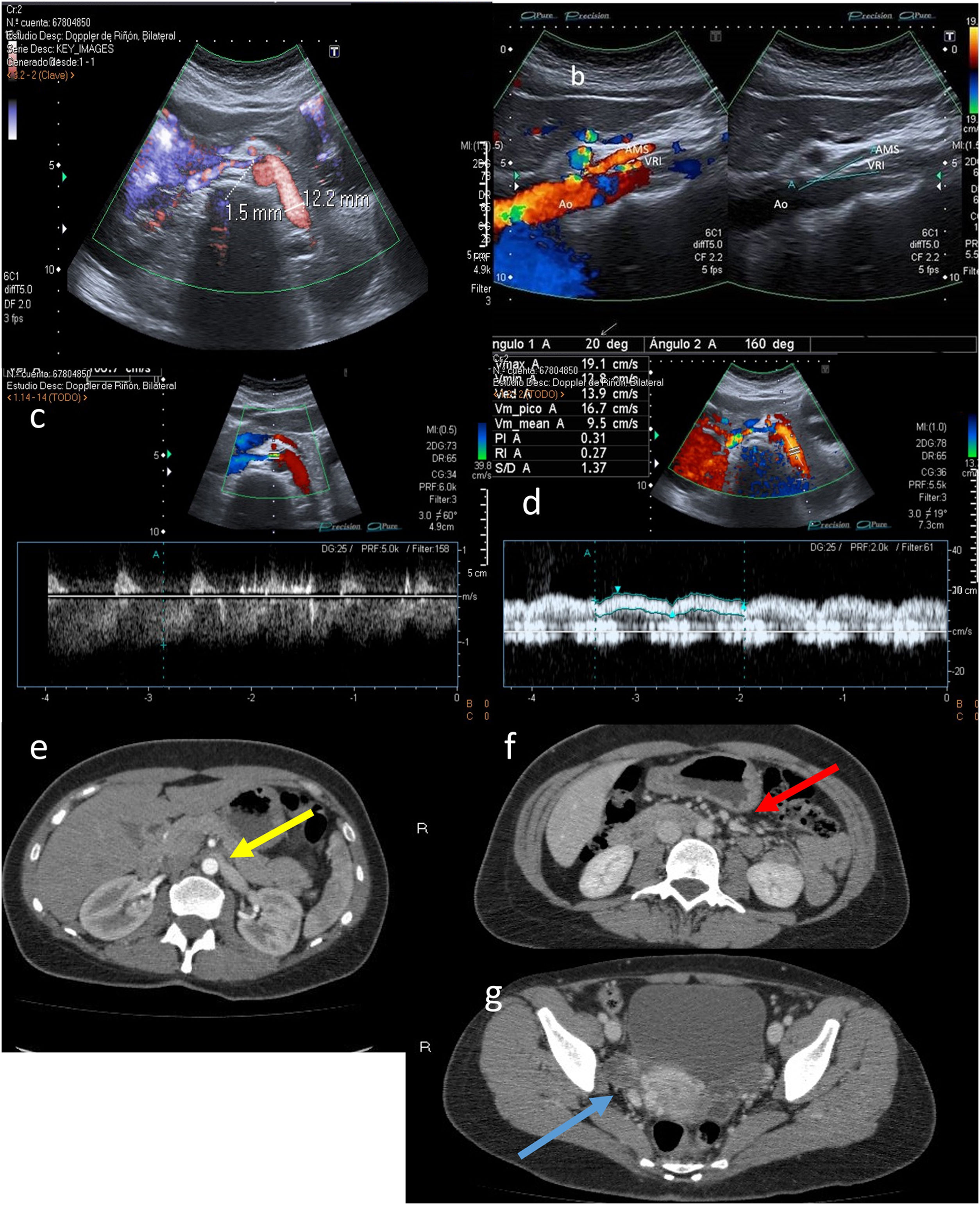
La ecografía en modo B se ha postulado como el método para la obtención de medidas del ángulo aortomesentérico, así como el cálculo de la ratio entre el diámetro de la parte dilatada de la VRI con la parte estrecha de esta y la distancia entre la aorta y la arteria mesentérica superior, respectivamente. Los puntos de corte son ángulo < 25°, ratios > 4,5 y distancia < 8mm, respectivamente. También se ha utilizado la diferencia de diámetros entre la vena renal derecha e izquierda, si bien no es un criterio muy aceptado (fig. 8).
A) Calibre de la vena renal izquierda (VRI) en región hiliar (antes de la pinza): 12,2mm. Calibre VRI en la propia pinza entre la aorta (Ao) y la arteria mesentérica superior (AMS): 1,5mm. B) Ángulo aortomesentérico a nivel de VRI disminuido (20°). C) Velocidad de la VRI aumentada en la pinza aortomesentérica (106cm/s). D) Velocidad normal de la VRI previa a la pinza (19cm/s). E-G) Proyecciones axiales de tomografía computarizada de abdomen con contraste en fase arterial (E) y fase portal (F y G). En la imagen E se observa una reducción del calibre de la VRI al pasar por la pinza aortomesentérica (flecha amarilla). En la imagen F se aprecian venas gonadales ligeramente dilatadas (flecha roja). En la imagen G son visibles varices parauterinas derechas (flecha azul).
La ecografía Doppler mide la velocidad del flujo de la VRI a nivel de la pinza aortomesentérica, así como la medición del diámetro y la velocidad máxima de flujo en la vena renal antes y después de su paso por la horquilla aortomesentérica, con una sensibilidad del 78% y una especificidad del 100%.
Se considera anormal un valor de velocidad máxima de la vena renal en la pinza mayor de 100cm/s (criterio no imprescindible). Una ratio distal/proximal > 5 es diagnóstica para este síndrome (fig. 8 C).
Dado que es una técnica inocua, puede ser útil en el cribado de proteinuria ortostática. En nuestro medio, no se suele requerir la realización de otras pruebas diagnósticas en la mayoría de los pacientes pediátricos. En adultos puede ser necesario angio-TC o angio-RM en función de la actitud terapéutica15.
Síndrome de atrapamiento de la arteria poplíteaEl síndrome de atrapamiento poplíteo (SAP) es un síndrome de compresión vascular que afecta a la arteria poplítea (AP) a nivel de la inserción proximal de ambas cabezas del músculo gastrocnemio. El recorrido normal de la AP transcurre entre ambas cabezas del mismo, acompañando a la vena y nervio poplíteos16. Es un síndrome raro, que afecta más a varones jóvenes, la mayoría de manera bilateral. Este síndrome puede ser explicado por una alteración en la embriogénesis, durante la formación de la AP y en la migración de músculo gastrocnemio17.
La clínica suele ser claudicación y dolor inducidos por el ejercicio. La ausencia de tratamiento lleva a daño arterial, trombosis e isquemia de la pierna18. Se clasifica según la escala de Love and Whelan de 1965, modificada por Rich en 1979, que se basa en las variantes anatómicas16,19:
- •
Tipo I: la AP muestra un trayecto aberrante medial a la cabeza del músculo gastrocnemio (CMG).
- •
Tipo II: la cabeza del músculo gastrocnemio (CMG) muestra una inserción femoral anómala más lateral de lo habitual, dejando a la AP a su lado medial.
- •
Tipo III: una banda muscular accesoria de la cabeza del músculo gastrocnemio (CMG) se inserta más lateral e independiente, rodeando la AP.
- •
Tipo IV: la AP se localiza profunda en la fosa poplítea y se encuentra comprimida por el músculo poplíteo o bandas fibrosas.
- •
Tipo V: cualquier forma de atrapamiento que además de a la AP también incluya a la vena poplítea.
- •
Tipo VI: no existen anomalías en el trayecto arterial ni en las inserciones o la morfología de las del gastrocnemio, pero estas comprimen el paquete vascular.
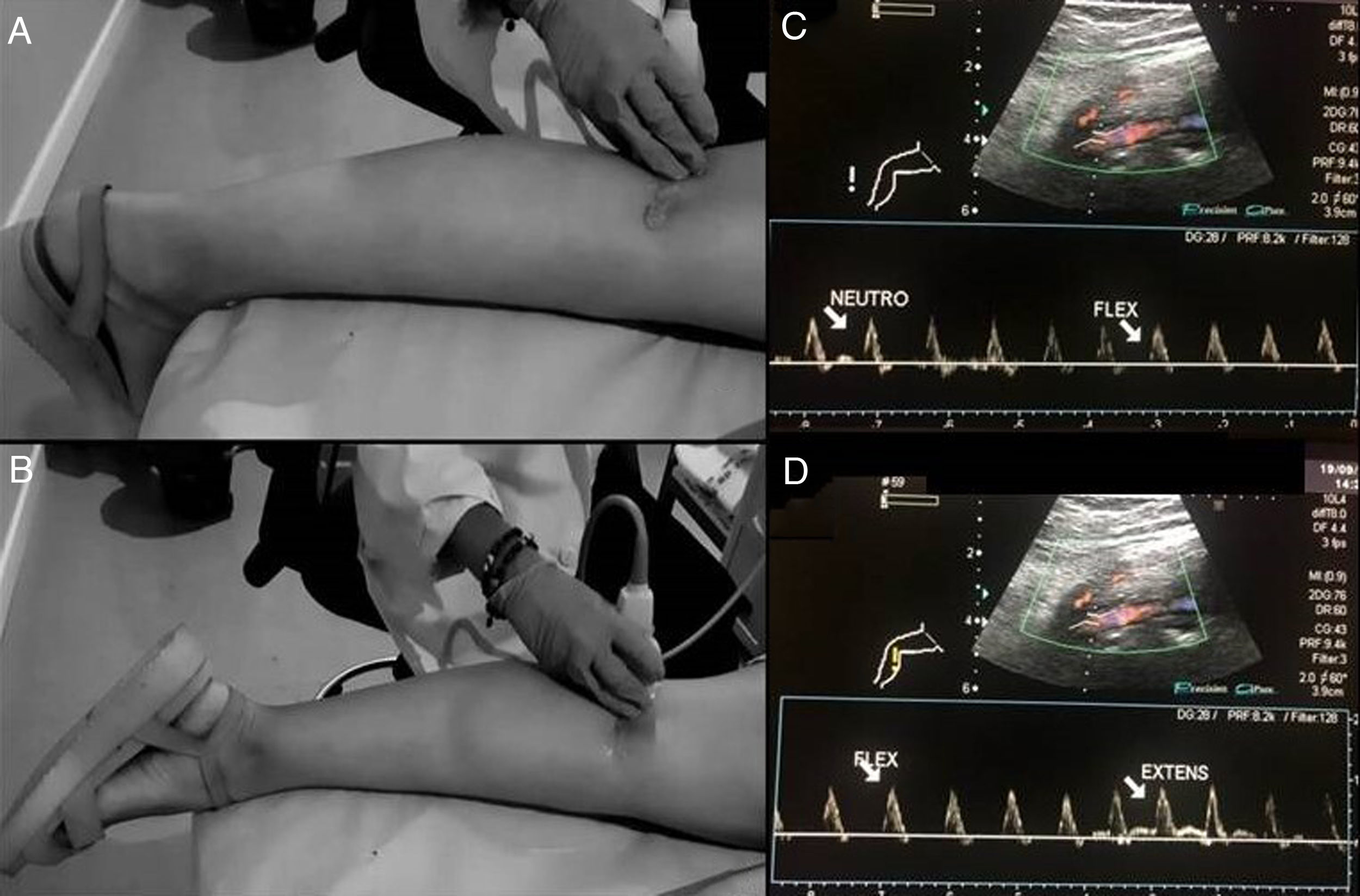
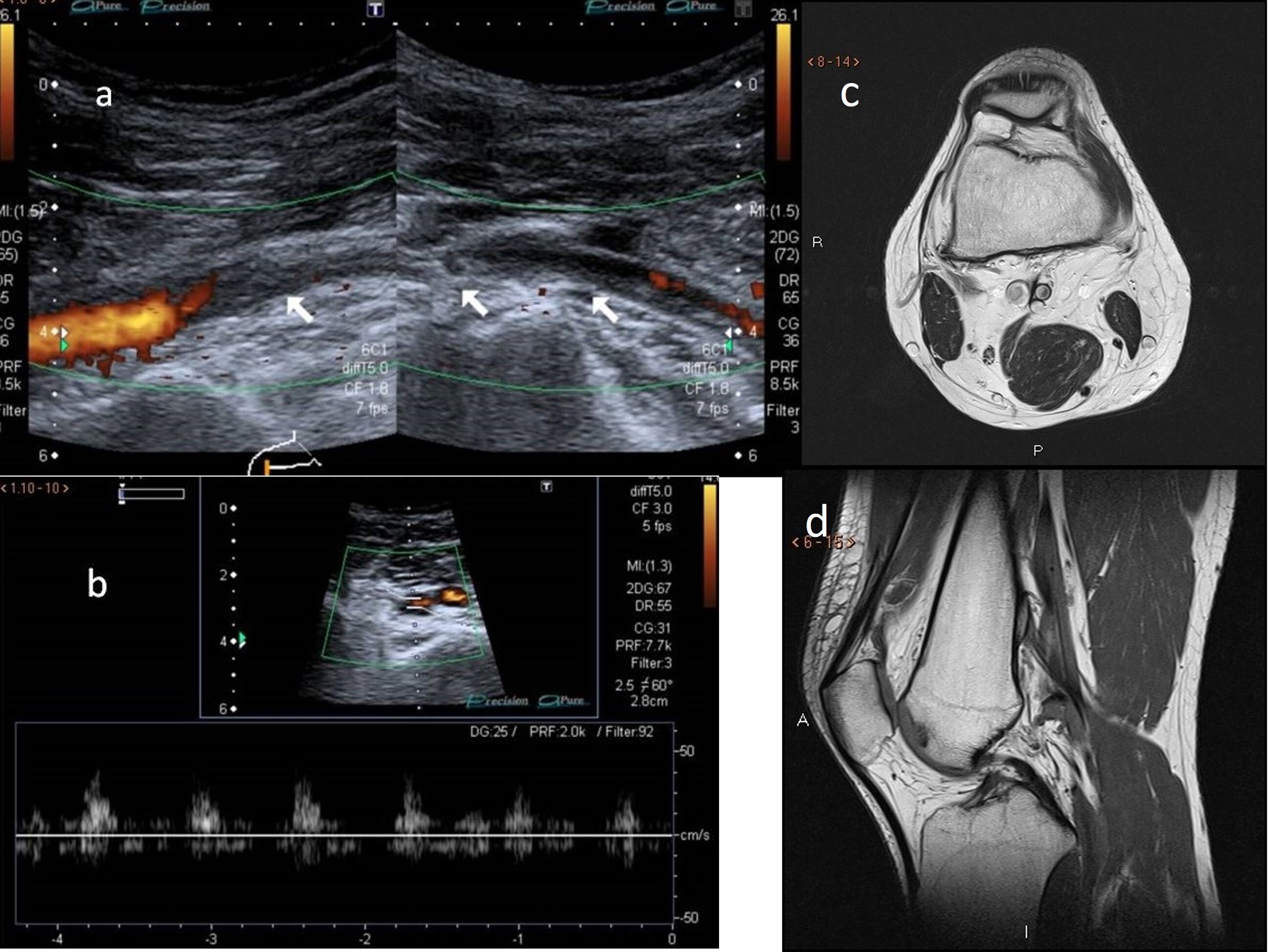
La ecografía Doppler se usa como método de cribado, al ser no invasiva y no emitir radiaciones. El estudio de la AP comienza por encima de la articulación de la rodilla hasta que se bifurca y de manera bilateral. El estudio se realiza con el paciente en decúbito prono, con la pierna extendida y en posición neutral para establecer los cambios de la capa íntima del vaso, la presencia de estenosis o aneurismas, así como la velocidad y la morfología de la curva espectral16,18. La segunda parte del estudio consiste en las maniobras de estrés, en las que el tobillo se coloca en dorsiflexión y flexión plantar hasta 30 segundos, donde el radiólogo puede ayudar a mantener la postura mediante presión (fig. 9 A). Posteriormente, el paciente se pondrá en bipedestación, sobre la punta de los pies15,16. Durante este momento evaluaremos el flujo en todo el recorrido de la AP y evaluaremos la presencia o ausencia del flujo y la disminución del pico sistólico con las maniobras de estrés (fig. 9 B). También podremos evaluar la arteria pedia y la arteria tibial posterior17,19.
Maniobras de estrés para valoración del síndrome de atrapamiento poplíteo. Paciente en decúbito prono, con la pierna extendida y el tobillo en dorsiflexión (A) y extensión plantar (B) durante 30 segundos. El radiólogo puede ayudar a mantener la postura mediante presión. Se evaluará la presencia, ausencia o cambios en el flujo de todo el recorrido de la arteria poplítea con los cambios de posición. C y D muestran hallazgos normales en Doppler espectral con las maniobras de estrés de flexión y extensión.
La estenosis de la AP puede ser cuantificada midiendo la ratio de la Vps en la lesión: la Vps es medida en la estenosis y se compara con la arteria sana contralateral, creando una ratio específica para cada paciente. Radonic V et al. (2000) definieron que una ratio mayor de 2 sería una estenosis significativa.
El flujo turbulento con aliasing es necesario para detectar una estenosis hemodinámicamente significativa. Se considera que hay una obstrucción de los vasos si no se detecta flujo ni por Doppler color ni pulsado18 (fig. 10). Para visualizar las variantes anatómicas correctamente, podremos complementar el estudio con una angio-RM.
A y B) Ecografía Doppler. Suboclusión de la arteria poplítea con flujo muy débil en paciente joven con síndrome de atrapamiento poplíteo y clínica de claudicación intermitente. C y D) Resonancia magnética sin contraste, proyecciones axial y sagital, respectivamente. Inserción anómala del músculo gastrocnemio medial cuyo tendón asciende más de lo habitual, pasando entre la arteria y la vena poplítea, hasta insertarse en la cortical posterior de la metáfisis femoral, donde se ha formado una excrecencia ósea benigna. Clasificación de Love y Whealan II.
Los síndromes de compresión vascular son entidades poco frecuentes y de difícil diagnóstico. Los síntomas característicos son debidos a la compresión intermitente del paquete vasculonervioso a su paso por diferentes estrechos anatómicos. La ecografía Doppler está indicada en el diagnóstico de primer nivel de los síndromes de compresión vascular porque evalúa la existencia, tipo y grado de compromiso hemodinámico en diferentes niveles vasculares, y será confirmada o confirmatoria de otras pruebas diagnósticas. La ventaja fundamental de esta técnica es que permite evaluar al paciente de forma no invasiva y dinámica, en tiempo real y con las maniobras de provocación. El radiólogo debe estar familiarizado con el protocolo de evaluación y la interpretación de los resultados, lo que puede incidir en el manejo diagnóstico y terapéutico de los pacientes, así como el seguimiento postratamiento. La ampliación del estudio radiológico con pruebas como la angio-RM y la angio-TC es importante especialmente en el SET y en el SAP, pues nos permiten valorar adecuadamente la relación de las estructuras vasculares con la anatomía.
Autoría- 1.
Responsable de la integridad del estudio: ERV, TBC, XCS, IAV, REL y CPR
- 2.
Concepción del estudio: ERV, TBC, XCS, IAV, REL y CPR
- 3.
Diseño del estudio: ERV, TBC, XCS, IAV, REL y CPR
- 4.
Obtención de los datos: ERV, TBC, XCS, IAV, REL y CPR
- 5.
Análisis e interpretación de los datos: ERV, TBC, XCS, IAV, REL y CPR
- 6.
Tratamiento estadístico: ERV, TBC, XCS, IAV, REL y CPR
- 7.
Búsqueda bibliográfica: ERV, TBC, XCS, IAV, REL y CPR
- 8.
Redacción del trabajo: ERV, TBC, XCS, IAV, REL y CPR
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ERV, TBC, XCS, IAV, REL y CPR
- 10.
Aprobación de la versión final: ERV, TBC, XCS, IAV, REL y CPR
No ha habido financiación para la realización de este artículo.