La resonancia magnética se ha convertido en una herramienta fundamental en la valoración de la patología tumoral de cabeza y cuello. Los detalles anatómicos que proporcionan las imágenes de resonancia son fundamentales para diagnosticar, caracterizar y estadificar tanto la tumoración primaria como las metástasis ganglionares.
Además de las mejoras técnicas en las secuencias anatómicas, como es el caso del Dixon para mejorar la supresión de la grasa, se están desarrollando otras secuencias como son la difusión y la perfusión, que dan información molecular, biológica y fisiológica del tumor proporcionando biomarcadores que pueden ayudar a conocer la biología del tumor en el momento del diagnóstico y posteriormente a monitorizar la enfermedad, y facilitan información muy relevante de la respuesta al tratamiento.
Magnetic resonance imaging has become a fundamental tool for the evaluation of head and neck tumors. The anatomic details that magnetic resonance images provide are fundamental for diagnosing, characterizing, and staging both primary tumors and lymph node metastases.
In addition to technical improvements in anatomic sequences, such as Dixon techniques to improve fat suppression, other sequences being developed, such as diffusion and perfusion, provide molecular, biological, and physiological information about the tumor and are yielding imaging biomarkers that can help in determining the tumor's biology at the time of diagnosis and in the follow-up of the disease. Magnetic resonance imaging also provides very useful information about the response to treatment.
Los tumores de cabeza y cuello son muy prevalentes en nuestro medio, con más de 550.000 casos y 380.000 muertes anuales1. Los esquemas tradicionales con quimio/radioterapia tienen altas tasas de recurrencia locorregional, y además son tratamientos agresivos y con efectos secundarios importantes2. Por eso es necesario desarrollar herramientas de neuroimagen avanzadas que proporcionen información para identificar aquellos tumores que no van a responder a los esquemas clásicos de tratamiento, con el fin de evitar terapias con toxicidades innecesarias y ganar tiempo con tratamientos de segunda línea, es decir, para hacer una medicina adaptada a cada paciente y a cada tumor, una medicina personalizada.
Las secuencias anatómicas convencionales proporcionan información muy importante sobre la tumoración primaria, la diseminación locorregional o perineural y las adenopatías, lo que permite hacer un diagnóstico de la tumoración y de la extensión3. Por tanto, son fundamentales y debe realizarse un protocolo adecuado para su valoración. Sin embargo, estas secuencias no son capaces, por ejemplo, de valorar la enfermedad metastásica en ganglios de pequeño tamaño o de predecir la respuesta al tratamiento hasta que se ha completado un determinado número de ciclos de tratamiento. Afortunadamente, se están desarrollando en resonancia magnética (RM) secuencias funcionales que proporcionan información molecular, biológica y fisiológica del tumor, como son las secuencias de difusión y perfusión, capaces de generar biomarcadores que pueden ayudar a conocer la biología del tumor en el momento del diagnóstico y posteriormente a monitorizar la enfermedad, dando información muy relevante de la respuesta al tratamiento.
En la última década se están desarrollando y poniendo en práctica clínica avances muy interesantes en las técnicas de imagen tanto anatómicas como funcionales para la valoración de la patología tumoral de cabeza y cuello. En este artículo, sobre las secuencias anatómicas se van a revisar las ventajas de adquirir las secuencias Dixon, y en las secuencias funcionales se va a profundizar en los modelos avanzados de difusión y en la perfusión.
Secuencias dixonLas secuencias de supresión grasa son indispensables para hacer un diagnóstico preciso y para la caracterización de la patología de cabeza y cuello4. Hay, fundamentalmente, tres tipos de supresión grasa: las basadas en el desplazamiento químico (fatsat o CHESS y las técnicas de excitación del agua), las técnicas de inversión (STIR) y las técnicas híbridas (SPIR y SPAIR)5,6. Comúnmente se ha utilizado la secuencia STIR, aunque también hay secuencias selectivas de supresión de artefacto químico (CHESS) y métodos híbridos como la inversión-recuperación con presaturación espectral (SPIR)6. Pero recientemente están apareciendo en la literatura especializada múltiples artículos sobre la técnica Dixon, que al igual que las secuencias fatsat y de excitación del agua se basan en el desplazamiento químico.
Aunque la técnica Dixon para la supresión grasa está descrita desde el año 19847, hasta hace poco no se ha desarrollado el hardware necesario para que esté disponible en los escáneres que se emplean en la práctica diaria, razón por la cual hasta hace poco no se utilizaba en dicha práctica.
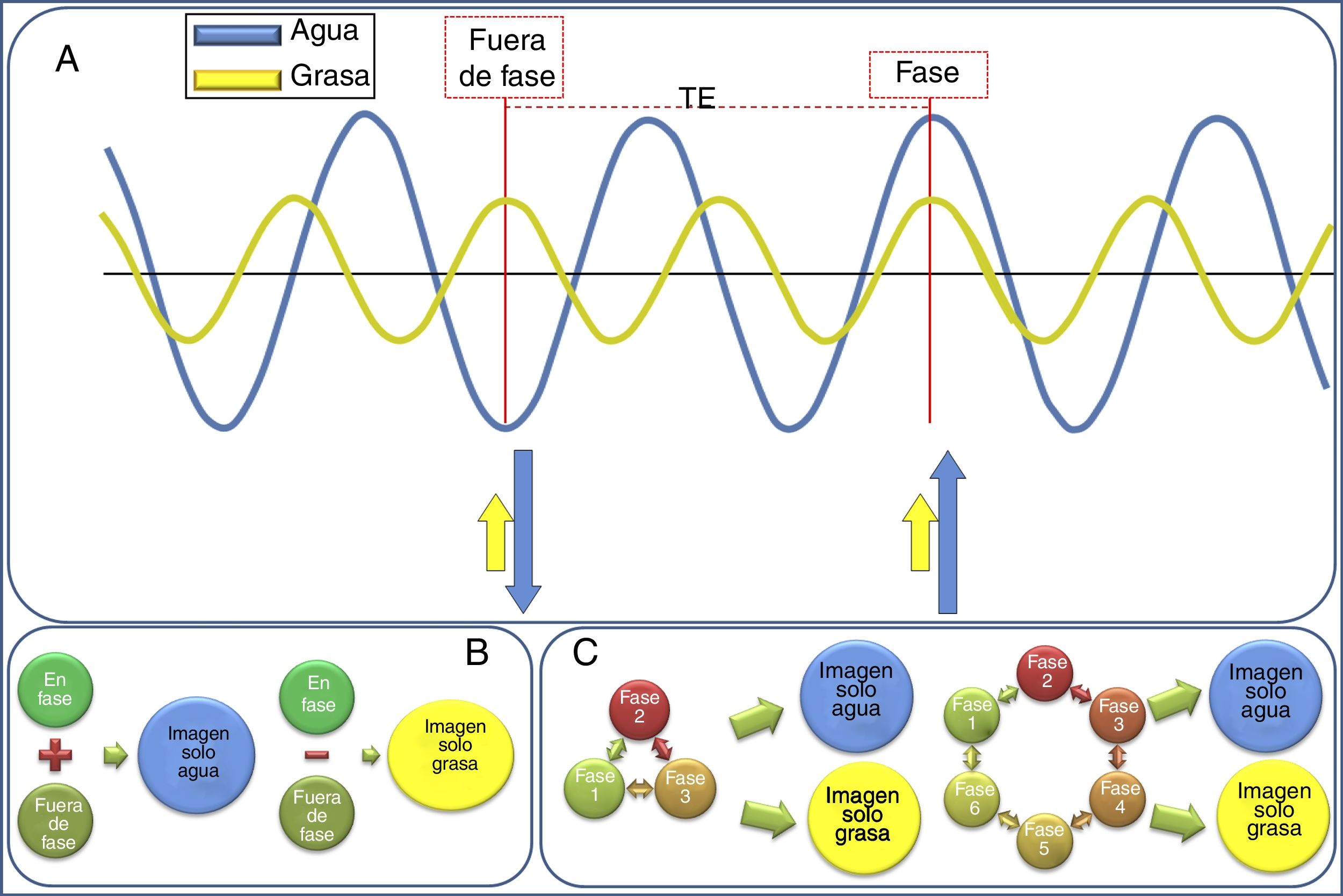
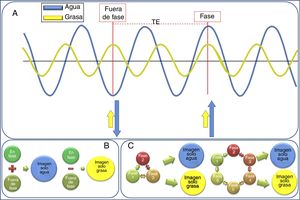
Su fundamento físico se basa en que la frecuencia con la que precesan los protones del agua y de la grasa es diferente, es lo que se conoce como desplazamiento químico8, y por tanto sus vectores de magnetización rotan uno con respecto al otro entre la excitación y la adquisición, estando alternativamente “en fase” (apuntando en la misma dirección) y “fuera de fase” (apuntando en direcciones contrarias)9. Por tanto, los datos se adquieren con un determinado tiempo de eco (TE), teniendo en cuenta el intervalo teórico que existe de precesión entre los protones de agua y de grasa (fig. 1). En el Dixon de dos puntos descrito inicialmente7 se hace una adquisición en el TE, en el que los protones del agua y de la grasa están en fase (y se obtiene así la llamada “señal en fase”, que es la equivalente a una adquisición convencional), y otra adquisición en el TE en el que los protones del agua y de la grasa están fuera de fase (llamada “señal fuera de fase”), con una diferencia de TE entre estos dos estados, fase y fuera de fase, de 2,2ms en equipos de 1,5 T (es decir, los TE fuera de fase se dan a los 2,2ms, 6,6ms, etc., y los TE en fase cada 4,4ms, 8,8ms, etc.) y 1,1ms en 3T9.
Esquema de las bases físicas de la adquisición Dixon. A) Los protones del agua y de la grasa tienen una frecuencia de precesión diferente: es el llamado “desplazamiento químico”. Esto hace que periódicamente sus protones estén en fases completamente diferentes: pueden estar en fase (momento en el que ambos están juntos) y fuera de fase (en el momento en el que están exactamente al revés, aproximadamente cada 2,4ms a 1,5 T y cada 1,1ms en 3T). Se puede aprovechar este comportamiento para diferenciar la seña que viene de los protones del agua de los de la grasa. B) La descripción original de Dixon hacía esta diferencia teniendo en cuenta únicamente dos TE, el de fase y el de fuera de fase. C) Sin embargo, han ido surgiendo mejoras a esta técnica para reducir los problemas de inhomogeneidades del campo, y han ido surgiendo las técnicas Dixon de 3, 4 y 6 fases.
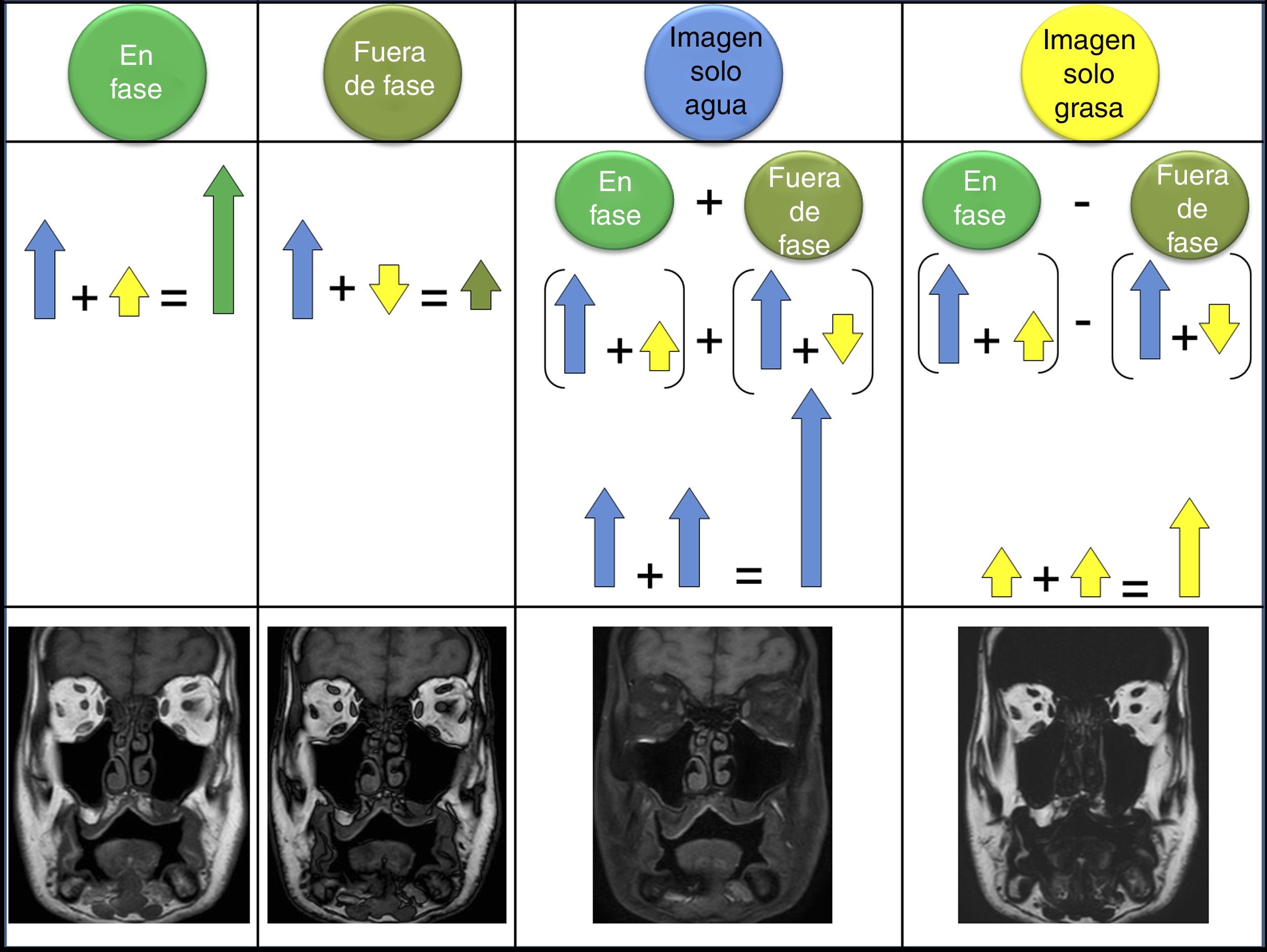
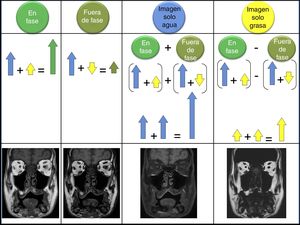
Posteriormente se pueden combinar estas dos adquisiciones para obtener una imagen “agua” haciendo la media de la suma de la señal en fase y la señal en fuera de fase (donde el agua tiene señal, pero la grasa no, y por tanto es equivalente a una supresión grasa) y una imagen “grasa” que se obtiene haciendo la media entre la resta de la señal en fase y la señal en fuera de fase, donde muestra señal solo la grasa, pero no el agua8 (fig. 2).
Cuando se hace una adquisición Dixon se pueden posprocesar y reconstruir automáticamente cuatro series de imágenes. Las imágenes en fase se forman sumando la señal del agua y de la grasa, con lo que se obtiene una imagen que se corresponde con una adquisición tradicional (en este ejemplo un T1). Las imágenes en fuera de fase se adquieren cuando los protones del agua y de la grasa están exactamente en la fase contraria. La imagen solo agua se obtiene tras restar a la imagen en fase la imagen en fuera de fase; esto hace que la grasa se quede sin señal y solo se va el agua, dando por tanto una imagen de supresión grasa. La imagen solo grasa es el resultado de restar a la fase la imagen fuera de fase, y por tanto el agua no tiene señal, se anula, y solo hay señal de la grasa.
Esta forma de adquirir es sencilla, pero exige que el campo sea muy homogéneo4, motivo por el cual se desarrollaron las técnicas Dixon de 3, 4 y 6 puntos (fig. 1), con adquisiciones a diferentes TE10,11.
La secuencia Dixon se puede adquirir en T1, T2 y DP y con diferentes técnicas (spin eco y eco de gradiente). Además, se puede utilizar tras la administración de contrastes basados en gadolinio, lo que permite optimizar la visualización de las lesiones, especialmente en las imágenes de “solo agua” (las imágenes de supresión grasa)9.
La utilización de estas secuencias en la patología tumoral de cabeza y cuello tiene varias ventajas. Por una parte, la gran ventaja ya comentada de que en una única adquisición se obtienen cuatro mapas: la fase que es similar a una secuencia convencional (T1, T2 o PD); la fase opuesta, que delimita e identifica la grasa microscópica y la muestra como una caída de señal; la imagen solo agua, que es una secuencia de supresión grasa8, y la imagen solo grasa, con la que de momento no se ha descrito ninguna aplicación en patología tumoral de cabeza y cuello. Adquirir una secuencia Dixon lleva algo más de tiempo que una secuencia convencional o que adquirir una secuencia con una supresión grasa STIR o SPIR, pero dado que en una única adquisición se obtienen estas cuatro series de imágenes en su conjunto, es una estrategia que significativamente ahorra tiempo. Sin embargo, hay que tener en cuenta que si el paciente se mueve durante la adquisición este artefacto de movimiento se propagaría a las cuatro series de imágenes derivadas de esta adquisición.
Las secuencias Dixon con tres o más puntos son poco sensibles a las inhomogeneidades del campo magnético, tanto B0 como B1, y esto hace que en la imagen “solo agua” la supresión grasa sea más homogénea que con las otras secuencias8. Esto adquiere una especial importancia en la proximidad de los implantes metálicos que con elevada frecuencia hay en la región de la boca en los estudios de cabeza y cuello. Además, la secuencia en fase está formada por la suma de la señal del agua y de la grasa, y por tanto tiene más señal, lo que da como resultado una imagen de mayor calidad. Y aunque en cabeza y cuello todavía no se ha descrito su utilidad, se puede cuantificar el contenido de grasa.
La tabla 1 resume las principales ventajas técnicas y clínicas de la aplicación de las secuencias Dixon en cabeza y cuello.
Principales ventajas técnicas y clínicas de la aplicación de las secuencias Dixon en cabeza y cuello
| • En una única adquisición se obtienen cuatro series de imágenes, lo que supone un ahorro de tiempo: • Imagen en fase: equivale a la secuencia convencional (T1, T2 o DP) • Imagen fuera de fase: delimita e identifica la grasa microscópica y la muestra como una caída de señal • Imagen solo agua: suprime la señal de la grasa • Imagen solo grasa: suprime la señal del agua |
| • La imagen en fase, al estar formada por la suma de la grasa y el agua, tiene más señal |
| • La supresión de la grasa es más robusta, con menos artefactos |
| • Es menos sensible a las inhomogeneidades del campo magnético B0 y B1 (fundamentalmente las secuencias Dixon de 3, 4 y 6 puntos) y por tanto tiene menos artefacto metálico |
| • Puede adquirirse con todo tipo de secuencias (eco de gradiente y spin eco) y en diferentes potenciaciones (T1, T2 y DP) y se pueden utilizar tras la administración de contrastes de gadolinio |
Las secuencias potenciadas en difusión (Diffusion Weighted Imaging, DWI) han sido ampliamente utilizadas en la última década para la valoración de las lesiones de cabeza y cuello12–14. La capacidad de dichas secuencias para detectar el grado de movimiento de las moléculas de agua en los tejidos biológicos, permitiendo obtener en un solo estudio información anatómica y funcional, las ha situado como herramienta de primera línea en la valoración de los estudios de cabeza y cuello. Los estudios de DWI en cabeza y cuello han demostrado su capacidad para diferenciar entre lesiones benignas y malignas, detectar lesiones (especialmente en el caso de las adenopatías metastásicas)15,16, discriminar entre distintos subtipos celulares o incluso para predecir respuesta a tratamiento o monitorizar el mismo17–19.
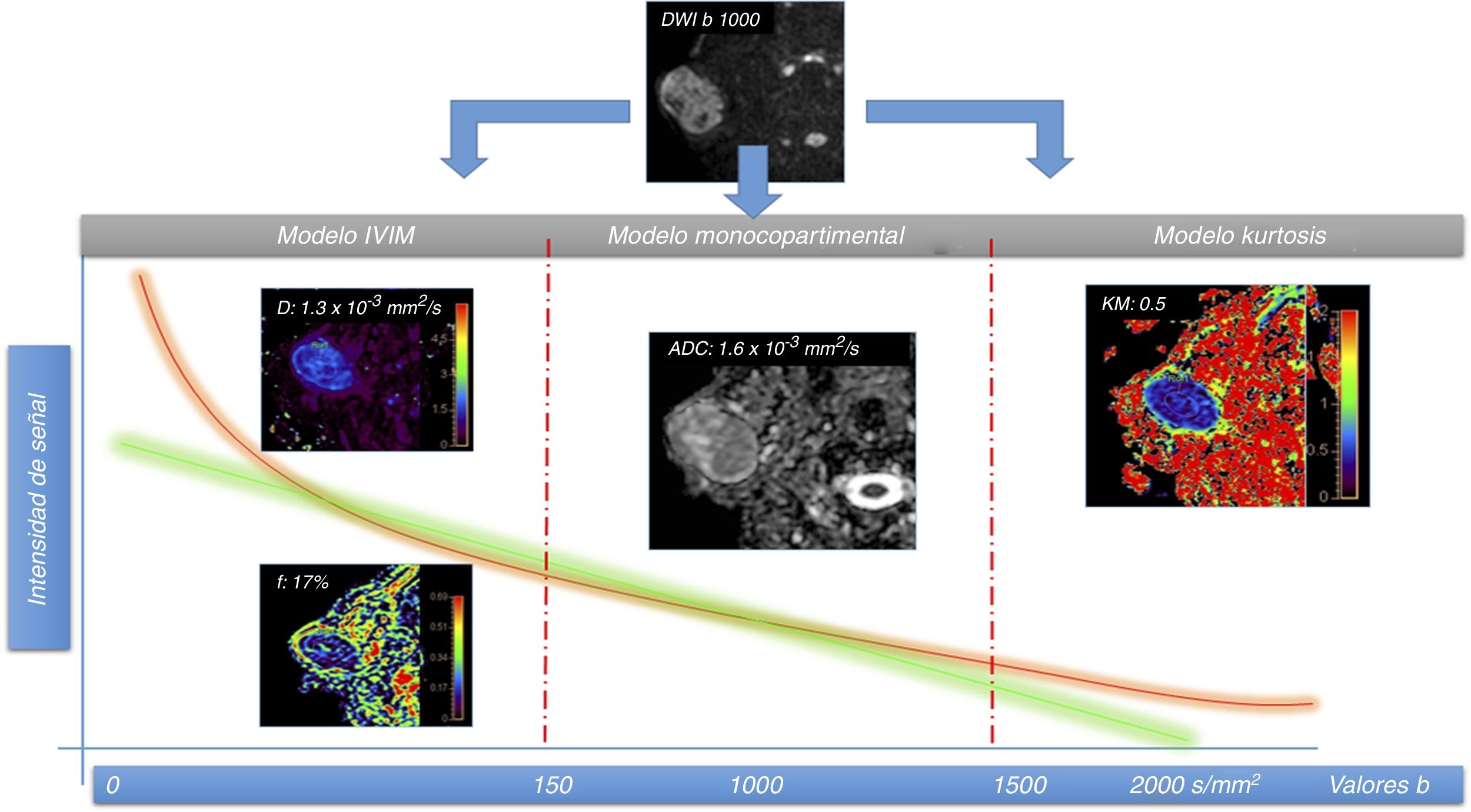
El modelo clásico de análisis de DWI considera solamente la existencia de un compartimento, el extracelular. La propia fisiopatología de las lesiones tumorales cervicales requiere de una mayor complejidad de estos modelos de análisis para acercarse más a la realidad de estas. Por este motivo se están aplicando nuevos modelos avanzados de análisis de la difusión que consideran la existencia de otros compartimentos distintos al extracelular para aproximarse de una manera más exacta al proceso de difusión del agua en los tejidos20. Estas nuevas aproximaciones son el modelo del movimiento incoherente intravóxel (IVIM en inglés) y el análisis de la curtosis.
Modelo IVIMEl modelo IVIM considera la existencia de dos espacios: el extracelular y el intravascular. Para su aplicación se deben adquirir múltiples valores de b por debajo de 150 mm2/s con el fin de poder diferenciar entre la contribución a la difusión del movimiento de las moléculas de agua en el interior de la red capilar (seudodifusión) y la difusión verdadera de las moléculas de agua en el compartimento extracelular (por encima de 150 mm2/s)21. Este modelo permite valorar la verdadera restricción de la difusión de las lesiones (evitando el efecto de la seudodifusión de la red capilar, que tiende a elevar los valores de coeficiente de difusión aparente) a través del parámetro D (difusión verdadera). Este modelo permite, con la misma adquisición, estimar la perfusión de los tejidos incluyendo solo los valores b por debajo de 150 mm2/s, a través de la fracción de perfusión (f) y del coeficiente de seudodifusión (D*), sin necesidad de contraste intravenoso22,23. En un futuro, el modelo IVIM permitirá disminuir o evitar el uso de gadolinio en pacientes para control de lesiones conocidas o cambios postratamiento, asunto de relevancia dadas las recientes recomendaciones de la agencia europea del medicamento en relación con el depósito de gadolinio en el sistema nervioso central24.
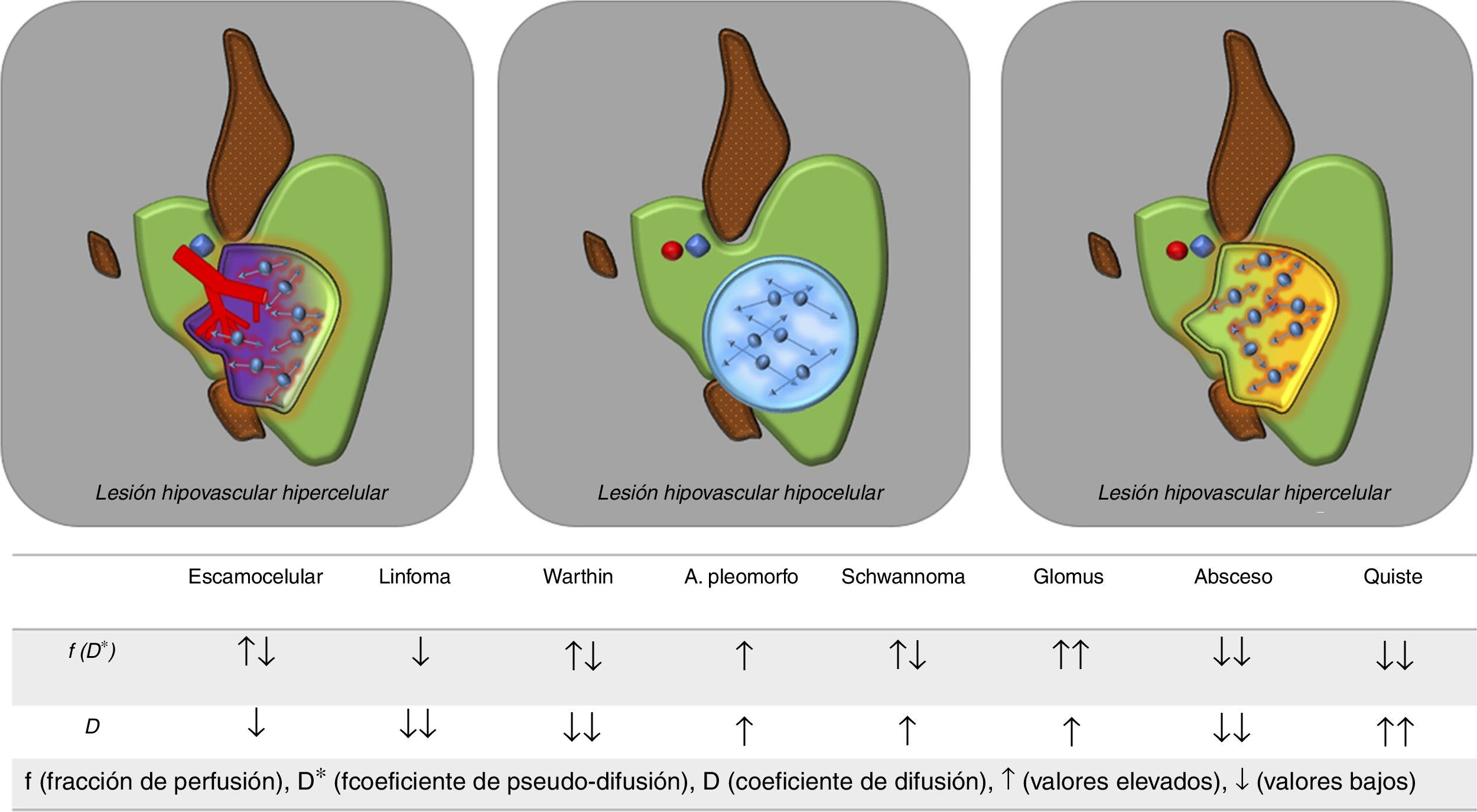
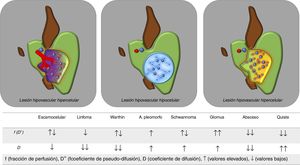
En ocasiones, la influencia del componente vascular sobre el coeficiente de difusión aparente (ADC) de una determinada lesión cervical puede inducir a error y clasificarla incorrectamente como benigna. Con el uso del modelo IVIM, la probabilidad de cometer falsos negativos disminuye e incluso permite diferenciar con mayor precisión entre distintos subtipos celulares, tanto en los tumores primarios como en adenopatías. Por ejemplo, los tumores escamocelulares suelen presentar valores más elevados de D (debido principalmente a la existencia de mayores cambios necrótico-quísticos en su interior) que los linfomas, cuyos valores de D son menores22. Dicha distinción también se ha aplicado para la diferenciación entre lesiones parotídeas tipo adenoma pleomorfo y tumor de Warthin25,26 (fig. 3).
Utilidad del modelo IVIM para el diagnóstico diferencial de lesiones en cabeza y cuello. El modelo IVIM permite una adecuada valoración de la naturaleza de las lesiones en cabeza y cuello sin necesidad de usar contraste intravenoso. Aquellas lesiones tumorales sólidas, hipercelulares y que muestren aumento en su vascularización presentarán valores bajos de D (más bajos que sus correspondientes valores de ADC) y valores elevados de f. Las lesiones quísticas puras presentarán valores muy bajos de f, al ser hipovasculares y elevados de D (similares a los de ADC al no tener componente de perfusión asociado). Las lesiones sólidas con escasa vascularización mostrarán valores bajos de D y también de f, como puede ser el caso de los linfomas. La tabla inferior recoge el comportamiento esperable de los principales tipos de lesiones de cabeza y cuello en función del modelo IVIM.
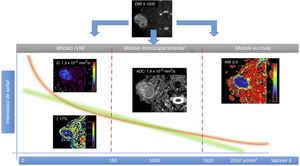
El modelo basado en la curtosis considera la existencia de un tercer compartimento, aquel en el que las moléculas de agua interaccionan con las membranas celulares (agua ligada a membranas). Se ha demostrado que dicha interacción sigue un movimiento no gaussiano20. Para poder estimar dicho movimiento, es necesario adquirir valores de b por encima de 2.000 mm2/s, con el fin de determinar el nivel de interacción de las moléculas de agua con las membranas celulares27.
El principal parámetro derivado del análisis mediante curtosis es la curtosis media (KM), que se ha relacionado con la heterogeneidad de los tejidos. Cuanto más heterogéneos sean los tejidos, más se alejará su distribución de la normal (gaussiana) y los valores de curtosis serán mayores27. El valor añadido de este tipo de análisis reside en la capacidad de caracterizar los tejidos tumorales más allá de la existencia de restricción de la difusión en su interior. Se ha demostrado que, a igualdad de grado de restricción de la difusión en determinadas lesiones, la curtosis permite discriminar entre dichas lesiones en función del grado de heterogeneidad de estas28. De esta forma, lesiones más agresivas, con mayor índice de mitosis, presencia de necrosis, neoangiogénesis, etc., mostrarán valores más elevados de KM con respecto a lesiones tumorales de menor agresividad (fig. 4).
Paciente varón de 51 años con masa parotídea derecha a estudio y diagnóstico histológico de adenoma pleomorfo. Se realizó estudio de resonancia magnética con difusión utilizando múltiples valores de b para valoración de modelo IVIM y curtosis. Existen dos tipos de curvas de caída de la intensidad de señal: la verde que sigue el modelo monocompartimental con caída de la señal entre dos puntos (2 valores b) y la naranja, obtenida a partir de múltiples valores b, que se ajusta más a las características biológicas de los tejidos especialmente en sus dos extremos. La primera parte (izquierda) de la caída de la curva refleja el desfase de las moléculas debido al componente de seudodifusión (difusión en el interior de la red capilar), apreciando una caída rápida por dicho componente vascular, y nos permite calcular la fracción de perfusión (f) que en esta lesión es del 17%, sin necesidad de usar contraste intravenoso. La difusión pura (D) también puede calcularse eliminando la contribución de dicho componente de seudodifusión. En la parte central de la gráfica, las curvas monocompartimental y multicompartimental se asemejan en su pendiente. En dicha parte de la curva el modelo que más se ajusta es el modelo clásico de difusión basado en el ADC. En este caso, debido al componente de seudodifusión que presenta la lesión, los valores de ADC son mayores, 1,6 × 10-3mm2/s que los de difusión pura (D), 1,3 × 10-3mm2/s. De esta forma, el modelo IVIM permite ajustarse más a la difusión real de las lesiones. En la parte derecha de la curva, el modelo basado en la estimación de la curtosis es el más apropiado, ya que permite valorar la interacción de las moléculas de agua con las membranas celulares usando valores de b elevados (normalmente por encima de 1.500-2.000 mm2/s. En este caso, al tratarse de una lesión benigna, los valores de KM no se encuentran realmente elevados (0,5), es decir, no se alejan demasiado de la distribución normal, lo que refleja la escasa heterogeneidad de dicha lesión.
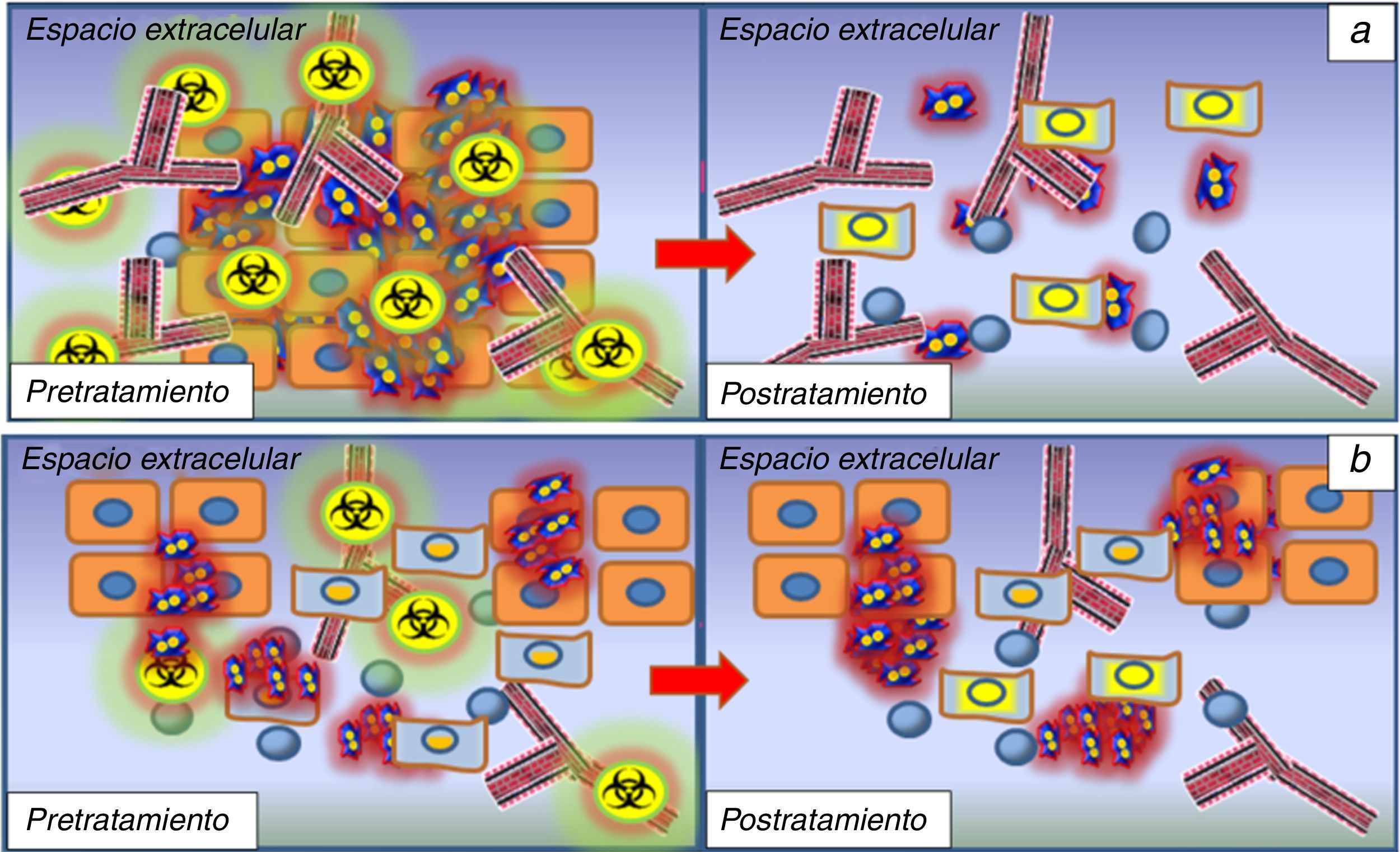
Otra de las potenciales utilidades de dichos modelos reside en su capacidad para predecir la respuesta al tratamiento de las lesiones que vayan a ser sometidas a quimio/radioterapia. Estudios recientes han demostrado que aquellos tumores con valores más bajos de D tendrán una mejor respuesta al tratamiento de quimio/radioterapia que aquellos con valores basales de D más elevados29,30. Esto se debe a que, debido a la existencia de un menor espacio extracelular, la distribución de la quimioterapia será más eficiente sobre las células malignas que en aquellos tumores con valores D altos en los que predomine la necrosis. De igual forma, los tumores con valores de f o D* más elevados, lo que se relaciona con mayor neoangiogénesis, también mostrarán mejor respuesta tanto a quimio como a radioterapia gracias a una mejor distribución de la quimioterapia y una mayor oxigenación tisular que hará que dichos tejidos sean más radiosensibles30 (fig. 5).
Predicción y monitorización de respuesta al tratamiento en tumores de cabeza y cuello. 1a) las lesiones hipercelulares suelen asociar con un mayor grado de neoangiogénesis debido a la expresión de factores de crecimiento endotelial para mantener el aporte de oxígeno y nutrientes que requiere la proliferación celular. Estas lesiones mostrarán, pues, valores bajos de D y elevados de f según el modelo IVIM. Este tipo de lesiones tendrán una mejor respuesta al tratamiento de quimioterapia, ya que el agente citotóxico se distribuirá de una manera más eficiente en el lecho tumoral gracias a la angiogénesis asociada. De igual forma, dichas lesiones serán más sensibles a la radioterapia al estar mejor oxigenadas. Tras los primeros ciclos de quimio/radioterapia, estas lesiones experimentarán cambios con incremento progresivo en los valores de D debido al incremento del espacio extracelular por necrosis/muerte celular; de esta forma se puede monitorizar de una manera precoz la respuesta al tratamiento. 1b) las lesiones que muestren valores altos de D y bajos de f antes del inicio del tratamiento son lesiones que responderán peor a la quimio y a la radioterapia debido a la existencia de áreas necróticas hipovasculares en su interior que harán poco efectiva la acción de dichos agentes terapéuticos y su predicción de respuesta a estos será pobre. De igual forma, la ausencia de un incremento significativo en los valores de D en la fase de monitorización tras los primeros ciclos de tratamiento será indicativo de una escasa respuesta al tratamiento, por lo que deberá plantearse un cambio en la línea terapéutica.
Estos modelos avanzados también están permitiendo monitorizar la respuesta al tratamiento de una forma precoz, basándose en la variación de valores tales como D o KM y de sus histogramas tras la introducción del tratamiento31. Lesiones que experimenten incremento en los valores de D (con desplazamiento hacia la derecha de la curva del histograma) tras los primeros ciclos de quimioterapia serán consideradas como respondedoras al tratamiento frente a aquellas que no experimenten variación significativa de estos valores32. Dichos cambios en los parámetros de difusión tienen lugar antes que los cambios morfológicos, lo cual supone un valor añadido como marcador precoz de respuesta terapéutica33 (fig. 6).
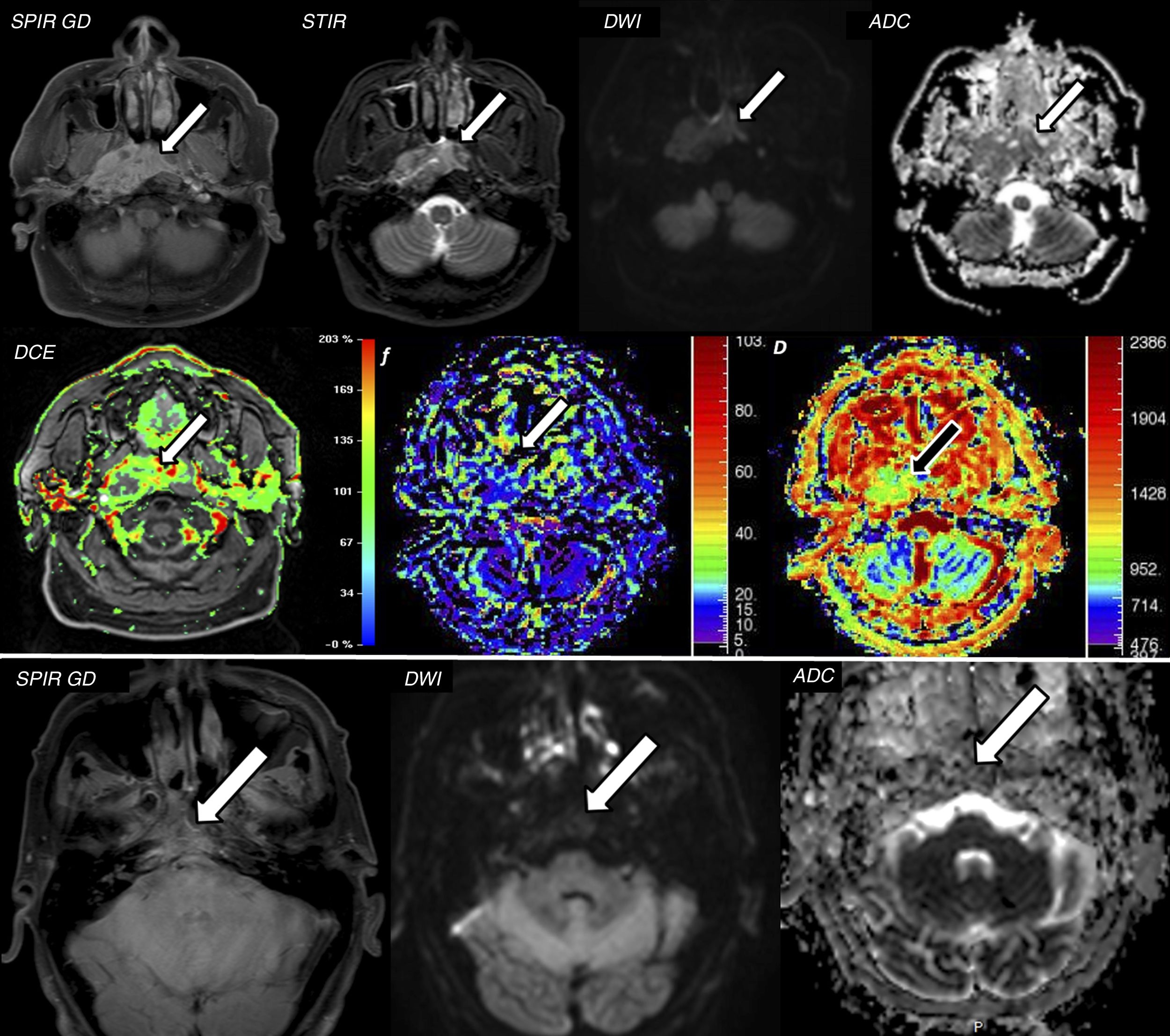
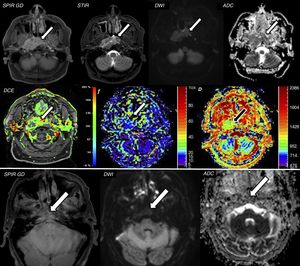
Varón de 56 años que acude para valoración de molestias en cavum. A) El estudio de resonancia magnética (RM) muestra masa infiltrativa en cavum nasofaríngeo con intenso realce tras la administración de contraste en las imágenes axiales T1 SPIR con contraste y STIR (flechas). Dicha lesión presenta marcada restricción de la difusión con valores de ADC de 1,1 × 10-3 mm2/s, compatible con carcinoma escamocelular de cavum (confirmado con biopsia). Se realizó análisis según modelo IVIM de dicha lesión que mostró valores altos de f (de hasta el 30%, con adecuada correlación con el estudio de perfusión DCE) y valores de D de 0,8 × 10-3 mm2/s, más bajos que el ADC, debido a la eliminación del componente de perfusión (seudodifusión) asociado. Dichos hallazgos sugerían una adecuada predicción de respuesta al tratamiento. B) 2 meses tras el inicio de la quimio/radioterapia, se realizó nueva RM que confirmó una muy importante respuesta al tratamiento con marcada reducción de la masa tumoral y del componente captante en la imagen axial T1 SPIR con contraste (flecha) y una menor restricción de la difusión con valores ADC de 1,9 × 10-3mm2/s.
El uso de estos modelos de análisis avanzados de la difusión no está exento de algunos inconvenientes, ya que para su aplicación es necesario adquirir múltiples valores b, lo que conlleva un mayor tiempo de exploración con los consecuentes artefactos por movimiento inherentes a esta localización anatómica (respiratorios, deglutorios o de pulsatilidad). La ausencia de estandarización, tanto en la fase de adquisición (número y valores de b adquiridos) como de posproceso, para lo que se necesita software específico no siempre disponible o validado para uso clínico, supone otro gran reto para la implementación en la práctica radiológica diaria. Son necesarios más estudios con correlación histopatológica para una validación óptima de estos modelos de análisis. La tabla 2 resumen los principales inconvenientes en la adquisición y análisis de dichos modelos avanzados en cabeza y cuello.
Limitaciones de la técnica de difusión en los estudios de cabeza y cuello
| • Falta de estandarización protocolos de adquisición (número y valores b) |
| • Falta de estandarización en posproceso y análisis (accesibilidad a software) |
| • Escasos estudios con correlación histopatológica |
| • Reproducibilidad de resultados y validación de parámetros derivados como biomarcadores |
| • Tiempo de adquisición prolongado (ligado a mayor número de valores b) |
| • Artefactos por movimiento en cabeza y cuello (deglución, respiración, pulsatilidad) |
La definición fisiológica de la perfusión hace referencia al estado estacionario de liberación de nutrientes y oxígeno por vía sanguínea por unidad de volumen y masa (ml de sangre/100g de tejido/min)34. La estimación de la perfusión con RM se basa en la realización de múltiples adquisiciones de alta resolución temporal antes, durante y tras la administración de un bolo de contraste35.
Tipos de perfusiónExisten dos tipos principales de perfusión, que se clasifican según el medio de contraste utilizado: exógeno o endógeno. La perfusión que utiliza un medio de contraste exógeno se basa en administrar un medio de contraste basado en gadolinio y analiza los efectos de susceptibilidad o de relajatividad de la señal en los tejidos tras su administración: perfusión con susceptibilidad al contraste (dynamic susceptibility contrast o DSC, utilizando secuencias eco-planares potenciadas en T2*) y perfusión dinámica con contraste (dynamic contrast enhanced o DCE, utilizando secuencias eco de gradiente potenciadas en T1), respectivamente. En la perfusión que utiliza un contraste endógeno se marca magnéticamente el agua de la sangre arterial o etiquetado de los espines arteriales (arterial spin labeling, ASL)36.
La DCE y en mucha menor medida la ASL son las técnicas de perfusión utilizadas para la evaluación de los tumores de cabeza y cuello.
La DCE habitualmente emplea secuencias eco de gradiente 3D T1. Para realizar los cálculos hay que disponer de los valores T1 basales utilizando distintos flip angle (habitualmente 2.° y 15.°, aunque depende de los vendedores, el llamado T1 mapping). Con el paso del bolo de contraste, se detecta un aumento de la señal tisular cuando el contraste alcanza el espacio extravascular. Esta perfusión no debe confundirse con los estudios “dinámicos multifase” con más resolución espacial que temporal y que disponen de apenas 6-9 fases en unos 5-7 minutos35.
Las curvas de intensidad-tiempo obtenidas en la perfusión DCE pueden analizarse aplicando dos métodos: el semicuantitativo y el cuantitativo.
El método semicuantitativo clasifica la morfología de la curva de intensidad de señal según su realce inicial (primeros 120 s) en realce rápido, medio o lento, y realce postinicial o tardío más allá de los 120 s como persistente, plateau o lavado.
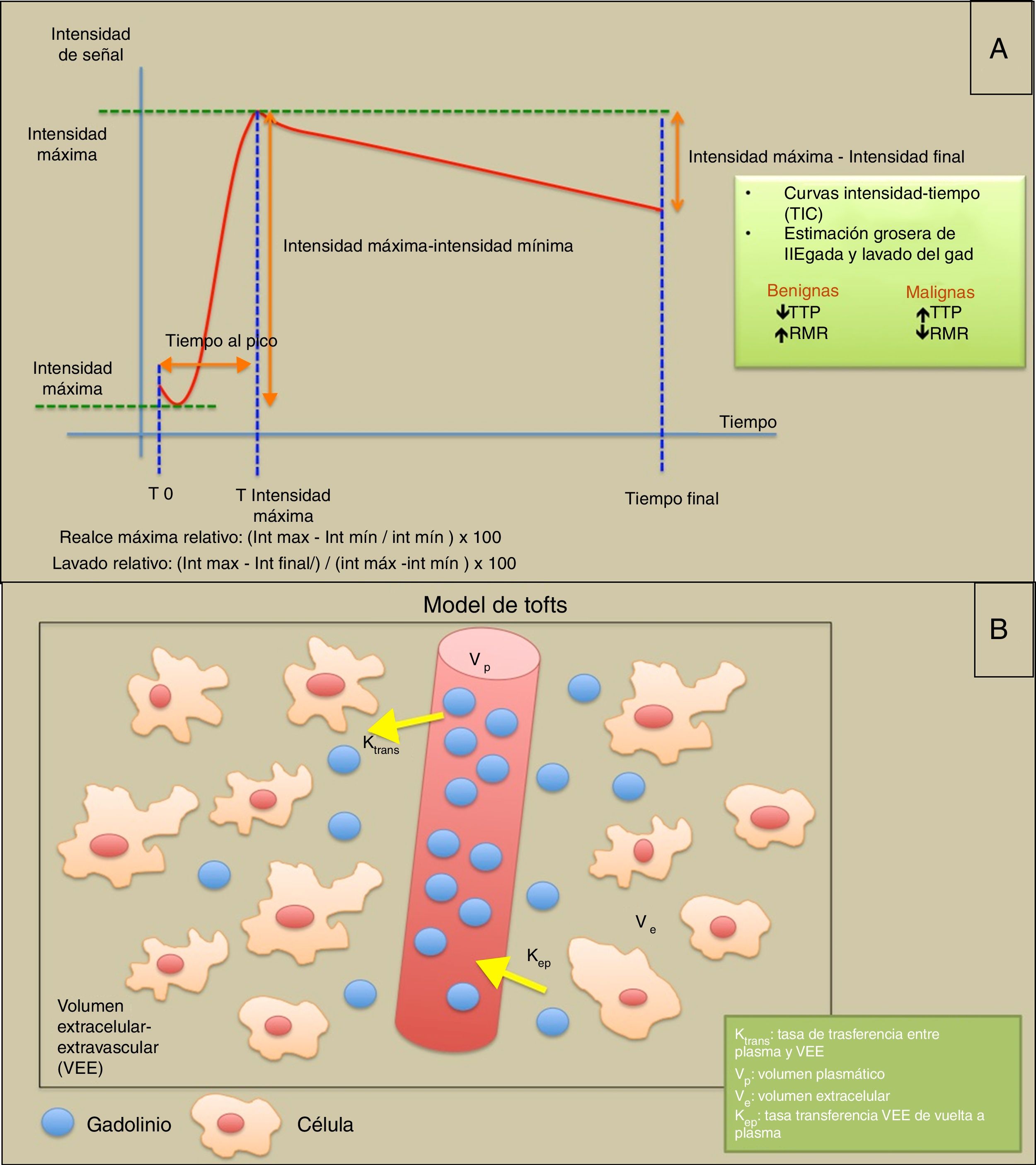
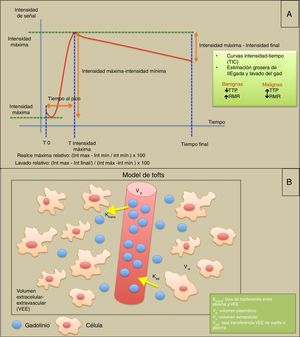
El método cuantitativo se basa en la microangioarquitectura del tumor (permeabilidad endotelial, distribución en los espacios extravascular-extracelular e intravascular). Para ello se aplica habitualmente el modelo farmacocinético “bicompartimental” de Tofts, que se basa en la “permeabilidad” de los capilares y de cómo difunden las moléculas de gadolinio. Se obtienen los parámetros de Ktrans (tasa de transferencia del compartimento intravascular al extravascular-extracelular); Kep, tasa de transferencia desde el espacio extravascular-extracelular a los vasos (conceptualmente el inverso al Ktrans); Vp, o volumen del plasma dentro del vóxel, y Ve o volumen extravascular-extracelular en el volumen del vóxel37. Para estimar adecuadamente la perfusión, es necesario obtener la arterial input fraction o AIF, que se puede obtener mediante un área de interés (ROI) en una arteria de aporte y, además, sirve para comprobar la embolada y el lavado, y valorar la calidad del estudio de perfusión38 (fig. 7).
Modelos de abordaje de la perfusión T1 DCE: A) Análisis semicuantitativo en el que el análisis de las curvas de intensidad-tiempo permite conocer parámetros como el tiempo al pico (TTP), realce máximo relativo (RMR) y lavado relativo. El área bajo la curva (AUC) es el área por debajo de la curva dinámica de intensidad del gadolinio. B) Diagrama que ilustra el modelo “bicompartimental” de Tofts para una valoración cuantitativa de la permeabilidad, donde se contempla un compartimento intravascular y otro extravascular-extracelular. Dependiendo de la “permeabilidad” de los capilares y la microvasculatura, las moléculas de gadolinio difunden al espacio extravascular-extracelular con una tasa de transferencia (Ktrans). Si el estudio se alarga el tiempo suficiente (5min) se podrán estimar parámetros como el Kep (conceptualmente inverso al Ktrans) o tasa de vuelta de algunas moléculas de gadolinio al compatimento intravascular.
En la tabla 3 se resumen los distintos parámetros necesarios para la obtención de un estudio de perfusión T1 y aplicar el modelo bicompartimental para la obtención de los parámetros de permeabilidad.
Resumen de los distintos parámetros necesarios para la obtención de un estudio de perfusión T1 y aplicar el modelo bicompartimental para la obtención de los parámetros de permeabilidad
| Parámetros | Requisitos recomendados |
|---|---|
| Antena | Antena neurovascular de 16 a 32 canales |
| Imagen en paralelo | SENSE/iPAT/ASSET |
| T1 MAPPING (flip angles) | 2.o, 10.o, 15.o, 20.o, 30.o |
| Vóxel | 1 × 1 × 1-3 mm |
| Espesor de corte | 1-3 mm |
| Resolución temporal | Recomendado < 6 s por fase |
| Tiempo total T1 mapping | Variable, menor de 2 min |
| Tiempo total de adquisición de todos los dinámicos | 5-6 min |
| Saturación grasa | No |
| Inyección de contraste | Flujo de 5 ml/s seguido de lavado de 20ml de suero salino |
Muchos autores han evaluado la potencial utilidad de la perfusión DCE para la diferenciación entre la patología benigna y la maligna en la región de la cabeza y cuello.
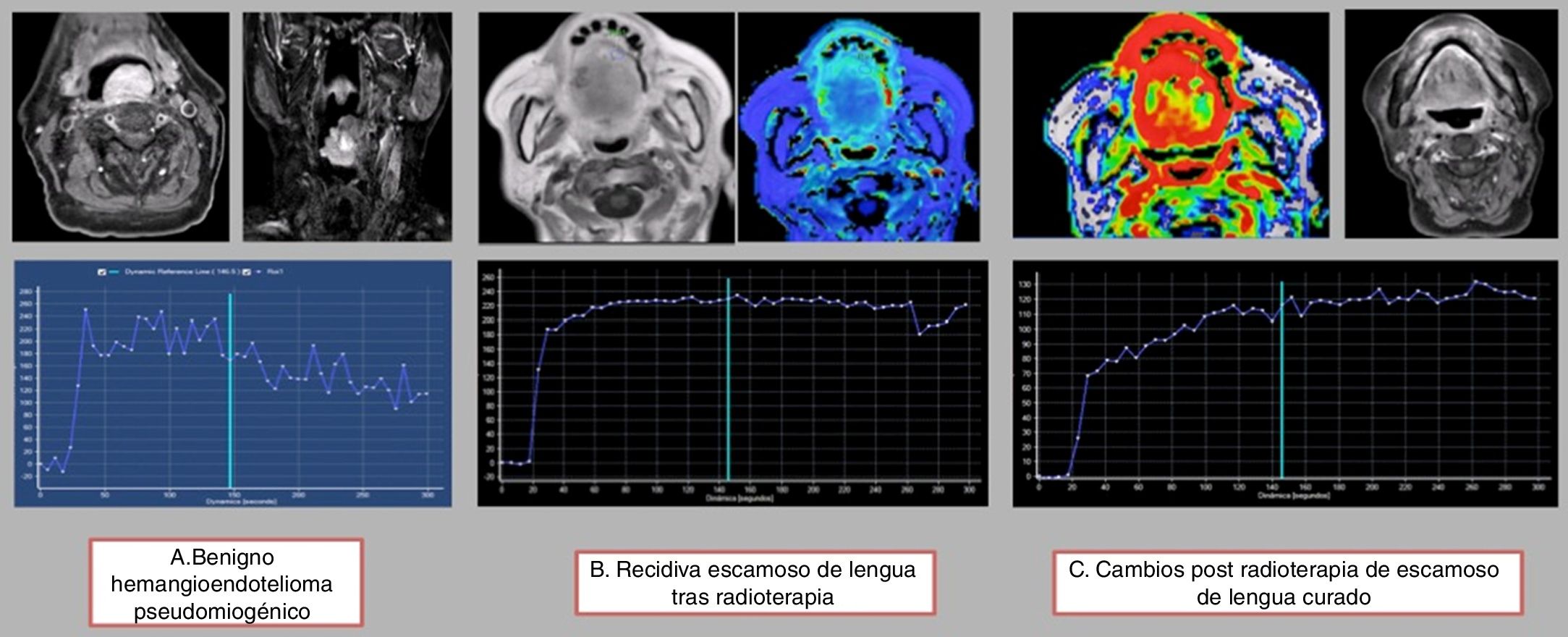
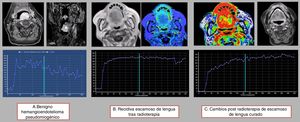
Utilizando una valoración semicuantitativa de las curvas intensidad-tiempo39, se han establecido cuatro tipos de curvas hemodinámicas “arquetípicas” en la patología de cabeza y cuello: lesiones benignas con un tiempo al pico (time to peak, TTP) muy corto y un lavado rápido con ángulo agudo; lesión maligna sin tratamiento de radioterapia con un TTP largo (más allá de 120 s) y un lavado más lento; lesiones malignas recurrentes posradioterapia con un TTP algo más lento y un lavado lento y ligero, y cambios posradioterapia con un TTP muy retrasado y sin lavado (fig. 8). El solapamiento y la dificultad para diferenciar entre las curvas de lesiones malignas y lesiones recurrentes posradioterapia es evidente, y en estos casos los antecedentes y la historia clínica son esenciales. El TTP tan corto y el lavado de las lesiones benignas se ha relacionado con una circulación microvascular preservada. Los cambios posradioterapia, sin embargo, muestran un TTP muy retrasado sin lavado, lo que puede atribuirse a una anormal permeabilidad en un lecho microvascular muy alterado.
Análisis semicuantitativo de las curvas de intensidad-tiempo: A) La primera lesión corresponde a una tumoración benigna con un TTP corto menor de 120 segundos y un lavado significativo. B) La segunda lesión corresponde a una recidiva sobre radioterapia en donde apreciamos un TTP prolongado con un muy leve lavado tardío. C) La tercera imagen nos muestra los cambios posradioterapia, con un TTP muy prolongado (mayor de 120 s) sin lavado significativo.
Dado que el carcinoma escamoso es la variedad más frecuente en las lesiones malignas de la región de cabeza y cuello, numerosos grupos han intentado valorar la utilidad diagnóstica y pronóstica de los parámetros cuantitativos obtenidos mediante el modelo bicompartimental de Tofts.
El Ktrans es, de forma global, el parámetro más estudiado40. El parámetro AUC90 es el que mejor discrimina entre carcinoma escamoso y el resto de los carcinomas indiferenciados (mejor incluso que el Ktrans). Sin embargo, ni el Ktrans ni el AUC90 fueron significativos para diferenciar entre carcinoma escamoso y linfoma41.
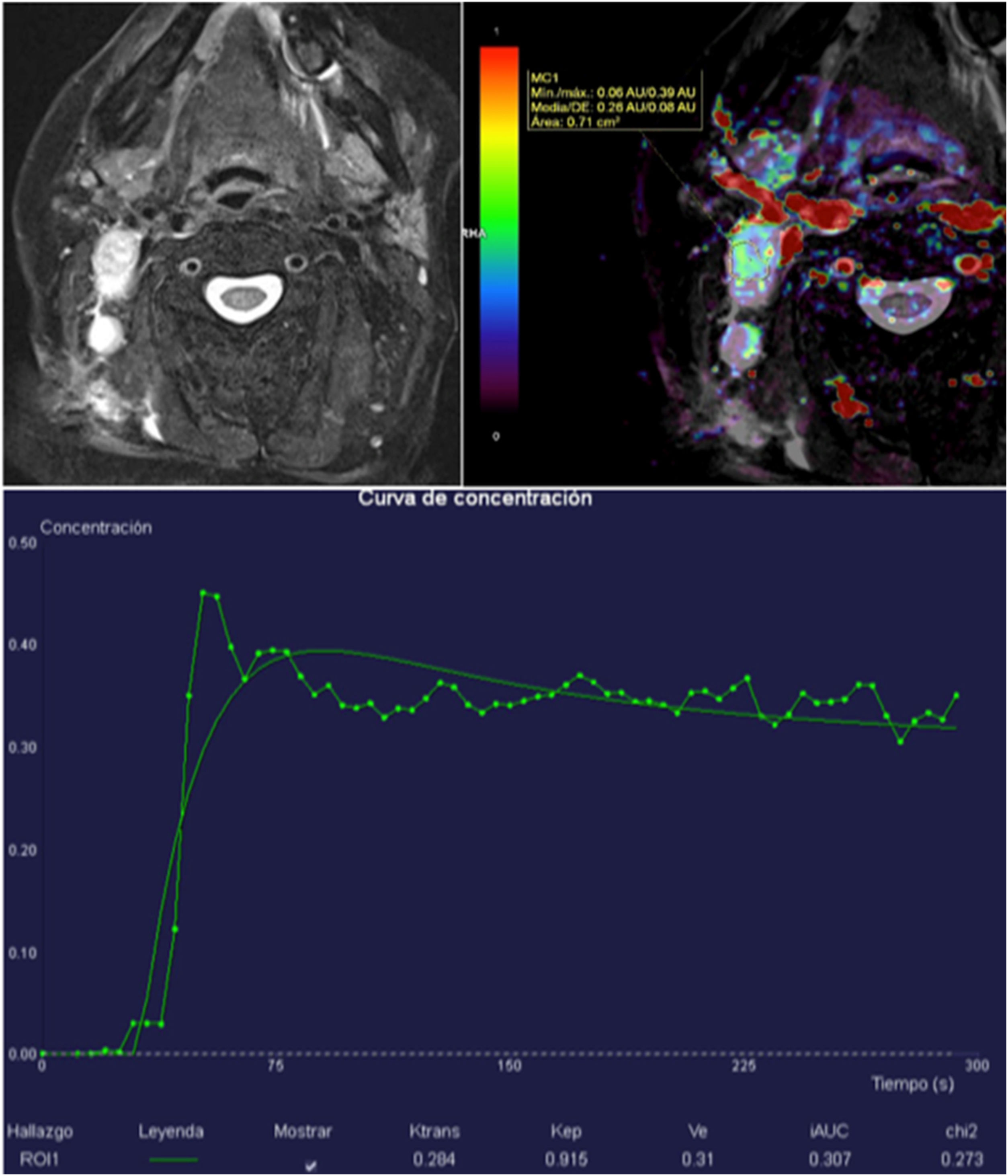
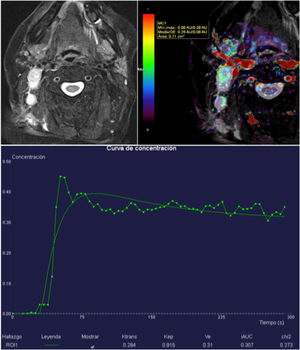
Hay una fuerte correlación entre una alta heterogeneidad del Ktrans, la supervivencia libre de enfermedad y la supervivencia global en pacientes con carcinoma escamoso de cabeza y cuello en estadio IV con metástasis ganglionares42. Un valor de Ktrans bajo antes del inicio del tratamiento, tanto en el tumor primario como en las metástasis ganglionares, se asocia con un peor pronóstico (peor respuesta al tratamiento de inducción de quimioterapia, probablemente por una menor permeabilidad que dificultará la llegada del agente quimioterápico a la lesión tumoral)43 (fig. 9). De forma inversa, un incremento en el valor del Ktrans durante el tratamiento quimioterápico se asocia a una buena respuesta al tratamiento44.
Metástasis ganglionares laterocervicales derechas de carcinoma escamoso comprobadas mediante biopsia. El mapa de Ktrans muestra un aumento de permeabilidad de predominio en la periferia de las adenopatías. En la curva intensidad-tiempo destaca un Ktrans elevado de 0,284, lo que sugiere una buena respuesta al tratamiento de quimioterapia. También puede ser útil en la monitorización del tratamiento.
Algunos autores han comparado los parámetros Kep y Ktrans con el SUV de la tomografía por emisión de positrones-tomografía computarizada (PET-TC) sin encontrar clara correlación entre ellos45. A la espera de estudios más amplios, ambas pruebas han de ser consideradas como complementarias y no como excluyentes, ya que aportan información de distintos aspectos fisiopatológicos de las lesiones tumorales de cabeza y cuello.
Asimismo, algunos autores han intentado correlacionar los parámetros de la perfusión con características histopatológicas de los tumores, especialmente el Ve y el Kep, y esto parece lógico, dado que, a mayor celularidad del tumor, menor volumen de espacio extracelular46.
Mención aparte merecen el subtipo de tumores de cabeza y cuello que se localizan en las glándulas salivales mayores y que, en combinación con las secuencias de difusión y mapas de coeficiente de difusión aparente, muestran unos comportamientos dinámicos de perfusión muy característicos. En estos tipos de tumores son útiles tanto la perfusión DCE como los estudios dinámicos multifase con cinco o más fases.
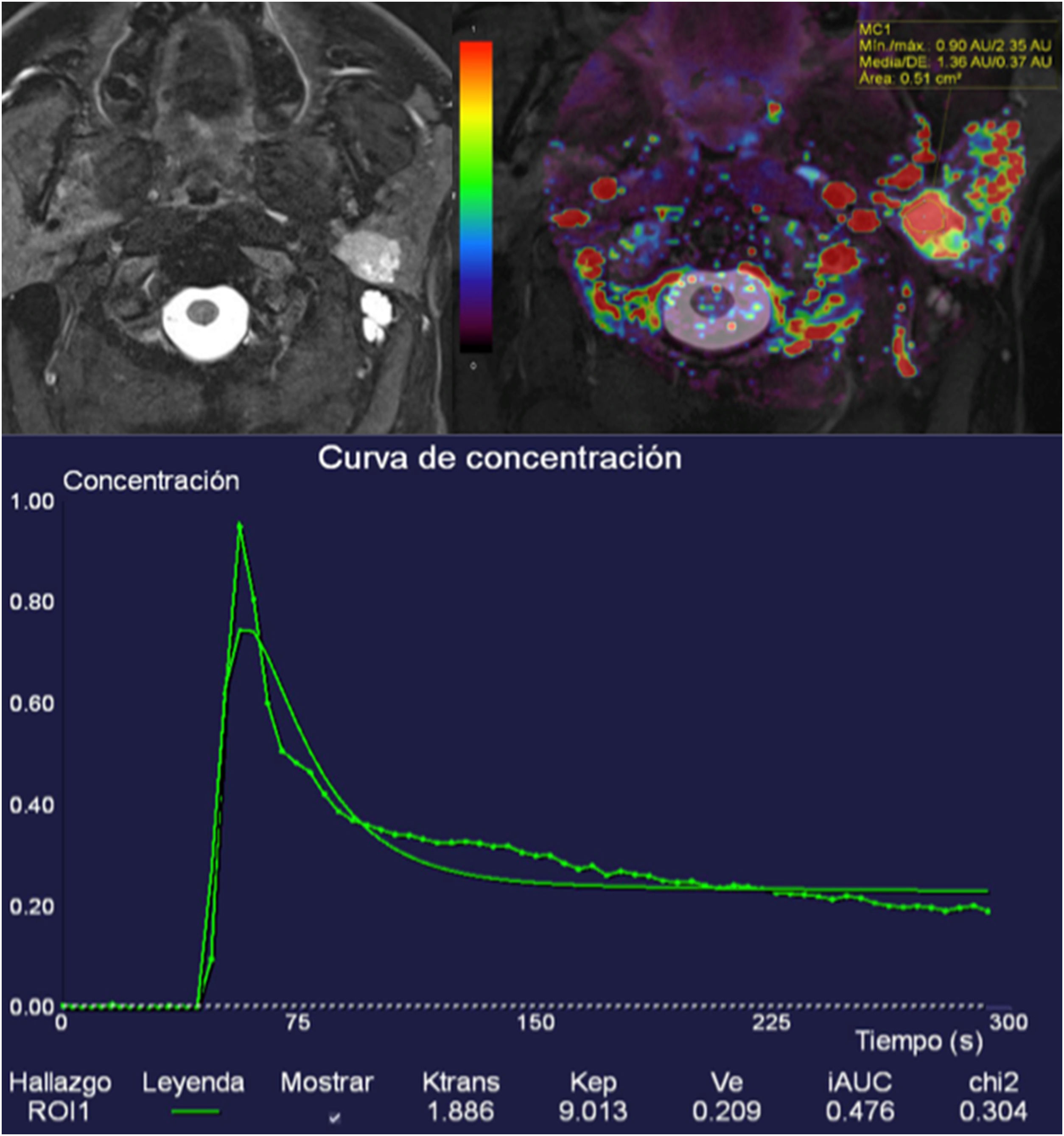
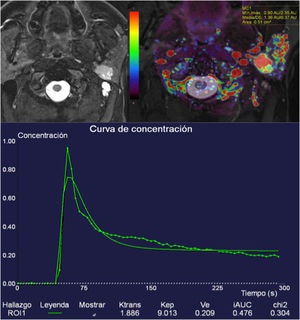
Aunque el grupo de Yabuuchi et al. fueron los primeros en describir patrones de curvas intensidad-tiempo en un ya clásico artículo47, finalmente pueden describirse cuatro tipos de morfología de curvas intensidad-tiempo: tipos I y II, características de tumores benignos, con curvas progresivas con TTP tardío, sin lavado; tipo III, con TTP menor de 120 segundos y menos del 30% de lavado, correspondientes a tumores malignos, y tipo IV con TTP menor de 120 segundos y lavado mayor del 30% (fig. 10) (tumores de Warthin y linfomas)48.
Tumor en lóbulo profundo de parótida izquierda hiperintenso y homogéneo en secuencia T2 DIXON con saturación grasa, de bordes bien definidos. La lesión mostraba unos valores muy altos de Ktrans de hasta 1,88. Un análisis semicuantitativo de la curva de perfusión T1 muestra un TTP corto de menos de 120 segundos y un intenso lavado mayor del 30% (curva tipo IV). La difusión (no incluida) mostraba valores bajos de ADC. Lesión compatible (y confirmada mediante exéresis) con tumor de Warthin.
En resumen, la perfusión T1 es una técnica avanzada que se puede implementar en la práctica clínica diaria en la evaluación de los tumores de cabeza y cuello como complemento a las secuencias morfológicas tradicionales y a las secuencias de difusión. Añade importante información, tanto para la caracterización de algunos de estos tumores como para la diferenciación con los cambios postratamiento, y puede tener un papel importante en la evaluación pronóstica y de monitorización del tratamiento.
ConclusionesLa valoración de la patología tumoral de cabeza y cuello es compleja, pero afortunadamente se están desarrollando técnicas de imagen no invasivas y sin radiación mediante RM. Es importante hacer una valoración conjunta de las imágenes anatómicas con las secuencias funcionales, para de esta forma poder caracterizar los tumores en el momento del diagnóstico, pero sobre todo para monitorizar la respuesta al tratamiento e identificar enfermedad residual o recurrencia tumoral en los pacientes tratados, algo fundamental para poder realizar una medicina personalizada.
Autoría- 1.
Responsables de la integridad del estudio: ESA, TMN y VSV.
- 2.
Concepción del estudio: ESA, TMN y VSV.
- 3.
Diseño del estudio: ESA, TMN y VSV.
- 4.
Obtención de los datos: NA.
- 5.
Análisis e interpretación de los datos: NA.
- 6.
Tratamiento estadístico: NA.
- 7.
Búsqueda bibliográfica: ESA, TMN y VSV.
- 8.
Redacción del trabajo: ESA, TMN y VSV.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ESA, TMN y VSV.
- 10.
Aprobación de la versión final: ESA, TMN y VSV.
Los autores declaran no tener ningún conflicto de intereses.