Conocer la anatomía de las venas pulmonares (VVPP) mediante tomografía computarizada multidetector (TCMD) en pacientes con fibrilación auricular (FA) antes de la ablación.
Material y métodosRealizamos TCMD a 89 pacientes con FA analizando número, variantes y venas accesorias pulmonares, diámetro y forma ostia, distancia a la primera bifurcación y trombo en la orejuela izquierda.
ResultadosEl patrón venoso pulmonar más frecuente fue 4 VVPP (dos derechas y dos izquierdas) en 49 pacientes (55,1%).
Las VVPP superiores presentaron mayor diámetro ostial que las inferiores [vena pulmonar superior derecha (VPSD)> vena pulmonar inferior derecha (VPID); p=0,001 y vena pulmonar superior izquierda (VPSI)> vena pulmonar inferior izquierda (VPII); p <0,001]. El diámetro ostial de las VVPP derechas era mayor que el de las izquierdas (VPSD> VPSI; p <0,001 y VPID> VPII; p <0,001). El ostium más circular lo presentó la VPID (ratio: 0,885) respecto a la VPII (p <0,001) y a la VPSI (p <0,001). La distancia a la primera bifurcación ha sido mayor en las venas superiores (VPSD> VPID; p=0,008 y VPSI> VPII; p=0,038). La distancia a la primera bifurcación fue mayor en las VVPP izquierdas (VPSI> VPSD; p <0,001 y VPII> VPID; p <0,001). Otros hallazgos fueron: divertículos (30), apéndices auriculares accesorios (5), aneurismas septales (8), bolsas septales (6) y 1 trombo en la orejuela izquierda.
ConclusiónLa TCMD antes de la ablación demuestra la anatomía de la aurícula izquierda (AI) y de las VVPP con diferencias significativas entre los diámetros y morfología de los ostia venosos.
To know the anatomy of the pulmonary veins (PVs) by multidetector computed tomography (MDCT) in patients with atrial fibrillation (AF) prior to ablation.
Materials and methodsMDCT was performed in 89 patients with AF, analyzing the number of PVs, accessory variants and veins, diameter and ostial shape, distance to the first bifurcation and thrombus in the left atrial appendage.
ResultsThe most frequent venous pattern was 4 PVs (two right and two.
left) in 49 patients (55.1%). The superior veins had a statistically significant greater mean ostial diameter than the inferior veins (Right Superior Pulmonary Vein (RSPV)> Right Inferior Pulmonary Vein (RIPV); p=0.001 and Left Superior Pulmonary Vein (LSPV)> Left Inferior Pulmonary Vein (LIPV); p<0.001). The right pulmonary veins ostial diameters were significantly larger than the left pulmonary veins ostial diameters (RSPV> LSPV; p<0.001 and RIPV> LIPV; p<0.001). The most circular ostium was presented by the VPID (ratio: 0.885) compared to the LIPV (p<00.1) and LSPV (p<0.001). The superior veins had a statistically significant greater mean distance to first bifurcation than the inferior veins (RSPV> RIPV; p=0.008 and LSPV> LIPV; p=0.038). Mean distance to first bifurcation has been greater in left PVs respect to the right PVs (LSPV> RSPV; p<0.001and LIPV> RIPV; p<0.001). Other findings found in AI: diverticula (30), accessory auricular appendages (5), septal aneurysms (8), septal bags (6) and 1 thrombus in the left atrial appendage.
ConclusionMDCT prior to ablation demonstrates the anatomy of the left atrium (LA) and pulmonary veins with significant differences between the diameters and morphology of the venous ostia.
La fibrilación auricular (FA) es la arritmia más frecuente en la población general1. El hallazgo publicado en 19982 de que los episodios de FA se inician, en más del 90% de los casos, en el último segmento de las venas pulmonares (VVPP), próximas a su desembocadura en la aurícula izquierda (AI), abrió el camino al desarrollo y expansión de un procedimiento que pudiera tratar la FA con ablación mediante catéteres intravasculares.
Según las Sociedades Americana y Europea de Cardiología3,4, el tratamiento mediante ablación de las VVPP está indicado en pacientes con FA sintomática (paroxística o persistente), resistente al tratamiento antiarrítmico.
La ablación percutánea consiste en la desconexión eléctrica completa de las VVPP del tejido auricular. Para garantizar una correcta ablación, resulta imprescindible una modalidad de imagen precisa y no invasiva que permita conocer la anatomía de la AI, el número de venas y su localización ostial5 y excluir trombos en la orejuela izquierda, ya que suponen una contraindicación absoluta para el procedimiento6.
Entre estas modalidades se encuentra la tomografía computarizada multidetector (TCMD), que se recomienda realizar 24 horas antes de la ablación, debido a la fluctuación de la frecuencia cardiaca de estos pacientes para evitar cambios en la anatomía y volumen de la AI7.
El objetivo de este estudio es conocer la anatomía venosa pulmonar y de la AI en pacientes con FA antes de la ablación mediante TCMD con sincronización electrocardiográfica (ECG), y realizar un análisis estadístico de la variabilidad anatómica de los ostia venosos.
Material y métodosSujetosDesde febrero de 2015 hasta febrero de 2018 se realizaron TCMD a 89 pacientes con FA sintomática (paroxística en 76 y persistente en 13 pacientes) resistente al tratamiento médico, candidatos a tratamiento de su FA mediante ablación pulmonar: un total de 59 (66%) hombres y 30 (34%) mujeres, con un rango de edad en los hombres de 36 a 76 años y una media de 55,61 años (±DE: 10,152) y en las mujeres de 38 y 76 años, con una media de 59,43 años (±DE: 8,508).
Técnica de tomografía computarizada multidetectorLos estudios se realizaron con un equipo de TCMD (Toshiba, Aquilion 64 Otawara, Japan) con sincronización ECG retrospectiva, sin modulación de dosis de radiación basada en ECG, ya que al ser frecuencias irregulares se precisó realizar la adquisición de los datos en todas las fases del ciclo cardiaco. El volumen de contraste (Iopromida, 370mg/l de Ultravist®, Bayer) se adaptó individualmente según peso y tiempo de exploración, aplicando la fórmula: 25×peso del paciente (kg)×tiempo de exploración (s)/concentración del contraste (mg l/ml)8, con caudal de 5 ml/s, seguido de un bolo de 40ml de suero salino, a la misma velocidad, mediante una bomba de doble inyector (OptivantageTM DH, Mallinckrodt). Se empleó el método del seguimiento del bolo de contraste (“bolus tracking”; SUREStartTM) con adquisición de cortes cada 1 s hasta que el contraste llegó al umbral definido (200 unidades Hounsfield) y región de interés (ROI) en la AI. El estudio se realizó en apnea inspiratoria y en sentido caudocraneal para minimizar el movimiento respiratorio y conseguir una correcta opacificación de la AI con lavado completo de las cavidades cardiacas derechas.
En el momento de la adquisición del estudio revisamos en todos los pacientes si la opacificación de la orejuela izquierda había sido completa y, en caso contrario, realizamos un estudio tardío.
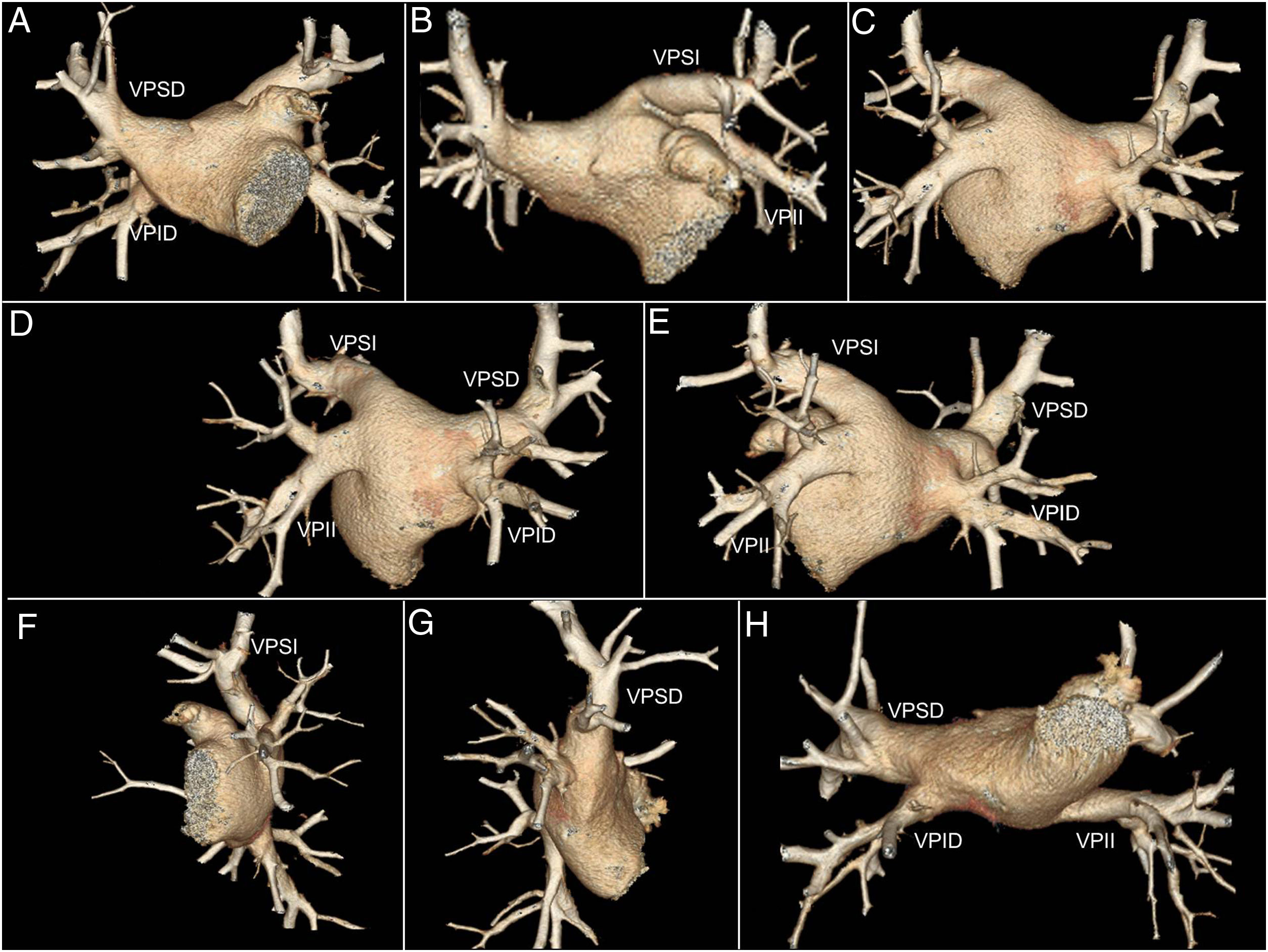
PosprocesadoCon reconstrucciones volumétricas (Volume Rendering; VR) obtuvimos una morfología tridimensional de la AI y de las VVPP. Se obtuvieron ocho vistas epicárdicas (fig. 1).
Ocho vistas epicárdicas mediante reconstrucción volumétrica de un paciente con 4 venas pulmonares. A) Anteroposterior 45° de inclinación craneal. B) Anteroposterior 45° de inclinación caudal. C) Posteroinferior 45° de inclinación craneal. D) Oblicua posterior derecha con inclinación craneal de 45°. E) Oblicua posterior izquierda con inclinación craneal de 45°. F) Lateral izquierda con inclinación craneal de 45°. G) Lateral derecha con inclinación craneal de 45°. H) Inferior.
VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
Con las vistas epicárdicas analizamos el número de VVPP por cada paciente. Consideramos patrón normal cuatro VVPP drenando en la pared posterior de la AI, dos venas derechas y dos venas izquierdas. Venas accesorias a las venas que presentaron una unión auriculopulmonar independiente a las VVPP y tronco común derecho (TCD) o izquierdo (TCI) cuando la unión proximal de las VVPP drenaba con un ostium único en la AI.
Mediante reconstrucciones multiplanares (multiplanar reconstruction, MPR) analizamos el diámetro ostial, el índice ostial (ratio) y la distancia desde la vena pulmonar a su primera bifurcación:
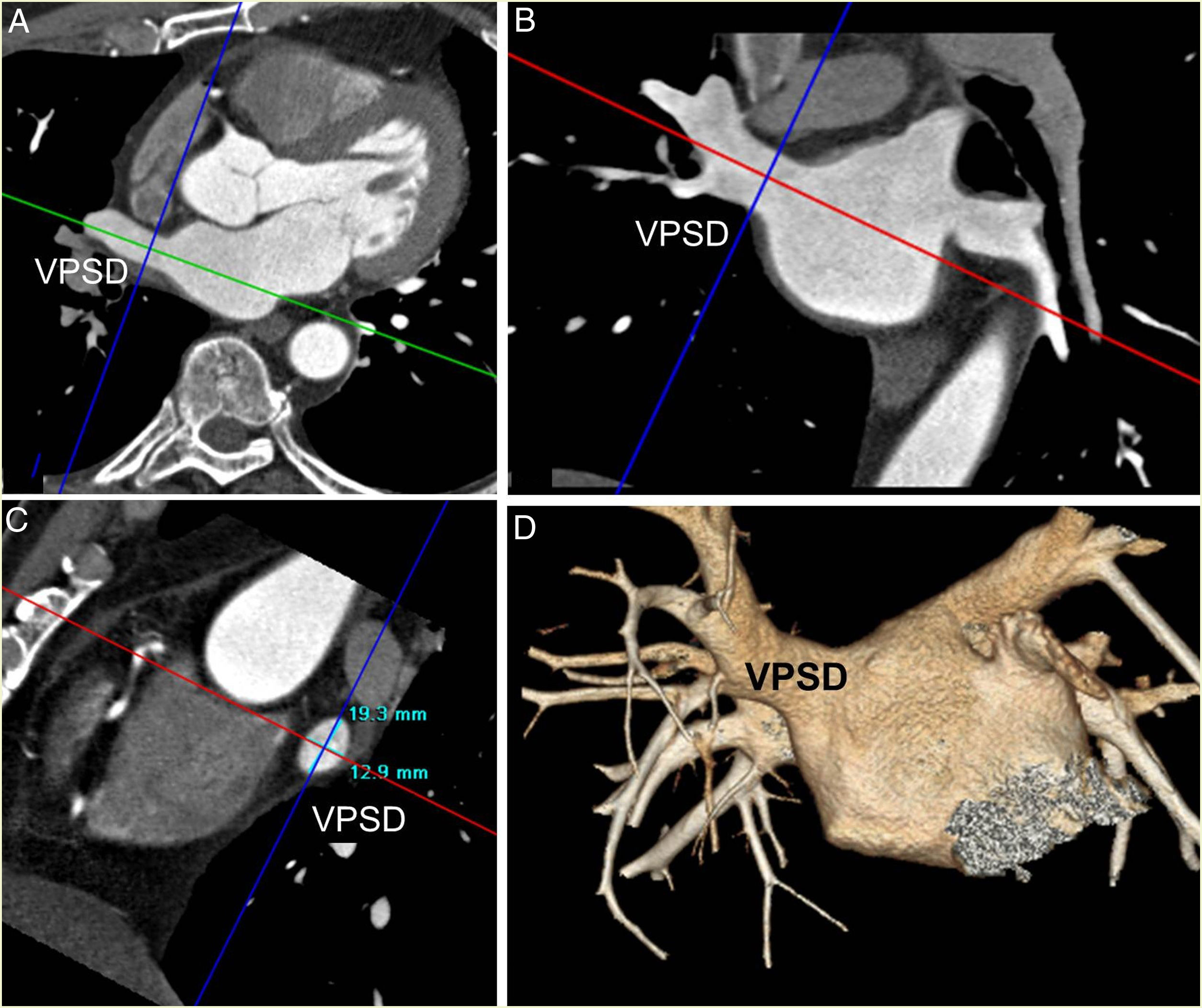
Diámetro ostial: en un plano axial trazamos un vector a través del eje largo de la vena con el que obtuvimos imágenes transversales y coronales oblicuas. Posteriormente, mediante un vector perpendicular al eje largo, obtuvimos dos diámetros: diámetro anteroposterior o diámetro mínimo y diámetro superoinferior o diámetro máximo. La imagen sagital oblicua representó los dos diámetros (fig. 2).
Análisis de los diámetros de la vena pulmonar superior derecha (VPSD). A) Reconstrucción multiplanar transversal oblicua. B) Coronal oblicua con vector sobre el eje largo de la VPSD (verde en A y rojo en B). Mediante un vector perpendicular al eje largo (color azul) se obtiene el diámetro anteroposterior en A y el diámetro superoinferior en B. C) Reconstrucción multiplanar sagital oblicua con los dos diámetros. D) Reconstrucción volumétrica anteroposterior con 45° de inclinación caudal.
Para el análisis estadístico empleamos los diámetros máximo (Ømáx), mínimo (Ømín) y el promedio de los dos (Ømáx+Ømín/2).
Índice ostial (ratio): valoramos la “forma” del ostium mediante el ratio entre dos áreas, área de la circunferencia [= π · r2] y área de la elipse [= π · a · b]. El cálculo del área de la circunferencia se obtuvo con el diámetro mínimo ostial [= π · (Ømin/2)2], y para el cálculo de los dos semiejes de la elipse (a,b), consideramos los diámetros mínimo y máximo ostiales [= π · (Ømín/2) · (Ømáx/2)].
Índice=1 cuando el ostium era completamente redondo. Cuanto más se aproximaba a 1, mayor forma redondeada y cuanto más se alejaba del 1, mayor forma ovalada.
Distancia desde la vena pulmonar a su primera bifurcación: medida en milímetros en coronal oblicua. Las distancias las clasificamos en tronco venoso corto o bifurcación temprana (distancia <5 mm) y tronco venoso largo (>5 mm).
Se valoró la existencia de anomalías auriculares izquierdas: divertículo (saculación de pared lisa y cuello ancho), apéndice auricular accesorio (saculación de pared irregular y cuello estrecho), aneurisma del septo interauricular (protrusión sacular del septo interauricular), defecto/bolsa septal (fusión incompleta septal con extensión anterior desde fosa oval) y anomalías congénitas coronarias.
En los casos de opacificación incompleta de la orejuela izquierda obtuvimos una segunda adquisición tardía para descartar trombo intracavitario.
En la sala de electrofisiología se realizó la reconstrucción anatómica de la AI con la fusión de las imágenes de la TCMD mediante un sistema de navegación EnSite-Velocity (EnsiteTM NavXTM; St Jude Medical).
Análisis estadísticoPara describir las variables cuantitativas se calculó el promedio, la desviación estándar, mínimo y máximo, y para las variables cualitativas se calcularon las frecuencias relativas.
Para determinar la asociación entre dos variables cualitativas utilizamos la prueba de la χ2 de Pearson (o la prueba de razón de verosimilitudes o prueba exacta de Fisher cuando no fue válida).
Se estimó la normalidad de las variables cuantitativas con la prueba de Shapiro-Wilk. En todos los casos se descartó la distribución normal, por lo que se utilizaron pruebas no paramétricas.
Para determinar la asociación de una variable cualitativa y una cuantitativa (comparación de medias) se utilizó la prueba U de Mann-Whitney (dos medias) o la prueba de Kruskal-Wallis (más de dos medias).
En el caso de variables cuantitativas pareadas se empleó la prueba de Friedman, y en la comparación por parejas se aplicó el ajuste de Bonferroni.
Todos los cálculos estadísticos se realizaron con el programa IBM SPSS 24.0 para Windows, y se estableció el error α en 0,050.
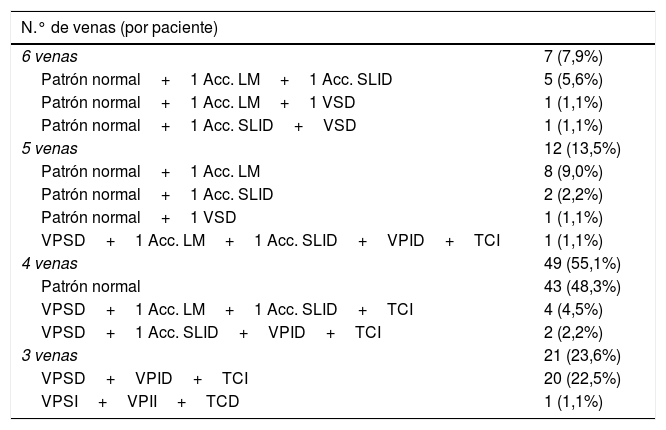
ResultadosNúmero y distribución de las venasLa tabla 1 muestra el número de VVPP por paciente y su distribución.
Número de venas por paciente y su distribución
| N.° de venas (por paciente) | |
|---|---|
| 6 venas | 7 (7,9%) |
| Patrón normal+1 Acc. LM+1 Acc. SLID | 5 (5,6%) |
| Patrón normal+1 Acc. LM+1 VSD | 1 (1,1%) |
| Patrón normal+1 Acc. SLID+VSD | 1 (1,1%) |
| 5 venas | 12 (13,5%) |
| Patrón normal+1 Acc. LM | 8 (9,0%) |
| Patrón normal+1 Acc. SLID | 2 (2,2%) |
| Patrón normal+1 VSD | 1 (1,1%) |
| VPSD+1 Acc. LM+1 Acc. SLID+VPID+TCI | 1 (1,1%) |
| 4 venas | 49 (55,1%) |
| Patrón normal | 43 (48,3%) |
| VPSD+1 Acc. LM+1 Acc. SLID+TCI | 4 (4,5%) |
| VPSD+1 Acc. SLID+VPID+TCI | 2 (2,2%) |
| 3 venas | 21 (23,6%) |
| VPSD+VPID+TCI | 20 (22,5%) |
| VPSI+VPII+TCD | 1 (1,1%) |
Patrón normal: 4 venas pulmonares principales (VPSD: vena pulmonar superior derecha; VPID: vena pulmonar inferior derecha; VPSI: vena pulmonar superior izquierda; VPII: vena pulmonar inferior izquierda).
Acc. LM: vena accesoria del lóbulo medio; Acc. SLID: vena accesoria del segmento superior del lóbulo inferior derecho; TCD: tronco común derecho; TCI: tronco común izquierdo; VSD: vena superior derecha.
Siete pacientes presentaron 6 VVPP (4 derechas y 2 izquierdas), en los que al patrón normal de cuatro venas se añadieron dos venas accesorias derechas. Doce pacientes presentaron 5 VVPP, de los cuales 11 tenían patrón normal de 4 venas más una vena accesoria derecha y un paciente 4 venas en el lado derecho (vena pulmonar superior derecha [VPSD], vena pulmonar inferior derecha [VPID] y dos venas accesorias derechas) y un tronco común izquierdo. Cuarenta y nueve pacientes presentaron 4 VVPP, 43 con patrón venoso normal y los seis restantes, 3 venas en el lado derecho (una de ellas VPSD) y un tronco común en el lado izquierdo. Veintiún pacientes presentaron 3 venas como resultado de un TCI en 20 pacientes y un TCD en un paciente.
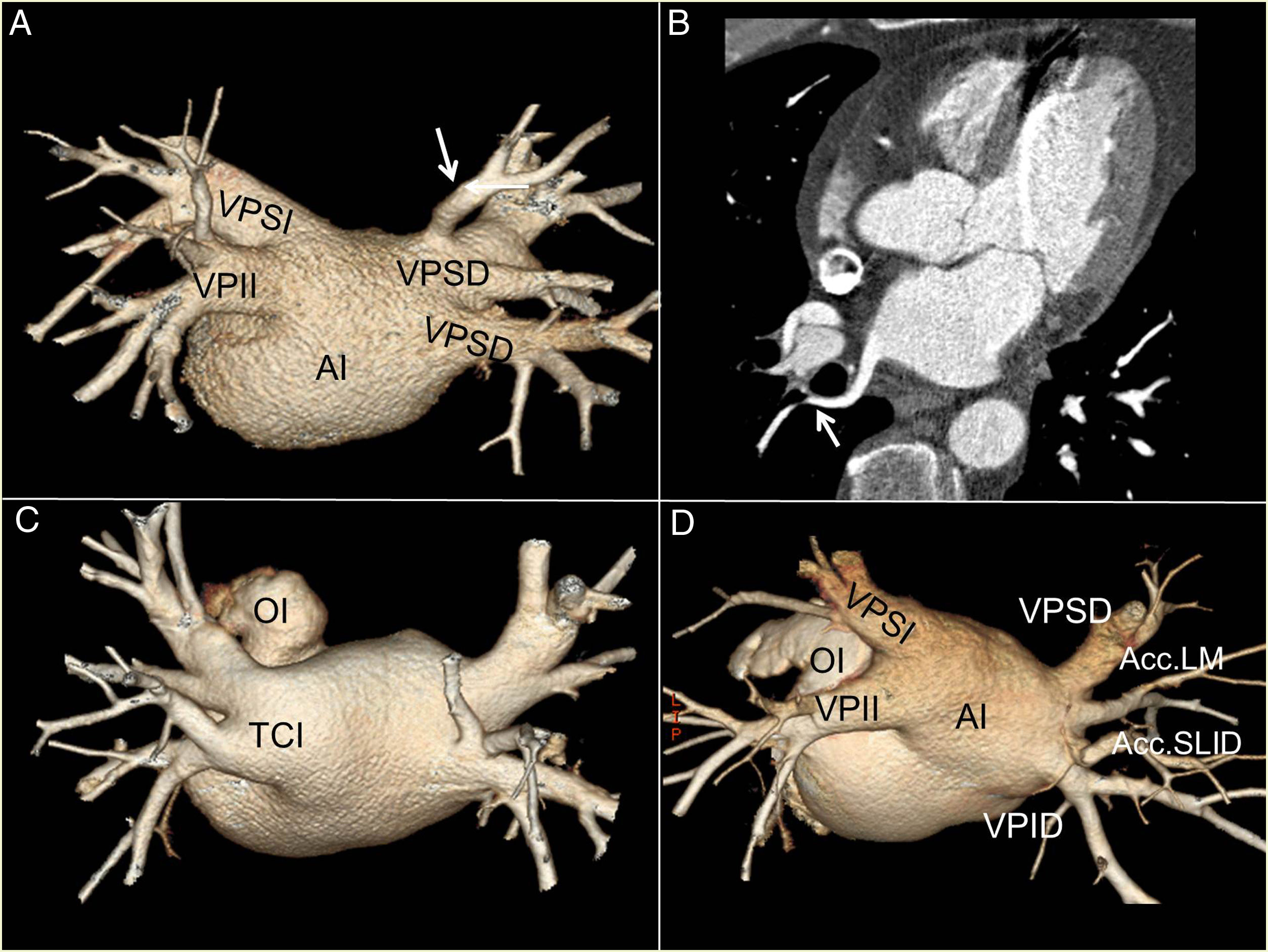
Venas accesorias y troncos comunesTodas las venas accesorias fueron derechas, identificadas en 33 (37%) pacientes: 19 (21,3%) drenaban el lóbulo medio; 11 (12,3%), el segmento superior del lóbulo inferior derecho, y 3 (3,4%) presentaron una vena accesoria superior derecha que en todos los casos drenaban el segmento superior del lóbulo superior derecho. Seis pacientes presentaron más de una vena accesoria derecha (1 vena accesoria del lóbulo medio y 1 vena accesoria del segmento superior del lóbulo inferior derecho), 27 pacientes presentaron un TCI y un paciente un TCD (fig. 3).
A) Reconstrucción volumétrica posteroanterior con 45° de inclinación craneal, con vena accesoria superior derecha (flecha blanca) drenando el segmento posterior del lóbulo superior derecho. B) Reconstrucción multiplanar transversal oblicua. En la figura B se observa su trayecto por detrás del bronquio intermediario (flecha blanca). C) Tronco común izquierdo. D) Dos venas accesorias derechas que corresponden a una vena accesoria del lóbulo medio (Acc. LM) y una vena accesoria del segmento superior del lóbulo inferior derecho (Acc. SLID).
AI: aurícula izquierda; OI: orejuela izquierda; VPID: vena pulmonar inferior derecha; VPSD: vena pulmonar superior derecha.
No encontramos pacientes con venas accesorias izquierdas ni con doble tronco común.
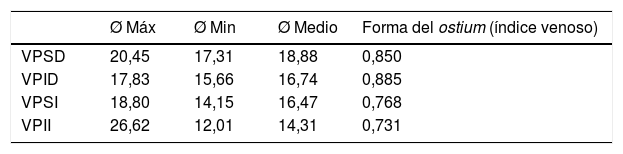
Diámetro del ostium de las venas pulmonaresEn la tabla 2 se representan los diámetros máximo, mínimo, medio (expresado en milímetros) y el índice ostial venoso (“forma” del ostium) de cada vena principal.
Diámetros máximo, mínimo, promedio y forma ostial (en milímetros)
| Ø Máx | Ø Min | Ø Medio | Forma del ostium (índice venoso) | |
|---|---|---|---|---|
| VPSD | 20,45 | 17,31 | 18,88 | 0,850 |
| VPID | 17,83 | 15,66 | 16,74 | 0,885 |
| VPSI | 18,80 | 14,15 | 16,47 | 0,768 |
| VPII | 26,62 | 12,01 | 14,31 | 0,731 |
VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
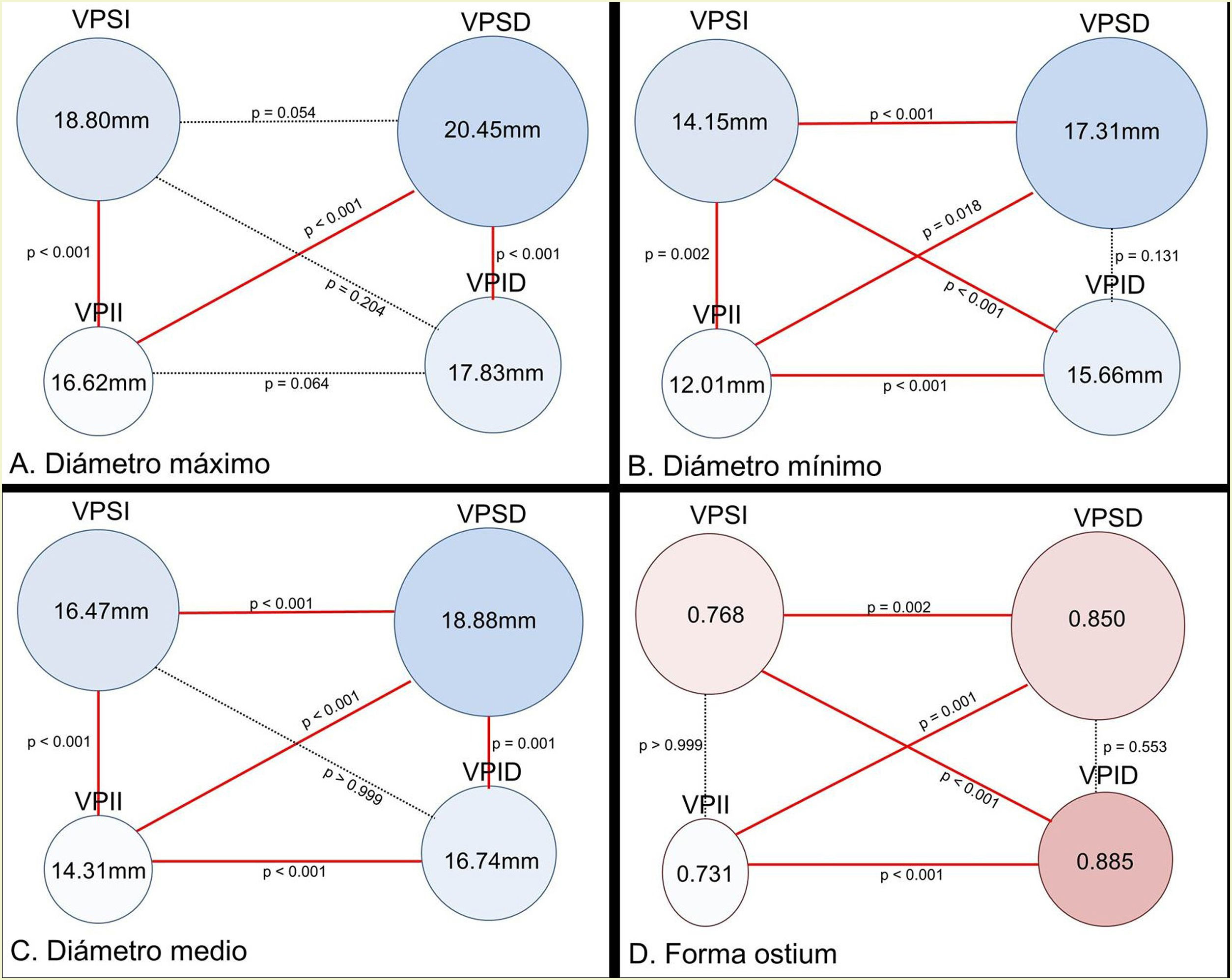
Cuando comparamos el diámetro de los ostia de las VVPP superiores con las inferiores y su forma (fig. 4), hallamos gran variabilidad de resultados.
Esquema con los ostia de las venas pulmonares (VVPP) en vista posteroanterior. Análisis de la relación interostial mediante los diámetros máximo (A), mínimo (B) y medio (C). La figura D muestra la forma de los ostia de VVPP mediante el cálculo del ratio ostial venoso. Ratio ostial: ratio entre dos áreas, área de la circunferencia [= π · r2] y área de la elipse [= π · a · b]. El área de la circunferencia se ha obtenido con el diámetro mínimo ostial [= π · (Ømín/2)2], y para los dos semiejes de la elipse (a,b), consideramos los diámetros mínimo y máximo ostiales [= π · (Ømín/2) · (Ømáx/2)]. Índice=1, cuando el ostium es completamente redondo. Cuanto más se aproxime al 1, mayor grado de “redondez”, y cuanto más se aleje del 1, mayor forma “ovalada”.
Tomando como referencia el diámetro ostial máximo, encontramos significativo que los ostia de las VVPP superiores eran mayores que los de las venas pulmonares inferiores (VPSD> VPID; p <0,001 y VPSI> VPII; p <0,001) y que el diámetro máximo del ostium de la VPSD era mayor que el de la VPII (p <0,001). No hallamos diferencias de tamaño entre los ostia de la VPSD y VPSI ni entre los ostia de la VPID y VPII (p=0,064).
Con el análisis del diámetro mínimo, las VVPP derechas presentaron de forma significativa un ostium mayor que el de las VVPP izquierdas (VPSD> VPSI; p <0,001 y VPID> VPII; p <0,001) y el diámetro mínimo ostial de la VPSI fue mayor que el de la VPII (p=0,002). No hubo diferencias entre los diámetros ostiales derechos (p=0,131). El diámetro mínimo de la VPSD fue significativamente mayor que el de la VPII (p=0,018) y el diámetro mínimo de la VPID fue mayor que el de la VPSI (p <0,001).
Con el diámetro ostial medio, fue significativo que el ostium de mayor tamaño ha sido el de la VPSD (18,88 mm) respecto al resto de las VVPP (VPID: 16,74 mm; p=0,001; VPSI: 16,47 mm; p <0,001 y VPII: 14,31mm; p <0,001). Las VVPP superiores presentaron mayor diámetro ostial que las VVPP inferiores (VPSD> VPID; p=0,001 y VPSI> VPII; p <0,001). El diámetro ostial de las VVPP derechas era mayor que el de las VVPP izquierdas (VPSD> VPSI; p <0,001 y VPID> VPII; p <0,001).
El ostium más circular lo presentó la VPID (ratio: 0,885) respecto a la VPII (ratio: 0,731; p <0,001) y a la VPSI (ratio: 0,768; p <0,001). Los ostium de las VVPP derechas eran más redondos que los de las VVPP izquierdas (VPSD: ratio 0,850 y VPSI: ratio 0,768; p=0,002. VPID: ratio 0,885 y VPII: ratio 0,731; p <0,001).
Al comparar el diámetro ostial con el sexo, solo encontramos diferencias con el diámetro máximo, observando que los diámetros máximos de las VVPP derechas son mayores en hombres respecto a las mujeres (p=0,009 en VPSD; p=0,050 en VPID). El ostium de la VPSD era más redondo en las mujeres que en los hombres (p=0,033).
Distancia a la primera bifurcaciónLas distancias desde el ostium de cada vena pulmonar hasta su primera bifurcación (promedio) fueron 7,90 mm en la VPSD, 4,49 mm en la VPID, 14,72 mm en la VPSI y 11,72 mm en la VPII.
Hubo mayor distancia a la primera bifurcación en las VVPP superiores que en las inferiores (distancia VPSD> distancia VPID; p=0,008 y distancia VPSI> distancia VPII; p=0,038). Las distancias de las VVPP izquierdas fueron mayores que las distancias de las VVPP derechas (distancia VPSI> distancia VPSD; p <0,001 y distancia VPII> distancia VPID; p <0,001). La vena que presentó una mayor distancia fue la VPSI y la de menor distancia la VPID.
Cuando clasificamos estas distancias en tronco corto (<5mm) y tronco largo (>5 mm), las mujeres presentaron un mayor porcentaje de VPSI con tronco corto, en comparación con los hombres (p=0,029). Fue significativo (p=0,011) que aquellos pacientes con 3 o 6 venas, presentaron un mayor porcentaje de tronco corto.
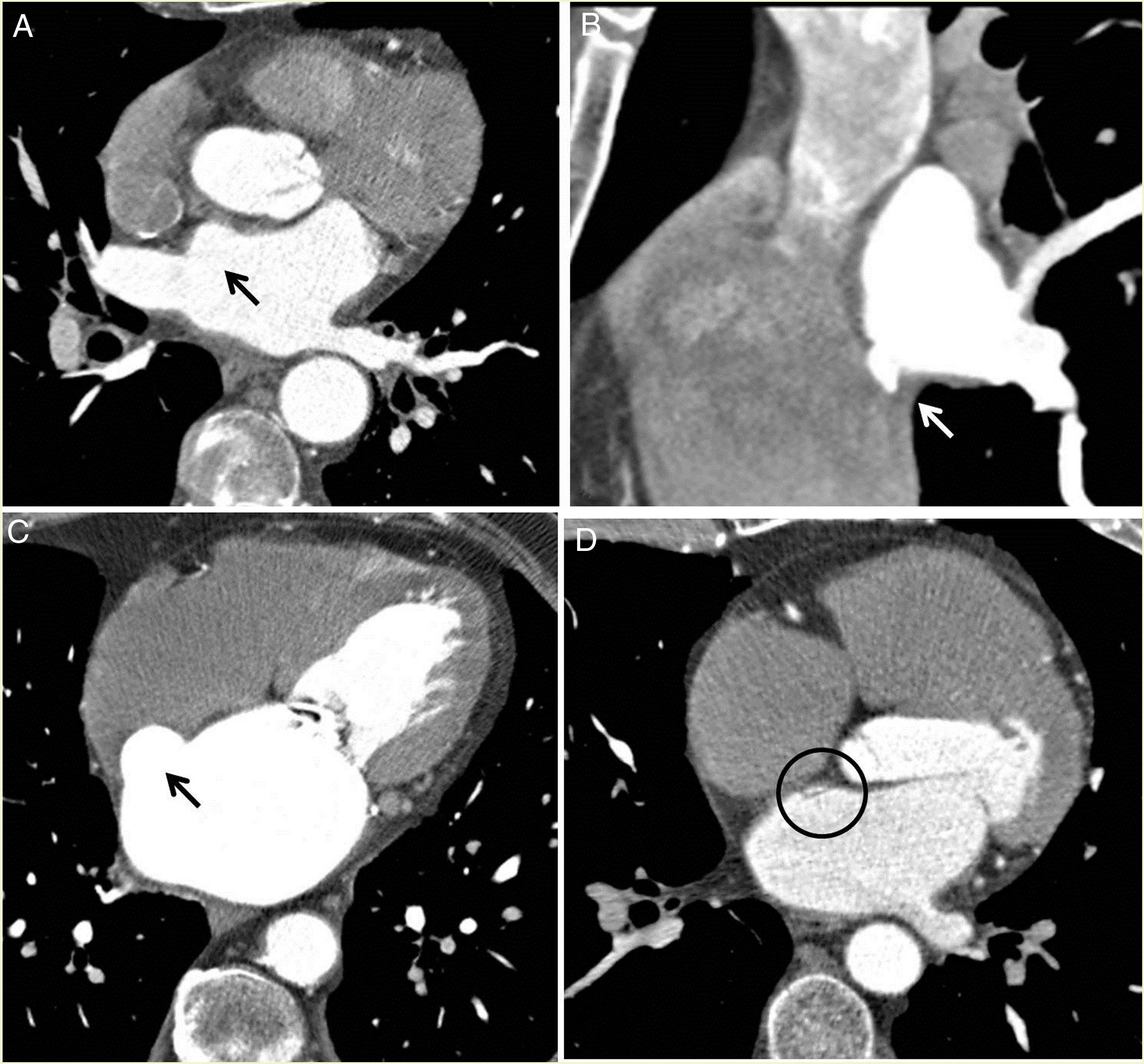
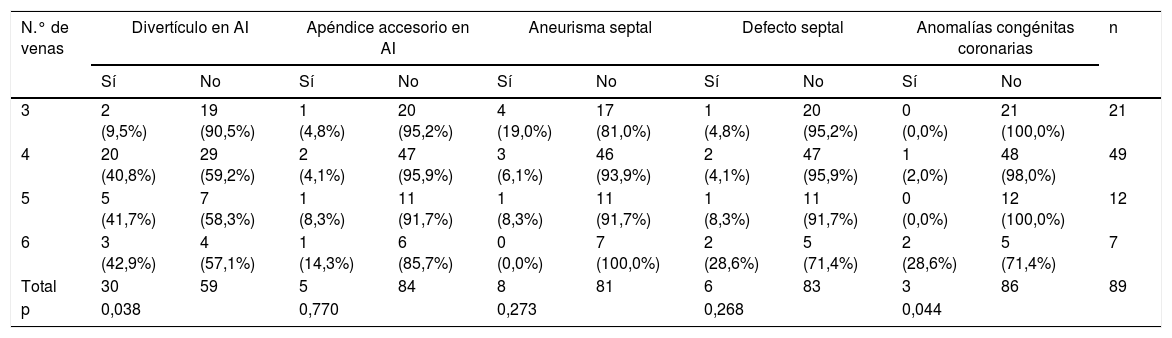
Anomalías asociadasTreinta pacientes (33,7%) presentaron divertículos en la pared anterosuperior de la AI; apéndices auriculares accesorios en la pared lateral inferior izquierda en 5 (5,6%); aneurismas del septo interauricular en 8 (9%); bolsas septales en 6 (6,7%) (fig. 5) y anomalías congénitas coronarias en 3 (3,4%): 2 pacientes con ostium alto coronario y un paciente con origen anómalo de la arteria circunfleja en coronaria derecha con trayecto retroaórtico.
Hallazgos encontrados en aurícula izquierda (AI). A) Reconstrucción oblicua transversa con imagen “sacular” (flecha negra) en pared anterosuperior derecha de AI, de contorno liso y base amplia que corresponde a divertículo. B) Reconstrucción oblicua sagital con imagen “sacular” en pared lateral inferior derecha de AI (flecha blanca) de contorno irregular que corresponde a apéndice accesorio auricular. C) Reconstrucción oblicua transversa con deformación sacular en el septo interauricular, en la región del foramen oval (flecha blanca) correspondiente a aneurisma. D) Reconstrucción oblicua transversa con defecto/bolsa septal en pared auricular izquierda en forma de fino septo que corresponde a foramen permeable sin evidencia de paso de contraste a cavidad derecha (círculo).
Al analizar estas anomalías respecto al número de VVPP (tabla 3), en pacientes con 3 venas apenas existían divertículos en AI, mientras que pacientes con 4, 5 o 6 venas, la proporción de presentar o no divertículos fue similar (p=0,038). También es significativo que la mayoría de las anomalías congénitas coronarias aparecieron en pacientes con 6 venas (p=0,044).
Relación de anomalías auriculares con el número de venas
| N.° de venas | Divertículo en AI | Apéndice accesorio en AI | Aneurisma septal | Defecto septal | Anomalías congénitas coronarias | n | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Sí | No | Sí | No | Sí | No | Sí | No | Sí | No | ||
| 3 | 2 (9,5%) | 19 (90,5%) | 1 (4,8%) | 20 (95,2%) | 4 (19,0%) | 17 (81,0%) | 1 (4,8%) | 20 (95,2%) | 0 (0,0%) | 21 (100,0%) | 21 |
| 4 | 20 (40,8%) | 29 (59,2%) | 2 (4,1%) | 47 (95,9%) | 3 (6,1%) | 46 (93,9%) | 2 (4,1%) | 47 (95,9%) | 1 (2,0%) | 48 (98,0%) | 49 |
| 5 | 5 (41,7%) | 7 (58,3%) | 1 (8,3%) | 11 (91,7%) | 1 (8,3%) | 11 (91,7%) | 1 (8,3%) | 11 (91,7%) | 0 (0,0%) | 12 (100,0%) | 12 |
| 6 | 3 (42,9%) | 4 (57,1%) | 1 (14,3%) | 6 (85,7%) | 0 (0,0%) | 7 (100,0%) | 2 (28,6%) | 5 (71,4%) | 2 (28,6%) | 5 (71,4%) | 7 |
| Total | 30 | 59 | 5 | 84 | 8 | 81 | 6 | 83 | 3 | 86 | 89 |
| p | 0,038 | 0,770 | 0,273 | 0,268 | 0,044 | ||||||
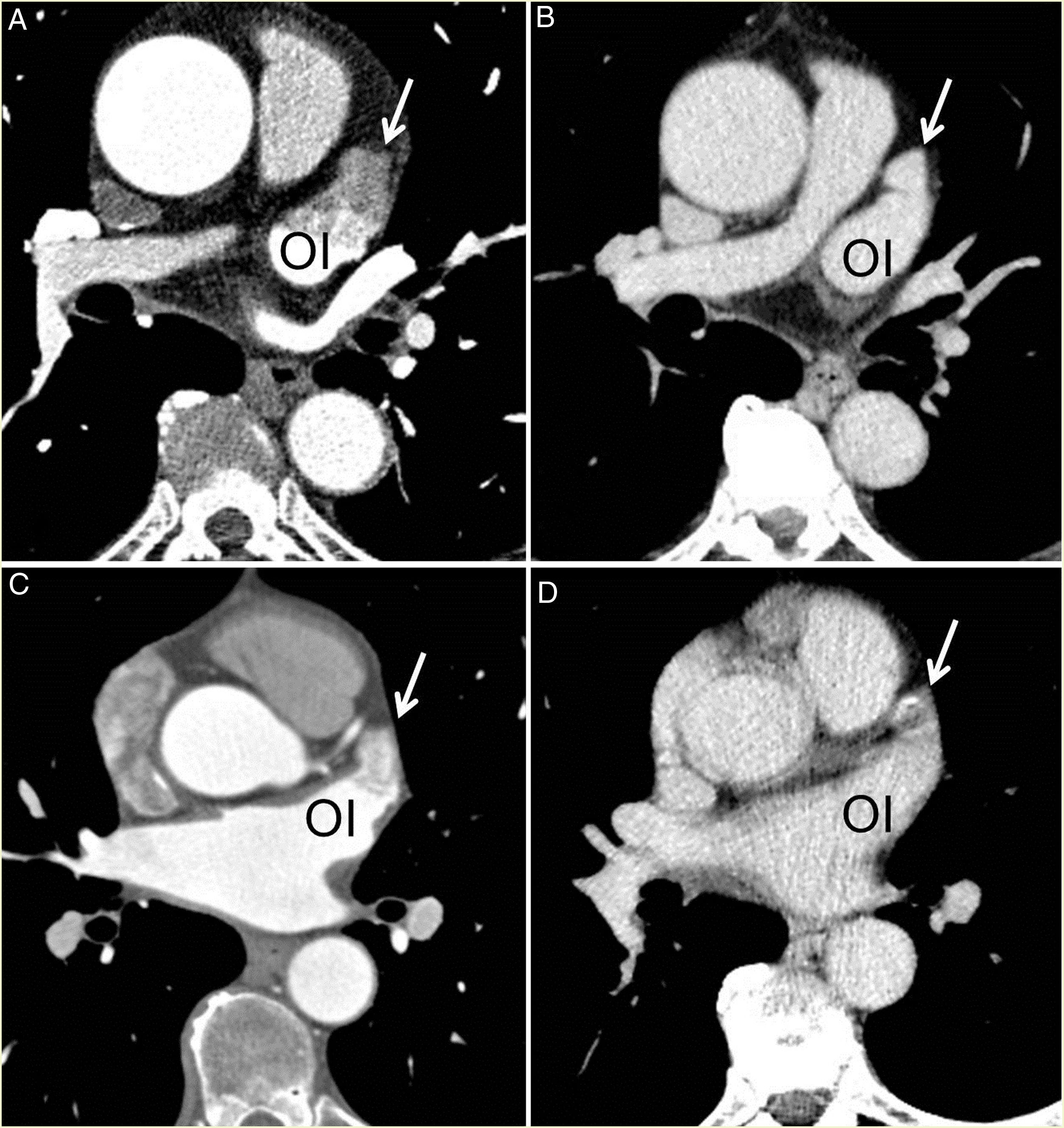
Tres de los 89 pacientes presentaron un defecto de repleción del contraste en la orejuela izquierda, por lo que realizamos una segunda adquisición en fase tardía. En dos de ellos, la opacificación fue homogénea y en el tercer paciente el defecto persistió, confirmando un trombo (fig. 6).
Falso trombo (A y B). A) Imagen axial con defecto de repleción en la orejuela izquierda (flecha blanca). B) Adquisición en fase tardía con opacificación completa de la orejuela (flecha blanca). Trombo (C y D). C) Imagen axial con defecto de repleción en la orejuela izquierda (flecha blanca). D) Adquisición en fase tardía con persistencia del defecto de repleción (flecha blanca). OI: orejuela izquierda.
La FA es la arritmia más frecuente en el adulto, con una prevalencia global del 0,4%9. Parte del miocardio de la AI que se extiende en forma de manguito en el segmento proximal de las VVPP es el responsable de los focos ectópicos2,6.
La ablación mediante catéter de los focos arritmogénicos de las VVPP distales representa un importante avance terapéutico, evitando la recurrencia de la FA en el 70-80% de los pacientes durante el primer año de seguimiento10.
Las VVPP deben ser cateterizadas de forma selectiva antes de que puedan ser tratadas eléctricamente. La evolución técnica ha hecho que la definición de los ostia de las VVPP mediante guía fluoroscópica haya quedado obsoleta, ya que no proporciona una imagen tridimensional adecuada de la anatomía venosa pulmonar y el éxito del procedimiento no solo implica un buen resultado, sino también minimizar el tiempo de exploración y de las complicaciones surgidas. La ecografía transesofágica (ETE), la TCMD y la resonancia magnética (RM) son técnicas de imagen que facilitan la anatomía de las VVPP y de la AI antes del procedimiento, y la elección de una de ellas depende de la experiencia y del equipo disponible11 y ayudan a reducir la duración del procedimiento, la recurrencia de la FA y la exposición a la radiación12.
La TCMD y la RM ofrecen una ventaja superior a la ETE en la identificación de la anatomía de las VVPP, en las medidas de los ostia y en la superposición de las imágenes con los mapas electroanatómicos13,14,15. A favor de la TCMD estaría su menor tiempo de exploración y que no requiere sedación para su realización.
La anatomía venosa pulmonar se demostró de forma correcta en todos los pacientes. El patrón normal de 4 VVPP estuvo presente en 43 pacientes (48,3%). En los artículos revisados existe una gran diversidad, con frecuencias entre el 57% y 82%16, bien por falta de consenso en la definición del ostium y por las diferentes técnicas de imagen empleadas17.
Por su menor diámetro ostial, las venas accesorias pueden pasar desapercibidas durante el procedimiento y ser causa de FA recurrente18. Revisando la literatura científica publicada, la incidencia de venas accesorias derechas es del 4-27%15, pero en nuestro estudio hallamos una frecuencia más elevada (37%). La frecuencia de dos venas derechas en un mismo paciente es menor, del 6,7%, similar a estudios publicados19.
La vena superior derecha (VSD) es una vena accesoria muy infrecuente. Descrita por primera vez por von Haller20, consiste en una vena supernumeraria con ostium en la región superior derecha de la AI, medial al ostium de la VPSD y trayecto posterior al bronquio intermediario. Esta vena debe ser reconocida durante el procedimiento por si queda bloqueada de forma accidental con el catéter. En nuestro estudio, la VSD se identificó en 3 pacientes (3,4%), frecuencia similar a la literatura publicada21.
Veintisiete pacientes (30,3%) presentaron un tronco común izquierdo y 1 paciente (1,1%) un tronco común derecho, con una enorme variabilidad en la frecuencia de este hallazgo, del 3% al 83% en el lado izquierdo18,21,22 y del 2% al 39% en el lado derecho17,23.
El diámetro del ostium es un factor muy importante para seleccionar el tamaño adecuado del catéter, ya que un diámetro pequeño es más propenso a la estenosis postablación.
La medida del diámetro depende de la técnica de imagen empleada y del plano donde se mida. La angiografía convencional sobreestima el diámetro y la ecocardiografía transesofágica lo subestima en comparación con la TCMD y la ecocardiografía intracardiaca, que proporcionan las mejores mediciones ostiales22.
Analizamos tres diámetros ostiales: máximo, mínimo y medio. De los tres, encontramos un mayor número de resultados significativos con el diámetro medio, con ostium de las venas derechas mayor que el de las venas izquierdas16,24. Hay estudios que no encontraron diferencias entre las venas derechas e izquierdas25, ya que las medidas ostiales se realizaron sobre reconstrucciones volumétricas analizando únicamente el diámetro máximo definido como la intersección de tangentes desde el margen superior e inferior de la vena pulmonar respecto a la pared de la AI.
De todas las VVPP, la que presentó un mayor diámetro ostial fue la VPSD (18,88 mm), similar a otros estudios26.
Aunque en los hombres los ostia de las VVPP tienden a ser más grandes que en las mujeres, en nuestro estudio solo es significativo en los ostia del lado derecho con el análisis del diámetro máximo. De los artículos revisados, encontramos resultados dispares. En un artículo, el diámetro ostial de las VVPP inferiores fueron mayores en los hombres16, mientras que en otro artículo, el ostium de la VPSI era mayor en hombres respecto a las mujeres26.
El plano sagital oblicuo es el más reproducible para las mediciones ostiales porque permite valorar dos diámetros, el máximo y el mínimo, ya que el ostium no es completamente circular27. Para evaluar la forma del ostium calculamos el índice (ratio) ostial venoso. Según este ratio, el ostium de las VVPP izquierdas es más ovalado que el de las VVPP derechas y son las venas derechas las que presentan un ostium más circular, hallazgos similares a la literatura publicada22,26,27,28. En nuestro estudio, el ostium que con más frecuencia presenta una forma ovalada es el de la VPII, ya que en su entrada en la pared posterior de la AI sufre una compresión por la pared de la aorta descendente y la pared de la AI26.
La distancia desde el ostium a la primera bifurcación es fundamental para asegurar que hay suficiente espacio para la ablación. Si la primera bifurcación está a menos de 5 mm de distancia, hay riesgo de estenosis15,29. En nuestro estudio, las VVPP izquierdas presentaron una distancia mayor de 5 mm respecto a las venas derechas, siendo la VPSI la de mayor distancia con 14,72 mm, similar a otros artículos16,19.
Los divertículos y apéndices accesorios representan variantes anatómicas. Un estudio de 2017 en el que analizaban la presencia de divertículos en pacientes antes de la ablación de VVPP30 demostró que la prevalencia de divertículos era muy frecuente, del 43,2%. Los divertículos pueden asociarse a arritmias, tromboembolia o regurgitación mitral31 y debemos tenerlos en cuenta como una causa que contribuye al riesgo de complicaciones durante la ablación, como el atrapamiento del catéter, perforación o formación de trombos28,30. Suelen ser más frecuentes en hombres, pero no hay diferencias estadísticamente significativas en cuanto al sexo31, resultado similar al de nuestro estudio que, aunque fue más frecuente en hombres (37,3% vs. 26,7%), no hubo diferencias. Llamó la atención que en pacientes con 3 venas pulmonares, la frecuencia de divertículos fue muy escasa.
Es importante detectar los aneurismas del septo interauricular, porque existe una asociación con las taquiarritmias auriculares y con la formación de trombos32. Debido a la gran disponibilidad de la ecocardiografía, es muy frecuente identificar esta anomalía5; aun así, la frecuencia en la población adulta es baja, del 2,2%33. En nuestro estudio obtuvimos una frecuencia mayor (9%).
El defecto o bolsa septal auricular puede ser origen de trombos33 y para su diagnóstico se emplean la TCMD y RM. En nuestro estudio la incidencia fue del 6,7%.
La presencia de trombo en la orejuela izquierda es contraindicación absoluta para realizar la ablación. La TCMD tiene mayor sensibilidad con respecto a la RM para la detección de trombos intracavitarios, por lo que, en estos casos, la ETE es la técnica de imagen que con mayor sensibilidad los demuestra.
Aunque la ETE sigue siendo el patrón de referencia para la exclusión definitiva de trombo, en los últimos años ha cobrado fuerza la TCMD para descartarlo. Los estudios que comparan la TCMD con la ETE indican que la TCMD tiene un excelente valor predictivo negativo (98%) y una especificidad del 85-88%34, aunque la sensibilidad varía entre el 29% y el 100%35,36. Si la orejuela izquierda se opacifica completamente en la fase arterial, la presencia de trombo es bastante improbable. Si hay un defecto de llenado, se puede realizar una adquisición más tardía para diferenciar entre trombo (el defecto persistirá) o flujo lento (el defecto ya no estará presente)37. En nuestra serie realizamos una segunda adquisición en 3 pacientes, debido a la falta de opacificación de la orejuela izquierda en la fase arterial. De los tres, en uno de ellos el defecto persistió, por lo que lo catalogamos como trombo, retrasándose la ablación un año.
ConclusiónLa información morfológica completa de las VVPP (patrón anatómico, patrón de ramificación, orientación y diámetro de los ostium y relación con la AI) es esencial como mapa anatómico previo al procedimiento intervencionista. La naturaleza no invasiva de la TCMD y la capacidad de demostrar la anatomía tridimensional de las VVPP y de las estructuras circundantes, así como su disponibilidad y fácil reproducibilidad, hacen que sea la técnica idónea para la evaluación de la AI y de las VVPP antes y después de la ablación. Nuestro estudio pone de manifiesto las diferencias anatómicas de las VVPP y de sus ostium y las diferencias estadísticamente significativas entre ellos en cuanto a su patrón y tamaño.
Autoría- 1.
Responsable de la integridad del estudio: EAH.
- 2.
Concepción del estudio: EAH, MEGS y DYR.
- 3.
Diseño del estudio: EAH, DYR y MEGS.
- 4.
Obtención de los datos: EAH, MEGS y PSM.
- 5.
Análisis e interpretación de los datos: EAH, MEGS y DYR.
- 6.
Tratamiento estadístico: EAH y ACS.
- 7.
Búsqueda bibliográfica: PSM, ACS y MENM.
- 8.
Redacción del trabajo: EAH, PSM y MENM.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: DYR.
- 10.
Aprobación de la versión final: EAH, MEGS y DYR.
Los autores declaran no tener ningún conflicto de intereses.









![Esquema con los ostia de las venas pulmonares (VVPP) en vista posteroanterior. Análisis de la relación interostial mediante los diámetros máximo (A), mínimo (B) y medio (C). La figura D muestra la forma de los ostia de VVPP mediante el cálculo del ratio ostial venoso. Ratio ostial: ratio entre dos áreas, área de la circunferencia [= π · r2] y área de la elipse [= π · a · b]. El área de la circunferencia se ha obtenido con el diámetro mínimo ostial [= π · (Ømín/2)2], y para los dos semiejes de la elipse (a,b), consideramos los diámetros mínimo y máximo ostiales [= π · (Ømín/2) · (Ømáx/2)]. Índice=1, cuando el ostium es completamente redondo. Cuanto más se aproxime al 1, mayor grado de “redondez”, y cuanto más se aleje del 1, mayor forma “ovalada”. Esquema con los ostia de las venas pulmonares (VVPP) en vista posteroanterior. Análisis de la relación interostial mediante los diámetros máximo (A), mínimo (B) y medio (C). La figura D muestra la forma de los ostia de VVPP mediante el cálculo del ratio ostial venoso. Ratio ostial: ratio entre dos áreas, área de la circunferencia [= π · r2] y área de la elipse [= π · a · b]. El área de la circunferencia se ha obtenido con el diámetro mínimo ostial [= π · (Ømín/2)2], y para los dos semiejes de la elipse (a,b), consideramos los diámetros mínimo y máximo ostiales [= π · (Ømín/2) · (Ømáx/2)]. Índice=1, cuando el ostium es completamente redondo. Cuanto más se aproxime al 1, mayor grado de “redondez”, y cuanto más se aleje del 1, mayor forma “ovalada”.](https://static.elsevier.es/multimedia/00338338/0000006200000002/v1_202002250834/S003383381930102X/v1_202002250834/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)



