Las complicaciones posquirúrgicas del cáncer colorrectal son frecuentes en los servicios de urgencias. La tomografía computarizada multidetector tiene un papel fundamental en el seguimiento de los pacientes operados, ya que hace posible el reconocimiento de complicaciones y recidiva. Es importante que el radiólogo esté familiarizado con las diferentes técnicas quirúrgicas y los cambios postoperatorios normales, con objeto de diferenciarlas de potenciales complicaciones y recidivas.
El objetivo de este trabajo es revisar los hallazgos en tomografía computarizada multidetector que pueden considerarse normales tras la intervención quirúrgica, y hacer una revisión de las complicaciones tempranas que con mayor frecuencia encontramos en los servicios de urgencias.
Complications after surgery for colorectal cancer are common in emergency departments. Multidetector computed tomography plays a fundamental role in the follow-up of patients after surgery, because it enables the detection of relapse and complications. Radiologists need to be familiar with different surgical techniques and the normal postsurgical changes so that we can differentiate them from potential complications and relapse.
This article reviews the multidetector computed tomography findings that can be considered normal after surgical intervention for colorectal cancer as well as the most common early complications seen in postsurgical colorectal cancer patients presenting at emergency departments.
El cáncer colorrectal (CCR) en España es el cáncer más frecuente cuando se consideran de forma conjunta ambos sexos. En hombres ocupa el tercer puesto después del cáncer de próstata y el de pulmón. En las mujeres se posiciona en segundo lugar después del cáncer de mama1. El único tratamiento con finalidad curativa en el CCR es la cirugía, que dependerá de la localización del tumor, el grado de invasión local y la existencia de metástasis a distancia2.
En este trabajo se revisarán los procedimientos quirúrgicos más frecuentes, incluyendo: resecciones segmentarias del colon, operación de Hartmann, colectomía total, resección abdominal baja (RAB) y resección abdominoperineal (RAP). Se describirán los cambios anatómicos posquirúrgicos en tomografía computarizada multidetector (TCMD) y los hallazgos que pueden considerarse normales tras la intervención quirúrgica, relacionándolos con el tiempo de aparición y su valoración clínica. Se hará una revisión de las complicaciones tempranas más frecuentes, y se expondrá el protocolo óptimo de realización de la TCMD según el tipo de complicación que se sospeche.
Consideraciones técnicasLos protocolos que se utilizan en nuestro centro son los siguientes:
- •
El estudio estándar se realiza desde la base del tórax hasta la sínfisis del pubis, con contraste intravenoso (i.v.) no iónico (100-120ml), en fase venosa portal. El contraste oral y rectal no se utiliza de forma rutinaria.
- •
En casos selectivos puede estar indicada la administración de contraste rectal para demostrar pequeñas fugas anastomóticas. Puede utilizarse Gastrografín diluido al 2% o contraste isoosmolar diluido al 5%.
- •
El estudio sin contraste i.v., aunque puede aportar información importante como la presencia de neumoperitoneo, hemoperitoneo, hematomas y dilatación de asas, no suele realizarse habitualmente. Está indicado siempre como estudio previo antes de la realización de una tomografía computarizada (TC) con contraste enteral o de una angio-TC, ya que permite diferenciar suturas, clips, grapas posquirúrgicas y calcificaciones de posible extravasación de contraste fuera de la luz intestinal o de sangrados activos.
- •
La TC en fase tardía (15-20min) está indicada cuando se sospeche afectación posquirúrgica de la vía urinaria, para detectar posible extravasación del contraste.
- •
Si se sospecha sangrado activo se realizará una angio-TC: sin contraste, y con contraste i.v. en las fases arterial y venosa.
Las resecciones segmentarias se refieren a la extirpación de la lesión focal y una porción intestinal sana adyacente con el fin de proporcionar amplios márgenes quirúrgicos. En las lesiones neoplásicas se realiza extirpación del mesenterio relacionado con el segmento intestinal afectado y linfadenectomía3.
La resección segmentaria del colon, según la localización del tumor, incluye3,4:
- •
Resección ileocecal (resección del ciego e íleon terminal con anastomosis ileocólica).
- •
Hemicolectomía derecha (resección del íleon terminal, ciego, colon ascendente y porción proximal del colon transverso, con anastomosis entre el íleon y el colon transverso).
- •
Hemicolectomía izquierda (resección de la flexura izquierda, colon descendente y porción proximal del sigma, con anastomosis entre el colon transverso y el sigma distal). La sigmoidectomía es una modificación de esta técnica que se realiza en pequeños tumores del colon sigmoides con resección del mismo y anastomosis entre el colon descendente y la unión rectosigmoidea.
La colectomía total (extirpación completa del colon con anastomosis ileorrectal) no es habitual en el cáncer de colon, pero puede ser necesaria cuando existan complicaciones como isquemia grave del colon o en caso de tumores sincrónicos.
Los cambios en la anatomía dependerán de la intervención quirúrgica realizada. Se apreciará la ausencia del segmento intestinal resecado, con los clips en la anastomosis quirúrgica y el desplazamiento de las vísceras adyacentes ocupando el espacio del área resecada5.
La intervención de Hartman6,7 se realiza generalmente en cirugía de urgencias cuando existe un alto riesgo de fuga de la anastomosis. En las lesiones neoplásicas, generalmente cuando se presentan con obstrucción o perforación, se reseca el segmento afectado y se realiza una colostomía en la fosa ilíaca izquierda. En un segundo tiempo se anastomosa con el muñón rectal restableciendo la continuidad del tránsito intestinal.
La RAB en el cáncer de recto está indicada cuando la lesión se sitúa a más de 8cm por encima de la línea pectínea o 5cm por encima del margen anal. Se realiza una resección de la porción distal del colon descendente, sigma y recto distal con anastomosis rectal baja preservando la continuidad intestinal3,4.
Los hallazgos en la RAB incluyen la anastomosis colorrectal con las grapas de sutura y un aumento del espacio presacro, con el recto separado del sacro unos 2cm.
Es frecuente la existencia de una colección líquida o de una pequeña cantidad de tejido blando en localización presacra, línea media, con unos diámetros medios de 1×5,3cm en los ejes anteroposterior y longitudinal (fig. 1). En un 70% de los casos desaparece o es mínima pasados unos meses, y en el otro 30% persiste, aunque puede disminuir con el tiempo o permanecer estable4.
Un desplazamiento del recto mayor de 3,5cm o un aumento en la cantidad de tejidos blandos debe hacer sospechar fuga anastomótica o recidiva tumoral según se produzca en fase temprana o tardía5.
La RAP se realiza en las lesiones neoplásicas situadas en el recto inferior, a menos de 8cm de la línea ileopectínea o menos de 5cm del borde anal. Esta técnica incluye resección de sigma, recto y ano con resección perineal. Se establece una colostomía permanente3,5.
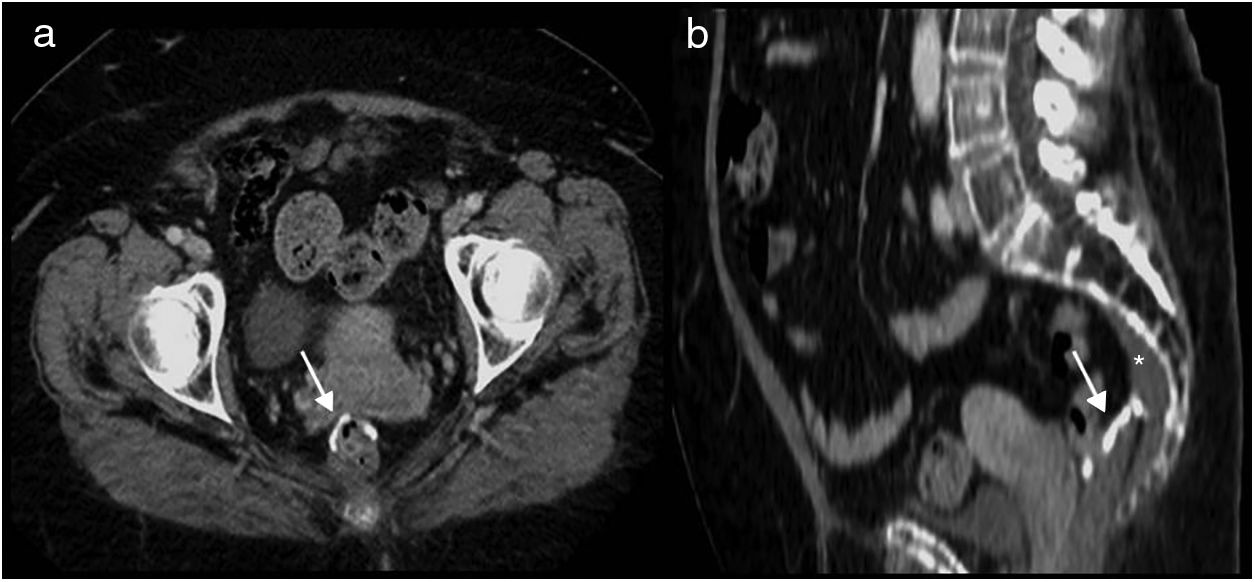
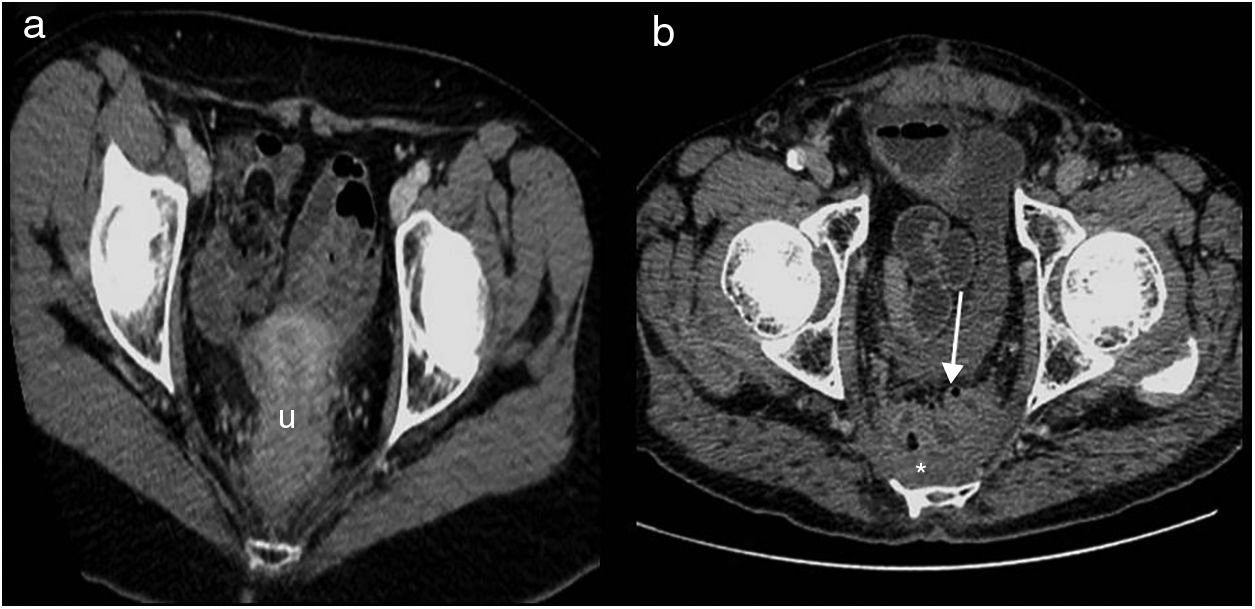
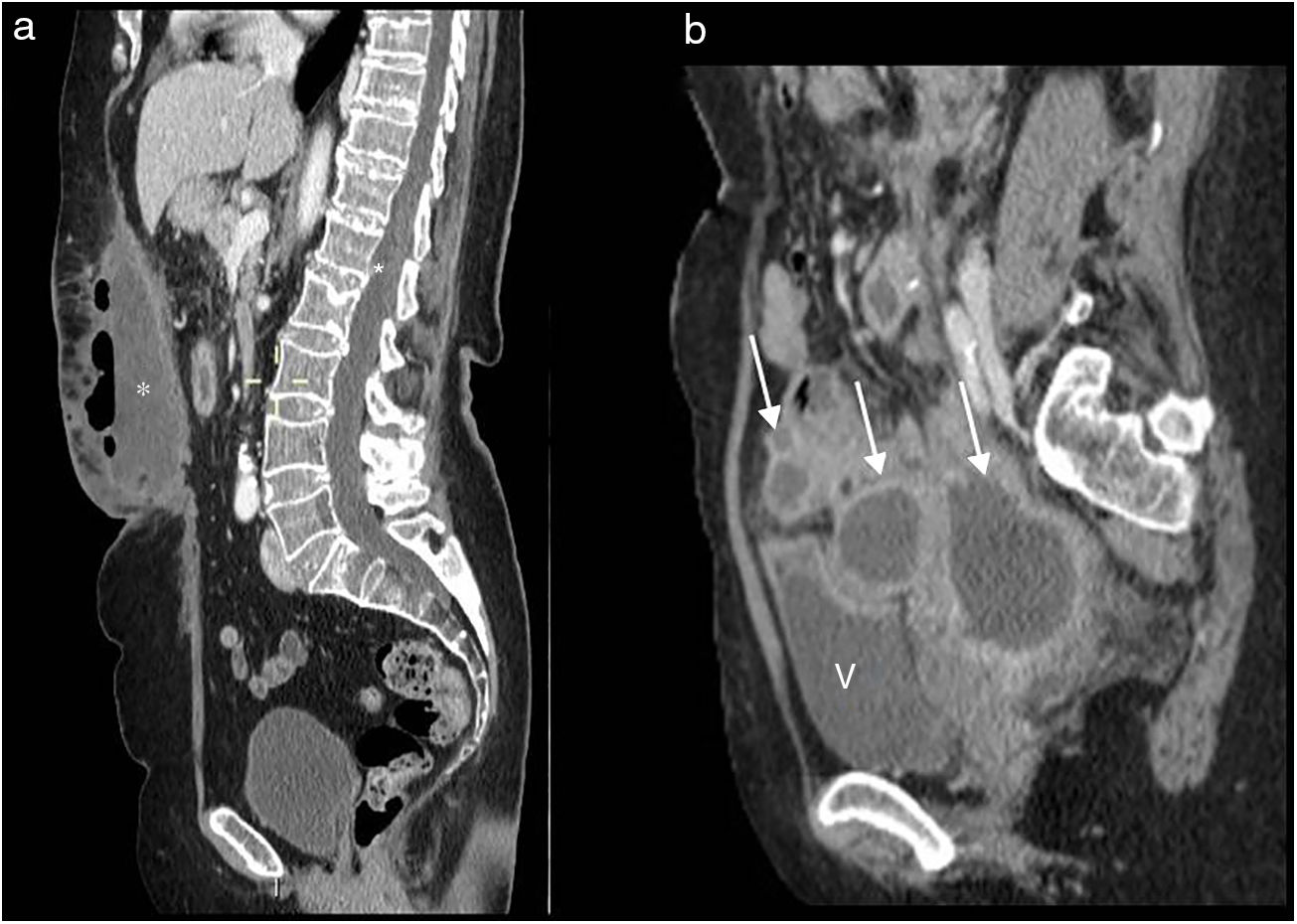
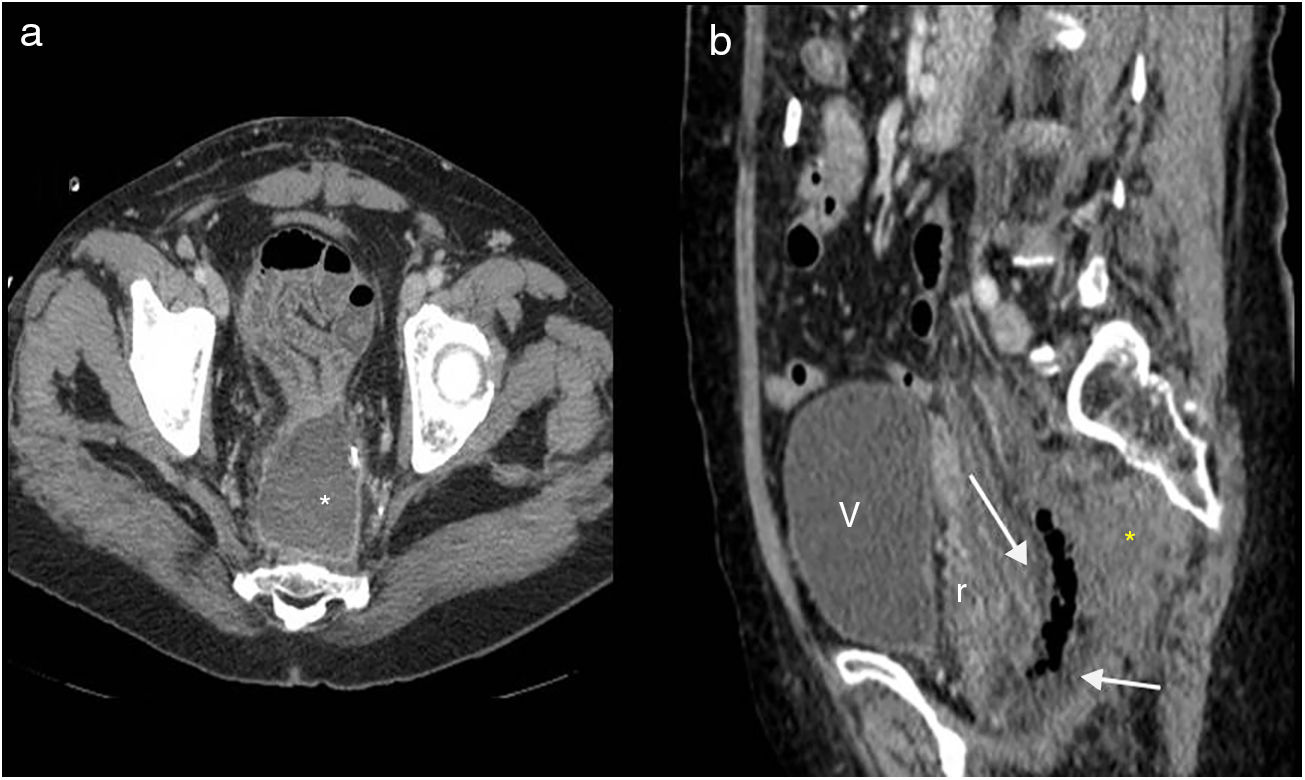
En la TC se aprecia la colostomía permanente en la pared abdominal (fig. 2 A), el desplazamiento posterior de las estructuras pélvicas urogenitales (vejiga, útero y próstata) y asas de intestino delgado en posición precoxígea (fig. 3 A). El útero, en esta localización, puede confundirse con cambios posquirúrgicos o recidiva local (fig. 3 B).
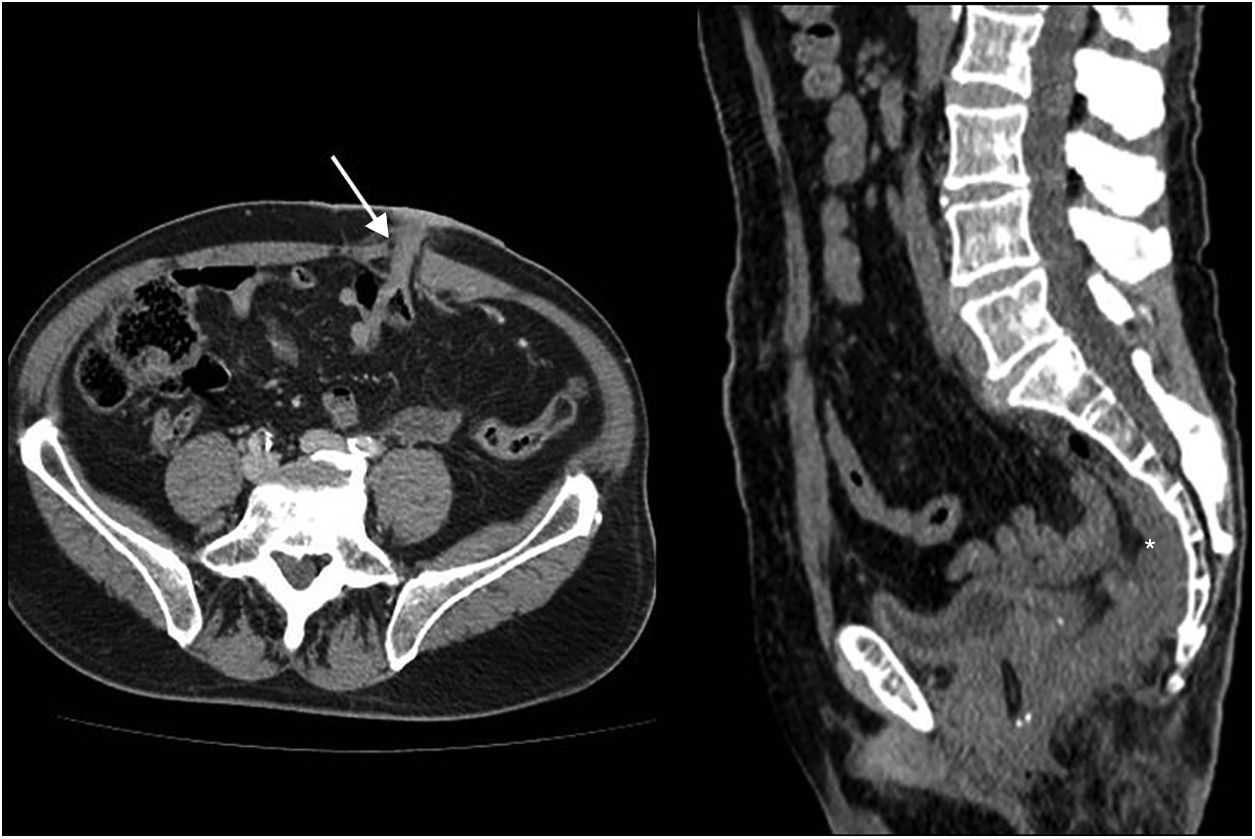
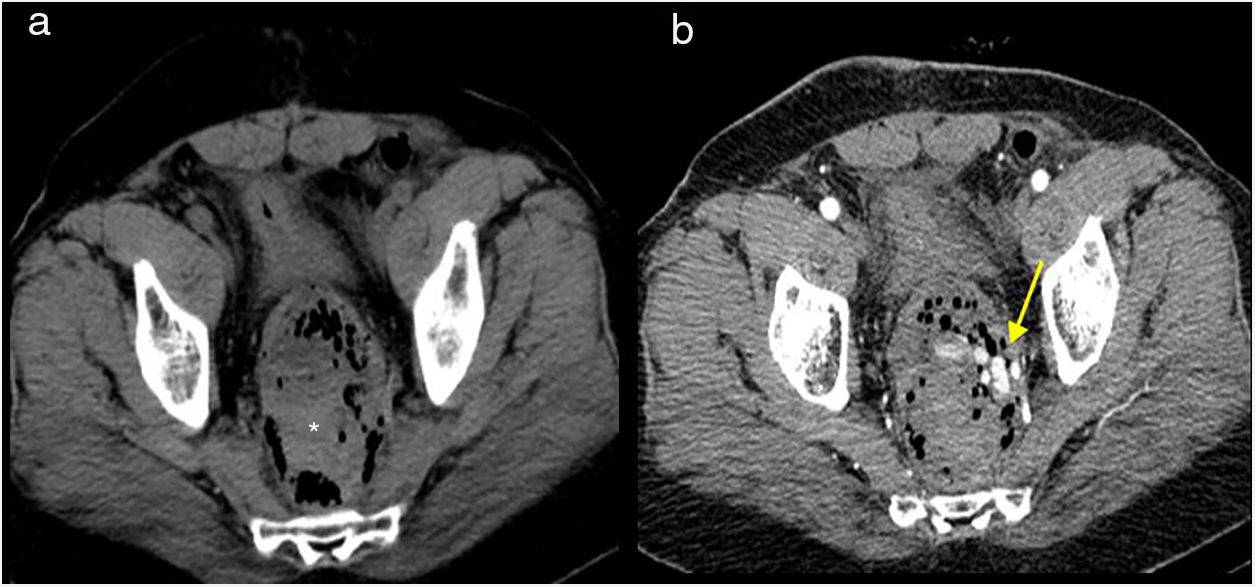
Resección abdominoperineal. Tomografía computarizada multidetector de abdomen sin contraste intravenoso. a) Corte transversal: se aprecia colostomía definitiva en fosa ilíaca izquierda (flecha). b) Reconstrucción sagital, imagen de densidad de tejidos blandos en localización presacra (asterisco).
Resección abdominoperineal. Tomografía computarizada multidetector de abdomen con contraste intravenoso, cortes transversales. a) Se identifica el útero desplazado posteriormente en localización presacra (u). b) Pequeña colección líquida (asterisco) y asas de intestino delgado (flecha) en localización presacra.
La mayoría de los pacientes con RAP presentan una masa presacra en la línea media de aproximadamente 3-5cm de diámetro máximo en la evaluación inicial8 (Fig. 2 B). Esta masa representa tejido de granulación, fibrosis posquirúrgica. Puede ser indistinguible de una recurrencia tumoral, y son los cambios en los controles sucesivos los que ayudan a su diferenciación. Por eso está indicado realizar un estudio de referencia en los 2 a 4 meses posteriores a la cirugía.
Generalmente, la masa posquirúrgica muestra disminución de tamaño y mejor definición de sus bordes en el seguimiento, aunque puede permanecer estable y persistir por encima de los 2 años, o incluso definitivamente. El incremento de tamaño o cambios en su morfología indicarían recurrencia local. La tomografía por emisión de positrones/tomografía computarizada (PET/TC) es el estudio de elección ante la sospecha de recidiva, con una sensibilidad del 98% y una especificidad del 96%9,10.
Existen tres tipos de anastomosis:
- 1.
Anastomosis término-terminal. Está indicada cuando el diámetro de los dos extremos es similar; habitualmente son anastomosis colocolónicas o colorrectales.
- 2.
Anastomosis término-lateral o látero-terminal. Se usa cuando los cabos intestinales tienen diferentes diámetros. Se emplea generalmente en las anastomosis ileocólica o ileorrectal.
- 3.
Anastomosis látero-lateral. Se conectan los dos bordes antimesentéricos del intestino. Tiene la ventaja de una mejor revascularización y es utilizada comúnmente en las anastomosis ileocólicas y en las de intestino delgado5,11.
- 1.
En el periodo postoperatorio inmediato es frecuente observar alteración en la densidad grasa y pequeñas colecciones líquidas, no encapsuladas, tanto en el lecho quirúrgico como en los espacios anatómicos normales4,12.
- 2.
Cambios en la pared abdominal anterior: se identifica la incisión quirúrgica como una banda de aumento de densidad que se extiende desde los planos peritoneales hasta la piel y se asocia con pequeñas zonas de alteración de la grasa subcutánea12.
- 3.
Neumoperitoneo. El aire libre después de la cirugía abdominal puede representar simplemente aire residual, que generalmente es bien tolerado, se reabsorbe con el tiempo y no necesita ningún tipo de intervención; o puede indicar la existencia de una complicación tipo fuga de la anastomosis o perforación de víscera hueca que requieren intervención quirúrgica urgente.
El neumoperitoneo posquirúrgico se aprecia en un 60% de las cirugías abiertas y en un 25% de las laparoscópicas. Se resuelven espontáneamente en un tiempo que depende de las características del paciente y de la técnica de imagen usada. En la radiografía de tórax o abdomen, el neumoperitoneo posquirúrgico se resuelve en 2 días en un 67% de los pacientes y en 5 días en el 97% de ellos. En TC se identifica a los 3 días en un 85% de los casos, y en un 50% de los pacientes puede identificarse a los 6 días tras la cirugía, pero puede llegar a persistir hasta 10-24 días13,14.
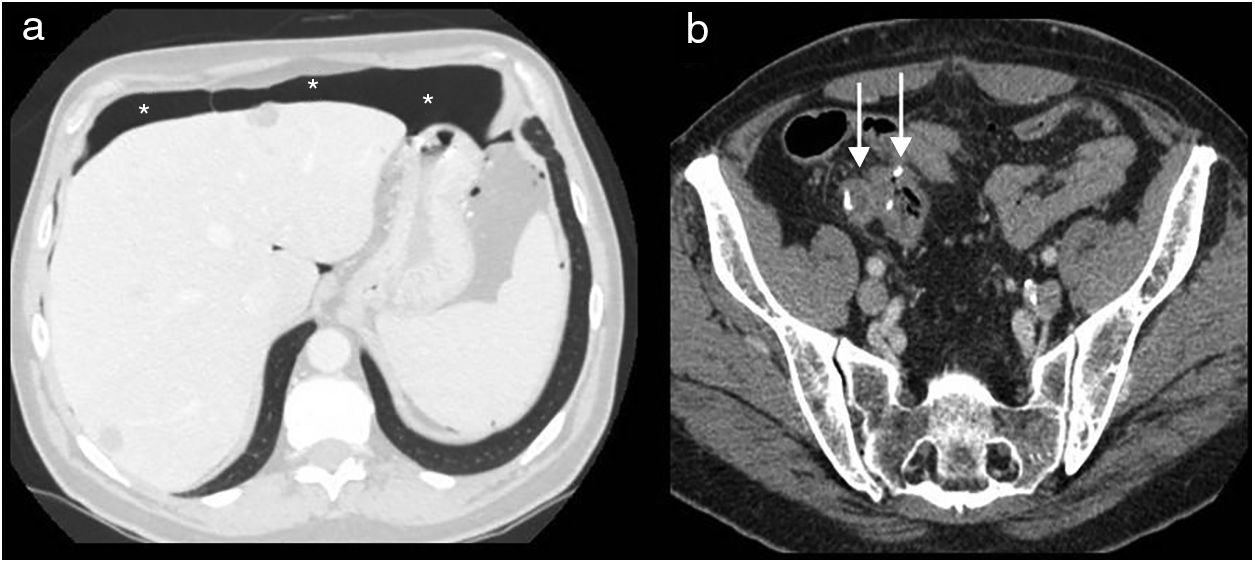
El manejo del neumoperitoneo posquirúrgico dependerá de la historia clínica, la exploración física y los datos analíticos del paciente. Los datos clínicos de peritonitis, inestabilidad hemodinámica o sepsis indican la intervención quirúrgica urgente. El neumoperitoneo por sí solo no requiere actuación, solo vigilancia (fig. 4). Sin embargo, la existencia de líquido libre asociado al mismo debe hacernos sospechar una complicación posquirúrgica15.
Figura 4.Neumoperitoneo posquirúrgico al 8.° día tras colectomía total. Tomografía computarizada multidetector de abdomen con contraste intravenoso, cortes transversales. a) Ventana de pulmón: se aprecia cámara de neumoperitoneo perihepático anterior (asteriscos). b) Anastomosis ileorrectal (flechas) sin signos de complicación. Ausencia de signos clínicos de peritonitis. Se resolvió espontáneamente.
(0.09MB). - 4.
Íleo posquirúrgico: el íleo posquirúrgico se considera un fenómeno normal dentro de los tres o cuatro primeros días después de una cirugía abdominal, –hasta 5 días en la cirugía del colon–, como una respuesta fisiológica del organismo ante una agresión externa16.
- 5.
Enfisema subcutáneo: es más frecuente en la cirugía laparoscópica en la que la insuflación prolongada de CO2 en la pared abdominal puede conducir a un enfisema subcutáneo, que puede llegar a ser extenso. Esta crepitación suele resolverse tras la desinsuflación del abdomen, deja mínimas secuelas clínicas y desaparece a los 7 días de la cirugía. Es importante reconocer este hallazgo y no confundirlo con la fascitis necrotizante, que es una urgencia quirúrgica. La incidencia de fascitis necrotizante tras cirugía laparoscópica es muy rara, habitualmente se manifiesta más tardíamente (aproximadamente a los 10 días de la intervención) y en general se asocia a eritema periincisional, drenaje maloliente que supura de la herida, fiebre y dolor17.
Las complicaciones posquirúrgicas tempranas más frecuentes incluyen: complicaciones de la herida quirúrgica, fuga anastomótica, abscesos, íleo paralítico/obstrucción intestinal, hemorragia abdominal y daño en órganos adyacentes4,5,16.
Complicaciones en la pared abdominalInfecciónLas incisiones se infectan en aproximadamente un 5-10% de los pacientes a los que se practica cirugía abdominal12. A pesar de la adecuada preparación intestinal y de los antibióticos profilácticos, el riesgo de infección sigue siendo alto y a menudo es debido a la contaminación por gérmenes anaerobios. Esto puede conducir a la inflamación, infección y necrosis de la herida quirúrgica5.
La infección de la pared se manifiesta clínicamente con signos inflamatorios en la herida, febrícula y leucocitosis. Suele presentarse en la 2.ª-3.ª semana del postoperatorio4.
En la TCMD, la celulitis se muestra con engrosamiento y septaciones de la piel y de la grasa subcutánea y engrosamiento de la fascia superficial adyacente. Los abscesos se presentan como colecciones de baja densidad, con realce periférico, con o sin contenido aéreo en su interior, y cambios inflamatorios, del tejido subcutáneo adyacente18,19 (fig. 5 A).
Tomografía computarizada multidetector de abdomen con contraste intravenoso, reconstrucciones sagitales. a) Absceso de pared abdominal: colección líquida, con contenido aéreo formando nivel hidroaéreo y con aumento de densidad y espiculaciones en el tejido subcutáneo adyacente (asterisco). b) Abscesos intraabdominales: colecciones hipodensas, con cápsulas periféricas realzadas por el contraste (flechas). V: vejiga.
Es necesario el drenaje de las colecciones y la administración de antibióticos de amplio espectro para evitar complicaciones tanto a nivel local (dehiscencia y hernia incisional) como sistémicas (peritonitis o sepsis sistémica)12.
El diagnóstico diferencial suele incluir seromas, que son colecciones líquidas que se resuelven gradualmente durante la primera y la segunda semana postoperatoria12.
HematomaUn pequeño hematoma, en el sitio de la incisión, no es infrecuente en el postoperatorio inmediato. Sin embargo, se puede desarrollar un hematoma importante de la vaina del recto como resultado de problemas de coagulación o por una lesión de los vasos epigástricos durante la incisión abdominal12.
Los signos más característicos son dolor abdominal, masa palpable y descenso de la hemoglobina.
Si los hematomas son supraumbilicales, pueden quedar confinados en el espesor del músculo o limitados por su vaina. En los infraumbilicales, donde no existe vaina posterior del recto, se pueden extender al espacio extraperitoneal supravesical y de ahí a la cavidad peritoneal provocando hemoperitoneo20.
El aspecto en TC es variable dependiendo de su evolución. Inicialmente se pueden presentar como una masa fusiforme de alta atenuación, que puede mostrar un nivel líquido-líquido. En el estudio sin contraste, la hemorragia tiene una densidad de más de 60 UH (unidades Hounsfield) en el período agudo. Posteriormente el contenido se hace líquido.
La angio-TC está indicada en los hematomas de gran tamaño o con inestabilidad hemodinámica. Puede identificar el lugar del sangrado activo como un área de mayor densidad, similar a la del contraste, entre 85 y 300 UH21.
El tratamiento habitualmente es conservador con suspensión de la anticoagulación, corrección de la hemostasia y reposición hemática. En casos de sangrado activo está indicada la embolización, y si esta no es posible, la intervención quirúrgica22.
Dehiscencia/hernia incisionalLa dehiscencia o evisceración de la pared abdominal se define como la separación de la fascia abdominal en el postoperatorio temprano. No existe cubierta peritoneal, por lo que las asas intestinales no están contenidas en un saco peritoneal. Puede ser parcial o completa, según exista o no dehiscencia de la piel23,24.
La dehiscencia de la herida quirúrgica se produce alrededor del 9.° día postoperatorio23.
Suele asociarse a complicaciones posquirúrgicas. Entre las más frecuentes están la infección de la herida quirúrgica y el íleo paralítico. Las manifestaciones clínicas predominantes son: la salida de líquido serohemático (en “agua de lavar carne”), manchando el apósito, el íleo adinámico y el abultamiento de la herida quirúrgica. El tratamiento es la intervención quirúrgica urgente con cierre de la pared25.
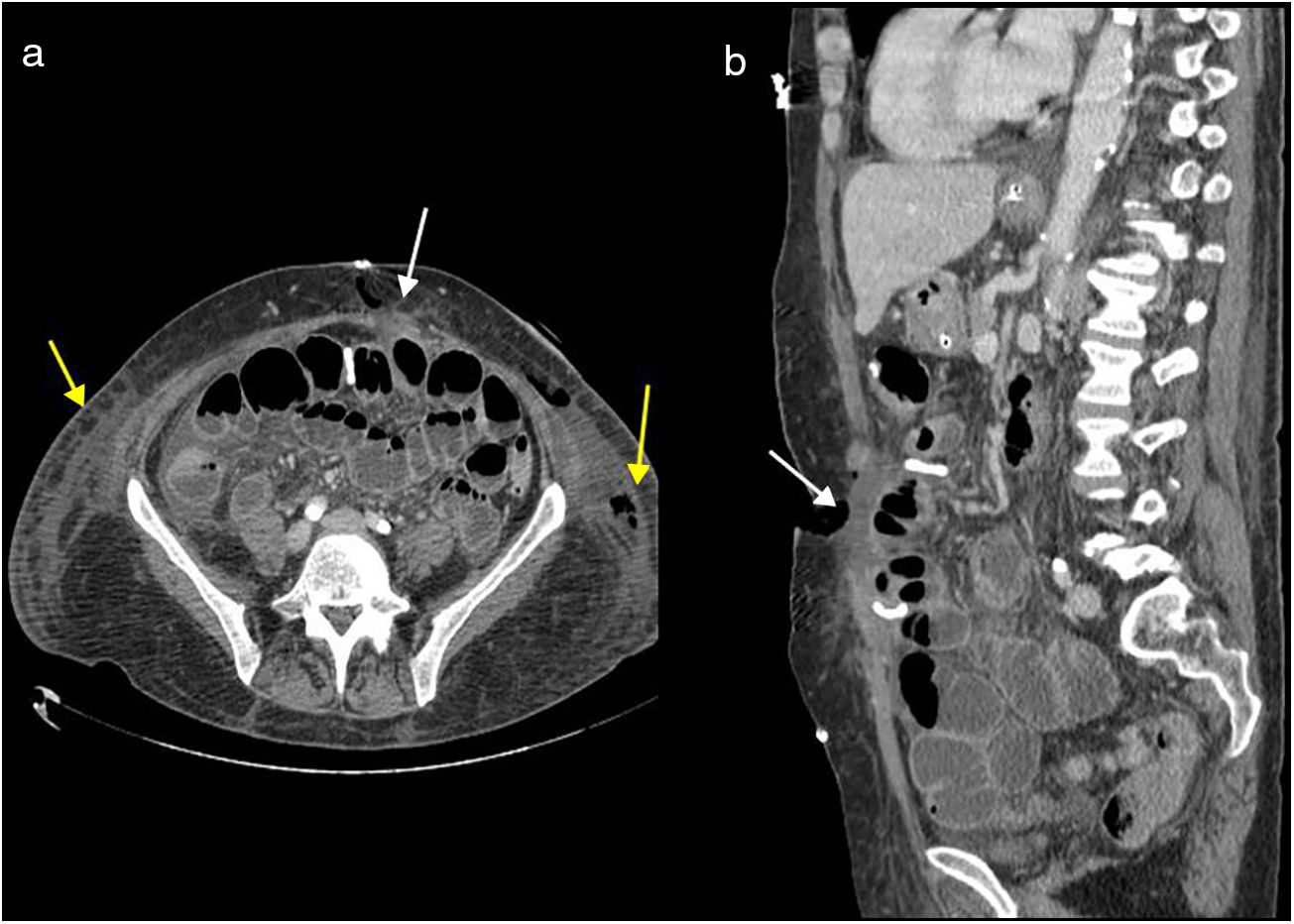
Los hallazgos tempranos de dehiscencia de la pared en TC incluyen la acumulación de líquido con aire dentro de la pared y tejidos adyacentes y la separación de las distintas capas de la pared5 (fig. 6 A y 6 B). La dehiscencia completa es una emergencia quirúrgica que se asocia con una alta morbimortalidad: entre el 15 y el 35%23.
Dehiscencia de la pared abdominal. Evisceración producida por isquemia muscular del recto izquierdo y gran infección con esfacelos. Tomografía computarizada multidetector de abdomen con contraste intravenoso, corte transversal (a) y reconstrucción sagital (b). Se aprecia disrupción completa de la pared abdominal con contenido líquido entre los bordes (flechas blancas) y acumulación de líquido en ambos flancos (flechas amarillas), con contenido aéreo en el lado izquierdo.
La hernia incisional es la protrusión anormal del peritoneo a través de la cicatriz patológica de la herida quirúrgica, que interesa a los planos músculos-fascio-aponeuróticos24. Es una complicación tardía de la cirugía abdominal, y generalmente se desarrolla durante los primeros 4 meses tras la intervención. El agrandamiento progresivo de estas hernias se manifestará habitualmente con signos y síntomas dentro del primer año26.
La TC es el método de elección para definir el defecto de la pared y la composición del saco herniario, y especialmente para evaluar las complicaciones asociadas, como la obstrucción intestinal.
Una hernia estomal o paraestomal es una forma común de hernia incisional en la que existe una protrusión anormal del contenido de la cavidad abdominal a través del estoma o adyacente al mismo. No suele ser motivo de consulta urgente a menos que se sospechen complicaciones como obstrucción intestinal, perforación o incarceramiento del asa herniada5.
Complicaciones intraabdominalesInfección de la cavidad abdominal: absceso/peritonitisSe producen esencialmente por dos causas: por el desarrollo de una contaminación microbiana masiva durante la intervención quirúrgica o por la dehiscencia de la sutura. También pueden ser secundarias a infección de la pared, fístulas y perforación. En todas estas situaciones se produce una contaminación del peritoneo que da lugar al desarrollo de abscesos localizados o peritonitis generalizada27.
Clínicamente, se presenta hacia el quinto o sexto día del postoperatorio con dolor abdominal acompañado de fiebre elevada (>38°C) y una respuesta inflamatoria sistémica que incluye fiebre, taquicardia y taquipnea. La rigidez con defensa abdominal sugiere la presencia de peritonitis27,28.
La TC es la técnica de elección para el diagnóstico. Los signos más característicos en TC de absceso son: colección hipodensa (10-30 UH), con realce periférico con el contraste, y la posibilidad de que existan septaciones, gas o niveles hidroaéreos en su interior5,12,29 (fig. 5 B).
La peritonitis suele manifestarse con ascitis, aumento de atenuación de la grasa mesentérica y engrosamiento focal o difuso del peritoneo que muestra hipercaptación con el contraste. Pueden identificarse colecciones asociadas e íleo paralítico reactivo a los cambios inflamatorios de vecindad, y neumoperitoneo en casos de perforación o dehiscencia de sutura30.
Los antibióticos y el drenaje están indicados en los abscesos intraabdominales cuando no hay signos de peritonitis generalizada. En casos de peritonitis, el tratamiento indicado es quirúrgico y el objetivo primordial es eliminar el foco, cerrando y controlando la fuente de contaminación27–29.
Fuga anastomóticaSe define como la salida del contenido intraluminal al exterior a nivel de la unión quirúrgica entre dos vísceras huecas. Algunos autores las clasifican en subclínicas o clínicas31.
Es una complicación grave, potencialmente mortal; aunque algunas pueden manejarse de forma conservadora, la mayoría requieren cirugía urgente con un marcado aumento en la morbimortalidad del paciente32,33.
Generalmente se manifiesta en las dos primeras semanas del postoperatorio, con mayor frecuencia entre los días 5 y 75,33.
La presentación clínica no siempre es específica. Suele ser con fiebre, leucocitosis, elevación de la proteína C reactiva, dolor abdominal e íleo paralítico. Otros signos más específicos serían la presencia de material purulento o fecaloideo por el drenaje.
En casos de fugas clínicamente aparentes o con signos de sepsis o peritonitis está indicada una relaparotomía urgente. El desafío diagnóstico es identificar la fuga anastomótica en el período postoperatorio temprano y en los casos con síntomas leves o inespecíficos33–35.
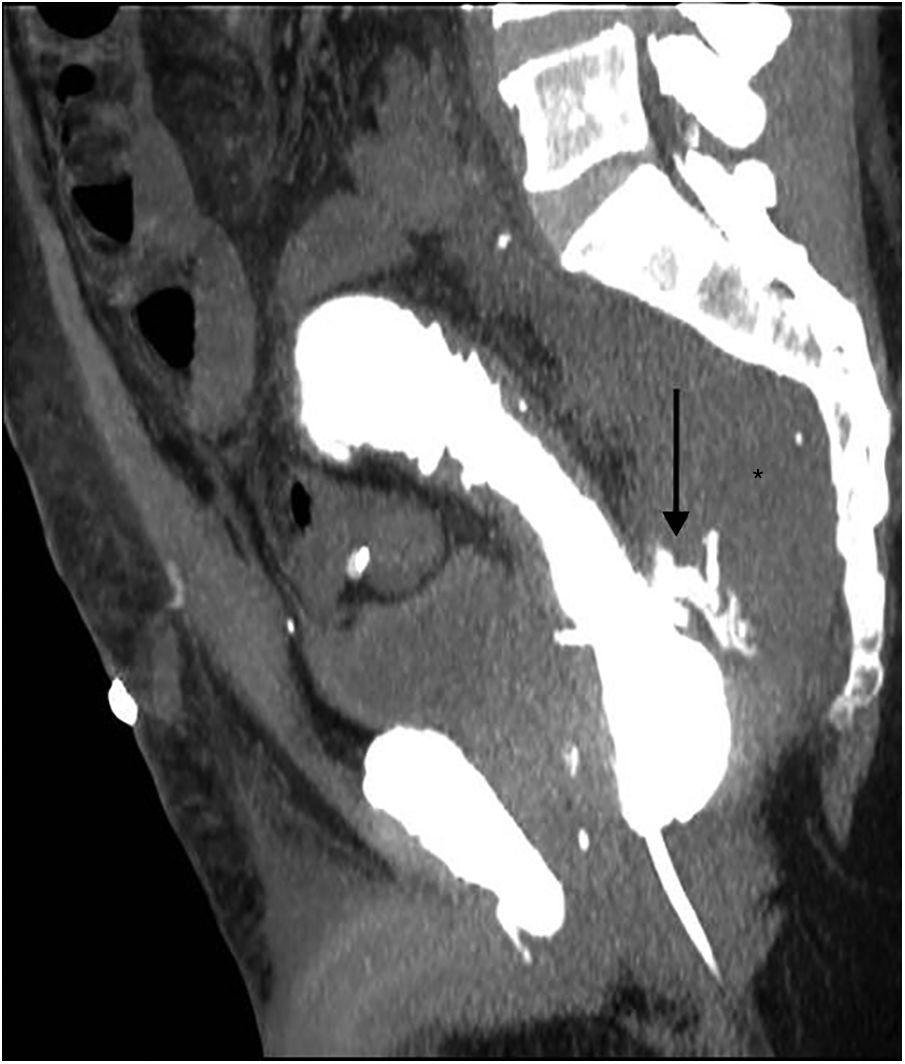
La TC con contraste i.v. es la técnica de elección. La extravasación del contraste rectal, cuando se usa, es el signo más específico de fuga anastomática (fig. 7). A nivel rectal, cuando la extravasación es franca puede producirse el signo del doble recto5,32. Pueden darse falsos negativos en los defectos anastomóticos muy pequeños o en las anastomosis más proximales, en las que el contraste se diluye y puede que no haya presión suficiente para provocar la fuga35.
Resección abdominal baja. Pequeña dehiscencia de sutura. Tomografía computarizada multidetector de abdomen con contraste endorrectal, imagen sagital con reconstrucción MIP. Se identifica pequeña extravasación del contraste rectal (flecha) y aumento de partes blandas en localización presacra (asterisco).
Otros signos de fuga son: grandes colecciones de aire y líquido (hidroneumoperitoneo), absceso en el lecho quirúrgico, y colecciones perianastomóticas con líquido y/o aire que es el hallazgo más frecuente. Cuando la fuga es a nivel rectal puede apreciarse un desplazamiento anterior del recto (separado del sacro más de 5cm)32,33,35,36 (figs. 8 y 9).
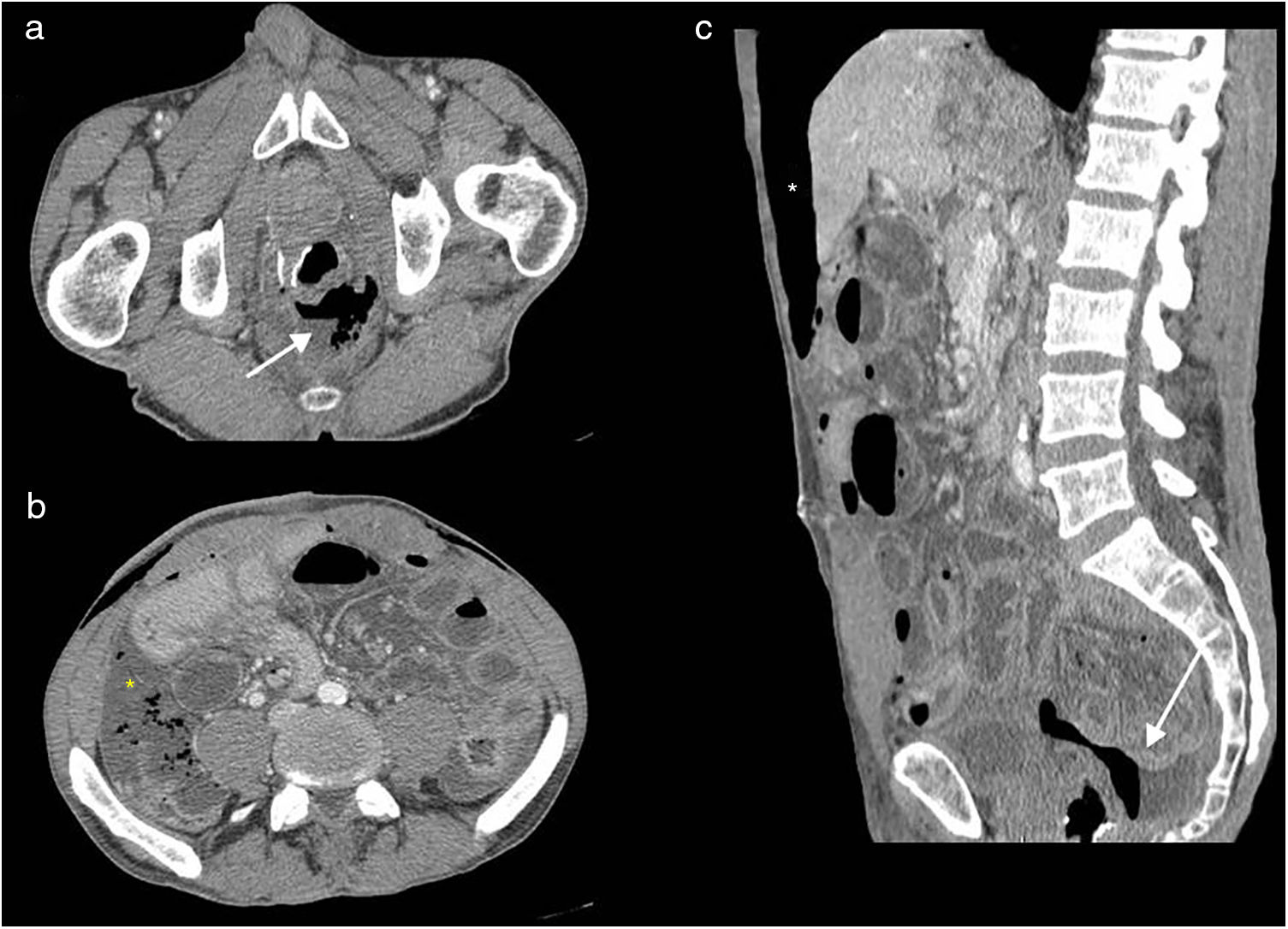
Resección abdominal baja. Dehiscencia de sutura. Tomografía computarizada multidetector de abdomen con contraste intravenoso, cortes transversales (a y b) y longitudinal (c). Colección hidroaérea adyacente a la anastomosis (flechas blancas), cámara de neumoperitoneo perihepática anterior (asterisco blanco) y líquido libre con burbujas aéreas que predomina en gotiera paracólica derecha (asterisco amarillo). Ligero engrosamiento de la pared de las asas de intestino delgado, con contenido líquido en su pared en relación con cambios inflamatorios reactivos (íleo secundario).
Resección abdominal baja. Dehiscencia de sutura. Tomografía computarizada multidetector de abdomen con contraste intravenoso, corte transversal (a) y reconstrucción sagital (b). a) Absceso pélvico, en el lecho quirúrgico (asterisco). b) Masa de partes blandas anterior al sacro (asterisco) que produce un desplazamiento anterior del recto (r), pequeña colección líquida con abundante contenido aéreo en el lecho quirúrgico. V: vejiga.
La apariencia de las grapas de sutura no tiene precisión para evaluar la integridad de la anastomosis32.
DuBrow et al. y Matthiessen et al. mostraron que los pacientes con y sin fuga anastomótica tienen hallazgos similares en el postoperatorio temprano (pequeñas colecciones líquidas reactivas y neumoperitoneo). Esto indica que, en la realización de la TC, el tiempo puede influir en la precisión diagnóstica de fugas anastomóticas36.
Es imprescindible relacionar los hallazgos en TC con los datos clínicos y analíticos. Si existe sospecha clínica y la TC es negativa, pueden realizarse pruebas adicionales con contraste oral o rectal o repetir la TC. Matthiessen et al. demostraron que el líquido y el aire perianastomóticos aumentan en pacientes con fuga anastomótica, en TC repetidas 7 días después de la cirugía36.
El enfoque del tratamiento se basa a menudo en los datos clínicos. Las fugas no siempre exigen el manejo quirúrgico porque algunas de ellas pueden ser autolimitadas. Si la fuga está contenida y el paciente está estable sin signos de sepsis o peritonitis, el tratamiento inicial puede ser conservador3,31.
Íleo/obstrucción intestinalEl íleo intestinal se define como la inhibición funcional de la actividad propulsora intestinal37. La motilidad del tracto gastrointestinal se altera por la anestesia y la cirugía38. Los agentes implicados en su producción son múltiples e interrelacionados37–39.
El íleo postoperatorio se considera una respuesta fisiológica en relación con la intervención quirúrgica; suele resolverse en pocos días, entre 24 y 48 horas. Aunque no existe un consenso en la definición de intervalo normal a la reanudación del tránsito, se considera normal entre 2 y 7 días según diferentes autores39.
Cuando persisten los síntomas en el tiempo se considera íleo paralítico –también llamado íleo patológico o prolongado– y debe diferenciarse del íleo secundario que está relacionado con causas extrínsecas como abscesos o peritonitis.
A veces es difícil diferenciar entre íleo paralítico y obstrucción intestinal basándose solo en los datos clínicos y la radiografía de abdomen. En estos casos, la TC es de gran ayuda. En el íleo paralítico existe una dilatación moderada y generalizada de asas de colon e intestino delgado, sin zona de transición. El colon se encuentra distendido con gas o líquido, a diferencia de la obstrucción intestinal en que suele encontrarse colapsado40.
La obstrucción intestinal en el postoperatorio temprano es la que ocurre en los primeros 30 días tras la intervención quirúrgica y debe diferenciarse del íleo postoperatorio prolongado41.
La obstrucción intestinal en este período es poco frecuente, con una incidencia aproximada del 1%. El 90% de estas obstrucciones están producidas por adherencias, especialmente cuando ha existido cuadro de peritonitis. También puede estar relacionada con hernias internas debidas a defectos omentales o mesentéricos producidos durante la intervención, con la formación de abscesos o con factores técnicos41,42.
Clínicamente es difícil de diferenciar del íleo postoperatorio. Cuando la función intestinal no se recupera pasados 5 días de la cirugía, debe descartarse una causa subyacente. La obstrucción intestinal precoz se puede tratar inicialmente de forma conservadora, durante 10-14 días; pasado este tiempo es poco probable la recuperación sin intervención quirúrgica42,43.
La TC permite identificar si existe o no obstrucción. El signo radiológico más importante para el diagnóstico de obstrucción intestinal es la transición brusca entre el intestino dilatado y no dilatado que indica el punto de la obstrucción. Las asas dilatadas tienen un diámetro mayor de 2,5cm. También puede verse el signo de las heces proximal al punto de obstrucción y ausencia de gas en colon y recto.
El uso de Gastrografín por vía oral no diluido (100 ml) puede ser útil para diferenciar entre íleo paralítico y obstructivo y sobre todo para determinar si la obstrucción es completa. Si el Gastrografin llega al colon dentro de las 24 horas posteriores a su administración, se considera que la obstrucción es parcial y puede ser tratada inicialmente de forma conservadora44.
SangradoLa hemorragia abdominal perioperatoria es una complicación infrecuente; el manejo suele ser conservador. La hemorragia intensa es excepcional.
La hemorragia abdominal perioperatoria se define por la presencia de signos de sangrado directos (hematoquecia si el sangrado es intraluminal, o presencia de sangre en el drenaje si es en la cavidad abdominal) o signos indirectos (anemización, repercusión hemodinámica)45,46.
Si el paciente se encuentra inestable, en shock hipovolémico, está indicada la intervención quirúrgica urgente. Si está estable, la angio-TC es la técnica de elección para su diagnóstico, ya que permite localizar el sangrado e identificar si existe hemorragia activa (fig. 10).
Resección abdominal baja. Dehiscencia de sutura con sangrado activo en lecho quirúrgico. Tomografía computarizada de abdomen, cortes transversales. a) Sin contraste intravenoso: colección en lecho quirúrgico con burbujas aéreas y contenido hemático en su porción declive. b) fase arterial: extravasación del material de contraste (flecha amarilla) que indica sangrado activo.
En el estudio sin contraste puede existir líquido libre de alta atenuación (>40 UH) o un hematoma, que se verá como una colección de alta densidad.
El signo del coágulo centinela se refiere a la presencia de sangre coagulada cerca del área de sangrado activo. La extravasación del contraste en fase arterial o en fase portal nos indicará si el sangrado es arterial o venoso. El sangrado activo de más de 1cm de diámetro o la extensión peritoneal son signos de sangrado intenso que sugieren una extravasación extensa45.
Las hemorragias postoperatorias que se manifiestan en forma de sangrado digestivo son menos frecuentes, entre el 1 y el 5,4% de los casos. El intervalo medio de aparición suele ser aproximadamente de una semana tras la intervención46.
Generalmente son autolimitadas y remiten con tratamiento conservador. Cuando este no funciona y como alternativa a la cirugía puede utilizarse el manejo endoscópico y la embolización angiográfica, considerados menos agresivos que una nueva intervención quirúrgica, aunque no exentos de riesgos46.
ConclusiónLas complicaciones posquirúrgicas del CCR son frecuentes. Es importante saber reconocerlas y diferenciar los hallazgos normales posquirúrgicos de complicaciones tempranas a fin de evitar intervenciones innecesarias.
Autoría- 1.
Responsabilidad de la integridad del estudio: ARD.
- 2.
Concepción del estudio: ARD.
- 3.
Diseño del estudio: ARD.
- 4.
Obtención de los datos: ARD, DMR, TRG, AGO y LCA.
- 5.
Análisis e interpretación de los datos: ARD, TRG, DMR, AGO y LCA.
- 6.
Tratamiento estadístico: NA.
- 7.
Búsqueda bibliográfica: ARD.
- 8.
Redacción del trabajo: ARD, DMR, TRG.
- 9.
Revisión crítica del manuscrito con aportaciones de interés relevante: ARD, DMA, TRG, AGO y LCA.
- 10.
Aprobación de la versión final: ARD, DMR, TRG, AGO y LCA.
Los autores declaran no tener ningún conflicto de intereses.