La tomosíntesis de la mama es una herramienta del diagnóstico radiológico que se encuentra en constante desarrollo. En esta actualización sobre tomosíntesis se hace una revisión de las ventajas de la técnica, tanto en mamografía diagnóstica como de cribado, así como de sus limitaciones, entre las que la dosis de radiación es la principal. La aparición más reciente de la mamografía sintetizada, la detección de lesiones asistida por ordenador y la biopsia guiada por tomosíntesis, ha contribuido a reducir la dosis de radiación empleada y a mejorar el rendimiento diagnóstico de la tomosíntesis, motivo por el cual también son objeto de esta revisión.
Breast tomosynthesis is a continually improving tool for diagnostic radiologists. This update about tomosynthesis reviews the advantages of the technique both in patients with suspected or known disease and in screening, as well as its limitations, of which the dose of radiation is the most important. The more recent advent of synthesized mammography, computer-assisted detection, and tomosynthesis-guided biopsy have helped to reduce the dose of radiation used and have improved the diagnostic performance of tomosynthesis, so they are also discussed in this review.
La mamografía digital (MD) es la única técnica que ha demostrado una disminución de la mortalidad y de la morbilidad por cáncer de mama, y es la técnica básica tanto para el cribado como para el diagnóstico1,2. Sin embargo, presenta dos limitaciones importantes: una baja sensibilidad en mamas densas por superposición tisular que puede ocultar la detección de pequeñas lesiones, y una especificidad limitada por imágenes de sumación del parénquima mamario normal que pueden simular patología3,4. La tomosíntesis salva estos inconvenientes y obtiene una imagen seudotridimensional de la mama. Esta técnica obtuvo la certificación de Conformidad Europea (CE) en 2008 y fue aprobada por la U.S. Food an Drug Administration (FDA) en 20115,6.
El propósito de este artículo es, por una parte, resumir los aspectos técnicos que influyen en la calidad de la imagen y, por otra, revisar las ventajas y limitaciones de la tomosíntesis en el proceso de diagnóstico y cribado del cáncer de mama frente al abordaje clásico con MD convencional. También se analiza el impacto que ha supuesto la incorporación más reciente de la mamografía sintetizada, la detección de lesiones asistida por ordenador (computer-aided detection [CAD]) y la biopsia guiada por tomosíntesis.
Sistema de TomosíntesisEl objetivo de la tomosíntesis es la reconstrucción seudotridimensional de la mama a partir de múltiples proyecciones de 1mm de grosor, todas ellas paralelas al detector, que se pueden obtener en cualquiera de las proyecciones mamográficas habituales5–7. No es estrictamente una imagen 3D como pueden serlo las reconstrucciones volume rendering de una tomografía computarizada (TC). Las imágenes de tomosíntesis se presentan consecutivamente como secciones individuales formando parte de un conjunto mayor que barre toda la mama, por lo que se prefiere el término seudotridimensional8.
En los mamógrafos digitales con tomosíntesis, la adquisición del estudio se realiza mediante la rotación del tubo de rayos X que describe un arco en torno a la mama. La imagen creada va a estar determinada por una serie de factores técnicos, diferentes en los distintos fabricantes, que influyen en el resultado final y que se resumen a continuación:
El ángulo de barridoPuede ser un barrido con ángulo ancho (>15°) o estrecho (≤15°). Por una parte, la adquisición con un mayor rango angular aumenta la resolución en profundidad y disminuye la superposición tisular, pero puede generar más borrosidad y, al alargar el tiempo de barrido, incrementar la dosis. Por otra parte, un ángulo demasiado estrecho puede realizar un barrido incompleto con aparición de artefactos5.
El tiempo de adquisiciónDebe ser corto para evitar un tiempo de compresión excesivo, lo que puede provocar incomodidad y por tanto falta de colaboración, con aparición de movimientos mínimos que degradan la calidad de la imagen5.
El movimiento del tuboExisten dos modos de adquisición. Por un lado, está la forma “step and shoot”, donde el tubo se detiene en cada exposición, con lo que evita la borrosidad por movimiento, pero alarga el tiempo de adquisición, y por otro, existe un modo “continuo”, más rápido, pero potencialmente menos nítido5.
La estructura del tuboEl uso combinado de tubos de wolframio con filtros de rodio y plata optimiza la dosis y la calidad de imagen5.
La calidad del detectorEl detector tiene que presentar una elevada velocidad de transferencia de datos con un tamaño suficientemente grande para poder registrar la imagen completa de la mama5.
Los algoritmos de reconstrucciónLos algoritmos de reconstrucción, como otros algoritmos clásicamente empleados en la TC, pueden ser iterativos (SIRT, por sus siglas en inglés Simultaneus Iterative Reconstruction Techniques) o bien FBP (Filtered Backprojection)5.
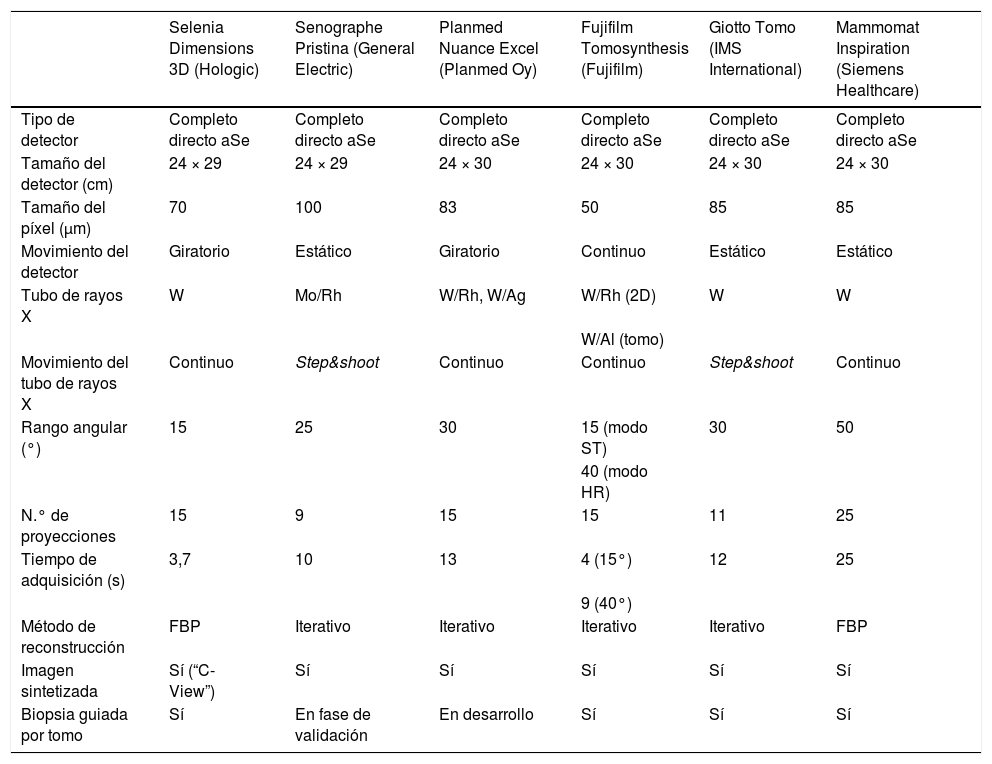
Las características y especificaciones técnicas más importantes de los equipos con certificación CE o registro en la FDA se resumen en la tabla 1.
Especificaciones técnicas de los distintos equipos disponibles actualmente en el mercado
| Selenia Dimensions 3D (Hologic) | Senographe Pristina (General Electric) | Planmed Nuance Excel (Planmed Oy) | Fujifilm Tomosynthesis (Fujifilm) | Giotto Tomo (IMS International) | Mammomat Inspiration (Siemens Healthcare) | |
|---|---|---|---|---|---|---|
| Tipo de detector | Completo directo aSe | Completo directo aSe | Completo directo aSe | Completo directo aSe | Completo directo aSe | Completo directo aSe |
| Tamaño del detector (cm) | 24 × 29 | 24 × 29 | 24 × 30 | 24 × 30 | 24 × 30 | 24 × 30 |
| Tamaño del píxel (μm) | 70 | 100 | 83 | 50 | 85 | 85 |
| Movimiento del detector | Giratorio | Estático | Giratorio | Continuo | Estático | Estático |
| Tubo de rayos X | W | Mo/Rh | W/Rh, W/Ag | W/Rh (2D) | W | W |
| W/Al (tomo) | ||||||
| Movimiento del tubo de rayos X | Continuo | Step&shoot | Continuo | Continuo | Step&shoot | Continuo |
| Rango angular (°) | 15 | 25 | 30 | 15 (modo ST) | 30 | 50 |
| 40 (modo HR) | ||||||
| N.° de proyecciones | 15 | 9 | 15 | 15 | 11 | 25 |
| Tiempo de adquisición (s) | 3,7 | 10 | 13 | 4 (15°) | 12 | 25 |
| 9 (40°) | ||||||
| Método de reconstrucción | FBP | Iterativo | Iterativo | Iterativo | Iterativo | FBP |
| Imagen sintetizada | Sí (“C-View”) | Sí | Sí | Sí | Sí | Sí |
| Biopsia guiada por tomo | Sí | En fase de validación | En desarrollo | Sí | Sí | Sí |
FBP: Filtered Backprojection;
Adaptada y actualizada para Radiología según los datos aportados por los fabricantes, y con autorización del autor del artículo original5.
Se puede utilizar de manera combinada la MD convencional con la tomosíntesis (“método combo”), adquiriendo por separado las imágenes de ambos estudios. No obstante, casi todas las casas comerciales disponen de mamografía sintetizada 2D (s2D), una aplicación que permite reconstruir las imágenes individuales de un estudio de tomosíntesis obteniendo una mamografía 2D comparable a la MD convencional. En este caso, se adquiere un estudio de tomosíntesis completo, es decir, en proyecciones craneocaudal (CC) y mediolateral oblicua (MLO), y se crea de manera virtual la mamografía 2D para cada vista (CC y MLO). De esta forma, se evita la realización de un estudio de MD convencional con 2 proyecciones.
Para obtener esta imagen virtual, las múltiples secciones que componen un estudio de tomosíntesis se posprocesan según un algoritmo de reconstrucción donde se mantienen los vóxeles con altos valores de atenuación creando una imagen en un solo plano 2D9–14, de una manera análoga a las reconstrucciones MIP (maximum intensity projection) de una TC.
El principal valor de la mamografía s2D resulta de su uso como técnica sustituta de la MD convencional en el cribado de cáncer de mama con MD y tomosíntesis, con el consecuente ahorro de dosis, sin perjuicio de la capacidad diagnóstica15,16.
La FDA autoriza el uso de mamografía s2D como alternativa a la MD convencional desde mayo de 201317.
Estudio de TomosíntesisProtocolo del examenUn sistema de tomosíntesis puede adquirir imágenes en proyecciones CC, MLO, mediolateral, compresión focalizada (spot) y vistas desplazadas del implante, y no permite la realización de imágenes magnificadas.
Un examen simple de tomosíntesis (con proyecciones CC y/o MLO) mejora la detección y caracterización de las lesiones en comparación con un examen de solo MD3,18–20. Inicialmente se sugirió restringir la realización de la tomosíntesis a la proyección MLO para limitar la dosis de radiación. Las diferencias en la visibilidad y detección de las lesiones, según la proyección utilizada, han cambiado, y se estima que el 7-9% de los cánceres confirmados solo se observa en una de las dos proyecciones de tomosíntesis, por lo que podrían pasar desapercibidos si la mama no se explora en esa proyección. Además, el 5-6% de los cánceres solo se ve en la proyección CC, y a su vez es más probable que el cáncer que es visible en una sola vista lo sea en la proyección CC19,21,22.
Por lo tanto, en caso de no disponer de imagen sintetizada, es recomendable realizar un examen de tomosíntesis completo en las dos proyecciones para la mamografía de diagnóstico. No obstante, el protocolo que debe seguirse en cada escenario clínico (mamografía de diagnóstico o mamografía de cribado) debe ser evaluado en cada centro.
Proceso de lectura e informeLos hallazgos más frecuentes detectados con el uso de la tomosíntesis son los siguientes:
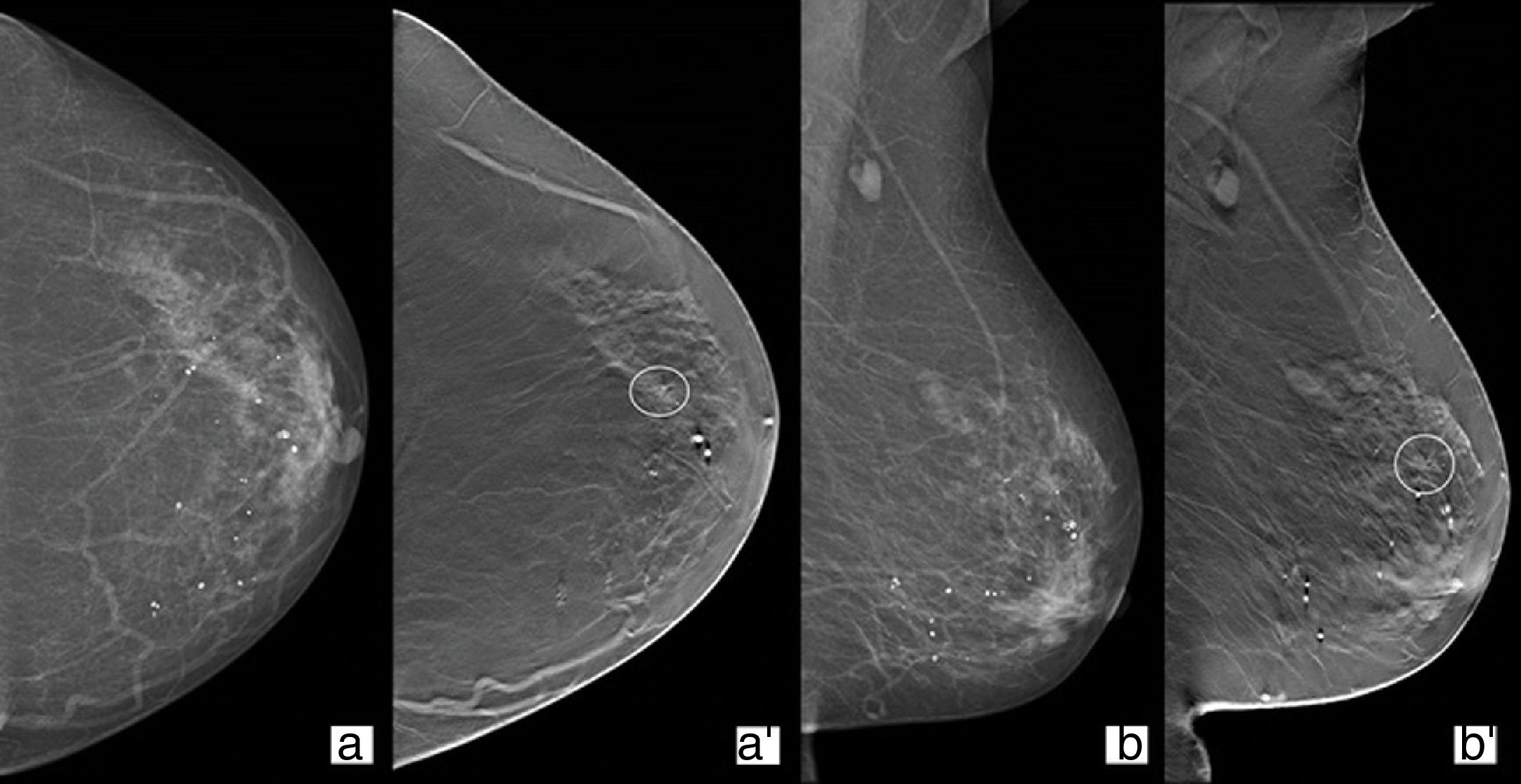
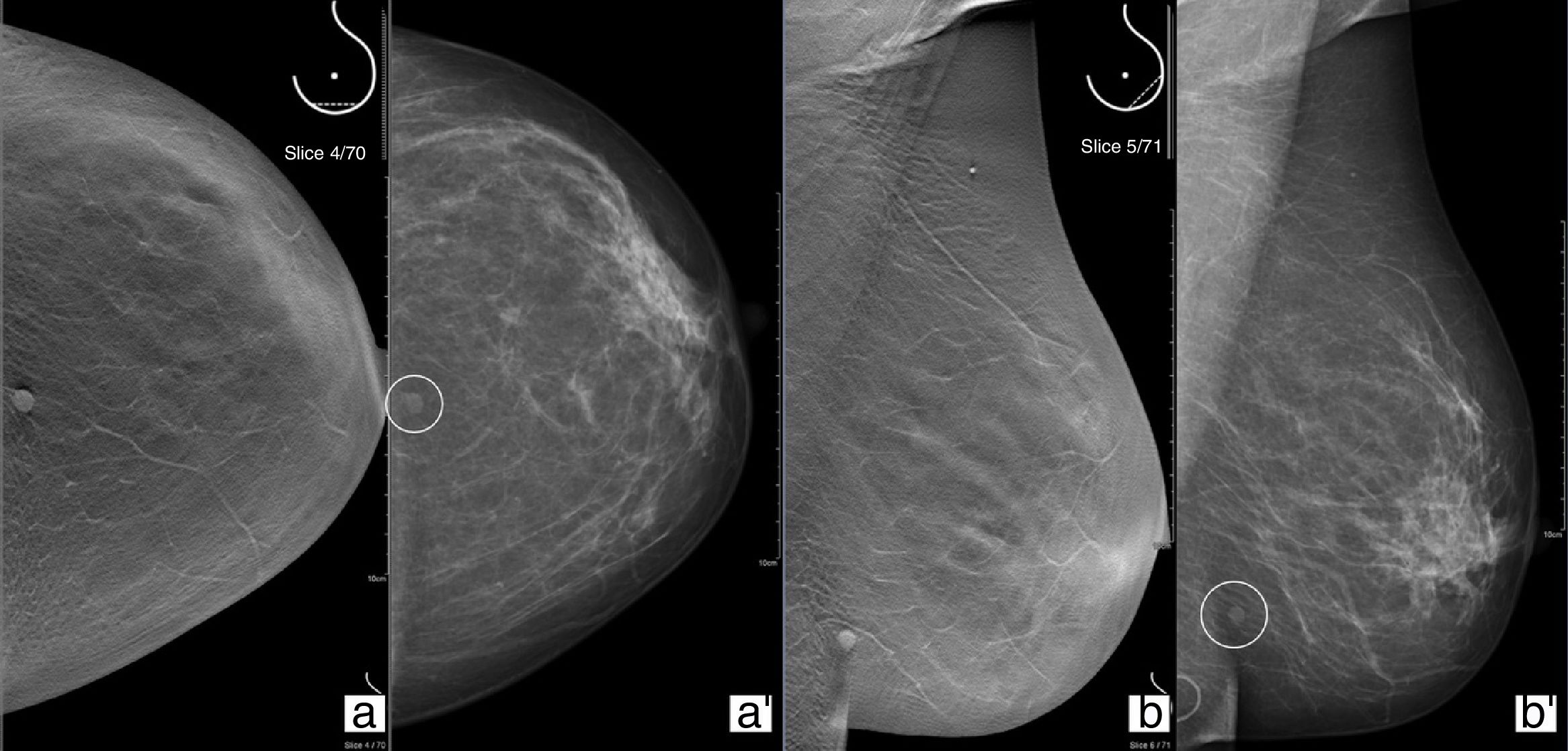
Distorsión arquitecturalPor frecuencia, es el tercer tipo de hallazgo más detectado en estudios de mamografía. De las lesiones que se detectan solo en una proyección de tomosíntesis, es la más habitual. Es también el descriptor de imagen que está más relacionado con cáncer de mama clínicamente negativo (fig. 1)23.
Revisión de una mujer de 74 años con antecedente de mastectomía derecha por carcinoma infiltrante en 2006. Proyecciones craneocaudal (CC)/mediolateral oblicua (MLO) de mamografía convencional 2D (a y b) donde se visualiza una mama izquierda heterogéneamente densa (composición C) sin evidencia de nódulos ni distorsiones parenquimatosas. Tomosíntesis en proyección CC/MLO (a’ y b’) donde se visualiza en cuadrante superoexterno, zona horaria 2 en su tercio anterior, una distorsión del parénquima con traducción en estudio ecográfico. Resultado: carcinoma lobulillar infiltrante.
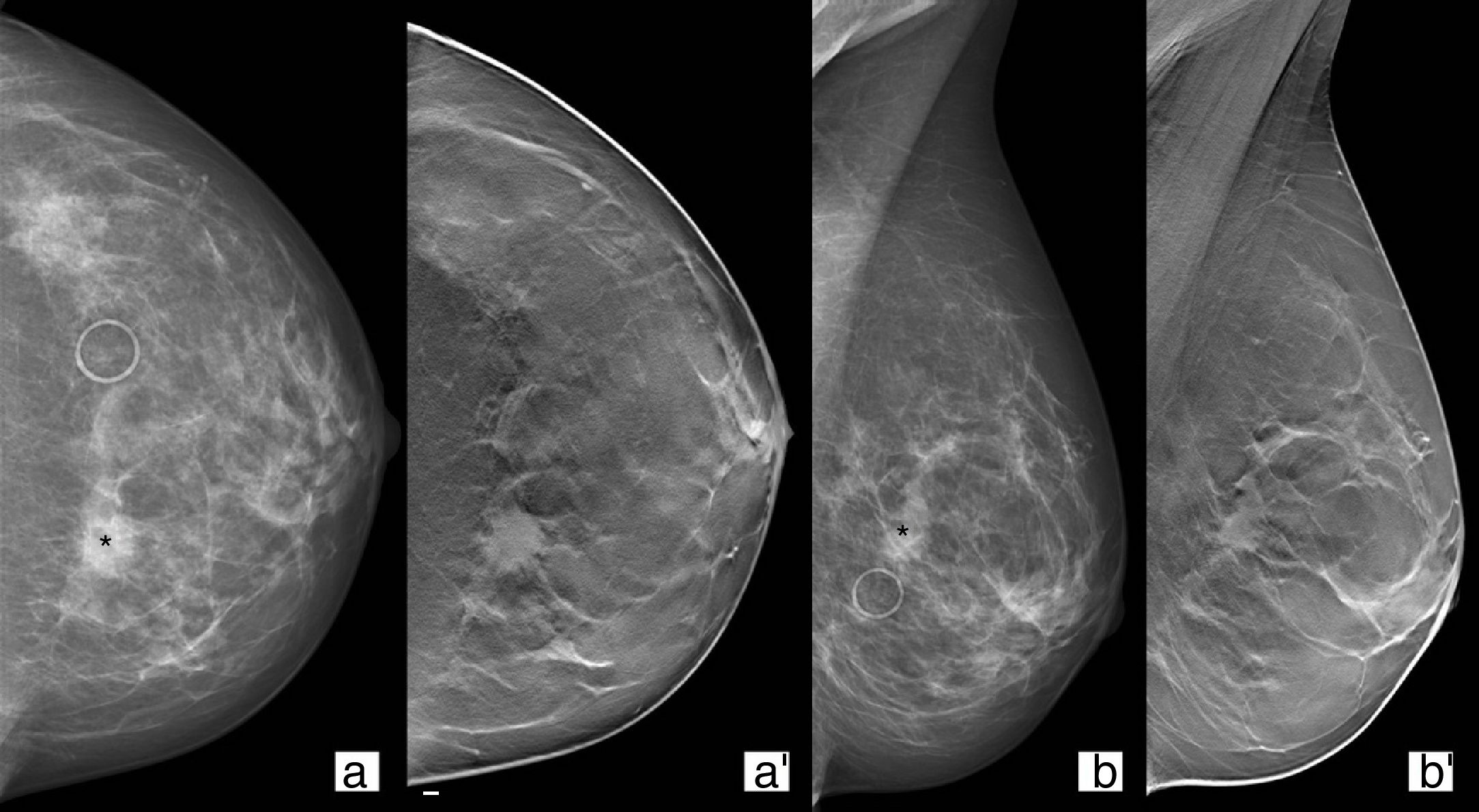
La tomosíntesis es útil para confirmar y caracterizar un aumento de densidad en un estudio de mamografía como una “verdadera” asimetría focal, descartarla por superposición o reclasificarla como un nódulo (fig. 2)24.
Paciente de 49 años procedente del programa de cribado por asimetría focal (asterisco) en mama izquierda (a y b). Tomosíntesis en proyección craneocaudal/mediolateral oblicua (a’ y b’) donde se evidencia un nódulo de morfología ovalada y márgenes espiculados subyacente a la asimetría por la que es remitida. Resultado: carcinoma ductal infiltrante.
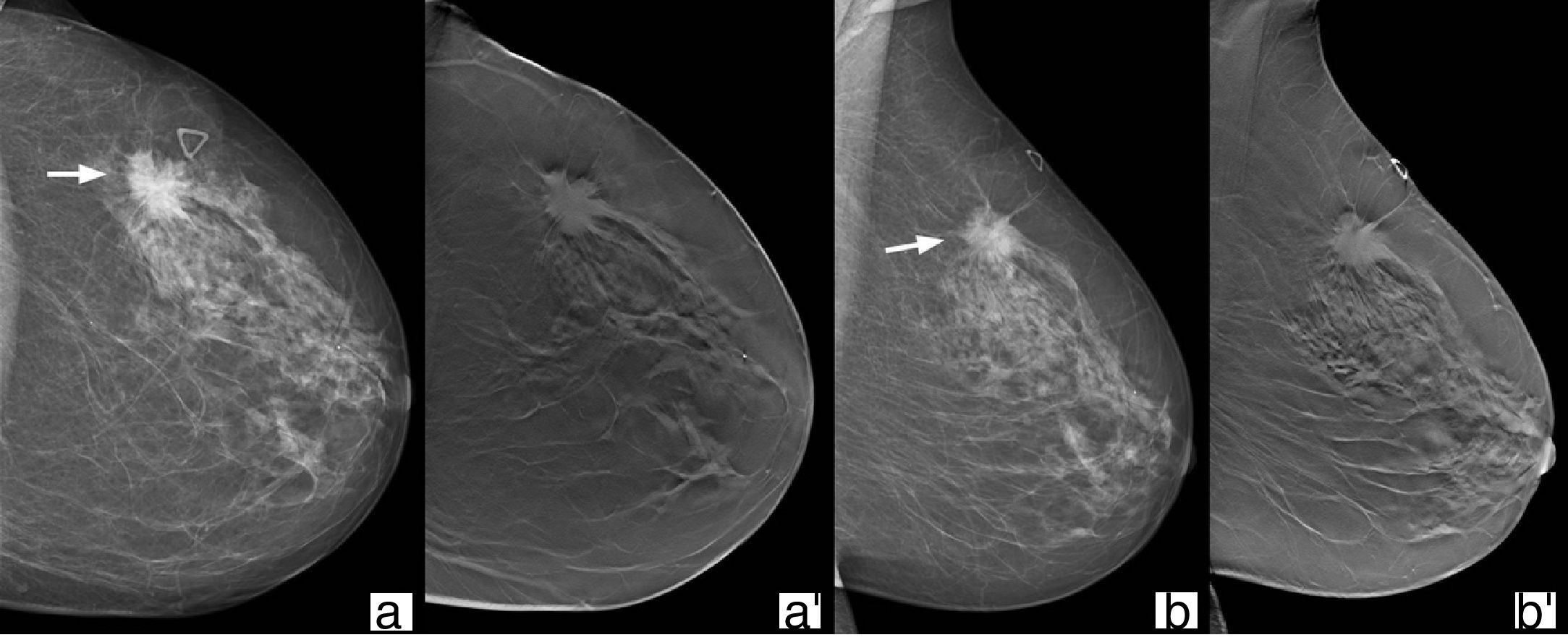
La tomosíntesis permite una mejor caracterización de su forma, márgenes y densidad. Aunque la hiperdensidad es una característica propia de procesos malignos, no ocurre con el uso de tomosíntesis, puesto que se elimina la superposición de los tejidos (fig. 3). Del mismo modo, la presencia de grasa intralesional no es una característica de benignidad en los nódulos visualizados con tomosíntesis, ya que los cánceres pueden, en su crecimiento, incluir el tejido adiposo de vecindad, lo que hace necesaria una evaluación cuidadosa en el caso de nódulos que contienen grasa no encapsulada25.
Mujer de 72 años remitida por nódulo palpable en mama izquierda. En mama izquierda, cuadrante superoexterno, zona horaria 2 en su tercio posterior, se visualiza un nódulo de morfología y márgenes irregulares (flechas), hiperdenso respecto al parénquima mamario en mamografía convencional 2D (a y b), que en el estudio de tomosíntesis (a’ y b’) es isodenso. Resultado: carcinoma ductal infiltrante.
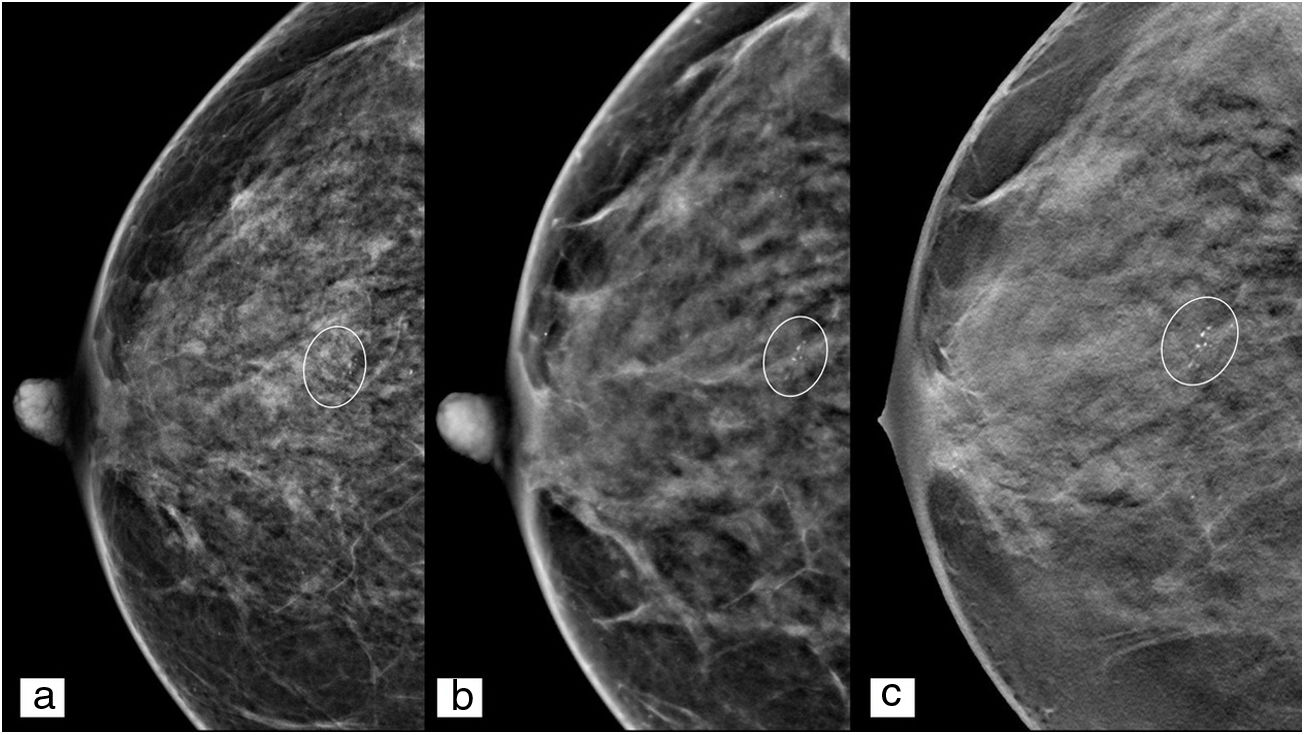
Se recomienda el uso de la proyección magnificada para su caracterización, ya que en cada imagen individual de tomosíntesis se podrá ver un número limitado de microcalcificaciones. La tomosíntesis será de ayuda para distinguir calcificaciones en el interior de un nódulo o para distinguir las de localización cutánea de las parenquimatosas26.
Cabe decir que la mamografía s2D tiene una mayor resolución de contraste que la MD convencional, consecuencia de los algoritmos de reconstrucción empleados9–14 (fig. 4), y ello hace que emerjan calcificaciones de otra forma no detectables e, incluso, que aparezcan falsos positivos por malinterpretación de estructuras densas27.
Repercusión en el informeNo se realiza un informe específico de tomosíntesis, ni independiente al de MD, puesto que se trata de una herramienta complementaria en el proceso de diagnóstico. Se recomienda usar el sistema Breast Imaging Reporting and Data System (BI-RADS) para realizar un informe estructurado. En el caso de lesiones solo visualizadas con tomosíntesis, es útil especificar la proyección y el número de corte donde se identifican los hallazgos, puesto que cada imagen individual de tomosíntesis está asignada a un número que se corresponde con la distancia en milímetros al detector (fig. 5).
Paciente de 52 años procedente del programa de cribado por nódulo central posterior en mama izquierda (a y b). Tomosíntesis en proyección craneocaudal/mediolateral oblicua (a’ y b’). En mama izquierda, cuadrantes centroinferiores, zona horaria 6 en su tercio posterior, se visualiza un nódulo de morfología redondeada y márgenes circunscritos (círculo) que se sitúa en tejido celular subcutáneo (primeros slices del conjunto de imágenes), compatible con quiste de inclusión epidérmico en estudio ecográfico y que corresponde con el hallazgo por el que es remitida la paciente.
Tampoco se requiere una orden médica específica para la realización del estudio, ya que es el radiólogo el que debe determinar el rendimiento de la tomosíntesis según la paciente y de acuerdo con los protocolos del centro.
Ventajas y Limitaciones de la TomosíntesisVentajasTasa de detecciónEstá demostrado que el uso combinado de tomosíntesis con MD produce un aumento en la tasa de detección de cánceres adicionales de entre un 30% y un 50%3,4,22, que en estudios recientes llega al 90%28. Estos resultados son superponibles para todas las categorías de composición tisular, incluso para las mamas densas (categorías BI-RADS C y D), a diferencia de lo que ocurre con el cribado solo con MD29. Hay que subrayar, pues, que la densidad mamaria es no solo un factor de riesgo independiente para el desarrollo de cáncer de mama, sino que también influye en la capacidad de detección de lesiones con MD convencional30–33. Teniendo en cuenta este hecho, más de la mitad de los estados de Estados Unidos, y de acuerdo con la American Society of Breast Surgeons, exigen la comunicación de la densidad mamaria a todas las mujeres sometidas a un estudio de mamografía34, con el fin de tener este dato en cuenta a la hora de valorar un posible estudio complementario con otra técnica: tomosíntesis, ecografía, mamografía con contraste, resonancia magnética (RM) y/o tomografía por emisión de positrones (PET). A este respecto, y en relación con la imagen sintetizada, hay que comentar que no se encuentran diferencias clínicamente significativas entre mamografía s2D y MD en la asignación subjetiva de densidad para una misma paciente utilizando las categorías del sistema BI-RADS35,36. Se entiende como diferencia clínicamente significativa aquella en la que, para una misma mama, la asignación de densidad con MD se corresponde con una categoría no densa (BI-RADS A o B), mientras que con mamografía s2D se corresponde con una mama densa (BI-RADS C o D) o viceversa. No obstante, sí existen discretas variaciones entre mamografía s2D y MD convencional, con una ligera tendencia a asignar una mayor densidad en los estudios adquiridos con mamografía s2D (lo que ocurre en aproximadamente en el 12,5% de los casos), hecho que se deriva de la mayor resolución de contraste de las imágenes s2D frente a las imágenes de MD convencional35.
A pesar de las diferencias subjetivas comentadas, en términos de sensibilidad, especificidad, tasa de rellamadas, tasa de detección de cánceres y valor predictivo positivo, los resultados del cribado utilizando mamografía s2D y tomosíntesis no son inferiores a los de MD combinada con tomosíntesis15,27,37 y por tanto resulta aceptable su uso como herramienta sustituta de la MD 2D convencional15,16.
Existe una mayor proporción de detección con la tomosíntesis de los carcinomas invasivos con respecto a los carcinomas in situ38 al mejorar la visualización de lesiones no calcificadas y también, quizás, a que los radiólogos prestan más atención a las imágenes de tomosíntesis (que tienen una menor especificidad en el caso de las microcalcificaciones) que al estudio 2D. Sin embargo, han aparecido estudios recientes donde esta tasa de detección es similar, ya que con el uso de la imagen sintetizada se mejora la detección de microcalcificaciones respecto a las imágenes individuales de tomosíntesis39, y las microcalcificaciones son el hallazgo más frecuente del carcinoma in situ.
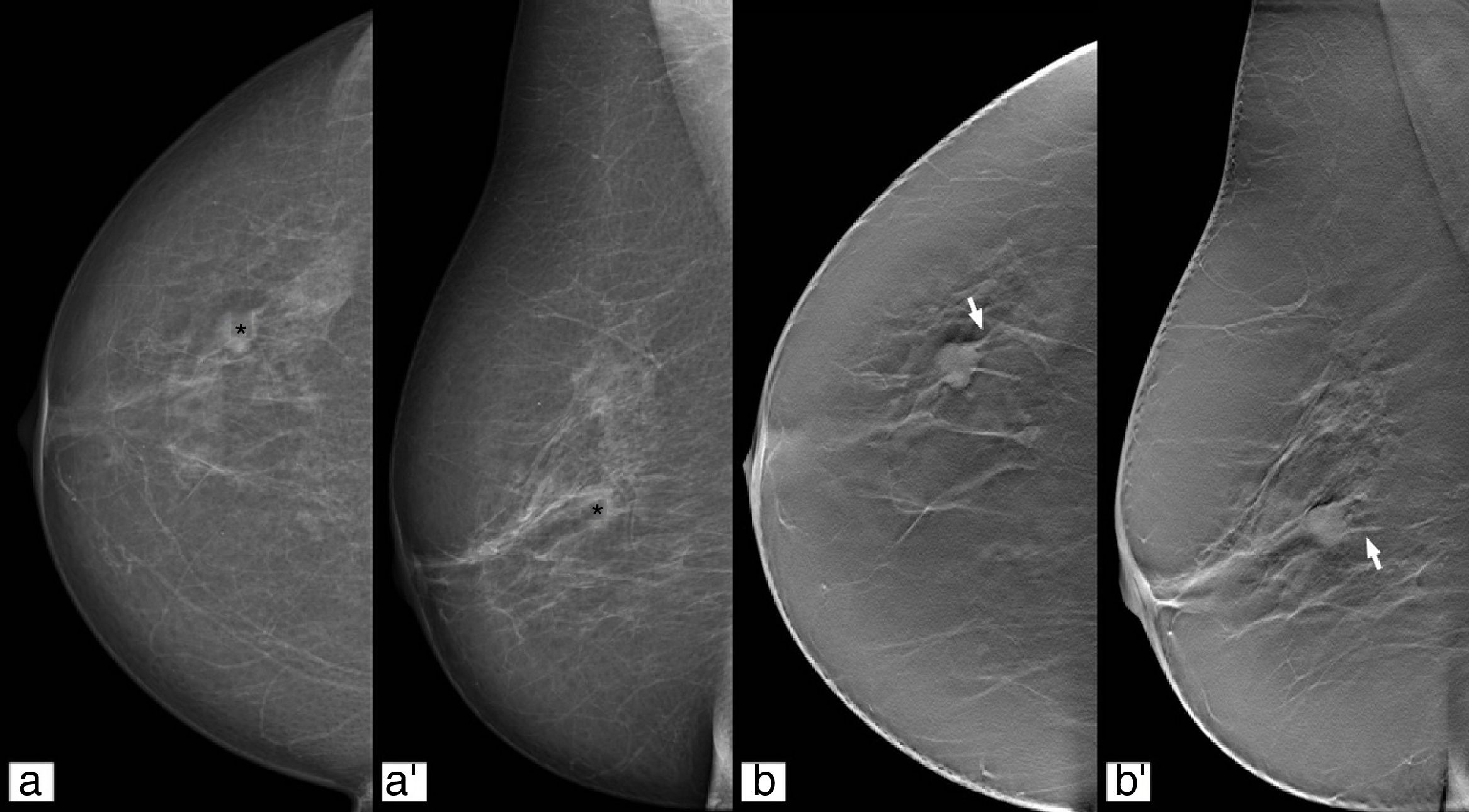
Caracterización de las lesionesLa mejora de la caracterización de las lesiones con el uso de la tomosíntesis ha demostrado que se incluyen menos lesiones benignas categorizadas como BI-RADS categorías 3, 4 y 5, y se clasifican más malignas como BI-RADS categorías 4 y 5 (fig. 6)40,41.
Nódulo en cuadrante superoexterno de la mama derecha (asterisco), hiperdenso, de morfología ovalada y márgenes circunscritos en estudio 2D (a y a’). Dicho nódulo presenta márgenes no circunscritos (flecha) en el estudio de tomosíntesis (b y b’). Resultado: carcinoma ductal infiltrante.
En el grupo de lesiones probablemente benignas (BI-RADS categoría 3) no hubo un cambio significativo en el caso de las asimetrías focales, pero sí una reducción en el seguimiento de estos hallazgos al esclarecer en muchos casos la existencia o no de lesión “verdadera”42.
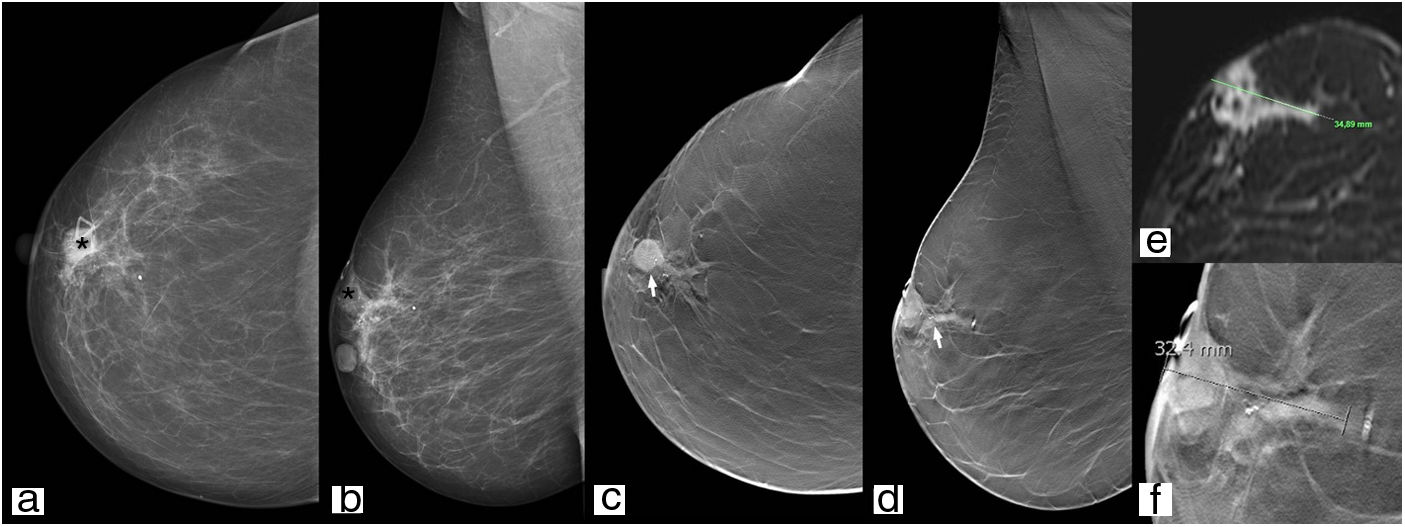
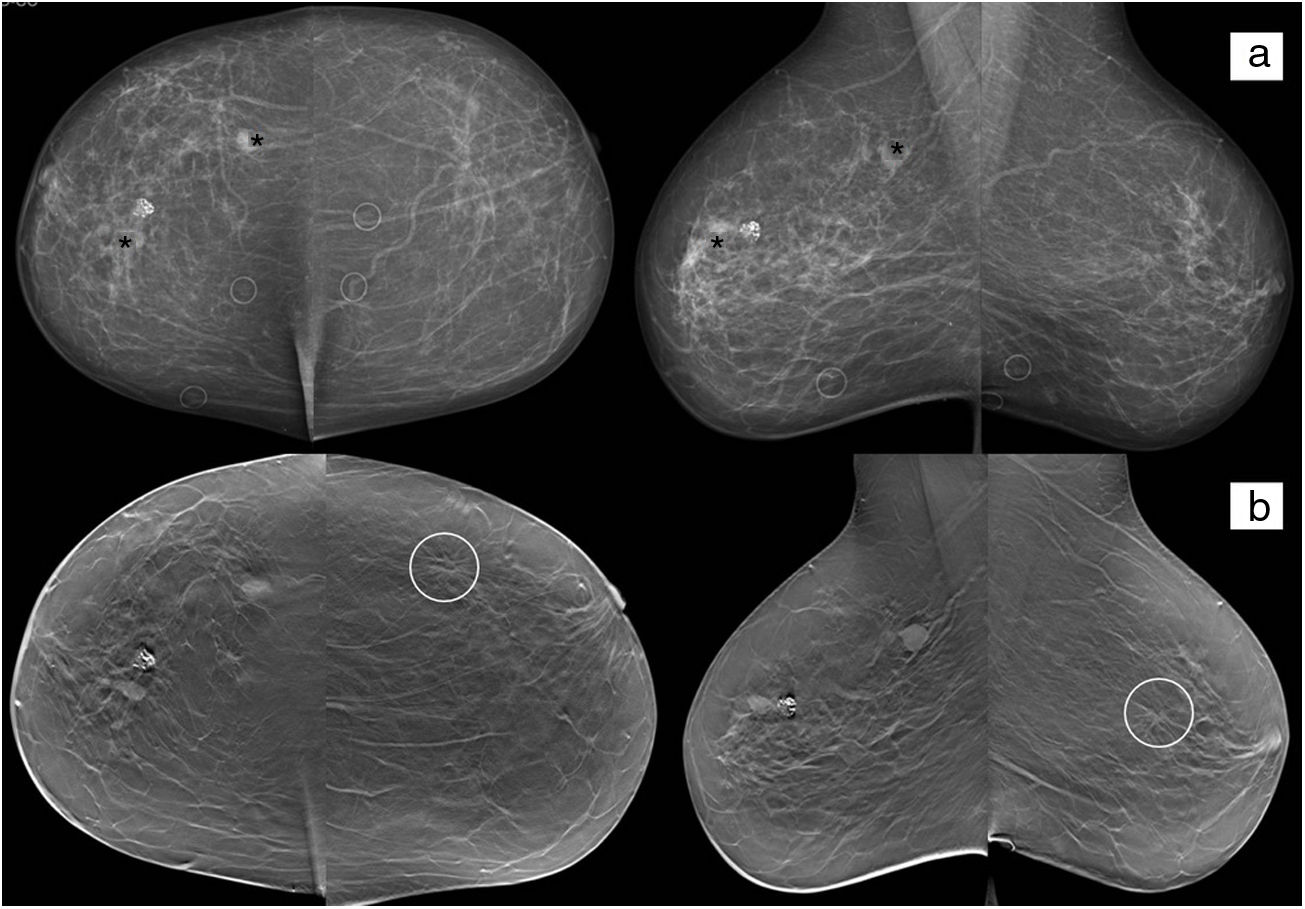
Estadificación tumoralLa tomosíntesis es superior a la MD en la determinación del tamaño de la lesión (se debe medir el núcleo del nódulo y no las espículas visualizadas en la imagen individual de tomosíntesis) (fig. 7), el número de lesiones (multifocalidad/multicentricidad) y en la evaluación de la mama contralateral (ya que ante un nuevo diagnóstico de cáncer de mama existe una probabilidad del 2-3% de cáncer en la mama contralateral, y no en todos los centros se realiza RM de estadificación de manera rutinaria) (fig. 8)43.
Mujer de 81 años que es derivada por nódulo palpable. En mama derecha, región retroareolar (asterisco), se visualiza un nódulo hiperdenso de morfología redondeada y márgenes parcialmente ocultos con microcalcificaciones en su interior (a y b), que en el estudio de tomosíntesis presenta morfología ovalada y márgenes no circunscritos (flecha) (c, d y f), de dimensiones similares a las del estudio de resonancia magnética de extensión (e).
Mujer de 72 años remitida para estudio por síndrome paraneoplásico y lesión quística renal compleja. Presenta tres nódulos en la mama derecha (asteriscos), uno de ellos densamente calcificado. Los nódulos marcados con asterisco tienen un diagnóstico histológico confirmado de carcinoma ductal infiltrante. El nódulo densamente calcificado se trata de un fibroadenoma y también fue confirmado. En mama izquierda se visualiza en el estudio de tomosíntesis (b) una distorsión del parénquima en cuadrante superoexterno (círculo). Tras la realización de biopsia se confirma la sospecha de bilateralidad.
La mejora en la localización y caracterización de las lesiones derivada del uso de tomosíntesis disminuye la tasa de rellamadas en lesiones no calcificadas y por tanto ahorra costes adicionales y ansiedad de las pacientes, reducción que se estima entre un 15% y un 40%44. Sin embargo, en los grandes estudios poblacionales aparecen resultados dispares. Se debe considerar que estos estudios poblacionales presentan importantes diferencias en los requisitos para la inclusión de las pacientes, no solo entre países, sino incluso dentro de un mismo país, aunque es invariable que en todos ellos el resultado de la tasa de rellamadas es más estable con tomosíntesis que con MD.
Rendimiento del radiólogo y flujo de trabajoExiste un mayor rendimiento diagnóstico en términos de mayor sensibilidad en la detección de lesiones y mayor valor predictivo negativo usando solo una proyección de tomosíntesis en comparación con el uso de MD; este beneficio es mayor para los radiólogos con menos experiencia en mamografía45.
En cuanto a los flujos de trabajo, la tomosíntesis permite reemplazar de manera efectiva el uso de las proyecciones focalizadas (spot) que se utilizan para caracterizar o confirmar la existencia de lesiones, con lo que disminuye el movimiento de las pacientes dentro y fuera de la sala, del mismo modo que disminuye su ansiedad20,46,47.
LimitacionesDosis de radiaciónLa dosis glandular media por proyección de un estudio de tomosíntesis se sitúa entre 1,7 y 2,2 mGy48,49, que es entre 1 y 1,5 veces la dosis de una MD estándar50.
El uso combinado de tomosíntesis con MD (“método combo”), al tratarse de una adquisición dual que obtiene por separado las imágenes de ambos estudios, multiplica por dos la dosis de radiación. Sin embargo, esta permanece dentro del límite de 3,0 mGy por proyección fijado en la normativa Mammography Quality Standards Act de la FDA51.
En consecuencia, el punto clave para la generalización del uso de tomosíntesis es el diseño de un método que disminuya la dosis utilizada en este tipo de exploraciones.
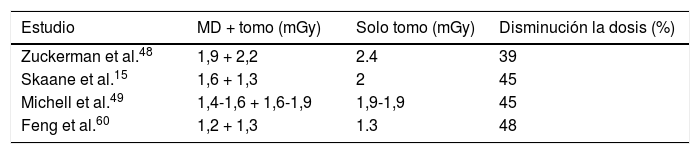
Se debe tener en cuenta que el componente 2D sigue siendo una parte muy importante del estudio de la mama, tanto en el cribado como en estudios diagnósticos de pacientes sintomáticas, ya que se utiliza para la evaluación de posibles asimetrías mamarias, estudio comparativo con mamografías previas e identificación de microcalcificaciones. Con la aparición de la mamografía s2D y la eventual eliminación del componente de MD 2D, las pacientes reciben solo la radiación correspondiente al estudio de tomosíntesis. Esto representa una reducción del 39-45% de la dosis respecto al estudio combinado de MD con tomosíntesis, similar a la dosis de un estudio de MD 2D convencional15,52–55 (tabla 2).
Tiempo de lecturaEl número de imágenes de un examen de tomosíntesis depende del espesor de la mama y del grosor de corte de reconstrucción. Por ejemplo, en el estudio de una mama con 5cm de espesor, utilizando un grosor de corte de 1mm se obtienen 100 imágenes, lo que conlleva un aumento del tiempo de lectura de entre un 35% y un 70% comparado con un estudio de MD convencional. Esta variabilidad depende principalmente de la rapidez de lectura de la MD. La experiencia puede ser, por tanto, un punto a favor, a fin de alcanzar tiempos de lectura más cortos. Un resultado a destacar es que, en el caso de un hallazgo positivo, el aumento del tiempo de lectura se debe a las imágenes múltiples y no a un tiempo más largo en la interpretación de los hallazgos56.
Tiempo de adquisiciónEl tiempo de adquisición de una MD convencional es de aproximadamente 4 segundos por proyección, mientras que una adquisición dual de tomosíntesis con MD conlleva un 26% más de tiempo57.
Curva de aprendizajeExiste una curva de aprendizaje tanto del técnico como del radiólogo que interpreta la tomosíntesis. Sin embargo, no es muy diferente a la de otros entrenamientos con nuevas aplicaciones o equipamientos. Según la Mammography Quality Standards Act and Program de la FDA, el personal debe recibir 8 horas de capacitación inicial antes de usar de manera independiente cualquier nueva modalidad de mamografía. Inicialmente es posible que aumente el número de rellamadas; sin embargo, este incremento suele estabilizarse a los 6 meses para posteriormente empezar a disminuir58.
Sistemas específicos de manejo y almacenamiento de imágenesEl uso de tomosíntesis supone un mayor peso de los datos almacenados, lo que requiere sistemas específicos de manejo y almacenamiento de imágenes. El peso de una imagen individual de tomosíntesis es de entre 3 y 4,5 MB. El uso combinado de tomosíntesis y MD produce aproximadamente 1.800 MB, un valor muy superior a los 80 MB de un conjunto de MD con 4 vistas6,59.
Lesiones no detectadas mediante tomosíntesisEn pequeñas series de casos se describen resultados falsos negativos en pacientes sintomáticas, que se corresponden con neoplasias luminales (tipo B principalmente) y, por tanto, de peor pronóstico. Debido a que no todos los cánceres se pueden detectar mediante tomosíntesis, el nivel de riesgo personal de cáncer de mama y los síntomas clínicos siempre deben marcar la guía de conducta a seguir en estas pacientes, y realizar en ellas un estudio multimodal60,61.
Tomosíntesis en el Cribado PoblacionalLa única técnica que ha demostrado disminuir la mortalidad en el cribado es la mamografía. Sin embargo, los cánceres detectados adicionalmente mediante tomosíntesis en estudios poblacionales como Oslo62 y Malmo18 correspondieron, sobre todo, a cánceres invasivos, pero de menor grado y tamaño, y a fenotipos luminales tipo A, sin poder determinar si estos resultados representan un diagnóstico más temprano o un sobrediagnóstico. Se necesitan más estudios que analicen el desarrollo tumoral, para entender el impacto que tiene la detección y tratamiento de lesiones de lento crecimiento, que son parte del sobrediagnóstico y una de las limitaciones de la incorporación de la tomosíntesis en los programas de cribado63.
La Comisión Europea recomienda un uso prudente de la tomosíntesis en el cribado por esta baja evidencia, por lo que es necesario realizar ensayos aleatorizados, lo que supone estudios de más de 10 o 20 años de duración64.
Una de las limitaciones de la tomosíntesis es, como ya se ha comentado, el aumento del tiempo de lectura y de realización del examen, aspecto importante dentro de los programadas de cribado, debido al elevado número de mujeres que participan en estas campañas. Por otra parte, las guías europeas recomiendan la doble lectura en estudios de cribado, y existen resultados que sugieren que el uso combinado de tomosíntesis con imagen sintetizada y CAD podría reducir la necesidad de una doble lectura64–66.
Además, la relación coste-efectividad debe ser considerada en cualquier programa de cribado poblacional. Hay que considerar la necesidad de una mayor capacidad de almacenamiento de imágenes en los PACS (Picture archiving and communication system), hecho que encarece la introducción de la tomosíntesis en los sistemas de cribado.
No se han evaluado suficientemente los cánceres de intervalo (es decir, los que aparecen entre una mamografía de cribado normal y la siguiente ronda de cribado), los cuales se asocian con características tumorales y tasas de supervivencia menos favorables y que por lo tanto reflejan la eficacia del programa. Los estudios más recientes no muestran diferencias significativas en cuanto a su detección con MD 2D respecto a la tomosíntesis67,68.
Avances en la Tomosíntesis: Detección de Lesiones Asistida por Ordenador y Biopsia Guiada por TomosíntesisDetección de lesiones asistida por ordenadorUna manera de mejorar el rendimiento diagnóstico de la tomosíntesis es la aplicación de un sistema de diagnóstico asistido por ordenador (CAD) en el proceso de lectura.
El CAD se ha utilizado a lo largo de los años para mejorar la detección e interpretación de los hallazgos de imagen en distintas modalidades radiológicas, no solo mamografía. Consiste en una aplicación que, mediante el empleo de algoritmos matemáticos, analiza las imágenes asignando marcas que resaltan los hallazgos. Por tanto, son sistemas diseñados para disminuir los descuidos en la observación durante una primera lectura y, en consecuencia, el número de falsos negativos69.
Existen dos aplicaciones comercializadas con posibilidad de aplicar esta tecnología en estudios de tomosíntesis (iCAD Inc., Nashua, NH, EE. UU. y GE Healthcare, Buc, Francia)70,71. En ambos casos el programa identifica en cada imagen individual de tomosíntesis los hallazgos que posteriormente se mezclan y se presentan en una imagen sintetizada 2D mejorada respecto a las imágenes de mamografía s2D estándar.
El rendimiento diagnóstico de cualquier imagen virtual sintetizada 2D depende mucho de los algoritmos matemáticos utilizados para generarla. No obstante, en términos de rendimiento diagnóstico y según las últimas investigaciones, la mamografía sintetizada 2D generada con los sistemas CAD tiene mayor especificidad que la MD 2D convencional (57,35% vs. 17,64%) y mayor sensibilidad que la mamografía s2D (94,1% vs. 52,94%)72.
Biopsia guiada por tomosíntesisDel total de lesiones mamarias con recomendación para la realización de biopsia, únicamente un pequeño porcentaje es visible solo en tomosíntesis, estando ocultas en la MD 2D convencional (aproximadamente un 7%; la mayoría, en mamas densas); sin embargo, hasta un 53% de estas lesiones acaban presentando un diagnóstico final confirmado de malignidad73. En función de estos resultados, cualquier hallazgo radiológico sospechoso en un estudio de tomosíntesis debe ser categorizado como BI-RADS 4C. Ello remarca la importancia del análisis histológico de estas lesiones y la necesidad del desarrollo de una técnica de biopsia guiada por tomosíntesis como herramienta precisa y eficaz de muestreo, sobre todo cuando no existe representación de los hallazgos en otras modalidades de imagen como ecografía o RM74.
La biopsia en mesa prona guiada por estereotaxia asistida por vacío (BAV) es considerada la técnica estándar de referencia para el muestreo de lesiones con representación solo en estudios de mamografía75.
A diferencia de la biopsia estereotáxica, la biopsia guiada por tomosíntesis permite el empleo del tamaño completo del detector y facilita la localización anatómica de las lesiones respecto al resto de la mama. Además, permite la reidentificación de lesiones de baja densidad, como masas no calcificadas, muchas veces difíciles de visualizar en sistemas estereotáxicos tras un estudio diagnóstico con MD. De todo ello se deriva una reducción en los tiempos de realización y sobre todo de planificación de la prueba, comparado con el método estándar de biopsia guiada por estereotaxia (13 vs. 29 minutos)74.
Por todo lo comentado anteriormente, la biopsia guiada por tomosíntesis no solo es útil para guiar el procedimiento en lesiones visibles mediante esta técnica, sino que puede llegar a reemplazar a la biopsia estereotáxica como método de muestreo en lesiones con representación en estudios bidimensionales de MD74.
ConclusionesLas ventajas principales que apoyan el uso generalizado de la tomosíntesis son la mejora en la tasa de detección de cáncer de mama, la caracterización de las lesiones, una mejor estadificación tumoral y una disminución en la tasa de rellamadas.
La limitación principal es la dosis de radiación. La introducción de la imagen sintetizada como técnica sustituta de la MD convencional conlleva todos los beneficios de la tomosíntesis con un ahorro de la dosis de radiación.
El uso de la tomosíntesis en el cribado requiere todavía estudios a largo plazo para su normalización.
La aportación de la CAD y la BAV guiada por tomosíntesis ayudará a mejorar el rendimiento diagnóstico.
Autoría1. Responsables de la integridad del estudio: AMF y DMF.
2. Concepción del estudio: AMF y DMF.
3. Diseño del estudio: AMF y DMF.
4. Obtención de los datos: AMF y DMF.
5. Análisis e interpretación de los datos: AMF y DMF.
6. Tratamiento estadístico: AMF y DMF.
7. Búsqueda bibliográfica: AMF y DMF.
8. Redacción del trabajo: AMF y DMF.
9. Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: AMF y DMF.
10. Aprobación de la versión final: AMF y DMF.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.